Лабораторная работа №2. Моделирование построения Периодической системы Д.И. Менделеева
§18. Неметаллы: атомы и простые вещества. Кислороду озон, воздух. (стр. 129-135)
§19. Водород. (стр. 136-142)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№19;§20. Вода. (стр. 143-152)
§21. Вода в жизни человека. (стр. 152-159)
§22. Галогены. (стр. 159-167)
§23. Соединения галогенов. (стр. 167-173)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№26;§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений. (стр. 173-180)
§25. Кислород. (стр. 180-188)
Лабораторный опыт:
№27;§26. Сера. (стр. 188-195)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№28;§27. Соединения серы. (стр. 195-204)
Лабораторный опыт:
№29;§28. Азот. (стр. 204-209)
Вопросы к параграфу:
1; 2; 3; 4; 5;§29. Аммиак. (стр. 210-216)
Лабораторный опыт:
№30;§30. Соли аммония. (стр. 216-219)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№31;§31. Кислородные соединения азота. (стр. 220-225)
§32. Фосфор и его соединения. (стр. 225-232)
§33. Углерод. (стр. 232-241)
Лабораторный опыт:
№36;§34. Кислородные соединения углерода. (стр. 242-249)
§35. Кремний и его соединения. (стр. 249-265)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№40;Темы для дискуссии::
1; 2; 3;Моделирование построения Периодической системы Д. И. Менделеева
| Химический символ | Название | Относительная атомная масса | Формула высшего оксида | Формула высшего гидроксида | Формула летучего водородного соединения |
|---|---|---|---|---|---|
| H | Водород | 1 | H2O | H2O | |
| He | Гелий | 4 | |||
| Li | Литий | 7 | Li2O (основный) |
LiOH (основный) |
|
| Be | Бериллий | 9 | BeO (амфотерный) |
Be(OH)2 (амфотерный) | |
| B | Бор | 11 | B2O3 (кислотный) |
H3BO3 (кислотный) |
BH3 |
| C | Углерод | 12 | CO2 (кислотный) |
H2CO3 (кислотный) |
CH4 |
| N | Азот | 14 | N2O5 (кислотный) |
HNO3 (кислотный) |
NH3 |
| O | Кислород | 16 | H2O | ||
| F | Фтор | 19 | HF | ||
| Ne | Неон | 20 | |||
| Na | Натрий | 23 | Na2O (основный) |
NaOH (основный) |
|
| Mg | Магний | 24 | MgO (основный) |
Mg(OH)2 (основный) |
|
| Al | Алюминий | 27 | Al2O3 (амфотерный) |
Al(OH)3 (амфотерный) |
|
| Si | Кремний | 28 | SiO2 (кислотный) |
H2SiO3 (кислотный) |
SiH4 |
| P | Фосфор | 31 | P2O5 (кислотный) |
H3PO4 (кислотный) |
PH3 |
| S | Сера | 32 | SO3 (кислотный) |
H2SO4 (кислотный) |
H2S |
| Cl | Хлор | 35.5 | Cl2O7 (кислотный) |
HClO4 (кислотный) |
HCl |
| Ar | Аргон | 40 | |||
| K | Калий | 39 | K2O (основный) |
KOH (основный) |
|
| Ca | Кальций | 40 | CaO (основный) |
Ca(OH)2 (основный) |
Объяснение несоответствия относительных атомных масс аргона и калия.
Относительные атомные массы химических элементов это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе.
Содержание в природе изотопа 39K значительно больше, чем изотопа 40K, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа 40Ar значительно больше, чем изотопа
Калий является щелочным металлом, а аргон – инертным газом, поэтому аргон был расположен перед калием, т. е. в VIIIА группе, а калий – в IА группе.
Лабораторная работа №1 «Моделирование построения Периодической таблицы химических элементов»
Лабораторная работа №1
«Моделирование построения Периодической таблицы химических элементов»
Цели работы
научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
уметь определять строение электронных оболочек атомов элементов малых периодов по положению хим. элемента в ПС.
Порядок выполнения работы:
- Запустите модуль «Периодические закономерности в строении атомов».
Выполните задания, ответ зафиксируйте в рабочую тетрадь.
Закройте и запустите модуль «Сведения о строении атома». Потренируйтесь в определении порядкового номера, числа электронов и числа электронных орбиталей на примере 5-7 элементов.
Закройте модуль и откройте «Состав атомных ядер». Также потренируйтесь в определении числа протонов и числа нейтронов (5-7 элем.). Завершите работу.
Откройте следующий модуль «Характеристика элемента металла».
Выполните задания по приведенной ниже схеме, по ходу выполнения работы делайте записи в рабочую тетрадь.

Вносить данные вместо пропусков можно с помощью клавиатуры, в некоторых случаях необходимо будет переключаться на английский язык.


Перед тем, как перейти к следующему пункту необходимо зарисовать в тетради схему электронной конфигурации атома и заполнить ее
5s5p
5d
5f
4s
4p
4d
4f
3s
3p
3d
2s
2p
1s
Пояснение: вместо пропуска укажите число электронов на каждом электронном подуровне, заполняйте только те подуровни, которые есть в наличие у атома элемента.


После выполнения всех заданий закройте модуль и откройте «Характеристика элемента неметалла».
По указанному выше образцу проведите характеристику выбранного элемента
Оформите отчет, сдайте тетрадь на проверку.
Учебно-методическое пособие по химии по теме: Моделирование построения Периодической таблицы.
Лабораторная работа№1.
«Моделирование построения Периодической таблицы химических элементов Д.И. Менделеева».
Цель: изучение s, p,d, f элементов на основании их положения в Периодической системе, моделирование Периодической системы.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, рисунки строения s, p,d, f элементов.
Ход работы:
- Строение s, p,d, f элементов и их положение в Периодической системе.
Существует 4 типа орбиталей : s, p,d, f .
s – орбитали имеют сферическую форму;
p- орбитали имеют форму гантели;
d – орбитали имеют форму листа клевера;
f – орбитали – форму шести лепестного цветка.
Каждую орбиталь могут занимать 2 электрона. Следовательно, максимальное число электронов, которые могут находиться на первом уровне равно двум.
N=2 n2 ,
где n-номер энергетического уровня, N-максимальное число электронов на этом уровне. На втором -8 ( 2 – на s – орбитали и 6 на р- орбитали). На третьем — 18 электронов (2 на s, 6 на р, 10 на d и 14 на f). В зависимости от того, на какую орбиталь отправлен последний электрон, химические элементы можно разделить на семейства (блоки): s, p,d, f .
К s-элементам относятся элементы I и II групп главных подгрупп, а также гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f — элементам относятся лантаноиды и актиноиды.
Деление Периодической таблицы на блоки.
s- облако р-облако d -облако
Задание:
1) Написать электронную формулу атома кислорода, магния и фосфора.
2) К каким элементам они относятся и где располагаются в Периодической таблице Д.И. Менделеева?
3) Какое максимальное количество электронов может находиться в IV периоде таблицы Д.И. Менделеева?
4) Сделайте вывод.
Лабораторная работа «Моделирование построения ПСХЭ»
Лабораторная работа №1
«Моделирование построения Периодической таблицы химических элементов»
Цель работы: научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
Задачи:
рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
уметь определять строение электронных оболочек атомов элементов малых периодов и особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов) по положению хим. элемента в ПС.
Краткие теоретические сведения
Периодический закон открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов. Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого заключалась в том, что в XIX в. совершенно отсутствовали какие-либо представления о сложности строения атома.
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Закономерности ПСХЭ Д. И. Менделеева
Рис.1
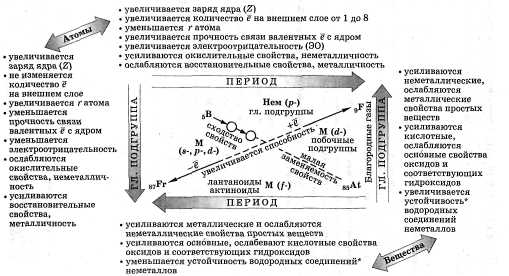
Оборудование: ПСХЭ Д. И. Менделеева
ЗАДАНИЕ: Дать характеристику химических элементов с № 3 по № 20 (по выбору преподавателя) по плану.
ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА
ПО ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
1. Положение элемента в периодической системе:
порядковый номер
период, ряд
группа, подгруппа
относительная атомная масса
2. Строение атома элемента:
заряд ядра атома
формула состава атома (количество р; n; е )
количество энергетических уровней и размещение на них электронов
формула электронной конфигурации (1S2S2Р3S3P4S4P5S4D5P)
графическая формула
число электронов на последнем слое => металл или неметалл
3. Формулы соединений:
оксида
гидроксида (кислоты или основания)
4. Химический характер, его доказательство:
а) кислотный: кислотный оксид + щелочь = соль + вода; кислота + основание = соль + вода
б) основной: основной оксид + кислота = соль + вода; основание + кислота = соль + вода
в) амфотерный (а + б)
5. Запишите сведения по двум химическим элементам в таблицу.
Таблица 1.
Строение атома элемента
Формулы соединений
Химический характер
№1.…
№2…
Сформулируйте выявленную вами закономерность в виде закона.
Вопросы для выводов
Почему формулировка ПЕРИОДИЧЕСКОГО ЗАКОНА (Д. И. Менделеева) была изменена?
Контрольные вопросы
Как изменяются неметаллические свойства элементов в периодах периодической системы?
Как определяется принадлежность химического элемента к тому или иному электронному семейству?
Что такое «провал» электрона? Приведите примеры элементов, у которых это явление наблюдается, запишите их электронные формулы.
Моделирование периодической таблитсы | Образовательный портал EduContest.Net — библиотека учебно-методических материалов
Лабораторная работа№1.
«Моделирование построения Периодической таблицы химических элементов Д.И. Менделеева».
Цель: изучение s, p,d, f элементов на основании их положения в Периодической системе, моделирование Периодической системы.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, рисунки строения s, p,d, f элементов.
Ход работы:
Строение s, p,d, f элементов и их положение в Периодической системе.
Существует 4 типа орбиталей : s, p,d, f .
s – орбитали имеют сферическую форму;
p- орбитали имеют форму гантели;
d – орбитали имеют форму листа клевера;
f – орбитали – форму шести лепестного цветка.
Каждую орбиталь могут занимать 2 электрона. Следовательно, максимальное число электронов, которые могут находиться на первом уровне равно двум.
N=2 n2 ,где n-номер энергетического уровня, N-максимальное число электронов на этом уровне. На втором -8 ( 2 – на s – орбитали и 6 на р- орбитали). На третьем — 18 электронов (2 на s, 6 на р, 10 на d и 14 на f). В зависимости от того, на какую орбиталь отправлен последний электрон, химические элементы можно разделить на семейства (блоки): s, p,d, f .
К s-элементам относятся элементы I и II групп главных подгрупп, а также гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f — элементам относятся лантаноиды и актиноиды.
Деление Периодической таблицы на блоки.
s- облако р-облако d -облако
Задание:
1) Написать электронную формулу атома кислорода, магния и фосфора.
2) К каким элементам они относятся и где располагаются в Периодической таблице Д.И. Менделеева?
3) Какое максимальное количество электронов может находиться в IV периоде таблицы Д.И. Менделеева?
4) Сделайте вывод.
Приложенные файлы
Лабораторные работы по химии
Лабораторная работа №1
Моделирование построения Периодической системы (таблицы) элементов.
Цель: научиться выявлять законы по таблице элементов.
Оборудование: карточки размером 6х10 см
Ход работы:
Заготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20 –й в Периодической системе Менделеева. На каждую карточку запишите следующие сведения об элементе:
— химический символ
— название
— значение относительной атомной массы
— формулу высшего оксида (в скобках укажите характер оксида- основный, кислотный или амфотерный)
— формулу высшего гидроксида (для гидроксидов металлов также укажите в скобках характер — основный или амфотерный)
— формулу летучего водородного соединения (для неметаллов).
Расположите карточки по возрастанию значений относительных атомных масс.
Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном. Сформулируйте выявленную вами закономерность в виде закона.
Поменяйте в полученном ряду местами аргон и калий. Объясните почему.
Еще раз сформулируйте выявленную вами закономерность в виде закона.
Лабораторная работа № 2
Приготовление раствора заданной концентрации.
Цель: приготовить растворы солей определённой концентрации. ОК2, ОК3, ОК4, ОК6.
Оборудование: — стакан объёмом 50 мл,
— стеклянная палочка с резиновым наконечником,
— весы,
— стеклянная лопаточка,
— мерный цилиндр,
— соли,
— холодная кипячёная вода.
Ход работы:
Произвести расчёты: определите, какую массу соли и воды потребуется взять для приготовления раствора, указанного в условии задачи.
Задача: приготовьте 20 г водного раствора поваренной соли с массовой долей соли 5%
Отвесьте соль и поместите её в стакан.
Отмерьте измерительным цилиндром необходимый объём воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Отчёт о работе:
— проведите расчёты,
— последовательность ваших действий.
Лабораторная работа №3.
Испытание растворов кислот.
Цель: исследовать, как действуют кислоты на индикаторы. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — 4 пробирки или платины с гнёздами,
— раствор серной кислоты (1:5),
— раствор соляной кислоты (1:3),
— раствор лакмуса,
— раствор метилового оранжевого (метилоранж).
Ход работы:
В 2 пробирки или гнёзда пластины внесите по 5 капель раствора соляной кислоты, к одной добавьте каплю лакмуса, а к другой – каплю метилоранжа.
Как изменяется окраска индикаторов от действия кислоты?
Теперь проделайте то же самое с серной кислотой. Что наблюдаете? Какой можно сделать общий вывод о действии кислот на индикаторы – лакмус и метиловый оранжевый? Согласуется ли вывод с таблицей «Изменение цвета индикаторов»
Изменение цвета индикаторов
Индикатор | Среда | ||
Кислая | Нейтральная | Щелочная | |
Лакмус | Красные | Бурый | Синий |
Фенолфталеин | Бесцветный | Бесцветный | Красный |
Метилоранж | Красный | Красный | 0оранжевый |
Задание: даны растворы 2 веществ. Как можно практически доказать, что одно из них является раствором кислоты?
Взаимодействие металлов с кислотами.
Цель: исследовать, все ли металлы реагируют с кислотами, всегда ли при этом выделяется кислород? ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — спиртовка,
— предметное стекло,
— стеклянная платина 30х60 мм,
— восемь пробирок,
— пипетка,
— две гранулы цинка,
— железные опилки,
— несколько кусочков меди, алюминия,
— раствор соляной кислоты (1:3),
— раствор серной кислоты (1:5).
Ход работы.
В пробирки положите разные металлы: в одну – гранулу цинка в другую – железные опилки, в третью – кусочки меди, в четвёртую – кусочки алюминия. Во все пробирки налейте по 1 мл раствора соляной кислоты. Что замечаете?
В следующие четыре пробирки поместите те же металлы и в таком же количестве, прилейте по 1 мл раствора серной кислоты. Что замечаете? Если в какой-либо пробирке не наблюдается реакция, то слегка нагрейте её содержимое (осторожно!, но не доводя до кипения. Докажите, в каких пробирках выделяется газ водород.
Из пробирки, в которой осуществлялась реакция между алюминием и соляной кислотой, отберите 1-2 кали раствора поместите их на предметное стекло, держа высоко над пламенем, выпарите его. Что осталось?
Сделайте общий вывод об отношении кислот к металлам. Для этого воспользуйтесь схемой:
Отношение металлов к воде и к некоторым кислотам
K, Ca, Na, Mg, Al | Zn, Fe, Ni, Pb | Cu, Hg, Ag, Au | |
Реагируют с водой с выделением водорода | Не реагирует с водой при обычных условиях | Не реагируют с водой и растворами соляной и серной кислот | |
Реагируют с растворами соляной и серной кислот с выделением водорода | |||
Ответьте на вопросы:
Какой из металлов, взятый для опытов, не реагирует с растворами соляной и серной кислот? Какие ещё металлы не реагируют с этими кислотами?
2. К какому типу реакций относится взаимодействие кислоты с металлом?
3.Взаимодействие кислот с основаниями.
Цель: изучить взаимодействия кислот с основаниями. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор гидроксида натрия,
— раствор фенолфталеина,
— пробирки,
— раствор уксусной кислоты,
— пипетки.
Ход работы
В две пробирки налейте по 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли раствора фенолфталеина. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
4. Взаимодействие кислот с солями
Цель: изучить взаимодействия кислот с солями. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор карбоната калия,
— раствор соляной кислоты,
— раствор уксусной кислоты,
— раствор силиката калия,
— пробирки, пипетки.
Ход работы:
В две пробирки налейте по 1-2 мл раствора карбоната калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
В две пробирки налейте по 1-2 мл раствора силиката калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Лабораторная работа №4
Факторы, влияющие на скорость химических реакций.
Цель: исследовать, как различные факторы влияют на скорость протекания реакицй. ОК2, ОК3, ОК4, ОК6.
Оборудование: — гранулы цинка, магний, железо,
— растворы соляной кислоты разной концентрации,
— раствор серной кислоты,
— CuO (II) (порошок),
— вода,
— спиртовка,
— пробирки,
— штатив.
Зависимость скорости взаимодействия цинка с соляной кислотой от её концентрации.
В две пробирки поместите по одной грануле цинка. В одну прилейте 1 мл соляной кислоты (1:3), в другую – столько же этой кислоты другой концентрации (1:10). В какой пробирке более интенсивно протекает реакция? Что влияет на скорость реакции?
Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
В три пробирки (подписанные, под номерами) прилить по 3 мл раствора НС1 и внести в каждую из пробирок навески опилок одинаковой массы: в первую – Mg, во вторую — Zn, в третью — Fe.
Что наблюдаете? В какой пробирке реакция протекает быстрее (или вообще не протекает)? Напишите уравнения реакций. Какой фактор влияет на скорость реакции? Сделайте выводы.
Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
В три пробирки (под номерами) налить по 3 мл раствора H2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе, вторую – опустить в стакан с горячей водой, третью – нагреть в пламени спиртовки.
В какой пробирке цвет раствора меняется быстрее (голубой цвет)? Что влияет на интенсивность реакции? Напишите уравнение. Сделайте вывод.
Лабораторная работа №5
Ознакомление со структурами белого и серого чугуна
Цель: изучить микроструктуру, свойства, способы получения и применение чугуна, ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы:
Вопросы для подготовки:
Чем отличается белый чугун от серого?
На какие классы подразделяют серые чугуны в зависимости от формы графитовых включений?
Какая металлическая основа может быть в серых чугунах и от чего это зависит?
Как получить серый чугун?
Как получить ковкий чугун?
Как получить высокопрочный чугун?
Как маркируют серые чугуны?
Ход работы
Рис. 1. Структурная диаграмма чугунов:
а) Влияние C и Si на структуру чугуна,
б) Влияние толщины отливки и суммы (C+Si) на структуру чугуна,
I – белые чугуны,
II – половинчатые чугуны,
III – серые перлитные чугуны,
IV – серые ферритно-перлитные чугуны,
V – серые ферритные чугуны.
По атласу микроструктур изучить микроструктуру белого и серого чугунов. Заполнить таблицу 1.
Таблица 1.
Название чугуна | Фазовый состав | Структурные составляющие | Схема микростуктуры |
Зарисовать схему микроструктуры серого чугуна.
Определить фазовый и структурный состав чугуна.
Визуально определить количество (в процентах) каждой структурной составляющей.
Рассчитать количество углерода в чугуне. Заполнить таблицу 2.
Таблица 2.
Наименование чугуна | Количество структурных составляющих, % | Количество связанного углерода, % | Количество углерода в чугуне, % | ||||
Ф | П | Г | |||||
3. Описать способ получения чугуна, его свойства, области применения.
Справочный материал:
Определение содержания углерода в серых чугунах, %:
С=Ссвоб + Ссвяз.,
Где Ссвоб – количество углерода, содержащегося в свободном состоянии в виде графита, %:
Где Г – площадь шлифа, занятая графитом,
р1 – плотиностьт графита, равная 2,3 г/см3,
р2 – плотность чугуна, равная 7,7 г/см3.
Ссвяз — количество связанного углерода (в виде цементита), %.
Принято, что феррит практически не имеет углерода.
Лабораторная работа № 6
Получение, собирание и распознавание газов.
Цель: получит экспериментально некоторые газы.
Оборудование: гранулы цинка, соляная кислота, раствор пероксида водорода, оксид марганца, кусок мрамора, раствор уксусной кислоты, раствор известковой воды, раствор хлорида аммония, лакмусовая бумажка, спиртовка, пробирки, шпатель, стеклянная трубочка.
Ход работы:
Получение, собирание и распознавание водорода
В пробирку поместите две гранулы цинка и прилейте в нее 1-2 мл соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1—2 ми нуты поднимите большую пробирку вверх и, не перевора чивая ее, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую пробирку?
2. Получение, собирание и распознавание кислорода
В пробирку объемом 20 мл прилейте 5—7 мл раствора пе роксида водорода. Подготовьте тлеющую лучинку (подожги те ее и, когда она загорится, взмахами руки погасите). Под несите к пробирке с пероксидом водорода, куда предвари тельно насыпьте немного (на кончике шпателя) оксида мар ганца (IV). Что наблюдаете? Запишите уравнение реакции.
3. Получение, собирание и распознавание углекислого газа
В пробирку объемом 20 мл поместите кусочек мра мора и прилейте раствор уксусной кислоты. Что наблюдаете? Через 1—2 минуты внесите в верхнюю часть пробирки горящую лучинку. Что наблюдаете? Запиши те уравнение реакции в молекулярной и ионной формах.
В пробирку налейте 1—2 мл прозрачного раствора из вестковой воды. Используя чистую стеклянную трубоч ку, осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение ре акции в молекулярной и ионной формах.
4. Получение, собирание и распознавание аммиака
В пробирку прилейте 1—2 мл раствора хлорида аммо ния, а затем такой же объем раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах.
Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете? Осторожно по нюхайте выделяющийся газ. Что ощущаете?
Лабораторная работа №7
Изготовление моделей молекул органических веществ
Цель: построить шаростержневые и масштабные модели молекул первых гомологов предельных углеводородов и их галогенопроизводных.
Оборудование: набор шаростержневых моделей.
Общие указания.
Для построения моделей используйте детали готовых наборов или пластилин с палочками. Шарики, имитирующие атомы углерода, готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, — из светлой окраски, атомы хлора – из зеленого или синего цвета. Для соединения шариков используют палочки.
Ход работы:
1.Соберите шаростержневую модель молекулы метана. На «углеродном» атоме наметьте четыре равноудаленные друг от друга точки и вставьте в них палочки, к которым присоединены «водородные» шарики. Поставьте эту модель (у нее должны быть три точки опоры).
2.Теперь соберите масштабную модель молекулы метана. Шарики «водорода» как бы сплющены и вдавлены в углеродный атом.
3.Сравните шаростержневую и масштабную модели между собой. Какая модель более реально передает строение молекулы метана? Дайте пояснения.
4.Соберите шаростержневую и масштабную модели молекулы этана. Изобразите эти модели на бумаги в тетради.
5.Соберите шаростержневые модели бутана и изобутана. Покажите на модели молекулы бутана, какие пространственные формы может принимать молекула, если происходит вращение атомов вокруг сигма связи. Изобразите на бумаге несколько пространственных форм молекулы бутана.
6.Соберите шаростержневые модели изомеров C5H12 . изобразите на бумаге.
7.Соберите шаростержневую модель молекулы дихлорметана CH2Cl2. Могут ли быть изомеры у этого вещества? Попытайтесь менять местами атомы водорода и хлора. К какому выводу вы приходите?
Лабораторная работа № 8
Качественная реакция на непредельные углеводороды
Цель работы:
-освоить лабораторный способ получения этилена, изучить его свойства, соблюдая правила по технике безопасности;
-закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: три пробирки, газоотводная трубка, резиновая пробка с отверстием под газоотводную трубку, металлический штатив, газовая горелка, этанол, концентрированная серная кислота, раствор перманганата калия, раствор бромной (или йодной) воды, кусочки пемзы.
Опыт.
Соберите прибор (см. рисунок), в пробирку налейте 0,5 мл этанола и добавьте туда 2 мл концентрированной серной кислоты (осторожно!). Положите туда небольшой кусочек пемзы (для равномерного кипения), полученную смесь сильно нагрейте. Выделяющийся этен пропустите по очереди через слабый раствор перманганата калия, а затем раствор бромной (или йодной) воды, взятые в количестве по 1 мл. Что вы наблюдаете?
После обесцвечивания растворов конец газоотводной трубки поднимите вверх и подожгите выделяющийся этен, не прекращая нагревания прибора. Отметьте характер пламени. Прекратите нагревание прибора, дайте ему остыть, разберите и помойте прибор.
Задание для самостоятельной работы
1.Как получают этен в лаборатории и промышленности? Напишите уравнения реакций.
2.Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
3.Почему этен легко обесцвечивает раствор перманганата калия и раствор бромной (или йодной) воды? Напишите уравнения реакций.
4. Напишите уравнение реакции горения этена.

Рисунок 3. Получение этена
Лабораторная работа №9
Кислородосодержащие органические соединения
Свойства глицерина
Цель: исследовать свойства глицерина. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — градуированная пробирка или пипетка,
— пробирка,
— глицерин,
— раствор хлорида (сульфата) меди (с=0,5 моль/л),
— раствор гидроксида натрия (калия) (10-12%-ный).
Ход работы:
К 0,5 мл воды в пробирке добавьте 2 капли глицерина, содержимое взболтайте. Прибавьте ещё каплю глицерина и снова взболтайте. Прибавьте ещё каплю глицерина. Что можно сказать о растворимости глицерина?
К полученному раствору глицерина прилейте 2 капли раствора соли меди и по каплям добавляйте раствор щёлочи до изменения окраски раствора (щелочь должна быть в избытке). Образуется глицерат меди ярко-синего цвета. Запомните: эта реакция является качественной на глицерин (многоатомные спирты).
Лабораторная работа № 10
Доказательство непредельного характера растительного жира .
Цель работы:
–экспериментально получить сложный эфир и изучить физические и химические свойства жиров, соблюдая правила по технике безопасности;
-закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: пробирки, вода, этанол, бензин, бензол, бромная вода, кусочки животного жира, подсолнечное масло, газовая горелка.
Опыт 1. Растворимость жиров
В одну пробирку налейте 3 мл бензина, во вторую – воды, в третью – этанола, в четвертую – бензола. Во все пробирки с веществами поместите по кусочку жира и встряхните.
Задание
1.В каком растворителе растворился кусочек жира?
Опыт 2. Доказательство непредельного характера жира
В одну пробирку налейте 2 мл подсолнечного масла, во вторую поместите кусочек твердого животного жира. К содержимому пробирок добавьте немного бромной воды. (Пробирку с кусочком твердого животного жира нагрейте до расплавления).
Задание В какой из пробирок бромная вода обесцветилась? О чем это свидетельствует?
Лабораторная работа №11.
2.Взаимодействие глюкозы и сахарозы с гидроксидом меди (II).
Цель: изучить свойства углеводов. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор глюкозы и сахарозы,
— раствор медного купороса,
— гидроксид натрия,
— вода,
— пробирки,
— спиртовка.
Ход работы
а) В пробирке №1 налито 0,5 мл раствора глюкозы, добавьте 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса.
б) К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки (соблюдайте правила ТБ обращения с нагревательными приборами). Прекратите нагревание, как только начнётся изменение цвета.
в) Прибавьте к раствору медного купороса раствор сахарозы, смесь взболтайте. Как изменилась окраска раствора? О чём это свидетелсьвует?
Ответьте на вопросы:
Что наблюдаете?
Почему образовавшийся в начале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора?
Наличием каких функциональных групп в глюкозе обусловлена эта реакция?
Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево-желтый?
Что представляет собой желто-красный осадок?
Наличие какой функциональной группы в глюкозе является причиной данной реакции?
Что доказывает реакции с раствором сахарозы?
Лабораторная работа №12
Денатурация раствора белка куриного яйца солями тяжёлых металлов.
Цель: изучить свойства белков. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор белка,
— раствор медного купороса,
— раствор ацетата свинца,
— пробирки.
Ход работы.
В 2 пробирки на лейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте с одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжёлыми металлами.
Оформите работу, сделайте выводы.
Растворение белков.
Многие белки растворяются в воде, то обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, щелочной – белки, обладающие основными свойствами.
Альбумины хорошо растворяются в дистиллированной воде, глобулины растворимы в воде только в присутствии электролитов.
Не растворяются в воде белки опорных тканей (кератин, эластин и др.)
