Тема 24. Массовая и объёмная доли компонентов смеси.
Часть I
1. Для жидких и твёрдых смесей массовая доля компонента (w) рассчитывается по формуле:
2. Объёмная доля компонента газообразной смеси (φ) рассчитывается по формуле:
3. Используя материал пунктов 1 и 2, выведите формулы для расчётов:
4. Для расчёта m раствора, если известны его плотность и объём, используют формулу, известную из курса физики: m(р-ра)=V*P
Часть II
1. В 40 г дистиллированной воды растворили 2 г хлорида натрия. Рассчитайте массовую долю соли в полученном растворе.
2. В 2 л раствора серной кислоты содержится 456 г h3SO4. Рассчитайте массовую долю растворённого вещества, учитывая, что плотность раствора равна 1,14 г/мл.
3.
4. К 1 кг 60%-го раствора соли добавили 50 г этой соли. Какова массовая доля соли в полученном растворе? Ответ округлить до десятых.
5. Какова массовая доля сахара в растворе, полученном при упаривании 200 г 20%-го раствора до 70 г? Ответ округлить до десятых.
6. Смешали 120 г 40%-го и 280 г 10%-го раствора азотной кислоты. Определите массовую долю азотной кислоты в полученном растворе.
7. Сколько хлороводорода нужно растворить в 1 м3 воды, чтобы получить 20%-й раствор? Вычислите массу и объём (н. у.) хлороводорода.
8. В воздухе содержится 21% кислорода и 78% азота по объёму. Рассчитайте объём кислорода и азота в 250 м3 воздуха. Определите для каждого газа количество вещества и массу.
9. К 300 л воздуха добавили 60 л азота. Вычислите массы кислорода и азота, которые можно получить из этой смеси.
Вычислите массы кислорода и азота, которые можно получить из этой смеси.
Контрольная работа «Соединения химических элементов. Массовая и объемная доля компонентов смеси» — 8 класс
Контрольная работа № 2 – 8 класс
Соединения химических элементов. Массовая и объемная доли компонентов смеси. Вариант 1
1. Установите соответствие между формулой вещества и степенью окисления азота
Формула вещества Степень окисления хлора
А) N2O 1) +1
Б) HNO2 2) –3
В) Mg
5) +5 2. Из предложенного перечня выберите два вещества, в которых атом марганца проявляет степень окисления + 2
Из предложенного перечня выберите два вещества, в которых атом марганца проявляет степень окисления + 2
1) MnO2
2) MnCl2
3) KMnO4
4) K2MnO4
5) MnSO4
3. Из предложенного перечня названий веществ выберите два бинарных соединения 1) хлорит натрия 2) бромид бария
3) сульфат алюминия
4) нитрид лития
5) нитрит кальция
4. Из предложенного перечня веществ выберите два нерастворимых основания 1) NaOH 2) Mg(OH)23) LiOH
4) Ca(OH)2
5) Fe(OH)3
5. Из предложенного перечня выберите два вещества с молекулярной кристаллической решеткой
1) вода
2) медь
3) поваренная соль
4) азот
5) оксид кремния (IV)
6. Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит
Формула вещества Класс
А) Cu(OH)2 1) оксид металла
Б) HClO3 2) кислота
В) Na2CO3 3)соль
Г) SO3 4) основание
5) оксид неметалла
7. Установите соответствие между формулами солей и названиями
Формула соли Название
А) K2CO3 1)хлорид калия
Б) MgSO4 2) хлорит калия
В) MgSO3 3) сульфит магния
Г) KCl 4) сульфид магния
5) сульфат магния
6) карбонат калия
8. Соотнесите формулу кислоты и соответствующего оксида
Соотнесите формулу кислоты и соответствующего оксида
Формула соли Название А) H3PO4 1) N2O3
Б) HNO2 2) NO
В) HNO3 3) N2O5
Г) H3PO3 4)P2O5
9. Определите массовую долю (%) нового раствора, если к раствору массой 120г с массовой долей карбоната натрия 4% добавили раствор массой 380г с массовой долей 6,5% этой же соли. В ответе приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). Ответ укажите с точностью до десятых.
10. Определите массу (г) азота, которая содержится в воздухе объемом 340л при н.
11. *Составьте четыре формулы сложных веществ, в состав которых входят атомы кальция и кислорода. Укажите названия веществ.
Составитель: Маланина Е. А. учитель химии МБОУ Одинцовская гимназия № 13
Контрольная работа № 2 – 8 класс
Соединения химических элементов. Массовая и объемная доли компонентов смеси.
Вариант 2
1. Установите соответствие между формулой вещества и степенью окисления серы
Формула вещества Степень окисления хлора
А) MgSO4 1) +1
Б) SO2 2) +2
В) Na2S2O3 3) –2
5) +6 2. Из предложенного перечня выберите два вещества, в которых атом хрома проявляет степень окисления +3
Из предложенного перечня выберите два вещества, в которых атом хрома проявляет степень окисления +3
1) CrO32) CrO
3) Na2Cr2O7
4) Cr(OH)3
5) KCrO2
3.
2) карбид кальция
3) силицид лития
4) гидроксид бария
5) нитрат алюминия
4. Из предложенного перечня веществ выберите два оксида металла
1) Ag2O
2) Zn(OH)2
3) SiO2
4) CaO
5) N2O
5. Из предложенного перечня выберите твердые смеси
1) апельсиновый сок
2) латунь
3) воздух 4) стекло
5) минеральная вода
6. Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит
Формула вещества Класс
А) Li2O 1) оксид металла
Б) NaOH 2) кислота
В) HNO3 3) нерастворимое основание
Г) P2O5 4) щелочь
5) оксид неметалла
7. Установите соответствие между формулами солей и названиями
Формула соли Название
А) Fe(NO3)2 1)нитрат железа (III)
Б) CaCl2 2) нитрат железа (II)
В) FeSO4 3) хлорид кальция
Г) Fe2(SO4)3 4)сульфат железа (III)
5) сульфат железа (II)
8. Соотнесите формулу основания и соответствующего оксида
Соотнесите формулу основания и соответствующего оксида
Формула соли Название
А) Fe(OH)3 1) FeO
Б) Fe(OH)2 2) Fe2O3
В) KOH 3) K2O
Г) Cr(OH)3 4) Cr2O3
9. Определите массовую долю нового раствора, если к раствору массой 80г с массовой долей сульфата магния 6% добавили раствор массой 320г с массовой долей 2,5% этой же соли. В ответе приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). Ответ укажите с точностью до десятых.
Ответ укажите с точностью до десятых.
10. Определите массу (г) кислорода, которая содержится в воздухе объемом 260л при н.у. В ответе приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). Ответ укажите с точностью до десятых.
11. *Составьте четыре формулы сложных веществ, в состав которых входят атомы фосфора и кислорода. Укажите названия веществ.
Составитель: Маланина Е. А. учитель химии МБОУ Одинцовская гимназия № 13
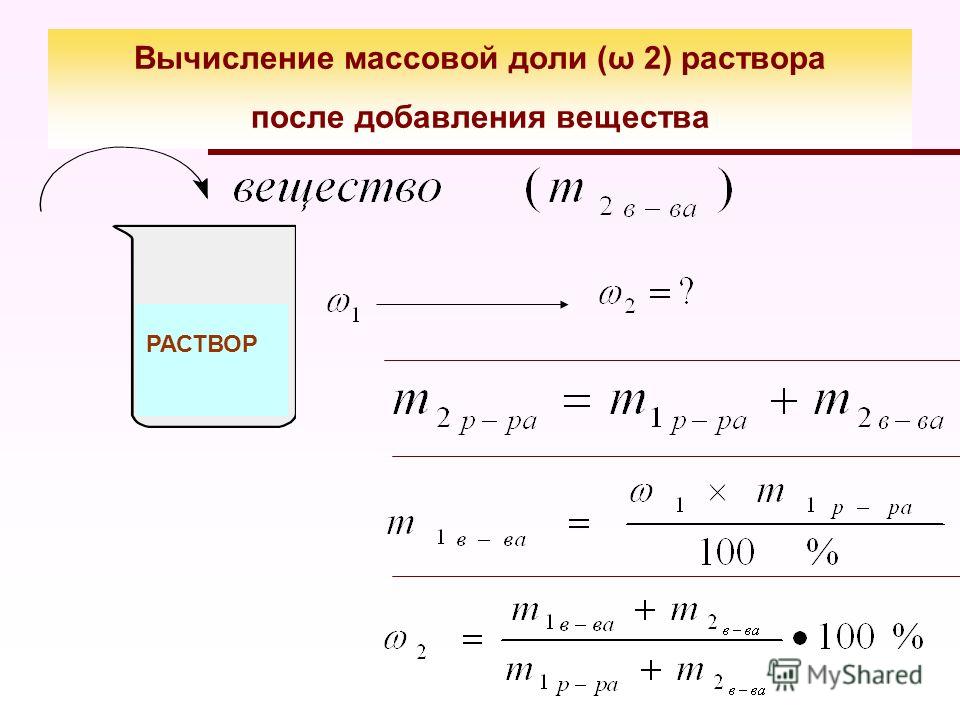
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
1.
Условие:
Для борьбы с болезнями растений, особенно плодовых деревьев и виноградников, применяют раствор сульфата меди (II). Обычно растворяют 100 г соли на ведро воды (8 л). Какова массовая доля соли в полученном растворе? Сколько воды и соли содержится в 500 г этого раствора?
Какова массовая доля соли в полученном растворе? Сколько воды и соли содержится в 500 г этого раствора?
Решение:
Ответ: массовая доля в полученном растворе составляет 1.2%, в 500 г этого раствора будет содержаться 6 г сульфата меди (II) и 494 г воды.
Советы:
Массовая доля — безразмерная физическая величина, равная отношению массы компонентов смеси к массе смеси.
2.
Условие:
Сколько граммов иода и спирта нужно взять для приготовления 30 г 5%-го раствора иодной настойки?
Решение:
Ответ: для приготовления 30 г 5%-го раствора иодной настойки необходимо взять 1.5 г иода и 28.5 г спирта.
Советы:
Массовая доля — безразмерная физическая величина, равная отношению массы компонентов смеси к массе смеси. Выражается в долях единицы, процентах (%), промилле, долях.
3.
Условие:
Рассчитайте количество вещества спирта C2H6O, который содержится в 500 г водки (40%-й раствор спирта). Не забудьте, что количество вещества измеряется в молях.
Решение:
Ответ: в 500 г водки содержится 4.35 моль этилового спирта.
Советы:
Формула этилового спирта C2H6O так же может выглядеть как C2H5OH.
4.
Условие:
Определите количество вещества золота и серебра, которое содержится в обручальном кольце массой 3,75 г и пробой 585°.
Решение:
Ответ: в обручальном кольце массой 3.75 г и пробой 585° содержится 11.1 ммоль золота и 14.4 ммоль серебра.
Советы:
Проба – это процент содержания золота или серебра в драгоценном металле, обозначенный цифрами. На каждом ювелирном изделии стоит клеймо, в котором указана проба.
5.
Условие:
Из 250 г 20%-го раствора хлорида калия выпарили 100 мл воды. Какой стала массовая доля соли в растворе?
Решение:
Ответ: после выпаривания 100 мл воды из 250 г 20%-го раствора, массовая доля хлорида калия составила 33%.
Советы:
При выпаривании концентрация раствора растет за счет того, что уменьшается количество растворителя, а количество растворимого вещества остается прежней.
6.
Условие:
В 180 г 15%-го раствора гидроксида натрия растворили ещё 20 г щёлочи. Рассчитайте массовую долю щёлочи в полученном растворе.
Решение:
Ответ: после растворения 20 г гидроксида натрия в 180 г 15%-го раствора гидроксида натрия, массовая доля щелочи составила 23.5%.
Советы:
Не забывайте про закон сохранения массы! Если в раствор добавили вещество и оно там растворилось, то его масса никуда не делась. Было 180г раствора, добавили 20г растворимого вещества, стало 200г раствора.
7.
Условие:
Смешали два раствора серной кислоты: 240 г 30%-го и 180 г 5%-го. Рассчитайте массовую долю кислоты в полученном растворе.
Решение:
Ответ: после смешивания 240г 30%-го и 180г 5%-го растворов серной кислоты, массовая доля кислоты составила 19.3%.
Советы:
Сначала считаем содержание серной кислоты в обоих растворах, складываем их в граммах. Затем складываем массы самих растворов. И уже в полученном растворе находим массовую долю кислоты по формуле.
«Массовая и объемная доля компонента в смеси, в том числе и доля примесей». Вариант 1
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
ТЕМА: «МАССОВАЯ И ОБЪЕМНАЯ ДОЛЯ КОМПОНЕНТА В СМЕСИ, В ТОМ ЧИСЛЕ И ДОЛЯ ПРИМЕСЕЙ»
ВАРИАНТ 1
Самостоятельные работы предназначены для текущей проверки знаний учащихся по всем программным темам 8 класса. Самостоятельные работы включают в себя 2 — 4 задания, на выполнение которых отводится от 10 до 20 минут. По усмотрению учителя задания самостоятельных работ могут быть использованы для индивидуального опроса учащихся или в качестве практических заданий во время зачетов или переводных экзаменов.
1. Какие массы соли и воды потребуются для приготовления 500 г ее 15%-го раствора?
2. Определите массу чистого Fe2O3 в 1 т магнитного железняка, содержащего 24% примесей.
Определите массу чистого Fe2O3 в 1 т магнитного железняка, содержащего 24% примесей.
3. К 200 г раствора с массовой долей хлорида натрия 24% долили 20 г воды. Определите массовую долю соли в новом растворе.
4. Какой объем кислорода можно получить из 400 л воздуха, если объемная доля кислорода в воздухе равна 21%.
Химия / 8 класс / Самостоятельные работы / Массовая и объемная доля компонента в смеси, в том числе и доля примесей
Преподавателю: Данная самостоятельная работа по химии проводится с учащимися 8 класса общеобразовательной школы. По структуре и сложности задания самостоятельной работы соответствуют обязательному минимуму содержания по химии в полной средней школе, а также соответствуют тематическому поурочному планированию к учебнику О. С. Габриеляна для 2-х часовой программы. Данная самостоятельная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
С. Габриеляна для 2-х часовой программы. Данная самостоятельная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
Целью данной самостоятельной работы является контроль усвоения учащимися темы «Массовая и объемная доля компонента в смеси, в том числе и доля примесей».
| < Предыдущая | Следующая > |
|---|
Массовая и объёмная доли компонентов смеси (раствора)
[музыка] вы уже знаете что своей жизнедеятельности мы используем обычно не чистые вещества и смеси которые могут быть твердыми и жидкими и газообразными смеси могут состоять как из двух веществ так и ис-3 и болью школьном курсе мы в основном будем говорить о смеси состоящих из двух веществ вещество входящая состав смеси называют компонентом смеси сначала рассмотрим самые распространенные смеси раствор и мы будем вести речь о водных растворах но растворы бывают и другие например спирту и водный раствор состоит из воды и растворенного в ней другого вещества следовательно масса раствор и состоит из массы воды и массы растворенного вещества и рассчитывать массу раствора мы с вами можем вот по этой формуле масса раствора равна масса воды плюс масса растворенного вещества тот компонент которого в растворе больше мы будем называть растворитель водных растворах это будет вода тот компонент смеси который растворяется в воде будем называть растворенное вещество для того чтобы работать с раствором нам необходимо знать какую дулю раствора или мы еще называем это концентрация раствора составляет растворенное вещество эту долю мы будем называть массовой долей растворенного вещества в растворе и выражать процентах или частях массовая доля растворенного вещества в растворе равна отношению масса растворенного вещества к общей массе раствора это и есть определение что такое массовая доля растворенного вещества масса раствора обозначается буквой м man элизу про масса растворенного вещества м низу раз там вещества массовая доля растворенного вещества [музыка] обозначается буквой омегой который читается массовая доля растворенного вещества таким образом по данной формуле мы можем рассчитать все что нам необходимо посмотрите масса растворенного вещества как гласит правило равна масса растворенного вещества деленная на массу раствора или массовая доля в процентах растворенного вещества равна масса растворенного вещества умножить на сто процентов и делить на массу раствора мы можем по этой футболе определять массу массовую долю растворенные вещества но также и массу раствора если нам известна масса растворенного вещества и массовая доля мы можем определить массу растворенного вещества если нам известна масса раствора и массовая доля растворенного вещества а вот это показано формулами посмотрите масса растворенного вещества равна массовая доля растворенного вещества [музыка] умноженное на масса раствора или масса растворенного вещества ровно массовая доля растворенного вещества выражен в процент умноженная на массу раствора и деленное на 100 процентов аналогично мы можем вычислить массу одного из компонентов и его массовую долю в твердой смеси или сплаве посмотрите масса вещества массовая доля тачки вещества равна масса вещества деленная на массу смеси или массовая доля вещества в процентах равна масса вещества умножить на сто процентов и деленная на массу смеси отсюда масса вещества ровно массовые дурачества умноженная на массу смеси или масса вещества равна массовая доля вещества выраженная в процентах умножить на массу смеси и деленное на 100 процентов где массовая доля вещества это массовая доля вещества смеси масса вещества ну понятно что это масса того компонента смеси который мы ищем и масса смеси эта масса всей смеси также мы можем рассчитать и объемную долю вещества в газовой смеси не забывая что объемная доля газообразного вещества обозначается уже буквой фи греческого алфавита посмотрите а формулы по сути остались те же самые объемная доля газа равна объем газа деленное на объем газовой смеси если же мы в процентах находим объемную долю там и объем газа умножаем на 100 процентов и делим на объем газовой смеси точно так же мы можем рассчитать объем горгаза если нам известна объемная доля газа в газовой смеси и объем газовой смеси таким образом как вы видите формула о которой мы с вами говорили достаточно универсальная да
ГЛАВА ТРЕТЬЯ.
 Соединения химических элементов § 25. Массовая и объёмная доли компонентов смеси (раствора)
Соединения химических элементов § 25. Массовая и объёмная доли компонентов смеси (раствора)Условие / ГЛАВА ТРЕТЬЯ. Соединения химических элементов / § 25. Массовая и объёмная доли компонентов смеси (раствора) / 2
2. Сколько граммов иода и спирта нужно взять для приготовления 30 г 5% -го раствора иодной настойки?
решебник №1 / ГЛАВА ТРЕТЬЯ. Соединения химических элементов / § 25. Массовая и объёмная доли компонентов смеси (раствора) / 2
решебник №2 / ГЛАВА ТРЕТЬЯ. Соединения химических элементов / § 25. Массовая и объёмная доли компонентов смеси (раствора) / 2
Соединения химических элементов / § 25. Массовая и объёмная доли компонентов смеси (раствора) / 2
Концентрация объемная: что такое и как правильно рассчитать
Концентрация растворов является важной характеристикой, показывающей содержание растворенного вещества и растворителя в его составе. Выражается концентрация, как правило, в массовых (вес) и объемных (объем) процентах или долях.
Растворы и их концентрация
Под раствором следует понимать однородную (гомогенную систему), в состав которой входит один или несколько компонентов. Растворы могут быть газовыми, жидкими, твердыми. Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация показывает массу или объем содержания веществ в составе раствора.
Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация показывает массу или объем содержания веществ в составе раствора.
Самый простой состав – это растворитель и растворенное вещество. Растворитель представляет собой вещество, которое при растворении не меняет свое состояние. Если смешиваются вещества в одинаковом агрегатном состоянии, к примеру, жидкость с жидкостью или газ с газом, растворителем будет компонент, которого больше. Образование раствора зависит от характера взаимодействия между частицами растворителя и растворенного вещества, их природой.
Чтобы определить соотношение растворенного вещества и растворителя в составе смеси и применяется такая характеристика, как концентрация. В зависимости от того, какая единица измерения выбрана, концентрация может быть объемной (содержание вещества в объеме раствора) или массовой (содержание вещества в единице массы раствора).
Объемные концентрации
Объемная доля вещества в общем объеме раствора выражается соотношением между объемом компонента, который нужно определить, и общим объемом всего раствора. Для измерения объемной концентрации используются доли или проценты. Значение концентрации указывается при определенных показателях температурного режима и давления.
Для выражения объемной доли используется следующая формула:
V(А) – объем вещества, V (смеси) – общий объем раствора.
Объемная доля, как правило, применяется в отношении газовых смесей. К примеру, содержание кислорода в воздухе составляет 21%, что означает объемную долю кислорода: φ(O2) = 21%. Применение объемной доли удобно потому, что объемное содержание газа в составе раствора газов, которые химически не взаимодействуют между собой, такая же, как молярная доля смеси. Это в достаточной мере точно выполняется, когда показатели давления и температуры не слишком высокие.
Для определения концентрации растворов определенных веществ используется ареометр. Он проградуирован непосредственно в концентрации смеси, а не в показателях ее плотности.
Он проградуирован непосредственно в концентрации смеси, а не в показателях ее плотности.
Объемная концентрация и объемная доля – безразмерные величины. Чтобы их выражать в большинстве случаев используются проценты, но могут также применяться такие единицы, как промилле, миллионные доли. Возможно также отображение единиц в таком виде: «% об.» или «об.%» (объемные проценты), однако рекомендуется писать конкретное указывать величину, к которой относится значение.
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Количественное выражение состава смесей и растворов
Химико-технологический факультет в Сплите
Относительная атомная масса ( A r ) элемента — это отношение между средней массой его атомов и 1/12 массы атома нуклида 12 C. Относительная молекулярная масса ( M r ) равно сумме относительной атомной массы всех атомов, входящих в эмпирическую формулу. Например, относительная молекулярная масса серной кислоты M r (H 2 SO 4 ) равна:
Например, относительная молекулярная масса серной кислоты M r (H 2 SO 4 ) равна:
= 2 * A r (H) + A r (S) + 4 * A r (O)
= 2 * 1,00794 + 32,066 + 4 * 15,9994
= 2,01 + 32,07 + 64,00
= 98,08
Относительная молекулярная масса — величина безразмерная, не имеет единиц измерения.
Количество вещества ( n ) равно соотношению количества элементарных сущностей: атомов, ионов, молекул, электронов… ( N ) и константа Авогадро ( L = 6,022045 · 10 23 моль -1 )
Молярная масса вещества ( M ) — это масса одного моля вещества, а точнее масса 6,022045 · 10 23 элементарных единиц вещества. Единица СИ для молярной массы — кг моль -1 , хотя чаще используется десятичная единица г моль -1 . Молярная масса численно равна относительной молекулярной массе, поэтому молярная масса серной кислоты, M (H 2 SO 4 ), равна 98. 08 г моль -1 .
08 г моль -1 .
Плотность вещества определяется как отношение массы ( м ) к объему ( V ) при заданной температуре. Единица измерения плотности — кг · м -3 , хотя чаще используется десятичная единица измерения в системе СИ: кг дм -3 . Важно указать температуру, при которой была измерена плотность, поскольку изменение температуры обычно приводит к изменению объема, а вместе с ним и к изменению плотности.
Растворы представляют собой однородные смеси чистых веществ.Растворы содержат два или более веществ (компонентов), смешанных вместе в состоянии молекулярной дисперсии. Компонент, который образует большую часть раствора, известен как растворитель , в то время как другие компоненты называются растворенными веществами . Стоит отметить, что сам растворитель может быть смесью.
Количественный состав раствора можно выразить с помощью:
- концентрация (молярная, массовая и объемная)
- фракция (молярная, массовая и объемная)
- соотношение (молярное, массовое и объемное)
- моляльность
Если не указано иное, соотношение относится к массовому соотношению .
Молярные, массовые и объемные доли пронумерованы, безразмерные единицы обычно выражаются как a:
- процентов, (% = 1/100)
- промилле или частей на тысячу, (‰ = 1/1 000)
- частей на миллион, (ppm = 1/1 000000)
Помните: процент — это не единица измерения, а соотношение определенного числа , деленного на 100 , поэтому 7% равно 0,07.
| Физическое количество | Символ | Определение | Блок | Описание |
|---|---|---|---|---|
| Концентрация | с | моль м -3 | Молярная концентрация или просто концентрация компонента A — это соотношение между количеством растворенного вещества A и объемом раствора. | |
| Массовая концентрация | γ | кг м -3 | Массовая концентрация компонента A равна отношению массы растворенного вещества A к объему раствора.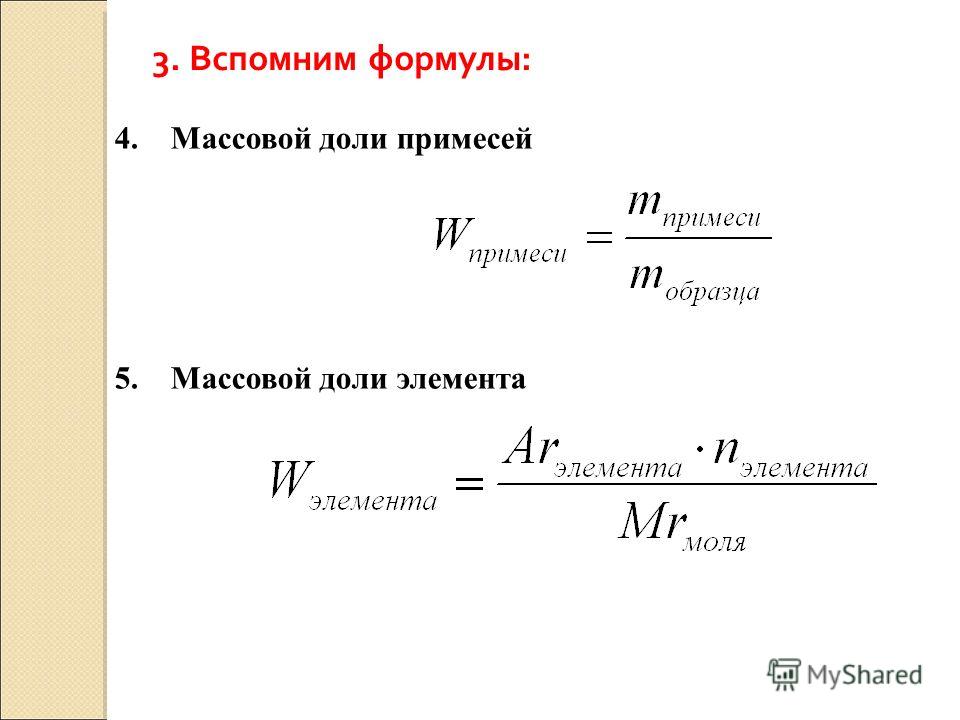 | |
| Объемная концентрация | σ | м 3 м -3 | Объемная концентрация компонента A равна отношению объема растворенного вещества A к объему раствора. | |
| Молярная доля | x | Мольная доля или количественная доля компонента A равна соотношению между количеством растворенного вещества A и суммой количеств всех веществ в растворе или смеси. | ||
| Массовая доля | w | Массовая доля или массовая доля компонента A — это массовое соотношение между растворенным веществом A и общей массой всех веществ в растворе или смеси. | ||
| Объемная доля | φ | Объемная доля компонента A — это объемное соотношение между растворенным веществом A и суммарным объемом всех веществ в растворе. | ||
| Мольное отношение | Моль или количественное соотношение — это соотношение между количеством молей любых двух компонентов в растворе или смеси. | |||
| Массовая доля | Массовое соотношение — это отношение масс двух любых компонентов в растворе или смеси. | |||
| Объемное соотношение | Объемное соотношение — это соотношение объемов двух компонентов раствора. | |||
| Моляльность | б | моль кг -1 | Моляльность компонента A равна отношению количества молей растворенного вещества A к массе растворителя S. |
Определение, примеры, проблемы, расчет ~ ChemistryGod
Массовая доля — это свойство смеси.Смесь — это физическая комбинация двух или более разных веществ. Типы смесей — растворы, суспензии и коллоиды.
Рисунок 1: Типы смесей: растворы (соль и вода), суспензии (почва и вода) и коллоиды (молоко) (слева направо)[Источники изображений: Викимедиа, Flickr и общественное достояние]
По химии, большинство смесей представляют собой растворы, гомогенную смесь растворенного вещества и растворителя. Но приведенное ниже определение массовой доли применимо и к другим типам.
Но приведенное ниже определение массовой доли применимо и к другим типам.
Содержание
Определение и формула
Массовая доля вещества в смеси — это отношение массы вещества к общей массе смеси. Он также известен как массовый процент или массовый процент при выражении в процентах. Поскольку массовая доля представляет собой отношение массы к массе, это безразмерная величина.
Для смеси
Здесь w i — массовая доля компонента i th , m i — масса компонента i th , и м T — общая масса смеси.
Общая масса смеси — это сумма масс каждого компонента.
Используя два приведенных выше уравнения,
Примечание: сумма всех массовых долей равна единице.
Примечание: массовая доля вещества не зависит от давления, температуры и местоположения; это интенсивное количество. Он остается постоянным, если не происходит химического изменения или чистого физического переноса какого-либо вещества. Итак, массовый процент вина (в приведенном выше примере) постоянен во всем мире.
Итак, массовый процент вина (в приведенном выше примере) постоянен во всем мире.
Массовая доля растворенного вещества в растворе определяется как отношение массы растворенного вещества к массе раствора.
Пусть m растворенного вещества будет массой растворенного вещества и m раствора , массой раствора. Массовая доля растворенного вещества следующая:
Массовый процент
Массовая доля также известна как массовый процент, массовый процент, массовый процент или массовый процент, когда выражается в процентах.Это сокращенно мас.% Или мас.%.
Для раствора:
Связь с другими величинами
Массовая доля — это одна из величин, используемых для выражения состава смеси. Но есть также и другие величины, такие как мольная доля, молярность, массовая концентрация и другие. Некоторые из них обсуждаются ниже.
Пропорция смешивания
Пропорция смешивания компонента — это относительное содержание данного компонента в смеси по сравнению с другими компонентами. Пусть m 1 будет массой чистого вещества 1, а m 2 — чистого вещества 2.Соотношение компонентов смеси составляет r m .
Пусть m 1 будет массой чистого вещества 1, а m 2 — чистого вещества 2.Соотношение компонентов смеси составляет r m .
Теперь мы можем выразить w 1 и w 2 через r m .
Молярная доля
Мольная доля широко используется в химии и технике. Это также безразмерная величина, представляющая собой отношение молей компонента к общему количеству молей смеси. Обычно обозначается как x i .
Пусть n i будет моль i th компонента смеси.Общее количество моль в смеси
. Мольная доля компонента i th составляет x i .Мы также знаем, что моль вещества — это отношение массы ( m i ) к молярной массе ( M i ).
Используя два приведенных выше уравнения,
Здесь
— средняя молярная масса смеси. Но мы тоже это знаем.
Но мы тоже это знаем.Подставив
,Таким образом, мы установили связь между мольной долей и массовой долей.
Объемная доля
Объемная доля ( v i ) — это объем компонента ( V i ) к общему объему смеси ( V смесь ).
Объем — это масса, разделенная на плотность.
Массовая концентрация
Массовая концентрация растворенного вещества ( ρ i ) — это отношение массы растворенного вещества ( м i ) к объему раствора ( V ).
Здесь
— плотность раствора ( ρ ).Из приведенного выше уравнения массовая концентрация растворенного вещества — это массовая доля растворенного вещества, умноженная на плотность раствора.
Молярность или молярная концентрация
Молярность или молярная концентрация ( C i ) — это моль растворенного вещества ( n i ) на единицу объема раствора ( V ).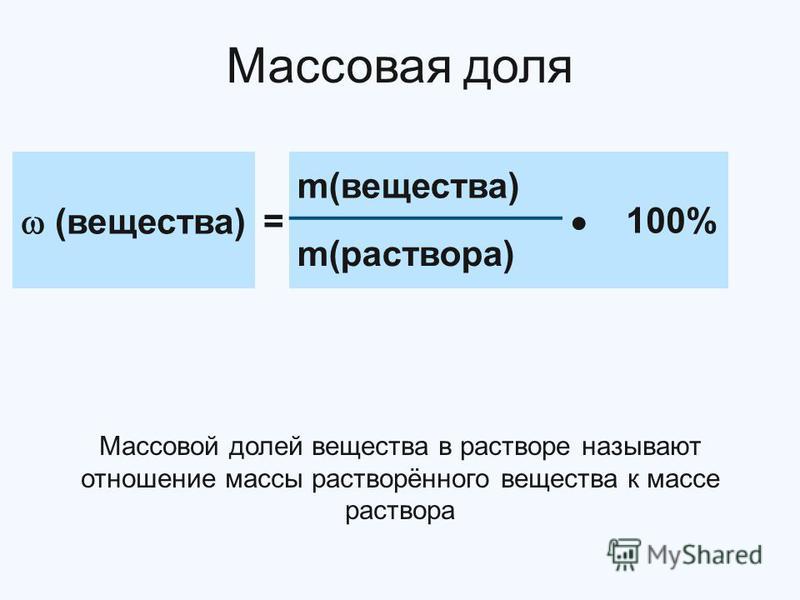 Объем раствора обычно выражается в дециметровых кубах (дм 3 ).
Объем раствора обычно выражается в дециметровых кубах (дм 3 ).
Моль вещества — это масса, деленная на молярную массу. А плотность — это масса, разделенная на объем.
Процентный состав
Составное соединение состоит из различных элементов. Когда рассчитывается массовая доля элемента, она называется процентным составом этого элемента. Короче говоря, массовая доля и процентный состав одинаковы, когда речь идет об элементах соединения.
Решенные проблемы
Проблема 1: Воздух
Заявление: Воздух содержит 21% кислорода и 79% азота.Молярная масса кислорода и азота составляет 15,999 г моль -1 и 14,007 г моль -1 .
Решение: Вышеуказанные проценты даны не по массе, а в молях. Итак, в 100 моль воздуха содержится 21 моль кислорода и 79 моль азота.
Преобразование моля в грамм,
Пусть w O 2 и w N 2 будут массовыми долями кислорода и азота соответственно.
Таким образом, массовая доля кислорода и азота составляет 23% и 77%.
Проблема 2: Газовая труба
Утверждение: Газовая труба содержит 2 моля диоксида углерода, 10 моль кислорода, 52 моль азота и 1,3 моль метана. Молярная масса водорода, углерода, азота и кислорода составляет 1,008 г моль -1 , 12,011 г моль -1 , 14,007 г моль -1 и 15,999 г моль -1 .
Решение: молярная масса диоксида углерода, кислорода, азота и метана равна M CO 2 , M O 2 , M N 2 и M CH 4 .
Преобразование моля в грамм,
Массовая доля рассчитывается как:
Задача 3: Серная кислота
Утверждение: Молярная концентрация серной кислоты составляет 2,0 М или 2 моль дм −3 . Молярная масса серной кислоты 98,08 г · моль -1 . Плотность раствора 1,19 г · см 900 · 10 −3 .
Решение: Рассмотрим 1 л (или 1 дм −3 ) раствора.
Моль серной кислоты в 1 л раствора составляет
Если перевести моль в грамм,
Таким образом, в 1 л раствора содержится 196.16 г серной кислоты.
Плотность раствора 1,19 г см −3 . На 1 л раствора масса раствора составляет
Массовая доля серной кислоты в 1190 г раствора составляет
Практические задачи
Найдите массовую долю в следующих задачах.
Проблема 1: Изопропиловый спирт
Раствор изопропилового спирта содержит 40 г изопропилового спирта и 20 г воды. Молярная масса изопропилового спирта и воды составляет 60 г моль -1 и 18 г моль -1 .
Задача 2: гидроксид натрия
Молярность раствора гидроксида натрия составляет 0,51 М. Молярная масса гидроксида натрия составляет 40 г · моль -1 . Плотность раствора 1,02 г · см 900 · 10 −3 .
Проблема 3: Выхлоп из дымохода
Выхлоп из дымохода содержит 10 моль кислорода (O 2 ), 53 моль азота (N 2 ) и 37 моль диоксида углерода (CO 2 ). Молярная масса кислорода, азота и диоксида углерода составляет 32 г моль -1 , 28 г моль -1 и 44 г моль -1 .
Молярная масса кислорода, азота и диоксида углерода составляет 32 г моль -1 , 28 г моль -1 и 44 г моль -1 .
- 0,67 изопропилового спирта и 0,33 воды.
- 0,020 гидроксида натрия.
- 0,09 кислорода, 0,43 азота и 0,48 диоксида углерода.
Сопутствующие статьи
Молярная доля и молярный процент
Цель обучения
- Вычислить мольную долю и мольный процент для данной концентрации смеси
Ключевые моменты
- Мольная доля описывает количество молекул (или молей) одного компонента, деленное на общее количество молекул (или молей) в смеси.
- Молярная доля полезна, когда два реактивных компонента смешиваются вместе, так как соотношение двух компонентов известно, если известна мольная доля каждого.
- Умножение мольной доли на 100 дает мольный процент, который описывает то же самое, что и мольная доля, только в другой форме.
 Мольные доли могут быть получены из различных концентраций, включая составы молярности, молярности и массовых процентов.
Мольные доли могут быть получены из различных концентраций, включая составы молярности, молярности и массовых процентов.
Условия
- мольная доля Отношение количества молей одного компонента в смеси к общему количеству молей.
- моль — основная единица измерения количества вещества в системе СИ; количество вещества, которое содержит столько же элементарных единиц, сколько атомов в 0,012 кг углерода-12.
Молярная доля
В химии мольная доля, x i , определяется как количество молей компонента, n i , деленное на общее количество молей всех компонентов в смеси, n тот :
[латекс] x_ {i} = \ frac {n_ {i}} {n_ {tot}} [/ латекс]
Мольные доли безразмерны, а сумма всех мольных долей в данной смеси всегда равна 1.
Свойства мольной доли
Мольная доля очень часто используется при построении фазовых диаграмм. Имеет ряд преимуществ:
- Он не зависит от температуры, в отличие от молярной концентрации, и не требует знания плотности фазы (фаз).

- Смесь с известными мольными долями может быть приготовлена путем взвешивания соответствующих масс компонентов.
- Мера симметричная; в мольных долях x = 0.1 и x = 0,9, роли «растворителя» и «растворенного вещества» обратимы.
- В смеси идеальных газов мольную долю можно выразить как отношение парциального давления к общему давлению смеси.
Молярный процент
Умножение мольной доли на 100 дает мольный процент, также называемый процентным содержанием / количеством (сокращенно n / n%).Для общей химии все мольные проценты смеси составляют в сумме 100 мольных процентов. Мы можем легко преобразовать молярный процент обратно в мольную долю, разделив на 100. Таким образом, мольная доля 0,60 равна 60,0% молярного процента.
Расчеты с молярной долей и мольным процентом
Молярная доля в смесях
Смесь газов была образована путем объединения 6,3 моль O 2 и 5,6 моль N 2 . Какая мольная доля азота в смеси?
Какая мольная доля азота в смеси?
Сначала мы должны найти общее количество родинок с n итого = n N2 + n O2 .
[латекс] n_ {всего} = 6,3 \ моль + 5,6 \ моль = 11,9 \ моль [/ латекс].
Затем мы должны разделить родинки N 2 на общее количество родинок:
[латекс] x (\ text {мольная доля}) = (\ frac {\ text {моль} N_2} {\ text {моль} N_2 + \ text {моль} O_2}) = (\ frac {5.6 \ text { молей}} {11.9 \ text {moles}}) = 0,47 [/ латекс]
Мольная доля азота в смеси составляет 0,47.
Молярная доля в растворах
Молярная доля также может применяться в случае растворов.Например, 0,100 моль NaCl растворяют в 100,0 мл воды. Какая мольная доля NaCl?
Нам дано количество молей NaCl, но объем воды. Сначала мы преобразуем этот объем в массу, используя плотность воды (1,00 г / мл), а затем преобразуем эту массу в моль воды:
[латекс] 100 \ мл \ H_2O \ times (\ frac {1.0g} {1mL}) = 100. 0 \ g \ H_2O \ times (\ frac {1 \ text {moles}} {18.0 г}) = 5.55 \ text {молес} H_2O [/ латекс]
0 \ g \ H_2O \ times (\ frac {1 \ text {moles}} {18.0 г}) = 5.55 \ text {молес} H_2O [/ латекс]
С помощью этой информации мы можем найти общее количество присутствующих родинок: 5.55 + 0,100 = 5,65 моль. Если разделить моли NaCl на общее количество молей, мы найдем мольную долю этого компонента:
[латекс] x = (\ frac {0.100 \ text moles} {5.65 \ text moles}) = 0,0176 [/ latex]
Мы находим, что мольная доля NaCl равна 0,0176.
Молярная доля с многокомпонентными смесями
Мольные доли также могут быть найдены для смесей, состоящих из нескольких компонентов. К ним относятся не иначе, чем раньше; опять же, общая мольная доля смеси должна быть равна 1.
Например, раствор образуется при смешивании 10,0 г пентана (C 5 H 12 ), 10,0 г гексана (C 6 H 14 ) и 10,0 г бензола (C 6 H 6 ). Какая мольная доля гексана в этой смеси?
Сначала мы должны найти количество молей, присутствующих в 10,0 г каждого компонента, с учетом их химической формулы и молекулярной массы. Количество молей каждого находится путем деления его массы на соответствующую молекулярную массу.Мы обнаружили, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Количество молей каждого находится путем деления его массы на соответствующую молекулярную массу.Мы обнаружили, что имеется 0,138 моль пентана, 0,116 моль гексана и 0,128 моль бензола.
Мы можем найти общее количество молей, взяв сумму всех молей: 0,138 + 0,116 + 0,128 = 0,382 общих молей. Если разделить моли гексана на общее количество молей, мы вычислим мольную долю:
[латекс] x = (\ frac {0,116 \ text {moles}} {0,382 \ text {moles}}) = 0,303 [/ латекс]
Мольная доля гексана составляет 0,303.
Молярная доля от моляльности
Мольную долю можно также рассчитать по моляльности.Если у нас есть 1,62 м раствор столового сахара (C 6 H 12 O 6 ) в воде, какова мольная доля столового сахара?
Поскольку нам дана моляльность, мы можем преобразовать ее в эквивалентную мольную долю, которая уже является массовым соотношением; помните, что моляльность = моль растворенного вещества / кг растворителя. Учитывая определение моляльности, мы знаем, что у нас есть раствор, содержащий 1,62 моля сахара и 1,00 кг (1000 г) воды. Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя его молекулярный вес:
Поскольку мы знаем количество молей сахара, нам нужно найти количество молей воды, используя его молекулярный вес:
[латекс] 1000 \ г \ H_2O \ times (\ frac {1 \ моль} {18.0 \ g}) = 55,5 \ text {moles} H_2O [/ latex]
Общее количество молей — это сумма молей воды и сахара, или 57,1 молей всего раствора. Теперь мы можем найти мольную долю сахара:
[латекс] x = (\ frac {1,62 \ text {молей сахара}} {57,1 \ text {молей раствор}}) = 0,0284 [/ латекс]
При мольной доле 0,0284 мы видим, что имеем 2,84% раствор сахара в воде.
Молярная доля от массового процента
Мольную долю можно также рассчитать из массовых процентов.Какова мольная доля коричной кислоты с мольным процентом 50,00% мочевины в коричной кислоте? Молекулярная масса мочевины составляет 60,16 г / моль, а молекулярная масса коричной кислоты составляет 148,16 г / моль.
Во-первых, мы предполагаем общую массу 100,0 г, хотя можно принять любую массу. Это означает, что у нас есть 50,0 г мочевины и 50,0 г коричной кислоты. Затем мы можем вычислить количество присутствующих молей, разделив каждый на его молекулярный вес. У нас 0,833 моль мочевины и 0,388 моль коричной кислоты, поэтому у нас 1.Всего 22 моля.
Затем мы можем вычислить количество присутствующих молей, разделив каждый на его молекулярный вес. У нас 0,833 моль мочевины и 0,388 моль коричной кислоты, поэтому у нас 1.Всего 22 моля.
Чтобы найти мольную долю, разделим количество молей коричной кислоты на общее количество молей:
[латекс] x = (\ frac {.388 \ text {моль коричной кислоты}} {1,22 \ text {моль раствор}}) = 0,318 [/ латекс]
Мольная доля коричной кислоты составляет 0,318.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
6.3: Закон Далтона — Chemistry LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи, представленные ниже.
- Один моль газа занимает объем 22,4 л при STP (стандартные температура и давление, 273 К, 1 атм = 103 кПа).
- Приведенный выше факт позволяет нам связать измеряемое свойство плотности газа с его молярной массой .

- Состав смеси газов обычно выражается через мольных долей ; убедитесь, что вы умеете их рассчитывать.
- Закон парциальных давлений Дальтона гласит, что каждый газ в смеси действует независимо, поэтому общее давление, которое газ оказывает на стенки контейнера, является просто суммой парциальных давлений отдельных компонентов.
Хотя все газы строго следуют закону идеального газа PV = nRT при соответствующих условиях, каждый газ также является уникальным химическим веществом, состоящим из молекулярных единиц с определенной массой. В этом уроке мы увидим, как эти молекулярные массы влияют на свойства газов, которые соответствуют закону идеального газа.После этого мы рассмотрим газы, которые содержат более одного вида молекул — другими словами, смесь газов. Начнем с обзора молярного объема и E.V.E.N. принцип, который является центральным для нашего понимания газовых смесей.
Молярный объем газа
Вы помните, что молярная масса чистого вещества — это масса 6,02 x 10 23 ( число Авогадро ) частиц или молекулярных единиц этого вещества. Молярные массы обычно выражаются в граммах на моль (г · моль –1 ) и часто обозначаются как молекулярная масса с. Как объяснялось в предыдущем уроке, равные объемы газов, измеренные при одинаковой температуре и давлении, содержат равное количество молекул (это «ЧЕТНЫЙ» принцип , более формально известный как закон Авогадро ). Стандартная температура и давление: 273К, 1 атм
Молярные массы обычно выражаются в граммах на моль (г · моль –1 ) и часто обозначаются как молекулярная масса с. Как объяснялось в предыдущем уроке, равные объемы газов, измеренные при одинаковой температуре и давлении, содержат равное количество молекул (это «ЧЕТНЫЙ» принцип , более формально известный как закон Авогадро ). Стандартная температура и давление: 273К, 1 атм
Величина этого объема, конечно, будет зависеть от температуры и давления, поэтому для удобства сравнения обычно определяют набор условий T = 273 K и P = 1 атм как стандартные температура и давление , обычно обозначается как STP .Подставляя эти значения в уравнение состояния идеального газа и решая для V , получаем объем 22,414 литра на 1 моль.
Пример \ (\ PageIndex {1} \)
Каким будет объем одного моля воздуха при 20 ° C на вершине Мауна-Кеа, Хаваи (высота 4,2 км), где давление воздуха составляет примерно 60 кПа?
Шлак и шлаковые шишки на вершине Мауна-Кеа зимой. (Общественное достояние; USGS)
(Общественное достояние; USGS)
Решение
Примените законы Бойля и Чарльза в качестве последовательных поправочных коэффициентов к стандартному давлению на уровне моря, равному 101.3 кПа:
Стандартный молярный объем 22,4 л моль –1 — это значение, которое стоит запомнить, но помните, что оно действительно только в STP. Молярный объем при других температурах и давлениях легко найти с помощью простой пропорции. Как показывает следующий пример, молярный объем вещества может кое-что сказать нам о том, сколько места занимает каждая молекула.
Пример \ (\ PageIndex {2} \)
Оценить среднее расстояние между молекулами в газе при давлении 1 атм и 0 ° C.{–7} \, см = 3.4 \, нм \ nonumber \]
В условиях, при которых применима модель идеального газа (то есть почти всегда, если вы не инженер-химик, имеющий дело с высокими давлениями), «молекула есть молекула», поэтому количество молекул Авогадро не зависит от состав газа. Причина, конечно, в том, что объем газа — это в основном пустое пространство; объемы самих молекул ничтожны.
Причина, конечно, в том, что объем газа — это в основном пустое пространство; объемы самих молекул ничтожны.
Молярная масса и плотность газа
Молекулярная масса (молярная масса) любого газа — это масса, выраженная в граммах, числа его молекул Авогадро.Это верно независимо от того, состоит ли газ из одного вида молекул или из смеси. Для смеси газов молярная масса будет зависеть от молярных масс ее компонентов и от фракционного содержания каждого вида молекул в смеси. Термин «средняя молекулярная масса» часто используется для описания молярной массы газовой смеси.
Средняя молярная масса (\ (\ bar {m} \)) смеси газов — это просто сумма мольных долей каждого газа, умноженная на молярную массу этого вещества:
\ [\ bar {m} = \ sum_i \ chi_im_i \]
Пример \ (\ PageIndex {3} \)
Найдите среднюю молярную массу сухого воздуха с объемным составом O 2 (21%), N 2 (78%) и Ar (1%).
Решение
Средняя молекулярная масса — это взвешенная по мольным долям сумма молекулярных масс его компонентов.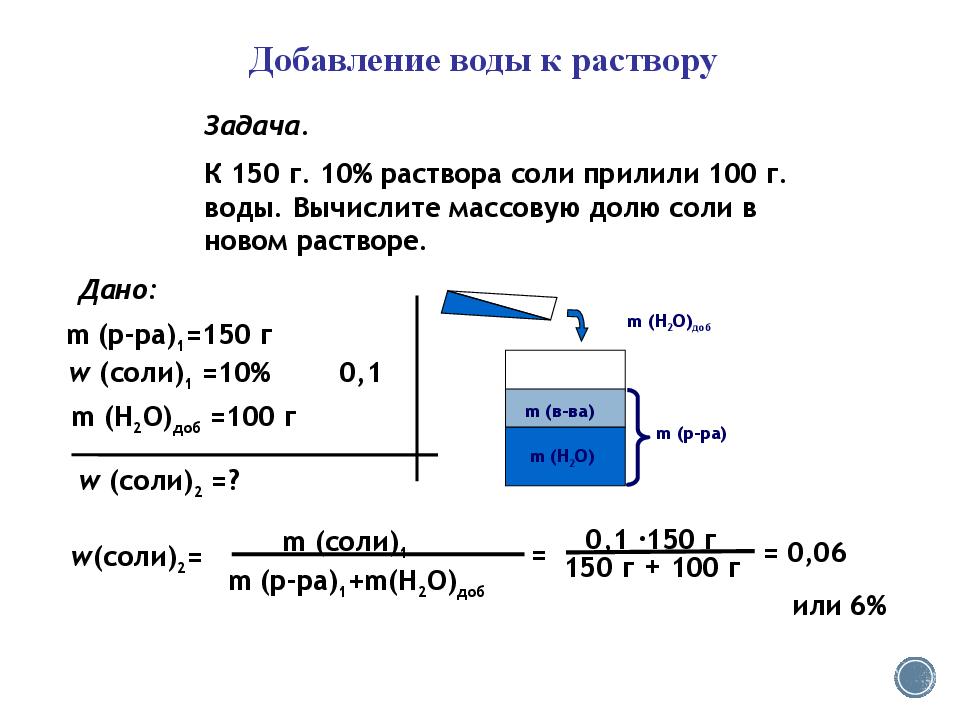 {- 1}} {22.{–1} \ nonumber \]
{- 1}} {22.{–1} \ nonumber \]
Примечание: нет необходимости искать «формулу» для этого расчета; просто скомбинируйте молярную массу и молярный объем таким образом, чтобы единицы получались правильно.
Что еще более важно, если мы можем измерить плотность неизвестного газа, у нас есть удобный способ оценки его молекулярной массы. Это один из многих важных примеров того, как макроскопическое измерение (выполненное на массивном веществе) может дать микроскопическую информацию (то есть об объектах молекулярного масштаба.)
Плотность газа в настоящее время измеряется в промышленности с помощью электромеханических устройств, таких как вибрирующие язычки, которые могут обеспечивать непрерывные записи в реальном времени в определенных местах, например в трубопроводах. Определение молекулярной массы газа по его плотности известно как метод Дюма , в честь французского химика Жана Дюма (1800-1840), который разработал его. Просто измеряют вес известного объема газа и преобразуют этот объем в его эквивалент STP, используя законы Бойля и Чарльза.Вес газа, деленный на его объем STP, дает плотность газа, а плотность, умноженная на 22,4 моль –1 , дает молекулярную массу. Обратите особое внимание на примеры расчета плотности газа, приведенные здесь и в вашем учебнике. Ожидается, что вы будете выполнять такие вычисления, переводя молекулярную массу в плотность газа.
Просто измеряют вес известного объема газа и преобразуют этот объем в его эквивалент STP, используя законы Бойля и Чарльза.Вес газа, деленный на его объем STP, дает плотность газа, а плотность, умноженная на 22,4 моль –1 , дает молекулярную массу. Обратите особое внимание на примеры расчета плотности газа, приведенные здесь и в вашем учебнике. Ожидается, что вы будете выполнять такие вычисления, переводя молекулярную массу в плотность газа.
Пример \ (\ PageIndex {5} \)
Рассчитайте приблизительную молярную массу газа, измеренная плотность которого равна 3.{–1} \ nonumber \]
Плотность газовой смеси
Измерение плотности газа может быть полезным средством оценки состава смеси двух разных газов; это широко применяется в процессах промышленной химии, в которых необходимо постоянно контролировать состав газовых потоков.
Пример \ (\ PageIndex {6} \): диоксид углерода и метан
Найдите состав смеси \ (\ ce {CO2} \) (44 г / моль) и метана \ (\ ce {Ch5} \) (16 г / моль), который имеет плотность STP, равную 1. 214 г / л.
214 г / л.
Решение
Плотность смеси этих двух газов будет прямо пропорциональна ее составу, варьируясь от плотности чистого метана до чистого CO 2 . Начнем с нахождения этих двух плотностей:
Для CO 2 :
(44 г / моль) ÷ (22,4 л / моль) = 1,964 г / л
Для CH 4 :
(16 г / моль) ÷ (22,4 л / моль) = 0,714 г / л
Если x — мольная доля CO 2 и (1– x ) — мольная доля CH 4 , мы можем написать
1.964 x + 0,714 (1 – x) = 1,214
(Есть ли в этом смысл? Обратите внимание, что если x = 0, плотность будет плотностью чистого CH 4 , а если бы она была 1, это была бы плотность чистого CO 2 .)
Расширение приведенного выше уравнения и решение относительно x дает мольные доли 0,40 для CO 2 и 0,60 для CH 4 .
Выражение состава газовой смеси
Поскольку большая часть объема, занимаемого газом, состоит из пустого пространства, ничто не мешает двум или более видам газов занимать один и тот же объем. Гомогенные смеси такого типа обычно известны как растворы , но принято называть их просто газовыми смесями . Мы можем задавать состав газовых смесей разными способами, но наиболее распространены по объемам и мольным долям .
Гомогенные смеси такого типа обычно известны как растворы , но принято называть их просто газовыми смесями . Мы можем задавать состав газовых смесей разными способами, но наиболее распространены по объемам и мольным долям .
Объемные доли
Из закона Авогадро мы знаем, что «равные объемы содержат равное количество молекул». Это означает, что объемы газов, в отличие от твердых и жидких, являются аддитивными.Таким образом, если контейнер с перегородками имеет два объема газа A в одной секции и один моль газа B в другой (оба при одинаковой температуре и давлении), и мы удалим перегородку, объем останется неизменным.
Мы можем уточнить состав этой смеси, сказав, что объемная доля A составляет 1/3, а объемная доля B составляет 2/3.Объемные доли часто называют частичными объемами:
\ [V_i = \ dfrac {v_i} {\ sum v_i} \]
Пусть вас не отпугнет такая нотация! Знак суммирования Σ (греч.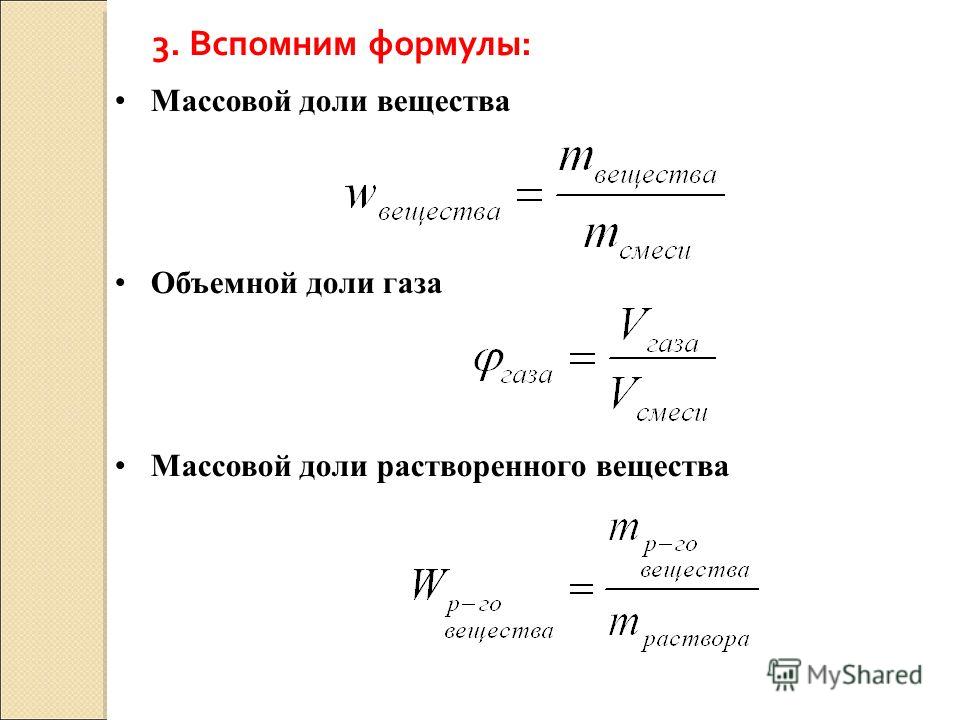 Сигма) означает просто сложить v (объемы) каждого газа.Таким образом, если Газ A является веществом « i -ое», как в приведенном выше выражении, суммирование выполняется от i = 1 до i = 2. Обратите внимание, что мы можем использовать частичные объемы для определения состава смеси, даже если она никогда не была фактически получена путем объединения чистых газов.
Сигма) означает просто сложить v (объемы) каждого газа.Таким образом, если Газ A является веществом « i -ое», как в приведенном выше выражении, суммирование выполняется от i = 1 до i = 2. Обратите внимание, что мы можем использовать частичные объемы для определения состава смеси, даже если она никогда не была фактически получена путем объединения чистых газов.
Когда мы говорим, что воздух, например, состоит на 21 процент кислорода и 78 процентов азота по объему, это то же самое, что сказать, что те же проценты молекул в воздухе состоят из O 2 и N 2 .Точно так же в 1,0 моль воздуха содержится 0,21 моль O 2 и 0,78 моль N 2 (остальные 0,1 моль состоит из различных газовых примесей, но в основном это неон). Обратите внимание, что вы никогда не сможете предположить подобное эквивалентно смесям жидкостей или твердых тел, к которым ДАЖЕ принцип не применяется.
Молярные доли
Эти последние два числа (0,21 и 0,78) также выражают мольные доли кислорода и азота в воздухе. Молярная доля означает именно то, что он говорит: долю молекул, которые состоят из определенного вещества.Это выражается алгебраически как
Молярная доля означает именно то, что он говорит: долю молекул, которые состоят из определенного вещества.Это выражается алгебраически как
\ [X_i = \ dfrac {n_i} {\ sum_i n_i} \]
, так что в случае кислорода в воздухе его мольная доля составляет
\ [X_ {O_2} = \ dfrac {n_ {O_2}} {n_ {O_2} + n_ {N_2} + n_ {Ar}} = \ dfrac {0,21} {1} = 0,21 \ nonumber \]
Пример \ (\ PageIndex {7} \)
Смесь \ (O_2 \) и закиси азота \ (N_2O \) иногда используется в качестве мягкого анестетика в стоматологической хирургии. Определенная смесь этих газов имеет плотность 1,482 г л –1 при 25 и 0.{-1} \ nonumber \]
Молярная масса смеси составляет (1,65 г л –1 ) (22,4 л моль –1 ) = 37,0 г моль –1 . Молекулярные массы \ (O_2 \) и \ (N_2 \) равны 32 и 44 соответственно. 37,0 составляет 5/12 разницы между молярными массами двух чистых газов. Поскольку плотность газовой смеси прямо пропорциональна ее средней молярной массе, мольная доля более тяжелого газа в смеси также составляет 5/12:
.
\ [\ dfrac {37-32} {44-32} = \ dfrac {5} {12} = 0.42 \ nonumber \]
Пример \ (\ PageIndex {8} \)
Какова мольная доля диоксида углерода в смеси, состоящей из равных масс CO 2 (MW = 44) и неона (MW = 20,2)?
Решение
Предположим любую произвольную массу, например 100 г, найдите эквивалентное количество молей каждого газа, а затем подставьте в определение мольной доли:
- n CO2 = (100 г) ÷ (44 г моль –1 ) = 2.3 моль
- n Ne = (100 г) ÷ (20,2 г моль –1 ) = 4,9 моль
- X Ne = (2,3 моль) ÷ (2,3 моль + 4,9 моль) = 0,32
Закон парциальных давлений Дальтона
Уравнение состояния идеального газа применимо к смесям так же, как и к чистым газам. Фактически именно с газовой смесью, обычным воздухом, Бойль, Гей-Люссак и Шарль проводили свои первые эксперименты. Единственная новая концепция, которая нам нужна для работы со смесями, — это парциальное давление , концепция, изобретенная известным английским химиком Джоном Далтоном (1766-1844).Дальтон рассуждал, что низкая плотность и высокая сжимаемость газов указывает на то, что они в основном состоят из пустого пространства; из этого следует, что когда два или более разных газа занимают один и тот же объем, они ведут себя совершенно независимо.
Единственная новая концепция, которая нам нужна для работы со смесями, — это парциальное давление , концепция, изобретенная известным английским химиком Джоном Далтоном (1766-1844).Дальтон рассуждал, что низкая плотность и высокая сжимаемость газов указывает на то, что они в основном состоят из пустого пространства; из этого следует, что когда два или более разных газа занимают один и тот же объем, они ведут себя совершенно независимо.
Вклад, который каждый компонент газовой смеси вносит в общее давление газа, известен как парциальное давление этого газа. Сам Далтон изложил этот закон в простой и наглядной форме, показанной слева.
Обычный способ сформулировать Закон парциальных давлений Дальтона — это
Полное давление газа — это сумма парциальных давлений его компонентов
, который алгебраически выражается как
\ [P_ {total} = P_1 + P_2 + P_3… = \ sum_i P_i \]
или, что эквивалентно
\ [P_ {total} = \ dfrac {RT} {V} \ sum_i n_i \]
Существует также аналогичное соотношение, основанное на объемных долях , известное как закон частичных объемов Амагата . Это в точности аналогично закону Дальтона в том смысле, что он гласит, что полный объем смеси — это просто сумма парциальных объемов ее компонентов. Но есть два важных отличия: закон Амагата справедлив только для идеальных газов, которые должны иметь одинаковую температуру и давление.Закон Дальтона не имеет ни одного из этих ограничений. Хотя закон Амагата кажется интуитивно очевидным, иногда он оказывается полезным в приложениях химической инженерии. Мы не будем использовать это в этом курсе.
Это в точности аналогично закону Дальтона в том смысле, что он гласит, что полный объем смеси — это просто сумма парциальных объемов ее компонентов. Но есть два важных отличия: закон Амагата справедлив только для идеальных газов, которые должны иметь одинаковую температуру и давление.Закон Дальтона не имеет ни одного из этих ограничений. Хотя закон Амагата кажется интуитивно очевидным, иногда он оказывается полезным в приложениях химической инженерии. Мы не будем использовать это в этом курсе.
Пример \ (\ PageIndex {9} \)
Рассчитайте массу каждого компонента, присутствующего в смеси фтора (MW и ксенон (MW 131,3), содержащейся в колбе объемом 2,0 л. Парциальное давление Xe составляет 350 торр, а общее давление составляет 724 торр при 25 ° C.
Решение
Согласно закону Дальтона, парциальное давление F 2 равно (724 — 350) = 374 торр:
Мольные доли
\ [\ chi_ {Xe} = \ dfrac {350} {724} = 0. {–1}) \ times (0,48 \ times 0,078 \, моль) = 4,9 \, г \ nonumber \]
{–1}) \ times (0,48 \ times 0,078 \, моль) = 4,9 \, г \ nonumber \]
Пример \ (\ PageIndex {10} \)
Три колбы, имеющие разный объем и содержащие разные газы при разном давлении, соединены запорными кранами, как показано. Когда краны открыты,
- Какое будет давление в системе?
- Какого газа будет больше всего в смеси?
Предположим, что температура однородна и что объем соединительных трубок незначителен.
Решение
Уловка здесь заключается в том, чтобы отметить, что общее количество молей n T и температура остаются неизменными, поэтому мы можем использовать закон Бойля PV = константа. Мы проработаем детали только для CO 2 , обозначенного индексами a.
Для CO 2 ,
P a V a = (2,13 атм) (1,50 л) = 3,19 л-атм.
Добавляя продукты PV для каждого отдельного контейнера, получаем
\ [\ сумма P_iV_i = 6. 36 Л-атм = n_T RT. \ nonumber \]
36 Л-атм = n_T RT. \ nonumber \]
Назовем эту сумму P 1 V 1 . После открытия запорных кранов и смешивания газов новые условия обозначаются как P 2 V 2 .
Из закона Бойля,
= 6,36 л-атм . V 2 = Σ V i = 4,50 л.Решая для конечного давления P 2 получаем
(6,36 л-атм) / (4.50 л) = 1,41 атм .
Для CO 2 это дает (3,19 / RT ) / (6,36 / RT ) = 0,501. Поскольку это значение превышает 0,5, мы знаем, что это самый распространенный газ в конечной смеси.
Применение закона Дальтона: сбор газов над водой
Обычный лабораторный метод сбора газообразного продукта химической реакции заключается в том, чтобы поместить его в перевернутую трубку или бутылку, наполненную водой, отверстие которой погружают в большую емкость с водой.Эта конструкция получила название «Пневматический желоб » и «» широко использовалась на заре химии.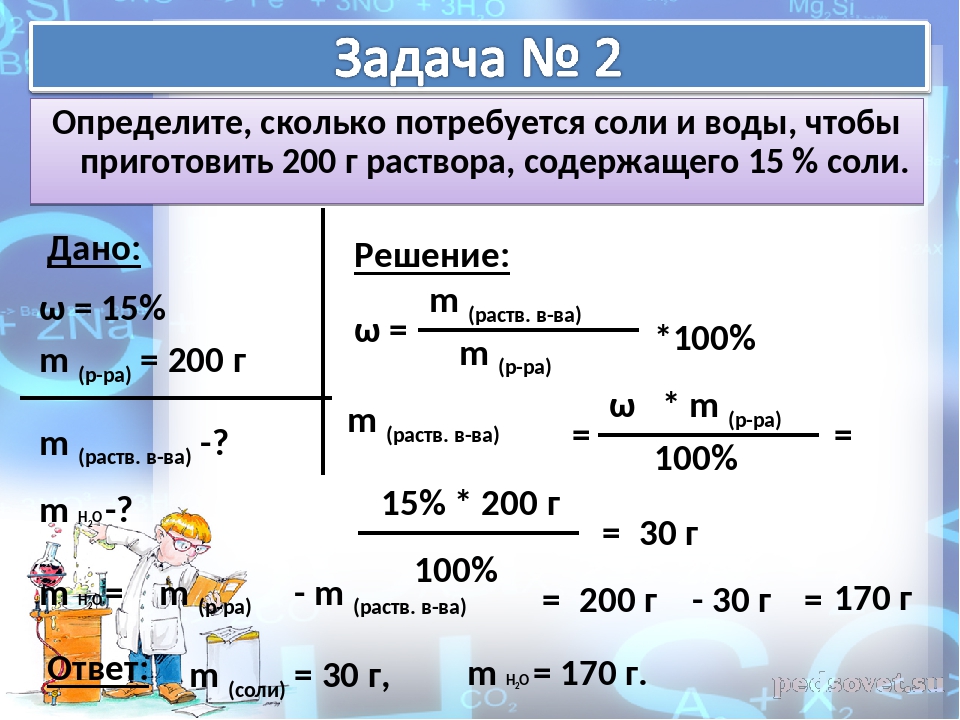 Когда газ попадает в баллон, он вытесняет воду и остается в верхней части.
Когда газ попадает в баллон, он вытесняет воду и остается в верхней части.
Объем газа можно наблюдать с помощью калиброванной шкалы на баллоне, но как насчет его давления? Общее давление, ограничивающее газ, — это давление атмосферы, передающей свою силу через воду. (Точный расчет также должен учитывать высоту водяного столба в перевернутой трубе.) Но сама жидкая вода всегда находится в равновесии со своим паром, поэтому пространство в верхней части трубки представляет собой смесь двух газов: собираемого газа и газообразного H 2 O. Парциальное давление H 2 O известен как давление водяного пара, и оно зависит от температуры. Чтобы определить количество газа, которое мы собрали, мы должны использовать закон Дальтона, чтобы найти парциальное давление этого газа.
Пример \ (\ PageIndex {11} \)
Газообразный кислород собирали над водой, как показано выше.Атмосферное давление 754 торр, температура 22 ° C, объем газа 155 мл. {- 1} \ right) (295 \ mathrm {K})} =.00619 \ mathrm {mol} \ nonumber \]
{- 1} \ right) (295 \ mathrm {K})} =.00619 \ mathrm {mol} \ nonumber \]
Применение закона Далтона: подводное плавание с аквалангом
Наши дыхательные системы предназначены для поддержания надлежащей концентрации кислорода в крови, когда парциальное давление O 2 составляет 0,21 атм, что является нормальным значением на уровне моря. Ниже поверхности воды давление увеличивается на 1 атм на каждые 10,3 м увеличения глубины; таким образом, аквалангист с высоты 10,3 м испытывает давление на тело в сумме 2 атм. Чтобы предотвратить коллапс легких, воздух, которым дышит дайвер, должен иметь примерно такое же давление.
Рисунок Но при общем давлении 2 атм парциальное давление \ (O_2 \) в обычном воздухе будет 0,42 атм; на глубине 100 футов (около 30 м) давление \ (O_2 \) в 0,8 атм было бы слишком высоким для здоровья. По этой причине воздушная смесь в баллонах под давлением, которые носят аквалангисты, должна содержать меньшую долю \ (O_2 \). Проще всего этого добиться, увеличив содержание азота, но высокое парциальное давление N 2 также может быть опасным, приводя к состоянию, известному как азотный наркоз. Предпочтительным разбавителем для длительного глубокого погружения является гелий, который имеет очень небольшую тенденцию растворяться в крови даже при высоком давлении.
Предпочтительным разбавителем для длительного глубокого погружения является гелий, который имеет очень небольшую тенденцию растворяться в крови даже при высоком давлении.
Авторы и авторство
Массовый процент и массовая фракция Учебное пособие по химии
Массовый процент (массовый процент) Расчет концентрации
Вопрос 1. Водный раствор хлорида калия содержит 78% воды по массе.
Каков массовый процент хлорида калия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества, хлорида калия (KCl), и растворителя, воды (H 2 O).
мас.% (Вода) = 78%
мас.% (KCl) =? % - Напишите уравнение для вычисления массового процента (KCl):
мас.% (KCl) + мас.% (H 2 O) = 100
Перепишите уравнение, чтобы найти% KCl по массе:
мас.% (KCl) = 100 — мас. % (H 2 O)
% (H 2 O) - Подставляет значения в уравнение и решает:
мас.% (KCl) = 100 — 78 = 22%
Вопрос 2. Водный раствор содержит 700 г воды и 45 г гидроксида натрия.
Каков массовый процент гидроксида натрия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaOH) и растворителя (H 2 O).
масса (H 2 O) = 700 г
масса (NaOH) = 45 г
мас.% (NaOH) =? % - Напишите уравнение для нахождения% массы:
мас.% NaOH = масса (NaOH) ÷ (масса (NaOH) + масса (H 2 O) ) × 100
- Подставьте значения (все массы должны иметь одинаковые единицы измерения) в уравнение и решите:
мас.% NaOH = 45 ÷ (45 + 700) × 100 = 6.04%
Вопрос 3. Водный раствор содержит 42% этанола по массе.
Водный раствор содержит 42% этанола по массе.
Какая масса этанола содержится в 250 г раствора?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (этанол) и растворителя (вода).
мас.% Этанола = 42%
масса (раствор) = масса (этанол) + масса (вода) = 250 г
масса (этанол) =? грамм - Напишите уравнение для нахождения этанола в% по массе:
мас.% Этанола = масса (этанол) ÷ масса (раствор) × 100
Переставьте уравнение, чтобы найти массу этанола:
масса (этанол) = мас.% Этанола × масса (раствор) ÷ 100
- Подставьте значения в уравнение и решите:
масса (этанол) = 42 × 250 ÷ 100 = 105 г
1.НЕ путайте м / м с м / м
м / м относится к массовой доле
м / м относится к расчету в молях, моль = масса ÷ молярная масса
2. НЕ путайте процентную массовую (или массовую) концентрацию с процентной концентрацией массового отношения.
НЕ путайте процентную массовую (или массовую) концентрацию с процентной концентрацией массового отношения.
процентов по массе = масса (растворенного вещества) ÷ масса (раствор) × 100
массовое соотношение процентная концентрация = масса (растворенного вещества) ÷ масса (растворитель) × 100
Конспект лекций RMP
Конспект лекций RMPПеременные процесса: состав
Большинство материальных потоков в технологических установках представляют собой смеси соединений.Мы описываем состав потока по-разному.
Состав фракций
Доли композиции могут быть основаны на массе или на молях.
Вы переводите «дробь» в «процент», умножая на 100.Используемые единицы измерения массы не имеют значения, пока верхняя и внизу соотношения используются те же единицы:
ПРИМЕР: Поток содержит 20 г газообразного кислорода, 70 г азота, 5 г гелия и 5 г водорода.Найти массовую и мольную доли, масса и составы в мольных процентах.

Во-первых, вам нужно найти массу каждого компонента (заданную), общую массу (добавить их вверх). Вам также необходимо рассчитать количество молей каждого компонента (разделить масса по молекулярной массе) и общее количество молей.
Теперь у вас есть все необходимое для расчета фракций состава. Результаты дроби можно проверить, сложив их — они должны равняться 1,0. Умножьте фракции на 100, чтобы получить процентный состав.Единица концентрации, часто встречающаяся при использовании в окружающей среде, составляет частей на млн или стр / мин . Это граммы растворенного вещества в 1 миллион граммах решение. PPM (или ppb) — это особый вид массовой доли.
Часто вам дают состав в процентном или дробном виде, но
для решения проблемы вам необходимо знать массы отдельных компонентов
(если только перевести в молярный состав). Позаботьтесь об этом, приняв основа 1 кг, 100 моль и др.и работать оттуда. Ведь если
смесь состоит из 21 мольного процента кислорода, не имеет значения, если у вас есть 5
г или 30 фунтов или 200 моль — процентный или фракционный состав такой же.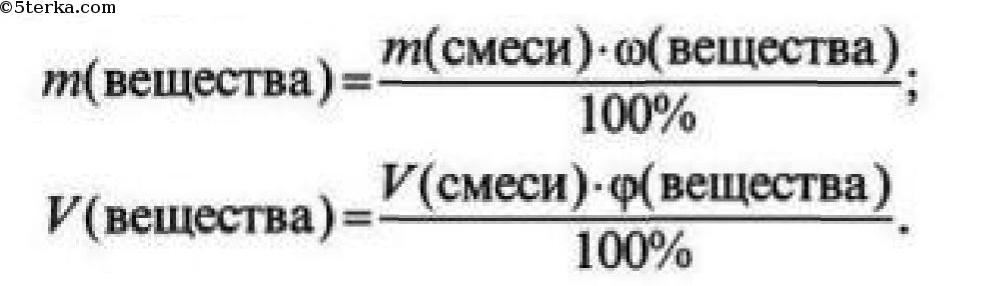
ПРИМЕР: Воздух содержит около 78 мольных процентов азота, 21 молярный процент. кислород и 1 процент аргона. Каков его массовый состав?
Вы не знаете, сколько у вас воздуха (общее количество молей или общая масса), но это не имеет значения. Поэтому выберите базовую сумму, при которой расчет легкий.Когда составы даны в процентах, за основу принимается 100 всегда хорошо, так как не требует умножения или деления. Я думаю, я буду работайте в фунтах-молях.
ОСНОВА: 100 моль воздуха ЗАПИШИТЕ!
Средний молекулярный вес смеси рассчитывается из молярный состав и молекулярная масса. Это средневзвешенное значение — молекулярные массы усредняются с использованием мольных долей в качестве веса.
ПРИМЕР: Рассчитайте средний молекулярный вес воздуха.
Предположим, что воздух состоит на 79 мол.% Азота и 21 мол.% Кислорода.
ОСНОВА: 1 гмоль воздуха.
Таким образом, после учета значащих цифр ответ будет 29 г / моль.
НЕ следует пытаться рассчитать среднюю плотность или средний удельный вес. с использованием средневзвешенного арифметического. Если вы посмотрите, что это делает, единицы не получается. Вы должны использовать взвешенное гармоническое среднее.
Концентрация
Часто используются термины «состав» и «концентрация». взаимозаменяемо.На этом этапе мы хотим прояснить разницу. Концентрация основана на объеме и является одним из способов выражения состав. Массовая концентрация — это масса компонента на единицу объема, аналогично молярная концентрация равна молей на единицу объема.
ПРИМЕР: Если я растворяю 1 г соли в 1000 л воды, что концентрация смеси?
Предположим, что объемов добавки.
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и растворенное вещество).
Чтобы упростить задачу, обратите внимание, что объем соли, вероятно, очень велик. намного меньше, чем у воды; следовательно, пренебрежем громкостью
соль. НАПИШИТЕ «Предположим, что количество соли незначительно». Если бы это была важная проблема, мы, вероятно, захотели бы вернуться и
обосновать наше предположение, посмотрев плотность соли и оценив, как
Во многом предположение изменило ответ.
намного меньше, чем у воды; следовательно, пренебрежем громкостью
соль. НАПИШИТЕ «Предположим, что количество соли незначительно». Если бы это была важная проблема, мы, вероятно, захотели бы вернуться и
обосновать наше предположение, посмотрев плотность соли и оценив, как
Во многом предположение изменило ответ.В этом примере я предполагал дополнительные объемы. Вообще говоря, если мы добавить 1 м 3 компонента A к 1 м 3 компонента B, мы не может быть гарантированно получить 2 м 3 смеси.Когда это правда, мы говорим, что «объемы прибавляются» или что «объем добавляется».
Объемы складываются только в том случае, если смесь «идеальная». Детали Идеальность будет обсуждаться в термодинамике ЧЭ, но пока мы обычно принимаем идеальных решения. Это, наверное, нормально, если все компоненты аналогичны, и если температура и давление не крайность, но необходимо заявить об идеальности.
Когда концентрация рассчитывается в гмоль / литр, она называется Молярность , сокращенно M.
ПРИМЕР: Сколько КОН содержится в 5 мл 2 М раствора?
Концентрация — это граммы растворенного вещества, деленные на объем смеси (вода и растворенное вещество).
Вы ДОЛЖНЫ иметь возможность переключаться между объемным, массовым и молярным составом и течет быстро и без борьбы. Иначе все проблемы в этом классе займет намного больше времени, чем следовало бы.
Умный инженер обычно будет работать с проблемами в массе или кроте. единиц, конвертируя при необходимости в единицы объема и обратно.Пытаюсь работать Проблемы в основном в единицах объема часто являются источником проблем.
Артикул:
- Р.М. Felder & R.W. Rousseau, Элементарные основы химии Процессы (2-е изд.), Джон Вили, 1986, стр. 50-55.
- Д.М. Химмельблау, Основные принципы и расчеты в химической Engineering (6-е изд.), Prentice Hall, 1996, стр. 16-17, 22-26.
R. M. Цена
M. Цена
Оригинал: 02.06.94
Изменен: 24.08.95, 14.08.96, 26.08.98; 24.05.2004
Авторские права 1998, 2004 Р.М. Прайс — Все права защищены.
жидкость | Химия, свойства и факты
Жидкость , в физике, одно из трех основных состояний вещества, промежуточное между газом и кристаллическим твердым телом.
Физические свойства жидкостей
Наиболее очевидными физическими свойствами жидкости являются сохранение объема и соответствие форме емкости. Когда жидкое вещество наливается в сосуд, оно принимает форму сосуда, и, пока вещество остается в жидком состоянии, оно остается внутри сосуда.Кроме того, когда жидкость переливается из одного сосуда в другой, она сохраняет свой объем (до тех пор, пока не происходит испарение или изменение температуры), но не форму. Эти свойства служат удобными критериями для отличия жидкого состояния от твердого и газообразного состояний. Например, газы расширяются, заполняя свой контейнер, так что объем, который они занимают, совпадает с объемом контейнера. Твердые вещества сохраняют свою форму и объем при перемещении из одного контейнера в другой.
Твердые вещества сохраняют свою форму и объем при перемещении из одного контейнера в другой.
Жидкости можно разделить на две основные категории: чистые жидкости и жидкие смеси.На Земле вода — самая распространенная жидкость, хотя большая часть воды, с которой вступают в контакт организмы, не в чистом виде, а представляет собой смесь, в которой растворены различные вещества. Такие смеси включают жидкости, необходимые для жизни, например кровь, напитки и морскую воду. Морская вода — это жидкая смесь, в которой растворены различные соли. Хотя в чистом виде эти соли являются твердыми веществами, в океанах они являются частью жидкой фазы. Таким образом, жидкие смеси содержат вещества, которые в чистом виде сами могут быть жидкостями, твердыми веществами или даже газами.
Жидкое состояние иногда описывают просто как состояние, которое возникает между твердым и газообразным состояниями, и для простых молекул это различие однозначно. Однако четкое различие между жидким, газообразным и твердым состояниями сохраняется только для тех веществ, молекулы которых состоят из небольшого числа атомов. Когда число превышает примерно 20, жидкость часто можно охладить ниже истинной точки плавления с образованием стекла, которое имеет многие механические свойства твердого тела, но не имеет кристаллического порядка.Если количество атомов в молекуле превышает примерно 100–200, классификация на твердые, жидкие и газовые перестает быть полезной. При низких температурах такими веществами обычно являются стекла или аморфные твердые тела, и их жесткость падает с повышением температуры, т. Е. Они не имеют фиксированных точек плавления; некоторые, однако, могут образовывать настоящие жидкости. С этими большими молекулами невозможно достичь газообразного состояния, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости.Таким образом ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и резина).
Когда число превышает примерно 20, жидкость часто можно охладить ниже истинной точки плавления с образованием стекла, которое имеет многие механические свойства твердого тела, но не имеет кристаллического порядка.Если количество атомов в молекуле превышает примерно 100–200, классификация на твердые, жидкие и газовые перестает быть полезной. При низких температурах такими веществами обычно являются стекла или аморфные твердые тела, и их жесткость падает с повышением температуры, т. Е. Они не имеют фиксированных точек плавления; некоторые, однако, могут образовывать настоящие жидкости. С этими большими молекулами невозможно достичь газообразного состояния, потому что они химически разлагаются до того, как температура станет достаточно высокой для испарения жидкости.Таким образом ведут себя синтетические и натуральные высокомолекулярные полимеры (например, нейлон и резина).
Если молекулы большие, жесткие и либо примерно плоские, либо линейные, как в холестерилацетате или p -азоксианизоле, твердое вещество может плавиться до анизотропной жидкости (т. Е. Жидкости, которая не является однородной во всех направлениях), в которой молекулы могут свободно перемещаться, но им очень трудно вращаться. Такое состояние называется жидким кристаллом, и анизотропия вызывает изменения показателя преломления (мера изменения направления света, когда он переходит из одной среды в другую) с направлением падающего света и, следовательно, приводит к необычным оптическим характеристикам. эффекты.Жидкие кристаллы нашли широкое применение в устройствах измерения температуры, а также в дисплеях для часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений образуют жидкие кристаллы. Таким образом, теория нормальных жидкостей — это преимущественно теория поведения веществ, состоящих из простых молекул.
Е. Жидкости, которая не является однородной во всех направлениях), в которой молекулы могут свободно перемещаться, но им очень трудно вращаться. Такое состояние называется жидким кристаллом, и анизотропия вызывает изменения показателя преломления (мера изменения направления света, когда он переходит из одной среды в другую) с направлением падающего света и, следовательно, приводит к необычным оптическим характеристикам. эффекты.Жидкие кристаллы нашли широкое применение в устройствах измерения температуры, а также в дисплеях для часов и калькуляторов. Однако никакие неорганические соединения и только около 5 процентов известных органических соединений образуют жидкие кристаллы. Таким образом, теория нормальных жидкостей — это преимущественно теория поведения веществ, состоящих из простых молекул.
Жидкость лишена как сильного пространственного порядка твердого тела, хотя она имеет высокую плотность твердых тел, так и отсутствия порядка газа, что является следствием низкой плотности газов — т. е.е. молекулы газа относительно свободны от влияния друг друга. Сочетание высокой плотности и частичного порядка в жидкостях привело к трудностям в разработке количественно приемлемых теорий жидкостей. Понимание жидкого состояния, как и всех состояний материи, пришло с кинетической молекулярной теорией, которая утверждала, что материя состоит из частиц, находящихся в постоянном движении, и что это движение является проявлением тепловой энергии. Чем больше тепловая энергия частицы, тем быстрее она движется.
е.е. молекулы газа относительно свободны от влияния друг друга. Сочетание высокой плотности и частичного порядка в жидкостях привело к трудностям в разработке количественно приемлемых теорий жидкостей. Понимание жидкого состояния, как и всех состояний материи, пришло с кинетической молекулярной теорией, которая утверждала, что материя состоит из частиц, находящихся в постоянном движении, и что это движение является проявлением тепловой энергии. Чем больше тепловая энергия частицы, тем быстрее она движется.
Переходы между состояниями материи
В очень общем виде частицы, составляющие материю, включают молекулы, атомы, ионы и электроны. В газе эти частицы расположены достаточно далеко друг от друга и движутся достаточно быстро, чтобы избежать влияния друг друга, которое может быть различного типа — например, притяжения или отталкивания из-за электрических зарядов и особых сил притяжения, которые связаны с электронами, вращающимися вокруг атома. ядра. Движение частиц происходит по прямой линии, и возникающие в результате столкновения происходят без потери энергии, хотя между сталкивающимися частицами может происходить обмен энергиями. Когда газ охлаждается, его частицы движутся медленнее, а те, которые достаточно медленны, чтобы задерживаться рядом друг с другом, сливаются, потому что сила притяжения преодолевает их пониженную кинетическую энергию и, по определению, тепловую энергию. Каждая частица, когда она соединяется с другими в жидком состоянии, отдает определенное количество тепла, называемое скрытой теплотой сжижения, но каждая продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, на которые частицы могут перемещаться в жидкости без столкновения, порядка диаметров молекул.По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создаст такую высокую плотность, что жидкость замерзнет в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, а их скрытая теплота плавления высвобождается в процессе замерзания. Нагревание твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы позволить им избежать влияния друг друга, достаточного для перемещения в жидком состоянии.
Когда газ охлаждается, его частицы движутся медленнее, а те, которые достаточно медленны, чтобы задерживаться рядом друг с другом, сливаются, потому что сила притяжения преодолевает их пониженную кинетическую энергию и, по определению, тепловую энергию. Каждая частица, когда она соединяется с другими в жидком состоянии, отдает определенное количество тепла, называемое скрытой теплотой сжижения, но каждая продолжает двигаться с той же скоростью внутри жидкости, пока температура остается на уровне точки конденсации. Расстояния, на которые частицы могут перемещаться в жидкости без столкновения, порядка диаметров молекул.По мере охлаждения жидкости частицы движутся еще медленнее, пока при температуре замерзания энергия притяжения не создаст такую высокую плотность, что жидкость замерзнет в твердом состоянии. Однако они продолжают вибрировать с той же скоростью, пока температура остается на уровне точки замерзания, а их скрытая теплота плавления высвобождается в процессе замерзания. Нагревание твердого тела обеспечивает частицы теплотой плавления, необходимой для того, чтобы позволить им избежать влияния друг друга, достаточного для перемещения в жидком состоянии. Дальнейшее нагревание обеспечивает жидкие частицы теплотой испарения, которая позволяет им полностью покинуть друг друга и перейти в парообразное или газообразное состояние.
Дальнейшее нагревание обеспечивает жидкие частицы теплотой испарения, которая позволяет им полностью покинуть друг друга и перейти в парообразное или газообразное состояние.
Этот резко упрощенный взгляд на состояния материи игнорирует многие усложняющие факторы, наиболее важным из которых является тот факт, что никакие две частицы не должны двигаться с одинаковой скоростью в газе, жидкости или твердом теле, и связанный с этим факт, что даже в твердом теле некоторые частицы не должны двигаться с одинаковой скоростью. частицы могли получить энергию, необходимую для существования в виде частиц газа, в то время как даже в газе некоторые частицы могут быть практически неподвижными в течение короткого времени.Следует учитывать среднюю кинетическую энергию частиц, а также тот факт, что движение является случайным. На границе раздела между жидкостью и газом и между жидкостью и твердым телом всегда происходит обмен частицами: медленные молекулы газа конденсируются на поверхности жидкости, а быстрые молекулы жидкости уходят в газ.

 Мольные доли могут быть получены из различных концентраций, включая составы молярности, молярности и массовых процентов.
Мольные доли могут быть получены из различных концентраций, включая составы молярности, молярности и массовых процентов.

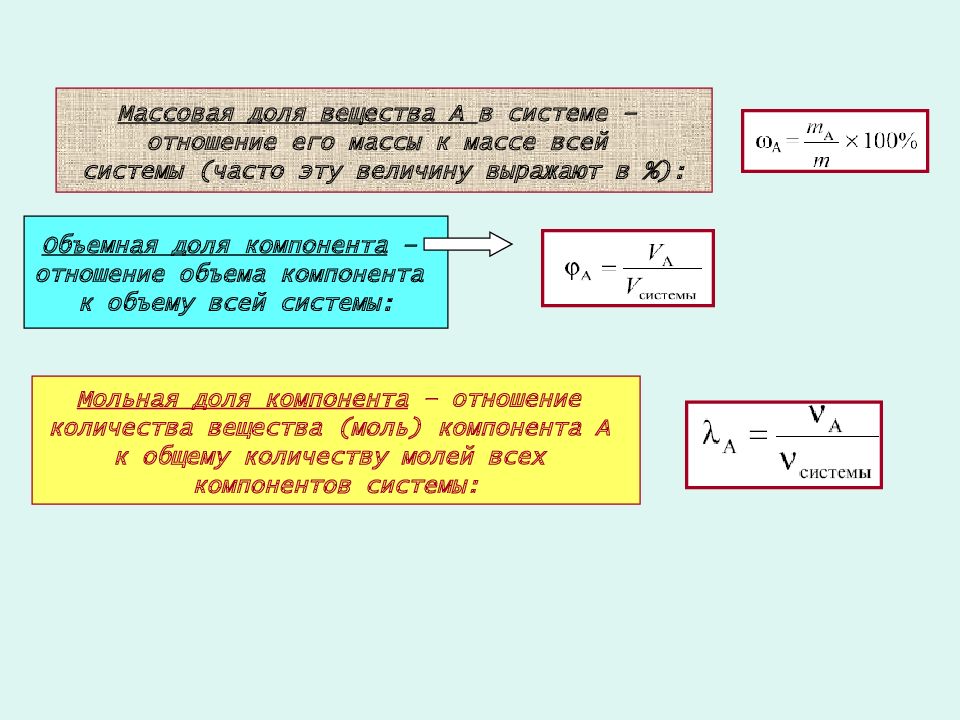 % (H 2 O)
% (H 2 O)