Лабораторная работа 1 Тема- Скорость химической реакции Опыт 1
Работа добавлена на сайт samzan.ru: 2016-03-30Лабораторная работа №1
Тема: Скорость химической реакции
Опыт 1. Зависимость скорости реакции от концентрации химических веществ.
Цель работы: На основании реакции взаимодействия Na2SO4 с h3SO4 исследовать влияние концентрации реагирующих веществ на скорость химической реакции.
Na2S2O3 + h3SO4 = Na2SO4 + S↓ + SO2↑ + h3O
Реактивы и материалы: раствор тиосульфата натрия, вода, раствор серной кислоты.
Оборудование: три сухих колбы, секундомер.
Ход работы:
Приготовили три сухих пронумерованных колбы. В первую внесли 5 мл раствора тиосульфата натрия и 10 мл; во вторую 10 мл тиосульфата натрия и 5 мл воды; в третью 15 мл тиосульфата натрия.
Затем в колбу №1 вносили 5 мл 4 % — ного раствора серной килосты, одновременно включали секундомер: встряхивая колбу, следили за появлением мути в колбе, держа ее на уровне глаз.
Результаты опытов занесли в таблицу 1.
Таблица №1.
№ пробирки | Количество раствора Na2S2O3 (мл) | Количество h3O (мл) | Количество раствора h3SO4 (мл) | Время реакции t, c | Относительная скорость реакции V = 1/r c-1 |
1 | 5 | 10 | 5 | 160 | 0,00625 |
2 | 10 | 5 | 5 | 130 | 0,00769 |
3 | 15 | — | 5 | 20 | 0,05000 |
По полученным данным построим график 1 зависимости скорости реакции от повышения концентрации раствора Na2S2O3 (мл).
График 1
Вывод:
С увеличением концентрации раствора Na2S2O3 и уменьшением h3O относительная скорость реакции возрастает.
Опыт 2. Зависимость скорости реакции от температуры
Цель работы: Найти зависимость скорости реакции смеси растворов от температуры.
Реактивы и материалы: раствор тиосульфата натрия, раствор серной кислоты.
Оборудование: две большие пробирки, мерная колба, водяная баня, термометр, секундомер.
Ход работы:
Зависимость скорости реакции от температуры можно наблюдать на той же системе
Na2S2O3+h3SO4=Na2SO4+S|+So2|+h3O
Для опыта были взяты две большие пробирки. В одну из них мы налили 10 мл раствора тиосульфата натрия, в другую 10 мл 4% — ного раствора серной кислоты.
Записали комнатную температуру. Слили содержимое пробирок в колбу, одновременно включив секундомер и остановив его при появлении слабой, едва заметной мути.
Повторили опыт дважды с тем же количеством тиосульфата натрия и серной кислоты, предварительно нагрев пробирку с раствором на водяной бане до температуры на 10 и 20 С выше комнатной. За температурой следили по термометру, опущенному в пробирку с раствором соли.
Результаты опытов записаны в таблице №2.
По полученным данным построен график 2 зависимости скорости реакции от температуры.
Таблица №2.
№ п/п | Темпе-ратура опыта t, С | Кол-во раст-ра Na2S2O3 (мл) | Кол-во раст-ра h3SO4 (мл) | Время помутнения раствора t, с | Относитель-ная скорость реакции ϑ = 1/t, с-1 | Температурный коэф-фициент ɤ |
1 | 17 | 10 | 10 | 33 | 0,030 | 0,848 |
2 | 27 | 10 | 10 | 28 | 0,035 | 0,678 |
3 | 37 | 10 | 10 | 19 | 0,052 | 0,763 |
График 2
Вывод:
С увеличением температуры, скорость реакции увеличивается.
Опыт 3. Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
Цель работы: Найти зависимость скорости реакции в гетерогенной системе под влиянием поверхности раздела реагирующих веществ.
Реактивы и материалы: мел, соляная кислота.
Оборудование: фильтровальная бумага, две пробирки, секундомер.
Ход работы:
Взяли два небольших одинаковых кусочка мела, приблизительно по 0,5 г. Один из них положили на кусочек фильтрованной бумаги и измельчили в порошок. В две пробирки налили по 5 мл разбавленной соляной кислоты и внесли в них одновременно навески мела: кусочек в одну пробирку, порошок в другую. Отметили время, которое потребовалось для полного растворения мела (t = , c).
Результат: В пробирке, куда положили не измельченный кусочек, реакция протекала гораздо медленнее чем в другой, куда поместили размельченный порошок. В первом случае соляной кислоте потребовалось больше времени, чтобы пропитать весь мел.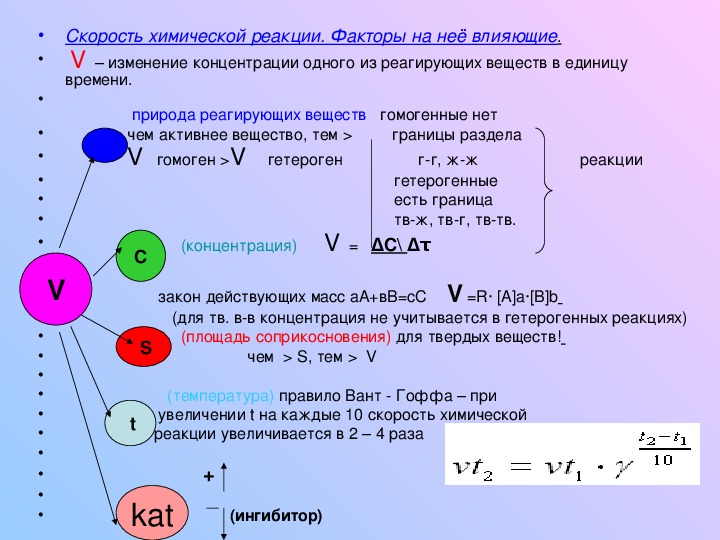
Уравнение реакции: Мел — CaCO3 и Соляная кислота — HCl
CaCO3 + 2HCl → CaCl2 + h3O + CO2↑
Вывод:
Реакция в гетерогенной системе происходит тем быстрее, чем больше площадь соприкосновения реагирующих веществ.
Опыт 4. Влияние степени смешения реагирующих веществ на скорость гетерогенной химической реакции
Цель работы: Определить уровень влияния степени смешения реагирующих веществ на скорость гетерогенной химической реакции.
Реактивы и материалы: нитрат свинца(II), иодид калия.
Оборудование: пестик, ступка, пипетка.
Ход работы:
В сухой ступке осторожно смешали, не растирая пестиком, несколько кристалликов нитрата свинца (II) и иодида калия. Окрас смеси не изменился. Затем энергично растерли кристаллы пестиком. Наблюдали изменение окраса на желтоватый оттенок. Добавили пипеткой к смеси несколько капель воды и еще раз растерли, смесь моментально окрасилась в ярко желтый цвет.
Наблюдали изменение окраса на желтоватый оттенок. Добавили пипеткой к смеси несколько капель воды и еще раз растерли, смесь моментально окрасилась в ярко желтый цвет.
Объяснение проведенному опыту в целом: На начало опыта в сухом и неизмельченном виде вещества плохо взаимодействовали, так как имели малую поверхность соприкосновения. Как только их начали толочь в одной ступке, реакция пошла немного лучше. После того, как добавили воду, растворенные вещества взаимодействовали полностью, в результате произошла полная реакция с образованием вещества с ярко-желтым цветом.
Уравнение реакции: Нитрат свинца — Pb(NO3)2 и йодид калия — 2KI.
Pb(NO3)2 + 2KI= PbI2 + 2 KNO3
Вывод:
Скорость гетерогенной реакции возрастает с увеличением степени смешения веществ. Реакция без промежуточного растворителя происходит плохо, только между контактирующими друг с другом молекулами веществ.
Исследование зависимости скорости химической реакции от условий ее проведения
⇐ ПредыдущаяСтр 4 из 11Следующая ⇒Будем экспериментально проводить реакцию, суммарно описываемую уравнением
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S¯ + H2O (1)
В конце реакции мы наблюдаем появление белой мути за счет выпадения серы в осадок. Это позволяет относительно четко фиксировать время протекания реакции, а значит определять ее условную скорость. Меняя внешние воздействия, будем наблюдать, как меняется скорость. Количественные результаты измерений используем для определения параметров математических уравнений, отражающих зависимость скорости от концентрации и от температуры.
Это позволяет относительно четко фиксировать время протекания реакции, а значит определять ее условную скорость. Меняя внешние воздействия, будем наблюдать, как меняется скорость. Количественные результаты измерений используем для определения параметров математических уравнений, отражающих зависимость скорости от концентрации и от температуры.
Опыт 1. Зависимость скорости разложения тиосульфата натрия от его концентрации.
Задание:найти константу скорости реакции (1).
Приборы и посуда: бюретки, пробирки, мерный цилиндр, секундомер.
Реактивы: растворы тиосульфата натрия, серной кислоты, дистиллированная вода.
Общее описание работы. В соответствии с законом действия масс скорость реакции прямо пропорциональна концентрации реагирующего вещества. В нашей реакции (1) участвуют два вещества.
V = k [Na2S2O3] (2)
Наша задача опытным путем найти константу скорости k. Из уравнения (2) видим, что k можно определить, измерив скорость V для какой-то концентрации [Na2S2O3]. Это уже даст искомую величину k = V/[Na2S2O3]. Но это будет результат, полученный лишь из одного измерения. А вдруг он ошибочен? C целью получения достаточно точного значения k проведем измерения при пяти различных концентрациях и результаты усредним. Тогда мы сможем подставлять полученное достоверное значение k в уравнение (2) и находить V при любых иных разумных [Na2S2O3].
Ход работы.
Пробный опыт. Сначала прорепетируем наше исследование. Надо научиться фиксировать время окончания реакции по появлению мути (за счет выпадения серы) в процессе протекания реакции (1).
Проделаем следующие манипуляции.
В одну пробирку из бюретки наливаем 5 мл раствора Na2S2O3 с концентрацией 0,1 моль/л, в другую пробирку — 5 мл раствора 0,1 М серной кислоты.
Выливаем содержимое первой пробирки во вторую, встряхиваем смесь и определяем по секундомеру или часам с секундной стрелкой время от сливания до появления мути. Для этого очень внимательно следим за столкновениями молекул в пробирке, пока не появится сера. Удобно рассматривать пробирку на темном фоне пиджака соседа или свитера соседки. Появление мути фиксируем возгласом «Вау..» и остановкой секундомера, который был запущен на старте реакции. Отмечаем это время как предварительное, записав его вне таблицы. Стремимся фиксировать именно начало помутнения, так как все остальные моменты будут плохо воспроизводимы. Причем желательно, чтобы был один и тот же наблюдатель, так как тогда будет одна и та же систематическая ошибка и меньший разброс результатов. Наблюдательницы тоже допускаются.
Отмечаем это время как предварительное, записав его вне таблицы. Стремимся фиксировать именно начало помутнения, так как все остальные моменты будут плохо воспроизводимы. Причем желательно, чтобы был один и тот же наблюдатель, так как тогда будет одна и та же систематическая ошибка и меньший разброс результатов. Наблюдательницы тоже допускаются.
Основные исследования запрограммированы в табл.8. Для проведения первого измерения (концентрация Na2S2O3 в реакционной смеси в 10 раз меньше исходной) в одну пробирку в соответствии с первой строкой таблицы8 наливаемиз бюретки 1 мл 0,1 М раствора Na2S2O3и сюда же приливаем также с помощью бюретки 4 мл Н2О. В другую пробирку наливаем 5 мл 0,1 М раствора H2SO4. Сливаем содержимое пробирок вместе, встряхиваем смесь и фиксируем в табл. 8 (которая, естественно, скопирована в вашу тетрадь) время от начала смешения до появления мути (такой, как в пробном опыте).
8 (которая, естественно, скопирована в вашу тетрадь) время от начала смешения до появления мути (такой, как в пробном опыте).
Отметим, что общий объём смеси в реакционной пробирке – 10 мл. В этом объёме: 1 мл (Na2S2O3) + 4 мл (H2O) + 5 мл (H2SO4). Исходный миллилитр раствор тиосульфата, имевший концентрацию 0,1 М, таким образом, разбавлен в 10 раз и его новая концентрация равна 0,01 моль/л. Это зафиксировано в первой строке пятой слева колонки табл.8.
Второе измерение скорости реакции проводим аналогично, сливая растворы двух пробирок в соответствии со второй строкой таблицы 8. В одной из них – 2 мл Na2S2O3 + 3 мл H2O, в другой – 5 мл H2SO4. Общий объём смеси снова 10 мл; концентрация тиосульфата натрия в «реакторе» в этом случае 0,02 моль/л. Это значение вам придется зафиксировать самостоятельно в соответствующей строке и графе таблицы 8. Остальные три измерения проводим, по-прежнему руководствуясь таблицей 8, продолжающей роль путеводителя. Экспериментальная часть заканчивается после заполнения пятой и шестой колонок таблицы 8.
Это значение вам придется зафиксировать самостоятельно в соответствующей строке и графе таблицы 8. Остальные три измерения проводим, по-прежнему руководствуясь таблицей 8, продолжающей роль путеводителя. Экспериментальная часть заканчивается после заполнения пятой и шестой колонок таблицы 8.
Таблица 8
| № п/п | Объем раствора Na2S2O3мл | Объем Н2О, мл | Объем раствора H2SO4, мл | Концентра-ция Na2S2O3 в реакцион-ной пробирке моль/литр | Время до появ-ления мути, i (с) | Условная скорость Vусл = 100/i (с–1) |
| 0,01 м/л | ||||||
Анализ результатов.
Закончена непосредственная экспериментальная часть, связанная с растворами, секундомером, бюретками, мытьем пробирок, вытиранием луж, беготней к раковине и т.д. Можно перевести дух и заняться обработкой того, что мы наизмеряли. Значения для последней колонки таблицы 8 вычисляем, руководствуясь тем обстоятельством, что скорость любого процесса обратно пропорциональна времени его протекания. (Так, скорость спортсмена, пробегающего дистанцию 100 м за 11 секунд равна 100/11 м/с). В нашем случае в последней колонке таблицы 8 произвольно выбрано в числителе число 100, чтобы получать более удобные для анализа числа. Ведь мы будем просто сравнивать скорости, не интересуясь их абсолютной величиной. А для сравнительных оценок важно только, чтобы, кроме времени, все было постоянно.
Доказательством справедливости закона действия масс служит прямо пропорциональная зависимость между скоростью реакции (V) и концентрацией тиосульфата натрия [Na2S2O3]. Найдем эту зависимость графически по экспериментальным данным.
Найдем эту зависимость графически по экспериментальным данным.
Для построения графика на миллиметровойбумаге откладываем на оси х значения концентраций тиосульфата натрия, а на оси у – соответ ствующие этим концентрациям величины условных скоростей реакции. Масштаб подбираем так, чтобы график занял всю предоставленную площадь миллиметровки. Для каждой оси координат можно делать свой масштаб, не надо его унифицировать. В этих координатах нанесем пять своих экспериментальных точек.
После нанесения на график экспериментальных точек из таблицы 8 осуществляем графическое усреднение (интерполирование) результатов. Для этого проводим прямую линию, проходящую через начало координат и усредняющую расположение экспериментальных точек. Здесь самая точная точка – начало координат, так как при нулевой концентрации никакая реакция не идет, а значит и скорость реакции равна нулю независимо от экспериментатора. Сильно выпадающее из общей зависимости или сомнительное значение можно измерить еще раз.
Сильно выпадающее из общей зависимости или сомнительное значение можно измерить еще раз.
Примерный график представлен на рис. 2. Ваш график, как отмечалось, следует сделать на миллиметровой бумаге. Обратите внимание на то, что точки на графике могут отстоять в стороне от проведенной «усредняющей» линии за счет экспериментальных погрешностей. Расположения точек (выше и ниже прямой) должны, строго говоря, компенсировать друг друга.Такой прием усреднения называется графическим аппроксимиро-ванием.
Аппроксимирующая прямая усредняет все результаты и обязательно проходит через начало координат, о чем говорилось выше.
В математике прямая, проходящая через начало координат, описывается уравнением
y = ax.
Коэффициент a = y/x в этом уравнении можно найти, используя значения координат для любой точки этой прямой. Отметим, что отношение y/x является тангенсом угла наклона описываемой прямой по отношению к оси x.
Найдём по нашему графику величину константы скорости, которая по уравнению (2) выглядит
k = Vусл/[Na2S2O3].
Это можно сделать, используя любую точку на построенной нами прямой. По возможности выбираем точку на прямой так, чтобы она лежала на пересечении жирных линий миллиметровки, что облегчает нахождение её координат. Разделив величину координаты y (Vусл) выбранной точки на величину координаты х (концентрация Na2S2O3), получаем среднее значение k для нашей реакции в наших условиях.
В случае графика на рис.2 выбрана точка А. Отношение длин отрезков АВ/ОВ дает величину k и является тангенсом угла АОВ.
Полученную величину k можно подставить в уравнение (2) и использовать для расчета скорости реакции при любой произвольной концентрации.
Отметим, что константу скорости можно было бы найти и алгебраическим путем. Из экспериментальных данных по уравнению (2) можно вычислить пять величин k и найти усредненное значение. Однако, проведенное нами графическое усреднение более корректно, поскольку учитывает разную «весомость» экспериментальных данных. При алгебраическом же усреднении всем экспериментальным данным придается одинаковая значимость, независимо от того, насколько они выпадают из общего ряда измерений.
Из экспериментальных данных по уравнению (2) можно вычислить пять величин k и найти усредненное значение. Однако, проведенное нами графическое усреднение более корректно, поскольку учитывает разную «весомость» экспериментальных данных. При алгебраическом же усреднении всем экспериментальным данным придается одинаковая значимость, независимо от того, насколько они выпадают из общего ряда измерений.
Для получения рейтинговой оценки за эту лабораторную работу предъявляем преподавателю рабочий журнал с таблицей результатов и график, из которого получена константа скорости. Готовимся к приятной беседе по вопросам для обсуждения.
Вопросы для обсуждения.
1. Что такое скорость реакции? Как она зависит от концентрации? Почему растет с ростом концентрации?
2. Какая разница между истинной и средней скоростью?
3. Что такое константа скорости реакции? Что она характеризует? От каких внешних факторов она зависит? От чего не зависит константа скорости?
4. В каких единицах выражают концентрацию при расчетах скоростей реакций? Почему?
В каких единицах выражают концентрацию при расчетах скоростей реакций? Почему?
5. Рассчитайте скорость реакции, если концентрация Na2S2O3 будет, например, 0,5 м/л.
6. Какая точка графика дает более точное значение k?
7. Как без графика найти значение k по вашим экспериментальным данным?
8. Сформулируйте закон действия масс.
Опыт 2. Зависимость скорости реакции разложения тио-сульфата натрия от температуры
Задание. Определить температурный коэффициент Вант-Гоффа для реакции, освоенной в первом опыте.
Консультационная часть. В соответствии с правилом Вант-Гоффа скорость большинства реакций при повышении температуры на каждые 10° возрастает в 2-4 раза. Это число «раз» и называется температурным коэффициентом Вант-Гоффа. Наше исследование будет заключаться в том, что мы определим этот температурный коэффициент для реакции тиосульфата натрия с серной кислотой (ею мы занимались на предыдущей работе в первом опыте).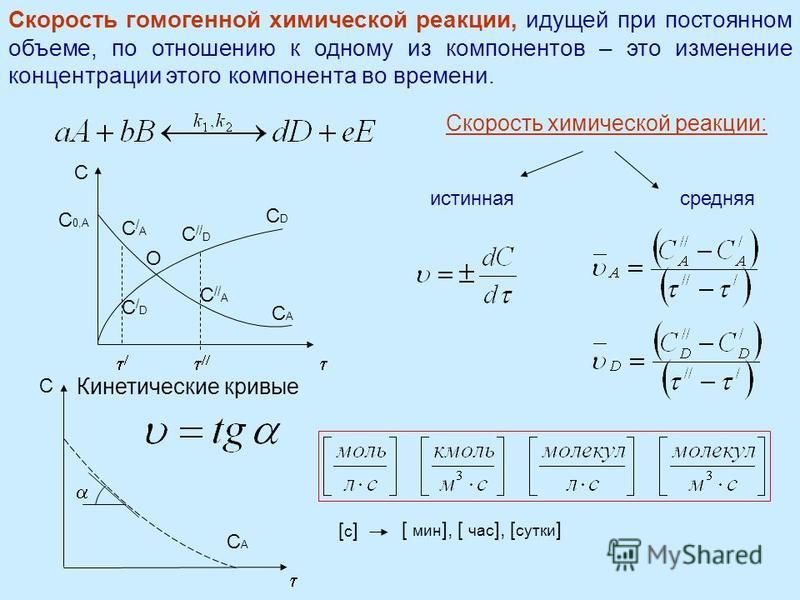
Для того, чтобы определить, во сколько раз возрастает скорость реакции при повышении температуры на 10°, надо, как минимум, измерить скорость при одной температуре, а затем при температуре, которая выше на 10°. Деление второй скорости на первую даст искомый температурный коэффициент. Чтобы получить его точнее и охватить больший температурный интервал, проведем измерения при нескольких температурах, а результаты усредним.
Приборы и посуда: бюретки, пробирки, мерный цилиндр, секундомер, электроплитка, стаканы.
Реактивы: те же, что в предыдущем опыте.
Ход работы. Первое измерение проведем при комнатной температуре так же, как мы это делали прошлый раз. Будем проводить измерения, взяв 3 мл раствора Na2S2O3 и 5 мл раствора H2SO4. Результаты измерений условной скорости реакции (см. опыт 1) запишем в первой строке таблицы 9. Комнатную температуру определяем по термометру, взятому со стола преподавателя. Пусть, например, комнатная температура 22°С. В таблице 9 эта величина приведена вместе с другими примерными значениями. Их, естественно, в рабочий журнал записывать не надо.
опыт 1) запишем в первой строке таблицы 9. Комнатную температуру определяем по термометру, взятому со стола преподавателя. Пусть, например, комнатная температура 22°С. В таблице 9 эта величина приведена вместе с другими примерными значениями. Их, естественно, в рабочий журнал записывать не надо.
Для проведения измерений при температуре на десять градусов выше (в нашем примерном случае при 32°С) две пробирки с новыми такими же порциями тех же растворов помещаем в стакан (условно назовем его стаканом-термостатом) с водой, температура которой предварительно доведена до 32о. Для этого используются еще два стакана — с водопроводной водой и с теплой водой. Теплую воду заимствуем из литрового стакана на электроплитке, так как для химических экспериментов не принято использовать кипяток из чайника.
Подливая необходимые количества теплой или холодной воды в стакан-термостат с пробирками, контролируем по термометру установку и поддержание нужной температуры.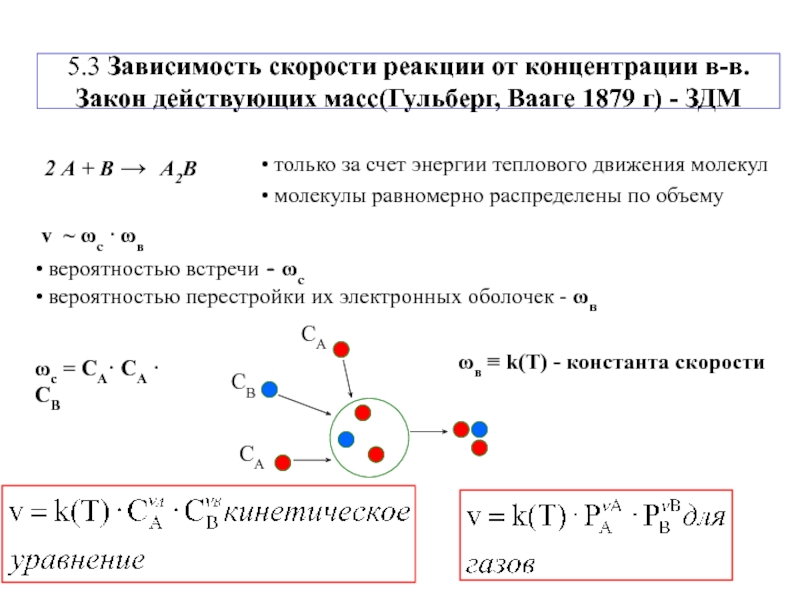 Чтобы в растворах внутри пробирок тоже установилась требуемая температура, нужно термостатировать пробирки с растворами 7–10 мин. Это очень нудная процедура, требующая терпеливого наблюдения. Ведь температура все время «ползет», и ее постоянно нужно стабилизировать. При этом надо постараться не разбить термометр, не опрокинуть термостат и вообще сильно не отвлекаться. Чем дольше идет термостатирование, тем больше уверенности в том, что растворы в пробирках имеют требуемую температуру, хочется «увильнуть на температурную свободу.
Чтобы в растворах внутри пробирок тоже установилась требуемая температура, нужно термостатировать пробирки с растворами 7–10 мин. Это очень нудная процедура, требующая терпеливого наблюдения. Ведь температура все время «ползет», и ее постоянно нужно стабилизировать. При этом надо постараться не разбить термометр, не опрокинуть термостат и вообще сильно не отвлекаться. Чем дольше идет термостатирование, тем больше уверенности в том, что растворы в пробирках имеют требуемую температуру, хочется «увильнуть на температурную свободу.
По прошествии 7-10 минут содержимое пробирок сливаем друг с другом и определяем время реакции, удерживая пробирку с реакционной смесью в стакане-термостате и продолжая поддерживать в нем необходимую температуру до тех пор, пока не выпадет осадок. Иными словами, на выпадение осадка в реакционной пробирке смотрим сквозь стенки стакана-термостата с водой. Время протекания реакции аккуратно заносим в собственную таблицу типа 9.
Аналогично проводим измерения, повысив температуру еще на 10о, а затем еще на 10о. Рассчитанные значения всех величин условных скоростей реакции опять-таки заносим в свою таблицу 9.
Таблица 9
| № п/п | t, oC | Время от начала опыта (τ, с) | Vусл = 100/τ (с-1) | Температурный коэффициент γ= Vt+10/Vt |
| 1,47 | ||||
| 3,13 | γ= 3,13/1,47 = 2,13 | |||
gсредн.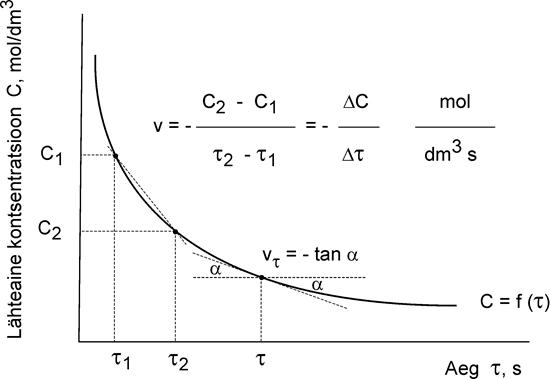 =
=
Обсуждение результатов.Используя полученные данные, убедимся, что Вант-Гофф не сильно ошибся, формулируя свое знаменитое правило. Оно лишь означает, что при повышении температуры на каждые 10о скорость реакции увеличивается в 2 – 4 раза, причем это увеличение (g раз) не зависит от диапазона температур, а является характерным для данной реакции.
По данным табл. 9 с помощью калькулятора найдем, во сколько раз возросла скорость изученной реакции при переходе от первого опыта ко второму (g = V2/V1), при переходе от второго опыта к третьему (g = V3/V2) и от третьего к четвёртому (g =V4/V3). Все три величины g должны быть приблизительно одинаковы. В случае значительного разброса надо выпадающие или сомнительные замеры повторить. Среднюю арифметическую величину температурного коэффициента предъявляем преподавателю в качестве конечного результата.
Лежит ли это значение в интервале 2 – 4, как это предсказывает правило Вант-Гоффа?
Вопросы для обсуждения результатов.
1. Почему скорость реакции так сильно зависит о температуры? Ведь скорости движения молекул газов при повышении температуры на 10о возрастают при обычных условиях лишь на 3 %, а жидкостей – еще меньше.
2 . Что такое температурный коэффициент Вант-Гоффа? В каких единицах он измеряется?
3 . Вспомните правило Вант-Гоффа. На сколько процентов ваш результат отклоняется от среднего значения коэффициента Вант-Гоффа?
4 . Попробуйте записать математическое выражение для правила Вант- Гоффа.
5 . Вычислите по вашим данным, какова будет скорость реакции при температуре, которая на 10о ниже комнатной?
6 . Что такое температура?
7 . Что вы слышали об энергии активации?
Опыт 3. Исследование зависимости скорости реакции разложения тиосульфата натрия от концентрации катализатора.
Снова изучаем реакцию (1), которую мы «терзали» в предыдущих двух опытах. Кроме концентраций реагирующих веществ и температуры, на скорость реакции существенно влияет присутствие катализатора. Разложение тиосульфата натрия катализируется ионами Cu2+. Будем изучать влияние концентрации CuSO4 на разложение тиосульфата натрия серной кислотой. Для достижения этой цели проведем измерения при трех различных концентрациях сульфата меди.
Задание. Построить график зависимости скорости реакции (1) от концентрации катализатора CuSO4.
Ход работы. Для опытов будем использовать прежние растворы (тиосульфата натрия, серной кислоты) и раствор медного купороса. Объемы растворов будем по-прежнему измерять бюретками, которые не подтекают. Температура комнатная.
План опыта виден из таблицы 10. Общий объем реакционной смеси – 10 мл. В четыре пробирки наливаем по 5 мл 0,1 М раствора H2SO4, затем последовательно в эти пробирки приливаем 0, 1, 2, 2,5 мл раствора CuSO4 и в той же последовательности — 3, 2, 1 и 0,5 мл воды для выравнивания объёмов используемых смешанных растворов, содержащих серную кислоту и катализатор. В четыре другие пробирки вливаем по 2 мл раствора Na2S2O3. Затем смешиваем попарно растворы, содержащие серную кислоту и катализатор, с растворами Na2S2O3. Фиксируем время протекания реакции для каждой пары пробирок. Результаты записываем в таблицу 10. Для этого строим ее в своем рабочем журнале, используя методичку как образец.
Очень важно не запутаться в этих указаниях. Если мы путаемся в четырех растворах, то работаем последовательно с первой строкой таблицы 10, потом со второй строкой и т.д.В одной пробирке предварительная смесь серная кислота + сульфат меди + вода, а в другой исходной пробирке — всегда тиосульфат натрия. Используемые объемы компонентов для этих четырех опытов указаны в таблице 10.
Таблица 10
| № опыта | Объём в мл | Время τ до появления мути (с) | Vусл.=100/τ | |||
| H2SO4 | CuSO4 | H2O | Na2S2O34 | |||
| 2,5 | 0,5 |
Обсуждение результатов. Примерный график полученной зависимости строим в тетрадке (не на миллиметровке) в координатах Vусл – Скат. Концентрацию катализатора выражаем в условных числах, соответствующих таблице 10. График предъявляем преподавателю. Более высокая рейтинговая оценка будет у тех студентов, кто быстрее покажет свой правильный результат.
В журнале «Химия и жизнь» была опубликована следующая история, иллюстрирующая механизм действия катализаторов. Одному биохимику была присуждена именная премия за исследования в области ферментативного катализа. Процедура вручения премии предусматривала общественную лекцию лауреата о проделанной работе. Чтобы пояснить некомпетентным слушателям существо исследований, лауреат в начале лекции рассказал индийскую притчу. Старый индиец, умирая, наказал трем сыновьям разделить завещанное имущество следующим образом: старшему сыну – половину, среднему сыну – третью часть, младшему – девятую часть имущества. Остальное – на благотворительные цели. Сыновья все разделили, как завещал отец, но не сумели разделить 17 верблюдов. Это количество не делится ни на 2, ни на 3, ни на 9. Старший сын предложил продать верблюдов, а деньги разделить. Младший сын возразил: это нарушит волю нашего любимого отца. Во время препирательств братьев мимо проезжал на верблюде дервиш. Удовлетворяя его любопытство, братья рассказали сущность проблемы. Дервиш попросил привести 17 верблюдов. Затем слез со своего верблюда и поставил его в общий ряд. После этого предложил старшему сыну отсчитать и отделить свою половину от 18 (9 верблюдов), затем средний сын отделил свою треть (6 верблюдов), а младший – свою девятую часть от 18 (2 верблюда). Всего, таким образом, братья и разобрали 9+6+2 = 17 верблюдов. Дервиш взгромоздился на своего верблюда и продолжил свой хадж. Его восемнадцатый верблюд послужил катализатором процесса деления наследства.
Эта история ранее была опубликована в «Занимательной математике» Перельмана, и автор справедливо указал, что строго математически воля отца все-таки была нарушена. Старший сын получил больше завещанного, а средний и младший – меньше. Отметим, что не все химические, а тем более биологические и социальные формы движения материи укладываются в простые математические рамки.
Вопросы для обсуждения:
1. Почему катализатор влияет на скорость реакции?
2. Какие виды катализа вы знаете? Какой вид катализа наблюдается в данном случае?
3. Какие катализаторы и для каких процессов вам известны?
4. Всегда ли концентрация катализатора влияет на скорость реакции?
Лабораторная работа №4
Читайте также:
Урок-практическая работа «Скорость химической реакции» | Методическая разработка по химии (11 класс) на тему:
Конкурс «Современный урок с использованием ИКТ»
Иванова Марина Васильевна
ГБОУ «Колледж архитектуры и строительства № 7»
«Скорость химических реакций»
I курс — 11 класс
урок: практическая работа, интегрированный с информатикой.
Цели и задачи: формирование активной творческой позиции, творческого научного интереса в процессе доказательства истинности теоретических законов посредством химического эксперимента и его математического обоснования и оформления средствами ИКТ.
ТСО: локальная компьютерная сеть кабинета информатики, программа Microsoft Excel.
Обоснование: 1. данная практическая работа совмещает качественный и количественный методы в химии; 2. Студенты (учащиеся 11 класса) уже овладели на уроках информатики программой Microsoft Excel; 3. так почему же не доказать возможности этой программы для количественного оформления химических экспериментов и наоборот?
Урок — практическая работа: «Скорость химической реакции», 11 класс.
Тип урока: интегрированный урок: практическая работа с использованием ИВТ.
Цели урока: Образовательная:
провести контроль теоретических знаний по теме «Скорость химических реакций» и практических умений и навыков осуществления химического эксперимента;
закрепить теоретические знания в процессе проведения и анализа результатов химического эксперимента;
используя возможности компьютерной программы Microsoft Excel, построить регрессионную модель по экспериментальным данным для наблюдения зависимости скорости химической реакции от концентрации реагирующих веществ.
Воспитательная:
воспитание чувства ответственности, стремления повысить успеваемость, аккуратности, настойчивости, критического отношения к информации.
Развивающая:
развитие навыков и умений самостоятельной работы с веществами и оборудованием;
формирование элементов научной деятельности, пытливости ума, научного мировоззрения;
развитие умений работы с ИВТ для оформления информации, анализа экспериментальных данных;
повышение интереса к процессу получения и закрепления знаний.
Оборудование: вещества и оборудование на каждую парту согласно технологической карте, для заключительной части урока – компьютеры (кабинет ИВТ).
Ход урока.
1. Организационный момент.
Учитель: приветствует учащихся, определяет готовность к уроку.
Учащиеся: приветствуют учителя, проверяют рабочие места.
2. Актуализация знаний.
Фронтальная беседа по теме «Скорость химической реакции». Зависимость скорости реакции от различных факторов (температуры, давления, концентрации, катализаторов, ингибиторов).
Учащиеся отвечают, записывают на доске формулы.
Учитель оценивает ответы.
Формулирование темы и цели практической работы, определение приёмов техники безопасности;
Работа с инструкцией – дидактической картой, проверка степени подготовленности учащихся к проведению эксперимента.
Составление плана работы.
План практической работы:
I ЧАСТЬ: химический эксперимент в кабинете химии, проведение опыта, фиксация качественных изменений во времени, заполнение дидактической карты – 20 мин.
II ЧАСТЬ: оформление результатов работы средствами программы Microsoft Excel: построение графической модели по полученным табличным данным – 15 мин.
III ЧАСТЬ: рифлексия: анализ работы, формулирование выводов о зависимости скорости реакции от концентрации и других факторов, работа с тестом – 10 мин.
Практическая работа.
1. Учащиеся выполняют работу попарно, фиксируют полученные данные в таблице и записывают свои наблюдения в дидактическую карту урока.
Учитель следит за последовательностью работы, соблюдением правил техники безопасности, умениями и навыками экспериментальной работы учащихся, делает отметки в своём журнале.
2. По мере завершения экспериментальной части работы учащиеся приводят в порядок свои рабочие места, сдают их лаборанту или дежурному и следуют в кабинет информатики.
3. В кабинете информатики работают с компьютером, создают графики и диаграммы, сохраняют на диске со своим номером карточки в качестве имени файла.
4. делают выводы, заносят их в свою дидактическую карту, сдают работу учителю.
Заключение, рефлексия.
Выполнение III части приведенного выше плана работы.
Дидактическая карточка к проведению практической работы.
А. 1этап. Как известно скорость реакции зависит от нескольких факторов.
Убедимся в этом на опыте, для этого проведём опыт, предложенный в практической работе «Скорость химической реакции» по учебнику химии О.С. Габриеляна для 11 кл.
1. Проведите опыты, согласно инструкции и заполните таблицу 1:
№ опыта | Схема опыта | Время протекания реакции, секунды | Изменения в пробирке, их последовательность |
1. | 0,2 % р-р KI + h3O2 | ||
2. | 0,4 % р-р KI + h3O2 | ||
3. | 0,8 % р-р KI + h3O2 | ||
4. | 0,4 % р-р KI + h3O2 + CuSO4 | ||
5. | 0,4 % р-р KI + h3O2, нагретый до 10С0 |
2. Проведем опыт взаимодействия кислоты с металлами: А) порошкообразное железо + 5 % р-р соляной кислоты.
Б) железо в стружках + 5 % р-р соляной кислоты.
Сравните скорости реакции визуально.
В) Проведите аналогичный опыт с гранулой цинка. Сравните опыт под (Б) с данным. Сделайте вывод: от чего зависит скорость реакции в этих случаях?
3. В одну пробирку налейте 2 мл раствора крахмала, а в другую столько же желудочного сока. Осторожно нагрейте пробирку с желудочным соком в водяной бане до 37 – 40 Со. Растворы двух пробирок смешайте. Что наблюдаете? Сделайте вывод об избирательном действии ферментов.
II этап. Цель: использование программы Microsoft Excel для построения графика и диаграммы по экспериментальным данным.
Построить таблицу, используя данные лабораторной работы, вычислить скорость реакций № 1,2,3 (см выше таблицу 1).
Вычисление скорости реакции.
время | концентрация | скорость |
t | С, моль/л | V |
Занесите в Excel данные первых двух столбцов, введите формулу скорости реакции, вычислите, используя Excel.
Для построения диаграммы используем параметры: концентрация и скорость.
Сохраните свой файл под именем номера вашей карточки и отправьте на данный вам диск.
III этап. Продумайте, сформулируйте и запишите на карте выводы работы.
Сдайте карту учителю на проверку.
Спасибо за грамотную и аккуратную работу.
Обработка данных химического эксперимента с помощью Excel.
|
|
|
|
|
|
|
№ опыта | время,с | конц. | скорость |
|
|
|
1 | 20 | 0,2 | 0,01 |
|
|
|
2 | 15 | 0,4 | 0,026667 |
|
|
|
3 | 10 | 0,8 | 0,08 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Зависимость скорости химических реакций от концентрации веществ
Петербургский
Государственный Университет путей
сообщения
Вариант
№7
Выполнил: студент 1 курса
Баладжаев Руслан Бахтиярович,
специальность «Системы обеспечения
движения поездов» (АС)
Учебный
шифр: 11-Аск-217
Санкт – Петербург 2011 г.
Скорость химических реакций и химическое равновесие
Опыт
1. Зависимость скорости
химических реакций
от концентрации
Явление опалесценции является аналитическим сигналом регистрирующим окончание реакции.
Рассмотрим
данный опыт на примере реакции между
раствором тиосульфата натрия и серной
кислотой, в результате которой выпадающая
сера даёт опалесценцию.
Na2S2O3 +h3SO4=h3SO3
+ Na2SO4 + S
Приготовим три раствора тиосульфата натрия (Na2S2O3) разной концентрации.
В три пробирки внесём соответственно следующее количество капель раствора Na2S2O3: в первую – 4; во вторую- 8; в третью – 12.
Затем в первую и во вторую пробирку добавляем 8 и 4 капель воды соответственно и перемешаем.
В каждый раствор добавим по две капли 2Н раствора Н2SО4.
После добавления последней капли включаем секундомер, и наблюдаем появление опалесценции (выпадение светло-желтого осадка).
При появлении опалесценции включаем секундомер.
Результаты
измерений запишем в таблице.
| № п/п | Кол-во
капель исх.раст-ра Na2S2O3 | Кол-во капель Воды | Количество капель полученного раствора Na2S2O3 | Соотношение концентраций | Время появления опалесценции | Скорость реакции | Соотношение скоростей |
| 1 | 4 | 8 | 12 | 1 | 30 | 1/30 | 1 |
| 2 | 8 | 4 | 12 | 2 | 15 | 1/15 | 2 |
| 3 | 12 | 0 | 12 | 3 | 10 | 1/10 | 3 |
Скорость реакции зависит от концентрации реагента по закону действующих масс:
V=k*C (Na2S2O3)
Порядок
реакции по реагенту
Na2S2O3 равен 1 (показатель
степени в уравнении
скорости химической
реакции)
Опыт 1. Зависимость скорости гомогенных реакций от концентрации — Студопедия
ЛАБОРАТОРНАЯ РАБОТА № 9
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Реактивы: 2,5 %-ный раствор , 5 %-ный раствор , мел(СаСОз), 0,1 М раствор , дистиллированная вода.
Оборудование: штатив с пробирками, мерные пипетки (2 мл), резиновые груши, стеклянные палочки, секундомер, плитки и стаканы с водой (водяная баня), термометры, ступка с пестиком.
В этой работе изучаются скорости гомогенных и гетерогенных реакций, влияние на скорость гомогенной реакции концентрации и температуры.
Опыт 1. Зависимость скорости гомогенных реакций от концентрации.
Классическим примером гомогенной реакции является взаимодействие между растворами тиосульфата натрия и серной кислоты, протекающей по уравнению:
Получающаяся сера в первый момент образует с водой коллоидный раствор, напоминающий по внешнему виду очень разбавленный мыльный раствор (едва заметное помутнение).
Возьмите 8 чистых пробирок. В первые четыре пробирки (№ 1, 2, 3, 4) налейте пипеткой по 2 мл 2,5%-ного раствора серной кислоты, а в четыре других (№ 1а, 2а, 3а, 4а) — 5%-ный раствор тиосульфата натрия и воду в следующих пропорциях:
| № пробирки | Объем раствора , мл | Объем воды , мл |
| 1а | ||
| 2а | ||
| 3а | ||
| 4а |
Объёмы растворов отмеряйте возможно точнее. Слейте их попарно (к раствору тиосульфата натрия приливайте раствор серной кислоты).
Перемешайте содержимое пробирок. Заметьте но секундомеру, через какой промежуток времени появляется муть. Результаты запишите следующим образом:
| № опыта | Объем раствора , мл | Объем раствора , мл | Объем воды, мл | Общий объем, мл | Относительная концентрация , М | Время, с | Скорость реакции |
Зная время протекания реакции (t), можно сделать вывод об изменении скорости реакции в зависимости от концентрации веществ, т.к. по определению, скорость реакции является величиной, обратной времени .
Постройте график зависимости скорости реакции (ось ординат) от концентрации (ось абсцисс).
Экспериментальная часть Лабораторная работа 5.1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Цель работы: изучение скорости взаимодействия тиосульфата натрия с серной кислотой.
Реактивы: раствор серной кислоты H2SO4 концентрации 0,1 моль/л, раствор тиосульфата натрия Na2S2O3 концентрации 0,1 моль/л.
Оборудование: пробирки, колбы вместимостью 50 мл, бюретки вместимостью 25 мл, секундомер, пипетки вместимостью 10 мл, стаканы вместимостью 50–100 мл, стеклянные палочки.
Методика работы
Зависимость скорости реакции от концентрации можно исследовать на примере реакции разложения тиосерной кислоты. При сливании растворов тиосульфата натрия и серной кислоты получают тиосерную кислоту по схеме
Na2S2O3 + H2SO4 H2S2O3 + Na2SO4.
Так как реакция идет между противоположно заряженными ионами, то скорость ее очень велика и время, необходимое для нее в первом приближении, не учитывается.
Полученная кислота распадается:
H2S2O3 H2O + SO2+ S.
При этом появляется желтоватая муть, которая состоит из коллоидной серы. Время, прошедшее от момента сливания растворов до появления мути, пропорционально скорости химической реакции и зависит от концентрации реагирующих веществ и температуры.
В три пробирки наливают из бюретки по 5 мл раствор раствора серной кислоты H2SO4 концентрации 0,1 моль/л. В три колбы помещают раствор тиосульфата натрия Na2S2O3 концентрации 0,1 моль/л и воду в объемах, указанных в табл. 5.1.
Затем в каждую колбу приливают и быстро перемешивают раствор серной кислоты из пробирки. По секундомеру отмечают промежуток времени между моментом сливания растворов и образованием желтоватой мути.
Результаты опытов вносят в табл. 5.1.
Таблица 5.1
Результаты опытов
Колба | Объем, мл | Концентрация Na2S2O3 С, моль/л | Температура t, ºC | Время , с | Скорость реакции υ, c–1 | |||
H2SO4 | Na2S2O3 | H2O | Общий | |||||
1 2 3 | 5,0 5,0 5,0 | 5,0 10,0 15,0 | 10,0 5,0 — | 20,0 20,0 20,0 | 1 2 3 | |||
Вычисляют относительную скорость протекающей химической реакции по формуле υ = 1/, где – время от момента сливания до появления мути, с.
По полученным данным строят график зависимости υ = f (С), приняв за единицу скорость и концентрацию Na2S2O3 в первой колбе. График удобно строить на миллиметровой бумаге; на оси абсцисс отложить концентрацию, на оси ординат – скорость реакции.
Делают вывод о влиянии концентрации на скорость химической реакции.
Лабораторная работа 5.2. Зависимость скорости реакции от температуры
Цель работы: изучить влияние температуры на скорость химической реакции.
Реактивы: раствор серной кислоты H2SO4 концентрации 0,1 моль/л, раствор тиосульфата натрия Na2S2O3 концентрации 0,1 моль/л.
Оборудование: пробирки, стакан вместимостью 100 мл, бюретки вместимостью 25 мл, секундомер, электрическая плитка, водяная баня, термометр.
Методика работы
В три пробирки наливают из бюретки по 5 мл раствора серной кислоты H2SO4 концентрации 0,1 моль/л, а в другие три – по 5 мл раствора тиосульфата натрия Na2S2O3 концентрации 0,1 моль/л. Сгруппируйте пробирки в три пары (кислота – тиосульфат).
Поместите первую пару пробирок и термометр в стакан с водой комнатной температуры и через 3-5 мин, когда температура в пробирках выровняется, запишите показания термометра.
Слейте содержимое пробирок в одну пробирку и встряхните ее несколько раз. Запишите время от начала реакции до появления слабой опалесценции.
Вторую пару пробирок поместите в стакан с водой и нагрейте воду до температуры на 10о выше той, при которой находилась первая пара пробирок, затем проделайте тот же самый опыт.
Точно так же поступите с третьей парой пробирок, повысив температуру воды еще на 10о.
Извлечение пробирок из стаканов, сливание растворов и их перемешивание проводят как можно быстрее, чтобы они не успели остыть. Определяют относительную скорость реакции.
Результаты опытов заносят в табл. 5.2, считая концентрацию постоянной, а скорость в первом опыте (табл. 5.2) – равной 1.
Таблица 5.2
Результаты опытов и расчетов
Опыт | Время до появления мути , с | Температура t, оС | Скорость реакции υ, c–1 |
1 2 3 | 20 40 60 |
Вычисляют скорость протекающей химической реакции по формуле υ = 1/, где – время от момента сливания до появления мути, с.
По полученным данным строят график зависимости υ = f(t), откладывая на оси абсцисс значение температур, а на оси ординат – скорость.
Делают вывод о влиянии температуры на скорость химической реакции.
Зависимость скорости реакции от концентрации реагента
Один из подходов кинетики заключается в описании зависимости скорости реакции от концентрации реагентов. Например, скорость фиксации фосфата зависит, по крайней мере, частично от количества добавленных удобрений, а скорость денитрификации (превращение почвенного азота, обычно нитрата в N2 и N2O) зависит от концентрации нитратов в почвенном растворе. Кинетика связывает скорости реакции и концентрации реагентов с помощью порядка реакции и константы скорости реакции.Скорость денитрификации (—ANO / At) предположительно связана с концентрацией нитрата в почве… [Pg.99]Зависимость скорости реакции от концентрации реагента Закон скорости … [Pg.542]
Зависимость скорости реакции от концентраций реагентов (и продуктов в некоторых случаях) может быть очень полезным для понимания механизма катализа. Некоторые из повсеместных механистических шагов проявляются в выражениях скорости, полученных эмпирическим путем. Другими словами, такие скоростные выражения, однажды установленные экспериментально, являются характерными признаками таких шагов.[Pg.28]
Химическая кинетика возникла как раздел физической химии в 1880-х годах благодаря плодотворным работам Харкорта и Эссона, демонстрирующих зависимость скорости реакции от концентраций реагентов. Немецкий ученый К. Венцель заявил, что сродство твердых материалов к растворителю обратно пропорционально времени растворения, и за 100 лет до того, как Гульдберг и Вааге (Норвегия) сформулировали закон, который позже был сформулирован как «закон действия масс, «означает, что силы реакции» пропорциональны произведению концентраций реагентов.[Стр.1]
Они изучали эту реакцию с перерывами около 30 лет, выполнив тысячи тщательных экспериментов, которые строго установили зависимость скорости реакции от концентраций реагентов. В 1895 году они описали, как скорость реакции зависит от температуры. Они обнаружили, что скорость реакции увеличивается примерно вдвое на каждые 10 ° C повышения температуры, и путем экстраполяции пришли к выводу, что при температуре -272,6 ° C никаких химических изменений не произойдет.[Стр.211]
Легко объяснима зависимость скорости реакции от концентрации. Обычно реакции происходят в результате столкновений между молекулами реагентов. Чем выше концентрация молекул, тем больше количество столкновений в единицу времени и, следовательно, тем быстрее реакция. По мере расходования реагентов их концентрации падают, столкновения происходят реже и скорость реакции снижается. Это объясняет распространенное наблюдение, что скорость реакции со временем снижается, в конечном итоге достигая нуля, когда ограничивающий реагент израсходован.[Pg.288]
В поисках лучшего подхода исследователи поняли, что воспламенение горючего материала требует инициирования экзотермических химических реакций, так что скорость выделения тепла превышает скорость потери энергии из зоны реакции воспламенения. Как только это условие будет достигнуто, скорость реакции будет продолжать расти из-за экспоненциальной зависимости скорости реакции от температуры. Основная проблема заключается в том, что критические скорости реакции определяются локальными концентрациями реагентов и локальными температурами.Этот подход, по сути, является результатом теории объемного теплового взрыва, изложенной Франком-Каменецким (F2). [Pg.9]
РИСУНОК 13.14 Характерные формы временной зависимости концентрации реагента во время реакции второго порядка. Чем больше константа скорости k, тем больше зависимость скорости от концентрации реагента. Нижние серые линии — это кривые для реакций первого порядка с такими же начальными скоростями, что и для соответствующих реакций второго порядка.Обратите внимание на то, что концентрации для реакций второго порядка падают гораздо медленнее при более длительных временах, чем концентрации для реакций первого порядка. [Pg.666]
Общие методы интерпретации данных скорости реакции для обратимых реакций. Определение математической формы выражения скорости реакции обычно представляет собой двухэтапную процедуру. Сначала определяют зависимость скорости от концентраций различных реагентов и продуктов при фиксированной температуре, а затем оценивают зависимость скорости от температуры… [Pg.131]
Еще одним фактором, влияющим на скорость химической реакции, является концентрация реагентов. Как уже отмечалось, большинство реакций происходит в растворах. Ожидается, что по мере увеличения концентрации реагентов происходит больше столкновений. Следовательно, увеличение концентраций одного или нескольких реагентов обычно приводит к увеличению скорости реакции. Зависимость скорости реакции от концентрации реагента определена экспериментально. Обычно проводится серия экспериментов, в которых концентрация одного реагента изменяется, в то время как концентрация другого реагента остается постоянной.Отметив, насколько быстро протекает реакция с различными концентрациями реагента, часто можно получить выражение, связывающее скорость реакции с концентрацией. Это выражение известно как закон скорости реакции. [Стр.143]
Хотя это соглашение сейчас широко используется, его не было в некоторых ранних кинетических исследованиях. Таким образом, нужно внимательно следить за тем, как именно определяется скорость, чтобы сообщаемые константы скорости интерпретировались и применялись правильно. В системах, представляющих интерес для атмосферы, закон скорости или выражение скорости реакции, элементарной или общей, представляет собой уравнение, выражающее зависимость скорости от концентраций реагентов.В некоторых реакциях (в основном в растворах) продукты также могут появляться в законе скорости. [Pg.131]
До этого момента мы обсуждали столкновительную дезактивацию колебательно-возбужденных ионов, образованных в результате ионизации или как продукты экзоэргических ион-молекулярных реакций с переносом частиц. Несколько иная ситуация преобладает с более крупными колебательно-возбужденными ионами, такими как те, которые образуются в качестве промежуточных продуктов в реакциях ионно-молекулярной ассоциации. Реакции, в которых образуются такие возбужденные промежуточные соединения, обычно демонстрируют зависимость скорости третьего порядка от концентраций реагентов при относительно низких давлениях.Общий механизм реакции может быть представлен как … [Pg.149]
Когда растворитель также является реагентом, его концентрация настолько велика по сравнению со степенью реакции, что она не изменяется. Так как это так, зависимость скорости от концентрации этилового спирта не может быть определена, если этиловый спирт не станет растворенным веществом в каком-либо другом растворителе. Если растворителем является другое вещество, то концентрацию спирта можно варьировать, что позволяет произвести расчет. Для реакции в этиловом спирте (этаноле) kexp = k [B] с [B] практически постоянным.Такие реакции называются реакциями псевдопервого порядка. [Pg.354]
Оцените методы. Что касается реакций с одним реагентом, наиболее примитивный и удобный метод определения скорости — это угадать, а затем скорректировать порядки реакции до получения приблизительно прямолинейного графика зависимости -rk от скорости от Ck CB. .. получается (см. таблицу 3.1). Например, если ожидается, что реакция будет второго порядка по А и первого порядка по Б, скорость будет нанесена на график в зависимости от CACB. Для первых предположений о порядке реакции имеющиеся данные можно разделить так, чтобы концентрация всех участников, кроме одного, была одинаковой в каждой группе.Тогда зависимость ставки от концентрации этого участника указывает на соответствующий порядок. Часто нет необходимости проводить оценку дальше этого этапа. [Стр.49]
Если некоторые из реагентов или продуктов присутствуют в чрезмерных количествах, то частичные изменения их концентраций в течение всей продолжительности реакции могут быть неизмеримо малыми. В таких случаях концентрации присутствующих в избытке реагентов остаются приблизительно постоянными и могут поглощаться с константой скорости fe.Измерение порядка реакции с помощью графиков концентрация-время тогда не показывает зависимости скорости от концентраций избыточных частиц, измерение дает псевдомолекулярность реакции, то есть сумму порядков по отношению к виды, которых нет в избытке. Таким образом, при определенных условиях оказывается, что ряд реакций более высокого порядка является псевдомолекулярным. Это наблюдение обеспечивает основу для метода выделения для определения порядка сложной реакции по отношению к конкретному реагенту в этом методе, очевидный общий порядок (псевдомолекулярность) реакции измеряется в условиях, в которых все реагенты, кроме интересующие присутствуют в избытке.[Pg.561]
Согласно закону действия масс, скорость химической реакции при данной температуре, выраженная как количество реагирующих на единицу объема в единицу времени, зависит только от концентраций различных веществ, влияющих на скорость (а не, например, от размера реакционного сосуда). Вещества, влияющие на скорость, обычно представляют собой один или несколько реагентов, иногда один из продуктов, а иногда и катализатор, который не появляется в сбалансированном общем химическом уравнении.Зависимость скорости от концентраций во многих случаях может быть выражена как прямая пропорциональность, в которой концентрации могут проявляться в нулевой, первой или второй степени. Степень, с которой концентрация вещества появляется в выражении скорости, называется порядком реакции по отношению к этому веществу. Ниже приведены некоторые примеры. [Pg.337]
Однако иногда эта процедура может привести к неверным выводам. Предположим, например, что один реагент присутствует в большом избытке, поэтому его концентрация существенно не меняется по мере протекания реакции, кроме того (например, если это растворитель), его концентрация может быть одинаковой в разных кинетических прогонах.Если это так, кинетическое исследование не покажет никакой зависимости скорости от концентрации этого вещества, которое, следовательно, не будет считаться вступающим в реакцию. Эта ситуация часто встречается в реакциях в растворах, где растворитель может быть реагентом. Например, в реакциях гидролиза в водном растворе молекула воды может вступать в реакцию с молекулой растворенного вещества. Если не использовать специальные процедуры, кинетические результаты не покажут участия растворителя.Однако его участие указывается, если оно входит в стехиометрическое уравнение. [Pg.386]
Зависимость скорости от концентрации
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика
Кинетика — это исследование скорости протекания химических реакций.
Четыре важных фактора влияют на скорость реакции:
1. Реагент Концентрация
Температура
Катализатор
4. площадь площадь
Скорость реакции
Скорость реакции измеряется изменением концентрации во времени.
Предположим, А реагирует с образованием Б.
Для реакции A B есть два способа измерения скорости:
1. Скорость, с которой появляются товары (т. Е.е. изменение концентрации B в единицу времени), или
2. Скорость исчезновения реагентов (т.е. изменение концентрации A в единицу времени).
Средняя скорость = изменение концентрации B или A = D [B] = — D [A]
время, необходимое для этого изменения D t D t
Единица измерения средней скорости — моль / л * с или [ м / с].
Скорость в любой момент времени (мгновенная скорость) — это наклон касательной к кривой (r = -d [A] / dt) Мгновенная скорость отличается от средней скорости.
Мы обычно называем мгновенную ставку ставкой.
Скорости реакций и стехиометрия
В общем за
aA + bB cC + dD
скорость = — 1d [A] = — 1d [B] = 1d [C] = 1d [D]
а дт б д т в д т д д т
Зависимость ставок от концентрации
Как правило, ставки увеличиваются с увеличением концентрации.
Для реакции:
NH 4 + (вод.) + NO 2 — (вод.) N 2 (г) + 2H 2 O (л)
Отметим:
— поскольку [NH 4 + ] удваивается с константой [NO 2 — ], скорость удваивается,
— поскольку [NO 2 — ] удваивается с константой [NH 4 + ], скорость удваивается.
Мы заключаем оценку a [NH 4 + ] [NO 2 — ]
Тарифный закон:
Коэффициент = k * [NH 4 + ] * [NO 2 — ]
Константа k — константа скорости
Обратите внимание на , что константа скорости k не зависит от концентрации.
Для общей реакции с законом скорости:
Скорость = k * [реагент 1] м * [реагент 2] n
Мы говорим, что реакция составляет m-й порядок в реагенте 1 и n-й порядок в реагенте 2.
Общий порядок реакции m + n.
Реакция может быть нулевого порядка, если m, n равны нулю.
Обратите внимание, что значения показателей (порядков) должны быть определены экспериментально. Они не просто связаны со стехиометрией.
:
Зависимость скорости реакции от концентрации и температуры
Chem 1252L-9123/5/
Зависимость скорости реакции от концентрации и температуры
Введение Среднюю скорость реакции можно определить как изменение концентрации реагенты или продукты за определенный период времени (м / с):
экв.1: скорость = -ΔΔt [A], где [A] — это концентрация реагента в любой единице концентрации
, а t — время в секундах (с). При нахождении скорости формируемого продукта положительный знак вместо этого используется в уравнении.
Химическая кинетика — это раздел химии, изучающий измеряемые свойства реакции, такие как скорость реакции, концентрационная зависимость реагентов, как Температура влияет на скорость реакции и какие механизмы вызывают реакции.Реагенты должны правильно ориентироваться и двигаться с достаточно высокой скоростью (с достаточной кинетической энергией), чтобы сталкиваются и превращаются в продукты. По мере протекания реакции количество реагентов уменьшается при определенная ставка при увеличении количества продукта. Изменение концентрации за период время можно наблюдать разными способами — в этом эксперименте спектрофотометр (или Спек-20) был используется для записи значений оптической плотности в течение 5-6 минут.
Зависимость от концентрации конкретного реагента может быть определена путем определения его скорости заказ.Реагент нулевого порядка показывает относительно постоянный наклон по сравнению с первым и второй порядок, что делает его полезным для выделения значений концентрации фенолфталеина.
Chem 1252L-9123/5/
экв. 2: коэффициент = k [A] a [B] b, где [A] и [B] — концентрации реагентов или продуктов, k — константа скорости, а «a» и «b» представляют соответствующие порядки скорости. Это уравнение известно как закон скорости.
Каждая молекула, участвующая в реакции, должна содержать достаточно тепла для преодоления барьер энергии активации, который является уникальным для каждой реакции и всегда обнаруживается во время самый медленный шаг.Связь между температурой, энергией активации и константой скорости равна известное как уравнение Аррениуса:
экв. 3: k = Ae− (EaRT), где k — константа скорости, A — константа, связанная с частотами столкновений
и ориентации реагентов, Ea — энергия активации, R — газовая постоянная, T — температура в Кельвинах. Это уравнение принимает разные формы, чтобы его можно было преобразовать в прямую линию. на графике или для определения скорости изменения при изменении температуры.
Процедура Для начала используемый спектрофотометр был установлен в режим пропускания при 550 нм. В коэффициент пропускания был установлен на 0,0 и 4,0 мл 0,2 М раствора гидроксида натрия переносили в кювета. После протирания кимвипом кювета была помещена в спектрофотометр. и коэффициент пропускания был установлен на 100,0. Теперь, когда Spec-20 был откалиброван, его повернули. переход в режим абсорбции для записи данных.
Для измерения изменения концентрации соединения фенолфталеина розового цвета Что касается времени, таблица данных была подготовлена за 360 секунд с 5-секундными интервалами для двух разные эксперименты.В первом эксперименте в использованную кювету помещали 1 каплю phph3-. в вышеуказанном шаге и несколько раз переверните, чтобы перемешать. При t = 0 (начальный момент времени) оптическая плотность составляла
Chem 1252L-9123/5/
График 1: ln (поглощение) в зависимости от времени; прямая линия означает, что это реакция первого порядка. Следовательно, a = 1.
-3 0 50 100 150 200 250 300 350
-2.
–
-1.
–
-0.
0 f (х) = — 0 х — 1.04R² = 1
ln (абсорбция) в зависимости от времени
ln (абсорбция) линейная (ln (абсорбция))
Время (сек)
ln (поглощение)
Чтобы найти начальную скорость реакции, наклон между t = 0 с и t = 10 с может быть рассчитывается по следующей формуле:
экв. 3: наклон = ΔΔt (|. |)
При t = 0 с оптическая плотность составляла 0,380. При t = 10 с оптическая плотность составляла 0,351.
начальная скорость = — (0,351¿ ¿) — (0,380)
Начальная скорость реакции 0.0029 / сек, что означает поглощение реагента phph3- упало примерно на 0,0029 в секунду первоначально происходящей реакции.
Chem 1252L-9123/5/
экв. 4: наклон = -kobs
-0,0046 / сек = -kobs
Кобс = 0,0046 / сек
Скорость = kobs [A] a
Скорость = (0,0046 / сек) [phph3-]
Часть 2: Порядок реагирования в отношении [OH-]
График 2: ln (поглощение) в зависимости от времени; прямая линия еще раз указывает, что порядок ставок, b, равно 1.
0 50 100 150 200 250 300 350
-1.
–
-0.
-0.
-0.
-0.
0
f (x) = — 0 x — 0,39R² = 1
лн (абсорбция) в зависимости от времени
лн (абсорбция) Линейный (ln (абсорбция)) Линейный (ln (абсорбция))
Время (сек)
ln (поглощение)
Значение R 2 линии тренда «1 / Поглощение в зависимости от времени» составляет 0,9972; следовательно, этот график демонстрирует самую линейную версию.
Chem 1252L-9123/5/
График 3: ln (поглощение) при низкой температуре в зависимости от времени
0 50 100 150 200 250 300 350
-0.
-0.
-0.
-0.
-0.
0
0. f (x) = — 0 x + 0,01R² = 0.
ln (поглощение) при 8,0 ° C в зависимости от времени
ln (поглощение) при 8,0 ° C Линейное (ln (поглощение) при 8,0 ° C) Линейное (ln (поглощение) при 8,0 ° C)
Время (сек)
лн (абсорбция)
Наклон = -klow
-0.0015 / сек = -klow
Klow = 0,0015 / сек
Поскольку температура прямо пропорциональна константе скорости, значение k падает, когда температуру снижали с помощью бани с ледяной водой.
Chem 1252L-9123/5/
График 4: ln (k) в сравнении с 1 / T
0 0 0 0 0 0 0
-6,6-6.
-6. -6. -6,2-6.
— -5. -5.
f (x) = — 2150 x + 1,24R² = 1
ln (k) По сравнению с 1 / T
ln (k) Линейное (ln (k)) Линейное (ln (k))
1 / т
лин (к)
экв.5: наклон = −REa
-2150 К-1 (8,314 Дж / (моль x К) = -Ea
Ea = 17875,1 Дж / моль
Ea = 17,88 кДж / моль
Обсуждение Порядок определения ставок может быть решен различными способами, одним из которых является использование графиков. Нанесение экспериментальных данных на графики может дать много подсказок о типе реакция и механизмы, которые происходят. Если график показывает прямую линию без изменен, то это нулевой порядок для этого конкретного реагента. Если взять натуральный логарифм концентрация дает прямую линию, тогда реагент является реагентом первого порядка для реакции.И наконец,
Chem 1252L-9123/5/
Следовательно, с увеличением температуры константа скорости увеличивается и реакция протекает более интенсивно. быстро. Энергия активации действует как барьер во время реакции, который предотвращает все молекулы от реакции. Только определенные молекулы с достаточной кинетической энергией обладают потенциалом преодоления этот барьер. На основании этого можно сделать вывод, что более высокая энергия активации будет снизить скорость реакции, затрудняя преодоление барьера молекулами.Если тот же эксперимент должен был быть проверен при более высокой температуре, например, 50 градусов Цельсия, данные обнаружит гораздо более быструю реакцию. Значения оптической плотности снизились бы при значительном более высокая скорость по мере использования реагентов
СКОРОСТЬ РЕАКЦИИ и КОНЦЕНТРАЦИЯ Химия Доктора Брауна KS4 science GCSE / IGCSE / O level Revision Примечания — Факторы влияющие на скорость Химические реакции 3а.Каков эффект изменение концентрации на скорость химической реакции? Экспериментальная страница с большим текстом размеры — комментарии по электронной почте (+/-)? Ставки заметки о реакции INDEX 3. Факторы, влияющие на скорость химических реакций Варьируя КОНЦЕНТРАЦИЮ реагента 3a Влияние концентрации (см. Также графики 4.6, 4.7 и 4.8) Имея дело с концентрацией и ее влияет на скорость реакции, вас обычно интересуют решения, НО все аргументы, графики, объяснения и т. д., описанные здесь, в равной степени могут относиться к смесь газов. Экспериментальные методы исследования влияния концентрации реагентов на скорость химической реакции. Части разделов 1.Введение и 2. теория столкновений повторяется здесь, но с дополнительными экспериментальными методами и теоретические детали, применяемые к экспериментам и теориям, связанным с эффектом изменение концентрации раствора от скорости химической реакции
Теоретическая интерпретация результаты влияния концентрации на скорость химической реакции Для каждого фактора, который я представил несколько диаграмм частиц, которые помогут вам следить за текстом, объясняющим, как теория столкновений частиц учитывает ваши наблюдения скорости реакции в зависимости от концентрации реагента (одни «работают» лучше других!) Изображение частицы (ионов или молекулы), претерпевающие изменения в химической реакции
===>
==> Молекулы продукта не показано, но только представьте, сколько столкновений произойдет в правые диаграммы!
ПРИЛОЖЕНИЕ 3а (Данные для студенческого упражнение в мае 2000 года, при «рождении» моего сайта!) Более подробный пример эффекта концентрации »с помощью пакета программ Excel. например из известняка — соляная кислота реакция с использованием системы газового шприца Результаты сведены в таблицу в Microsoft Excel программное обеспечение для четырех постоянно возрастающих концентраций соляной кислота (четыре различных молярности соляной кислота, 0,50 моль / дм 3 до 2,0 моль / дм 3 ) Эксперименты следует проводить с постоянным объем кислоты, постоянная масса известняка и постоянная температура. График в Excel результатов для четырех концентрации кислоты Серия 1 = 0,50 моль / дм 3 , серия 2 = 1,0 моль / дм 3 , серия 3 = 1,5 моль / дм 3 , серия 4 = 2,0 моль / дм 3 С участков вы получить четыре начальных градиента скорости из графика например, серия 2, для 1,0 молярной кислоты, исходная градиент = скорость = 19/2 = 8.5 см 3 / мин Напоминание: вы должны измерить градиент рисование линии от 0,0 на оси в течение первых нескольких минут, где график достаточно линейный, потому что скорость уменьшается по мере увеличения реагенты расходуются. За пределами первых нескольких минут график становится довольно изогнутым и неточным. Подробнее о лабораторные исследования («лаборатории»), включающие «скорости реакции», т.е. экспериментальные методы наблюдения за скоростью реакции, включая влияние концентрации реагентов приведены в ВВЕДЕНИЕ Ставки заметки о реакции INDEX GCSE / IGCSE МНОЖЕСТВЕННЫЙ ВЫБОР Викторина по ТАРИФАМ реакции Ключевые слова фразы: Как мы можем исследовать эффект концентрации по скорости реакции? Как изменение концентрации влияет на скорость реакция? Почему изменение концентрации влияет на скорость реакции? Как можем ли мы исследовать влияние концентрации на скорость химического реакция? Какой аппарат нам нужен для исследования эффекта концентрации по скорости реакции? Как мы обрабатываем результаты концентрации эксперименты? Эти примечания к пересмотру подходят для естественных наук, химии GCSE IGCSE O Level KS4 студенты изучают, как скорость реакции зависит от концентрации реагент в растворе.Описание экспериментов с рейтингом концентрационные эксперименты и теоретические объяснения должны помочь с домашние задания, курсовые задания, лабораторные эксперименты, исследования «лаборатории» по как скорость реакции зависит от концентрации. Эти заметки об эффекте изменения концентрации в зависимости от скорости реакции, и методы эксперимента, которым следует следовать скорость реакции при изменении концентрации реагента и задействованные экспериментальные методы и исследования разработан в соответствии с высочайшими стандартами необходимых знаний и понимания для студентов / учеников, изучающих химию GCSE, химию IGCSE, химию O Level, KS4 и может быть полезным учебником для курсов химии A Level.Эти примечания к пересмотру о влиянии изменения концентрации реагента на скорость химической реакции, должна оказаться полезной для нового AQA GCSE химия, химия Edexcel GCSE и химия OCR GCSE (Gateway & 21st Century) GCSE (91), (9-5) и (5-1) научные курсы. Химия GCSE Пересмотр химии IGCSE примечания к скорости реакции влияние концентрации KS4 GCSE Science примечания к редакции скорость реакции эффект концентрации руководство по химии GCSE заметки о скорости реакции эффект концентрации для школ колледжи академии преподаватели курсов естествознания изображения изображения диаграммы для скорости реакции эффект концентрации наука химия примечания к пересмотру скорость реакции эффект концентрации для пересмотра примечания по темам модуля по химии, чтобы помочь в понимании скорость реакции эффект концентрации университетские курсы естествознания карьера в науке работа в промышленности лаборант стажировки технические стажировки США США 8 класс 9 класс 10 AQA химия GCSE примечания по скорости реакции эффект концентрации Edexcel химические научные заметки о влиянии скорости реакции концентрация для OCR химии 21 века примечания к скорости реакции эффект концентрации OCR GCSE Gateway science химические заметки о скорости реакции влияние концентрации WJEC gcse science chemistry notes on скорость реакции эффект концентрации CCEA / CEA gcse химия заметки наука O уровень химия заметки для реакции оценивает эффект концентрации IGCSE примечания к пересмотру химии на влияние скорости реакции химические записи уровня O должны оказаться полезным для новой химии AQA, химии Edexcel и OCR химия GCSE (91, 9-5 и 5-1) естественные курсы Использование кинетическая модель частиц, как вы объясните эффект изменение концентрации на скорости или скорости химического вещества реакция? какой аппарат вам нужен, чтобы исследовать эффект изменения концентрации на скорости реакции? описать экспериментальную процедуру для исследования эффекта изменение концентрации на скорость химической реакции, как вы рисуете графики данных расследования влияние изменения концентрации на скорость / скорость химического вещества реакция? исследование эффекта изменения концентрации соляной кислоты, реагирующей с известняком (кальций карбонат), эксперимент по исследованию эффекта изменения концентрация от скорости разложения перекиси водорода раствор с использованием катализатора диоксида марганца, как исследовать влияние изменения концентрации на скорость реакции между растворы тиосульфата натрия и соляной кислоты?, диаграммы модели частиц, чтобы показать эффект увеличения или уменьшение концентрации на скорости / скорости реакции пересмотр химии gcse бесплатные подробные заметки по скорости реакции, эффект изменения концентрация, чтобы помочь пересмотреть химию igcse Примечания к пересмотру химии igcse о влиянии скорости реакции изменение концентрации химического состава уровня O Не требующие пересмотра подробные заметки о влиянии скорости реакции изменение концентрации, чтобы помочь пересмотреть gcse бесплатные химические подробные заметки о влиянии скорости реакции изменение концентрации, чтобы помочь пересмотреть уровень O бесплатный веб-сайт по химии, который поможет пересмотреть скорость реакции эффект изменения концентрации gcse бесплатный онлайн-сайт по химии, чтобы помочь пересмотреть реакцию эффект скорости изменения концентрации для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O скорость реакции эффект изменения концентрации химия как добиться успеха в вопросах по Эффект скорости реакции при изменении концентрации gcse химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по скорость реакции эффект изменения концентрации, помогающий сдавать вопросы по химии gcse скорость реакции эффект изменения концентрации хороший сайт бесплатно помогите пройти igcse химия с доработкой заметки по скорости реакции эффект изменения концентрации хороший сайт бесплатно помощь для прохождения уровня O химия GCSE (91, 9-5 и 5-1), естественные курсы НАЧАЛО СТРАНИЦЫ Нормы реакции отмечает ИНДЕКС НАЧАЛО СТРАНИЦЫ |
| Планирование и проведение расследований.Сделайте направленные гипотезы, которые определяют, что происходит с зависимой переменной при манипулировании независимой переменной. Задавать вопросы и определять проблемы. Задавайте вопросы, которые можно исследовать в рамках школьной лаборатории, исследовательского центра или поля (например, на открытом воздухе) с доступными ресурсами, и, при необходимости, сформулируйте гипотезу на основе модели или теории. Анализ и интерпретация данных Анализируйте данные с помощью инструментов, технологий и / или моделей (например,g., вычислительный, математический), чтобы сделать обоснованные и надежные научные утверждения или определить оптимальное проектное решение. Построение объяснений и разработка решений. Сделайте количественное и / или качественное заявление относительно взаимосвязи между зависимыми и независимыми переменными. Применяйте научные идеи, принципы и / или доказательства для объяснения явлений. | PS1.B: Химические реакции.
Химические процессы, их скорость и то, сохраняется или высвобождается энергия, можно понять с точки зрения столкновений молекул и перегруппировки атомов в новые молекулы с последующими изменениями суммы всех энергий связей в наборе молекул, которые соответствуют изменениям кинетической энергии. PS3.A: Определения энергии.
Эти отношения лучше понять в микроскопическом масштабе, в котором все различные проявления энергии могут быть смоделированы как комбинация энергии, связанной с движением частиц, и энергии, связанной с конфигурацией (относительное положение частиц). В некоторых случаях энергия относительного положения может рассматриваться как хранимая в полях (которые опосредуют взаимодействия между частицами). Эта последняя концепция включает излучение — явление, при котором энергия, запасенная в полях, перемещается в пространстве. | Причина и следствие.
Изменения в системах могут иметь разные причины, которые могут иметь разные последствия. Масштаб, пропорции и количество. Алгебраическое мышление используется для изучения научных данных и прогнозирования влияния изменения одной переменной на другую (например, линейный рост против экспоненциального роста). Стабильность и перемены. Изменения и темпы изменений можно количественно оценить и смоделировать за очень короткие или очень длительные периоды времени. Некоторые системные изменения необратимы. |
Инициирование, распространение, прекращение — Master Organic Chemistry
Инициирование, распространение и прекращение свободных радикальных реакций
В предыдущем посте о реакциях замещения свободных радикалов мы говорили о том, почему в свободнорадикальных реакциях требуются тепло или свет . В этом посте мы рассмотрим механизм реакции свободнорадикального замещения, который имеет три основных типа этапов: инициирование, распространение и завершение.
Содержание
- Механизм замещения свободных радикалов в алкане Cl 2
- Этап, на котором происходит чистое увеличение количества свободных радикалов, называется «инициированием»
- A Этап, на котором нет чистой прибыли или потери свободных радикалов, называется «распространением»
- Остерегайтесь этой распространенной ошибки при выявлении механизмов свободных радикалов
- Есть два этапа распространения свободных радикалов в галогенировании алканов
- Шаг, на котором Чистое уменьшение количества свободных радикалов называется «прекращением»
- Полный механизм замещения алкана свободными радикалами
- Резюме: Реакции замещения свободных радикалов
- Примечания
- (расширенные) Ссылки и дополнительная литература
1.Механизм замещения алкана свободными радикалами с помощью Cl 2
Вы, возможно, помните, что видели эту реакцию в предыдущем посте — это свободнорадикальное хлорирование метана с помощью Cl 2 .
Это замена углерода, потому что связь C-H разрывается и образуется новая связь C-Cl. Побочный продукт — HCl.
Теперь, когда мы знаем немного больше о том, что такое свободные радикалы и их ключевые свойства, сегодня мы ответим: «, как работает эта реакция? “.
Мы собираемся пройти ключевые этапы этой реакции и узнать, что они состоят из трех ключевых фаз: инициирование , завершение и распространение .
2. Этап, на котором происходит чистое увеличение количества свободных радикалов, называется «инициированием»
Реакции свободных радикалов обычно требуют воздействия тепла или света. Это потому, что любой из этих источников энергии может привести к гомолитическому разрыву относительно слабых связей, таких как Cl-Cl, с образованием свободных радикалов [i.е. Cl •]
Каждая свободнорадикальная реакция начинается со стадии образования свободных радикалов, и по этой причине эта начальная стадия называется инициацией .
Вот уравнение для этого шага инициации. Следует отметить два момента:
- Реакция является равновесной — в любой момент времени присутствует только небольшая концентрация свободных радикалов (но этого будет достаточно, как мы увидим)
- Обратите внимание, что существует чистых увеличение количества свободных радикалов в этой реакции.Мы переходим от ноль (в реагентах) к два (в продуктах).
3. Этап, на котором нет чистой прибыли или потери свободных радикалов, называется «распространением»
Наш субстрат (CH 4 в нашем примере) участвует только в том случае, если присутствуют свободные радикалы. Хлорные радикалы обладают высокой реакционной способностью и могут соединяться с водородом из метана, давая метильный радикал, • CH 3
Если вы посчитаете количество свободных радикалов в этом уравнении, вы заметите, что он есть в реагентах и один в продуктах.Итак, на нет чистого увеличения количества свободных радикалов.
Этот тип шага называется «распространение».
Если вы ведете счет, к этому моменту вы должны быть в состоянии увидеть, что до завершения нашей реакции остается сформировать только одну облигацию. Все, что нам нужно сделать, это сформировать связь C – Cl.
4. Остерегайтесь этой распространенной ошибки при построении свободных радикалов
Именно здесь легко допустить небольшую ошибку. Увидев, что на стадии инициирования образуются два радикала хлора, кажется естественным объединить метильный радикал и радикал хлора с образованием CH 3 –Cl.Правильно?????
Неееет!
Обратите внимание: количество свободных радикалов уменьшилось на , здесь , а не на , а осталось прежним. Это не может быть пропагандой! (На самом деле это увольнение, о чем мы поговорим через минуту).
5. Есть два этапа распространения при замещении свободных радикалов
Фактически, мы можем сделать правильный этап «распространения» следующим образом: возьмите метильный радикал, и он вступает в реакцию с Cl 2 , все еще присутствующим. Это дает нам Ch4Cl и радикал хлора.Обратите внимание, что не произошло чистого изменения количества свободных радикалов, так что это все еще «распространение».
Еще раз обратите внимание, что мы формируем радикал хлора! Что в этом такого важного? Это очень важно, потому что этот хлор радикал может затем выполнить стадию распространения № 1 на новой молекуле нашего субстрата (CH 4 ), продолжит процесс. Это цепная реакция — после образования хлор радикал становится катализатором . Вот почему для протекания реакции нам нужно лишь небольшое количество радикала хлора.
6. Этап, на котором наблюдается чистое сокращение свободных радикалов, называется «прекращением»
Может ли эта цепная реакция продолжаться вечно? №
Давайте подумаем о двух крайних случаях. Если концентрация Cl 2 низкая по сравнению с CH 4 (другими словами, Cl 2 является нашим ограничивающим реагентом), то скорость стадии распространения № 2 будет снижаться по мере уменьшения его концентрации. Без какого-либо Cl 2 для взаимодействия наши радикалы • CH 3 могут просто объединиться с другим свободным радикалом (таким как • Cl), например, с образованием CH 3 Cl.По существу, для этой реакции нет барьера. Обратите внимание, что здесь количество свободных радикалов уменьшается с 2 до нуля. Это называется завершением .
Две метильные группы также могут объединиться вместе с образованием CH 3 –CH 3 ; это тоже прекращение!
7. Полный механизм замещения алкана свободными радикалами
Давайте соберем все эти шаги вместе, чтобы мы могли четко видеть шаги инициации, распространения и завершения.
8. Резюме: свободнорадикальные реакции замещения
Эти три типа стадий встречаются в каждой свободнорадикальной реакции.
Суть в том, что , подсчитав количество радикалов, созданных или уничтоженных на каждом этапе, вы можете определить, является ли этот этап инициированием, распространением или завершением.
- Начало -> чистое образование радикалов
- Распространение -> количество свободных радикалов не изменилось
- Прекращение -> чистое уничтожение свободных радикалов
Мы оставим две тизеры для будущих публикаций.
Во-первых … обратите внимание, что здесь мы используем CH 4 , где все связи C – H идентичны. Что могло бы случиться, если бы мы использовали алкан, в котором все связи C – H не равны… например, пропан или пентан?
Во-вторых, эта реакция совершенно не работает, , когда Br 2 используется вместо Cl 2 для реакции CH 4 . Однако мы увидим, что Br 2 может работать в некоторых особых случаях.
Скоро!
Следующее сообщение: Изомеры от свободных радикальных реакций
Примечания
БОНУС-материал.
Мы только что говорили о ситуации, когда используется один эквивалент хлора (Cl 2 ). Что происходит, когда мы используем несколько эквивалентов или даже огромное количество?
Подумайте об этом на секунду. Представьте, что у нас есть несколько эквивалентов Cl 2 в присутствии CH 3 Cl. Как вы думаете, что может случиться?
Атом Cl • может реагировать с CH 3 Cl с образованием • CH 2 Cl [и HCl], который затем может реагировать с Cl 2 с образованием CH 2 Cl 2 !
Точно так же, если у нас все еще есть избыток Cl 2 , мы будем наблюдать преобразование CH 2 Cl 2 в CHCl 3 .
Наконец, при наличии достаточного количества Cl 2 мы можем представить превращение CHCl 3 в CCl 4 .
На этом этапе больше нет связей C-H, которые могли бы взаимодействовать с радикалом хлора, и, таким образом, наша реакция в конечном итоге завершится.
Суть в том, что алканы, учитывая достаточно большой избыток Cl 2 , в конечном итоге все их водороды будут заменены хлором.
Фактически, этот путь представляет собой промышленное производство дихлорметана (CH 2 Cl 2 — обычный лабораторный растворитель), хлороформа (CHCl 3 ) и четыреххлористого углерода (CCl 4 ).В течение многих десятилетий CCl 4 производился в мегатонном масштабе для использования в качестве хладагента и растворителя для химической чистки, пока исследования не выявили его и других CFC в разрушении озонового слоя.
(Advanced) Ссылки и дополнительная литература
- Хлорирование метана
T. McBee, HB Hass, CM Neher и H. Strickland
Industrial & Engineering Chemistry 1942, 34 (3) , 296-300
DOI : 10.1021 / ie50387a009
В этой статье показано, что хлорированием метана можно управлять для получения любого из желаемых хлорметанов с высоким выходом. Это важно, потому что CH 3 Cl, CH 2 Cl 2 , CHCl 3 и CCl 4 все являются важными исходными материалами или растворителями, и именно так они производятся в промышленности. - КИНЕТИКА ТЕПЛОВОГО ХЛОРИРОВАНИЯ МЕТАНА
Роберт Н. Пиз и Джордж Ф. Уолц
Журнал Американского химического общества 1931, 53 (10), 3728-3737
DOI : 10 .1021 / ja01361a016
В этой статье представлены кинетические доказательства того, что хлорирование метана 2 -й порядок (первый порядок как по метану, так и по Cl 2 ). - БРОМИНИРОВАНИЕ ЦИКЛОГЕКСАНА, МЕТИЛЦИКЛОГЕКСАНА И ИЗОБУТАНА
М.С. ХАРАШ, УИЛЬЯМ ХЕРЕД и ФРАНК Р. МЕЙО
Журнал органической химии 1941 0690-8122 : 10.1021 / jo01206a005
Природа механизма радикальной цепной реакции при замещении алканов не была полностью изучена до 1940-х годов.В этом новаторском отчете 1941 года Хараш предлагает цепной механизм, который мы сейчас читаем в учебниках:
a) Br2 + hv -> 2 Br • (начало)
b) R – H + Br • -> R • + HBr (шаг распространения 1 )
c) R • + Br2 -> R-Br + Br • (стадия распространения 2)
Kharasch сообщает, что радикальное замещение циклогексана на Br2 очень медленно реагирует в темноте или в отсутствие кислорода.
