Практическая работа «Влияние различных факторов на скорость реакций» (9 класс)
Практическая работа
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, держатель, штатив для пробирок, цинк, магний, железо: гранулы и порошок, растворы серной (1:5, 1:10) и соляной кислоты, пероксид водорода, оксид марганца (IV), оксид меди (II).
Ход работы:
Вспомните правила техники безопасности при выполнении химического эксперимента.
Ø Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Ø Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление.
Ø В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Ø Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Ø Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
Ø Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Ø Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
Ø Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
Ø При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
Ø Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
Ø Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
Ø Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
Ø Без разрешения учителя, ничего на столах не трогать.
Ø Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
Ø После работы приведи порядок на рабочем месте.
ОПЫТ 1. Влияние природы реагирующих веществ.
Налейте в три пробирки по 2 мл раствора соляной кислоты. Положите в первый стакан кусочек магния, во второй стакан — гранулу цинка, в третий – кусочек железа. Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему?
ОПЫТ 2. Влияние концентрации реагирующих веществ.
В две пробирки, наклонив их, опустите по грануле цинка, осторожно прилейте растворы серной кислоты: в первую пробирку раствор кислоты 1:5, во вторую – 1:10. В какой из них реакция идет быстрее?
ОПЫТ 3. Влияние площади соприкосновения реагирующих веществ.
В одну пробирку насыпьте немного порошка железа, в другую – положите железную скрепку и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2). В какой из пробирок реакция идет быстрее? Почему?
ОПЫТ 4. Влияние температуры.
В де пробирки поместите немного черного порошка оксида меди (II), прилейте в обе пробирки раствор серной кислоты. Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему?
Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему?
ОПЫТ 5. Влияние катализатора.
В две пробирки налейте по 2 мл пероксида водорода Н2О2, в одну из пробирок добавьте несколько кристалликов оксида марганца (IV) MnO2. В какой из пробирок реакция идет быстрее? Почему?
Оформите работу в виде таблицы:
Рассматриваемый фактор, влияющий на скорость хим. реакцииОписание эксперимента
Наблюдения, позволяющие судить о скорости реакции
Уравнения реакций
Вывод
Опыт 1. Влияние природы реагирующих веществ.
Налейте в три пробирки по 2 мл раствора соляной кислоты. Положите в первый стакан кусочек магния, во второй стакан — гранулу цинка, в третий – кусочек железа. Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему?
Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему?
Выделение газа наиболее бурно происходит в пробирке с магнием.
Мg + 2HCl → MgCl2 +H2↑
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
Скорость химической реакции зависит от природы реагирующих веществ. Магний обладает наиболее сильными восстановительными свойствами.
Опыт 2. Влияние концентрации реагирующих веществ.
В две пробирки, наклонив их, опустите по грануле цинка, осторожно прилейте растворы серной кислоты: в первую пробирку раствор кислоты 1:5, во вторую – 1:10. В какой из них реакция идет быстрее?
В первой пробирке газ выделяется более интенсивно.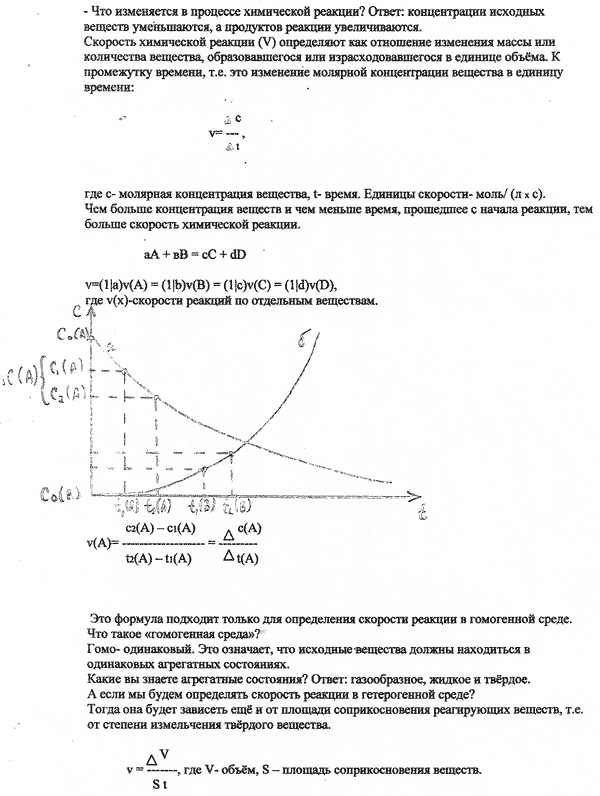
Zn + H2SO4 → ZnSO4 + H2↑
Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции.
Опыт 3. Влияние площади соприкосновения реагирующих веществ.
В одну пробирку насыпьте немного порошка железа, в другую – положите железную скрепку и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2). В какой из пробирок реакция идет быстрее? Почему?
Выделение газа идет быстрее в пробирке с порошком железа.
Fe + 2HCl → FeCl2 + H2↑
Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции.
Опыт 4. Влияние температуры.
В две пробирки поместите немного черного порошка оксида меди (II), прилейте в обе пробирки раствор серной кислоты. Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему?
Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему?
Растворение оксида меди (II
) и образование раствора голубого цвета идет быстрее при нагревании.
СuO + H2SO4 CuSO4 + H2O
При повышении температуры возрастает скорость движения частиц и скорость химической реакции.
Опыт 5. Влияние катализатора.
В две пробирки налейте по 2 мл пероксида водорода Н2О2, в одну из пробирок добавьте несколько кристалликов оксида марганца (IV) MnO2. В какой из пробирок реакция идет быстрее? Почему?
В присутствии оксида марганца (IV) происходит бурное выделение пузырьков газа.
2Н2О2
2Н2О + О2↑
Оксид марганца (IV) – катализатор, ускоряет реакцию разложения пероксида водорода.
Вывод: Скорость химической реакции зависит от условий: от природы реагирующих веществ, от площади соприкосновения, от концентрации, от температуры, от присутствия катализаторов.
Скорость химических реакций и химическое равновесие
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Петербургский государственный университет путей сообщения»
Кафедра «Инженерная химия и естествознание»
Лабораторная работа #1
«Скорость химических реакций и химическое равновесие»
Проверил:
Л.Л.Масленникова
Выполнил:
студент группы  И.
И.
Санкт-Петербург 2013
Лабораторная работа – опыт №1
Вариант № 9
Ход работы:
Берём три пробирки. В первую пробирку накапаем 4 капли Na2S2O3, во вторую
8 капель Na2S2O3, в третью
12 капель Na2S2O3. После
этого добавляем в первую пробирку 8 капель
H
Затем в 1-ую пробирку накапаем 2 капли раствора H2SO4 и отмечаем время с момента сливания раствора до появления коллоидных частиц серы — помутнения раствора.
1. Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S ¯
Данное явление опалесценции
является аналитическим сигналом регистрирующим
окончание реакции. Подобным образом
поступаем со 2-ой и 3-ей пробирками.
Полученные результаты заносим в
таблицу.
Подобным образом
поступаем со 2-ой и 3-ей пробирками.
Полученные результаты заносим в
таблицу.
№ п/п | Количество капель | Соотношение концентраций Na2S2О3 | Время появления опалесценции t (сек) | Скорость реакции (условные единицы) 1/t | Соотношение скоростей | ||
Исходного раствора Na2S2О3 | Воды | Полученного раствора Na2S2О3 | |||||
1 | 4 | 8 | 12 | 1:3 | 36 | 1/36 | 1:3 |
2 | 8 | 4 | 12 | 2:3 | 18 | 1/18 | 2:3 |
3 | 12 | — | 12 | 3:3 | 12 | 1/12 | 3:3 |
Вывод:
Скорость протекания
реакции зависит от концентрации
реагирующих веществ. Это следует
из того, что реагируют те молекулы,
которые сталкиваются. Поэтому, чем
больше концентрация и, следовательно,
вероятность столкновения молекул
реагентов, тем выше скорость протекания
реакции.
Это следует
из того, что реагируют те молекулы,
которые сталкиваются. Поэтому, чем
больше концентрация и, следовательно,
вероятность столкновения молекул
реагентов, тем выше скорость протекания
реакции.
Согласно закону действующих масс при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Петербургский государственный университет путей сообщения»
Кафедра «Инженерная химия и естествознание»
Лабораторная работа #2
«Влияние концентрации реагирующих веществ на сдвиг химического равновесия»
Проверил: Л. Л.Масленникова
Л.Масленникова
Выполнил:
студент группы
Санкт-Петербург 2013
Лабораторная работа – опыт №2
Ход работы:
Для изучения влияния концентрации реагирующих веществ на смещение химического равновесия приготовим исходный раствор. Для этого возьмём разбавленные растворы FeCl3 и KCNS.
Возьмём 4-е пробирки. В первую накапаем 6 капель FeCl3 и 6 капель KCNS. Полученный раствор окрасился в красный цвет. Система пришла в состояние равновесия.
FeCl3 + 3 KCNS <=> Fe(CNS)3 + 3 КСl
Разделим содержимое
первой пробирки на 4 равные части. 1-ю пробирку будем использовать
в качестве образца, для контрольного
сравнения. Добавим во вторую пробирку
каплю концентрированного раствора FeCl3. Сравним содержимое 1-ой и 2-ой пробирок.
Во второй пробирке окраска усилилась,
что говорит о смещении равновесия.
Добавим во вторую пробирку
каплю концентрированного раствора FeCl3. Сравним содержимое 1-ой и 2-ой пробирок.
Во второй пробирке окраска усилилась,
что говорит о смещении равновесия.
è
FeCl3 + 3 KCNS <=> Fe(CNS)3 + 3 КСl
Добавим в 3-ю пробирку каплю концентрированного раствора KCNS. Сравним содержимое 1-ой и 3-ей пробирок. Во второй пробирке окраска усилилась, что говорит о смещении равновесия.
ç
FeCl3 + 3 KCNS <=> Fe(CNS)3 + 3 КСl
Добавим в 4-ю пробирку несколько кристалликов КСl. Сравним содержимое 1-ой и 4-ой пробирок. В 4-ой пробирке окраска ослабла. Произошло смещение равновесия.
Вывод:
Принцип Ла Шателье — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами, при увеличении концентрации одного из исходных веществ
(FeCl3 и KCNS) равновесие сдвигается в направлении
продукта реакции, а при увеличении концентрации
одного из продуктов реакции (КСl) —
в направлении исходных веществ.
Из веществ этой системы роданид железа (III) Fe(CNS)3 окрашен в красный цвет. Раствор FeCl3 имеет слабо жёлтую окраску, а растворы KCNS и КСl – бесцветны. Поэтому всякое изменение концентрации Fe(CNS)3 изменяет интенсивность окраски раствора. Это позволяет наблюдать, в каком направлении смещается равновесие при изменении концентраций реагирующих веществ.
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Петербургский государственный университет путей сообщения»
Кафедра «Инженерная химия и естествознание»
Лабораторная работа #3
«Химическая идентификация(обнаружение) и измерение веществ»
Проверил: Л. Л.Масленникова
Л.Масленникова
Выполнил:
студент группы
Санкт-Петербург 2013
Лабораторная работа №3
Вариант № 24
Ход работы:
Берём на исследование пробирку с 1-ым раствором. Раствор розового цвета, поэтому по таб.1 это может быть Mn(II) или Co(II). Для получения осадка(гидроксида) к исходному раствору добавляем 3 капли водного раствора щёлочи(NaOH) и наблюдаем. Цвет выпавшего осадка синий. Смотрим по таб.2 и видим, что это Co(II). Полученный осадок делим на 2 части.
К первой части добавим избыток щёлочи(NaOH). Осадок не растворился, цвет не изменился. По таб.3. подтвердился Co(II).
Ко второй части добавим
водный раствор аммиака (Nh5OH). Осадок гидроксида растворился, цвет
изменился на жёлтый. По таб.4 подтвердился
Co(II).
По таб.4 подтвердился
Co(II).
Для окончательной уверенности проведём специфическую реакцию.
К исходному раствору
добавим специфический реагент
По таб.5 также подтвердился Co(II).
Берём на исследование пробирку со 2-ым раствором. Раствор зелёного цвета, поэтому по таб.1 это может быть Ni(II) или Cr(III). Для получения осадка(гидроксида) к исходному раствору добавляем 3 капли водного раствора щёлочи(NaOH) и наблюдаем. Цвет выпавшего осадка зелёный. Смотрим по таб.2 и видим, что это Cr(III). Полученный осадок делим на 2 части.
К первой части добавим избыток щёлочи(NaOH). Осадок растворился, цвет не изменился. По таб.3. подтвердился Cr(III).
Ко второй части добавим водный раствор аммиака (Nh5OH). Осадок гидроксида не растворился, цвет не изменился. По таб.4 подтвердился Cr(III).
Для окончательной уверенности проведём специфическую реакцию.
К исходному раствору
добавим специфический реагент
По таб.5 также подтвердился Cr(III).
Вывод: в результате проведённых химических реакций удалось установить наличие в представленных растворах вредных веществ и идентифицировать их.
Ионы | Цвет исходного раствора | Реакция со щелочью, гидроксид | Поведение осадка гидроксида | Специфи- ческие реакции | Результат реакции | ||
Формула гидроксида | Цвет осадка | в избытке щелочи | в водном растворе аммиака | ||||
Co(II) | розовый | Co(OH)2 | синий | нерастворим | Жёлтый растворим | S | чёрный |
Cr(III) | зелёный | Cr(OH)3 | зелёный | растворим | нерастворим | окислитель | жёлтый |
лабораторные работы скорость химической реакции | Учебно-методический материал по химии по теме:
ЛПЗ №6. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
Цель работы: практическим путем подтвердить зависимость скорости химической реакции от природы реагирующего вещества, от её концентрации и от температуры.
Оборудование: сосуды Ландольта, мензурки, воронки, термометр, пинцет, прибор для определения скорости химических реакций.
Техника безопасности. Требуется осторожное обращение с раствором серной кислоты и уксусной кислот. В результате реакции образуется горючий газ водород: рядом не должно быть открытого пламени.
Ход работы:
- Влияние природы реагирующих веществ на скорость химических реакций
Скорость химической реакции зависит от многих факторов. Один из них – природа реагирующих веществ. Проведем в одинаковых условиях реакции с цинком двух разных кислот. В сосуды Ландольта наливаем растворы уксусной и серной кислот одинаковой концентрации. Во второе колено обоих сосудов помещаем по две одинаковые гранулы цинка. Приливаем кислоты к цинку. Объем выделяющегося газа определяем по уровню жидкости в приборе. Газ интенсивнее выделяется
ЛПЗ №6. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
Цель работы: практическим путем подтвердить зависимость скорости химической реакции от природы реагирующего вещества, от её концентрации и от температуры.
Оборудование: сосуды Ландольта, мензурки, воронки, термометр, пинцет, прибор для определения скорости химических реакций.
Техника безопасности. Требуется осторожное обращение с раствором серной кислоты и уксусной кислот. В результате реакции образуется горючий газ водород: рядом не должно быть открытого пламени.
Ход работы:
1.Влияние природы реагирующих веществ на скорость химических реакций
Скорость химической реакции зависит от многих факторов. Один из них – природа реагирующих веществ. Проведем в одинаковых условиях реакции с цинком двух разных кислот. В сосуды Ландольта наливаем растворы уксусной и серной кислот одинаковой концентрации. Во второе колено обоих сосудов помещаем по две одинаковые гранулы цинка. Приливаем кислоты к цинку. Объем выделяющегося газа определяем по уровню жидкости в приборе. Газ интенсивнее выделяется
в сосуде с серной кислотой, здесь реакция идет значительно быстрее. Серная кислота – более сильная кислота по сравнению с уксусной. Мы убедились в том, что природа вещества влияет на скорость химической реакции.
Написать уравнение реакции взаимодействия цинка с серной кислотой и уксусной кислотой.
2.Влияние концентрации реагирующих веществ на скорость химических реакций
Скорость химической реакции зависит от многих факторов, в том числе и от концентрации реагирующих веществ.
Проведем в одинаковых условиях реакции цинка с растворами серной кислоты различной концентрации. Скорость реакции определим по скорости выделения водорода. В сосуде, где концентрация кислоты более высокая, скорость выделения водорода выше. Мы увидели, что концентрация реагирующих веществ влияет на скорость химической реакции.
3.Влияние температуры на скорость химических реакций
Как влияет температура на скорость химической реакции? Проведем две одинаковые реакции цинка с серной кислотой. Единственное отличие – в одном из сосудов раствор серной кислоты комнатной температуры, а в другом – подогретый раствор кислоты.
После начала реакций видно, что более интенсивное выделение водорода происходит в приборе с подогретой серной кислотой. Мы убедились в том, что температура влияет на скорость химической реакции.
Написать уравнение реакции взаимодействия цинка с серной кислотой.
Вывод данной работы.
в сосуде с серной кислотой, здесь реакция идет значительно быстрее. Серная кислота – более сильная кислота по сравнению с уксусной. Мы убедились в том, что природа вещества влияет на скорость химической реакции.
Написать уравнение реакции взаимодействия цинка с серной кислотой и уксусной кислотой.
2.Влияние концентрации реагирующих веществ на скорость химических реакций
Скорость химической реакции зависит от многих факторов, в том числе и от концентрации реагирующих веществ.
Проведем в одинаковых условиях реакции цинка с растворами серной кислоты различной концентрации. Скорость реакции определим по скорости выделения водорода. В сосуде, где концентрация кислоты более высокая, скорость выделения водорода выше. Мы увидели, что концентрация реагирующих веществ влияет на скорость химической реакции.
3.Влияние температуры на скорость химических реакций
Как влияет температура на скорость химической реакции? Проведем две одинаковые реакции цинка с серной кислотой. Единственное отличие – в одном из сосудов раствор серной кислоты комнатной температуры, а в другом – подогретый раствор кислоты.
После начала реакций видно, что более интенсивное выделение водорода происходит в приборе с подогретой серной кислотой. Мы убедились в том, что температура влияет на скорость химической реакции.
Написать уравнение реакции взаимодействия цинка с серной кислотой.
Вывод данной работы.
Практическая работа №2. Скорость химических реакций | Методическая разработка по химии (11 класс):
11 класс Практическая работа №2
по теме «Влияние различных факторов на скорость химической реакции».
Соблюдайте технику безопасности при работе с кислотами, пероксидом водорода, при нагревании веществ.
1.Влияние природы реагирующих веществ.
В три пробирки налейте соляной кислоты. В первую пробирку положите кусочек магния, во вторую – кусочек цинка, в третью – кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2.Влияние концентрации реагирующих веществ.
В две пробирки поместите по одной грануле алюминия. В одну пробирку прилейте 1мл соляной кислоты (1:3), в другую – 1мл соляной кислоты (1:10). В каком случае реакция проходит более интенсивно? Почему?
3.Влияние поверхности соприкосновения реагентов.
В одну пробирку опустите кусочек мела, в другую насыпьте порошок мела, в эти пробирки налейте по 1 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа? Почему?
4.Влияние температуры.
В пробирку насыпьте небольшое количество порошка оксида меди (II), прилейте 1мл серной кислоты. Пронаблюдайте, что происходит. Закрепите эту пробирку в держателе и нагрейте её на пламени сухого горючего. Что наблюдаете? Почему?
5.Влияние катализатора.
В пробирку налейте 1-2 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца (IV) и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет MnO2?
Составьте отчёт о работе в произвольной форме. Отчёт должен содержать следующую информацию: название опыта, что делали, что наблюдали, уравнения реакции, вывод.
____________________________________________________________________________
11 класс Практическая работа №2
по теме «Влияние различных факторов на скорость химической реакции».
Соблюдайте технику безопасности при работе с кислотами, пероксидом водорода, при нагревании веществ.
1.Влияние природы реагирующих веществ.
В три пробирки налейте соляной кислоты. В первую пробирку положите кусочек магния, во вторую – кусочек цинка, в третью – кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2.Влияние концентрации реагирующих веществ.
В две пробирки поместите по одной грануле алюминия. В одну пробирку прилейте 1мл соляной кислоты (1:3), в другую – 1мл соляной кислоты (1:10). В каком случае реакция проходит более интенсивно? Почему?
3.Влияние поверхности соприкосновения реагентов.
В одну пробирку опустите кусочек мела, в другую насыпьте порошок мела, в эти пробирки налейте по 1 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа? Почему?
4.Влияние температуры.
В пробирку насыпьте небольшое количество порошка оксида меди (II), прилейте 1мл серной кислоты. Пронаблюдайте, что происходит. Закрепите эту пробирку в держателе и нагрейте её на пламени сухого горючего. Что наблюдаете? Почему?
5.Влияние катализатора.
В пробирку налейте 1-2 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца (IV) и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет MnO2?
Составьте отчёт о работе в произвольной форме. Отчёт должен содержать следующую информацию: название опыта, что делали, что наблюдали, уравнения реакции, вывод.
Лабораторная работа № 3 «Скорость химических реакций»
Цель работы
Определить зависимость скорости химической реакции в жидкой фазе от концентрации реагирующих веществ.
Теоретическая часть
Скорость гомогенной химической реакции это изменение концентрации исходных веществ или продуктов реакции за единицу времени.
моль/л∙мин
К важнейшим факторам, влияющим на скорость, относятся: концентрация, температура и наличие катализатора.
Влияние концентрации веществ на скорость реакции описывается законом действующих масс (кинетическим уравнением).
В общем виде для простой (элементарной) реакции
аА+bB продукты реакции
уравнение имеет вид:
где k – константа скорости реакции, не зависящая от концентраций, но завися- щая от природы веществ, температуры и катализатора.
В данной работе изучается скорость реакции между раствором тиосульфата натрия и раствором серной кислоты.
Данная реакция сопровождается выпадением в осадок элементарной серы, т.е. помутнением раствора. Время, которое проходит от момента сливания растворов до «начала помутнения» характеризует скорость данной реакции.
В наших опытах концентрацию серной кислоты будем поддерживать постоянной, а концентрацию соли изменять, разбавляя исходный раствор водой. Выражение для скорости реакции упрощается:
Математически скорость при изменении концентрации соли должна изменяться прямопропорционально по линейному уравнению типа .
Экспериментальная часть
Опыт 1.
Ход работы:
В коническую колбу с помощью мерного цилиндра налить 12 мл раствора исходной концентрации.
В отдельном мерном цилиндре приготовить 4 мл раствора .
Быстро влить кислоту в колбу и включить секундомер.
Внимательно следить за реакцией, при появлении легкого помутнения выключить секундомер, записать время реакции (например, 20 сек.).
Опыт 2.
Ход работы:
В коническую колбу налить 8 мл исходной соли и 4 мл дистиллированной воды (разбавление 2 : 1).
2-4. Аналогично опыту 1 (время реакции, например, 30 сек.).
Опыт 3.
Ход работы:
В коническую колбу налить 4 мл исходной соли и 8 мл воды (разбавление 1 : 2).
Аналогично опыту 1 (время реакции, например, 60 сек.).
Результаты опытов занести в таблицу.
Таблица 1
Влияние концентрации тиосульфата натрия на скорость его реакции
с серной кислотой
№ опыта | Объем раствора, мл | относи- тельная | , сек | ||||
1 | 12 | 0 | 4 | 3 | 20 | 3 | |
2 | 8 | 4 | 4 | 2 | 30 | 2 | |
3 | 4 | 8 | 4 | 1 | 60 | 1 | |
Например, в первом опыте помутнение началось через 20 сек., а в третьем – через 60 сек. Скорость реакции уменьшилась в 3 раза.
По данным таблицы построить график зависимости относительной скорости реакции от концентрации соли.
3
2
1
1 2 3 (относит.)
(опыт 3) (опыт 1)
Рис. Зависимость относительной скорости реакции от концентрации соли
Выводы:
Исследована зависимость скорости реакции от концентрации реагирующих веществ.
Для элементарной химической реакции эта зависимость является линейной, что соответствует кинетическому уравнению типа
.
Лабораторная работа №4м
Лабораторная работа 4.
Скорость химических реакций. Химическое равновесие
Цель работы. Установить влияние температуры, концентрации реагирующих веществ на скорость реакции и сдвиг химического равновесия.
Химический процесс. Реакция между тиосульфатом натрия и серной кислотой выражается общим уравнением.
Экспериментальная часть.
Опыт 1. Влияние концентрации реагирующих веществ на скорости реакции.
Для проведения опыта налил в четыре нумерованные пробирки 2% раствор тиосульфата натрия: в первую — 2 мл, во вторую — 3 мл, в третью — 4 мл, в четвертую — 6 мл. После этого в первую пробирку долил 4 мл воды, во вторую — 3 мл воды, в третью — 2 мл воды. Затем в каждую из пробирок поочередно прилил по 6 мл раствора серной кислоты, отмечая на часах момент приливания кислоты и момент помутнения раствора. Результаты занес в таблицу 1.
По полученным данным на миллиметровой бумаге построил график, откладывая на оси ординат величину, характеризующую скорость реакции, на оси абсцисс — концентрацию раствора Na2S2O3 в процентах.
Опыт 2. Влияние температуры на скорость химической реакции.
В три пробирки налил по 4 мл 2% раствора тиосульфата натрия, а в три другие пробирки по 4 мл 2% раствора серной кислоты. Поместил 2 пробирки (одну с кислотой, одну с тиосульфатом натрия) в стакан с водой, снабженный термометром. Через 3-5 мин отмерил в них температуру. Затем достал пробирку с кислотой и, не вытаскивая вторую пробирку, аккуратно вылил кислоту в пробирку с тиосульфатом натрия. Отметил на часах момент приливания кислоты и момент помутнения раствора. Помыл пробирки.
После этого нагревал воду до тех пор, пока температура не стала выше первоначальной на 10ºС. Поместил в стакан с водой снова 2 пробирки (одну с кислотой, одну с тиосульфатом натрия) выдержите пробирки при этой температуре 3-5 минут и вновь влил раствор серной кислоты в пробирку с тиосульфатом натрия. Отметил на часах момент приливания кислоты и момент помутнения.
Вновь нагрел стакан с водой до температуры выше первоначальной на 200 С и вновь проделал опыт с оставшимися двумя пробирками. Результаты опыта записал в таблицу 2.
По данным таблицы 1 построил график, откладывая на оси абсцисс температуру, а на оси ординат величину, характеризующую скорость реакции 1/t.
Таблица 1
№ пробы | Объем, мл | Концент-рация Na2S2O3, % | Время, прошедшее от прили-вания до помутнения | Скорость реакции усл. ед., 1/t | ||
Раствор Na2S2O3 | Вода | Кислота | ||||
1 | 2 | 4 | 6 | 33.3 | 159 с | 0.0063 |
2 | 3 | 3 | 6 | 50 | 105 с | 0.0095 |
3 | 4 | 2 | 6 | 66.7 | 76 с | 0.0131 |
4 | 6 | 0 | 6 | 100 | 55 с | 0.0182 |
Таблица 2
Номер пробы | Температура, 0С | Время от приливания до помутнения, с | Скорость реакции усл. ед., 1/t |
1 2 3 | 18 28 38 | 64 50 33 | 0.015 0.02 0.03 |
Опыт 3. Смещение химического равновесия при изменении концентрации реагирующих веществ.
В пробирку налил несколько капель раствора хлорида железа (III), несколько капель раствора роданида калия (KCNS) и разбавил водой до светло-желтого цвета. Полученную смесь разлил равными частями в четыре пробирки. В одну пробирку добавил раствор FeCl3, во вторую — сухого KCl, в третью пробирку добавил раствор KCNS. Четвертую пробирку использовал в качестве эталона.
Сравнил цвет растворов в этих пробирках с цветом раствора в пробирке № 4. Данные опыта занес в таблицу 3.
FeCl3 + 3KCNS → Fe(CNS)3 + 3KCl
Константа равновесия:
С увеличением концентрации исходных веществ равновесие смещалось в сторону образования продуктов реакции, с увеличением концентрации продуктов реакции равновесие смещалось в сторону исходных веществ, что свидетельствует о выполнении принципа Ле Шателье.
Таблица 3
Номер пробы | Добавлено | Наблюдаемые изменения | Вывод: равновесие сместилось в сторону образования … |
1 2 3 4 | FeCl3 KCl KCNS эталон | потемнел посветлел потемнел | Продуктов реакции Исходных веществ реакции Продуктов реакции |
Вывод: Установил влияние температуры, концентрации реагирующих веществ на скорость реакции и сдвиг химического равновесия. С увеличением температуры в системе возрастает скорость реакции. Так же чем больше концентрация реагирующих веществ, тем быстрее будет протекать реакция. Подтвердил на практике выполнение принципа Ле Шателье.
4
2.5.2: Скорость химической реакции
- Последнее обновление
- Сохранить как PDF
- Введение
- Внешние ссылки
- Ссылки
- Проблемы
- Участники
Скорость химической реакции — это изменение концентрации по сравнению с изменением во времени.
Введение
Скорость химической реакции — это изменение концентрации по сравнению с изменением во времени и является метрикой «скорости», с которой происходят химические реакции, и может быть определена в терминах двух наблюдаемых:
- Скорость исчезновения реагентов \ [- \ dfrac {\ Delta [Reactants]} {\ Delta {t}} \] Обратите внимание, что это отрицательный результат, поскольку он измеряет скорость исчезновения реагентов.
- Скорость формирования продуктов \ [\ dfrac {\ Delta {[Products]}} {\ Delta {t}} \] Это скорость формирования продуктов.
Оба они связаны сбалансированными химическими реакциями, и оба могут использоваться для измерения скорости реакции.
скорость, полученная путем взятия изменения концентрации за период времени, например: -0,3 M / 15 минут. Это приблизительная скорость реакции в интервале; это не обязательно означает, что реакция имеет эту конкретную скорость на протяжении временного интервала или даже в любой момент в течение этого времени. С другой стороны, мгновенная скорость реакции отображает более точное значение.Мгновенная скорость реакции определяется как изменение концентрации в бесконечно малом интервале времени, выраженное как предел или производное выражение выше. Мгновенную скорость можно получить из экспериментальных данных, сначала построив график концентрации системы как функции времени, а затем найдя наклон касательной в конкретной точке, которая соответствует интересующему времени. В качестве альтернативы, экспериментаторы могут два или более раз измерить изменение концентрации за очень короткий период времени, чтобы получить среднюю скорость, близкую к мгновенной.Скорость реакции для этого времени определяется по наклону касательных.
Ссылки
- Petrucci et al. Общая химия: принципы и современные приложения, 9 th Edition . Нью-Джерси: Prentice-Hall Inc., 2007.
- Коннорс, Кеннет. Химическая кинетика: изучение скорости реакции в растворе . Нью-Йорк: VCH Publishers, Inc., 1990.
Проблемы
- Рассмотрим реакцию \ (2A + B \ longrightarrow C \).{-6} м / с \). Какая концентрация [A] будет через 3 минуты?
- Рассмотрим реакцию \ (A + B \ longrightarrow C \). Скорость реакции 1,23 * 10-4. [A] изменится с 0,4321 M до 0,4444 M за какой промежуток времени?
- Запишите скорость химической реакции относительно переменных данного уравнения. \ [2A + 3B \ rightarrow C + 2D \]
- Верно или неверно: средняя скорость и мгновенная скорость равны друг другу.
- Как скорость образования продукта связана со скоростью исчезновения реагентов.
Соавторы
- Альберт Лоу, Виктория Бланшар, Дональд Ле
15.2: Скорость химической реакции
Цели обучения
- Опишите условия успешного столкновения, вызывающего реакцию.
- Опишите ставку с точки зрения условий успешных столкновений.
- Опишите, как изменение температуры, концентрации реагента или площади поверхности реакции влияет на скорость реакции.+} \) и т. д.) или молекул (\ (\ ce {H_2O} \), \ (\ ce {C_ {12} H_ {22} O_ {11}} \) и т. д.). Мы также знаем, что в химической системе эти частицы перемещаются случайным образом. Теория столкновений объясняет, почему на этом уровне частиц происходят реакции между этими атомами, ионами и / или молекулами. Также объясняется, как можно ускорить или замедлить происходящие реакции.
Теория столкновений
Теория столкновений дает нам возможность предсказать, какие условия необходимы для успешной реакции.Эти условия включают:
- Частицы должны столкнуться друг с другом.
- Частицы должны столкнуться с достаточной энергией, чтобы разорвать старые связи.
- Частицы должны иметь правильную ориентацию.
Химическая реакция включает разрыв связей в реагентах, перегруппировку атомов в новые группы (продукты) и образование новых связей в продуктах.
Следовательно, столкновение должно происходить не только между частицами реагента, но столкновение также должно иметь достаточно энергии, чтобы разорвать все связи реагента, которые необходимо разорвать для образования продуктов.Некоторым реакциям требуется меньше энергии столкновения, чем другим. Количество энергии, которое должны иметь частицы реагента для разрыва старых связей для того, чтобы произошла реакция, называется энергией активации , сокращенно \ (\ text {E} _a \). Другой способ подумать об этом — взглянуть на энергетическую диаграмму, показанную на рисунке. Частицы должны иметь возможность преодолевать «выступ» — энергию активации — если они собираются реагировать. Если частицы реагента сталкиваются с энергией, меньшей, чем энергия активации, частицы будут отскакивать (отскакивать друг от друга), и никакой реакции не произойдет.
Скорость реакции
Химики используют реакции для получения продукта, который они используют. По большей части реакции, в результате которых образуется какое-либо желаемое соединение, полезны только в том случае, если реакция протекает с разумной скоростью. Например, использование реакции для производства тормозной жидкости было бы бесполезным, если бы реакция требовала 8000 лет для завершения продукта. Такая реакция также не была бы полезной, если бы реакция была настолько быстрой, что она была взрывной. По этим причинам химики хотят иметь возможность контролировать скорость реакции.В некоторых случаях химики хотят ускорить слишком медленные реакции и замедлить слишком быстрые. Чтобы получить какой-либо контроль над скоростью реакции, мы должны знать факторы, которые влияют на скорость реакции. Химики выявили множество факторов, влияющих на скорость реакции.
Скорость или скорость, с которой происходит реакция, зависит от частоты успешных столкновений. Помните, успешное столкновение происходит, когда два реагента сталкиваются с достаточной энергией и с правильной ориентацией.Это означает, что если мы сможем сделать что-то, что увеличит количество столкновений, увеличит количество частиц, у которых достаточно энергии для реакции, и / или увеличим количество частиц с правильной ориентацией, мы увеличим скорость реакции.
Влияние температуры на скорость реакции
Скорость реакции обсуждалась с точки зрения трех факторов: частоты столкновений, энергии столкновения и геометрической ориентации. Помните, что частота столкновений — это количество столкновений в секунду.Частота столкновений зависит, среди прочего, от температуры реакции.
При повышении температуры средняя скорость частиц увеличивается. Средняя кинетическая энергия этих частиц также увеличивается. В результате частицы будут сталкиваться чаще, потому что частицы перемещаются быстрее и сталкиваются с большим количеством частиц реагента. Однако это лишь малая часть причины повышения ставки. То, что частицы сталкиваются чаще, не означает, что реакция обязательно произойдет.
Главный эффект повышения температуры состоит в том, что большее количество сталкивающихся частиц будет иметь количество энергии, необходимое для эффективного столкновения. Другими словами, большее количество частиц будет иметь необходимую энергию активации.
При комнатной температуре водород и кислород в атмосфере не обладают достаточной энергией для достижения энергии активации, необходимой для производства воды:
\ [\ ce {O_2} \ left (g \ right) + \ ce {H_2} \ left (g \ right) \ rightarrow \ text {Нет реакции} \]
В любой момент в атмосфере происходит множество столкновений между этими двумя реагентами.Но мы обнаружили, что вода не образуется из молекул кислорода и водорода, сталкивающихся в атмосфере, потому что энергетический барьер активации слишком высок, и все столкновения приводят к отскоку. Когда мы повышаем температуру реагентов или даем им энергию каким-либо другим способом, молекулы обладают необходимой энергией активации и могут реагировать с образованием воды:
\ [\ ce {O_2} \ left (g \ right) + \ ce {H_2} \ left (g \ right) \ rightarrow \ ce {H_2O} \ left (l \ right) \]
Бывают случаи, когда скорость реакции нужно снизить.Понижение температуры также можно использовать для уменьшения количества столкновений, которые могут произойти, а понижение температуры также уменьшит кинетическую энергию, доступную для энергии активации. Если у частиц недостаточно энергии активации, столкновения приведут к отскоку, а не к реакции. Используя эту идею, когда скорость реакции должна быть ниже, удержание частиц от достаточной энергии активации определенно будет поддерживать реакцию с более низкой скоростью.
Общество ежедневно использует влияние температуры на скорость реакции.\ text {th} \) века исследователи были очарованы тем, что первыми достигли Южного полюса. Чтобы попытаться решить такую сложную задачу в то время, когда не было большей части технологий, которые мы сегодня принимаем как должное, они разработали множество способов выживания. Один из методов заключался в том, чтобы хранить пищу в снегу, чтобы использовать ее позже во время продвижения к полюсу. Во время некоторых исследований они закопали столько пищи, что им не нужно было использовать ее всю, а часть осталась позади. Много лет спустя, когда эта еда была обнаружена и разморожена, оказалось, что она все еще пригодна для еды.
Когда молоко, например, хранится в холодильнике, молекулы молока имеют меньше энергии. Это означает, что, хотя молекулы все еще будут сталкиваться с другими молекулами, некоторые из них будут реагировать (что в данном случае означает «испортиться»), потому что молекулы не обладают достаточной энергией для преодоления энергетического барьера активации. Однако молекулы обладают энергией и сталкиваются, поэтому со временем молоко испортится даже в холодильнике. В конце концов, молекулы с более высокой энергией получат энергию, необходимую для реакции, и когда произойдет достаточное количество этих реакций, молоко станет «закисшим».
Однако, если бы та же самая упаковка молока была комнатной температуры, молоко реагировало бы (другими словами, «портилось») намного быстрее. Большинство молекул будет иметь достаточно энергии, чтобы преодолеть энергетический барьер при комнатной температуре, и произойдет гораздо больше столкновений. Это позволяет молоку испортиться за довольно короткое время. Это также причина того, что большинство фруктов и овощей созревают летом, когда температура намного выше. Возможно, вы испытали это на собственном опыте, если когда-нибудь откусили незрелый банан — это, вероятно, было кислым на вкус и, возможно, даже было похоже на то, что укусить кусок дерева! Когда банан созревает, происходят многочисленные реакции, которые производят все соединения, которые мы ожидаем от банана на вкус.Но это может произойти только в том случае, если температура достаточно высока, чтобы позволить этим реакциям производить эти продукты.
Влияние концентрации на скорость реакции
Если бы у вас было замкнутое пространство, например, классная комната, и один красный и один зеленый мяч летали по комнате в случайном движении, претерпевая совершенно упругие столкновения со стенами и друг с другом, за заданный промежуток времени, шары будут сталкиваться друг с другом определенное количество раз, определяемое вероятностью.Если теперь вы поместите два красных шара и один зеленый шар в комнату при одинаковых условиях, вероятность столкновения красного и зеленого шара удвоится. У зеленого шара будет в два раза больше шансов столкнуться с красным шаром за то же время.
В отношении химических реакций существует аналогичная ситуация. Частицы двух газообразных реагентов или двух реагентов в растворе имеют определенную вероятность столкновения друг с другом в реакционном сосуде.Если вы удвоите концентрацию любого из реагентов, вероятность столкновения удвоится. Скорость реакции пропорциональна количеству столкновений в единицу времени. Если удвоить одну концентрацию, удвоится и количество столкновений. Если предположить, что процент успешных коллизий не изменится, то наличие вдвое большего количества коллизий приведет к удвоению количества успешных коллизий. Скорость реакции пропорциональна количеству столкновений с течением времени; увеличение концентрации любого из реагентов увеличивает количество столкновений и, следовательно, увеличивает количество успешных столкновений и скорость реакции.
Например, химический тест, используемый для идентификации газа как кислорода или нет, основан на том факте, что увеличение концентрации реагента увеличивает скорость реакции. Реакция, которую мы называем горением, относится к реакции, в которой горючее вещество реагирует с кислородом. Если мы зажжем деревянную шину (тонкую щепку) в огне, а затем задуваем огонь, шина будет продолжать светиться на воздухе в течение некоторого времени. Если мы вставим эту светящуюся шину в любой газ, не содержащий кислорода, шина немедленно перестанет светиться, то есть реакция прекратится.Кислород — единственный газ, который поддерживает горение, воздух — это примерно \ (20 \% \) газообразный кислород. Если мы возьмем эту светящуюся шину и вставим ее в чистый газообразный кислород, скорость реакции увеличится в пять раз, поскольку чистый кислород имеет в 5 раз большую концентрацию кислорода, чем в воздухе. Когда реакция, происходящая на светящейся шине, увеличивается в пять раз, светящаяся шина внезапно вспыхивает полным пламенем. Этот тест заключается в том, чтобы вставить светящуюся шину в газ, чтобы идентифицировать этот газ как кислород.Только более высокая концентрация кислорода, чем в воздухе, может вызвать возгорание светящейся шины.
Влияние площади поверхности на скорость реакции
Самым первым требованием для прохождения реакции между частицами реагента является столкновение частиц друг с другом. В предыдущем разделе указывалось, как увеличение концентрации реагентов увеличивает скорость реакции, поскольку увеличивает частоту столкновений между частицами. Можно показать, что количество столкновений, которые происходят между частицами реагента, также зависит от площади поверхности твердых реагентов.Рассмотрим реакцию между КРАСНЫМ реагентом и СИНИМ реагентом, в которой синий реагент находится в форме единого комка. Затем сравните это с той же реакцией, где синий реагент был разбит на множество более мелких частей.
На схеме только синие частицы на внешней поверхности комка доступны для столкновения с красным реагентом. Синие частицы внутри комка защищены синими частицами на поверхности. На рисунке A, если вы посчитаете количество синих частиц, доступных для столкновения, вы обнаружите, что только 20 синих частиц могут быть поражены частицей красного реагента.На рисунке A внутри шишки есть несколько синих частиц, по которым невозможно ударить. Однако на рисунке B кусок разбит на более мелкие части, и все внутренние синие частицы теперь находятся на поверхности и доступны для столкновения. На рисунке B будет происходить больше столкновений между синим и красным цветом, и поэтому реакция на рисунке B будет происходить с большей скоростью, чем та же реакция на рисунке A. Увеличение площади поверхности реагента увеличивает частоту столкновений и увеличивает скорость реакции.
Несколько более мелких частиц имеют большую площадь поверхности, чем одна большая частица. Чем больше площадь поверхности доступна для столкновения частиц, тем быстрее будет происходить реакция. Вы можете увидеть пример этого в повседневной жизни, если когда-либо пытались развести огонь в камине. Если вы поднесете спичку к большому бревну в попытке начать запись журнала, вы обнаружите, что это попытка не увенчалась успехом. Если поднести спичку к большому бревну, это не вызовет реакции, достаточной для поддержания огня, обеспечивая достаточную энергию активации для дальнейших реакций.Чтобы разжечь дрова, обычно ломают полено на множество маленьких тонких палочек, называемых растопкой. Эти более тонкие деревянные бруски во много раз превышают площадь одного бревна. Спичка вызовет достаточное количество реакций в растопке, чтобы выделялось достаточно тепла, чтобы обеспечить энергию активации для дальнейших реакций.
К сожалению, были случаи, когда серьезные аварии были вызваны непониманием взаимосвязи между площадью поверхности и скоростью реакции.Один из таких примеров произошел на мукомольных заводах. Пшеничное зерно не горючее. Чтобы сжечь пшеничное зерно, требуются значительные усилия. Однако, если пшеничное зерно измельчается и разлетается по воздуху, достаточно только искры, чтобы вызвать взрыв. Когда пшеница перемалывается для получения муки, она измельчается в мелкий порошок, и часть порошка разлетается в воздухе. Тогда достаточно небольшой искры, чтобы начать очень быструю реакцию, которая может разрушить всю мукомольную мельницу.За 10-летний период с 1988 по 1998 год на мельницах США произошло 129 взрывов пыли. В настоящее время на мукомольных заводах прилагаются усилия к тому, чтобы огромные вентиляторы циркулировали воздух в мельнице через фильтры, чтобы удалить большую часть частиц мучной пыли.
Другой пример — эксплуатация угольных шахт. Уголь, конечно, будет гореть, но чтобы уголь пустили в ход, нужно приложить усилия; когда он горит, он горит медленно, потому что только поверхностные частицы могут столкнуться с частицами кислорода.Внутренние частицы угля должны подождать, пока внешняя поверхность куска угля не сгорит, прежде чем они смогут столкнуться с кислородом. В угольных шахтах огромные блоки угля должны быть разбиты до того, как уголь можно будет извлечь из шахты. В процессе дробления огромных блоков угля используются сверла, чтобы просверлить стены из угля. Это бурение производит мелкую угольную пыль, которая смешивается с воздухом; тогда искра от инструмента может вызвать мощный взрыв в шахте. На угольных шахтах бывают взрывы по другим причинам, но взрывы угольной пыли привели к гибели многих шахтеров.На современных угольных шахтах разбрызгиватели газонов используются для распыления воды в воздухе шахты, что уменьшает количество угольной пыли в воздухе и исключает взрывы угольной пыли.
Влияние катализатора на скорость реакции
Последним фактором, влияющим на скорость реакции, является влияние катализатора. Катализатор — это вещество, которое увеличивает скорость реакции, но не расходуется на саму реакцию.
В реакции разложения хлората калия на хлорид калия и кислород доступен катализатор, который заставляет эту реакцию протекать намного быстрее, чем она могла бы протекать сама по себе в комнатных условиях.Реакция:
\ [2 \ ce {KClO_3} \ left (s \ right) \ overset {\ ce {MnO_2} \ left (s \ right)} {\ longrightarrow} 2 \ ce {KCl} \ left (s \ right) + 3 \ ce {O_2} \ left (g \ right) \]
Катализатором является диоксид марганца, и его присутствие заставляет реакцию, показанную выше, протекать во много раз быстрее, чем это происходит без катализатора. Когда реакция завершится, \ (\ ce {MnO_2} \) можно удалить из реакционного сосуда, и его состояние будет точно таким же, как и до реакции.Это часть определения катализатора — он не расходуется в реакции. Следует отметить, что катализатор не записывается в уравнение как реагент или продукт, но отмечен над стрелкой выхода. Это стандартное обозначение для использования катализатора.
Без катализатора некоторые реакции протекают очень медленно. Другими словами, энергия активации этих реакций очень высока. Когда катализатор добавляется, энергия активации снижается, поскольку катализатор обеспечивает новый путь реакции с более низкой энергией активации.
На рисунке справа эндотермическая реакция показывает каталитическую реакцию красным цветом с более низкой энергией активации, обозначенной \ (\ text {E} ‘_ a \). Новый путь реакции имеет более низкую энергию активации, но не влияет на энергию реагентов, продуктов или значение \ (\ Delta H \). То же верно и для экзотермической реакции. Энергия активации каталитической реакции ниже, чем у некаталитической реакции. Новый путь реакции, обеспечиваемый катализатором, влияет на энергию, необходимую для разрыва связей реагентов и образования связей продукта.\ text {o} \ text {C} \). Конечно, бывают случаи, например, когда организм борется с инфекцией, когда температура тела может повышаться. Но в целом у здорового человека температура вполне стабильная. Однако многие реакции, от которых зависит здоровое тело, никогда не могут возникнуть при температуре тела. Ответ на эту дилемму — катализаторы, также называемые ферментами. Многие из этих ферментов производятся в клетках человека, потому что ДНК человека содержит указания по их созданию. Однако есть некоторые ферменты, необходимые организму, которые не производятся клетками человека.Эти катализаторы должны поступать в наш организм с пищей, которую мы едим, и называются витаминами.
Обратимые реакции
Обычно, когда мы думаем о химической реакции, мы думаем о том, что реагенты полностью израсходованы, так что ничего не остается, и что в итоге мы получаем только продукты. Кроме того, мы обычно рассматриваем химические реакции как односторонние события. Вы, возможно, уже узнали на предыдущих занятиях по естествознанию, что это один из способов отличить химические изменения от физических изменений — физические изменения (например, таяние и замерзание льда) легко обратить, но химические изменения не повернуть вспять (довольно сложно отменить) обжарить яйцо).
В этом разделе мы увидим, что это не всегда так. Мы увидим, что многие химические реакции на самом деле обратимы при правильных условиях. И поскольку многие реакции могут быть обращены вспять, наше представление о реакции, заканчивающейся без остатков реагентов, а только с продуктами, необходимо будет изменить.
Вот несколько примеров реакций, которые можно обратить:
1. Двуокись азота \ (\ ce {NO_2} \), красновато-коричневый газ, реагирует с образованием бесцветного четырехокиси азота, \ (\ ce {N_2O_4} \):
\ (\ ce {2NO_2 (g) \ rightarrow N_2O_4 (g)} \)
Но реакция может идти и по другому пути — четырехокись азота также легко распадается с образованием двуокиси азота:
\ (\ ce {N_2O_4 (g) \ rightarrow 2NO_2 (g)} \)
Обычно мы пишем реакцию, которая может идти в обоих направлениях, используя двойную стрелку (которая иногда отображается как ↔ в этих онлайн-заметках):
\ (\ ce {2NO_2 (g) \ leftrightarrow N_2O_4 (g)} \)
Поскольку реакция продолжается в обоих направлениях одновременно, у нас никогда не заканчивается \ (\ ce {NO_2} \) или \ (\ ce {N_2O_4} \) . \ (\ ce {NO_2} \) постоянно используется для формирования \ (\ ce {N_2O_4} \), но в то же время \ (\ ce {N_2O_4} \) формирует еще \ (\ ce {NO_2 } \)
2. При пропускании газообразного водорода над нагретым оксидом железа образуются железо и пар:
(1) \ (\ ce {Fe_3O_4 (s) + 4H_2 (g) \ rightarrow 3Fe (s) + 4H_2O (g)} \) При пропускании пара через раскаленный утюг может возникнуть обратная реакция: (2) \ (\ ce {3Fe (s) + 4H_2O (g) \ rightarrow Fe_3O_4 (s) + 4H_2 (g)} \) Мы можем записать эти два уравнения вместе как: (3) \ (\ ce {Fe_3O_4 (s) + 4H_2 (g) \ leftrightarrow 3Fe (s) + 4H_2O (g)} \) Когда у нас есть обратимая реакция, записанная таким образом, мы должны иметь возможность различать, в какую сторону идет реакция.Как написано выше в реакции (3), мы бы сказали, что в прямой реакции оксид железа и газообразный водород, реагенты, производят железо и водяной пар.
Во время обратной реакции железо реагирует с паром с образованием продуктов оксида железа и газообразного водорода.
Важно понимать терминологию и правильно использовать термины.
Имеет ли значение, как мы пишем обратимую реакцию? Его также можно записать как
\ (\ ce {3Fe (s) + 4H_2O (g) \ leftrightarrow Fe_3O_4 (s) + 4H_2 (g)} \)
Итак, железо и водяной пар являются реагентами прямого направления, а оксид железа и газообразный водород — реагентами обратного направления.
Резюме
- Теория столкновений объясняет, почему происходят реакции между атомами, ионами и молекулами.
- Для того, чтобы реакция была эффективной, частицы должны сталкиваться с достаточной энергией и иметь правильную ориентацию.
- С повышением температуры увеличивается энергия, которая может быть преобразована в энергию активации при столкновении, что увеличивает скорость реакции. Снижение температуры имело бы противоположный эффект.
- С повышением температуры увеличивается количество столкновений.
- Увеличение концентрации реагента увеличивает частоту столкновений между реагентами и, следовательно, увеличивает скорость реакции.
- Увеличение площади поверхности реагента (путем разрушения твердого реагента на более мелкие частицы) увеличивает количество частиц, доступных для столкновения, и увеличит количество столкновений между реагентами в единицу времени.
- Катализатор — это вещество, которое ускоряет скорость реакции, но не расходуется на саму реакцию. Когда добавляется катализатор, энергия активации снижается, поскольку катализатор обеспечивает новый путь реакции с более низкой энергией активации.
Словарь
- Катализатор — вещество, которое ускоряет скорость реакции, но не расходуется на саму реакцию.
- Отношение площади поверхности к объему — Сравнение объема внутри твердого тела с площадью, открытой на поверхности.
Дополнительная литература / Дополнительные ссылки
- Энергия активации: http://www.mhhe.com/physsci/chemistr…sh/activa2.swf
- Learner.org/resources/series61.html Веб-сайт Learner.org позволяет пользователям просматривать потоковое видео из серии видеороликов по химии Анненберга. Вы должны зарегистрироваться, прежде чем вы сможете смотреть видео, но это бесплатно. На веб-сайте есть одно видео, относящееся к этому уроку, под названием Molecules in Action .
- www.vitamins-guide.net
- en.Wikipedia.org/wiki
- Наблюдение за молекулами во время химических реакций помогает объяснить роль катализаторов. Также демонстрируется динамическое равновесие. Молекулы в действии (www.learner.org/vod/vod_window.html?pid=806)
- Наука о поверхности изучает, как поверхности взаимодействуют друг с другом на молекулярном уровне. На поверхности (www.learner.org/vod/vod_window.html?pid=812)
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
11.6: Скорости реакций — Chemistry LibreTexts
Результаты обучения
- Определите скорость реакции.
- Дайте определение катализатору и объясните его поведение в химической реакции.
- Опишите, как температура, концентрация или давление реагента и катализатора влияют на скорость реакции.
- Объясните понятие энергии активации.
- Обозначьте диаграмму с реагентами, продуктами, энтальпией прямых и обратных реакций, энергией активации прямых и обратных реакций и активированным комплексом.
- Рассчитайте энтальпию и энергию активации, используя данные на диаграмме реакции.
Химическая кинетика — это исследование скорости химических реакций. В этом уроке вы узнаете, как выразить скорость химической реакции и о различных факторах, которые влияют на скорость реакции.
Выражение скорости реакции
Химические реакции сильно различаются по скорости. Некоторые реакции происходят очень быстро. Когда зажженная спичка соприкасается с жидкостью для зажигалок или другой легковоспламеняющейся жидкостью, она мгновенно воспламеняется и быстро горит.Остальные реакции происходят очень медленно. Емкость с молоком в холодильнике можно пить в течение нескольких недель, прежде чем оно начнет скисать. Потребовались миллионы лет, чтобы мертвые растения под поверхностью Земли накапливались и в конечном итоге превратились в ископаемое топливо, такое как уголь и нефть.
Химики должны интересоваться скоростью, с которой происходят химические реакции. Скорость — это еще одно слово, обозначающее скорость. Если спринтеру требуется 11,0 секунд \ (\ left (s \ right) \), чтобы пробежать 100-метровый (\ left (m \ right) \) рывок, его темп или скорость определяется как пройденное расстояние, деленное на время (см. рисунок ниже).
\ [\ text {speed} = \ frac {\ text {distance}} {\ text {time}} = \ frac {100 \: \ text {m}} {11.0 \: \ text {s}} = 9.09 \: \ text {m / s} \]
Средняя скорость бега спринтера на забеге равна \ (9.09 \: \ text {м / с} \). Мы говорим, что это его средний темп, потому что он не бегал с такой скоростью за всю гонку. В самом начале гонки, когда он выходит из состояния покоя, его темп должен быть ниже, пока он не сможет набрать максимальную скорость. Его максимальная скорость должна быть больше, чем \ (9.09 \: \ text {m / s} \), чтобы средняя скорость за всю гонку была равна \ (9.09 \: \ text {m / s} \).
Рисунок \ (\ PageIndex {1} \): Усэйн Болт установил мировой рекорд в беге на 100 метров в 2009 году со временем 9,58 секунды. Его средняя скорость бега на протяжении этой гонки была \ (10,4 \: \ text {m / s} \) или \ (23,4 \: \ text {mph} \).Химические реакции нельзя измерить в метрах в секунду, поскольку в этом нет никакого смысла. Скорость реакции — это изменение концентрации реагента или продукта во времени . Предположим, что должна была произойти простая реакция, в которой 1.00 молярный \ (\ left (\ text {M} \ right) \) водный раствор вещества \ (\ ce {A} \) был преобразован в вещество \ (\ ce {B} \).
\ [\ ce {A} \ left (aq \ right) \ rightarrow \ ce {B} \ left (aq \ right) \]
Предположим, что через 20,0 секунд концентрация \ (\ ce {A} \) упала с \ (1.00 \: \ text {M} \) до \ (0.72 \: \ text {M} \), как это было превращается в вещество \ (\ ce {B} \). Мы можем выразить скорость этой реакции как изменение концентрации \ (\ ce {A} \), деленное на время.
\ [\ text {rate} = — \ frac {\ Delta \ left [\ ce {A} \ right]} {\ Delta t} = — \ frac {\ left [\ ce {A} \ right] _ \ текст {final} — \ left [\ ce {A} \ right] _ \ text {initial}} {\ Delta t} \]
Скобка вокруг символа или формулы означает молярную концентрацию этого вещества.Изменение концентрации \ (\ ce {A} \) — это его конечная концентрация минус его начальная концентрация. Поскольку концентрация \ (\ ce {A} \) со временем уменьшается, используется отрицательный знак. Таким образом, скорость реакции положительна, и единицы измерения — молярность в секунду или \ (\ text {M / s} \).
\ [\ text {rate} = — \ frac {0.72 \: \ text {M} — 1.00 \: \ text {M}} {20.0 \: \ text {s}} = — \ frac {-0.28 \: \ text {M}} {20.0 \: \ text {s}} = 0,041 \: \ text {M / s} \]
В течение первых 20,0 секунд этой реакции молярность \ (\ ce {A} \) снижается в среднем на \ (0.041 \: \ text {M} \) каждую секунду. Таким образом, скорость химической реакции измеряется изменением концентрации реагента или продукта во времени. Единицей измерения скорости реакции является молярность в секунду \ (\ left (\ text {M / s} \ right) \).
Теория столкновений
Поведение реагирующих атомов, молекул или ионов отвечает за скорость данной химической реакции. Теория столкновений — это набор принципов, основанных на идее, что частицы реагента образуют продукты, когда они сталкиваются друг с другом, но только тогда, когда эти столкновения имеют достаточную кинетическую энергию и правильную ориентацию, чтобы вызвать реакцию. Частицы, у которых отсутствует необходимая кинетическая энергия, могут сталкиваться, но частицы просто отскакивают друг от друга без изменений. Рисунок ниже иллюстрирует разницу. При первом столкновении частицы отскакивают друг от друга, и перегруппировки атомов не происходит. Второе столкновение происходит с большей кинетической энергией, и поэтому связь между двумя красными атомами разрывается. Один красный атом связывается с другой молекулой как один продукт, а один красный атом — другой продукт. Первое столкновение называется неэффективным, а второе — эффективным.
Рисунок \ (\ PageIndex {2} \): (A) Неэффективное столкновение — это такое столкновение, которое не приводит к образованию продукта. (B) Эффективное столкновение — это такое столкновение, при котором химические связи разрываются и образуется продукт.Подача энергии частицам реагента заставляет связи между атомами колебаться с большей частотой. Это увеличение колебательной энергии увеличивает вероятность разрыва химической связи и возникновения химической реакции, когда эти частицы сталкиваются с другими частицами.Кроме того, более энергичные частицы имеют более сильные столкновения, что также увеличивает вероятность того, что произойдет перегруппировка атомов. Энергия активации для реакции — это минимальная энергия, которой должны обладать сталкивающиеся частицы, чтобы пройти реакцию . Некоторые реакции легко протекают при комнатной температуре, поскольку большинство реагирующих частиц уже имеют необходимую энергию активации при этой температуре. Другие реакции происходят только при нагревании, потому что у частиц недостаточно энергии для реакции, если только больше не обеспечивается внешним источником тепла.
Диаграммы потенциальной энергии
Затем изменения энергии, происходящие во время химической реакции, могут быть показаны на диаграмме, называемой диаграммой потенциальной энергии, иногда называемой кривой хода реакции. Диаграмма потенциальной энергии показывает изменение потенциальной энергии системы при преобразовании реагентов в продукты . На рисунке ниже показаны основные диаграммы потенциальной энергии для эндотермической (слева) и экзотермической (справа) реакций. Напомним, что изменение энтальпии \ (\ left (\ Delta H \ right) \) положительно для эндотермической реакции и отрицательно для экзотермической реакции.Это можно увидеть на диаграммах потенциальной энергии. Полная потенциальная энергия системы увеличивается для эндотермической реакции, поскольку система поглощает энергию из окружающей среды. Полная потенциальная энергия системы уменьшается для экзотермической реакции, поскольку система выделяет энергию в окружающую среду.
Рисунок \ (\ PageIndex {3} \): Диаграмма потенциальной энергии показывает полную потенциальную энергию реагирующей системы по мере протекания реакции. (Слева) В эндотермической реакции энергия продуктов больше, чем энергия реагентов, и \ (\ Delta H \) положительна.(Справа) В экзотермической реакции энергия продуктов ниже, чем энергия реагентов, и \ (\ Delta H \) отрицательна.Энергия активации реакции показана на диаграмме потенциальной энергии высотой холма между реагентами и продуктами. По этой причине энергию активации реакции иногда называют барьером энергии активации. Реагирующие частицы должны обладать достаточной энергией, чтобы при столкновении они могли преодолеть этот барьер (см. Рисунок ниже).
Рисунок \ (\ PageIndex {4} \): Энергия активации \ (\ left (E_a \ right) \) реакции — это барьер, который необходимо преодолеть, чтобы реагенты стали продуктами. (A) Энергия активации низкая, что означает, что реакция, вероятно, будет быстрой. (B) Энергия активации высокая, что означает, что реакция, вероятно, будет медленной.Как обсуждалось ранее, частицы реагента иногда сталкиваются друг с другом, но остаются неизменными в результате столкновения. В других случаях столкновение приводит к образованию продуктов.{-13} \: \ text {s} \)). Активированный комплекс с одинаковой вероятностью либо преобразует исходные реагенты, либо продолжит образование продуктов. На рисунке ниже показано образование возможного активированного комплекса между сталкивающимися молекулами водорода и кислорода. Из-за их нестабильной природы и недолгого существования очень мало известно о точных структурах большинства активированных комплексов.
Рисунок \ (\ PageIndex {5} \): Активированный комплекс — это короткоживущее состояние, в котором сталкивающиеся частицы находятся на пике кривой потенциальной энергии.Факторы, влияющие на скорость реакции
По своей природе одни реакции происходят очень быстро, а другие — очень медленно. Однако определенные изменения в условиях реакции могут повлиять на скорость данной химической реакции. Теория столкновений может быть использована для объяснения этих эффектов скорости.
Концентрация
Увеличение концентрации одного или нескольких реагирующих веществ обычно увеличивает скорость реакции. Когда в заданном объеме пространства присутствует больше частиц, между этими частицами, естественно, произойдет большее количество столкновений.Поскольку скорость реакции зависит от частоты столкновений между реагентами, скорость увеличивается с увеличением концентрации.
Давление
Когда давление газа увеличивается, его частицы сближаются, уменьшая количество пустого пространства между ними. Следовательно, повышение давления газа — это также увеличение концентрации газа. Для газообразных реакций повышение давления увеличивает скорость реакции по тем же причинам, что и для увеличения концентрации, описанные выше.Более высокое давление газа приводит к более высокой частоте столкновений между реагирующими частицами.
Площадь
Большое бревно, помещенное в огонь, горит относительно медленно. Если добавить в огонь ту же массу дров в виде маленьких веточек, они сгорят намного быстрее. Это потому, что прутья обеспечивают большую поверхность, чем бревно. Увеличение площади поверхности реагента увеличивает скорость реакции. Площадь поверхности больше, когда определенное количество твердого вещества присутствует в виде более мелких частиц.Порошкообразный реагент имеет большую площадь поверхности, чем такой же реагент, как твердый кусок. Чтобы увеличить площадь поверхности вещества, его можно измельчить на более мелкие частицы или растворить в жидкости. В растворе растворенные частицы отделяются друг от друга и быстрее реагируют с другими реагентами. На рисунке ниже показан нежелательный результат нежелательной реакции горения — большая площадь поверхности. Мелкие частицы зерновой пыли очень чувствительны к быстрой реакции с кислородом, что может привести к сильным взрывам и быстрому возгоранию.
Рисунок \ (\ PageIndex {6} \): Этот элеватор в Канзасе взорвался в 1998 году. Крошечный размер реагирующих частиц (зерновая пыль) вызывал взрывоопасную реакцию с кислородом в воздухе.Температура
Повышение температуры химической реакции приводит к увеличению скорости реакции. Когда частицы реагента нагреваются, они движутся все быстрее и быстрее, что приводит к увеличению частоты столкновений. Еще более важным эффектом повышения температуры является то, что столкновения происходят с большей силой, а это означает, что реагенты с большей вероятностью преодолеют энергетический барьер активации и продолжат образовывать продукты.Повышение температуры реакции увеличивает не только частоту столкновений, но и процент этих столкновений, которые являются эффективными, что приводит к увеличению скорости реакции.
Бумага, безусловно, является легковоспламеняющимся материалом, но бумага не горит при комнатной температуре, потому что энергия активации реакции слишком высока. Подавляющее большинство столкновений молекул кислорода с бумагой неэффективны. Однако, когда бумага нагревается пламенем спички, она достигает точки, когда у молекул теперь достаточно энергии для реакции.Реакция очень экзотермична, поэтому выделяющееся при начальной реакции тепло обеспечивает достаточно энергии, чтобы реакция продолжалась, даже если спичку убрать. Бумага продолжает быстро гореть, пока не исчезнет.
Катализаторы
Скорость некоторых химических реакций может быть резко увеличена путем введения в реакционную смесь некоторых других веществ. Перекись водорода используется в качестве дезинфицирующего средства для ссадин и порезов, и ее можно найти во многих аптечках в виде 3% водного раствора.Перекись водорода естественным образом разлагается с образованием воды и кислорода, но реакция идет очень медленно. Бутылки с перекисью водорода хватит на несколько лет, прежде чем ее нужно будет заменить. Однако добавление небольшого количества оксида марганца (IV) к перекиси водорода приведет к ее полному разложению всего за несколько минут. Катализатор — это вещество, которое увеличивает скорость химической реакции, но не используется в реакции . Он выполняет эту задачу, обеспечивая альтернативный путь реакции, который имеет более низкий энергетический барьер активации.После того, как реакция происходит, катализатор возвращается в исходное состояние, поэтому катализаторы можно использовать снова и снова. Поскольку он не является ни реагентом, ни продуктом, катализатор показан в химическом уравнении над стрелкой выхода.
\ [2 \ ce {H_2O_2} \ left (aq \ right) \ overset {\ ce {MnO_2}} {\ rightarrow} 2 \ ce {H_2O} \ left (l \ right) + \ ce {O_2} \ left (г \ вправо) \]
Катализатор работает, изменяя механизм реакции, который можно рассматривать как конкретный набор более мелких стадий, в результате которых реагенты становятся продуктами.Важным моментом является то, что использование катализатора снижает общую энергию активации реакции (см. Рисунок ниже). При более низком энергетическом барьере активации больший процент молекул реагентов способен вступать в эффективные столкновения, и скорость реакции увеличивается.
Рисунок \ (\ PageIndex {7} \): Добавление катализатора в реакцию снижает энергию активации, увеличивая скорость реакции. Энергия активации некаталитической реакции показана как \ (E_a \), а катализируемая реакция обозначена как \ (E_a ‘\).Теплота реакции \ (\ left (\ Delta H \ right) \) не изменяется в присутствии катализатора.Катализаторы — чрезвычайно важные составляющие многих химических реакций. Ферменты в вашем теле действуют как природные катализаторы, позволяя важным биохимическим реакциям протекать с разумной скоростью. Химические компании постоянно ищут новые и лучшие катализаторы, чтобы ускорить реакцию и, таким образом, сделать компанию более прибыльной.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Султ, Ph.D. (Департамент химии, Университет Кентукки)
Химия — Скорость реакции
Скорость реакции — мощный диагностический инструмент. Узнав, как быстро производятся продукты и что вызывает замедление реакции, мы можем разработать методы улучшения производства. Эта информация необходима для крупномасштабного производства многих химикатов, включая удобрения, лекарства и бытовые чистящие средства.
Как мы отслеживаем скорость реакции?
Во-первых, важно понять, что такое скорость реакции. Когда происходит реакция, молекулы сталкиваются друг с другом с достаточной энергией для того, чтобы реагенты расщеплялись или превращались в новый вид, известный как продукт (часто существует более одного продукта). Таким образом, скорость реакции — это фактически скорость образования продукта, а также скорость, с которой расходуется реагент. Поскольку реакции требуют, чтобы молекулы преодолели определенный энергетический барьер для успешного столкновения, скорость реакции часто указывает, являются ли условия адекватными для того, чтобы это произошло.Например, низкая скорость реакции может указывать на то, что не многие столкновения происходят с силой, достаточной для разрыва химических связей реагентов, поэтому продукт не производится так быстро. Если это известно, производители могут исследовать лучший способ увеличения числа успешных столкновений молекул для увеличения выхода.
Итак, важно уметь измерять скорость реакции, но как это сделать? Было бы очень сложно контролировать производимое или используемое конкретное химическое вещество, поскольку реакции часто представляют собой запутанную смесь, но довольно часто мы можем наблюдать очевидные побочные эффекты, которые легко измерить.Например, экзотермическая реакция может выделять тепло, и мы можем отслеживать изменение температуры во времени. При других реакциях, таких как добавление соляной кислоты к образцу магния, образуется газообразный водород. Это вызывает шипение (шикарное название пузырей!). Пузырьки можно легко подсчитать, и сравнение количества пузырьков, образовавшихся за установленное время, когда вы изменяете другой аспект реакции, такой как температура или концентрация кислоты, позволяет нам увидеть, как изменяется скорость реакции.
Другой распространенный эксперимент A Level, с которым вы можете столкнуться, — это часы с йодом.На этот раз за реакцией следят, записывая, сколько времени нужно, чтобы увидеть изменение цвета раствора, что объясняется в видео ниже. Во избежание ложных результатов важно убедиться, что в экспериментах все одинаково, за исключением изменяемой переменной, в данном случае концентрации тиосульфата. Может помочь работа в парах: один человек нажимает на таймер, а другой запускает реакцию, так что вы можете запускать часы в одной и той же точке для каждого эксперимента.
Почему нам нужно знать скорость реакции?
Скорость реакции
Уравнение скорости реакции
Это то, что всех заставляет нервничать; уравнения! Они могут выглядеть сложными, а иногда и совершенно другим языком, но на самом деле они очень полезны.Они позволяют нам определить, какие реагенты отвечают за скорость реакции, на основе очень простых экспериментальных измерений, подобных упомянутым выше.
Во время экзамена или в классе вам может быть предоставлена таблица данных, которая показывает, как изменяется скорость реакции, когда вы меняете концентрацию каждого из реагентов. На основе этой информации мы можем составить уравнение скорости.
Скоростные уравнения имеют вид:
k — константа скорости.Это значение, которое говорит нам, насколько быстрой или медленной является реакция. Поскольку на скорость реакции может влиять ряд переменных, таких как температура или концентрация реагента, константа скорости также будет изменяться. Все, что находится в квадратных скобках ([]), означает, что мы имеем в виду концентрацию реагента в скобках, в данном случае концентрацию A и B. Последние две буквы, m и n, даны как степени концентрации. . Числа, которые заменяют m и n, показывают, как скорость зависит от индивидуального реагента.Это известно как порядок реакции для данного вида.
Если скорость реакции не меняется при изменении концентрации A, тогда мы знаем, что скорость не зависит от A. В этом случае мы можем записать m как ноль и сказать, что порядок относительно A равен нулю. Все, что находится в нулевой степени, равно единице, и поэтому мы можем удалить это, поскольку мы просто умножаем остальную часть уравнения скорости на единицу. Это просто!
Для реакций первого порядка m равно единице. Поскольку A равно степени 1, мы можем просто написать [A].На практике это означает, что по мере увеличения концентрации A скорость реакции будет увеличиваться в той же пропорции, например, если вы удвоите количество A, скорость также удвоится. Тот же принцип применяется к реакции второго порядка, но на этот раз m равно 2, поэтому, если вы удвоите A, у вас будет вдвое больше исходного количества A в степени 2, а 22 равно 4. Таким образом, если вы удвоите A, коэффициент реакции увеличится в четыре раза.
Отлично, так что готово, а как насчет B? Что ж, это то же самое, что облегчает жизнь каждому! Вас никогда не попросят заказать более двух реагентов, и если реагентов больше двух, не беспокойтесь, просто добавьте их, как вы это делали с A и B.
Лабораторные признания
Исследователи подкаста In the Laboratory Confessions рассказывают о своем лабораторном опыте в контексте практических экзаменов A Level. В этом эпизоде мы рассмотрим соответствующее устройство для записи измерений и измерения скорости реакции с помощью методов непрерывного мониторинга и начальной скорости.
Скорость реакции в промышленности
Возможность интерпретации данных о скорости реакции имеет важное значение во многих областях производства и исследований.Одно из самых важных отраслевых приложений — это процесс Haber, который вы, возможно, изучали на GCSE или A Level. Это включает в себя преобразование газообразного азота и водорода в аммиак, а аммиак имеет широкий спектр применения — от чистящих средств до оружия. Контролируя скорости, Хабер обнаружил, что скорость реакции во многом зависит от того факта, что тройную связь в азоте действительно трудно разорвать. Он и его помощник смогли разработать катализаторы, которые позволили этому процессу протекать гораздо быстрее.Этому процессу 100 лет, но он используется до сих пор!
Следующие шаги
Эти ссылки предоставлены только для удобства и в информационных целях; они не означают одобрения или одобрения Бирмингемским университетом какой-либо информации, содержащейся на внешнем веб-сайте. Бирмингемский университет не несет ответственности за точность, законность или содержание внешнего сайта или за содержание последующих ссылок. Пожалуйста, свяжитесь с внешним сайтом для получения ответов на вопросы относительно его содержания.
Скоростей Реакции | Безграничная химия
Измерение скорости реакции
Скорость реакции определяется путем наблюдения за изменениями концентраций реагентов или продуктов в течение определенного периода времени.
Цели обучения
Составьте выражения для скоростей при заданных химических реакциях и обсудите методы измерения этих скоростей
Основные выводы
Ключевые моменты
- Скорость реакции рассчитывается по формуле скорость = Δ [C] / Δt, где Δ [C] — изменение концентрации продукта за период времени Δt.
- За скоростью реакции можно наблюдать, наблюдая за исчезновением реагента или появлением продукта с течением времени.
- Если в результате реакции образуется газ, такой как кислород или диоксид углерода, есть два способа измерения скорости реакции: использование газового шприца для измерения произведенного газа или расчет уменьшения массы реакционного раствора.
- Если в результате реакции образуется осадок, образовавшееся количество можно использовать для определения скорости реакции путем измерения того, сколько времени требуется, чтобы образовавшийся осадок скрыл видимость креста через коническую колбу.
Ключевые термины
- скорость реакции : насколько быстро или медленно происходит реакция.
- газовый шприц : Элемент лабораторного оборудования, используемый для забора газа из закрытой химической системы для измерения и / или анализа.
- продукт : Химическое вещество, образующееся в результате химической реакции.
Скорость реакции
За скоростью реакции обычно наблюдают, наблюдая за исчезновением реагента или появлением продукта в течение заданного периода времени.Возьмем химическую реакцию:
[латекс] \ text {A} + 2 \ text {B} \ rightarrow 3 \ text {C} [/ latex]
Здесь скорость появления продукта C на временном интервале Δt составляет:
[латекс] \ text {средняя скорость} = \ frac {\ Delta \ text {C}} {\ Delta \ text {t}} [/ latex]
Концентрация C [C] обычно выражается в моль / литр. Это средняя скорость появления C за интервал времени Δt. Предел этой средней скорости по мере того, как временной интервал становится меньше, называется скоростью появления C в момент времени t, и это наклон кривой [C] в зависимости от t в момент времени t.Этот мгновенный наклон или скорость записывается как [латекс] \ frac {\ text {d} [\ text {C}]} {\ text {dt}} [/ latex]. Поскольку одна молекула A и две молекулы B расходуются на каждые три производимые молекулы C, скорости исчезновения и появления этих химических соединений различны, но связаны между собой.
Скорость исчезновения и появления химических частиц : Это выражение связывает скорости исчезновения и появления химических частиц в реакции A + 2B -> 3C.
Измерение скорости реакции
Способ измерения скорости реакции будет зависеть от того, что это за реакция и какой продукт образуется. В следующих примерах описаны различные способы измерения скорости реакции.
Реакции, в результате которых образуются газы, такие как кислород или диоксид углерода
Перекись водорода разлагается с образованием кислорода:
[латекс] 2 \ text {H} _2 \ text {O} _2 (\ text {aq}) \ rightarrow 2 \ text {H} _2 \ text {O} (\ text {l}) + \ text {O } _2 (\ text {g}) [/ latex]
Объем произведенного кислорода можно измерить с помощью газового шприца.Газ собирается в шприце, выталкиваясь из поршня. Объем произведенного газа можно определить по отметкам на шприце. Это изменение объема можно преобразовать в изменение концентрации ([латекс] \ Delta [\ text {C}] [/ latex]) и разделить его на время реакции ([латекс] \ Delta \ text {t } [/ latex]) даст среднюю скорость реакции.
Метод газового шприца : В реакции, в которой образуется газ, объем произведенного газа можно измерить с помощью метода газового шприца.
Изменения массы
Скорость реакции, при которой образуется газ, также можно измерить путем расчета потери массы при образовании и выходе газа из реакционной колбы. Этот метод можно использовать для реакций, в которых выделяется диоксид углерода или кислород, но он не очень точен для реакций с выделением водорода, поскольку масса слишком мала для точного измерения. Измерение изменения массы также может быть подходящим для других типов реакций.
Реакция осаждения
В реакции, в которой образуется осадок, количество осадка, образовавшегося за период времени, можно использовать в качестве меры скорости реакции.Например, когда тиосульфат натрия реагирует с кислотой, образуется желтый осадок серы. Эта реакция записывается так:
[латекс] \ text {Na} _2 \ text {S} _2 \ text {O} _3 (\ text {aq}) + 2 \ text {HCl} (\ text {aq}) \ rightarrow 2 \ text {NaCl } (\ text {aq}) + \ text {SO} _2 (\ text {aq}) + \ text {H} _2 \ text {O} (\ text {l}) + \ text {S} (\ text {s}) [/ латекс]
Один из способов оценить скорость этой реакции — это унести
.
