Практическая работа №1 Качественное определение углерода, водорода и хлора в органических веществах
Отчёт о практической работе ( отправить по адресу [email protected])Дата выполнения ________________________________
Фамилия, Имя ___________________________________
Практическая работа № 1
Качественное определение углерода, водорода и хлора в органических веществах
Цели: научиться определять углерод, водород, хлор в органических соединениях
Реактивы: парафин, оксид меди (II), сульфат меди (II), известковая вода, медная проволока, хлороформ.
Посуда и оборудование: лабораторный штатив (или проборкодержатель), пробирки, пробка с газоотводной трубкой, спиртовка, спички, вата.
Ход работы:
Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II) просмотрев ресурс
http://files.school-collection.edu.ru/dlrstore/0abb6278-4185-11db-b0de-0800200c9a66/x10_039.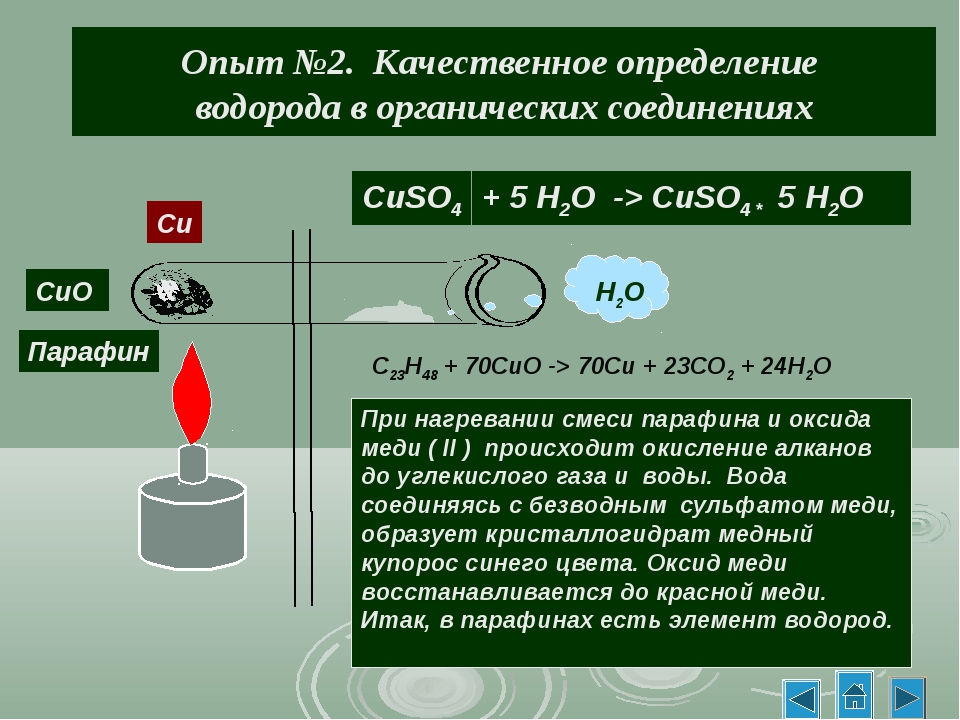
Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
Наблюдения:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
СnH2n+2 + (3n+1) CuO → n CO2↑ + (n+1) H2O + (3n+1) Cu
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
СО2 + Cа(OН)2 → СаCO3↓ + H2O
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.
Вывод: по продуктам окисления парафина СО2 и H2
Ответьте на вопросы:
1. Почему помутнел раствор известковой воды?
Напишите уравнение реакции, считая условно формулу парафина С16Н34.
2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая, что безводному сульфату меди (П) присоединяется 5 молекул воды.
3.Что произошло с чёрным порошком оксида меди (П).
Сделайте выводы.
Опыт №2. Качественное определение хлора в молекулах галогенопроизводных углеводородов
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Сделайте вывод.
4. Оформите работу:
| № и название опыта | Что наблюдали? | УХР.  Выводы Выводы |
5. Приведите в порядок своё рабочее место.
Методическая разработка урока по органической химии «Качественное определение углерода, водорода и хлора в органических соединений» | План-конспект урока по химии (10 класс) на тему:
ПРАКТИЧЕСКАЯ РАБОТА №1.
Название работы: ________________________________________________
Цель работы: _____________________________________________________
__________________________________________________________________
С техникой безопасности знаком (а) ___________________________
Действия | Наблюдения | Уравнения реакций. Выводы |
Опыт №1. Определение углерода и водорода | Ca(OH)2 + CO2 → CuSO4 + 5h3O → C16h44 + CuO | |
Опыт №2. |
Вывод:___________________________________________________________________________________________________________________________________________________________________________________________________________________
Приведите рабочее место в порядок. Оценка ______________
ИНСТРУКЦИЯ К ПРАКТИЧЕСКОЙ РАБОТЕ № 1
КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ УГЛЕРОДА, ВОДОРОДА И ХЛОРА В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
ЦЕЛЬ РАБОТЫ:научиться определять углерод, водород и хлор в органических соединениях.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди(II), известковая вода, прокаленный сульфат меди(II), медная проволочка 10 см., раствор тетрахлорметана.
ИНСТРУКЦИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ:
1.Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.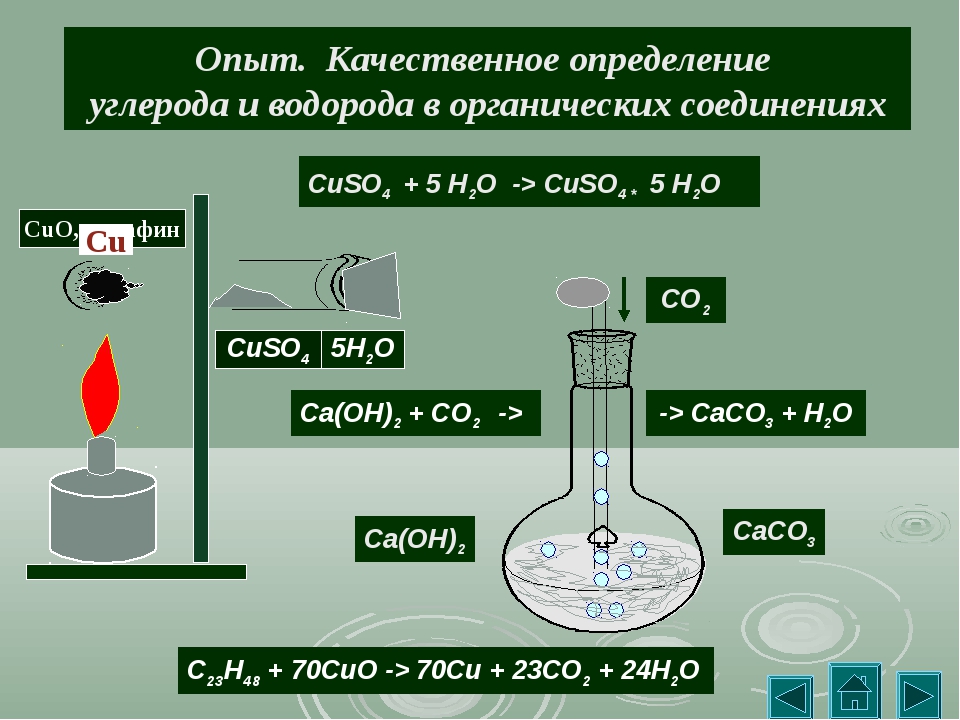
2.Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
3.Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей, избегая выбрасывания жидкости.
4.Не наклоняйтесь над нагреваемой пробиркой.
5.При пользовании нагревательным прибором запрещается:
— передача зажженного нагревательного прибора.
— зажигание одного нагревательного прибора от другого.
6.Гасите только накрывая пламя колпачком.
7.Выньте газоотводную трубку из пробирки с водой, не прекращая нагревания пробирки с веществом , в противном случае воду из пробирки может перебросить в раскаленную пробирку с веществом!
ХОД РАБОТЫ:
Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II)
Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
При протекании реакции:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.
Опыт №2. Качественное определение хлора в молекулах галогенопроизводных углеводородов
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
качественное определение углерода, водорода в органических соединениях | Учебно-методический материал по химии по теме:
Цели: научиться определять углерод, водород, хлор в органических соединениях
Реактивы: парафин, оксид меди (II), сульфат меди (II), известковая вода, медная проволока, хлороформ.
Посуда и оборудование: лабораторный штатив (или пробркодержатель), пробирки, пробка с газоотводной трубкой, спиртовка, спички, вата.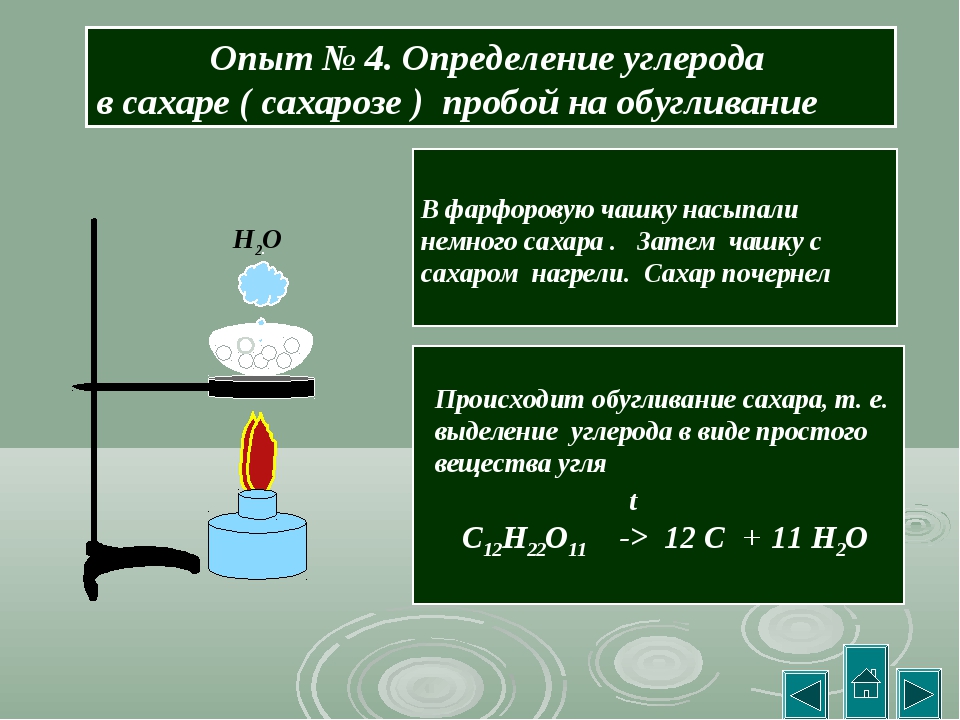
Ход работы:
Обнаружение углерода и водорода окислением оксидом меди (II).
Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения. После изменения окраски сульфата меди (П) следует прекратить нагревание.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
Наблюдения:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
Сnh3n+2 + (3n+1) CuO → n CO2↑ + (n+1) h3O + (3n+1) Cu
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
СО2 + Cа(OН)2 → СаCO3↓ + h3O
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.
Вывод: по продуктам окисления парафина СО2 и h3O установили, что в его состав входят углерод и водород.
Ответьте на вопросы:
1. Почему помутнел раствор известковой воды?
Напишите уравнение реакции, считая условно формулу парафина С16Н34.
2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая, что безводному сульфату меди (П) присоединяется 5 молекул воды.
3.Что произошло с чёрным порошком оксида меди (П).
Сделайте выводы.
Методическая разработка урока по органической химии «Качественное определение углерода, водорода и хлора в органических соединений
ПРАКТИЧЕСКАЯ РАБОТА №1.
Название работы: ________________________________________________
Цель работы: _____________________________________________________
__________________________________________________________________
Действия Наблюдения Уравнения реакций. Выводы
Опыт №1. Определение углерода и водорода
Ca(OH)2 + CO2 →
CuSO4 + 5h3O →
C16h44 + CuOОпыт №2. Определение хлора
22225174625
973455-1894840 Вывод:___________________________________________________________________________________________________________________________________________________________________________________________________________________
Приведите рабочее место в порядок. Оценка ______________
Оценка ______________
ИНСТРУКЦИЯ К ПРАКТИЧЕСКОЙ РАБОТЕ № 1
КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ УГЛЕРОДА, ВОДОРОДА И ХЛОРА В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
ЦЕЛЬ РАБОТЫ:научиться определять углерод, водород и хлор в органических соединениях.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди(II), известковая вода, прокаленный сульфат меди(II), медная проволочка 10 см., раствор тетрахлорметана.
1.Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.
2.Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
3.Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей, избегая выбрасывания жидкости.
4.Не наклоняйтесь над нагреваемой пробиркой.
5.
 При пользовании нагревательным прибором запрещается:
При пользовании нагревательным прибором запрещается:— передача зажженного нагревательного прибора.
— зажигание одного нагревательного прибора от другого.
6.Гасите только накрывая пламя колпачком.
ХОД РАБОТЫ:
Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II)
Соберите прибор, как показано на рисунке.
-571553975 Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П).
 Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.После изменения окраски сульфата меди (П) следует прекратить нагревание.
При протекании реакции:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.

Опыт №2. Качественное определение хлора в молекулах галогенопроизводных углеводородов
-16573564770Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Приложенные файлы
Практическая работа №1. Качественное определение углерода и водорода в органических веществах
Практическая работа №1 Качественное определение углерода и водорода в органических веществах Реактивы и оборудования: лабораторный штатив, спиртовка, химический стаканчик, пробка с газоотводной трубкой, большая пробирка; порошок CuO (II), 0,2г парафина, безводн CuSO4 , известковая вода Ca(OH)2.

Поделитесь с коллегами:
Практическая работа №1
Качественное определение углерода и водорода в органических веществах
Реактивы и оборудования: лабораторный штатив, спиртовка, химический стаканчик, пробка с газоотводной трубкой, большая пробирка; порошок CuO (II), 0,2г парафина, безводн CuSO4 , известковая вода Ca(OH)2.
ЧТО ДЕЛАЛИ?
ЧТО НАБЛЮДАЛИ?
Собираем установку изображенную на рис.7 стр.27.
В пробирку засыпаем 0,2г парафина и 1г CuO. Недалеко от пробки с газоотводной трубкой помещаем чуть-чуть безводного CuSO4. Свободный конец газоотводной трубки опускаем в химический стаканчик с р-ром известковой воды — Ca(OH)2. Пробирку осторожно нагреваем.
( Рисунок установки со всеми обозначениями)
Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос
CuSO4 + 5H2O = CuSO4 * 5 H2O
кристаллогидрат
голубого цвета
При нагревании парафина углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu
Известковая вода мутнеет от углекислого газа.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Вывод: выполнив данную работу, мы убедились, что парафин состоит из С и Н. Значит парафин — углеводород.
Либиха метод определения углерода и водорода
Принципы всех современных количественных методов определения углерода, водорода и азота базируются на классических методах Либиха и Дюма. Разложение вещества по этим методам проводят в присутствии окиси меди при нагревании. Либих недооценил в своем методе роли скорости сожжения вещества, быстроты его окисления и скорости поглощения в аппаратах паров воды и двуокиси углерода. Последующими работами многочисленных исследователей удалось полностью выяснить и устранить недостатки в методе Либиха. [c.33]
[c.33] Количественное определение углерода и водорода, которое нам надлежит осуществить в соответствии с результатами качественного анализа глюкозы, производится всегда одновременно, чаще всего с помощью классического метода Либиха, заключающегося в следующем. [c.173]
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ УГЛЕРОДА И ВОДОРОДА ПО МЕТОДУ ЛИБИХА [c.144]
Углерод и водород. Принципы количественного определения углерода ж водорода были разработаны Либихом. Эти методы сохранились до настоящего времени. Однако чаще в настоящее время применяют базирующийся на тех же принципах микроанализ, основание которому положил Прегль. Для микроанализа требуется в 50 раз меньше вещества и выполняется он в три раза быстрее. Приводим очень удобный метод микроанализа сожжением в пустой трубке, разработанный М. О. Коршун и [c.47]
Определение углерода и водорода (по методу Либиха) [c. 215]
215]
Определение элементного состава нефтей проводится общепринятыми методами анализа органических соединений, в частности углерод и водород — сожжением, по Либиху, или в калориметрической бомбе, азот, — по Дюма, сера, — по Кариусу, а кислород, — по разности, причем на процент его содержания ложатся все ошибки опыта. [c.76]
Основные научные работы посвящены разработке микроанализа органических веществ, создателем которого он является.
 Поставил перед собой задачу приспособить классические методы элементного органического анализа, разработанные Ю. Либихом и Ж. Б. Д. Дюма, для исследования очень малых количеств веществ. Разработал (1911) методы микроанализа органических веществ, обеспечивающие точность определения углерода, азота, серы и галогенов в навеске вещества до 7—10 мг. Затем (1913) ему удалось уменьшить количество анализируемого вещества до 1—3 мг. Сконструировал и изготовил всю необходимую для этих методов аппаратуру. Создал первую модель микрохимических весов с чувствительностью до миллионных долей грамма. Предложил оригинальные композиции аналитических реагентов, ввел принципиально новые способы разложения органических веществ при элементном анализе. Его методы включали определение элементов, наиболее часто встречающихся в органических веществах (углерода, водорода, азота, галогенов, серы, фосфора и др.), многих функциональных групп, молекулярной массы веществ. [c.406]
Поставил перед собой задачу приспособить классические методы элементного органического анализа, разработанные Ю. Либихом и Ж. Б. Д. Дюма, для исследования очень малых количеств веществ. Разработал (1911) методы микроанализа органических веществ, обеспечивающие точность определения углерода, азота, серы и галогенов в навеске вещества до 7—10 мг. Затем (1913) ему удалось уменьшить количество анализируемого вещества до 1—3 мг. Сконструировал и изготовил всю необходимую для этих методов аппаратуру. Создал первую модель микрохимических весов с чувствительностью до миллионных долей грамма. Предложил оригинальные композиции аналитических реагентов, ввел принципиально новые способы разложения органических веществ при элементном анализе. Его методы включали определение элементов, наиболее часто встречающихся в органических веществах (углерода, водорода, азота, галогенов, серы, фосфора и др.), многих функциональных групп, молекулярной массы веществ. [c.406] Понятие о количественном элементарном анализе. Процентное содержание отдельных элементов, обнаруженных дри качественном анализе органического вещества, устанавливают с помощью методов количественного элементарного анализа. Принципы количественного определения углерода и водорода, разработанные еще во времена Либиха, основаны на взвешивании углекислого газа и воды, получающихся при сожжении в токе кислорода навески около 0,2 г вещества, смешанной с окисью меди. [c.28]
Процентное содержание отдельных элементов, обнаруженных дри качественном анализе органического вещества, устанавливают с помощью методов количественного элементарного анализа. Принципы количественного определения углерода и водорода, разработанные еще во времена Либиха, основаны на взвешивании углекислого газа и воды, получающихся при сожжении в токе кислорода навески около 0,2 г вещества, смешанной с окисью меди. [c.28]
В своем приборе Либих широко использовал аналитический метод Берцелиуса, заключающийся в определении количества углерода в соединении по весу образующегося при анализе углекислого газа. Однако Либих значительно усовершенствовал прибор, впервые предложенный Берцелиусом во-первых, разделил печь на участки, во-вторых, применил трубку с оттянутым концом и, наконец, предложил использовать кали-аппарат. Нагревание трубки для сжигания, в которую помещалось органическое вещество, производилось раскаленным древесным углем (и в методе Либиха этот нагрев мог хорошо регулироваться). По окончании сжигания оттянутый конец трубки отламывался и через трубку прогонялся воздух для удаления из нее остатков продуктов сгорания. В шарообразной части аппарата был налит раствор едкого кали, который мог поглощать большие количества углекислого газа. Перед ним располагалась наполненная хлоридом кальция трубка, поглощавшая водяные пары. Для точного анализа органических соединений, содержащих только углерод, водород и кислород, кали-аппарат был идеальным прибором. Многочисленные данные, полученные на установках, привели ученых к выводу, что состав органических соединений тоже можно выразить совершенно определенными целочисленными весовыми соотношениями. [c.148]
По окончании сжигания оттянутый конец трубки отламывался и через трубку прогонялся воздух для удаления из нее остатков продуктов сгорания. В шарообразной части аппарата был налит раствор едкого кали, который мог поглощать большие количества углекислого газа. Перед ним располагалась наполненная хлоридом кальция трубка, поглощавшая водяные пары. Для точного анализа органических соединений, содержащих только углерод, водород и кислород, кали-аппарат был идеальным прибором. Многочисленные данные, полученные на установках, привели ученых к выводу, что состав органических соединений тоже можно выразить совершенно определенными целочисленными весовыми соотношениями. [c.148]
Хотя Либих не изменил известного ранее принципа определения углерода и водорода, однако сконструированный им аппарат позволил значительно сократить продолжительность выполнения анализа и упростить методику, а это создавало условия для более широкого применения количественного анализа органических соединений. Аппарат Либиха применялся в течение многих десятков лет без принципиальных изменений. Усовершенствования, введенные в дальнейшем, коснулись главным образом конструкции печи для сожжения, метода обогрева и т. п. Аппарат Либиха сыграл в развитии органической химии чрезвычайно важную роль он дал возможность количественно исследовать состав органических соединений и их реакции, что раньше было затруднено длительностью и сложностью выполнения анализа. [c.12]
Аппарат Либиха применялся в течение многих десятков лет без принципиальных изменений. Усовершенствования, введенные в дальнейшем, коснулись главным образом конструкции печи для сожжения, метода обогрева и т. п. Аппарат Либиха сыграл в развитии органической химии чрезвычайно важную роль он дал возможность количественно исследовать состав органических соединений и их реакции, что раньше было затруднено длительностью и сложностью выполнения анализа. [c.12]
Определение углерода и водорода методом Либиха—Прегля заключается в количественном разложении органического вещества до углекислого газа и воды, которые затем определяют количественно. Определение углерода и водорода всегда проводят совместно (из одной навески) в установке, схема которой изображена на рис. 4. Точно взвешенную навеску вещества (4—8 мг) помещают в платиновую лодочку или кварцевую пробирку и сжигают в кварцевой трубке, через которую пропускают с постоянной скоростью кислород. Трубку ( зону окисления ) нагревают электрической печью (800—900° С), а вещества сжигают обычно на газовой горелке. За кварцевой трубкой размещают аппараты с поглотителями для воды — перхлорат магния (ангидрон), [c.183]
За кварцевой трубкой размещают аппараты с поглотителями для воды — перхлорат магния (ангидрон), [c.183]
Другая большая заслуга Гей-Люссака состоит в том, что он ввел в аналитическую химию объемные методы которые имели большую важность как для чистой, так и для прикладной химии. В своем Наставлении по испытанию мокрым путем материалов, содержащих серебро (1832) Гей-Люссак оригинально излагает хлорометрию и алкалиметрию уже разработанные им в 1824 и 1828 гг. соответственно, а также описывает объемные методы определения хлора и серебра методом осаждения. Вместе с Тенаром Гей-Люссак ввел способ анализа органических соединений с применением хлората калия в качестве окислителя, используя который можно по количеству полученных угольного ангидрида и воды вычислить количество углерода, водорода и кислорода в соединении. Этот метод, связанный с бурной реакцией, был видоизменен, II впоследствии (1815) Гей-Люссак вместо хлората в качестве окислителя стал применять окись меди. Разработанные им методы проложили путь для элементарного анализа органических веществ и затем привели Либиха к открытию его известного способа, применяемого и в настоящее время в исследовательских лабораториях. [c.180]
Разработанные им методы проложили путь для элементарного анализа органических веществ и затем привели Либиха к открытию его известного способа, применяемого и в настоящее время в исследовательских лабораториях. [c.180]
Классический метод Либиха определения углерода и водорода в органических веществах, принятый за основу при разработке ГОСТ 2408—49, все основные положения которого строго нормализованы применительно к сжиганию в электрических печах, остается достаточно сложным и мало доступным для рядовых производственных лабораторий. Ускоренный метод, предложенный Николаевским кораблестроительным институтом, хотя в основном и сохраняет принцип классического метода, имеет ряд преимуществ перед последним, а именно помимо сокращения времени, потребного на проведение определения, ускоренный метод проще по выполнению, позволяет упростить аппаратуру, легче осваивается аналитиком. [c.177]
Однако иногда результаты Лавуазье из-за несовершенства аппаратуры носили только качественный характер. Тем не менее ему удалось установить, что в винном спирте весовое отношение углерода к водороду равно 3,6 1 (при правильном 4 1). Лавуазье сжигал навеску органического вещества в кислороде, определяя объем (и, следовательно, массу) затраченного кислорода и поглощаемой щелочью двуокиси углерода. Более усовершенствованную методику предложили Гей-Люссак и Тенар, которые сообщили в 1810 г. об анализе своим способом 19 органических веществ (14 растительного и четырех животного происхождения). Они впервые применили для окисления бертолетову соль (вещество, которое, судя по неопубликованным в свое время лабораторным записям, пытался для той же цели использовать и Лавуазье), но успех их методики заключался главным образом в предложении удачной конструкции аппарата. Впоследствии (1839) Берцелиус писал об их работе как о первом удачном опыте элементарного анализа органических тел [20, с. 19]. Однако метод Гей-Люссака — Тенара был неудобен из-за быстроты разложения, иногда даже взрыва бертолетовой соли.
Тем не менее ему удалось установить, что в винном спирте весовое отношение углерода к водороду равно 3,6 1 (при правильном 4 1). Лавуазье сжигал навеску органического вещества в кислороде, определяя объем (и, следовательно, массу) затраченного кислорода и поглощаемой щелочью двуокиси углерода. Более усовершенствованную методику предложили Гей-Люссак и Тенар, которые сообщили в 1810 г. об анализе своим способом 19 органических веществ (14 растительного и четырех животного происхождения). Они впервые применили для окисления бертолетову соль (вещество, которое, судя по неопубликованным в свое время лабораторным записям, пытался для той же цели использовать и Лавуазье), но успех их методики заключался главным образом в предложении удачной конструкции аппарата. Впоследствии (1839) Берцелиус писал об их работе как о первом удачном опыте элементарного анализа органических тел [20, с. 19]. Однако метод Гей-Люссака — Тенара был неудобен из-за быстроты разложения, иногда даже взрыва бертолетовой соли. Сам Гей-Люссак предложил заменить ее окисью меди. Были и другие попытки внести усовершенствования, но вполне удовлетворительный способ определения в органических веществах углерода и водорода, удержавшийся в химии по сути дела до наших дней, был введен после шестилетней предварительной работы Либихом в 1831 г. [c.291]
Сам Гей-Люссак предложил заменить ее окисью меди. Были и другие попытки внести усовершенствования, но вполне удовлетворительный способ определения в органических веществах углерода и водорода, удержавшийся в химии по сути дела до наших дней, был введен после шестилетней предварительной работы Либихом в 1831 г. [c.291]
До настоящего времени общераспространенным способом определения содержания углерода и водорода является метод Либиха. Однако он требует затраты нескольких часов для каждого определения. [c.264]
Менее распро странавным методом определения углерода и водорода является метод Денштедта, отличающийся от метода Либиха применением для дожигания продуктов разложения и газификации топлива не окиси меди, а платинового катализатора. Этот катализатор представляет собой шестилучевую зв-езду длиной около 100 мм, изготовленную из тонкой платиновой фольги толщиной около 0,1 мм. [c.159]
По мере развития органической химии и особенно исследований в области природных веществ, возрастали требования к элементарному анализу. По методу Либиха, для данного определения углерода и водорода необходимо было не менее 0,2 г вещества. Зачастую химик не раополагал таким количеством вещества. С этим затруднением встретился в процессе своих изысканий австрийский профессор Ф. Прегль (1869—1930). [c.14]
По методу Либиха, для данного определения углерода и водорода необходимо было не менее 0,2 г вещества. Зачастую химик не раополагал таким количеством вещества. С этим затруднением встретился в процессе своих изысканий австрийский профессор Ф. Прегль (1869—1930). [c.14]
Определение элементарного состава нефти производится общими методами анализа органических соединений, а именно углерод и водород определяются сожжением по Либиху, или в калориметрической бомбе азот определяется по Дюма, сера — по Кариусу, либо иными методами, которые будут рассмотрены в гл. VIII и IX, стр. 235 и 251, наконец, кислород определяется обыкновенно по остатку, редко —- методом непосредственного определения в виде воды. [c.15]
Лабораторная работа № 1
ТЕМА: КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ.
Вы выбрали профессию провизора и в своей деятельности должны не только уметь готовить лекарства, но и анализировать их. Анализ любого вещества и лекарственного в том числе, должен начинаться с определения его элементного состава. Знание данной темы потребуется также при изучении последующих курсов химии – фармацевтической, токсикологической и т.д.
Студент должен знать:
Реакции, лежащие в основе качественного анализа органических веществ, т.е. в основе открытия таких элементов, как углерод, водород, хлор, бром, иод, азот и т.д.
Студент должен уметь:
Отличать органические вещества от неорганических.
Переводить определяемые элементы из состава органических веществ в состав неорганических, например, углерод и водород из сахарозы — в состав углекислого газа и воды; азот из мочевины — в состав цианида натрия или аммиака; серу из сульфаниловой кислоты — в состав сульфида натрия, хлор из хлороформа или полихлорвинила — в состав хлорида натрия и т.
 д.
д.Открывать эти элементы качественными реакциями.
Уметь записывать соответствующие уравнения реакций.
Оборудование: пробирки, держалки, шпатели, газоотводные трубки, ступки с пестиками, вата, штативы, лакмусовая бумага, медная проволока.
Реактивы: сахароза, оксид меди, безводный сульфат меди, натронная известь (оксид кальция и едкий натр), баритовая вода, мочевина, ацетат свинца, хлороформ, этанол, мет. натрий, спиртовый раствор фенолфталеина, белок яйца, 0,1н р-р AgNO3, к. HNO3.
Опыт
1. Обугливание органических веществ. Поскольку
большинство органических веществ горят
и обугливаются (помимо тех, которые
возгоняются или испаряются), а
неорганические — не горят и не обугливаются,
следовательно, сжигая вещество, мы можем
отнести его к органическим или
неорганическим веществам.
На кончик шпателя набрать несколько кристаллов исследуемого вещества и внести в пламя горелки. Наблюдения и выводы записать в тетрадь вместе с уравнениями реакций окисления углерода и водорода.
Внимание! Некоторые органические вещества не обугливаются, они либо испаряются, либо возгоняются поэтому данная проба является лишь ориентировочной и ее отрицательный результат еще не свидетельствует о том, что вещество не является органическим.
Опыт
2. Открытие углерода и водорода сожжением
вещества с оксидом меди. В сухую пробирку поместить 0,5г. сахарозы,
1-2 г порошка оксида меди, все это тщательно
перемешать. В верхнюю часть пробирки
поместить рыхлый комочек ватки, на
который насыпать немного безводного
(белого) сульфата меди. Пробирку закрыть
пробкой с газоотводной трубкой, второй
конец которой опустить в пробирку с
баритовой водой. Нагреть первую пробирку
на пламени горелки. Посинение сульфата
меди (образование CuSO4∙5H2O)
и появление капелек воды на стенках
пробирки указывают на содержание
водорода в исходном веществе, а помутнение
баритовой воды (образование BaCO3 )– на
присутствие углерода.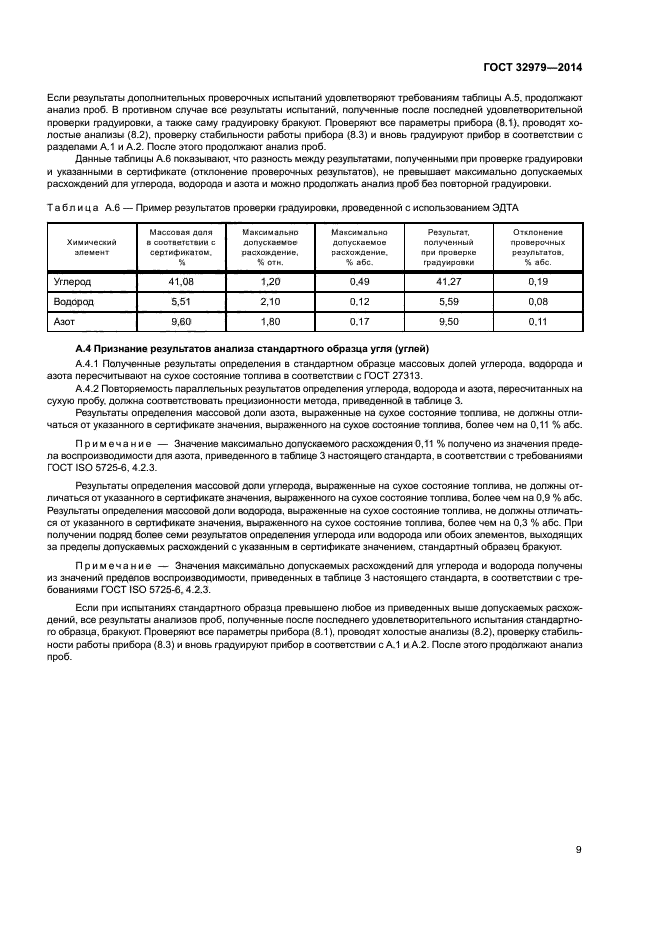
белый синий
Этот метод используется и для количественного определения углерода и водорода.
Опыт 3. Открытие азота. В сухой пробирке смешать равные количества мочевины и натронной извести, смесь нагреть – выделяется аммиак с характерным запахом. Если к отверстию пробирки поднести розовую лакмусовую бумагу, то она посинеет, следовательно, исходное вещество мочевина содержит азот.
Опыт 4. Открытие серы. Органическое вещество, содержащее серу, сплавить с металлическим натрием, сера переходит в состав сульфида натрия. Сульфид ион открыть качественной реакцией с растворимой солью свинца в щелочном растворе.
В
белке серу открывают, нагревая его с
раствором едкого натра. К образовавшемуся
раствору, содержащему сульфид натрия,
добавляют раствор ацетата свинца.
Раствор окрашивается в коричневый цвет:
к 1 мл 1%-го раствора белка добавить
столько же 35%-го раствора едкого натра
и 0,5 мл раствора ацетата свинца, смесь
нагреть на пламени горелки в течение 3
мин. Выпадает темно-коричневый осадок
сульфида свинца.
К образовавшемуся
раствору, содержащему сульфид натрия,
добавляют раствор ацетата свинца.
Раствор окрашивается в коричневый цвет:
к 1 мл 1%-го раствора белка добавить
столько же 35%-го раствора едкого натра
и 0,5 мл раствора ацетата свинца, смесь
нагреть на пламени горелки в течение 3
мин. Выпадает темно-коричневый осадок
сульфида свинца.
коричневый
Опыт 5. Открытие хлора при действии водорода в момент выделения на органическое вещество. Поместить в пробирку 1 каплю хлороформа СНCl3. Добавить 5 капель этилового спирта и кусочек металлического натрия (столбик длиной 1 мм ). При этом происходит следующая реакция:
Обратить
внимание на выделяющийся водород. Его
можно зажечь у отверстия пробирки, если
предварительно закрыть это отверстие
пальцем, чтобы накопить водород, а потом
поднести отверстие к пламени горелки
— водород горит с характерным хлопком.
Водород в момент выделения отщепляет хлор от хлороформа и образует хлористый водород, реагирующий затем с образовавшимся алкоголятом натрия:
хлороформ метан
После того как прекращается выделение водорода, для растворения образующегося белого осадка NaCl, нерастворимого в этиловом спирте, добавить в пробирку 2-3 капли воды. При этом избыток алкоголята натрия реагирует с водой, образуя щёлочь:
В присутствии щёлочи нельзя открывать ион хлора, так как при добавлении раствора нитрата серебра немедленно выпадает коричневый осадок оксида серебра, маскирующий белый осадок хлорида серебра:
бурый осадок
Поэтому
следует добавить в раствор сначала 2-3
капли к. HNO3 (в вытяжном шкафу) для нейтрализации
щёлочи, т.е. чтобы предотвратить
нежелательную реакцию, а затем уже 1
каплю 0,1н. AgNO3.
При наличии хлора немедленно выпадает
белый творожистый осадок хлорида
серебра, нерастворимый в HNO3:
HNO3 (в вытяжном шкафу) для нейтрализации
щёлочи, т.е. чтобы предотвратить
нежелательную реакцию, а затем уже 1
каплю 0,1н. AgNO3.
При наличии хлора немедленно выпадает
белый творожистый осадок хлорида
серебра, нерастворимый в HNO3:
белый осадок
Опыт 6. Открытие хлора по зеленой окраске пламени. (Проба Бейльштейна)
Получить
перед занятием медную проволоку длинной
около 10 см, загнутую на конце петлей и
вставленную другим концом в небольшую
корковую пробку. Держа за пробку,
прокалить петлю в пламени горелки до
исчезновения посторонней окраски
пламени (признак загрязнения медной
петли). Остывшую петлю, покрывшуюся
черным налётом оксида меди (II),
опустить в пробирку, на дно которой
поместить каплю испытуемого вещества,
например, хлороформа. Смоченную веществом
петлю вновь внести в пламя горелки.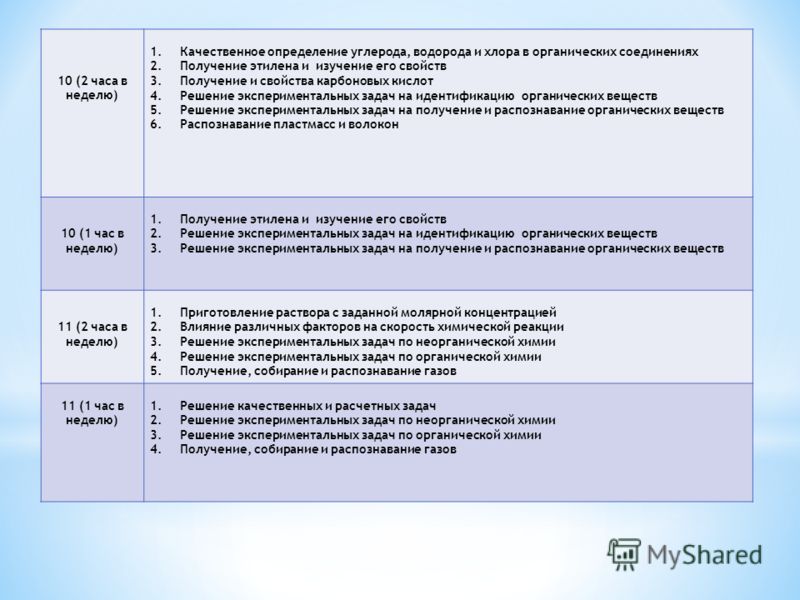 Немедленно появляется характерная
ярко-зелённая окраска пламени вследствие
образования летучего соединения меди
с хлором. Подобную же окраску пламени
дают помимо хлористых и другие
галогеносодержащие органические
соединения. Однако, этим методом нельзя
обнаружить фториды, т.к. фторид меди не
летуч.
Немедленно появляется характерная
ярко-зелённая окраска пламени вследствие
образования летучего соединения меди
с хлором. Подобную же окраску пламени
дают помимо хлористых и другие
галогеносодержащие органические
соединения. Однако, этим методом нельзя
обнаружить фториды, т.к. фторид меди не
летуч.
Контрольные вопросы, вопросы для самостоятельной работы:
Что изучает органическая химия?
Наличие какого элемента является обязательным в органическом соединении.
Как отличить органическое вещество от неорганического?
Что такое качественный анализ органических соединений?
К определению каких неорганических веществ сводится качественное определение углерода и водорода в сахарозе?
Написать уравнения реакций качественного анализа органических соединений: углерода и водорода в сахарозе, серы в сульфаниловой кислоте, хлора в хлороформе, азота в мочевине или в белке.

К открытию каких неорганических веществ сводится
качественное определение перечисленных элементов?
Литература:
Л.Б.Дзараева Руководство к лабораторным занятиям по органической химии. Владикавказ, 2011.
Тестовые задания к работе 1:
1-ый вариант:
1.Углерод и водород мы открывали в:
а) мочевине
б) сахарозе
в) хлороформе
г) белке
2. Азот мы открывали в:
а) мочевине
б) сахарозе
в) хлороформе
г) белке
3. Если горит
органическое вещество, пламя нужно
тушить
Если горит
органическое вещество, пламя нужно
тушить
а) пенным огнетушителем
б) углекислотным огнетушителем
в) сухим песком
г) асбестовым покрывалом
4. Ионы хлора в составе хлорида натрия можно открыть:
а) ацетатом свинца
б) нитратом серебра
в) по запаху
г) пробой Бельштейна
5. Серу в сульфиде натрия можно открыть:
а) ацетатом свинца
б) нитратом серебра
в) по запаху
г) сульфатом меди
6. Азот в составе аммиака можно открыть?
а) гидроксидом натрия
б) нитратом серебра
в) по запаху
г) сульфатом меди
7. Углерод в составе СО2 можно открыть:
Углерод в составе СО2 можно открыть:
а) ацетатом свинца
б) нитратом серебра
в) гидроксидом бария
г) сульфатом меди
8. Число монохлорпроизводных пропана равно
а) 2
б) 3
в) 4
г) 5
9. Если на кожу попал фенол, нужно растирать обожженное место кусочком ваты, смоченным:
а) глицерином;
б) спиртом;
в) раствором мочевины ;
г) раствором карбоната натрия
10. При термическом ожоге обожженное место нужно протирать:
а) раствором мочевины ;
б) раствором карбоната натрия;
в) раствором танина в спирте;
г) глицерином
11. Валентность углерода в органических
соединениях
Валентность углерода в органических
соединениях
а) 2
б) 3
в) 4
г) 5
12. Указать формулы гомологов метана
а) С3Н8
б) С4Н8
в) С4Н10
г) С7Н8
13. Хлор мы открывали в:
а) мочевине
б) сахарозе
в) хлороформе
г) белке
14. Если на кожу попал бром, нужно растирать обожженное место кусочком
ваты, смоченным:
а) глицерином;
б) спиртом;
в) раствором мочевины ;
г) раствором карбоната натрия
15. Перекиси в эфире открывают раствором
Перекиси в эфире открывают раствором
а) KI
б) KBr
в) FeSO4
г) NaCI
16. Качественной реакцией на ионы хлора является реакция с раствором
а) ацетатом свинца
б) нитратом серебра
в) гидроксида натрия
17. Если на кожу попала щелочь, нужно растирать обожженное место кусочком ваты, смоченным:
а) глицерином;
б) спиртом;
в) 2%-ной уксусной кислотой;
д) раствором карбоната натри
Ответы:
1-ый вариант: 1 – б; 2 – а; 3 –б, в,г; 4 – б, г; 5 – а; 6 – в; 7 – в; 8 – а;
9
– а;10-в 11-в; 12- а,в; 13 – в; 14 – б,г; 15 –
в; 16 – б; 17 – в.
Занятие №3
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
(PDF) Качественный тест на элементы в органическом соединении
I. Введение
Эксперимент проводился со следующими целями:
1. Определить качественный тест на элементы в органическом соединении.
2. Определить реакции следующих химикатов, которые имеют различный цвет.
II. Методология
A. Химические вещества и оборудование
В эксперименте использовались следующие химические вещества: сульфат железа, натронная известь, NaOH, мочевина, серная кислота,
HCL, растворы железа, уксусная кислота, раствор нитропруссида натрия и CuO. Используемое оборудование включает: спиртовую лампу
Используемое оборудование включает: спиртовую лампу
, капельницу, пробирку, шпатель, клещи для тиглей, ступку и пестик, стержень для перемешивания, штатив для пробирок, держатель для пробирок
, лакмусовую бумагу
B. Процедура
1. Тест на Азот
а. Lassaignes Test
Добавьте 2 капли насыщенного раствора сульфата двухвалентного железа к 2 мл исследуемого раствора. Добавьте достаточно 40% растворов NaOH
, чтобы получить отчетливую щелочность (около pH 11).Нагрейте до кипения и профильтруйте, чтобы удалить FeS.
Подкислите фильтрат 5M серной кислотой и добавьте 2 капли раствора хлорида железа. Дать постоять 10
минут. Осадок берлинской лазури указывает на присутствие азота.
г. Тест на натронную известь
Нагрейте щепотку испытуемого соединения с небольшим количеством натровой извести в сухой пробирке (в данном случае в качестве образца можно использовать мочевину
).При образовании паров обнажите небольшой кусок влажной литмусовой бумаги на одном конце стержня для перемешивания
. Обратите внимание на изменение цвета при контакте с паром. Затем окуните другой конец стержня для перемешивания
Обратите внимание на изменение цвета при контакте с паром. Затем окуните другой конец стержня для перемешивания
в концентрированную соляную кислоту и снова подвергните его воздействию выделяющихся паров.
3. Тест на серу
a. Подкислите 2 мл исследуемого раствора разбавленной уксусной кислотой. Добавьте несколько капель раствора ацетата свинца
.
г. К 2 мл исследуемого раствора добавить 2 капли раствора нитропруссида натрия. Глубокий красновато-фиолетовый раствор
указывает на присутствие серы. Цвет исчезает при стоянии.
Анализ горения | Введение в химию
Цель обучения
- Опишите процесс анализа горения.
Ключевые моменты
- Горение — это процесс сжигания органического соединения в кислороде с образованием энергии, двуокиси углерода и водяного пара.
- При анализе сгорания сжигается образец известной массы, а образующиеся двуокись углерода и водяной пар улавливаются и взвешиваются.

- Относительные количества углерода, водорода и кислорода в исходном соединении могут быть определены по массам продуктов реакции горения.
- Таким образом, анализ горения можно использовать для определения эмпирической формулы неизвестного органического соединения.
Условия
- Анализ горения Использование горения для определения элементного состава органического соединения.Компаунд сжигается, продукты собираются и взвешиваются, определяется состав.
- сгорание: Процесс, при котором топливо объединяется с кислородом, обычно при высокой температуре, с выделением тепла, диоксида углерода и водяного пара.
Анализ горения — это метод элементного анализа твердых и жидких органических соединений. Он может определять относительные количества углерода, водорода, кислорода в соединениях, а иногда также может определять количества азота и серы в соединениях.Этот метод был изобретен Жозефом Луи Гей-Люссаком.
Горение
Анализ горения обычно используется для анализа образцов неизвестной химической формулы. Для этого требуется всего лишь миллиграммы образца. Образец взвешивается и затем полностью сжигается при высокой температуре в присутствии избытка кислорода, в результате чего образуется диоксид углерода и вода.
Реакции горения — YouTube В этом видео рассказывается об основах реакций горения, о том, как их идентифицировать, прогнозировать продукты и уравновешивать химическое уравнение.Включены три взрыва: метановая мамба, свистящая бутылка и водородный газовый баллон.Одним из примеров простой реакции горения является горение метана:
[латекс] CH_ {4} + 2 \: O_ {2} \ rightarrow CO_ {2} + 2 \: H_ {2} O + энергия [/ латекс]
Другой распространенный пример горения — сжигание древесины для производства тепловой энергии. Когда 1 моль пропана (C 3 H 8 ) сжигается в избытке кислорода, образуется 3 моля CO 2 и 4 моля H 2 O.
Анализ горения
При анализе горения продукты, диоксид углерода и водяной пар, улавливаются путем абсорбции на реакционноспособных твердых веществах, расположенных в трубах над реакционным сосудом. Затем эти пробирки можно взвесить для определения поглощенных масс углекислого газа и воды.
- Масса углерода в исходном материале определяется соотношением 1: 1 с массой образовавшегося диоксида углерода (как в уже отображенной реакции горения метана).
- Начальная масса водорода определяется соотношением 2: 1 к количеству произведенной воды.
Затем данные и соотношения можно использовать для вычисления эмпирической формулы неизвестной выборки. Анализ горения также можно выполнить с помощью анализатора CHN, который использует газовую хроматографию для анализа продуктов сгорания.
Показать источники Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
4.7: Химические уравнения и количественный анализ
Цели обучения
- Различия между количественным и качественным анализом
- Определите количество неизвестного растворенного вещества в растворе, используя метод гравиметрического анализа
- Определите эмпирическую формулу углеводорода или органического соединения, используя метод анализа горения
Количественный анализ — это раздел аналитической химии, в котором вы определяете «количество» неизвестного, что часто противопоставляется качественному анализу, который стремится идентифицировать идентичность неизвестного.Существует много типов количественных методов, основанных на стехометрии, и многие из них имеют дело с решениями и будут рассмотрены в следующих нескольких разделах этой главы
.Гравиметрический анализ:
Идентификация количества неизвестного растворенного вещества в растворе путем определения его в качестве ограничивающего реагента реакции осаждения, взвешивания массы образовавшегося осадка и последующего использования стехиометрии реакции осаждения для определения молей неизвестного. Этот метод использует преимущества правил растворимости, а стратегия заключается в использовании реакции двойного замещения, когда один из продуктов растворим, а другой образует осадок
Этот метод использует преимущества правил растворимости, а стратегия заключается в использовании реакции двойного замещения, когда один из продуктов растворим, а другой образует осадок
Например, если вы хотите определить количество молей растворимого хлорида бария в растворе, вы можете добавить избыток сульфата натрия, полное ионное уравнение будет
BaCl 2 (водн.) + Na 2 SO 4 (водн.) -> BaSO 4 (т.) + 2NaCl (водн.)
(предельное значение) (избыток)
Добавляя избыток сульфата натрия, вы можете заставить весь барий образовать осадок, который можно профильтровать, высушить и взвесить.После того, как масса известна, можно рассчитать количество молей сульфата бария и на основании этого определить количество молей (или массу) хлорида бария. Чтобы это сработало, ограничивающим реагентом должно быть неизвестное.
Гравиметрический анализ нитрата свинца (II)
Свинец был обнаружен в питьевой воде во Флинте, штат Мичиган, и один из способов его удаления — реакция двойного вытеснения с фосфатом с образованием фосфата свинца (II), который представляет собой нерастворимую соль. Интересно, что это образует защитное покрытие на трубе, предотвращающее дальнейшую коррозию.Фактически, город Флинт удалил фосфат из процесса обработки, так как он также предотвращает коррозию железа, и именно тогда свинец начал растворяться в первую очередь, как описано в статье Chemical and Engineering News в American Chemical Общество.
Интересно, что это образует защитное покрытие на трубе, предотвращающее дальнейшую коррозию.Фактически, город Флинт удалил фосфат из процесса обработки, так как он также предотвращает коррозию железа, и именно тогда свинец начал растворяться в первую очередь, как описано в статье Chemical and Engineering News в American Chemical Общество.
Рисунок \ (\ PageIndex {1} \): Изображения из Flint Michigan в ответ на присутствие свинца в питьевой воде. Слева изображение Национальной гвардии Техаса из U.S. Министерство обороны, изображение справа загружено на Flickr Эдвардом Киммелем.
Применяя правила растворимости из раздела 3.4.2.1, можно не только увидеть, как фосфат может удалить растворенный свинец из воды, но даже использовать его в лаборатории для определения концентрации свинца в неизвестном образце.
Пример \ (\ PageIndex {1} \): Анализ свинца в пробе воды.
Какова молярная концентрация Pb +2 в загрязненной воде, если 14,06 грамма Pb 3 (PO 4 ) 2 (s) выпадает из 1. {-3} (водн.)} \ Rightarrow \ underset {m = 14.06g} {Pb_3 (PO_4) _2 (водн.)} \]
{-3} (водн.)} \ Rightarrow \ underset {m = 14.06g} {Pb_3 (PO_4) _2 (водн.)} \]
Общая стратегия:
- Из массы фосфата свинца (II) рассчитать количество молей фосфата свинца, выпавших в осадок из 1 литра загрязненной воды.
- По формуле фосфата свинца (II) рассчитать моль фосфат-иона
- Используйте чистое ионное уравнение для расчета молей свинца (II)
- Разделите на объем пробы свинец, осажденный из (1,00 л), чтобы рассчитать концентрацию свинца (II)
Это решается в видео \ (\ PageIndex {1} \), и в одном уравнении это:
\ [\ frac {14.{+2} \]
Видео \ (\ PageIndex {1} \): 4’31 «YouTube показывает расчет концентрации ионов свинца (II) в пробе воды, если 14,06 г фосфата свинца (II) выпадает в осадок из 1,00 л (https: // youtu.be/XIEs8l2xfuk).Exercise \ (\ PageIndex {1} \) Мышьяк в грунтовых водах
Вы хотите определить концентрацию арсената в грунтовых водах. Вы добавляете нитрат серебра в образец объемом 100 мл. {- 3} (вод.) \ Rightarrow Ag_3AsO_4 (s) \]
{- 3} (вод.) \ Rightarrow Ag_3AsO_4 (s) \]
Концентрация арсената — это количество молей арсената в 100 мл воды, выраженное в литрах.{-3}} {1 \; mol \; Ag_3AsO_4} \ right)} {0.100L} = 0.00757M = 7.57mM \]
Свинец в сфере потребительских товаров
В 1980 году ацетат свинца (II) был внесен в список как безопасный для использования в косметических средствах, таких как средства для окрашивания волос, которые использовались в таких продуктах, как Grecian Formula (Рисунок \ (\ PageIndex {2} \)), а FDA было отменено. 30 октября 2018 г. в связи с проблемами со здоровьем в связи с запретом, который должен вступить в силу 3 декабря 2018 г. У запрета был 30-дневный период апелляции для всех, кто «пострадал» от запрета и производителя, компания Combe запросила слушание, утверждая, что это было безопасно, и теперь запрет приостановлен, пока проблема не будет решена (см.Фонд защиты окружающей среды от 4 января 2019 г. и Consumer Report от 9 января 2019 г. ).
).
Рисунок \ (\ PageIndex {2} \) Изображение предоставлено Бобом Белфордом (слева) и справа объявление FDA США об отмене разрешения на применение ацетата свинца (II) в продуктах для волос, https://www.fda.gov/ косметика / косметические продукты / прогрессивные краски для волос с ацетатом свинца.
Виртуальное упражнение \ (\ PageIndex {1} \)
Использование виртуальной лаборатории \ (\ PageIndex {1} \) для разработки и проведения эксперимента по определению концентрации ацетата свинца в неизвестном веществе.Просмотрите http://www.chemcollective.org/chem/common/vlab_walkthrouh_html5.php, чтобы получить краткое руководство по запуску виртуальной лаборатории. Ответ на Неизвестный А дан ниже. Вам следует изучить логику упражнения \ (\ PageIndex {1} \) «Мышьяк в грунтовых водах», чтобы разработать стратегию решения этой проблемы. Студентам UALR будет дано одно из других 5 неизвестных в качестве домашнего задания.
- Ответ
Реакция:
\ [Pb (C_2H_3O_2) _2 (вод.) + K_2CrO_4 \ rightarrow PbCrO_4 (s) + 2KC_3H_3O_2 (вод.) \]
Обратите внимание, что мы использовали постоянное значение выхода хромата свинца (II), полученного в избытке хромата калия, для 100 мл неизвестного A
\ [\ frac {9.6966gPbCrO_4} {0,1000l} \ left (\ frac {1mol \; PbCrO_4} {323.2g} \ right) \ left (\ frac {1mol \; Pb (C_2H_3O_2) _2} {1mol \; PbCrO_4} \ right) = 0,3000 M \; Pb (C_2H_3O_2) _2 \]
ПРИМЕЧАНИЕ. Если в виртуальной лаборатории указано «Настройка лаборатории по умолчанию», обновите страницу.
должно быть написано: «Гравиметрический анализ неизвестных растворов свинца»
Virtual Lab \ (\ PageIndex {1} \): Виртуальная лаборатория ChemCollective, разработанная Дэйвом Яроном из Университета Карнеги-Меллона, (http: //www.chemcollective.org /). ПРИМЕЧАНИЕ: если лаборатория загружается как «Настройка лаборатории по умолчанию» (с набором кислот, оснований и индикаторов), обновите страницу.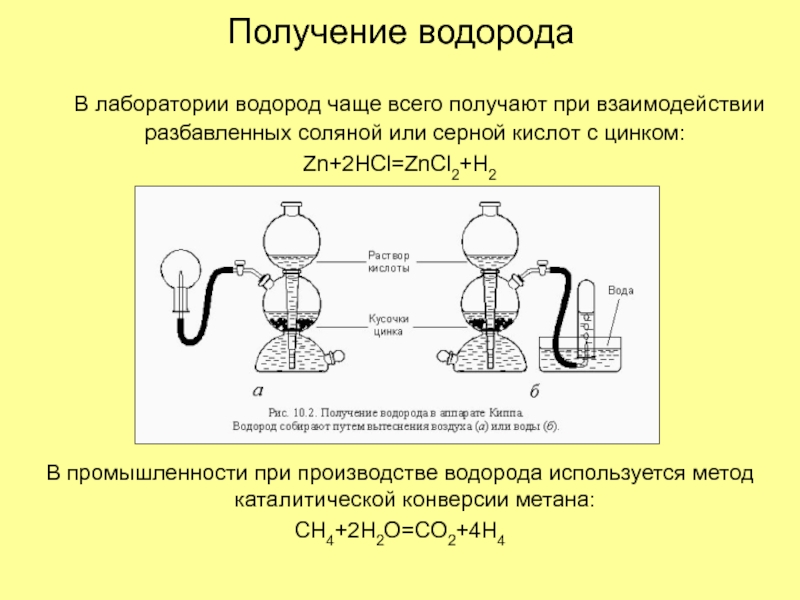 Вы хотите, чтобы он загрузил «Гравиметрический анализ неизвестных растворов», который содержит хлорид натрия, хромат калия и шесть неизвестных.
Вы хотите, чтобы он загрузил «Гравиметрический анализ неизвестных растворов», который содержит хлорид натрия, хромат калия и шесть неизвестных.
Титрование кислотной основы
Титрование — очень важный аналитический метод, при котором вы определяете количество неизвестного (аналита), реагируя на него титрантом известной концентрации до тех пор, пока они не достигнут стехиометрических пропорций, а затем используете сбалансированное уравнение для определения количества неизвестного аналита.Эти типы методов часто используют визуальные индикаторы, чтобы указать, когда они завершены, в том числе индикаторами могут быть сами реагенты и продукты или другие химические вещества, которые реагируют с реагентами и продуктами. Например, индикатор в реакции кислотно-щелочной нейтрализации будет иметь изменение цвета в определенном диапазоне pH, и вы выбираете индикатор, который меняет цвет при pH, указывающем на то, где кислота и основание находятся в стехиометрических пропорциях.
Существуют и другие виды титрования, но принцип тот же.
Пример \ (\ PageIndex {2} \): титрование кислотной основы
Химику необходимо знать концентрацию 50-галлонной бочки с серной кислотой.Таким образом, химик использует мерную пипетку на 25 мл для переноса 25,00 мл неизвестной кислоты в колбу Эрленмейера и добавляет 2 капли индикатора, который меняет цвет при нейтрализации кислоты. Затем раствор титруют 0,100 М гидроксидом натрия, и требуется 30,00 мл для нейтрализации 25,00 мл серной кислоты. Насколько концентрирована серная кислота в бочке?
Насколько концентрирована серная кислота в бочке?
Решение
Шаг 1: Запишите сбалансированное уравнение и под каждым элементом напишите, что указано в формулировке задачи.
\ [\ underset {M =? \\ V = 25,00 мл} {H_2SO_4 (водн.)} + \ Underset {M = 0,100M \\ V = 30,00 мл} {2NaOH (вод.)} \ Rightarrow Na_2SO_4 (водн.) + 2H_2O (l) \]
Шаг 2: Рассчитайте количество молей кислоты, нейтрализованных добавлением 30,00 мл 0,100 М NaOH.
\ [0,03000LNaOH \ left (\ frac {0,100molNaOH} {l} \ right) \ left (\ frac {1 \; mol \; H_2SO_4} {2 \; mol \; NaOH} \ right) = 0,0015o \ ; моль \; H_2SO_4 \]
Шаг 3: Разделите на объем титруемой кислоты, и это даст концентрацию кислоты в бочке емкостью 50 галлонов
\ [гидроразрыв {0.00150 \; моль} {0,02500 \; L} = 0,0600M = 80,0 мм \]
Анализ горения
Это тип качественного анализа, который можно использовать для определения эмпирической формулы неизвестного органического соединения, состоящего из углерода, водорода и кислорода. При анализе горения образец известной массы сжигается в избытке кислорода. Затем он проходит через абсорберы H 2 O и CO 2 , которые собирают водород и углерод, которые были в исходной пробе. Как известно массовый процент водорода в воде (2.01 / 18.01 или 11,2%) и массовый процент углерода в диоксиде углерода (12,01 / 44,01 или 27,3%), мы можем определить их массы по образующейся воде и диоксиду углерода. Как только эти массы известны, масса кислорода может быть определена путем вычитания их из исходной массы образца, и это становится проблемой эмпирических формул, подобных тем, которые приведены в главе 2.
При анализе горения образец известной массы сжигается в избытке кислорода. Затем он проходит через абсорберы H 2 O и CO 2 , которые собирают водород и углерод, которые были в исходной пробе. Как известно массовый процент водорода в воде (2.01 / 18.01 или 11,2%) и массовый процент углерода в диоксиде углерода (12,01 / 44,01 или 27,3%), мы можем определить их массы по образующейся воде и диоксиду углерода. Как только эти массы известны, масса кислорода может быть определена путем вычитания их из исходной массы образца, и это становится проблемой эмпирических формул, подобных тем, которые приведены в главе 2.
\ (\ PageIndex {2} \): Схема для получения данных массового анализа из анализа горения для определения эмпирической формулы
Рисунок \ (\ PageIndex {4} \): В 1670 году Джон Рэй опубликовал в «Философских трудах Лондонского королевского общества» свои наблюдения и эксперименты, касающиеся «сока, который можно найти в муравьях». DOI: 10.1098 / rstl.1670.0052. Справа: армейские муравьи в Уганде, фото предоставлено Бернаром Дюпоном, Flickr
DOI: 10.1098 / rstl.1670.0052. Справа: армейские муравьи в Уганде, фото предоставлено Бернаром Дюпоном, Flickr
Пример \ (\ PageIndex {3} \) Анализ горения муравьиной кислоты, муравьиной кислоты
Муравьиная кислота, полученная перегонкой Formica rufa (муравьи). Какова эмпирическая формула муравьиной кислоты, если 2,4527 г образца дает 0,9696 г воды и 2,3482 г диоксида углерода?
Решение
Шаг 1. Рассчитайте массу водорода в воде
\ [M_ {H} = m_ {H_ {2} O} \ left (\ text {доля водорода в воде} \ right) \\
M_ {H} = 0.9696 г \; H_2O \ left (\ frac {2.016g \; H} {18.016g \; H_2O} \ right) = 0.1067g \; H \]
Шаг 2: Расчет массы углерода в диоксиде углерода
\ [M_ {C} = m_ {CO_ {2}} \ left (\ text {доля углерода в воде} \ right) \\
M_ {H} = 2.3482 г \; CO_2 \ left (\ frac {12.011g \; C} {44.011g \; CO_2} \ right) = 0.6404g \; C \]
Шаг 3: Рассчитайте массу кислорода, вычтя массовые водород и углерод из массы образца
\ [m_ {кислород} = m_ {образец} -m_ {водород} -m_ {углерод} \\ m_ {кислород} = 2. 4527 г-0,1067 г-0,6404 г = 1,7056 г \]
4527 г-0,1067 г-0,6404 г = 1,7056 г \]
Теперь это проблема с эмпирической формулой, которая решается в видео \ (\ PageIndex {3} \), давая эмпирическую формулу CH 2 O 2 . См. Раздел 2.11, если вам нужно рассмотреть проблемы с эмпирической формулой.
Видео \ (\ PageIndex {3} \): 4’01 «Пример решения YouTube \ (\ PageIndex {3} \), (https://youtu.be/QxugidpNaEA)Упражнение \ (\ PageIndex {3} \)
Формальдегид состоит из углерода, водорода и кислорода. Если образец 8,7355 г подвергается анализу горения и образует 12.806 г диоксида углерода и 5,2385 г воды, какова его эмпирическая формула?
- Ответ
CH 2 O
Авторы и авторство
Роберт Э. Белфорд (Университет Арканзаса, Литл-Рок; факультет химии). За широту, глубину и достоверность этой работы отвечает Роберт Э. Белфорд, [email protected]. Вам следует связаться с ним, если у вас возникнут какие-либо вопросы. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
- Ноябрь Палмер и Рония Каттум (UALR)
- анонимно
3.5: Эмпирические формулы из анализа
Когда соединение, содержащее углерод и водород, подвергается сгоранию с кислородом в специальном аппарате для сжигания, весь углерод превращается в CO 2 , а водород в H 2 O (Рисунок \ (\ PageIndex {2} \)). Количество произведенного углерода может быть определено путем измерения количества произведенного CO 2 . Он улавливается гидроксидом натрия, и, таким образом, мы можем контролировать массу произведенного CO 2 , определяя увеличение массы ловушки CO 2 .Точно так же мы можем определить количество H, образовавшегося из количества H 2 O, захваченного перхлоратом магния.
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом горения. Небольшой, тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода. Другие элементы, такие как металлы, можно определить другими методами.и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 , соответственно) определяют одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке \ (\ PageIndex {3} \), а типичный анализ горения проиллюстрирован в примерах \ (\ PageIndex {3} \) и \ (\ PageIndex {4} \).
Небольшой, тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода. Другие элементы, такие как металлы, можно определить другими методами.и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 , соответственно) определяют одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке \ (\ PageIndex {3} \), а типичный анализ горения проиллюстрирован в примерах \ (\ PageIndex {3} \) и \ (\ PageIndex {4} \).
Пример \ (\ PageIndex {3} \): горение изопропилового спирта
Какова эмпирическая формула для изопропилового спирта (который содержит только C, H и O), если при сгорании 0.Образец изопропилового спирта 255 г дает 0,561 г CO 2 и 0,306 г H 2 O?
Решение
По этой информации определите количество C и H в образце.
\ [(0.561 \; \ cancel {g \; CO_2}) \ left (\ dfrac {1 \; mol \; CO_2} {44.0 \; \ cancel {g \; CO_2}} \ right) = 0,0128 \; моль \; CO_2 \]
Поскольку один моль CO 2 состоит из одного моля C и двух молей O, если в нашем образце 0,0128 моль CO 2 , то мы знаем, что имеем 0.0128 моль C в образце. Сколько это граммов C?
\ [(0,0128 \; \ cancel {mol \; C}) \ left (\ dfrac {12.011 \; g \; C} {1 \; \ cancel {mol \; C}} \ right) = 0,154 \; г \; C \]
Как насчет водорода?
\ [(0.306 \; \ cancel {g \; H_2O}) \ left (\ dfrac {1 \; mol \; H_2O} {18.0 \; \ cancel {g \; H_2O}} \ right) = 0,017 \; моль \; H_2O \]
Поскольку один моль H 2 O состоит из одного моля кислорода и двух моль водорода, если у нас 0.017 моль H 2 O, тогда имеем 2 * (0,017) = 0,034 моль водорода. Поскольку водород составляет примерно 1 грамм / моль, в нашем исходном образце должно быть 0,034 грамма водорода .
Если сложить углерод и водород, мы получим:
0,154 грамма (C) + 0,034 грамма (H) = 0,188 грамма
Но мы знаем, что сожгли 0,255 грамма изопропилового спирта. «Недостающая» масса должна быть связана с атомами кислорода в изопропиловом спирте:
0.255 г — 0,188 г = 0,067 г кислорода
Сколько молей это кислород?
\ [(0,067 \; \ cancel {g \; O}) \ left (\ dfrac {1 \; mol \; O} {15.994 \; \ cancel {g \; O}} \ right) = 0,0042 \; моль \; O \]
Таким образом, всего имеем:
- 0,0128 моль Углерод
- 0,0340 моль Водород
- 0,0042 моль Кислород
Разделить на наименьшее молярное количество для нормализации:
- C = 3,05 атома
- H = 8.1 атом
- O = 1 атом
В пределах экспериментальной ошибки наиболее вероятной эмпирической формулой для пропанола будет \ (C_3H_8O \)
Пример \ (\ PageIndex {4} \): Горение нафалена
Нафталин, активный ингредиент одного вида нафталина, представляет собой органическое соединение, которое содержит только углерод и водород. Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Дано : масса пробы и масса продуктов сгорания
Запрошено : эмпирическая формула
Стратегия :
- Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходном образце нафталина.
- Используйте эти массы и молярные массы элементов для расчета эмпирической формулы нафталина.
Решение :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль \ (\ ce {CO2} \). Точно так же 1 моль H 2 O образуется на каждые 2 моля атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны на основе этих соотношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицы молярной массы выражаются в граммах на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
Поскольку единицы молярной массы выражаются в граммах на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
\ [масса \, of \, C = 69.{−3}} = 1,250 \]
Таким образом, нафталин содержит соотношение молей углерода к молям водорода 1,25: 1: C 1,25 H 1,0 . Поскольку соотношения элементов в эмпирической формуле должны быть выражены в виде малых целых чисел, умножьте оба нижних индекса на 4, что дает C 5 H 4 как эмпирическую формулу нафталина. Фактически химическая формула нафталина C 10 H 8 , что согласуется с нашими результатами.
График услуг— Анализ углерода, водорода, азота, кислорода и галогенов, включая фтор
Элементный анализ и заряды
Пожалуйста, позвоните по телефону или электронной почте, чтобы запросить наш стандартный прайс-лист.Имейте в виду, что Midwest Microlab предлагает пакеты скидок.
Анализ преформ Midwest Microlab на все следующие элементы:
- Углерод
- Водород
- Азот
- Бром
- Хлор
- Фтор
- Йод
- Кислород
- Фосфор
- Натрий
- Сера
* Мы не проводим никакого анализа следов
Мы также предлагаем чувствительные к воздуху устройства для дополнительного количественного определения золы ИЛИ за дополнительную плату. По вашему запросу может быть проведен повторный анализ.
По вашему запросу может быть проведен повторный анализ.
Упаковка
Рекомендуется отправлять образцы в картонных трубках или картонных коробках с достаточным количеством упаковочных материалов, чтобы выдержать суровые условия транспортировки. Если флаконы будут повреждены во время транспортировки, мы свяжемся с вами, прежде чем приступить к анализу.
Образцы
Твердые материалы или жидкости следует отправлять в соответствии с теоретическим процентным соотношением для всех тестов на галогены или со стандартными 5 мг на определение C-H-N.Летучие и / или чувствительные к воздуху вещества следует запечатывать в небольшие ампулы или компрессионные флаконы.
Листы для подачи
Формы подачи заявок доступны для скачивания с нашего сайта. Требуется, чтобы они были заполнены полностью, по одному на каждый образец с соответствующим идентификационным номером образца, и отправлены вместе с образцами. В примечаниях к пункту укажите все известные характеристики, которые могут повлиять на анализ.
В примечаниях к пункту укажите все известные характеристики, которые могут повлиять на анализ.
Опасные образцы
Ответственность за раскрытие всех без исключения опасностей, связанных с веществами, отправляемыми на анализ, лежит на отправителе.В целях надлежащей защиты персонала нашей лаборатории мы просим вас сообщать обо всех мерах предосторожности, таких как: высокотоксичные, канцерогенные, сильные раздражители и т. Д. Мы не анализируем радиоактивные образцы или любые образцы, содержащие осмий или ПХД.
Как проверить качество воды? Химические тесты для ограниченного бюджета
Примечание редактора: это вторая часть из серии блогов , посвященных вариантам низкотехнологичного мониторинга качества воды . Благодаря современной химии мы можем обнаруживать в воде тысячи химических веществ даже при очень низких концентрациях.Постоянно растущий список доступных тестов может показаться огромным, и подавляющее большинство методов требуют современного лабораторного оборудования. К счастью, нам не нужно проверять все! Гораздо меньший и более практичный набор тестов может дать хорошее представление о химическом качестве воды для целей мониторинга. Хорошая новость заключается в том, что существуют низкотехнологичные версии этих тестов для ситуаций, когда бюджет ограничен.
К счастью, нам не нужно проверять все! Гораздо меньший и более практичный набор тестов может дать хорошее представление о химическом качестве воды для целей мониторинга. Хорошая новость заключается в том, что существуют низкотехнологичные версии этих тестов для ситуаций, когда бюджет ограничен.
Форматы тестов Типичные низкотехнологичные портативные методы полевых испытаний для химического мониторинга качества воды делятся на три категории:
- Тест-полоски — это небольшие одноразовые полоски, которые меняют цвет, указывая на концентрацию определенного химического вещества.В зависимости от конкретного теста пользователь «активирует» бумажную или пластиковую полоску, погружая ее в образец воды и размахивая ею, или удерживая полоску в струе воды. После короткого ожидания пользователь сравнивает цвет тест-полоски с цветовой диаграммой, чтобы определить концентрацию химического вещества. Эти наборы чрезвычайно просты, но они менее точны, чем другие методы, особенно если пользователи не следуют инструкциям.

- Наборы цветных дисков — Наборы цветных дисков доступны для широкого спектра химических тестов.В типичной установке пользователь добавляет пакет порошка или несколько капель жидкого реагента к пробе воды в многоразовой пластиковой пробирке. Затем пользователь помещает пробирку с образцом в небольшой пластиковый смотровой ящик. Этот смотровой бокс содержит пластиковый диск с напечатанным на нем градиентом цвета. Пользователь вращает цветной диск, чтобы найти часть, которая лучше всего соответствует цвету образца, а затем считывает концентрацию химического вещества с диска. Комплекты цветных дисков обычно состоят из нескольких этапов и часто включают предписанное время ожидания, поэтому они немного сложнее и дороже, но обычно более точны.
- Переносные цифровые инструменты — Для тестирования воды доступны легкие и портативные цифровые измерители, колориметры и фотометры. Они обеспечивают наиболее точные результаты этих трех методов тестирования, но они также более дорогие и тонкие, чем предыдущие варианты.
 Эти инструменты требуют батарей и калибровки. Хотя цифровые инструменты полезны для полевых специалистов и являются важной частью любой сети постоянного или удаленного мониторинга, они вряд ли подходят для «гражданской науки» или краудсорсингового тестирования качества воды.
Эти инструменты требуют батарей и калибровки. Хотя цифровые инструменты полезны для полевых специалистов и являются важной частью любой сети постоянного или удаленного мониторинга, они вряд ли подходят для «гражданской науки» или краудсорсингового тестирования качества воды.
Химические параметры качества воды
После определения различных форматов тестирования возникает следующий вопрос: для чего мы тестируем? ЮНИСЕФ рекомендует отдавать приоритет фторидам, мышьяку и нитратам для химического мониторинга. В областях, где земля естественным образом богата минералами, содержащими фтор и мышьяк, уровни в колодезной воде могут быть достаточно высокими, поэтому хроническое воздействие опасно для здоровья человека [1].Как мы можем проверить эти элементы?
- Фторид: Для определения фторида имеется по крайней мере один набор для тестирования цветного диска.Однако портативные цифровые колориметры часто предпочитают из-за опасений по поводу точности.
 Система тестирования Ackvo Caddisfly недавно описала колориметрический тест на фторид, который можно прочитать в приложении для смартфона.
Система тестирования Ackvo Caddisfly недавно описала колориметрический тест на фторид, который можно прочитать в приложении для смартфона. - Arsenic: Возможности портативных полевых испытаний мышьяка ограничены; это загрязнение лучше всего измерять в лаборатории. Существуют коммерчески доступные тестовые наборы, но они относительно сложны и требуют нескольких шагов. Хотя концентрации мышьяка, «измеренные» этими тестовыми наборами, могут быть неточными, наборы действительно обнаруживают мышьяк почти во всех образцах, концентрация которых превышает 100 микрограммов на литр (мкг / л), а также в большинстве образцов с концентрацией 50-99 мкг / л. ассортимент.Поэтому ЮНИСЕФ рекомендовал сообщать результаты мониторинга мышьяка с помощью этих портативных тестов как «присутствующие» или «отсутствующие» с использованием эталонной концентрации 50 мкг / л — стандарта питьевой воды во многих странах, затронутых естественным загрязнением мышьяком.
- Нитраты: Для тестирования нитратов доступны как тест-полоски, так и тестовые наборы с цветными дисками.
 Нитраты также можно измерить с помощью цифрового измерителя. Высокие уровни питательных веществ связаны с загрязнением сельского хозяйства удобрениями (азотом и фосфором) и отходами животноводства (азот).Туалеты, сточные воды, свалки и промышленные загрязнения также могут вносить азот. Мониторинг нитратов — это простой способ оценить влияние сельскохозяйственных и человеческих отходов на качество воды.
Нитраты также можно измерить с помощью цифрового измерителя. Высокие уровни питательных веществ связаны с загрязнением сельского хозяйства удобрениями (азотом и фосфором) и отходами животноводства (азот).Туалеты, сточные воды, свалки и промышленные загрязнения также могут вносить азот. Мониторинг нитратов — это простой способ оценить влияние сельскохозяйственных и человеческих отходов на качество воды.
- Железо и Марганец : для этих двух металлов доступны как тестовые полоски, так и тесты на цветных дисках, которые также можно измерить с помощью портативных цифровых инструментов.
 Полевые испытания с использованием цифрового оборудования считаются надежными для железа и марганца.
Полевые испытания с использованием цифрового оборудования считаются надежными для железа и марганца. - TDS : TDS включает смесь неорганических солей, в основном натрия, хлорида, калия, кальция и магния. Вместо тестирования отдельных компонентов, TDS контролируется путем измерения проводимости воды с помощью цифрового измерителя.Здесь нет тест-полосок или набора цветных дисков, которые можно использовать здесь, хотя по крайней мере один измеритель проводимости взаимодействует со смартфоном.
- pH : полоски для тестирования pH и тесты на цветных дисках широко доступны. Более дорогие и высокотехнологичные варианты включают pH-метры на основе электродов. pH — это мера активности ионов водорода, что означает, что он говорит нам, насколько вода кислая или щелочная.pH не является загрязнителем, но это основная химическая переменная.
 Это влияет на поведение других химических компонентов, включая эффективность остаточного хлора против микробного загрязнения. Внезапные изменения pH также могут указывать на выход из строя очистных сооружений или случаи загрязнения природных водоемов (например, незаконные промышленные сбросы).
Это влияет на поведение других химических компонентов, включая эффективность остаточного хлора против микробного загрязнения. Внезапные изменения pH также могут указывать на выход из строя очистных сооружений или случаи загрязнения природных водоемов (например, незаконные промышленные сбросы). - Хлор : Есть много простых способов проверить остаточный хлор, включая тест-полоски, цветные диски и даже наборы, разработанные для тестирования бассейнов.Также существуют портативные цифровые измерители, которые могут обеспечивать надежные количественные измерения.
 g., полихлорированные бифенилы, цианиды). Наконец, тяжелых металлов , таких как свинец, ртуть, медь, хром и т. Д., Часто представляют местный интерес.
g., полихлорированные бифенилы, цианиды). Наконец, тяжелых металлов , таких как свинец, ртуть, медь, хром и т. Д., Часто представляют местный интерес.Однако подавляющее большинство этих дополнительных тестов лучше всего проводить в лаборатории, учитывая современные технологии. Тем не менее, низкотехнологичное тестирование — часто с использованием смартфона — является областью активных исследований таких параметров, как ртуть и пестициды (также здесь).
Следите за обновлениями в нашей следующей публикации, которая будет посвящена микробиологическому тестированию воды!
[1] Если предыдущие испытания показали, что мышьяк и фторид не являются проблемой в конкретной водной системе, эти два параметра могут быть опущены в пользу более значимых для местных условий.Загрязнение мышьяком и фтором также может быть вызвано деятельностью человека, например, сбросом промышленных отходов или горнодобывающей промышленности. [2] Низкотехнологичные тесты растворенного кислорода требуют нескольких этапов с добавлением реагентов с последующим титрованием по каплям; может потребоваться некоторое обучение, и результаты могут быть более разными, чем у других наборов тестов.

 Определение хлора
Определение хлора д.
д.

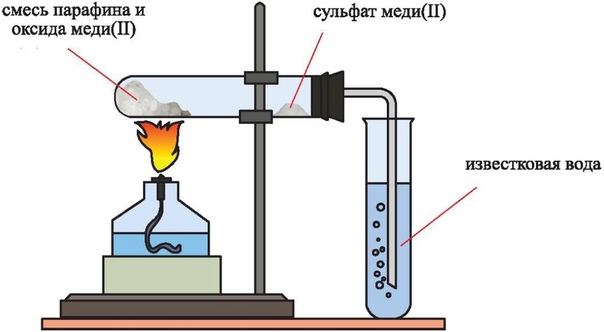

 Эти инструменты требуют батарей и калибровки. Хотя цифровые инструменты полезны для полевых специалистов и являются важной частью любой сети постоянного или удаленного мониторинга, они вряд ли подходят для «гражданской науки» или краудсорсингового тестирования качества воды.
Эти инструменты требуют батарей и калибровки. Хотя цифровые инструменты полезны для полевых специалистов и являются важной частью любой сети постоянного или удаленного мониторинга, они вряд ли подходят для «гражданской науки» или краудсорсингового тестирования качества воды. Система тестирования Ackvo Caddisfly недавно описала колориметрический тест на фторид, который можно прочитать в приложении для смартфона.
Система тестирования Ackvo Caddisfly недавно описала колориметрический тест на фторид, который можно прочитать в приложении для смартфона. Нитраты также можно измерить с помощью цифрового измерителя. Высокие уровни питательных веществ связаны с загрязнением сельского хозяйства удобрениями (азотом и фосфором) и отходами животноводства (азот).Туалеты, сточные воды, свалки и промышленные загрязнения также могут вносить азот. Мониторинг нитратов — это простой способ оценить влияние сельскохозяйственных и человеческих отходов на качество воды.
Нитраты также можно измерить с помощью цифрового измерителя. Высокие уровни питательных веществ связаны с загрязнением сельского хозяйства удобрениями (азотом и фосфором) и отходами животноводства (азот).Туалеты, сточные воды, свалки и промышленные загрязнения также могут вносить азот. Мониторинг нитратов — это простой способ оценить влияние сельскохозяйственных и человеческих отходов на качество воды. Полевые испытания с использованием цифрового оборудования считаются надежными для железа и марганца.
Полевые испытания с использованием цифрового оборудования считаются надежными для железа и марганца. Это влияет на поведение других химических компонентов, включая эффективность остаточного хлора против микробного загрязнения. Внезапные изменения pH также могут указывать на выход из строя очистных сооружений или случаи загрязнения природных водоемов (например, незаконные промышленные сбросы).
Это влияет на поведение других химических компонентов, включая эффективность остаточного хлора против микробного загрязнения. Внезапные изменения pH также могут указывать на выход из строя очистных сооружений или случаи загрязнения природных водоемов (например, незаконные промышленные сбросы).