Лабораторная работа №7 Химические свойства металлов
Цель работы: Изучить химические свойства металлов
Теоретическая часть:
Свободные металлы являются восстановителями. Их восстановительная способность меняется в широких пределах и служит мерой химической активности. За меру химической активности металла принимается его способность переходить в состояние положительно заряженного иона, теряя при этом электроны.
Русский ученый Н.Н.Бекетов расположил все металлы в порядке уменьшения их активности. Полученный ряд был назван «вытеснительным рядом», а теперь он известен как ряд активности металлов.
Li K Ba Ca Na Mg Be Al Zn Cr Fe Cd Bi Sn Pb H
Металлы,
расположенные в ряду активностей левее
цинка, считаются активными металлами. Металлы, начиная с цинка, расположенные
в ряду активностей до водорода, считаются
металлами средней активности. Металлы
стоящие после водорода, являются
малоактивными.
Металлы, начиная с цинка, расположенные
в ряду активностей до водорода, считаются
металлами средней активности. Металлы
стоящие после водорода, являются
малоактивными.
Каждый металл вытесняет из растворов солей все металлы, которые следуют за ним в ряду активностей.
Взаимодействие металлов с водой, щелочами, кислотами.
Тем, что атомы свободных металлов легко отдают внешние электроны, объясняется такое свойство типичных металлов как способность реагировать с водой, щелочами, кислотами.
Взаимодействие металлов с водой.
Активные металлы разлагают воду с вытеснением водорода, при комнатной температуре:
2Na + 2H2O = 2NaOH + H 2 2Na0 – 2e 2 Na+
2H + + 2e H2
Менее активные
металлы вступают в реакцию с водой при
нагревании.
Взаимодействие металлов с щелочами
Со щелочами могут взаимодействовать металлы, имеющие амфотерные оксиды (Be,Zn. Al). В этом случае металлы образуют анионы своих кислот.
Be + 2KOH = K2BeO2 + H2 Be 0 – 2e Be2+
2H + + 2e H2
Взаимодействие металлов с кислотами
С кислотами металлы реагируют различно в зависимости от активности металла и окислительных свойств кислоты.
1.
В реакции с галогеноводородными кислотами
(HCl,HBr),
а также с разбавленной серной кислотой
могут вступать только металлы, стоящие
в ряду активности до водорода. В этом
случае окислителем являются ионы Н
Fe + 2HCl = FeCl2 + H2 Fe 0 – 2e Be2+
2H + + 2e H2
2. В
концентрированном растворе H2SO4 окислителем
выступают атомы серы со степенью
окисления +6.
В
концентрированном растворе H2SO4 окислителем
выступают атомы серы со степенью
окисления +6.
Металлы малой активности восстанавливают серную кислоту до диоксида серы SO2, среднеактивные металлы – атомарной серы, а более активные до H2S.
Cu + 2H2SO4 = CuSO4 + SO 2
+ H2 Cu 0 – 2e Cu2+S +6 + 2e S+4
Пассивацией металла называется его энергичное окисление концентрированной кислотой, в результате чего поверхность металла покрывается плотной пленкой оксида, предохраняющей металл от дальнейшего окисления.
Концентрированная серная кислота пассивирует на холоде железо.
3.
В растворе азотной кислоты любой
концентрации окислителем являются
атомы азота со степенью окисления +5. Продукты восстановления HNO3 металлом
зависят от концентрации кислоты и
активности металла.
Продукты восстановления HNO3 металлом
зависят от концентрации кислоты и
активности металла.
Таблица 1
Возможные продукты окисления
Концентрация HNO3 | Активные металлы | Среднеактивные металлы | Малоактивные металлы |
Концентрированная =1,45 | NO | NO | NO2 |
Разбавленная =1,2 | N2O | NO | NO |
Очень разбавленная =1,0 | NH4NO3 | — | — |
Концентрированная
азотная кислота при обычной температуре
пассивирует железо, алюминий, никель,
хром, марганец.
Практическая работа «Химические свойства металлов»
Тема урока: Химические свойства металлов.
Тип урока: практическая работа.
Цели и задачи урока:
- закрепить на практике знания химических свойств металлов;
- продолжить формирование умений наблюдать за явлениями и делать выводы;
- продолжить формирование умений и навыков учащихся по использованию лабораторного оборудования для проведения эксперимента.
Методы и методические приемы: репродуктивный (повторение), наглядный, поисковый.
Оборудование и реактивы:
- лоток, пробирки, штатив для пробирок, щипцы, спиртовка, соляная кислота, серная кислота, цинк, сульфат меди(II), железо;
- методичка для выполнения опытов;
- творческое задание.
ХОД УРОКА
I. Организационный момент
Организационный момент
II. Актуализация знаний (вводная часть)
Учитель: Мы изучаем тему «Металлы», познакомились с нахождением металлов в Периодической системе элементов Д.И.Менделеева, их физическими и химическими свойствами. Вспомните, какие химические свойства металлов нам известны?
Ученик: Взаимодействие с простыми веществами (кислородом, хлором, серой, азотом) и сложными веществами (водой, кислотами, солями).
Учитель: При изучении химических свойств металлов мы рассмотрели реакцию их взаимодействия с водой, а теперь вам предстоит познакомиться на практике еще с некоторыми свойствами металлов.
III. Практическая работа
Учитель: Итак, откройте тетради, запишите дату и приступайте к оформлению работы по заданному образцу.
На доске образец оформления работы (продублирован в рабочих картах):
Практическая работа № 1.
 Химические
свойства металлов
Химические
свойства металловЦель работы: на практике познакомиться с основными химическими свойствами металлов. Повторить навыки обращения с лабораторным оборудованием и реактивами.
Приборы и реактивы: (заполняется учащимися самостоятельно, исходя из предложенных материалов, согласно варианту).
Ход работы:
Что делал |
Что наблюдал | Уравнения реакций | Выводы |
| Опыт 1 |
|
|
|
| Опыт 2 |
|
|
|
Общий вывод:
Учитель: Перед выполнением опытов,
давайте повторим основные правила проведения
эксперимента и техники безопасности.
Ученик: Действия производятся над лотком,
на расстоянии вытянутой руки, на уровне глаз.
Банки с реактивами берутся в руку этикеткой
внутрь, реактив наливается 1–2 мл, но если
перелили, то обратно в банку не возвращается.
Учитель: Приступаем к проведению
опытов.
Учащиеся выполняют опыты по вариантам (1, 2) группами по 4 человека.
IV. Закрепление материала
Учитель: для проверки полученных вами знаний поработайте над творческим заданием – отгадайте по описанным свойствам о каком металле идет речь и ответьте на вопросы.
Вариант 1.
Конечно, мы металлы – дружная семья,
Но все же всех прекрасней – я.
Я красная, блестящая и очень работящая.
Ведь если нужно потрудиться, ток вам проводя,
Все тут же вспоминают про меня.
И если колокол звенит, под куполом паря,
Так это я звеню, всем музыку даря.
Доспехи в древности для рыцаря, коня
Ведь тоже делали при помощи меня.
А вот теперь в карман залезьте
И монетами звеня, вы дружно угадайте
Кто же я?
А заодно ответьте, правды не тая,
Вот почему же люди, красоту мою ценя
Посуду-то не делают, скажите из меня?
Ученик: Этот металл – медь. Медь не применяют для производства посуды, потому что изделия из меди в присутствии влаги покрываются темно-зеленой пленкой.
Вариант 2.
Прославился я твердостью и прочностью своей,
И потому-то мною исписал стекло злодей,
Но нет полезней нас с танталом для людей.
Когда хирург не смог собрать костей,
То обратился к помощи моей.
Так вот ответьте, почему же?
И имя постарайтесь отгадать к тому же.
Ученик: Этот металл – титан. Он
применяется в хирургии для восполнения
утраченных фрагментов костей, так как
является устойчивым к окислительным
процессам, происходящим в организме человека.
V. Рефлексия
Учитель: Что мы закрепили сегодня на уроке? Какие вопросы у вас остались неразрешенными?
Ученик: Мы повторили и закрепили на практике химические свойства металлов.
Учитель: Запишите в дневниках домашнее задание – стр. 34– 37, в. 1 , з.7 (стр. 37).
Рабочая карта
1. Оформление работы
Практическая работа № 1. Химические свойства металлов.
1 вариант.
Цель работы: на практике познакомиться с основными химическими свойствами металлов. Повторить навыки обращения с лабораторным оборудованием и реактивами.
Приборы и реактивы:
Ход работы:
Что делал |
Что наблюдал | Уравнения реакций | Выводы |
| Опыт 1 |
|
|
|
| Опыт 2 |
|
|
|
Общий вывод:
2. Описание проведения опытов
Описание проведения опытов
Опыт 1. Поместите в пробирку кусочек цинка и добавьте 1–2 мл раствора серной кислоты.
Опыт 2. Зажмите щипцами медную проволоку и прокалите в пламени спиртовки до образования черного налета.
3. Творческое задание
Конечно, мы металлы – дружная семья,
Но все же всех прекрасней – я.
Я красная, блестящая и очень работящая.
Ведь если нужно потрудиться, ток вам проводя,
Все тут же вспоминают про меня.
И если колокол звенит, под куполом паря,
Так это я звеню, всем музыку даря.
Доспехи в древности для рыцаря, коня
Ведь тоже делали при помощи меня.
А вот теперь в карман залезьте
И монетами звеня, вы дружно угадайте
Кто же я?
А заодно ответьте, правды не тая,
Вот почему же люди, красоту мою ценя
Посуду-то не делают, скажите из меня?
Рабочая карта.
1. Оформление работы
Практическая работа № 1. Химические свойства металлов.
2 вариант.
Цель работы: на практике познакомиться с основными химическими свойствами металлов. Повторить навыки обращения с лабораторным оборудованием и реактивами.
Приборы и реактивы:
Ход работы:
Что делал |
Что наблюдал |
Уравнения реакций |
Выводы |
| Опыт 1 |
|
|
|
| Опыт 2 |
|
|
|
Общий вывод:
2. Описание проведения опытов
Описание проведения опытов
Опыт 1. Поместите в пробирку кусочек цинка и добавьте 1–2 мл раствора соляной кислоты.
Опыт 2. Налейте в пробирку 1–2 мл сульфата меди(II) и поместите в данный раствор кусочек железа. Оставьте систему на 5 минут, после чего аккуратно достаньте железо.
3. Творческое задание
Прославился я твердостью и прочностью своей,
И потому-то мною исписал стекло злодей,
Но нет полезней нас с танталом для людей.
Когда хирург не смог собрать костей,
То обратился к помощи моей.
Так вот ответьте, почему же?
И имя постарайтесь отгадать к тому же.
Свойства металлов Научный урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.
Металлы находятся в центре и слева в таблице Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок науки о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.
- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму.
 На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.
На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки. - Проводимость: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это с помощью некоторых предметов домашнего обихода. Продолжайте читать, чтобы узнать, как!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реактивность : Некоторые металлы претерпевают химическое изменение (реакцию) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они находятся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они находятся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не реагируют с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются в виде чистых металлов, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений. Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны.
Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также более твердые и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Бедные металлы довольно мягкие, и большинство из них не используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные комбинации
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе. Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются обработке и выглядят красиво. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения. Чистота золота измеряется в карат. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды – это горные породы или минералы, из которых можно извлечь ценное вещество – обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: обработка и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже отверстия в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом. Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому химическому разрушению или коррозии .
Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Железо и сталь, с другой стороны, имеют серьезные проблемы, если они не обработаны для предотвращения коррозии. Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другим методом является гальванизация : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Технология: фейерверк и химия
Если вы посмотрите фейерверк на Четвертое июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад. Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, который при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездами , и сделаны из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Соединения с меньшей реакционной способностью не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Дополнительная литература о металлах:
- Скульптура из вращающейся проволоки
- Проекты Ярмарки химических наук
- Проекты Ярмарки наук по физике
- Проекты
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21742
Цели обучения
- Понять основные свойства, отличающие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, ковалентные |
| Образуют катионы в водном растворе | Образуют анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, образующие положительные ионы за счет потери электронов в ходе химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются прекрасными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются прекрасными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут быть отполированы, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле. - Пластичность: Металлы можно волочить в проволоку. Например, 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на самой внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что они имеют свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Температура плавления и кипения : Металлы имеют высокие температуры плавления и кипения. У вольфрама самые высокие температуры плавления и кипения, а у ртути самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т.е. окисляются ), когда подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в с подоболочкой)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 9{-}} \label{1.
 3} \]
3} \]Соединения металлов с неметаллами имеют тенденцию быть ионными по своей природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\[\ce{Na2O(s) + h3O(l) \rightarrow 2NaOH(aq)}\label{1.4} \]
\[\ce{CaO(s) + h3O(l) \rightarrow Ca(OH)2(aq)} \label{1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислоты 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение реакции оксида алюминия с азотной кислотой:
Раствор
90 003Оксид металла + кислота -> соль + вода
\[\ce{Al2O3(s) + 6HNO3(aq) \rightarrow 2Al(NO3)3(aq) + 3h3O(l)} \nonumber \]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами.
 Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существуют в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое тело (углерод). Только бром существует в виде жидкости при комнатной температуре.
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \(\ce{h3(g)}\), \(\ce{N2(g)}\), \(\ce{O2(g) }\), \(\ce{F2(g)}\), \(\ce{Cl2(g)}\), \(\ce{Br2(l)}\), \(\ce{I2( с)}\).

Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. Они электроотрицательны по характеру. Неметаллы, реагируя с металлами, имеют тенденцию приобретать электроны (обычно приобретают электронную конфигурацию благородного газа) и становятся анионы:
\[\ce{3Br2(l) + 2Al(s) \rightarrow 2AlBr3(s)} \nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами. Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\[\ce{CO2(g) + h3O(l)} \rightarrow \underset{\text{угольная кислота}}{\ce {h3CO3(aq)}} \nonumber \]
Как вы знаете, газированная вода слабокислая (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\[\ce{CO2(g) + 2NaOH(aq) \rightarrow Na2CO3(aq) + h3O(l)} \nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — характеристика некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — характеристика некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.Таблица \(\PageIndex{2}\): Элементы, разделенные на металлы, неметаллы и металлоиды. Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Железо Азот Сурьма Меркурий Сера Германий Цинк Фосфор Тенденции металлических и неметаллических свойств
Металлический характер наиболее силен для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер увеличивается с увеличением электроотрицательности и ионизации).
 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
Неметаллический характер увеличивается снизу вверх и слева направо с наибольшим количеством неметаллических элементов в правом верхнем углу. металлический характер демонстрирует противоположную тенденцию: самый металлический элемент находится внизу слева.Авторы и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- нет на стр.



 На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.
На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
 3} \]
3} \] Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — характеристика некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — характеристика некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.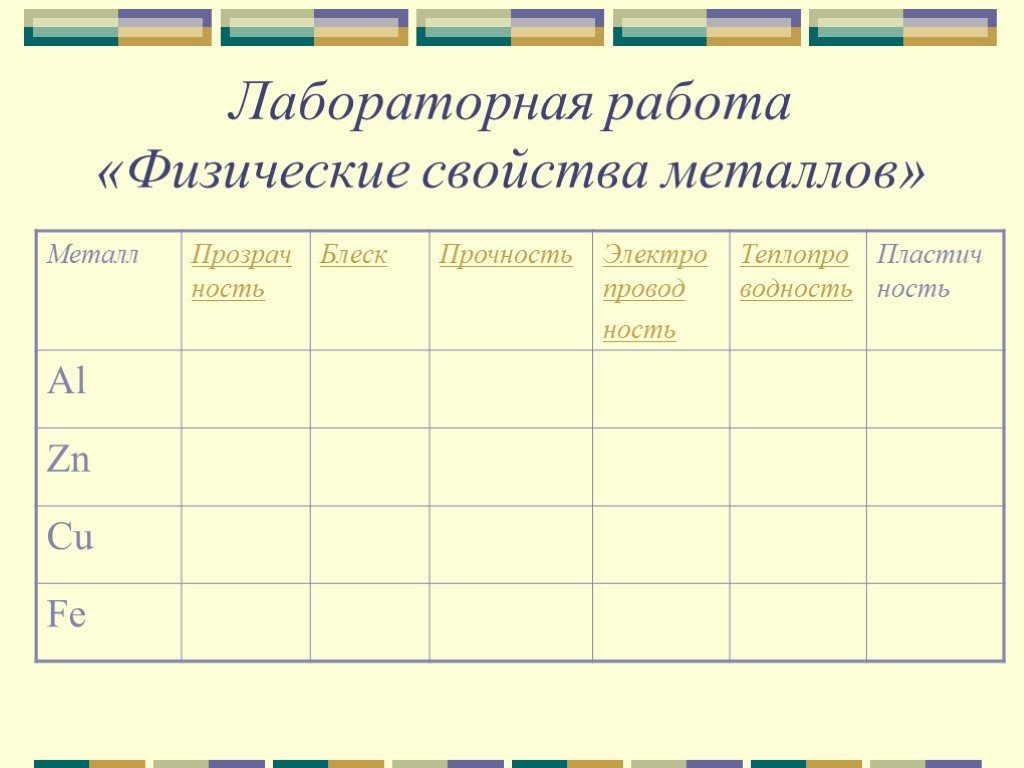 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.