Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → CaO → Ca(OH)
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг.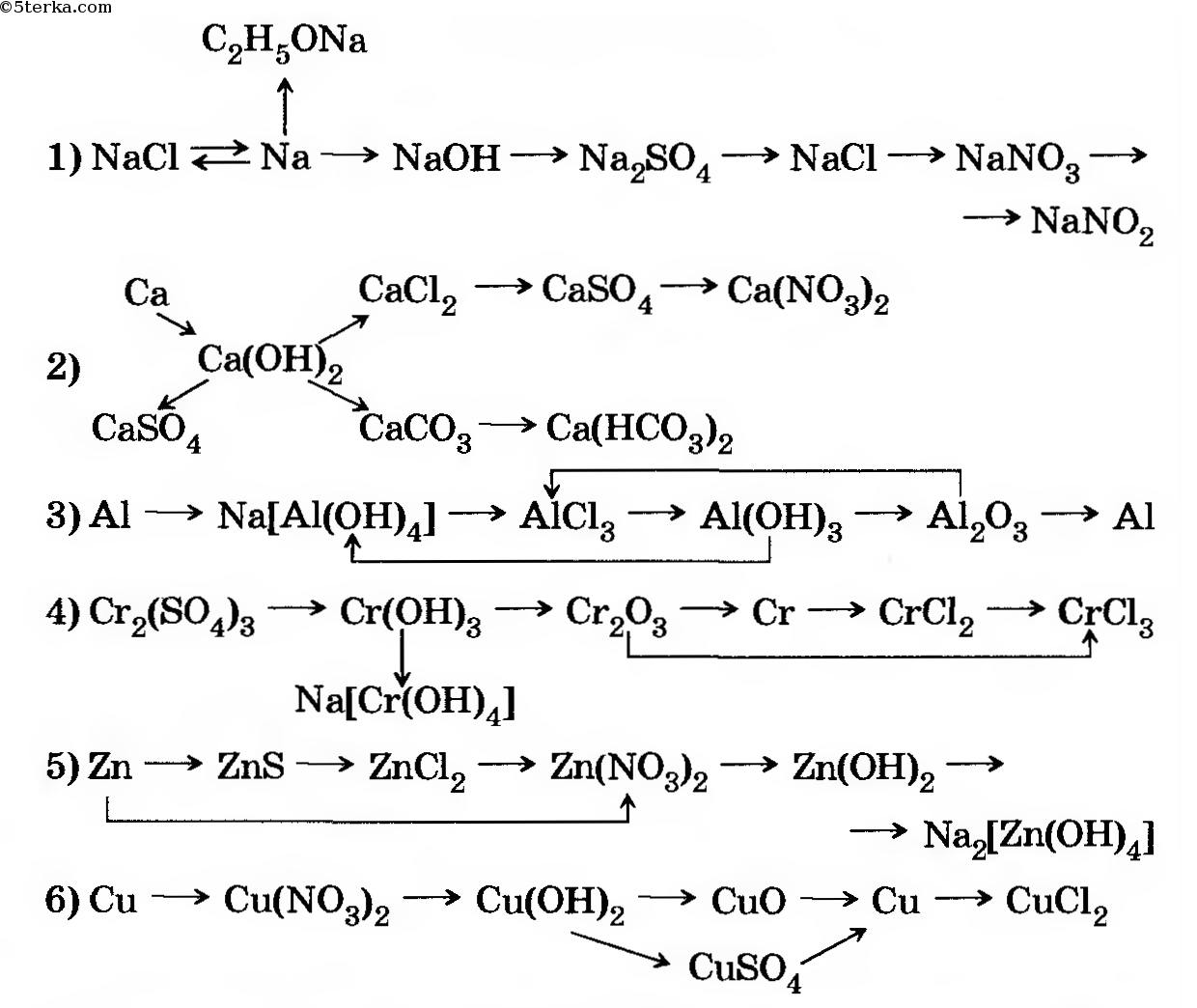 Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 2Ca+2O-2
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca +2O-2 + H2O → Ca 2+(OH)2—
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2— + 2H3+PO43- → Ca32+(PO4)23- + 6H2O
Органические цепочки из ЕГЭ с решениями (50 цепочек).
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение1) Уравнение спиртового брожения глюкозы под действием дрожжей:
2) Этиловый спирт сернокислым раствором перманганата калия может быть окислен до уксусной кислоты:
3) Уравнение нейтрализации уксусной кислоты гидроксидом натрия:
4) Взаимодействие солей карбоновых кислот со щелочами при сплавлении приводит к образованию углеводорода с меньшим числом атомов углерода
5) Алканы вступают в реакцию нитрования с разбавленной азотной кислотой при сильном нагревании:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) При нагревании одноатомных спиртов с концентрированной серной кислотой выше 140 оС протекает внутримолекулярная дегидратация с образованием алкена:
2) Алкены вступают в реакцию соединения с бромом. При этом атомы брома присоединяются по месту двойной связи, сами двойная связь превращается в одинарную:
3) Вицинальные дигалогенпроизоводные углеводородов при нагревании с некоторыми металлами, например, цинком или магнием, образуют алкены:
4) Гидратация несимметричных алкенов протекает в соответствии с правилом Марковникова:
5) Вторичные спирты в ЕГЭ окисляем до соответствующих кетонов (углеродный скелет не рвем):
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение1) При бромировании бутана на свету образуется преимущественно 2-бромбутан:
2) При действии на галогенпроизводные алканов спиртового раствора щелочи при нагревании образуется алкен. Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
3) Бутен-2, реагируя с бромом, образует 2,3-дибромбутан:
4) 2,3-дибромбутан при реакции с избытком спиртового раствора щелочи образует бутин-2:
5) Гидратация алкинов с числом углеродных атомов в молекуле больше 2-х приводит к образованию кетонов:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решениеv1) Реакция алкенов с нейтральным холодным раствором перманганата калия приводит к образованию соответствующих вицинальных диолов:
2) Взаимодействие этиленгликоля с избытком бромоводорода приводит к образованию 1,2-дибромэтана:
3) Дегидрогалогенирование вицинальных дигалогеналканов действием спиртового раствора щелочи приводит к образованию соответствующих алкинов:
4) В результате гидратации ацетилена в присутствии солей ртути образуется ацетальдегид:
5) Совместное нагревание ацетальдегида с гидроксидом меди (II) приводит к его окислению до уксусной кислоты. Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеЗадание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеЗадание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеЗадание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеЗадание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №24
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №25
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №26
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №27
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №28
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №29
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №30
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №31
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. Решение Ответ:Задание №32
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.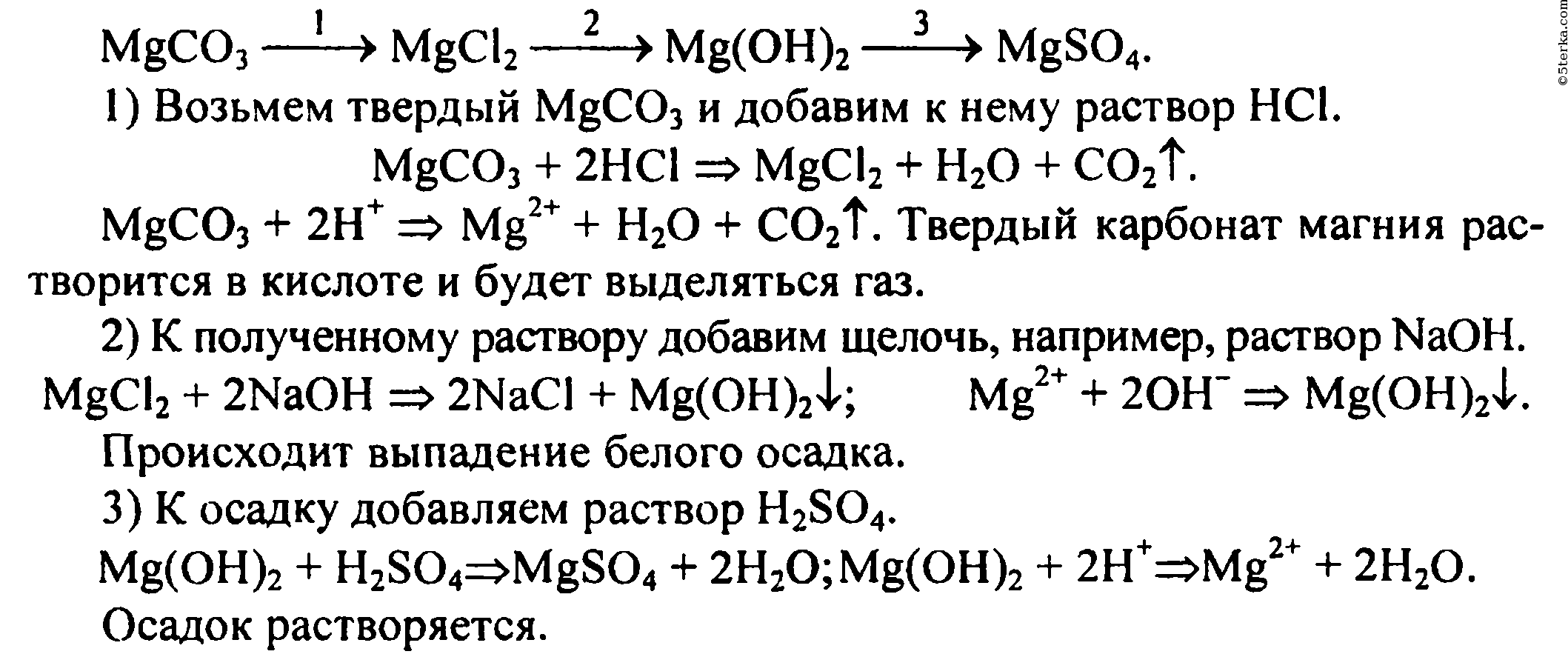
Ответ:
Задание №34
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №35
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №36
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №37
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №38
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №39
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №40
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №41
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Задание №42
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №43
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №44
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №45
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.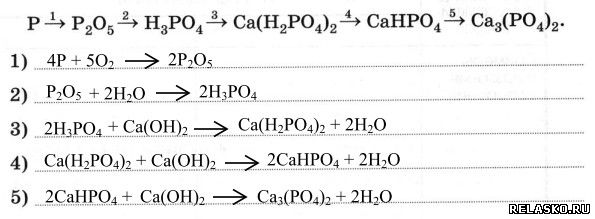
Ответ:
Задание №46
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №47
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №48
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
РешениеОтвет:
Задание №49
Напишите уравнения реакций, с помощью которых можно осуществить следующие превраще
Органические цепочки для подготовки к ЕГЭ по химии 2017 года.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
РешениеПояснение:
1) Получить ацетилен из 1,2-дибромэтана можно, подействовав на него спиртовым раствором щелочи при нагревании. При этом от одной молекулы дибромэтана отщепляются две молекулы бромоводорода, которые нейтрализуются щелочью:
2) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция М.Г. Кучерова):
3) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
4) Гидрокарбонаты аналогично карбонатам вступают в реакцию обмена с растворами кислот:
5) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию разложения, в результате которой образуется карбонат металла и кетон:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
РешениеПояснение:
1) Под действием катализаторов гидрирования/дегидрирования (платина, никель, палладий) алканы с длиной углеродной цепи более 6-ти атомов при нагревании могут вступать в реакцию дегидроциклизации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат.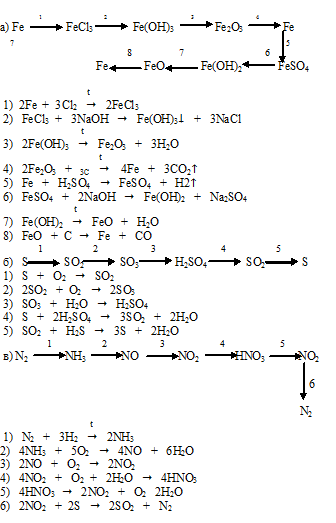 — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При хлорировании этилбензола на свету замещение происходит не в ароматическом ядре, а в боковой цепи. При этом замещение атомов водорода происходит преимущественно у вторичного, а не первичного углеродного атома:
4) Моногалогенпроизводные углеводородов при действии водных растворов щелочей вступают в реакцию замещения. При этом образуются спирты соответствующего строения:
5) 1-фенилэтанол при действии таких окислителей, как перманганат калия или дихромат калия в присутствии серной кислоты может окислиться до кетона, либо до бензойной кислоты и углекислого газа. Любой вариант из двух записанных ниже реакций засчитывался на экзамене:
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
РешениеПояснение:
1) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь. При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
* Напомним, что для того чтобы замещение атома водорода атомом галогена происходило в ароматическом ядре, а не боковой цепи, галогенирование следует проводить в присутствии соответствующего галогенида алюминия или трехвалентного железа.
1) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Если бы раствор щелочи был водным, то вместо указанной реакции произошло бы замещение атома галогена в галогенпроизводном на гидроксильную группу.
3) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
4) Бензойная кислота реагирует с раствором гидрокарбоната (как и карбоната) натрия, поскольку является более сильной, чем образующаяся нестойкая угольная:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При гидрировании бутадиена-1,3 и изопрена протекает преимущественно так называемое 1,4-присоединение:
2) Действие на алкены подкисленного раствора перманганата или дихромата относят к так называемому жесткому окислению. При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Действием на галогенпроизводные карбоновых кислот избытка аммиака получают соответствующие аминокислоты:
5) Аминокислоты реагируют с щелочами с образованием солей:
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Сложные эфиры могут вступать в реакции гидролиза. При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
* Следует отметить, что сложные эфиры могут также состоять из остатков карбоновых кислот и фенолов. При щелочном гидролизе таких эфиров образуются две соли — соль карбоновой кислоты и фенолят активного металла.
2) Соли, состоящие из остатков карбоновых кислот и катионов щелочноземельных металлов, при нагревании вступают в реакцию декарбоксилирования — образуются соответствующие карбонат двухвалентного металла и кетон:
3) Кетоны легко гидрируются в присутствии катализаторов (Pt, Pd, Ni) до соответствующих вторичных спиртов:
4) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
5) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий):
2) Спирты реагируют с галогеноводородными кислотами, образуя соответствующие галогенпроизводные:
3) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси). В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
5) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление нитросоединений до солей аминов:
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь:
4) При щелочном гидролизе геминальных дигалогенпроизводных образуются альдегиды или кетоны:
5) Альдегиды под действием таких окислителей, как гидроксид меди (II), перекись водорода, а также подкисленные растворы перманганатов и дихроматов превращаются в соответствующие карбоновые кислоты:
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Спирты при нагревании с концентрированной серной кислотой могут вступать в реакцию внутримолекулярной дегидратации, приводящей к образованию алкенов:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра.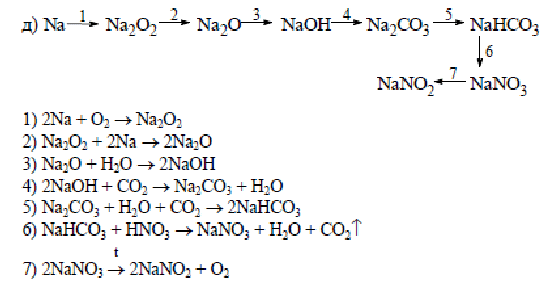 В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Действие на 1,3-дибромпропан цинковой пыли приводит к образованию циклопропана:
2) В циклоалканах с малым размером цикла (3 и 4 углеродных атома) в связи с малыми значениями валентных углов С-С-С имеется сильное напряжение внутри молекулы. Такие соединения легко вступают в реакцию присоединения с водородом, галогенами и галогеноводородами подобно алкенам:
* В отличие от алкенов циклоалканы не реагируют с водой и водным раствором перманганата калия.
3) Действие на моногалогеналканы спиртового раствора щелочи
4) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи.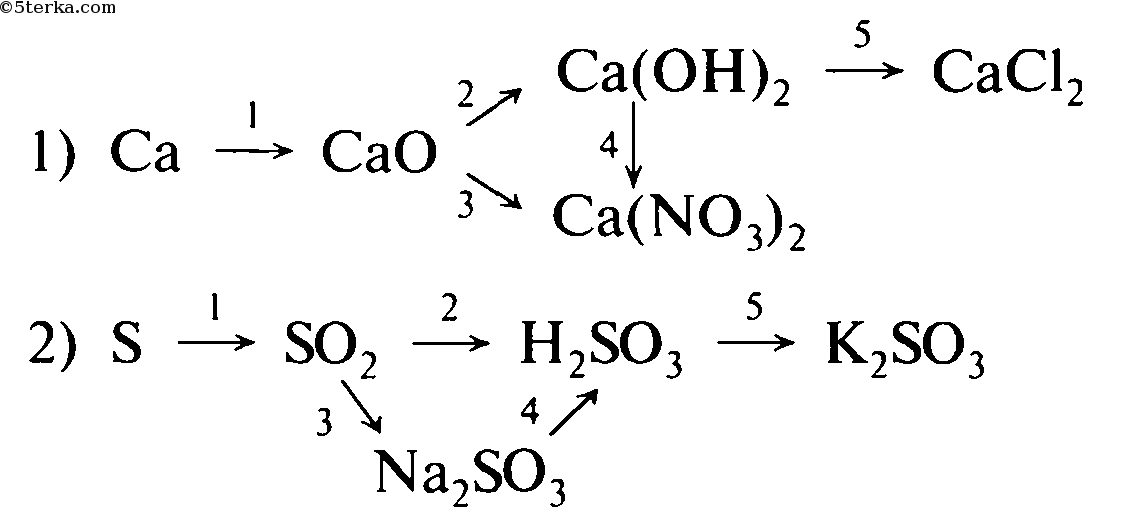 При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
5) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя из них более слабую угольную кислоту:
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии воды на карбид кальция протекает реакция обмена, одним из продуктов которой является ацетилен:
2) Ацетилен в присутствии солей ртути вступает в реакцию гидратации:
3) Альдегиды легко окисляются до карбоновых кислот или их солей. В карбоновые кислоты альдегиды могут быть превращены действием таких реагентов, как Cu(OH)2, H2O2, подкисленные растворы K2Cr2O7 или KMnO4:
4) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
5) При сплавлении твердых соли карбоновой кислоты и щелочи протекает реакция декарбоксилирования:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на бензол и его гомологи брома или хлора в присутствии галогенидов алюминия или железа (III) галогенированию подвергается ароматическое ядро. В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-бромтолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
4) При смешении п-бромтолуола с бромметаном и натрием протекает реакция Вюрца-Фиттига:
5) Гомологи бензола, представляющие собой метилзамещенный бензол, при действии подкисленного раствора перманганата калия окисляются до карбоновой кислоты. При этом
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Нагревание метана до 1200-1500 oC приводит к образованию ацетилена и водорода:
2) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на толуол раствора перманганата калия в кислой среде образуется бензойная кислота, а в нейтральной или щелочной — соль бензойной кислоты:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии хлора или брома на алканы при ультрафиолетовом облучении протекает реакция замещения с образованием галогеналкана и соответствующего галогеноводорода. В зависимости от от пропорции галоген/алкан замещаться на галоген может один или более атомов водорода:
2) При действии натрия на моногалогеналканы протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана. При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
2) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на изопропилбензол (кумол) хлора или брома в реакцию замещения вступает боковая цепь ароматического углеводорода. При этом, как и в случае алканов, замещению подвергается атом водорода при наиболее замещенном атоме углерода, в нашем случае — третичном:
5) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При нагревании алканов в присутствии таких катализаторов, как платина, никель, палладий или оксид хрома (III) можно осуществлять реакцию дегидрирования:
2) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
3) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
4) При действии на пропин катализаторов при нагревании протекает реакция, аналогичная тримеризации ацетилена. При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
5) При действии на метилзамещенные бензолы перманганата или дихромата калия в кислой среде все метильные радикалы превращаются в карбоксильные группы:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция Кучерова):
* Гомологи ацетилена в этих же условиях вместо альдегида образуют кетон.
2) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
3) Органические кислоты подобно неорганическим реагируют с основными оксидами, образуя соль и воду:
4) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию декарбоксилирования, в результате которой образуется карбонат металла и кетон:
5) Кетоны способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование вторичного спирта:
Результатом такой реакции является образование вторичного спирта:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование первичного спирта:
2) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
3) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
4) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
5) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии на альдегиды нейтрального либо щелочного раствора перманганата калия они окисляются, образуя соли карбоновых кислот соответствующего строения:
2) При проведении электролиза растворов солей карбоновых кислот происходит образование углеводорода, углекислого газа, водорода и щелочи:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
2) Первичные спирты действием перманганата или дихромата калия в кислой среде могут быть окислены до альдегидов либо до карбоновых кислот:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя более слабую угольную кислоту, которая будучи нестойкой разлагается на углекислый газ и воду
5) Действием галогенпроизводных на соли, образованные щелочными металлами и карбоновыми кислотами, могут быть получены сложные эфиры:
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение1) Этилбензол при действии подкисленного раствора дихромата или перманганата калия окисляется с образованием бензойной кислоты и углекислого газа:
2) Карбоновые кислоты реагируют с щелочами с образованием соответствующих солей и воды:
3) При сплавлении соли карбоновой кислоты с твердой щелочью протекает реакция декарбоксилирования, продуктами которой является углеводород и карбонат металла:
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси):
5) При действии на нитропроизводные кислот-неокислителей совместно с металлами, расположенными до водорода в ряду активности, происходит восстановление первых до солей аминов:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Урок 12: Превращения между веществами
План урока:
Почему связь между классами веществ считается генетической
Родственные связи между металлами и неметаллами
Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Источник
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой.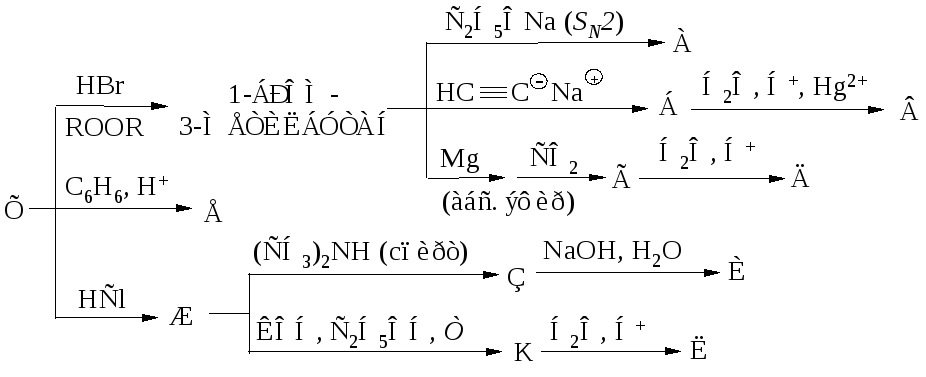
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2.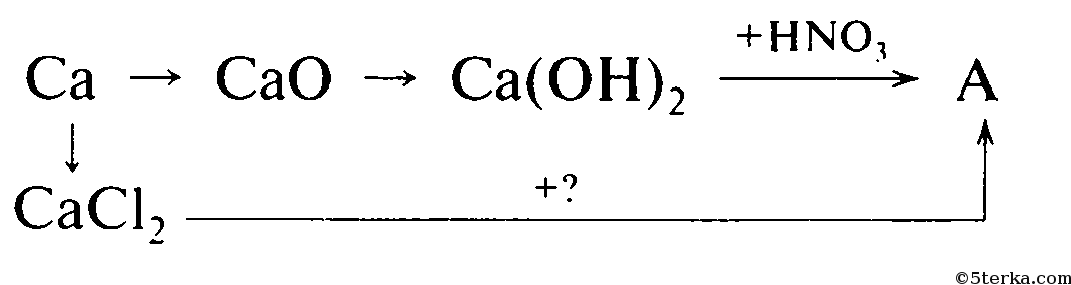 Здесь решением будет один вариант, это прибавление щёлочи.
Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Источник
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция.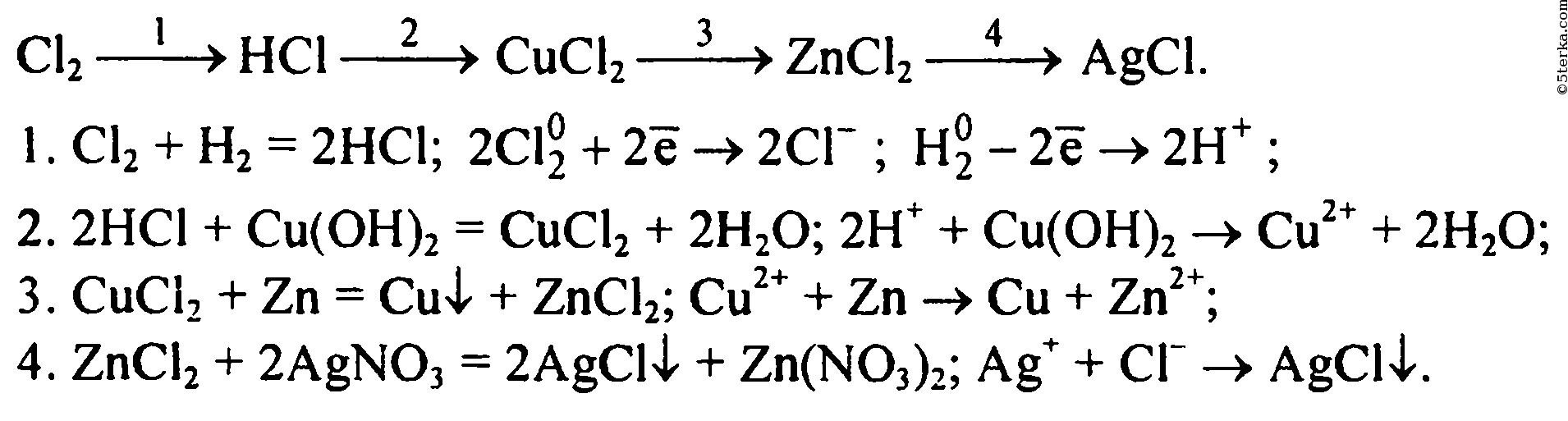 Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере.
Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + h3O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение.
 В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h3. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h3. Величину активности можно узнать из таблицы ряда электрохимических напряжений. - Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + h3O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций).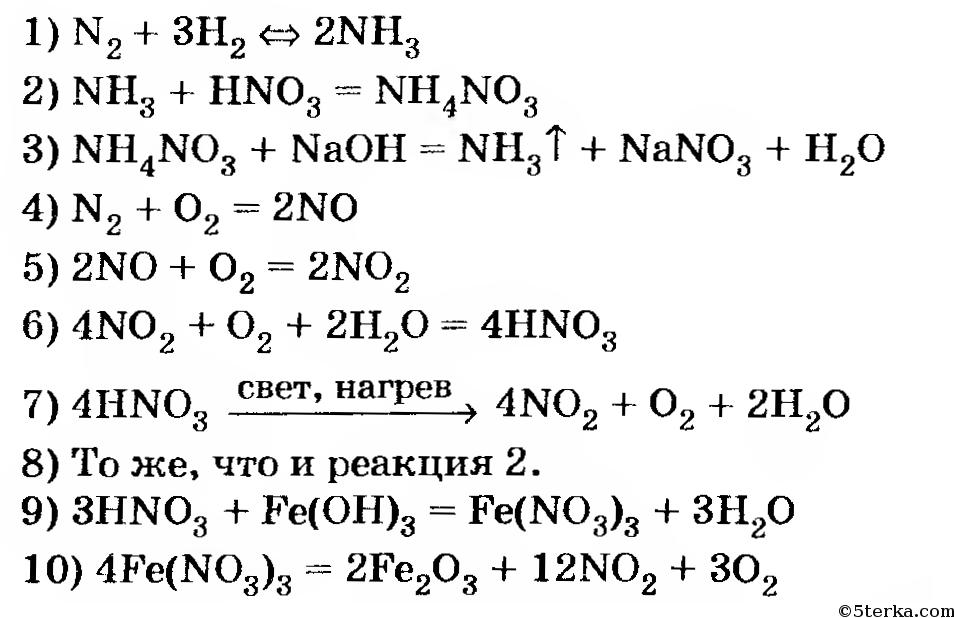 Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + h3SO 4 → Na 2SO4 + h3O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + h3SO 4 → Na2 SO4 +2h3O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + h3O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + h3O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5h3O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле Nh4 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4.
 Гидролизом можно пренебречь.
Гидролизом можно пренебречь. - В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8h30 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8h30 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2h3O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2h3O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8h30 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10h3O.
-
Уравнение можно сократить на 16H+ и 8h3O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO—3 + 4 H+ = Fe3+ + 2SO2-4 + 5NO + 2h3O.

- Добавив в обе части нужное количество ионов, записывают молекулярное уравнение: FeS2 + 8HNO3 = Fe (NO 3) 3 + 2h3SO4 + 5NO + 2h3O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Алгоритм решения «цепочек превращений».
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 2Ca+2O-2
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
(Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + h3O → Ca 2+(OH)2-
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – h4PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2- + 2h4+PO43- → Ca32+(PO4)23- + 6h3O
Как найти и пронумеровать самую длинную цепь в разветвленном алкане
- Образование
- Наука
- Химия
- Как найти и пронумеровать самую длинную цепь в разветвленном алкане
Артур Винтер
Алканы не ограничиваются пребыванием в одной линии — у них могут быть структуры, которые разветвляются. Называя разветвленный алкан, ваш первый шаг — найти и пронумеровать самую длинную цепь.
Называя разветвленный алкан, ваш первый шаг — найти и пронумеровать самую длинную цепь.
После того, как вы пронумеровали родительскую цепь, если вы хотите назвать разветвленный алкан, вам необходимо определить имена всех заместителей, которые выступают из родительской цепи, а затем расположить заместители в алфавитном порядке перед родительской цепью.
На этом рисунке показан пример разветвленного алкана. Как видите, алкан с формулой C 4 H 10 может иметь две возможные химические структуры или изомеров — один алкан с прямой цепью (бутан) и один алкан с разветвленной цепью (изобутан).
Изомеры C 4 H 10 .Найдите самую длинную цепь в разветвленном алкане
Первый и потенциально самый сложный шаг в присвоении названия разветвленному алкану — найти самую длинную цепочку атомов углерода в молекуле. Эта задача может быть сложной, потому что, как читатель английского языка, вы привыкли читать слева направо. Однако часто самая длинная цепочка атомов углерода — это не цепь, которая следует просто слева направо, а цепочка, которая огибает молекулу в разных направлениях.Профессора-органики любят делать родительскую цепь такой, которая изгибается вокруг молекулы и не обязательно течет слева направо, поэтому вы должны быть настороже, чтобы убедиться, что вы заметили самую длинную углеродную цепь.
Однако часто самая длинная цепочка атомов углерода — это не цепь, которая следует просто слева направо, а цепочка, которая огибает молекулу в разных направлениях.Профессора-органики любят делать родительскую цепь такой, которая изгибается вокруг молекулы и не обязательно течет слева направо, поэтому вы должны быть настороже, чтобы убедиться, что вы заметили самую длинную углеродную цепь.
Неправильный и правильный способы подсчета родительской цепочки.
Самая длинная углеродная цепь показанной здесь молекулы состоит из семи атомов углерода, поэтому исходное название этого алкана — гептан.
Номер самой длинной цепи в разветвленном алкане
Пронумеруйте родительскую цепь, начиная с конца, который первым достигает заместителя.Цепочку всегда можно пронумеровать двумя способами. Для молекулы в этом примере нумерация может начинаться сверху и идти вниз, или она может начинаться снизу и идти вверх. Правильный способ пронумеровать родительскую цепь — начинать с конца, который раньше достигает первого заместителя.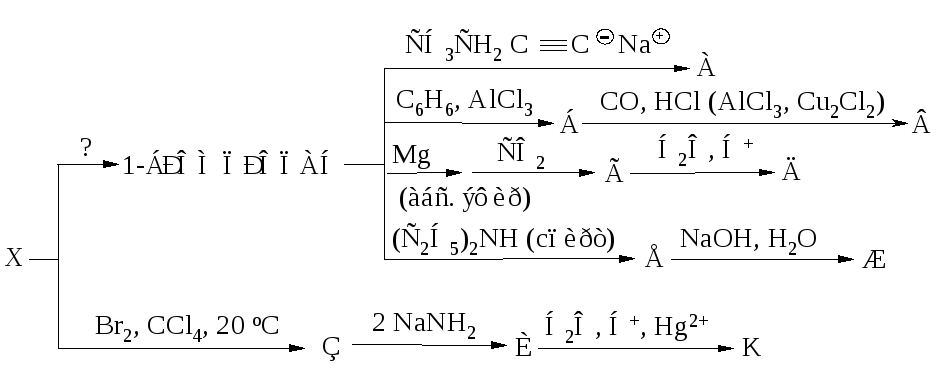 Заместитель является органическим обозначением фрагмента, отходящего от родительской цепи.
Заместитель является органическим обозначением фрагмента, отходящего от родительской цепи.
Правильный и неправильный способы нумерации атомов углерода в родительской цепи.
Как вы можете видеть здесь, если вы пронумеруете сверху вниз, первый заместитель будет у атома углерода номер три; если вы пронумеруете снизу вверх, первый заместитель будет на четвертом атоме углерода.Таким образом, правильная нумерация в этом случае начинается сверху и идет вниз.
Об авторе книги
Артур Винтер окончил Фростбургский государственный университет, где получил степень бакалавра химии. Он получил докторскую степень в Университете Мэриленда в 2007 году. В настоящее время он является профессором химии в Университете штата Айова.
Как назвать разветвленные алканы в химии
- Образование
- Наука
- Химия
- Как назвать разветвленные алканы в химии
Джон Т. Мур, Крис Хрен, Питер Дж. Микулецки
Мур, Крис Хрен, Питер Дж. Микулецки
Органическая химия получает плохую репутацию. На самом деле, это не такая уж грубая тема, если вы потратите время. К сожалению, не все алканов и (простые органические соединения) являются алканами с прямой цепью. Это было бы слишком просто. Многие алканы представляют собой так называемые разветвленные алканы . Разветвленные алканы отличаются от алканов с непрерывной цепью тем, что углеродные цепи замещают несколько атомов водорода вдоль цепи. Атомы или другие группы (например, углеродные цепи), замещающие водород в алкане, называются заместителями.
Присвоение имен разветвленным алканам немного сложнее, чем наименование алканов с непрерывной цепью, но вам нужно всего лишь выполнить простой набор шагов, чтобы получить правильное (и часто длинное) имя:
Подсчитайте самую длинную непрерывную цепочку атомов углерода.
Хитрые учителя химии часто рисуют разветвленные алканы с самой длинной цепью, извивающейся через несколько ветвей, вместо того, чтобы явно выстраиваться в ряд.
 Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой.В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.
Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой.В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.Одна углеродная структура, нарисованная двумя разными способами.
Пронумеруйте атомы углерода в цепочке, начиная с конца, ближайшего к ответвлению.
Чтобы убедиться, что вы выполнили этот шаг правильно, вы можете проверить свою работу, пронумеровав углеродную цепочку с противоположного конца. Правильная последовательность нумерации — это та, в которой заместители отходят от атомов углерода с наименьшим номером.Например, как показано и пронумеровано выше, у алкана есть группы заместителей, ответвляющиеся от третьего, четвертого и пятого атомов углерода. Если бы углеродная цепь была пронумерована в обратном порядке, это были бы четвертый, пятый и шестой атомы углерода в цепи. Поскольку первый набор цифр ниже, цепочка нумеруется правильно. Самая длинная цепь разветвленного алкана называется родительской цепью.

Подсчитайте количество атомов углерода в каждой ветви.
Эти группы называются алкильными группами и называются добавлением суффикса -yl к соответствующему префиксу алкана.Три наиболее распространенных алкильных группы — это метильная (одна углеродная), этильная (два углерода) и пропильная (три углерода) группы. На рисунке 1 показаны две метильные группы, одна этильная группа и нет пропильных групп.
Будьте осторожны, когда имеете дело с алкильными группами, состоящими не из нескольких атомов углерода. Сложный рисунок может привести к неправильной нумерации родительской цепочки!
Прикрепите номер атома углерода, от которого разветвляется каждый заместитель, перед названием алкильной группы.
Например, если группа из двух атомов углерода присоединена к третьему атому углерода в цепи, как на рисунке 1, группа называется 3-этил.
Проверить наличие повторяющихся алкильных групп.
Если несколько групп с одинаковым количеством атомов углерода ответвляются от родительской цепочки, не повторяйте имя.
 Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы ди-, три-, тетра-, и так далее.Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».
Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы ди-, три-, тетра-, и так далее.Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».Поместите названия групп заместителей перед названием родительской цепи в алфавитном порядке.
Префиксы, такие как ди-, три-, и тетра- , не фигурируют в алфавитном порядке, поэтому собственное название органической молекулы на рисунке 1 — 3-этил-4,5-диметилоктан.
Обратите внимание, что дефисы используются для соединения всех элементов именования, кроме последнего соединения с родительской цепочкой (то есть диметилоктан будет неправильным).
Об авторе книги
Джон Т. Мур, EdD, более 40 лет преподавал химию в Государственном университете Стивена Ф. Остина в Накогдочес, Техас. Кристофер Р. Хрен — выпускник Мичиганского государственного университета, преподает химию в средней школе. Питер Дж. Микулецки, доктор философии, преподает химию и биологию в Учебном центре Fusion и Академии Fusion.
Мур, EdD, более 40 лет преподавал химию в Государственном университете Стивена Ф. Остина в Накогдочес, Техас. Кристофер Р. Хрен — выпускник Мичиганского государственного университета, преподает химию в средней школе. Питер Дж. Микулецки, доктор философии, преподает химию и биологию в Учебном центре Fusion и Академии Fusion.
Как решать вопросы синтеза органической химии Учебник по органической химии
Органическая химия может охватывать множество концепций и тем, но это все о реакциях и механизмах.
Поначалу это не так уж и страшно, подумайте о простом кислотно-основном депротонировании, реакции алкена здесь, другой там. Прежде чем вы это осознаете, вы тонете в десятках и десятках реакций!
Вас просят «запомнить» каждого из них, а до знать , что будет делать каждый реагент и реагент.
И как только вы все это разберетесь, не забудьте про дюжину или около того исключений из правил.
Стон!
И когда у вас есть все ЭТО, давайте объединим их все вместе: когда вам дадут молекулу A и попросите придумать все 20 шагов для получения продукта Z!
Хорошо, возможно, я немного преувеличиваю… но на самом деле совсем чуть-чуть!
В среднем вопрос по синтезу 1 или 2 экзамена по органической химии будет варьироваться от двух до пяти шагов с промежуточными продуктами.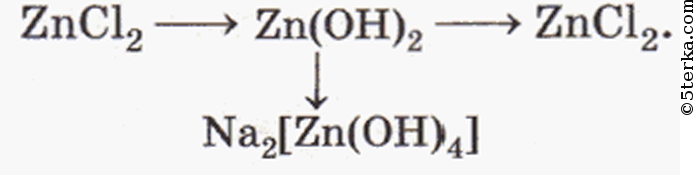
Как правильно все выучить?
И что еще более важно, как вы просеиваете сотни точек данных в своей голове, чтобы произвести точные шаги, необходимые для достижения желаемого результата?
В детстве я гордился тем, что называл себя ботаником.Возможно, с небольшим количеством ОКР.
Я всегда искал тенденции и находил закономерности там, где их не было. Возможно, поэтому мне так нравится Orgo.
СЕКРЕТ для синтеза прост:
A) Ищите закономерности, как мы объясним ниже.
B) когда вы застряли, помните, что, вероятно, есть несколько способов добраться до желаемого продукта.
Для правильного синтеза требуется сочетание прямого и обратного мышления!
Мы рассмотрим обратное мышление в руководстве по ретросинтезу.
В этом руководстве мы сосредоточимся на более коротком и простом синтезе.
Начнем с поиска закономерностей.
Следующие вопросы помогут вам понять, на что следует обращать пристальное внимание.
Обратите внимание на следующее:
- Какая функциональная группа присутствует в реагенте ?
- Какая функциональная группа присутствует в продукте ?
- Какие реакции конвертируют из одного в другое, что я знаю?
- Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Например:
Если вы начинаете с четырехуглеродного алкена, а в продукте запрашивается четырехуглеродный спирт, спросите себя:
«Что у меня в реагенте?»
Реактивная пи-связь!
« Что содержится в продукте?»
Спирт.
«Какая из известных мне реакций может помочь мне превратиться из алкена в спирт?»
Ну, если вдуматься, их много. Пойдем по порядку от наиболее очевидного к менее очевидному:
- Гидратация, катализируемая кислотой
- Оксимеркурация-демеркурация
- Гидроборирование-окисление
Это прямые очевидные реакции с потенциально разными результатами. Мы воспользуемся 3-метил-1-бутеном, чтобы подчеркнуть эту разницу.
Но что, если бы вам не давали алкен или вы не думали об этих алкеновых реакциях?
А как насчет помещения уходящей группы галогена на алкен посредством гидрогалогенирования?
Или радикальное галогенирование, если исходить из алкана?
Затем можно провести реакцию SN2, используя NaOH в полярном протонном растворителе.
Что, если бы это было не так просто?
Что, если вас попросят начать с алкина?
Мы не можем перейти от алкина к спирту напрямую, так как енольный продукт немедленно таутомеризуется в кетон или альдегид.
Здесь мы представляем множество вариантов:
-> Если вы восстанавливаете алкин до алкена, вы можете использовать одно из следующего, как уже обсуждалось выше:
-> Если вы перейдете от алкина к карбонилу (кетону или альдегиду), вы можете продолжить восстановление:
Вы понимаете, к чему мы идем?
A) Определите шаблоны
B) Спросите себя: «Что я знаю?» чтобы распознать эти образцы
C) Оттуда
Давайте начнем с простого примера концепции, а затем применим ту же логику к чему-то более сложному.
Допустим, вас попросили синтезировать 2-бутанон из пропина. Просмотрите свои вопросы:
- Какая функциональная группа присутствует в реагенте ?
Реактивный терминал алкин - Какая функциональная группа присутствует в продукте ?
Кетон на угле # 2 - Какие реакции конвертируют из одного в другое, что я знаю?
Гидратация алкинов, катализируемая кислотой, дает кетон в соответствии с правилом Марковникова.
ОДНАКО , в этом примере мы начинаем с цепи из 3 атомов углерода, но заканчиваем цепочкой из 4 атомов углерода.
4. Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Да! Терминальные алкины легко подвергаются удлинению цепи через SN2.
Мы начнем с кислотно-основной реакции, чтобы депротонировать концевой алкин с образованием хорошего нуклеофила.
Нам нужно удлинить цепочку всего на один углерод.Давайте дадим этой метильной группе хорошую уходящую группу, чтобы облегчить быструю реакцию SN2 — моим «незаменимым» является бром, но вы также можете использовать хлор или йод.
Теперь, когда у нас есть углеродная цепь желаемой длины, приступим к гидратации, катализируемой кислотой.
Но подождите, продукт — енол, а не кетон !!
Следующий шаг произойдет автоматически. Поэтому, хотя вам не нужно показывать реагент, просто нарисуйте «KET» над стрелкой реакции для таутомеризации кето енола.
И вот оно!
Следующий экзаменационный вопрос / запрос страшнее, чем синтез сам по себе:
«Предложите разумный механизм для выполнения следующего синтеза».
Здесь вам предоставляется один реагент, один продукт и ОДИН или ДВА набора реагентов.
Другими словами, вам даны все шаги, но вас попросят показать, как разные молекулы работают вместе.
Хотя вопрос совсем другой, концепт тот же .
Немного изменим начальные вопросы:
- Какая функциональная группа присутствует в реагенте ?
- Какая функциональная группа присутствует в продукте ?
- ГДЕ РЕАКТИВНОСТЬ НА ЗАПУСКНОЙ МОЛЕКУЛЕ? Например, где мне запустить механизм?
- Какие реакции конвертируют из одного в другое, что я знаю?
- Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Студент недавно показал мне этот экзаменационный вопрос, за который ни один студент в его классе не получил полного кредита.
Позвольте мне предварить это, сказав ДА, это сложный вопрос.
НО, если вы обдумаете это логически, вы поймете, что если вы изучите отдельные шаги и узнаете их, вы сможете следовать за ними.
На самом деле, я призываю вас попробовать и посмотреть, как далеко вы продвинетесь, прежде чем читать дальше.
Предложите разумный механизм для следующей реакции. Показать всех промежуточных звеньев и официальных сборов. Это реакция SN1 SN2 E1 E2?
Как вы думаете? Ты понял?
Вот видео с пошаговым решением:
Независимо от того, насколько хорошо вы подготовились, тот или иной хитрый шаг все равно застает вас врасплох.
А когда застрешь?
Скорее всего, существует несколько способов получения вашего продукта!
Когда я проходил свою первую еженедельную викторину по органической химии 2, я непреднамеренно установил тенденцию к получению лучших баллов в классе, но это была случайность. Я не знал, что у нас еженедельные викторины…
Нас попросили обрисовать пошаговую процедуру разделения двух похожих молекул с разными функциональными группами. Процесс включал серию реакций для подготовки одной молекулы к экстракции.
Я пробовал!
Я вспомнил, что шагов было около шести, но уверенно ответил только на четыре. Я уже бомбил, потом одолел Орго 1 и больше не хотел этого делать!
Что бы я ни делал, я не мог придумать другие шаги. Вместо этого я вычеркнул свои четыре с половиной шага и написал подробную пошаговую процедуру проведения фракционной перегонки.
Мой TA очень неохотно дал мне полную оценку забавным предупреждением.
Никто и близко не подошел.
Я прошу вас перехитрить вопрос?
Не совсем так.
Просто поймите, что чем больше реакций вы узнаете, тем больше у вас вариантов для создания единой функциональной группы.
Если вы застряли на определенном пути или не можете полностью описать шаги,
Спросите себя: «Есть ли другой способ создать такую же функциональную группу?»
Вспомните многие реакции образования спирта, которые мы обсуждали выше. Если вы забыли один вариант, просто используйте другой.
Вот несколько интересных моделей и альтернатив, которые стоит рассмотреть.
-> Переходные реакции удлинения цепи
- Используйте алкины в Orgo 1
- Используйте гриньяр или конденсат в Orgo 2
-> Добавление карбоновых кислот или карбонилов
-> «Перемещение» реактивности, чтобы вы могли начать / реагировать в другой части молекулы по сравнению с текущим положением активной группы.
Активные группы включают уходящие группы, пи-связи, уязвимые нуклеофильные центры и многое другое.
Вот некоторые из моих любимых трюков «перемещение реактивного местоположения»:
Это лишь НЕКОТОРЫЕ уловки, которые вы можете использовать.
Увеличение частичного кредита на экзамене
Получение бонусных баллов на экзаменах — это одно, но вот самое лучшее:
Средний вопрос синтеза оценивается в 10-30 баллов.
И средний профессор БУДЕТ давать частичную оценку.
Итак, если вы можете запомнить только четыре из пяти шагов, НЕ оставляйте поле пустым, чтобы получить ноль баллов!
Вместо этого напишите четыре шага и добавьте как можно больше релевантной информации.
Тогда ОЧЕНЬ УВЕРЕННО подделайте пятый шаг.
Не пишите « Magic! »(да, я видел это на студенческом экзамене).
Придумайте что-то, что кажется просто «небрежной» ошибкой. Ваш профессор будет впечатлен вашей работой и, надеюсь, даст вам 80% за вопрос.
Это касается и реагентов!
Если вы помните только шаги, но не помните, какие реагенты приведут вас к нужному результату, начните с рисования молекул:
А -> В -> С
У этого есть два преимущества:
- Это помогает вам думать, не отвлекаясь, поэтому вы можете четко видеть, как молекула и функциональные группы изменяются / развиваются от шага к шагу.
- Теперь, когда у вас есть четкое представление о том, что вы делаете, вы можете вернуться к своим действиям и заполнить необходимые реагенты!
Конечно, если у вас с этим возникают проблемы с реагентами, вот видео о «запоминании» реагентов органической химии.
И если вы не можете их вспомнить, лучше ИЗОБРЕЙТЕ ЧТО-нибудь, а не оставляйте поле пустым. Попробуйте использовать реагент, содержащий группы, которые вы добавляете.
Например, если вы забудете, что алкин будет реагировать с HgSO4 в h3SO4 с образованием кетона,
, но вы ЗНАЕТЕ, что вы пытаетесь направить кислород в молекулу, добавить что-нибудь еще с кислородом.Например: O3 или KMnO4.
Они правы?
Не совсем!
Оба они расщепляют алкин.
НО, я видел достаточно студентов, которые использовали это как законную ошибку, и ваш профессор может подумать так же и, надеюсь, частично вам поверит.
Опять же, я не прошу вас изобретать на экзамене.
Но, угадав логически в многоэтапной задаче, в которой вы уже заработали достаточно очков, поможет вам приблизиться к полному баллу.
Я успешно сдала это на экзаменах по орго и вышла на первое место в классе, несмотря на то, что пропустила полбалла то тут, то там по нескольким вопросам.Члены моего учебного зала и клиенты-репетиторы делают то же самое, чтобы выжать несколько дополнительных очков и вывести их на вершину.
Итог, убедитесь, что вы усвоили и ПОНИМАЕТЕ все необходимые реакции!
Но даже лучшие из нас забывают некоторые вещи под давлением.
Вот когда вы можете воспользоваться приведенными выше советами, чтобы помочь вам максимально постараться, и у вас будет преимущество перед большинством профессоров. Мы надеемся, что они дадут вам возможность выразить сомнение, когда ответы будут сомнительными или не совсем то, что они искали.
Готовы начать думать задом наперед? Именно здесь вступает в игру более сложная тема ретросинтетического анализа или просто ретросинтеза.
Я хотел бы услышать от вас
Чувствуете ли вы себя лучше в синтезе и знании, что делать, когда вы застряли? Дайте мне знать в комментариях под
Учебное пособие по химии первичных алканаминов с прямой цепью ИЮПАК
Ключевые понятия
- Алканамины — это органические молекулы, содержащие только атомы углерода (C), водорода (H) и азота (N).
- Алканамины относятся к группе органических соединений, известных как амины.
- Амины — производные аммиака, NH 3 , в которых углеродные цепи заменяют атомы водорода.
- Первичные алканамины возникают, когда только один из атомов водорода в аммиаке заменен углеродной цепью.
R-NH 2
- Первичные алканамины содержат функциональную группу NH 2 , амин (амино) (1) .
- Первичный алканамин состоит из цепи из 1 или более атомов углерода, соединенных друг с другом одинарными ковалентными связями, с функциональной группой NH 2 , присоединенной к одному из атомов углерода в цепи.
- Систематическое название IUPAC (2) алкана -n- амина состоит из трех частей:
(i) префикс или основа
(название исходного углеводорода (алкановой цепи) без окончания «е», алкан ) (3)
(ii) инфикс
(число, указывающее местонахождение функциональной группы NH 2 , -n- )
(iii) суффикс
(последняя часть названия, амин )
- Суффиксом в названии первичного алканамина всегда является «амин».
- Префикс или основа зависит от числа атомов углерода в самой длинной цепи атомов углерода (родительский углеводород или родительский алкан):
Число атомов углерода: 1 2 3 4 5 6 7 8 9 10 meth Префикс eth58 prop но pent hex hept oct non dec
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Структура и связь в первичных алканаминах с прямой цепью
Первичные алканамины — это амины и соединения, содержащие ТОЛЬКО атомы углерода, водорода и азота.
Первичные алканамины содержат функциональную группу NH 2 , известную как функциональная группа амина (или амино).
- Углерод принадлежит к 14 группе периодической таблицы.
Каждый атом углерода в первичной молекуле алканамина имеет 4 валентных электрона.
- Каждый атом водорода в первичной молекуле алканамина имеет 1 валентных электрона .
- Азот принадлежит к 15-й группе периодической таблицы.
Каждый атом азота в первичной молекуле алканамина имеет 5 валентных электронов.
- Каждая функциональная группа амина (или амино) (NH 2 ) состоит из 1 атома азота и 2 атомов водорода, разделяющих пару электронов (ковалентная связь):
Обратите внимание, что на атом азота теперь приходится всего 7 валентных электронов.
Это означает, что неспаренный электрон может образовать пару с электроном другого атома, такого как углерод, для образования ковалентной связи. - Когда неспаренный электрон от атома азота аминогруппы (амино) группы соединяется с электроном от атома углерода, атом азота будет иметь долю в 8 электронах:
- Непарные электроны вокруг атома углерода теперь могут образовывать пары с другими атомами углерода или с атомами водорода с образованием первичной молекулы алканамина:
Структура Льюиса
(электронная точечная диаграмма)Структура валентности R .. .. R ‘ . . С . . N . . H . . . . R « H R | .. R ‘ — C — N — H |
R «|
HR, R ‘и R «могут быть атомами водорода (H) или атомами углерода (C).
- Следовательно, группа NH 2 может быть присоединена к любому атому углерода в алкановой цепи.
Этапы присвоения ИЮПАК наименования первичных алканаминов с прямой цепью
- Систематическое название IUPAC алкана -n- амина состоит из трех частей:
(i) префикс или основа (первая часть названия, название исходного алкана без окончания «е»): alkan
(ii) инфикс (число, указывающее расположение функциональной группы NH 2 ): -n-
(iii) суффикс (последняя часть названия, указывающая на присутствие функциональной группы NH 2 ): амин
- Название первичного алканамина всегда оканчивается суффиксом амин
- Первая часть названия первичного алканамина, его префикс или основа, определяется числом атомов углерода в родительской алкановой цепи:
Число атомов углерода: 1 2 3 4 5 6 7 8 9 10 meth Префикс eth58 prop но pent hex hept oct non dec
Шаг 1: Определите самую длинную углеродную цепь, содержащую функциональную группу NH 2 (амино или амино).
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(Название исходного алкана без окончания «е»)
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Шаг 6: Напишите название первичного алканамина в виде префикса -infix- суффикс
Рабочий пример присвоения ИЮПАК названия первичного алканамина с прямой цепью: 1 атом углерода в цепи
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
Шаг 1: Определите самую длинную углеродную цепь , содержащую NH 2 (аминную или амино) функциональную группу.
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
Только 1 атом углерода в цепи, родительский углеводород — метан.
Префикс метан
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
В алкановой цепи присутствует только 1 атом углерода, поэтому инфикс не требуется.
Шаг 5: Определите суффикс для названия первичного алканамина.Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Суффикс: амин
Шаг 6: Напишите название первичного алканамина в виде префикса -infix- суффикс
метан амин
Рабочий пример присвоения ИЮПАК названия первичных алканаминов с прямой цепью: цепь с двумя атомами углерода
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
| H | | H | | ||||
| H- | C | — | C | — | NH 2 |
| | H | | H |
Шаг 1: Определите самую длинную углеродную цепь , содержащую NH 2 (аминную или амино) функциональную группу.
| H | | H | | ||||
| H- | C | — | C | — | NH 2 |
| | H | | H |
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
2 атома углерода в цепи, поэтому исходным алканом является этан
Префикс: ethan
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
| H | | H | | ||||
| H- | C 2 | — | C 1 | — | NH 2 |
| H | | H |
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
Присутствуют только 2 атома углерода, поэтому инфикс не требуется.
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Суффикс: амин
Шаг 6: Напишите название первичного алканамина в виде префикса -infix- суффикс
этан амин
Рабочий пример присвоения ИЮПАК названия первичных алканаминов с прямой цепью: цепь с 3 атомами углерода
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
| H | | H | | H | | |||||
| H- | C | — | C | — | C | — | NH 2 |
| H | | H | | H |
Шаг 1: Определите самую длинную углеродную цепь , содержащую NH 2 (аминную или амино) функциональную группу.
| H | | H | | H | | |||||
| H- | C | — | C | — | C | — | NH 2 |
| H | | H | | H |
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
3 атома углерода в цепи, поэтому исходным алканом является пропан
Префикс пропан
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
| H | | H | | H | | |||||||||||||
| H- | C 3 | — | C 2 | — | C 1 | — | NH3 | — | NH H | | H | | H |
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
В цепи 3 атома углерода, поэтому требуется инфикс.
NH 2 Группа связана с углеродом 1
Infix — это -1-
Шаг 5: Определите суффикс для названия первичного алканамина.Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Суффикс: амин
Шаг 6: Напишите название первичного алканамина в виде префикса -infix- суффикс
пропан -1- амин
Этапы построения структуры (4) первичных алканаминов с прямой цепью
Шаг 1: Разбейте систематическое название алкан-н-амина по ИЮПАК на три части:
| алкан | -н- | амин |
| префикс | инфикс | суффикс |
Обратите внимание, что инфикс может отсутствовать, если родительская алкановая цепь содержит только 1 или 2 атома углерода.
Шаг 2: Определите количество атомов углерода в самой длинной углеродной цепи алкана, используя префикс .
Шаг 3: Нарисуйте цепочку атомов углерода необходимой длины, используя пунктирную линию, чтобы обозначить одну ковалентную связь между каждой парой атомов углерода.
Шаг 4: Нарисуйте пунктир вокруг каждого атома углерода в цепи так, чтобы каждый атом углерода образовывал 4 связи.
Шаг 5: Пронумеруйте атомы углерода в цепочке слева направо.
Шаг 6: Определите местоположение функциональной группы NH 2 (амин или амино) с помощью инфикса .
Мы знаем, что существует функциональная группа NH 2 , поскольку название молекулы имеет суффикс , амин (5) .
Шаг 7: Нарисуйте группу NH 2 в конце тире на угле с тем же номером, что и инфикс.
Шаг 8: Завершите структуру, поместив атом водорода (H) в конец всех пустых штрихов.
Рабочий пример построения структуры первичного алканамина с прямой цепью
Изобразите структуру первичного алканамина пропан-2-амина с прямой цепью (2-пропанамин).
Шаг 1: Разбейте систематическое название алкан-н-амина по ИЮПАК на три части:
| алкан | -н- | амин |
| префикс | инфикс | суффикс |
| пропан | -2- | амин |
Шаг 2: Определите количество атомов углерода в самой длинной углеродной цепи алкана, используя префикс .
Префикс— пропан , следовательно, в цепочке 3 атома углерода .
Шаг 3: Нарисуйте цепочку атомов углерода необходимой длины, используя пунктирную линию, чтобы обозначить одну ковалентную связь между каждой парой атомов углерода.
Шаг 4: Нарисуйте пунктир вокруг каждого атома углерода в цепи так, чтобы каждый атом углерода образовывал 4 связи.
| | | | | | | ||||
| – | С | – | С | – | С | – |
| | | | | | |
Шаг 5: Пронумеруйте атомы углерода в цепочке слева направо.
| | | | | | | ||||
| – | С 1 | – | С 2 | – | С 3 | – |
| | | | | | |
Шаг 6: Определите местоположение функциональной группы NH 2 (амин или амино) с помощью инфикса .
Мы знаем, что существует функциональная группа NH 2 , поскольку название молекулы имеет суффикс , амин (5) .
Infix — это -2-, поэтому группа NH 2 связана с углеродным номером 2 в цепи.
Шаг 7: Нарисуйте группу NH 2 в конце тире на угле с тем же номером, что и инфикс.
| | | NH 2 | | | | ||||
| – | С 1 | – | С 2 | – | С 3 | – |
| | | | | | |
Шаг 8: Завершите структуру, поместив атом водорода (H) в конец всех пустых штрихов.
| или |
|
Шаги для написания молекулярной формулы первичных алканаминов с прямой цепью
Молекулярная формула сообщает нам количество атомов каждого элемента, присутствующего в молекуле соединения.
Для первичного алканамина с прямой цепью присутствуют только три элемента: углерод (C), водород (H) и азот (N).
При написании молекулярной формулы алканамина число атомов углерода записывается перед числом атомов водорода, которое записывается перед числом атомов кислорода, то есть C пишется перед H, который записывается перед N (6) :
C x H y Н
Шаг 1: Изобразите структуру молекулы алкан-н-амина.
Шаг 2: Напишите скелетную молекулярную формулу, используя символы углерода (C), водорода (H) и азота (N).
C H N
Шаг 3: Подсчитайте количество атомов углерода в молекуле алканамина.
Шаг 4: Запишите количество атомов углерода в молекулярной формуле скелета в виде нижнего индекса справа от символа углерода (C).
Шаг 5: Подсчитайте количество атомов водорода в молекуле алканамина.
Шаг 6: Запишите количество атомов водорода в молекулярной формуле скелета в виде нижнего индекса справа от символа водорода (H).
Шаг 7: Подсчитайте количество атомов азота в молекуле алканамина.
Шаг 8: Запишите количество атомов азота в молекулярной формуле скелета в виде нижнего индекса справа от символа азота (N).
Примечание: если присутствует только одна аминогруппа (или амино, NH 2 ), количество атомов азота равно 1, и индекс 1 НЕ входит в молекулярную формулу.
Шаг 9: Убедитесь, что ваша завершенная молекулярная формула имеет смысл (для первичного алканамина с прямой цепью C n H 2n + 3 N)
Рабочий пример написания молекулярной формулы первичного алканамина с прямой цепью
Напишите молекулярную формулу бутан-2-амина (2-бутанамина).
Шаг 1: Изобразите структуру молекулы алкан-н-амина.
| H | H | |||||||
| \ | / | |||||||
| H | N | H | H | |||||
| | | | | | | | | |||||
| H- | С | – | С | – | С | – | С | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 2: Напишите скелетную молекулярную формулу, используя символы углерода (C), водорода (H) и азота (N).
C H N
Шаг 3: Подсчитайте количество атомов углерода в молекуле алканамина.
| H | H | |||||||
| \ | / | |||||||
| H | N | H | H | |||||
| | | | | | | | | |||||
| H- | С 1 | – | С 2 | – | С 3 | – | С 4 | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 4: Запишите количество атомов углерода в молекулярной формуле скелета в виде нижнего индекса справа от символа углерода (C).
C 4 H N
Шаг 5: Подсчитайте количество атомов водорода в молекуле алканамина.
| H 1 | H 2 | |||||||
| \ | / | |||||||
| H 11 | N | H 3 | H 4 | |||||
| | | | | | | | | |||||
| 10 H- | С | – | С | – | С | – | С | -H 5 |
| | | | | | | | | |||||
| H 9 | H 8 | H 7 | H 6 |
Шаг 6: Запишите количество атомов водорода в молекулярной формуле скелета в виде нижнего индекса справа от символа водорода (H).
С 4 В 11 Н
Шаг 7: Подсчитайте количество атомов азота в молекуле алканамина:
| H | H | |||||||
| \ | / | |||||||
| H | N 1 | H | H | |||||
| | | | | | | | | |||||
| H- | С | – | С | – | С | – | С | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 8: Запишите количество атомов азота в молекулярной формуле скелета в виде нижнего индекса справа от символа азота (N).
Примечание: если присутствует только одна аминогруппа (или амино, NH 2 ), количество атомов азота равно 1, и индекс 1 НЕ включается в молекулярную формулу.
В этой молекуле присутствует только 1 атом азота, поэтому индекс 1 в молекулярной формуле не требуется.
Молекулярная формула бутан-2-амина: C 4 H 11 N
Шаг 9: Убедитесь, что ваша завершенная молекулярная формула имеет смысл (C n H 2n + 3 N для первичных алканаминов)
n = количество атомов углерода = 4
количество атомов водорода = 2 × n + 3 = 2 × 4 + 3 = 11
количество атомов азота = 1
Таблица Суммэя: Молекулярная формула, структура и названия некоторых первичных алканаминов с прямой цепью по ИЮПАК
| №Атомы C (n) | Молекулярная формула C n H 2n + 3 N | Структура | Предпочтительное название ИЮПАК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | CH 5 N |
| метанамин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | C 2 H 7 N |
| этанамин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | C 3 H 9 N |
| пропан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| пропан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | С 4 В 11 Н |
| бутан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| бутан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | C 5 H 13 N |
| пентан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| пентан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| пентан-3-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | C 6 H 15 N |
| гексан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гексан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гексан-3-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | C 7 H 17 N |
| гептан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гептан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гептан-3-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гептан-4-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 | С 8 В 19 Н |
| октан-1-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| октан-2-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| октан-3-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| октан-4-амин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сноски:
(1) Функциональная группа NH 2 в первичных аминах называется аминогруппой или аминогруппой.
Если функциональная группа NH 2 является единственной присутствующей функциональной группой или, если группа NH 2 является функциональной группой с наивысшим приоритетом, тогда молекула обозначается суффиксом амина.
Обратите внимание, что когда другая функциональная группа имеет приоритет над функциональной группой NH 2 , группа NH 2 тогда называется аминогруппой и становится префиксом.
(2) IUPAC — это аббревиатура Международного союза теоретической и прикладной химии.
Предпочтительное систематическое имя ИЮПАК является замещающим именем и помещает инфикс для локанта непосредственно перед той частью имени, к которой оно относится, за исключением случаев, когда предпочтительное имя ИЮПАК является традиционным сокращенным именем, и в этом случае инфикс помещается впереди имени.
Для простых первичных алканаминов, которые мы обсуждаем, допустима любая номенклатура, поскольку название в каждом случае однозначно.
Также часто встречаются амины, названные с использованием системы именования функциональных классов IUPAC, но это не предпочтительная номенклатура. В номенклатуре функциональных классов суффиксу «амин» предшествует название алкильной цепи, так что название имеет форму алкиламин.
Систематическое название ИЮПАК происходит от набора общих «правил», разработанных для обеспечения того, чтобы каждой органической молекуле можно было дать однозначное имя.
Правила наименования органических соединений все еще разрабатываются. Самый последний документ для направления — «Предпочтительные наименования в номенклатуре органических соединений» (проект от 7 октября 2004 г.).
(3) Мы рассматриваем алканамины с прямой цепью, а не диамины.
При названии диамина, например, сохраняется буква «е» исходного алкана, например этан-1,2-диамин НЕ этан-1,2-диамин.
(4) «Структура» здесь будет относиться к валентной структуре, которую можно использовать для представления двумерной структурной формулы.
После того, как вы нарисовали валентную структуру или двухмерную структурную формулу, вы можете использовать ее для рисования
сжатая (полу) структурная формула
или скелетная структура
(5) Мы знаем, что это первичный алканамин, потому что в названии нет локанта « N », следовательно, функциональная группа амина — NH 2 , а не NH или N.
(6) Молекулярная формула первичного алканамина с прямой цепью: C n H 2n + 3 N, в то время как часто используемый C n H 2n + 1 NH 2 , строго говоря, не молекулярная формула, но сжатая структурная формула.
Как сделать цепной шлем в Майнкрафт
В этом руководстве Minecraft объясняется, как создать цепной шлем, со скриншотами и пошаговыми инструкциями.
В Майнкрафте цепной шлем — это предмет брони, который нельзя сделать с помощью верстака или печи. Вместо этого вам нужно найти и собрать этот предмет в игре.
Давайте посмотрим, как добавить цепной шлем в свой инвентарь.
Поддерживаемые платформы
Цепной шлем доступен в следующих версиях Майнкрафт:
* Версия, в которой он был добавлен или удален, если применимо.
ПРИМЕЧАНИЕ. Pocket Edition (PE), Xbox One, PS4, Nintendo Switch и Windows 10 Edition теперь называются Bedrock Edition. Мы продолжим показывать их индивидуально для истории версий.
Где найти цепной шлем в творческом режиме
Определения
- Платформа — это применяемая платформа.
- Версия (и) — это номера версий Minecraft, где элемент можно найти в указанном месте меню ( мы протестировали и подтвердили этот номер версии ).
- Расположение меню «Креатив» — это расположение элемента в меню «Креатив».
Как получить цепной шлем в режиме выживания
Вы можете добавить цепной шлем в свой инвентарь в режиме выживания, убив зомби, на котором он надет.
Если у вас возникли проблемы с поиском зомби в цепном шлеме, вы можете вызвать его с помощью нашего генератора призыва мобов.
Как только вы найдете зомби, вам нужно атаковать его. Когда вы атакуете зомби, он становится розовым, поскольку получает урон.
Продолжайте преследовать и атаковать зомби. После того, как вы убили зомби, с него может упасть броня, которую он носит.
Убедитесь, что вы подняли цепной шлем, прежде чем он исчезнет.
Цепной шлем — редкий предмет брони и должен храниться в вашем инвентаре.
Идентификатор и название предмета
- Java
- ПЭ
- Xbox
- PS
- Нинтендо
- Win10
- Edu
Minecraft Java Edition (ПК / Mac)
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Java Edition (ПК / Mac) | 1.8 — 1,12 | |
| Кольчужный шлем ( minecraft: | 302 | Java Edition (ПК / Mac) | 1,13 — 1,17 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Карманное издание (PE)
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Карманное издание (PE) | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Xbox One
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Xbox One | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт PS4
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | PS4 | 1.14.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Nintendo Switch
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Nintendo Switch | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Windows 10 Edition
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Windows 10 Edition | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Education Edition
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Кольчужный шлем ( minecraft: | 302 | 0 | Education Edition | 1.0 — 1.14.31 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Определения
- Описание — так называется элемент, а ( Minecraft ID Name ) — строковое значение, которое используется в игровых командах.
- Minecraft ID — это внутренний номер предмета.
- Minecraft DataValue (или значение ущерба) определяет вариант блока, если для идентификатора Minecraft ID существует более одного типа.
- Платформа — это подходящая платформа.
- Версия (и) — это номера версий Minecraft, для которых действительны идентификатор и имя Minecraft.
Подать команду на цепной шлем
- Java
- ПЭ
- Xbox
- PS
- Нинтендо
- Win10
- Edu
Дать команду в Minecraft Java Edition (ПК / Mac)
В Minecraft Java Edition (ПК / Mac) 1.13, 1.14, 1.15, 1.16, 1.16.4 и 1.17, команда / give для цепного шлема:
/ give @p chainmail_helmet 1
В Minecraft Java Edition (ПК / Mac) 1.8, 1.9, 1.10, 1.11 и 1.12 команда / give для цепного шлема:
/ give @p chainmail_helmet 1 0
Дайте команду в Minecraft Pocket Edition (PE)
В Minecraft Pocket Edition (PE) 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для кольчужного шлема:
/ give @p chainmail_helmet 1 0
Дайте команду в Minecraft Xbox One
В Minecraft Xbox One 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100 / give command для цепного шлема:
/ give @p chainmail_helmet 1 0
Отдать команду в Minecraft PS4
В Minecraft PS4 1.14.0, 1.16.0 и 1.16.100 команда / give для Chain Helmet:
/ give @p chainmail_helmet 1 0
Отдать команду в Minecraft Nintendo Switch
В Minecraft Nintendo Switch 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепного шлема — :
/ give @p chainmail_helmet 1 0
Дайте команду в Minecraft Windows 10 Edition
В Minecraft Windows 10 Edition 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12. 0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепного шлема:
/ give @p chainmail_helmet 1 0
Дайте команду в Minecraft Education Edition
В Minecraft Education Edition 0.14.2, 1.0, 1.0.18, 1.0.21, 1.4.0, 1.7.0, 1.9.0, 1.12.0, 1.12.60 и 1.14.31, команда / give для кольчужного шлема:
/ give @p chainmail_helmet 1 0
Прочность
Прочность показывает, сколько прослужит предмет. Для инструментов, оружия и транспорта долговечность — это количество полезных действий до того, как предмет будет уничтожен. Для предметов брони долговечность — это количество ударов (которые могут быть заблокированы броней) до того, как предмет будет уничтожен. Таким образом, чем выше показатель прочности, тем дольше прослужит предмет.
В следующей таблице показана долговечность каждого шлема / кепки в Minecraft:
Чары для кольчужного шлема
В Майнкрафт цепной шлем можно зачаровать следующими чарами:
Определения
- Чары — так называется чары.
- Описание — это описание того, что делают чары.
См. Полный интерактивный список Minecraft Enchantments с возможностью поиска.
Что делать с цепным шлемом
Вот некоторые действия, которые вы можете делать с цепными шлемами в Minecraft:
Другая броня
В Майнкрафте можно сделать другую броню, например:
Как сделать цепные сапоги в Майнкрафт
В этом руководстве Minecraft объясняется, как создать цепные ботинки, со скриншотами и пошаговыми инструкциями.
В Minecraft цепные сапоги — это броня, которую нельзя изготовить с помощью верстака или печи.Вместо этого вам нужно найти и собрать этот предмет в игре.
Давайте посмотрим, как добавить цепные ботинки в свой инвентарь.
Поддерживаемые платформы
Chain boots доступны в следующих версиях Minecraft:
* Версия, в которой он был добавлен или удален, если применимо.
ПРИМЕЧАНИЕ. Pocket Edition (PE), Xbox One, PS4, Nintendo Switch и Windows 10 Edition теперь называются Bedrock Edition. Мы продолжим показывать их индивидуально для истории версий.
Где найти цепные сапоги в творческом режиме
Определения
- Платформа — это применяемая платформа.
- Версия (и) — это номера версий Minecraft, где элемент можно найти в указанном месте меню ( мы протестировали и подтвердили этот номер версии ).
- Расположение меню «Креатив» — это расположение элемента в меню «Креатив».
Как получить цепные ботинки в режиме выживания
Вы можете добавить цепные ботинки в свой инвентарь в режиме выживания, убив зомби, который носит их.
Если у вас возникли проблемы с поиском зомби в цепных ботинках, вы можете призвать его с помощью нашего генератора призыва мобов.
Как только вы найдете зомби, вам нужно атаковать его. Когда вы атакуете зомби, он становится розовым, поскольку получает урон.
Продолжайте преследовать и атаковать зомби. После того, как вы убили зомби, с него может упасть броня, которую он носит.
Убедитесь, что вы подняли цепочку, прежде чем она исчезнет.
Кольчужные сапоги — редкий предмет брони, и их следует держать в инвентаре.
Идентификатор и название предмета
- Java
- ПЭ
- Xbox
- PS
- Нинтендо
- Win10
- Edu
Minecraft Java Edition (ПК / Mac)
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Java Edition (ПК / Mac) | 1.8 — 1,12 | |
| Сапоги с цепочкой ( minecraft: | 305 | Java Edition (ПК / Mac) | 1,13 — 1,17 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Карманное издание (PE)
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Карманное издание (PE) | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Xbox One
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Xbox One | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт PS4
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | PS4 | 1.14.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Nintendo Switch
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Nintendo Switch | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Windows 10 Edition
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Windows 10 Edition | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Education Edition
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Арт. | Описание ( Minecraft ID Name ) | Майнкрафт ID | Minecraft Данные Значение | Платформа | Версия (и) |
|---|---|---|---|---|---|
| Сапоги с цепочкой ( minecraft: | 305 | 0 | Education Edition | 1.0 — 1.14.31 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Определения
- Описание — так называется элемент, а ( Minecraft ID Name ) — строковое значение, которое используется в игровых командах.
- Minecraft ID — это внутренний номер предмета.
- Minecraft DataValue (или значение ущерба) определяет вариант блока, если для идентификатора Minecraft ID существует более одного типа.
- Платформа — это подходящая платформа.
- Версия (и) — это номера версий Minecraft, для которых действительны идентификатор и имя Minecraft.
Подать команду на кольчужные сапоги
- Java
- ПЭ
- Xbox
- PS
- Нинтендо
- Win10
- Edu
Дать команду в Minecraft Java Edition (ПК / Mac)
В Minecraft Java Edition (ПК / Mac) 1.13, 1.14, 1.15, 1.16, 1.16.4 и 1.17, команда / give для Chain Boots:
/ give @p chainmail_boots 1
В Minecraft Java Edition (ПК / Mac) 1.8, 1.9, 1.10, 1.11 и 1.12 команда / give для Chain Boots:
/ give @p chainmail_boots 1 0
Дайте команду в Minecraft Pocket Edition (PE)
В Minecraft Pocket Edition (PE) 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепных ботинок:
/ give @p chainmail_boots 1 0
Дайте команду в Minecraft Xbox One
В Minecraft Xbox One 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100 / give command for Chain Boots:
/ give @p chainmail_boots 1 0
Отдать команду в Minecraft PS4
В Minecraft PS4 1.14.0, 1.16.0 и 1.16.100 команда / give для Chain Boots:
/ give @p chainmail_boots 1 0
Отдать команду в Minecraft Nintendo Switch
В Minecraft Nintendo Switch 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для Chain Boots: :
/ give @p chainmail_boots 1 0
Дайте команду в Minecraft Windows 10 Edition
В Minecraft Windows 10 Edition 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12. 0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для Chain Boots:
/ give @p chainmail_boots 1 0
Дайте команду в Minecraft Education Edition
В Minecraft Education Edition 0.14.2, 1.0, 1.0.18, 1.0.21, 1.4.0, 1.7.0, 1.9.0, 1.12.0, 1.12.60 и 1.14.31, команда / give для Chain Boots:
/ give @p chainmail_boots 1 0
Прочность
Прочность показывает, сколько прослужит предмет. Для инструментов, оружия и транспорта долговечность — это количество полезных действий до того, как предмет будет уничтожен. Для предметов брони долговечность — это количество ударов (которые могут быть заблокированы броней) до того, как предмет будет уничтожен. Таким образом, чем выше показатель прочности, тем дольше прослужит предмет.
В следующей таблице показана долговечность каждой пары ботинок в Minecraft:
Чары для кольчужных сапог
В Майнкрафт вы можете зачаровать цепные ботинки следующими чарами:
Определения
- Чары — так называется чары.

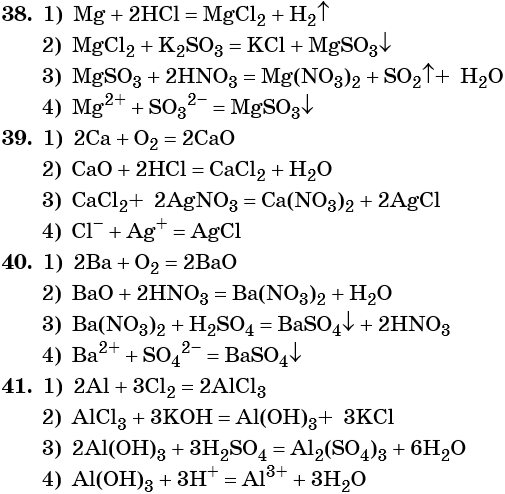 Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
 В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h3. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h3. Величину активности можно узнать из таблицы ряда электрохимических напряжений. Гидролизом можно пренебречь.
Гидролизом можно пренебречь.
 Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой.В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.
Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой.В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.
 Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы ди-, три-, тетра-, и так далее.Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».
Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы ди-, три-, тетра-, и так далее.Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».