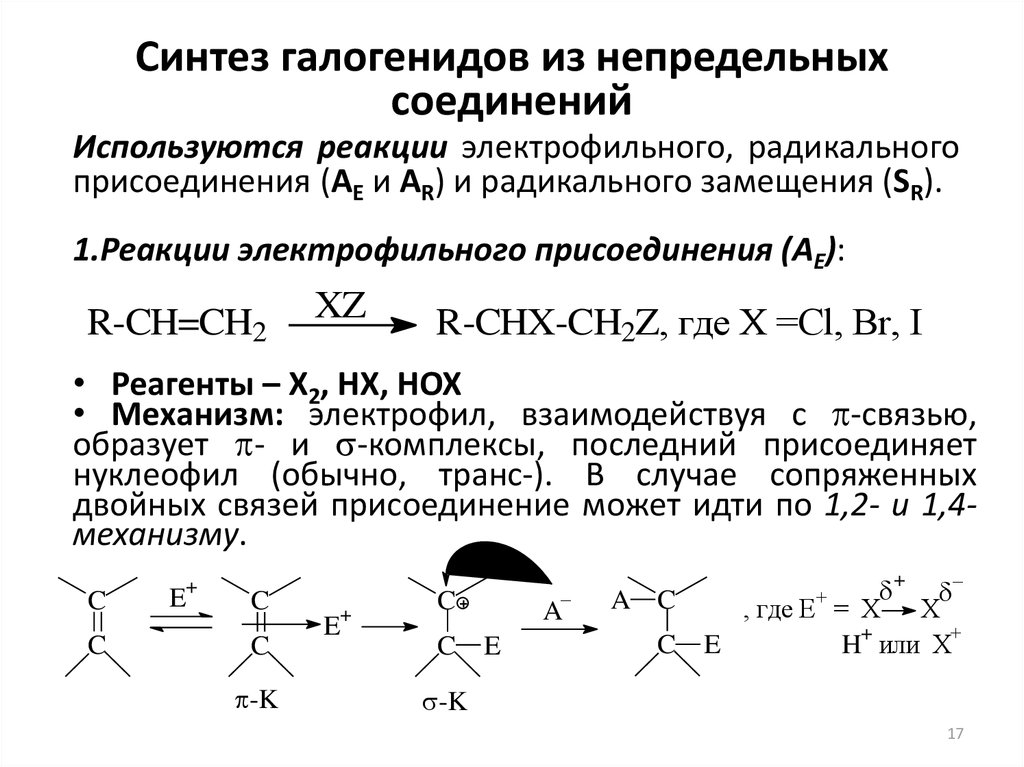
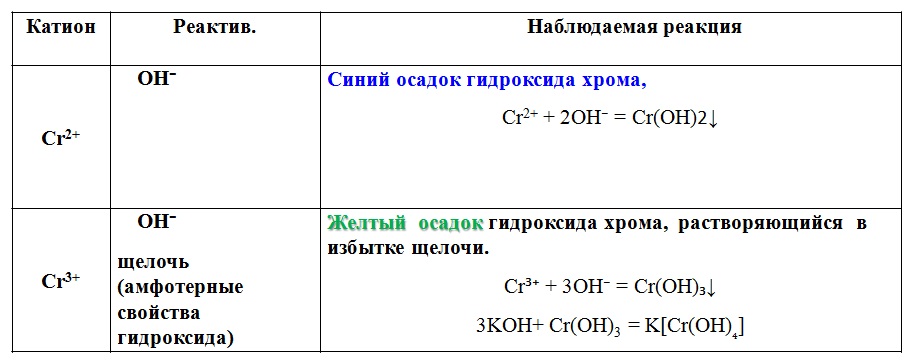
Качественные реакции на галогенид ионы: фармакопейная реакция с AgNo3
NaCl + AgNO3 ® AgCl¯ + NaNO3
белый
AgCl не растворяется в кислотах и щелочах, но растворяется в избытке раствора аммиака:
AgCl + 2NH3 ® [Ag(NH3)2]Cl
хлорид диамминсеребра (I)
NaBr + AgNO3 ® AgBr¯ + NaNO3
светло- желтый
AgBr частично растворяется в избытке раствора аммиака:
NaI + AgNO3 ® AgI¯ + NaNO3
желтый
AgI
нерастворим в растворе аммиака.
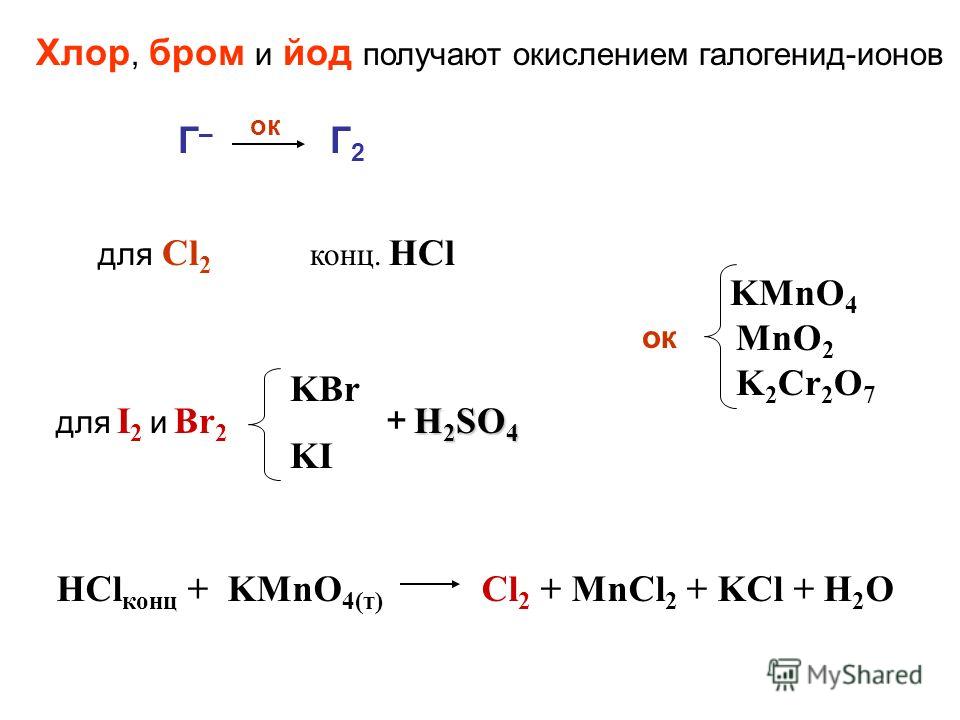
Окислители – KMnO4, MnO2, NaClO, хлорамин, хлорная вода – в кислой среде окисляют бромиды до свободного брома:
2KMnO4 + 16HCl + 10KBr ® 12KCl + 2MnCl2 + 5Br2 + 8H2O
Выделение свободного брома можно обнаружить несколькими способами:
1) В присутствии Br2 растворы буреют.
2) Органические растворители (хлороформ, бензол) окрашиваютcя Br2 в оранжевый цвет. При избытке хлорной воды окраска слоя органического растворителя становится лимонно-желтой вследствие образования бромхлорида BrCl.
3) При действии свободного брома на фуксинсернистую кислоту образуется бромпроизводное фуксинсернистой кислоты, имеющее красно-фиолетовый цвет.
Окислители окисляют йодиды до свободного йода. Чаще всего для окисления йодидов используют хлорную и бромную воду.
Если
к испытуемому раствору в присутствии
слоя хлороформа добавить хлорную воду
небольшими порциями, то сначала происходит
окисление I— до свободного йода и хлороформный слой
окрашивается в фиолетовый цвет. При
дальнейшем добавлении хлорной воды
происходит окисление I2 до йодноватой кислоты HIO3 и фиолетовая окраска исчезает:
При
дальнейшем добавлении хлорной воды
происходит окисление I2 до йодноватой кислоты HIO3 и фиолетовая окраска исчезает:
I2 + 5Cl2 + 6H2O ® 2HIO3 + 10HCl
Вреден не только недостаток, но и избыток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (1,2 мг/л) зубная эмаль легко разрушается и появляются симптомы хронического отравления фтором — флуороз (фтороз) – повышение хрупкости костей, костные деформации и общее истощение организма.
Жизненно необходимые хлорид-ионы не обладают токсическим действием, в то время как молекулярный хлор – высокотоксичный газ, применявшийся в первую мировую войну в качестве отравляющего вещества. Газообразный хлор раздражает слизистые оболочки глаз, носа, гортани, вызывает тяжелое поражение легких. Предельно допустимая концентрация газообразного хлора в воздухе 0,001 мг/л.
Злоупотреблять
препаратами брома опасно, т. к. накопление
брома в организме вызывает отравление.
Бромид-ионы легко всасываются в
желудочно-кишечном тракте. Их токсичность
невысока. Однако вследствие медленного
выведения из организма они могут
куммулировать, что приводит к развитию
хронического отравления, которое
называется «бромизмом». При появлении
признаков хронического отравления
бромом немедленно прекращают прием
препаратов брома, вводят большое
количество хлорида натрия, чтобы
увеличить скорость выделения бромид-ионов
и назначают обильное питье.
к. накопление
брома в организме вызывает отравление.
Бромид-ионы легко всасываются в
желудочно-кишечном тракте. Их токсичность
невысока. Однако вследствие медленного
выведения из организма они могут
куммулировать, что приводит к развитию
хронического отравления, которое
называется «бромизмом». При появлении
признаков хронического отравления
бромом немедленно прекращают прием
препаратов брома, вводят большое
количество хлорида натрия, чтобы
увеличить скорость выделения бромид-ионов
и назначают обильное питье.
Большие дозы элементарного йода очень опасны: 2-3 г являются смертельными. Пары йода также ядовиты. Они вызывают сильное катаральное воспаление слизистой оболочки носа и глаз (йодный насморк).
ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
Осторожно, грипп!!!
. ..
..
Правила здоровья
…
еще …
Наши новости
Открыт тестовый доступ к электронной коллекции Henry Stewart Talks: The Biomedical & Life Sciences Collection
16 марта 2023
Поздравление Министра здравоохранения Российской Федерации М.А. Мурашко с праздником 8 Марта
07 марта 2023
еще …
Наши события
85 лет Молоховой Лилии Георгиевне (1938-2007)
03 марта 2023
Концерт «Сквозь мечты» 3 марта 2023 года в 18:00
02 марта 2023
еще …
Конференции, олимпиады, форумы.
 ..
..Приглашаем к участию в Краевом конкурсе молодых педагогов «Старт в профессию: я — педагог»
15 марта 2023
Исследования учёных ПГФА получили высокую оценку на конференции по цифровизации фармации в Тюмени
22 февраля 2023
Приглашение к участию в Международном литературном конкурсе «Живая латынь»
09 января 2023
еще …
Новости спорта
Женская сборная ПГФА по футболу в I Спартакиаде среди мед- и фармвузов по футзалу
17 марта 2023
Первый игровой день I Спартакиады студентов мед- и фармвузов России по женскому волейболу.
17 марта 2023
Чемпионат Пермского края среди ВУЗов
17 марта 2023
еще …
Button
Ученый совет
Коммерческое предложение ПК 2023
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
День открытых дверей
Информация об аккредитации специалистов
Галерея новостей
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано). Съёмка 2016 года.
Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Тестирование ионов галогенидов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3701
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются тесты на ионы галогенидов (фторид, хлорид, бромид и йодид) с использованием нитрата серебра и аммиака.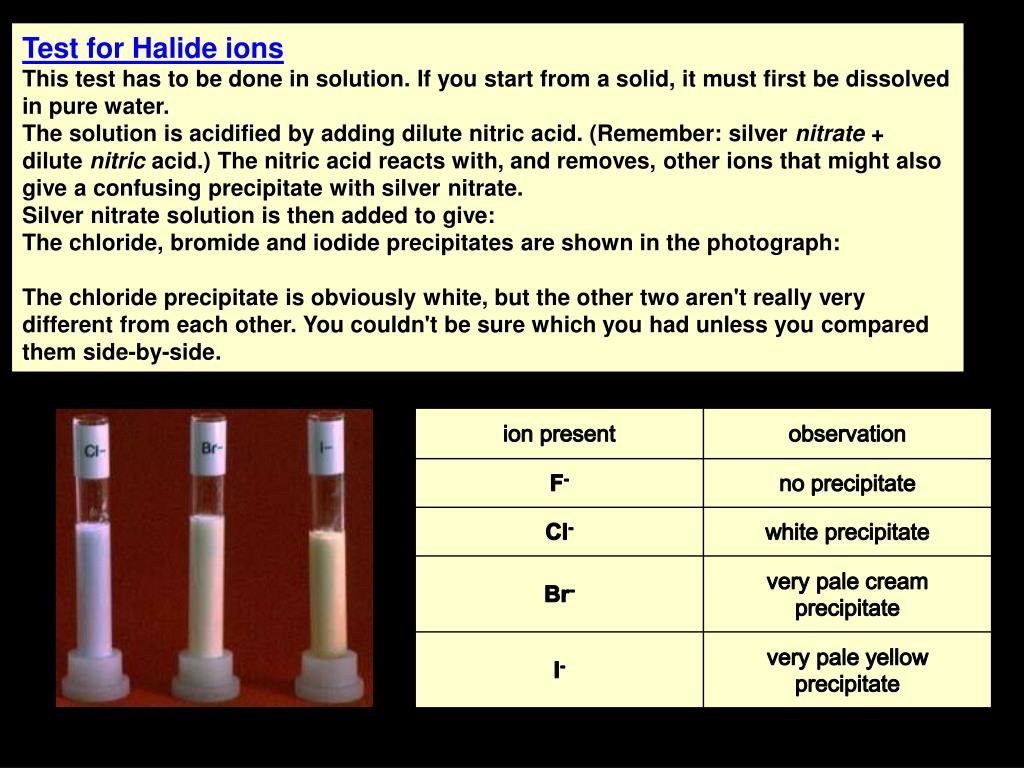
С использованием раствора нитрата серебра
Это испытание проводят в растворе ионов галогенидов. Раствор подкисляют добавлением разбавленной азотной кислоты. Азотная кислота реагирует и удаляет другие ионы, которые также могут образовывать осадки с нитратом серебра. Затем добавляют раствор нитрата серебра, и галогенид можно идентифицировать по следующим продуктам:
| ион присутствует | наблюдение |
|---|---|
| Ф — | без осадка |
| Класс — | белый осадок |
| Бр — | очень бледно-кремовый осадок |
| I — | очень бледно-желтый осадок |
Осадки хлорида, бромида и йода показаны на фотографии:
Осадок хлорида легко идентифицировать, но два других очень похожи друг на друга. Отличить их можно только при прямом сравнении. Все осадки меняют цвет на свету, приобретая серый или фиолетовый оттенок. Отсутствие осадка с ионами фтора бесполезно, если только не известно, что присутствует галоген; в противном случае это указывает на отсутствие хлорида, бромида или йодида. 9-_{(aq)} \]
Отличить их можно только при прямом сравнении. Все осадки меняют цвет на свету, приобретая серый или фиолетовый оттенок. Отсутствие осадка с ионами фтора бесполезно, если только не известно, что присутствует галоген; в противном случае это указывает на отсутствие хлорида, бромида или йодида. 9-_{(aq)} \]
Подтверждение осадка с помощью раствора аммиака
К осадку добавляется раствор аммиака.
| исходный осадок | Наблюдение |
|---|---|
| AgCl | Осадокрастворяется, образуя бесцветный раствор | .
| AgBr | Осадокпочти не изменяется при использовании разбавленного раствора аммиака, но растворяется в концентрированном растворе аммиака с образованием бесцветного раствора |
| АГ | осадок нерастворим в растворе аммиака любой концентрации |
Абсолютно нерастворимых ионных соединений не существует. -]\]
-]\]
В квадратных скобках указаны молярные концентрации в моль-л -1 .
- Если произведение концентраций ионов меньше произведения растворимости, осадок не образуется.
- Если произведение концентраций превышает это значение, образуется осадок.
По существу, произведение концентраций ионов никогда не превышает значение произведения растворимости. Всегда осаждается достаточно твердого вещества, чтобы понизить ионное произведение до произведения растворимости. В таблице ниже перечислены продукты растворимости хлорида серебра в йодид серебра (произведение растворимости фторида серебра не может быть указано, поскольку он слишком растворим).
| К сп (моль 2 дм -6 ) | |
|---|---|
| AgCl | 1,8 x 10 -10 |
| AgBr | 7,7 x 10 -13 |
| АГ | 8,3 x 10 -17 |
Все соединения совершенно нерастворимы, но становятся еще менее растворимыми в группе.
Назначение аммиака
Аммиак соединяется с ионами серебра с образованием комплексного иона, называемого ионом диамминсеребра(I), [Ag(NH 3 ) 2 ] + . Это обратимая реакция, но комплекс очень стабилен, и положение равновесия смещено далеко вправо. Уравнение этой реакции приведено ниже:
Раствор, контактирующий с одним из осадков галогенида серебра, содержит очень небольшую концентрацию растворенных ионов серебра. Добавление аммиака приводит к еще большему снижению этой концентрации. Если скорректированная концентрация ионов серебра, умноженная на концентрацию галогенид-ионов, меньше произведения растворимости, часть осадка растворяется для восстановления равновесия.
Это происходит с хлоридом серебра и с бромидом серебра, если аммиак концентрированный. Более концентрированный аммиак смещает равновесие еще дальше вправо, еще больше снижая концентрацию ионов серебра.
Иодид серебра настолько нерастворим, что аммиак не может снизить концентрацию ионов серебра настолько, чтобы осадок растворился.
Альтернативный тест с использованием концентрированной серной кислоты
Добавление концентрированной серной кислоты к твердому образцу одного из галогенидов дает следующие результаты:
| ион присутствует | наблюдение |
|---|---|
| Ф — | парообразные кислотные пары (HF) |
| Класс — | пары кислотных паров (HCl) |
| Бр — | парообразные кислотные пары (HBr), загрязненные коричневыми парами брома |
| I — | некоторые пары HI с большим количеством пурпурных паров йода и красного соединения в реакционном сосуде |
Единственная возможная путаница между фторидом и хлоридом — они ведут себя одинаково в этих условиях.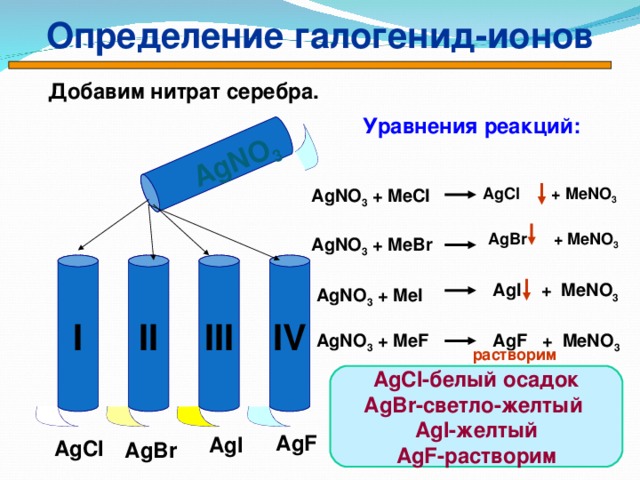 Их можно отличить, растворив исходное твердое вещество в воде, а затем проверив его раствором нитрата серебра. Хлорид дает белый осадок; фтор не дает.
Их можно отличить, растворив исходное твердое вещество в воде, а затем проверив его раствором нитрата серебра. Хлорид дает белый осадок; фтор не дает.
Авторы и авторство
Эта страница под названием «Тестирование ионов галогенидов» публикуется в соответствии с лицензией CC BY-NC 4.0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Аммиак
- бромид
- хлорид
- концентрации
- фторид
- ионы галогенидов
- нерастворимые ионные соединения
- йодид
- ионные соединения
- молярные концентрации
- осадок
- осадки
- Нитрат серебра
- Произведение растворимости
Анализ на ионы галогенидов
ИСПЫТАНИЯ НА ГАЛИД-ИОНЫ На этой странице описываются и объясняются тесты на ионы галогенидов (фторид, хлорид, бромид и йодид) с использованием раствора нитрата серебра, а затем раствора аммиака. Использование раствора нитрата серебра Проведение теста Этот тест необходимо проводить в растворе. Если вы начинаете с твердого вещества, его нужно сначала растворить в чистой воде. Раствор подкисляют добавлением разбавленной азотной кислоты. (Помните: серебро нитрат + разбавленная азотная кислота.) Азотная кислота вступает в реакцию с другими ионами и удаляет их, которые также могут давать осадок, вызывающий путаницу с нитратом серебра. Затем добавляют раствор нитрата серебра, чтобы получить:
На фотографии показаны осадки хлоридов, бромидов и йодидов: Осадок хлорида явно белый, но два других на самом деле не сильно отличаются друг от друга. Все осадки меняют цвет на свету, приобретая серый или пурпурный оттенок. Отсутствие осадка с ионами фтора ничего не доказывает, если вы уже не знаете, что у вас должен присутствовать галоген, и просто пытаетесь выяснить, какой именно. Все отсутствие осадка показывает, что вы не содержит ионов хлорида, бромида или йодида. Химия теста Осадки представляют собой нерастворимые галогениды серебра — хлорид серебра, бромид серебра или йодид серебра.
Фторид серебра растворим, поэтому осадка не образуется. Подтверждение осадка с помощью раствора аммиака Проведение подтверждения К осадкам добавляют раствор аммиака.
Объяснение происходящего Фон Не существует абсолютно нерастворимых ионогенных соединений. Осадок будет образовываться только в том случае, если концентрация ионов в растворе в воде превысит определенное значение, разное для каждого отдельного соединения. Это значение может быть указано как произведение растворимости . Для галогенидов серебра произведение растворимости определяется выражением: K sp = [Ag + (водн. Квадратные скобки имеют обычное значение и показывают концентрации в моль дм -3 . Если фактическая концентрация ионов в растворе меньше произведения растворимости, осадка не образуется. Если произведение концентраций превысит это значение, то выпадет осадок. По существу, произведение концентраций ионов никогда не может быть больше, чем значение произведения растворимости. Осаждается достаточное количество твердого вещества, так что ионное произведение снижается до значения произведения растворимости. | |||||||||||||||||||||||
Примечание: Если в вашей учебной программе сказано, что вам необходимо знать о расчетах произведения растворимости, вам может быть интересна моя книга по химическим расчетам, где они подробно объясняются. | |||||||||||||||||||||||
Посмотрите, как меняются продукты растворимости от хлорида серебра до йодида серебра.
| |||||||||||||||||||||||
Примечание: Эти цифры взяты из Книги химических данных Старка и Уоллеса. | |||||||||||||||||||||||
Вы видите, что все соединения почти нерастворимы, но становятся еще менее растворимыми по мере перехода от хлорида к бромиду и к йодиду. Что делает аммиак? Аммиак соединяется с ионами серебра с образованием комплексного иона, называемого ионом диамминсеребра(I), [Ag(NH 3 ) 2 ] + . Раствор, контактирующий с одним из осадков галогенида серебра, будет содержать очень небольшую концентрацию растворенных ионов серебра. Добавление аммиака приводит к еще большему снижению этой концентрации. Что произойдет, если вы умножите эту новую концентрацию ионов серебра на концентрацию ионов галогенидов? Если ответ меньше произведения растворимости, осадок растворится. Это происходит с хлоридом серебра и с бромидом серебра, если используется концентрированный аммиак. Более концентрированный аммиак смещает равновесие еще дальше вправо, еще больше снижая концентрацию ионов серебра. Иодид серебра настолько нерастворим, что аммиак не снижает концентрацию ионов серебра настолько, чтобы осадок растворился. Альтернативный тест с использованием концентрированной серной кислоты Если вы добавите концентрированную серную кислоту к твердому образцу одного из галогенидов, вы получите следующие результаты:
| |||||||||||||||||||||||

 Вы не могли бы быть уверены, что у вас есть, если бы вы не сравнили их бок о бок.
Вы не могли бы быть уверены, что у вас есть, если бы вы не сравнили их бок о бок.
 ) ][X — (водн.) ]
) ][X — (водн.) ] (Вы не можете указать значение произведения растворимости для фторида серебра, потому что оно слишком растворимо. Продукты растворимости работают только с соединениями, которые очень и очень плохо растворимы.)
(Вы не можете указать значение произведения растворимости для фторида серебра, потому что оно слишком растворимо. Продукты растворимости работают только с соединениями, которые очень и очень плохо растворимы.)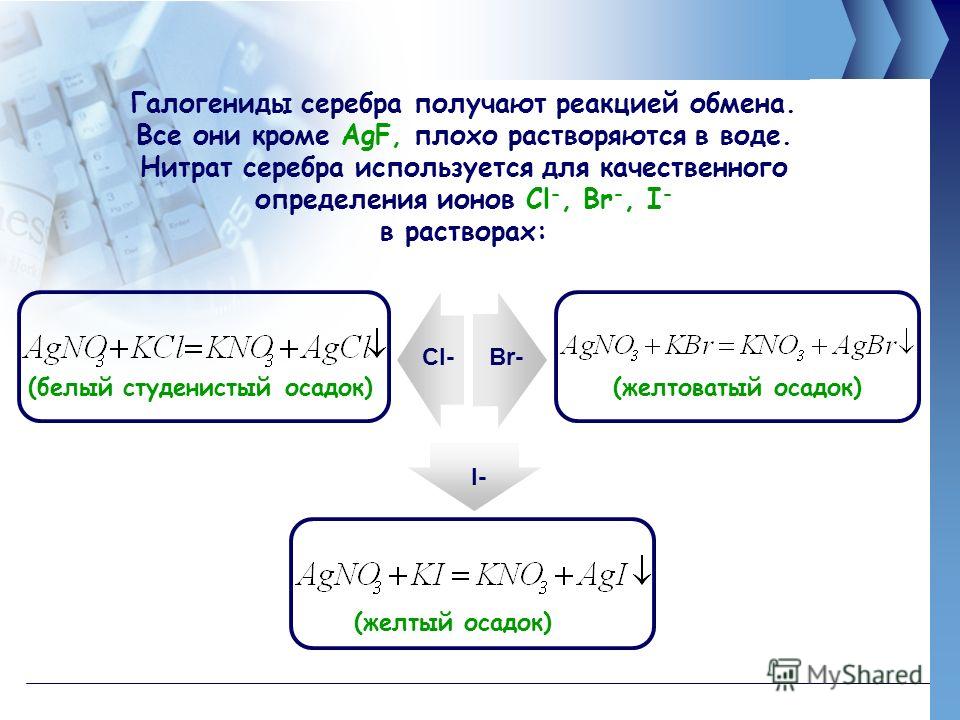 Это обратимая реакция, но комплекс очень стабилен, и положение равновесия смещено далеко вправо.
Это обратимая реакция, но комплекс очень стабилен, и положение равновесия смещено далеко вправо.