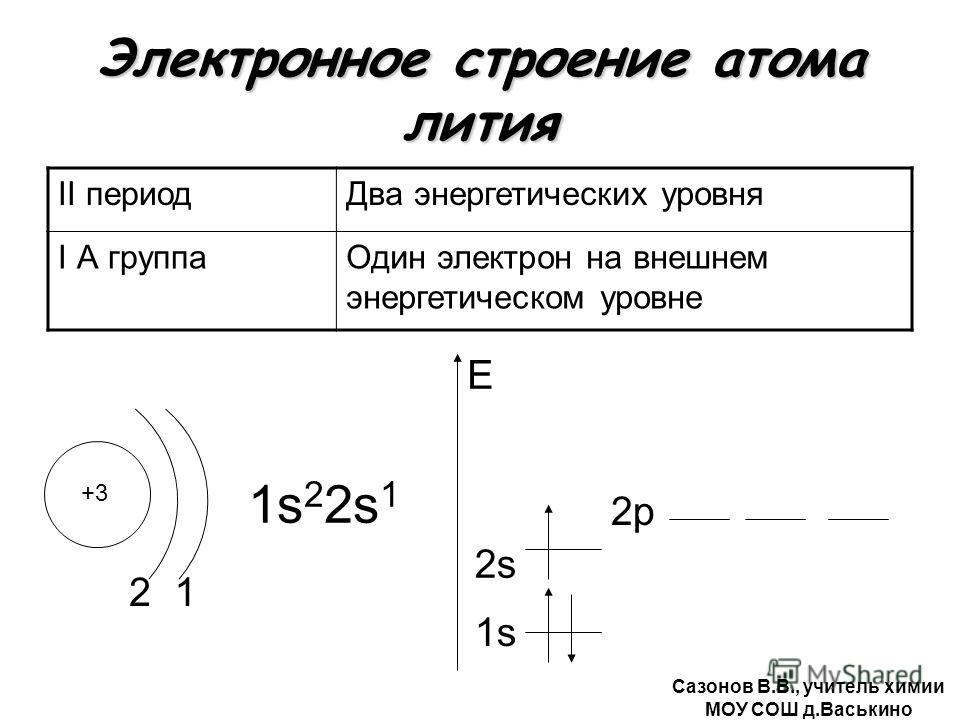
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов, 8 класс
МБОУ «Гимназия №1 города Новопавловска»
Химия 8 класс
Тема:
«Изменение числа электронов
на внешнем энергетическом уровне
атомов химических элементов»
Учитель: Татьяна Алексеевна Комарова
г. Новопавловск
Дата: ___________
Урок – 9
Тема урока: Изменение числа электронов на внешнем энергетическом
уровне атомов химических элементов.
Цели урока:
— сформировать понятие о металлических и неметаллических свойствах элементов на атомном уровне;
— показать причины изменения свойств элементов в периодах и группах на основе строения их атомов;
— дать первоначальные представления об ионной связи.
Оборудование: ПСХЭ, таблица «Ионная связь».
Ход урока
Организационный момент.
Проверка знаний
Характеристика химических элементов по таблице ( 3 чел.)
Строение атомов (2 чел.)
Изучение нового материала
Рассмотрим следующие вопросы:
1. Атомы, каких химических элементов, имеют завершенные энергетические уровни?
— это атомы инертных газов, которые расположены в главной подгруппе 8-й группы.
Завершенные электронные слои обладают повышенной устойчивостью и стабильностью.
Атомы VIII группы (He Ne Ar Kr Xe Rn) содержат на внешнем уровне 8е—, именно поэтому они инертны, т.е. химически не активны, не вступают во взаимодействие с другими веществами, т.е. их атомы обладают повышенной устойчивостью и стабильностью. То есть, все химические элементы(обладающие различным электронным строением) стремятся при химическом взаимодействии получить завершенный внешний энергетический уровень,8е—.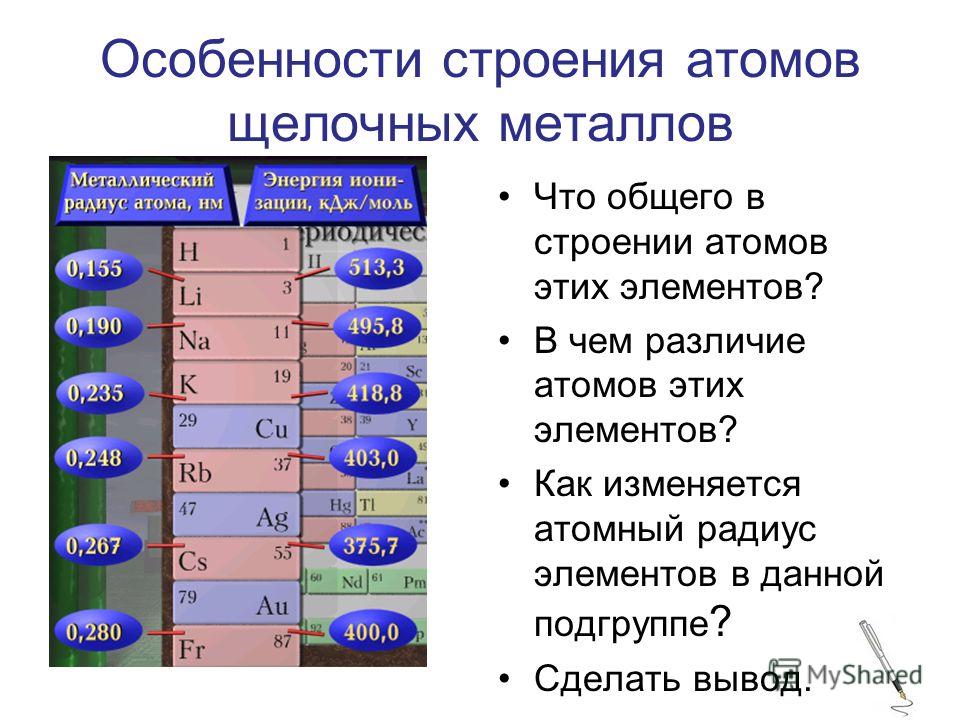
Пример:
Na Mg F Cl
+11 +12 +9 +17
2 8 1 2 8 2 2 7 2 8 7
1s22s2p63s1 1s22s2p63s2 1s22s2p5 1s22s2p63s2p5
Как вы считаете, каким образом атомы этих элементов могут достичь восемь электронов на внешнем уровне?
Если (предположим) закрыть рукой последний уровень у Na и Mg , то получаются завершенные уровни. Следовательно, надо отдать с внешнего электронного уровня эти электроны! Тогда при отдаче электронов пред-внешний слой из 8е—, становится внешним.
А у элементов F и Cl , следует принять 1 недостающий электрон на свой энергетический уровень, чем отдать 7е—. И так, существует 2 пути достижения завершенного энергетического уровня:
А) Отдача ( «лишних») электронов с внешнего слоя.
Б) Принятие на внешний уровень («недостающих») электронов.
2.Понятие о металличности и неметалличности на атомном уровне:
Металлы – это элементы, атомы которых отдают свои внешние электроны.
Неметаллы – это элементы, атомы которых принимают на внешний энергетический уровень электроны.
Чем легче атом Ме отдает свои электроны, тем сильнее выражены его металлические свойства.
Чем легче атом неМе принимает недостающие электроны на внешний слой, тем более сильно выражены его неметаллические свойства.
3. Изменение Ме и неМе свойств атомов х.э. в периодах и группах в ПСХЭ.
В периодах:
Пример: Na (1e—) Mg (2е—) – записать строение атома.
— Как вы считаете, у какого элемента сильнее выражены металлические свойства, у Na или Mg? Что легче отдать 1е— или 2е—? ( Конечно 1е—, следовательно у Na металлические свойства выражены сильнее).
Пример: Al (3e—) Si (4e—) и т.д.
По периоду количество электронов на внешнем уровне растет слева направо.
(ярче металлические свойства выражены у Al).
Конечно, способность к отдаче электронов по периоду будет уменьшаться, т.е. металлические свойства будут ослабевать.
Таким образом, самые сильные Ме расположены в начале периодов.
— А как будет меняться способность к присоединению электронов? (будет увеличиваться)
Пример:
Si Cl
+14 r +17 r
2 8 4 2 8 7
Легче принять 1 недостающий электрон ( у Cl ), чем 4е— у Si.
Вывод:
Неметаллические свойства по периоду слева направо будут усиливаться, а металлические свойства ослабевать.
Еще 1 причина усиления неМе свойств – это уменьшение радиуса атома при неизменном числе уровней.
Т.к. в пределах 1-го периода число энергетических уровней для атомов не меняется, но растет число внешних электронов е— и число протонов р— в ядре.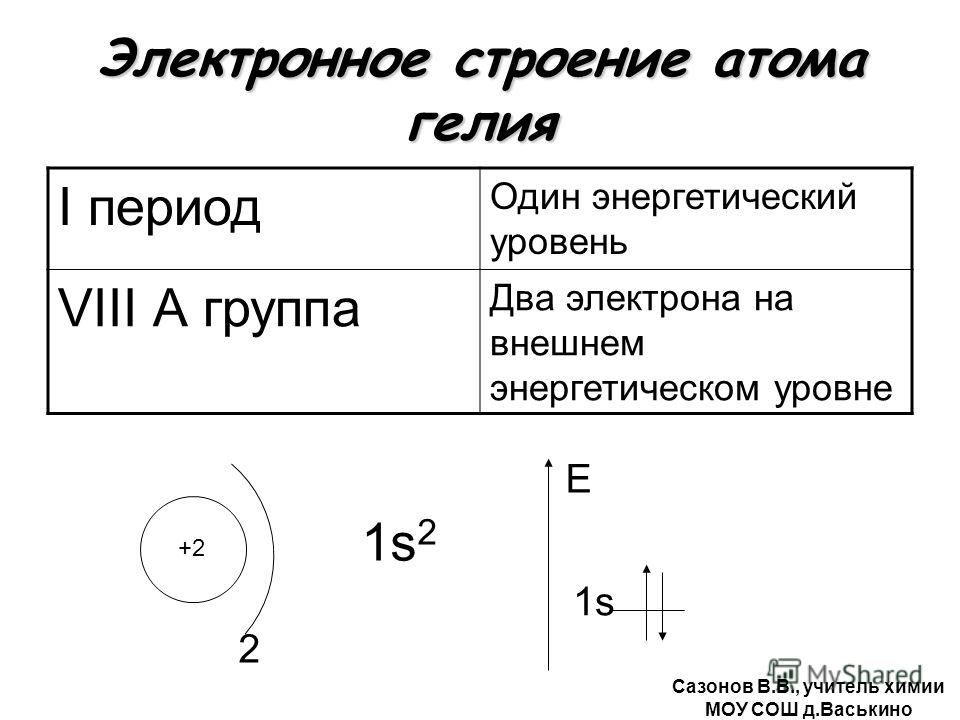 Вследствие этого притяжения электронов к ядру усиливается ( закон Кулона), и радиус (r) атома уменьшается, атом как бы сжимается.
Вследствие этого притяжения электронов к ядру усиливается ( закон Кулона), и радиус (r) атома уменьшается, атом как бы сжимается.
Вывод общий:
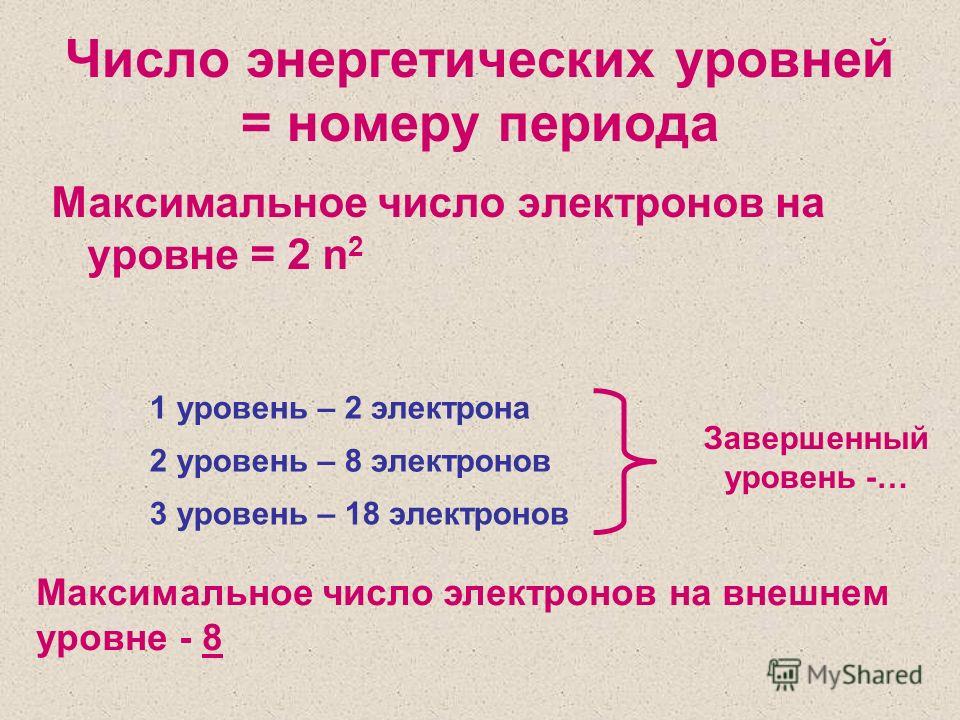
В пределах одного периода с ростом порядкого номера (N) элемента, металлические свойства элементов ослабевают, а неметаллические – усиливаются, потому что:
— Растет число е— на внешнем уровне оно равно № группы и число протонов в ядре.
— Радиус атома уменьшается
— Число энергетических уровней постоянно.
4. Рассмотрим вертикальную зависимость изменения свойств элементов ( в пределах главных подгрупп) в группах.
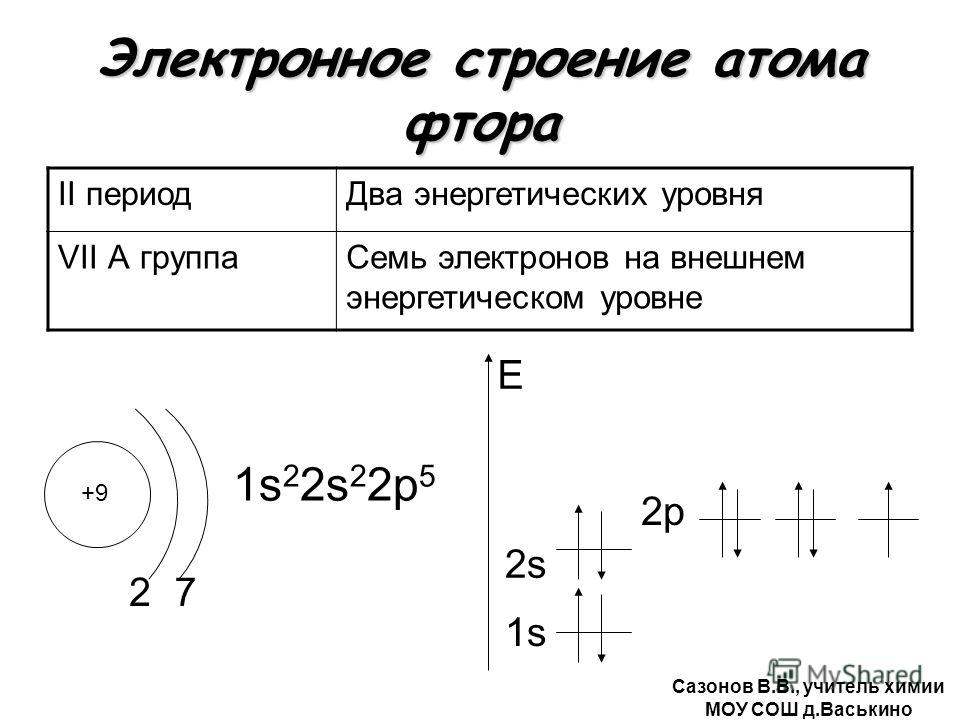
Пример: VII группа главная подгруппа (галогены)
F Cl
+9 +17
2 7 2 8 7
1s22s2p5 1s22s2p6 3s2p5
Число е— на внешнем уровнях этих элементов одинаковое, а число энергетических уровней разное,
у F -2e—, а Cl – 3e—/
— У какого атома радиус больше? ( — у хлора, т. к. 3 энергетических уровней).
к. 3 энергетических уровней).
Чем ближе к ядру расположены е— тем они сильнее притягиваются к нему.
— Атом какого элемента будет легче присоединять е— у F или Сl?
( F – легче присоединить 1 недостающий электрон), т.к. у него меньше радиус, а значит сила притяжения электрона к ядру больше, чем у Cl.
Закон Кулона
Сила взаимодействия двух электрических зарядов обратно-пропорциональна квадрату
расстояния между ними, т.е. чем больше расстояние между атомами, тем меньше сила
притяжения двух разноименных зарядов ( в данном случае, электронов и протонов).
F сильнее Cl ˃Br˃J и т.д.
Вывод:
В группах (главных подгруппах) неметаллические свойства – уменьшаются, а металлические усиливаются, потому что:
1). Число электронов на внешнем уровне атомов одинаковое ( и равно № группы).
2). Число энергетических уровней в атомах растёт.
3). Радиус атома увеличивается.
Устно по таблице ПСХЭ рассмотреть I — группу главную подгруппу. Сделать вывод, что самый сильный металл- это Fr франций, а самый сильный неметалл – это F фтор.
Сделать вывод, что самый сильный металл- это Fr франций, а самый сильный неметалл – это F фтор.
Ионная связь.
Рассмотрим, что произойдет с атомами элементов, если они достигнут октета ( т.е. 8е—) на внешнем уровне:
Выпишем формулы элементов:
Na0 +11 2е—8е—1е— Mg0 +12 2е—8е—2е— F0 +9 2е—7e— Cl0 +17 2е—8е—7е—
Naх +11 2е—8е—0е— Mgх +12 2е—8е—0е— Fх +9 2е—8e— Clх +17 2е—8е—8е—
Верхний ряд формул содержит одинаковое число протонов и электронов, т.к. это формулы нейтральных атомов( стоит нулевой заряд «0»- это степень окисления).
Нижний ряд – разное число p+ и e—, т.е. это формулы заряженных частиц.
Вычислим заряд данных частиц.
Na+1 +11 2е—8е—0е— 2+8=10, 11-10 =1, степень окисления +1
F — +9 2е—8e— 2+8 =10, 9-10 =-1, степень окисления -1
Mg+2 +12 2е—8е—0е—2+8 =10, 12-10 =-2, степень окисления -2
В результате присоединения – отдачи электронов получаются заряженные частицы, которые называют ионы.
Атомы Ме при отдаче е— приобретает «+» (положительный заряд)
Атомы неМе принимая «чужие» электроны заряжаются «- » (отрицательный заряд)
Химическая связь, образующаяся между ионами, называют ионной.
Ионная связь возникает между сильными Ме и сильными неМе.
Примеры.
а) образование ионной связи. Na+ Cl—
Na Cl + —
+11 + +17 +11 +17
2 8 1 2 8 7 2 8 2 8 8
1e—
Процесс превращения атомов в ионы:
1е—
Na0 + Cl0 Na+ + Cl— Na+ Cl—
атом атом ион ион ионное соединение
2е—
б) Са О 2+ 2-
+ 20 +8 +20 +8
2 8 8 2 2 6 2 8 8 2 8
Са2+О2-
Алгоритм образования ионной связи.

Пример между атомами Са и Сl .
Сa – II группа, главная подгруппа, Ме. Его атому легче отдать 2е— внешних , чем принять недостающие 6е—.
Ca0 – 2e— Ca2+
атом ион
Сl – VII группа, главная подгруппа, неМе. Его атому легче принять 1е—, чем отдать 7е— с внешнего уровня:
Cl0 + 1e— Cl—
атом ион
Са0 – 2е— Са2+ 2 1
Сl0 + 1е— Сl— 1 2
Са0 + 2 Сl0 Ca2+Cl2—
2е—
Закрепление знаний, умений, навыков.
Атомы Ме и неМе
Ионы «+» и «-»
Ионная химическая связь
Коэффициенты и индексы.
Д/З §9, №1,№2, стр.
 58
58
Итог урока
Литература:
1. Химия 8 класс. учебник для общеобразовательных
учреждений/О.С. Габриелян. Дрофа 2009 год
2. Габриелян О.С. Настольная книга учителя.
Химия 8 класс, Дрофа, 2003 г
ГДЗ / ОТВЕТЫ Химия 8 класc Габриелян О.С. §10 Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов » Крутые решение для вас от GDZ.cool
ГДЗ / ОТВЕТЫ Химия 8 класc Габриелян О.С. §10 Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Сравните строение и свойства атомов:
а) углерода и кремния;
| +6 С )) 1s22s22p2 24 | +14 Si ))) 1s22s22p63s23p2 284 |
Электронная оболочка атомов содержит одинаковое количество электронов на внешнем энергетическом уровне (по 4 электрона), а различается количеством энергетических уровней (2 в атома углерода и 3 в атома кремния), и, соответственно, радиусом атома, в связи с чем электроны внешнего энергетического уровня располагаются дальше от ядра и слабее с ним связаны, поэтому металические свойства кремния выражены сильнее, чем в углерода.
б) кремния и фосфора.
| +14 Si ))) 1s22s22p63s23p2 284 | +15 P ))) 1s22s22p63s23p3 285 |
Электронная оболочка атомов содержит одинаковое количество энергетических уровней (по 3 уровня), а различается количеством электронов на внешнем энергетическом уровне (4 в атома кремния и 5 в атома фосфора), а из увеличением числа электронов способность к отдаче валентных электронов ослабевает, а стремление к присоединению электронов усиливается, поэтому неметаллические свойства фосфора выражены сильнее, чем в кремния.
Задание 2 Рассмотрите схемы образования ионной связи между атомами химических элементов:
а) калия и кислорода;
Калий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
К0 -1е → К+
атом ион
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов:
Его атому легче принять 2 электрона, чем отдать 6 электронов:
О0 +2е → О2-
атом ион
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (1•2=2). Затем определим, сколько атомов калия нужно взять, чтобы они отдали два электрона (т.е. надо взять 2 атома К), и сколько атомов кислорода надо взять, чтобы они могли принять два электрона (т.е. нужно взять 1 атом О)
| 2К0 + О0 → K22+O2- └─2e─┘ |
б) лития и хлора;
Литий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
Li0 -1е → Li+
атом ион
Хлор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов:
Cl0 +1е → Cl—
атом ион
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 1(1•1=1). Затем определим, сколько атомов лития нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом Li), и сколько атомов хлора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом Cl)
Затем определим, сколько атомов лития нужно взять, чтобы они отдали один электрон (т.е. надо взять 1 атом Li), и сколько атомов хлора надо взять, чтобы они могли принять один электрон (т.е. нужно взять 1 атом Cl)
| Li0 + Cl0 → Li+Cl— └─1e─┘ |
в) магния и фтора.
Магний — элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешний электрон, чем принять недостающие 6:
Mg0 -2е → Mg2+
атом ион
Фтор — элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, чем отдать 7 электронов:
F0 +1е → F—
атом ион
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2•1=2). Затем определим, сколько атомов магния нужно взять, чтобы они отдали два электрона (т.е. надо взять 1 атом Mg), и сколько атомов фтора надо взять, чтобы они могли принять два электрона (т.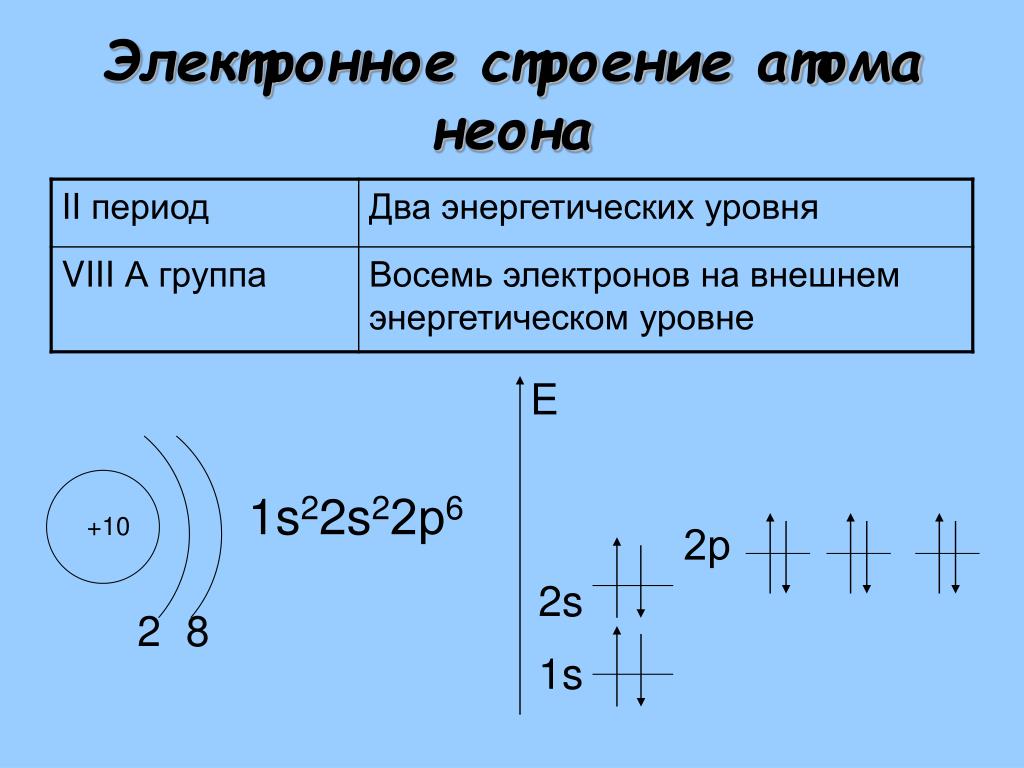 е. нужно взять 2 атома F)
е. нужно взять 2 атома F)
| Mg0 + 2F0 → Mg2+F2— └─2e─┘ |
Задание 3 Назовите самый типичный металл и самый типичный неметалл Периодической системы Д. И. Менделеева.
Самый типичный металл ― франций (Fr), т.к. размещен в нижнем левом углу периодической системы Д.И.Менделеева, имеет наибольшее количество энергетических уровней (=7) и наименьший заряд ядра среди элементов своего периода.
Самый типичный неметалл ― фтор (F), расположен в верхнем правом углу периодической системы Д.И.Менделеева (кроме инертных элементов), имеет наименьшее количество энергетических уровней (=2) и наибольший заряд ядра атома среди элементов своего периода.
Задание 4 Пользуясь дополнительными источниками информации, объясните, почему инертные газы стали называть благородными. Инертные газы стали называть благородными, по аналогии с благородными металлами, так как они образуют соединения с другими химическими элементами с большим трудом и существуют в виде одноатомных молекул.
Другие задания смотри здесь…
уровней энергии, электронов и ковалентной связи | Глава 4: Периодическая таблица и связь
Вам это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 4.4
Ключевые понятия
- Электроны на внешнем энергетическом уровне атома называются валентными электронами.
- Валентные электроны участвуют в связывании одного атома с другим.
- Притяжение ядра каждого атома к валентным электронам другого атома сближает атомы.
- Поскольку притяжение сближает атомы, электроны от каждого атома притягиваются к ядрам обоих атомов, которые «делят» электроны.
- Совместное использование электронов между атомами называется ковалентной связью, которая удерживает атомы вместе как молекулу.
- Ковалентная связь возникает, если притяжение достаточно сильно в обоих атомах и если каждый атом имеет место для электрона на своем внешнем энергетическом уровне.

- Атомы будут ковалентно связываться, пока их внешний энергетический уровень не будет заполнен.
- Атомы, ковалентно связанные как молекула, более устойчивы, чем отдельные атомы.
Резюме
Учащиеся будут смотреть анимацию и обращаться к моделям уровней энергии, которые они использовали для рисования процесса ковалентной связи. Учащиеся рассмотрят, почему атомы связываются с образованием таких молекул, как H 2 (водород), H 2 O (вода), O 2 (кислород), CH 4 (метан) и CO 2 (углекислый газ).
Задача
Учащиеся смогут объяснить, что притяжение между протонами и электронами двух атомов вызывает их связь. Учащиеся смогут нарисовать модель ковалентных связей между атомами H 2 (водород), H 2 O (вода), O 2 (кислород), CH 4 (метан) и CO 2 (двуокись углерода).
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы для каждой группы
- 9-вольтовая батарея
- 2 провода с зажимами типа «крокодил» на обоих концах
- 2 карандаша, заточенных с обоих концов
- Вода
- Соль
- Прозрачный пластиковый стаканчик
- Лента
Об этом уроке
Этот урок, вероятно, займет больше одного урока.
Покажите анимацию, знакомящую с процессом ковалентной связи.
Представьте вопрос, который учащиеся будут исследовать на этом уроке:
- Если атомы имеют одинаковое количество протонов и электронов, почему атомы связаны с другими атомами? Почему бы им просто не остаться отдельными?
- Начните отвечать на этот вопрос, используя в качестве примера водород.
Анимационный проект Ковалентная связь в водороде.

Убедитесь, что учащиеся видят, что каждый атом водорода имеет 1 протон и 1 электрон. Напомните учащимся, что электрон и его собственный протон притягиваются друг к другу. Объясните, что если атомы подходят достаточно близко друг к другу, электрон каждого атома водорода испытывает притяжение от протона другого атома водорода (показано двусторонней стрелкой). Укажите учащимся, что силы притяжения недостаточно, чтобы полностью оторвать электрон от собственного протона. Но притяжение достаточно сильно, чтобы притянуть два атома достаточно близко друг к другу, так что электроны чувствуют притяжение от обоих протонов и разделяются обоими атомами. В конце анимации объясните, что отдельные атомы водорода теперь связаны, образуя молекулу H 2 . Этот тип связи называется ковалентной связью. В ковалентной связи электроны от каждого атома притягиваются или «делятся» обоими атомами.
Обсудите условия, необходимые для образования ковалентной связи, и образующуюся стабильную молекулу.

Спроецируйте изображение Ковалентная связь в водороде.
Узнайте больше о сплочении в дополнительном разделе истории учителя в конце этого урока.
Примечание: Эта модель ковалентной связи для молекулы водорода (H
- Два атома водорода находятся рядом друг с другом.
- Когда два атома водорода подходят достаточно близко друг к другу, их электроны притягиваются к протону другого атома.
- Поскольку существует достаточно сильное притяжение между атомами и место для электронов на внешнем энергетическом уровне обоих атомов, атомы имеют общие электроны. Это образует ковалентную связь.

Расскажите учащимся, что есть две основные причины, по которым два атома водорода соединяются вместе, образуя одну молекулу водорода:
- Между электронами каждого атома должно быть достаточно сильное притяжение к протонам другого атома.
- На внешнем энергетическом уровне обоих атомов должно быть место.
После связывания молекула водорода более стабильна, чем отдельные атомы водорода. Объясните учащимся, что, являясь частью ковалентной связи, электрон от каждого атома водорода оказывается рядом с двумя протонами, а не только с одним протоном, с которого он начинался. Поскольку электроны ближе к большему количеству протонов, молекула из двух связанных атомов водорода более стабильна, чем два отдельных несвязанных атома водорода.
Вот почему очень редко можно найти атом водорода, не связанный с другими атомами. Атомы водорода связываются с другими атомами водорода, образуя газообразный водород (H 2 ). Или они могут связываться с другими атомами, такими как кислород, образуя воду (H 2 O), или углерод, образуя метан (CH

Покажите учащимся, что когда два атома водорода соединяются вместе, внешний энергетический уровень заполняется.
Предложите учащимся просмотреть свою Периодическую таблицу энергетических уровней элементов 1–20, представленную на уроке 3.
Объясните, что два электрона в молекуле водорода (H 2 ) можно считать «принадлежащими» каждому атому. Это означает, что каждый атом водорода теперь имеет два электрона на своем первом энергетическом уровне. Первый энергетический уровень во внешнем энергетическом уровне для водорода и может вмещать или «удерживать» только два электрона. Атомы будут продолжать ковалентно связываться, пока их внешние энергетические уровни не будут заполнены. В этот момент дополнительные атомы не будут ковалентно связываться с атомами в H 2 молекула.
Предложите учащимся описать ковалентную связь в молекуле водорода на своих рабочих листах, а затем просмотреть свои ответы.
Раздайте каждому учащемуся лист с заданиями.

Предложите учащимся написать краткую подпись под каждой картинкой, чтобы описать процесс ковалентной связи и ответить на первые три вопроса. Остальная часть рабочего листа будет выполнена в классе, в группах или индивидуально, в зависимости от ваших инструкций.
Спросите студентов:
- Что вы написали для второй и третьей картинки ковалентной связи?
- Рисунок в центре: Когда два атома водорода подходят достаточно близко, их электроны притягиваются к протону другого атома.
- Последний рисунок: это сближает атомы настолько, что у них есть общие электроны.
- Какие два условия должны иметь атомы, чтобы образовать ковалентные связи друг с другом?
- Между атомами существует достаточно сильное притяжение, и на внешнем энергетическом уровне обоих атомов есть место для электронов.
- Почему молекула водорода (H 2 ) более стабильна, чем два отдельных атома водорода?
- В молекуле водорода электроны от каждого атома могут находиться рядом с двумя протонами, а не только с одним протоном, с которого он начинался.

- Почему третий атом водорода не присоединяется к молекуле H 2 , образуя H 3 ?
- Когда два атома водорода делят свои электроны друг с другом, их внешние энергетические уровни заполнены.
Вы можете объяснить учащимся, что когда внешние энергетические уровни заполнены, обмена электронами с другим атомом не произойдет по двум основным причинам:
- Электрон из нового атома должен был бы присоединиться к атому в молекуле h3 на следующем энергетическом уровне, дальше от ядра, где он не чувствовал бы достаточно сильного притяжения.
- Электрон из атома, уже находящегося в молекуле H 2 и близкого к ядру, должен будет удалиться еще дальше, чтобы поделиться с новым атомом.
Обе эти возможности сделали бы молекулу менее стабильной и не произошли бы.

Обсудите процесс ковалентной связи в молекуле воды.
Проект анимации Ковалентная связь в воде.
Прежде чем нажать кнопку «воспроизведение», укажите на атом кислорода и два атома водорода.
Спросите студентов:
- Есть ли что-нибудь, что могло бы притягивать эти атомы друг к другу?
- Учащиеся должны предположить, что электроны каждого атома притягиваются к протонам других атомов.
Включите анимацию, чтобы показать притяжение между протонами кислорода для электрона от каждого из атомов водорода, притяжение протона от атомов водорода для электронов кислорода и сближение атомов.
Объясните, что атомы кислорода и водорода разделяют электроны, образуя ковалентную связь. Эти связи удерживают атомы кислорода и водорода вместе и образуют молекулу h3O. Причина, по которой атомы способны связываться, заключается в том, что притяжение достаточно сильно в обоих направлениях и на внешнем энергетическом уровне атомов есть место для электронов.

Электрон от каждого атома водорода и электроны от атома кислорода почти больше протонов, когда атомы связаны вместе как молекула, чем когда они разделены как отдельные атомы. Это делает молекулу связанных атомов кислорода и водорода более стабильной, чем отдельные отдельные атомы.
Объясните учащимся, что два электрона в связи между атомом водорода и атомом кислорода можно рассматривать как «принадлежащие» каждому атому. Это дает каждому атому водорода два электрона на его внешнем энергетическом уровне, который заполнен. Он также отдает кислороду 8 электронов на внешнем энергетическом уровне, который также заполнен.
Спроецируйте изображение Ковалентная связь в воде.
Вместе с учащимися повторите процесс ковалентной связи, показанный в анимации.
Предложите учащимся описать ковалентную связь в молекуле воды на листе с заданиями.
Предложите учащимся написать короткую подпись рядом с каждой картинкой, описывающую процесс образования ковалентной связи в молекуле воды.

- Два атома водорода и один атом кислорода находятся рядом друг с другом.
- Когда два атома водорода подходят достаточно близко к атому кислорода, их электроны притягиваются к протону другого атома.
- Поскольку существует достаточно сильное притяжение между атомами и место для электронов на внешних энергетических уровнях атомов, они делят электроны. Это образует ковалентную связь.
Примечание. Эта модель ковалентной связи молекулы воды начинается с 2 отдельных атомов водорода и 1 атома кислорода. На самом деле эти атомы никогда не бывают отдельными. Они всегда связаны с чем-то другим. Для упрощения процесса в этой модели не показаны атомы водорода и кислорода, разрывающие свои связи с другими атомами. Он фокусируется только на процессе образования ковалентных связей для образования воды.
Спросите студентов:
- Почему третий атом водорода не может присоединиться к молекуле воды (H 2 0), чтобы получить H 3 O?
- Когда два атома водорода и атом кислорода делят друг с другом свои электроны, их внешние энергетические уровни заполнены.

Предложите учащимся использовать электричество для разрыва ковалентных связей в молекулах воды.
Скажите учащимся, что электрическая энергия может быть использована для разрыва ковалентных связей в молекулах воды с образованием атомов водорода и атомов кислорода. Затем два атома водорода связываются с образованием газообразного водорода (H 2 ), а два атома кислорода связываются с образованием газообразного кислорода (O 2 ).
Вы можете выполнить это упражнение в качестве демонстрации или показать видео «Электролиз».
Вопрос для расследования
Что образуется при разрыве ковалентной связи в молекулах воды?
Материалы для каждой группы
- 9-вольтовая батарея
- 2 провода с зажимами типа «крокодил» на обоих концах
- 2 карандаша, заточенных с обоих концов
- Вода
- Соль Эпсома (сульфат магния)
- Прозрачный пластиковый стаканчик
- Лента
Процедура
- Поместите батарейку между двумя карандашами.
 Убедитесь, что батарея поднята более чем наполовину.
Убедитесь, что батарея поднята более чем наполовину. С помощью напарника обмотайте карандаши и батарейку лентой, как показано на рисунке.
- Налейте воду в прозрачный пластиковый стакан, пока он не наполнится примерно на ½.
- Добавьте в воду примерно ½ чайной ложки английской соли и перемешайте, пока соль не растворится.
- Подсоедините один зажим типа «крокодил» к одной клемме аккумулятора.
- Используя другой провод, соедините один зажим типа «крокодил» с другой клеммой аккумулятора.
- Подсоедините один конец грифеля карандаша к зажиму типа «крокодил» на конце одного из проводов.
- Используя другой провод, соедините один конец другого грифеля карандаша с зажимом типа «крокодил» на конце провода.
- Поместите концы карандаша в воду, как показано на рисунке.
Ожидаемые результаты
Пузыри сначала образуются и поднимаются из одного грифеля карандаша. Вскоре пузыри сформируются и поднимутся из другого.
 Учащиеся должны увидеть, что одного газа больше, чем другого. Газ, который образует маленькие пузырьки, которые отрываются первыми, — это водород. Другой газ, который образует более крупные пузыри и немного отстает, — это кислород.
Учащиеся должны увидеть, что одного газа больше, чем другого. Газ, который образует маленькие пузырьки, которые отрываются первыми, — это водород. Другой газ, который образует более крупные пузыри и немного отстает, — это кислород.Примечание. При образовании газообразного водорода и кислорода на стержнях карандаша будут появляться пузырьки. Убедитесь, что у учащихся не сложилось неправильное представление о том, что пузыри, которые они видят, означают, что вода кипит. При кипячении связи, удерживающие атомы вместе в молекулах воды, не разрываются. В процессе электролиза связи, удерживающие атомы вместе, разрываются.
Обсудите наблюдения учащихся.
Спросите студентов:
- Из чего сделаны пузыри в игре?
- Газообразный водород (H 2 ) и газообразный кислород (O 2 )
- Почему было произведено больше газообразного водорода, чем газообразного кислорода?
- Каждая молекула воды распадается на 2 атома водорода и 1 атом кислорода.
 Затем два атома водорода связываются с образованием газообразного водорода (H 2 ), а два атома кислорода связываются с образованием газообразного кислорода (O 2 ). Каждая молекула воды содержит все атомы, необходимые для образования 1 молекулы газообразного водорода. Но имея всего 1 атом кислорода, молекула воды содержит только половину того, что необходимо для образования 1 молекулы газообразного кислорода. Таким образом, 2 молекулы воды производят 2 молекулы газообразного водорода, но только 1 молекулу газообразного кислорода.
Затем два атома водорода связываются с образованием газообразного водорода (H 2 ), а два атома кислорода связываются с образованием газообразного кислорода (O 2 ). Каждая молекула воды содержит все атомы, необходимые для образования 1 молекулы газообразного водорода. Но имея всего 1 атом кислорода, молекула воды содержит только половину того, что необходимо для образования 1 молекулы газообразного кислорода. Таким образом, 2 молекулы воды производят 2 молекулы газообразного водорода, но только 1 молекулу газообразного кислорода.
Помогите учащимся понять, как атомы соединяются, образуя молекулы кислорода, метана и углекислого газа.
Напомните учащимся, что на этом уроке они рассматривали ковалентные связи в молекулах водорода и в молекулах воды. Скажите им, что они рассмотрят ковалентные связи в трех других обычных веществах.
Проецируйте анимацию «Двойная связь кислорода».
Объясните учащимся, что молекулы кислорода, присутствующие в нашем воздухе, состоят из 2 атомов кислорода.
 Эта анимация покажет им, на что похожа ковалентная связь между двумя атомами кислорода. Расскажите анимацию, отметив, что каждый атом кислорода имеет 6 валентных электронов. Когда атомы кислорода сближаются, притяжение ядер обоих атомов притягивает внешние электроны. В этом случае 2 электрона от каждого атома являются общими. Это называется двойной связью.
Эта анимация покажет им, на что похожа ковалентная связь между двумя атомами кислорода. Расскажите анимацию, отметив, что каждый атом кислорода имеет 6 валентных электронов. Когда атомы кислорода сближаются, притяжение ядер обоих атомов притягивает внешние электроны. В этом случае 2 электрона от каждого атома являются общими. Это называется двойной связью.- Каждый атом кислорода имеет 6 валентных электронов на внешнем энергетическом уровне
- Когда два атома кислорода приближаются друг к другу, притяжение ядер обоих атомов притягивает внешние электроны.
- В этом случае два электрона от каждого атома являются общими. Это называется двойной связью.
Спроецируйте изображение Двойная связь кислорода II.
Спроектируйте фотографии до и после Ковалентная связь метана.
Спросите студентов:
- Кратко опишите процесс ковалентной связи между углеродом и четырьмя атомами водорода для образования молекулы метана.
 Обязательно укажите притяжение между электронами и протонами и количество электронов на внешнем энергетическом уровне для атомов в конечной молекуле.
Обязательно укажите притяжение между электронами и протонами и количество электронов на внешнем энергетическом уровне для атомов в конечной молекуле. - Убедитесь, что учащиеся понимают, что протоны каждого атома притягивают электроны других атомов, что сближает атомы. Атомы продолжают связываться с другими атомами, пока их внешние энергетические уровни не будут заполнены.
Спроектируйте изображения до и после Ковалентная связь углекислого газа.
Спросите студентов:
- Кратко опишите процесс ковалентной связи между углеродом и двумя атомами кислорода для образования молекулы углекислого газа. Обязательно укажите притяжение между электронами и протонами и количество электронов на внешнем энергетическом уровне для атомов в конечной молекуле.
- Убедитесь, что учащиеся понимают, что протоны каждого атома притягивают электроны других атомов, что сближает атомы. Атомы продолжают связываться с другими атомами, пока их внешние энергетические уровни не будут заполнены.

Объяснение урока: Уровни энергии электронов
В этом объяснении мы узнаем, как определить, является ли электронная оболочка заполнен ли атом и какие электронные переходы возможны в данном атоме.
Атом состоит из трех различных типов частиц: протонов, нейтронов, и электроны. Нейтроны и протоны вместе составляют ядро, а электроны находятся вне его. На приведенной ниже схеме показан атом.
Розовая точка на этой диаграмме представляет собой ядро в целом, а синяя точки вокруг него — электроны. Эта диаграмма и все последующие диаграммы не в масштабе: электроны намного меньше атомных ядер, а расстояние между ними больше, чем поместилось бы на странице.
Для простоты эти схемы электрически нейтральны, если только
в противном случае указано. Это означает, что на каждый электрон приходится протон, поэтому
Вы сможете определить, к какому элементу относится атом, сравнив
электронов к атомному номеру.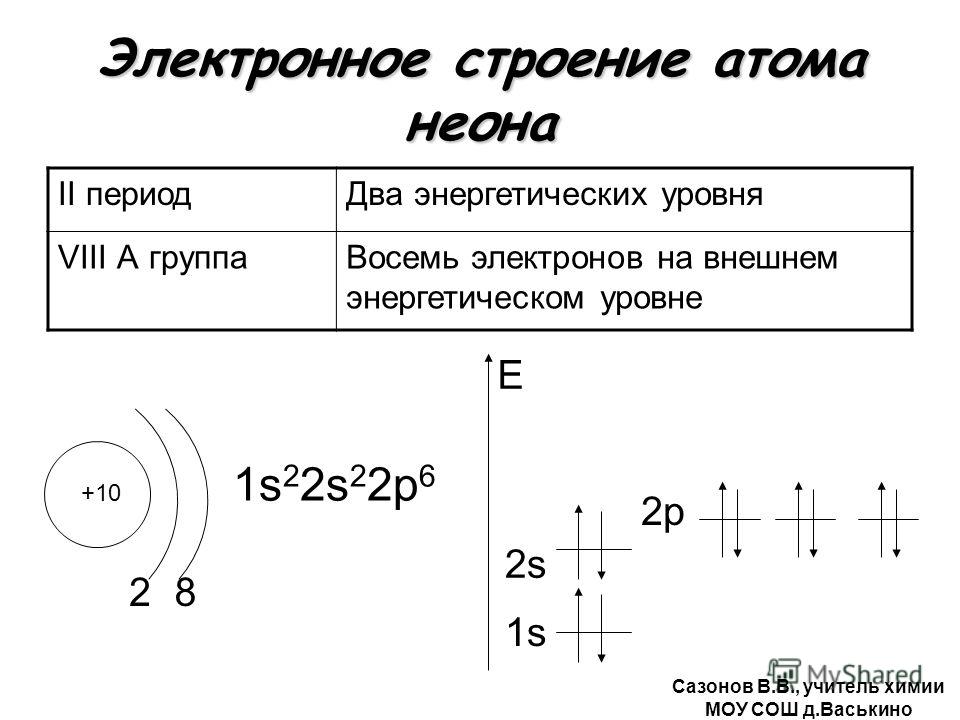 Например, на приведенной выше диаграмме 2 электрона,
так что это элемент с атомным номером 2, гелий.
Например, на приведенной выше диаграмме 2 электрона,
так что это элемент с атомным номером 2, гелий.
Давайте рассмотрим пример.
Пример 1. Определение элемента путем подсчета электронов в электрически Нейтральный атом
На схеме показаны электроны в различных электронных оболочках атома. Атом электрически нейтральным. Атом какого элемента это?
Ответ
Этот атом электрически нейтрален, а это означает, что на каждый электрон приходится является протоном. Есть 3 электрона, значит, в атоме 3 протона, поэтому элемент имеет атомный номер 3,
Глядя на периодическую таблицу, литий имеет атомный номер 3.
Итак, этот атом и есть литий.
Если бы вместо того, чтобы быть электрически нейтральным, атом в приведенном выше примере имел бы
заряд -1, то это будет означать, что у него на один электрон больше, чем у него
протоны. Поскольку есть три электрона, это означает, что у него будет два протона,
вместо этого сделать его гелием.
На этих диаграммах видно, что электроны находятся в кольце вокруг ядра. Эти кольца на самом деле очень специфичны и показывают, на какой оболочке находятся электроны. находятся внутри. Каждая оболочка, также называемая энергетическим уровнем, может обрабатывать только определенный количество электронов, прежде чем им придется переместиться во внешнюю оболочку, как показано на таблицу ниже.
| Shell/Energy Level | Electrons |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
Electron оболочки также называют электронными энергетическими уровнями, потому что энергия электроны внутри них меняются от оболочки к оболочке. Электроны в самые внутренние оболочки наименее энергичны, а те, что находятся во внешних оболочках являются наиболее энергичными.
Давайте рассмотрим пример.
Пример 2: Количество электронов в различных электронных оболочках
На диаграмме показаны электроны в различных электронных оболочках атома. Все из первые четыре электронные оболочки в атоме заполнены.
- Какая из электронных оболочек содержит больше всего электронов?
- Какая из электронных оболочек содержит наименьшее количество электронов?
Ответ
Часть 1
Номер оболочки говорит нам, насколько близка оболочка к ядру. Оболочка 1 — ближайшая, а оболочка 4 — самая дальняя. Мы можем считать человека электронов, чтобы определить их количество, но мы также можем видеть, что как оболочки выходят больше, количество электронов в каждой увеличивается также.
Самое внутреннее кольцо, оболочка 1, содержит 2 электрона. Следующий, оболочка 2, содержит 8; оболочка 3 имеет 18; а оболочка 4 имеет 32.
Электронная оболочка, содержащая наибольшее количество электронов, называется оболочкой 4.
Часть 2
Электронная оболочка, содержащая наименьшее количество электронов, является ближайшей к ядро, оболочка 1.
Обычно электроны занимают самый низкий энергетический уровень, аккуратно заполняя оболочки от самого внутреннего наружу. Когда все электроны атома заполнили самые низкие возможные энергетические уровни, мы говорим, что атом находится в основном состоянии.
Можно временно сделать определенные электроны более высокой энергией уровень, подвергая их воздействию света. Когда электроны находятся на более высоком энергетическом уровне чем в основном состоянии, мы говорим, что они находятся в возбужденном состоянии. Это означает что электрон может оказаться на более высокой оболочке раньше, чем на более низкой энергетический уровень заполнен полностью. На приведенной ниже диаграмме показан нейтральный атом гелия как в основном, так и в возбужденном состоянии.
Давайте рассмотрим пример.
Пример 3: Электроны в возбужденном состоянии вокруг атома неона
На схеме показан электрически нейтральный атом неона. Сколько электронов в атоме находятся в возбужденном состоянии?
Ответ
Начнем с подсчета общего числа электронов и рассмотрения того, как многие будут в основном состоянии. На первом энергетическом уровне их 2, 6 во втором и 2 в третьем. Всего 10 электронов.
Чтобы быть в основном состоянии, 10 электронов должны сначала заполнить самое внутреннее оболочка, которая может содержать 2. Таким образом, у нас осталось 8 электронов.
Восьмерка полностью заполнит второй энергетический уровень, поэтому в основном состоянии в 3-й оболочке не должно быть электронов. Мы видим, что их 2 хотя там, поэтому эти 2 электрона в 3-й оболочке должны быть возбуждены.
В возбужденных состояниях находятся 2 электрона с третьей энергией уровень.
Когда нет возбужденных электронов, внутренние уровни энергии заполняются до
крайний. Это означает, что прежде чем вторая оболочка начнет заполняться, она
должна иметь полную первую оболочку.
Это означает, что прежде чем вторая оболочка начнет заполняться, она
должна иметь полную первую оболочку.
Оболочки не заполнены, если они не содержат максимальное количество электронов допускается в их оболочке. Это означает, что если на 1-й оболочке только 1 электрон, он не заполнен, так как может вместить максимум 2.
Давайте рассмотрим пример.
Пример 4: Заполнение электронных оболочек
На схеме показаны электроны в различных электронных оболочках атома. внешняя оболочка незаполнена. Сколько еще электронов может иметь атом в своем самая внешняя оболочка?
Ответ
Когда в вопросе говорится о самой внешней оболочке, имеется в виду только самая внешняя оболочка в котором в настоящее время есть электроны. Это означает, что мы не стремимся заполнить третья или четвертая оболочка.
Мы знаем, что первая оболочка может вместить 2, а вторая — 8. Глядя на эту диаграмму, первая оболочка заполнена, а вторая —
содержит всего 7 электронов. Он может поместиться ровно на 1 электрон больше, чем
становится полным.
Он может поместиться ровно на 1 электрон больше, чем
становится полным.
Ответ: 1 электрон.
Чтобы возбудиться, электрон может поглотить фотон, который является частица света. Энергия фотона передается электрону, заставляя его перейти на другой энергетический уровень. Фотоны более высокой энергии осуществить переход электрона на более высокие энергетические уровни.
Для перехода между двумя определенными энергетическими уровнями энергия фотона должно быть равно разности энергий между энергетическими уровнями. На приведенной ниже диаграмме показан фотон с энергией, равной разнице между 1-й и 3-й энергетические уровни поглощаются электроном.
Поглощение фотона приводит к переходу электрона с 1-й энергии
уровень до 3-го. Однако электроны не могут долго находиться в возбужденном состоянии,
и они распадаются обратно в основное состояние по прошествии некоторого времени, как видно на
диаграмма ниже.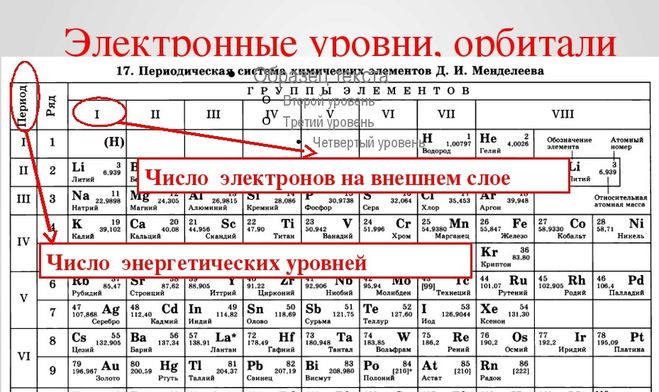
Фотон испускается при переходе электрона с третьей энергии уровень обратно на первый энергетический уровень. Энергия этого фотона, листьев почти идентичен фотону, который первым их возбудил.
Давайте рассмотрим несколько примеров.
Пример 5. Переход электрона в атоме водорода
На схеме показан атом водорода. Электрон показывает переходы между двумя энергетические уровни атома.
- На каком энергетическом уровне изначально находится электрон?
- На какой энергетический уровень переходит электрон?
Ответ
Часть 1
Энергетические уровни отсчитываются изнутри наружу. Мы видим, что электрон изначально на самом внешнем уровне, четвертом кольце от центра.
Изначально электрон находится на четвертом энергетическом уровне.
Часть 2
Энергетический уровень, на который переходит электрон, указан стрелкой
и указывает на второе кольцо от центра.
Электрон переходит на второй энергетический уровень.
Пример 6: Определение наибольшей энергии фотона при электронном переходе
На каждой из следующих диаграмм показан атом водорода, который изначально находится в возбужденное состояние. В каждом случае электрон переходит с более высокого энергетического уровня на более низкий энергетический уровень, испуская фотон. В каком случае энергия испускаемый фотон самый большой?
Ответ
Электроны на более высоких энергетических уровнях имеют более высокую энергию, чем электроны на более низких энергетические уровни. Когда электрон переходит в более низкое состояние, фотон излучается, энергия которого равна разности энергий между энергетические уровни, между которыми он перемещается.
Это означает, что переход с более высокого энергетического уровня в основное состояние
(например, от оболочки 3 к оболочке 1) приводит к фотону с более высокой энергией по сравнению с
к переходу из более низкого начального состояния (из 2 в 1).
В случае А мы видим фотон, испускаемый после перехода электрона с уровня энергии 3 на уровень энергии 1. Энергия фотона также показано его длиной волны: более короткие волны означают больше энергии.
В случае B мы видим фотон, испускаемый, когда электрон уходит из оболочки 2 в оболочку 1. Это производит длинноволновый фотон с более низкой энергией чем случай А, так что это не может быть этот случай.
В случае С электрон полностью переходит с энергетического уровня 4 до энергетического уровня 1, дальше всего он может идти. Испущенный фотон имеет короткая длина волны и более высокая энергия по сравнению со случаем А, который только увеличился с 3 до 1.
Таким образом, случай, когда испускаемый фотон имеет наибольшую энергию, равен C.
Электроны, которые возбуждаются и переходят на более высокие энергетические уровни, должны
по-прежнему подчиняются пределу того, сколько электронов может поместиться в конкретную оболочку.
Давайте рассмотрим пример.
Пример 7. Переход электрона в атоме с полными оболочками
На схеме показан электрически нейтральный атом. Если один из электронов в внутренняя оболочка должна была поглотить фотон и перейти в возбужденное состояние, которое из электронных оболочек, показанных на диаграмме, он мог двигаться?
Ответ
Возбужденный электрон способен перейти на любой более высокий неполный энергетический уровень, поэтому нам нужно выяснить, какие оболочки полны, а какие нет. Давайте вспомним Таблица, показывающая, сколько электронов разрешено на каждом энергетическом уровне.
| Shell/Energy Level | Electrons |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
Возбужденный электрон движется с самой внутренней оболочки,
который, как мы видим, имеет полные 2 электрона.


 58
58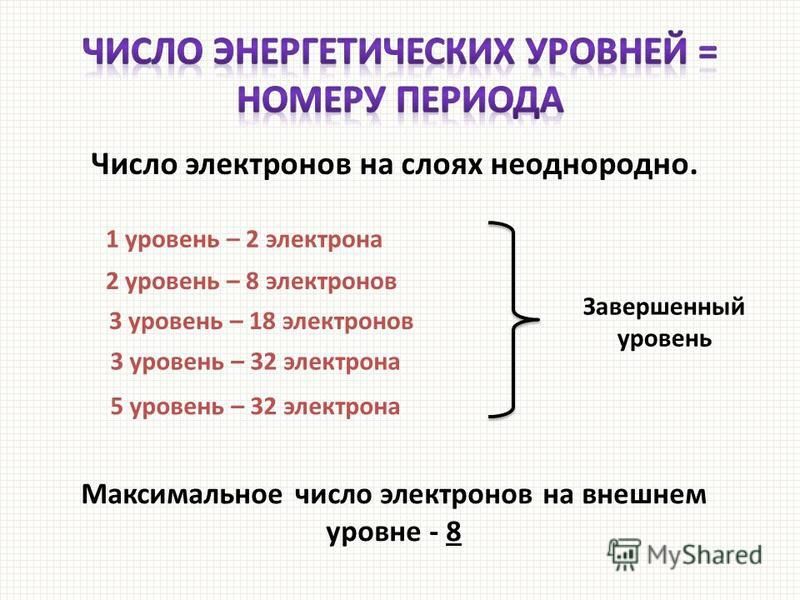








 Убедитесь, что батарея поднята более чем наполовину.
Убедитесь, что батарея поднята более чем наполовину.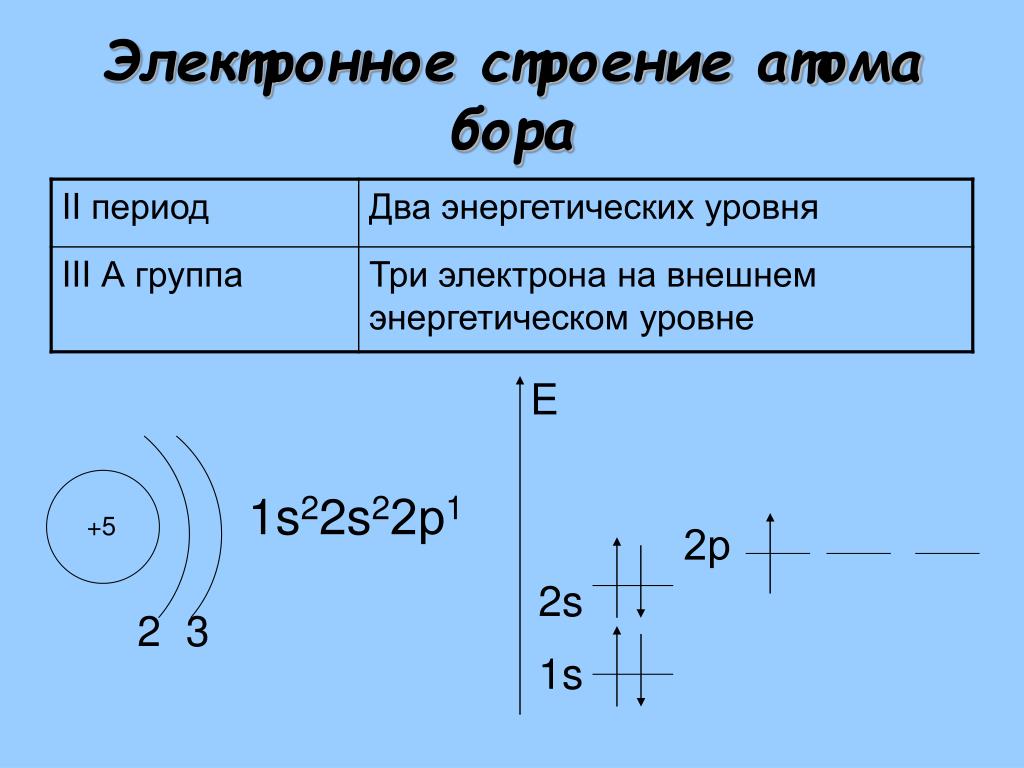 Учащиеся должны увидеть, что одного газа больше, чем другого. Газ, который образует маленькие пузырьки, которые отрываются первыми, — это водород. Другой газ, который образует более крупные пузыри и немного отстает, — это кислород.
Учащиеся должны увидеть, что одного газа больше, чем другого. Газ, который образует маленькие пузырьки, которые отрываются первыми, — это водород. Другой газ, который образует более крупные пузыри и немного отстает, — это кислород.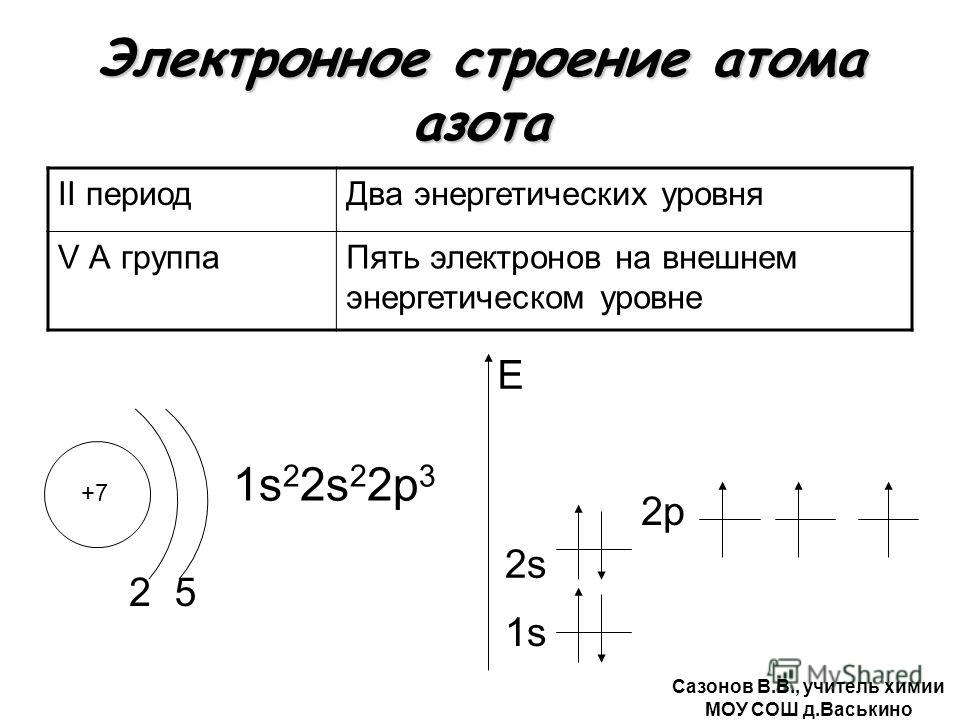 Затем два атома водорода связываются с образованием газообразного водорода (H 2 ), а два атома кислорода связываются с образованием газообразного кислорода (O 2 ). Каждая молекула воды содержит все атомы, необходимые для образования 1 молекулы газообразного водорода. Но имея всего 1 атом кислорода, молекула воды содержит только половину того, что необходимо для образования 1 молекулы газообразного кислорода. Таким образом, 2 молекулы воды производят 2 молекулы газообразного водорода, но только 1 молекулу газообразного кислорода.
Затем два атома водорода связываются с образованием газообразного водорода (H 2 ), а два атома кислорода связываются с образованием газообразного кислорода (O 2 ). Каждая молекула воды содержит все атомы, необходимые для образования 1 молекулы газообразного водорода. Но имея всего 1 атом кислорода, молекула воды содержит только половину того, что необходимо для образования 1 молекулы газообразного кислорода. Таким образом, 2 молекулы воды производят 2 молекулы газообразного водорода, но только 1 молекулу газообразного кислорода. Эта анимация покажет им, на что похожа ковалентная связь между двумя атомами кислорода. Расскажите анимацию, отметив, что каждый атом кислорода имеет 6 валентных электронов. Когда атомы кислорода сближаются, притяжение ядер обоих атомов притягивает внешние электроны. В этом случае 2 электрона от каждого атома являются общими. Это называется двойной связью.
Эта анимация покажет им, на что похожа ковалентная связь между двумя атомами кислорода. Расскажите анимацию, отметив, что каждый атом кислорода имеет 6 валентных электронов. Когда атомы кислорода сближаются, притяжение ядер обоих атомов притягивает внешние электроны. В этом случае 2 электрона от каждого атома являются общими. Это называется двойной связью.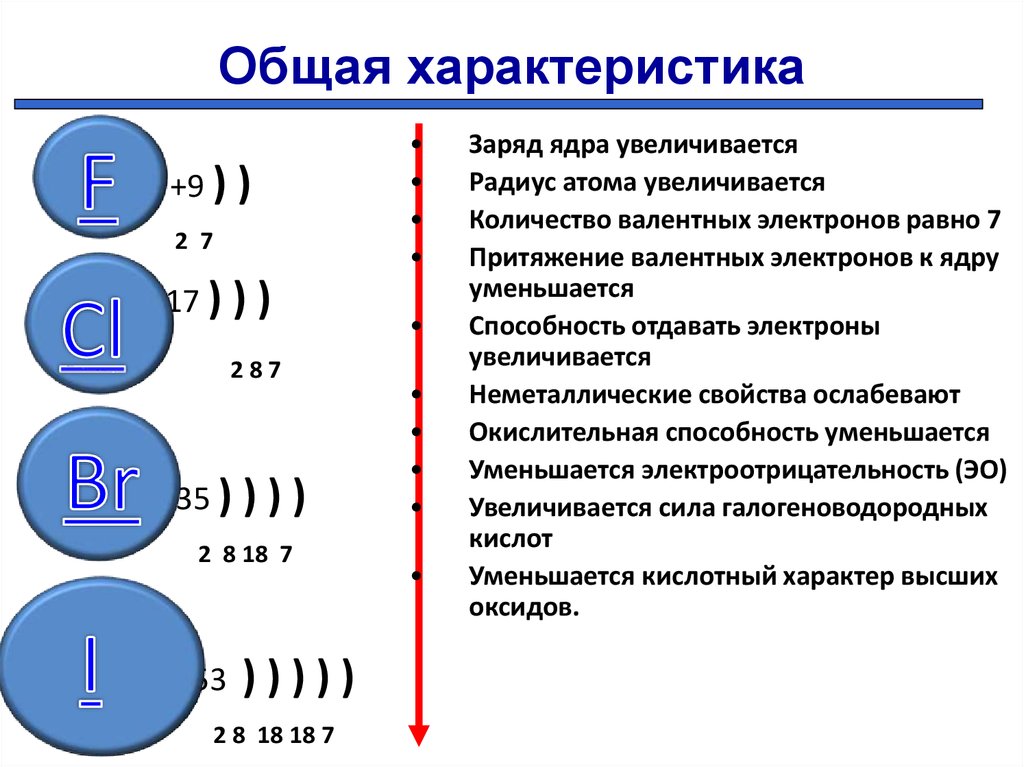 Обязательно укажите притяжение между электронами и протонами и количество электронов на внешнем энергетическом уровне для атомов в конечной молекуле.
Обязательно укажите притяжение между электронами и протонами и количество электронов на внешнем энергетическом уровне для атомов в конечной молекуле.