Смешать, но не взбалтывать
Для многих химия – это когда в колбах что-то кипит, дымит, взрывается, или, по меньшей мере, меняет цвет. Мы решили не разрушать это представление и показать несколько прекрасных видеозаписей, раскрывающих всю красоту химических реакций.
За основу для этой медитативной видеогалереи мы выбрали серию видео Beautiful Chemistry, снятых профессором Янь Ляном и его коллегами из Университета науки и технологии Китая. Кстати, эти видеоролики получили премию Experts Choice («Выбор экспертов») на конкурсе 2015 VIZZIES Visualization Challenge.
На первом видео пять классических реакций, сопровождающихся
выпадением осадка. Первая — это выпадение хлорида серебра при внесении капли
нитрата серебра в раствор обычной соли — реакция, позволяющая обнаружить в
растворах следы хлоридов (а также бромидов и иодидов).
Следующая видеозапись показывает эксперимент, известный как
«Неорганический сад». В раствор силиката натрия («жидкого стекла») бросают кристаллики
солей металлов.
Рост вытянутых столбов связан с тем, что плотность жидкости внутри оболочки может оказаться меньше плотности жидкого стекла — остальное делает сила Архимеда. Для реакции используют кристаллы хлоридов кальция, кобальта и железа, а также сульфатов цинка и кобальта.
Третий ролик посвящен реакциям вытеснения металлов из их
солей. Из-за того, что у разных металлов сильно отличаются свойства — например,
способность восстанавливать ионы водорода, — в некоторых ситуациях могут
протекать реакции, в которых один металл, более активный, вытесняет менее
активный металл из его соли.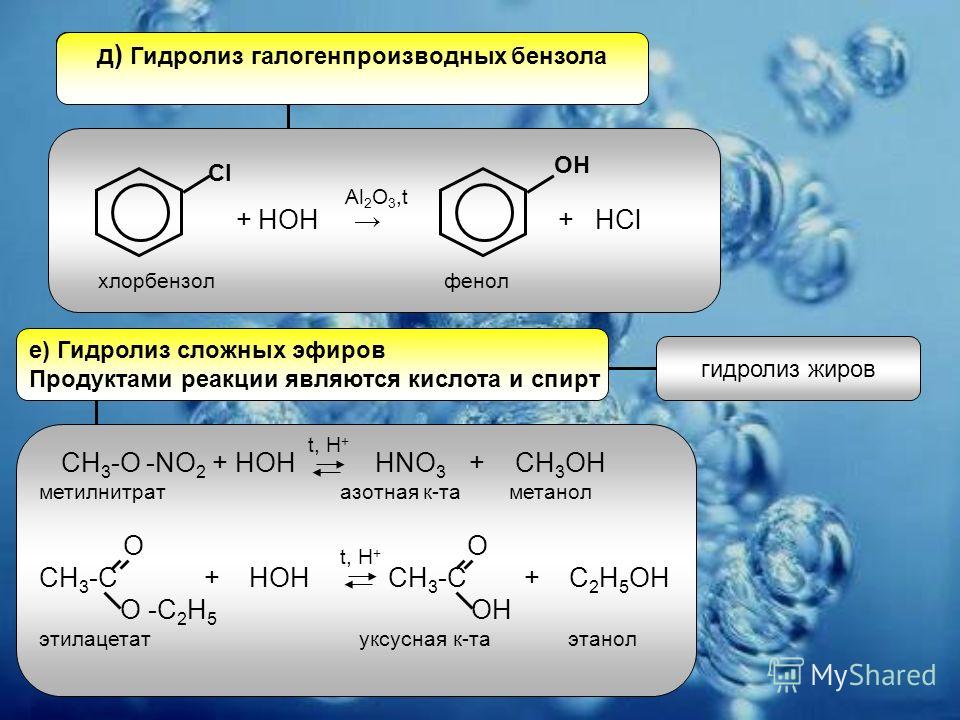
В четвертом видеоролике химики показывают крупным планом
реакции, сопровождающиеся выделением газов. Первая реакция — растворение цинка
в соляной кислоте, в результате которого образуются пузырьки водорода, а цинк
превращается в хлорид цинка. Следующая реакция — растворение магния в уксусной
кислоте с тем же результатом (образуется ацетат магния). Третья реакция — растворение в соляной кислоте карбоната
кальция (содержащегося в яичной скорлупе). В результате реакции выделяется
углекислый газ. Если довести реакцию до конца, то яйцо станет мягким и будет
прогибаться при прикосновении. Ту же процедуру можно повторить и в крепком уксусе.
В этом видео химики капают растворы кислот и щелочей на растения. Многие цветы, ягоды (и не только) содержат в себе индикаторы — вещества, меняющие свою структуру и окраску в кислых или щелочных средах. Здесь для опытов использовали краснокочанную капусту и цветок из семейства Линдерниевых —
Шестое видео, строго говоря, не показывает химических
реакций. Оно посвящено кристаллизации — переходу солей из растворов в твердую
форму. Тем не менее, каждый химик сталкивается с этим явлением, например,
занимаясь очисткой веществ. Для того, чтобы вырастить небольшие кристаллы
необходимо растворить соль в большом количестве горячей воды, удалить не растворившийся
осадок (например, слив с него чистый раствор) и оставить жидкость остывать. Чем
медленнее жидкость остывает (или испаряется), тем больше шансов получить большой
кристалл.
Для того, чтобы вырастить небольшие кристаллы
необходимо растворить соль в большом количестве горячей воды, удалить не растворившийся
осадок (например, слив с него чистый раствор) и оставить жидкость остывать. Чем
медленнее жидкость остывает (или испаряется), тем больше шансов получить большой
кристалл.
На видео показано как кристаллизуются медный купорос, тиосульфат натрия, трисоксалат железа калия и ацетат натрия. Последний еще используется в известном опыте «горячий лед», в котором перенасыщенный раствор соли почти полностью затвердевает от прикосновения или падения одного маленького кристалла.
На следующем видео авторы показали «танцующие капли», сделанные
из флуоресцирующих палочек. Химики смешали жидкости, запускающие интенсивное
свечение смеси — обычно это комбинация дифенилоксалата, перекиси и красителя. Затем
они поместили смесь в раствор щелочи. Из-за того, что светящаяся основа растворена
в маслянистом веществе, капли не растворились в щелочи. На границах капель происходит химическая реакция, заставляющая их двигаться.
Из-за того, что светящаяся основа растворена
в маслянистом веществе, капли не растворились в щелочи. На границах капель происходит химическая реакция, заставляющая их двигаться.
Последний видеоролик посвящен дыму. Если первая его часть — обычное горение свечи и ароматических палочек, то затем химики показывают как дым может возникнуть без огня. Следует отметить, что дым это аэрозоль, взвесь твердых частиц в воздухе. Последняя реакция — взаимодействие газообразного аммиака с парами соляной кислоты. В результате реакции образуются крошечные кристаллы хлорида аммония, которые и кажутся похожими на дым. Как шутят авторы — все три типа дыма пахнут совершенно-по разному. Например, ароматические палочки пахнут довольно приятно, а хлорид аммония нюхать явно не стоило.
Сайт проекта Beautiful Chemistry давно не пополнялся новыми видео.
Владимир Королёв
1 задание ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 2 балла. {2+} = Zn(OH)_2$
{2+} = Zn(OH)_2$
Ответ:
Показать решение
Полный курс
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк — это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить уведомления.
Включить уведомления
Готовим к ЕГЭ на 85+ баллов и побеждаем лень
Каждый месяц 12 онлайн-занятий в дружелюбной атмосфере + 16 домашних работ с жесткими сроками.
Не готовишься — вылетаешь. Подробнее о курсе
ОФС.1.3.0002.15 Титрованные растворы | Фармакопея.рф
Содержимое (Table of Contents)
- 1 ОФС.1.3.0002.15 Титрованные растворы
- 1.1 Исходные стандартные вещества для титрованных растворов
- 1.
 1.1 Калия бромат РО
1.1 Калия бромат РО - 1.1.2 Калия гидрофталат РО
- 1.1.3 Калия дихромат РО
- 1.1.4 Кислота бензойная РО
- 1.1.5 Мышьяка оксид РО
- 1.1.6 Натрия карбонат безводный РО
- 1.1.7 Натрия хлорид РО
- 1.1.8 Сульфаниловая кислота РО
- 1.1.9 Цинк РО
- 1.
- 1.2 Титрованные растворы
- 1.2.1 1 М раствор азотной кислоты
- 1.2.2 0,1 М раствор аммония тиоцианата
- 1.2.3 0,01 М раствор аммония тиоцианата
- 1.2.4 0,1 М раствор аммония церия нитрата
- 1.2.5 0,01 М раствор аммония церия нитрата
- 1.2.6 0,1 М раствор аммония церия сульфата
- 1.2.7 0,01 М раствор аммония церия сульфата
- 1.2.8 0,05 М раствор бария перхлората
- 1.2.9 0,025 М раствор бария перхлората
- 1.2.10 0,1 М раствор бария хлорида
- 1.2.11 0,004 М раствор бензэтония хлорида
- 1.2.12 0,0167 М (0,1 н.) раствор бромид-бромата
- 1.2.13 0,1 М раствор железа(III) аммония сульфата
- 1.2.14 0,1 М раствор железа(II) сульфата
- 1.
 2.15 0,5 М (1 н.) раствор йода
2.15 0,5 М (1 н.) раствор йода - 1.2.16 0,1 М (0,2 н.) раствор йода
- 1.2.17 0,05 М (0,1 н.) раствор йода
- 1.2.18 0,01 М (0,02 н.) раствор йода
- 1.2.19 0,1 М раствор йода монохлорида (для определения йодного числа)
- 1.2.20 0,033 М (0,2 н.) раствор калия бромата
- 1.2.21 0,02 М (0,12 н.) раствор калия бромата
- 1.2.22 0,0167 М (0,1 н.) раствор калия бромата
- 1.2.23 0,0083 М (0,05 н.) раствор калия бромата
- 1.2.24 1 М раствор калия гидроксида
- 1.2.25 0,1 М раствор калия гидроксида
- 1.2.26 0,5 М раствор калия гидроксида в спирте 60 % (об/об)
- 1.2.27 0,5 М раствор калия гидроксида спиртовой
- 1.2.28 0,1 М раствор калия гидроксида спиртовой
- 1.2.29 0,01 М раствор калия гидроксида спиртовой
- 1.2.30 0,1 М раствор калия гидрофталата
- 1.2.31 0,0167 М (0,1 н.) раствор калия дихромата
- 1.2.32 0,05 М раствор калия йодата
- 1.2.33 0,0167 М (0,1 н.) раствор калия йодата
- 1.2.
 34 0,001 М раствор калия йодида
34 0,001 М раствор калия йодида - 1.2.35 0,02 М раствор калия перманганата
- 1.2.36 0,1 М раствор лития метоксида
- 1.2.37 0,05 М раствор магния сульфата
- 1.2.38 0,1 М раствор магния хлорида
- 1.2.39 0,02 М раствор меди сульфата
- 1.2.40 0,1 М раствор натрия арсенита
- 1.2.41 0,025 М раствор натрия арсенита
- 1.2.42 0,001 М раствор натрия додецилсульфата
- 1.2.43 1 М раствор натрия гидроксида
- 1.2.44 0,5 М раствор натрия гидроксида
- 1.2.45 0,1 М раствор натрия гидроксида
- 1.2.46 0,05 М раствор натрия гидроксида
- 1.2.47 0,02 М раствор натрия гидроксида
- 1.2.48 0,01 М раствор натрия гидроксида
- 1.2.49 0,1 М раствор натрия гидроксида этанольный
- 1.2.50 0,1 М раствор натрия гидроксида в смеси метанола и бензола
- 1.2.51 0,1 М раствор натрия метоксида
- 1.2.52 0,1 М раствор натрия нитрита
- 1.2.53 0,1 М раствор натрия перйодата
- 1.2.54 0,1 М раствор натрия тиосульфата
- 1.
 2.55 0,005 М раствор натрия тиосульфата
2.55 0,005 М раствор натрия тиосульфата - 1.2.56 0,1 М раствор натрия эдетата
- 1.2.57 0,05 М раствор натрия эдетата
- 1.2.58 0,02 М раствор натрия эдетата
- 1.2.59 0,05 М (0,1 н.) раствор ртути(II) нитрата
- 1.2.60 0,1 М раствор серебра нитрата
- 1.2.61 0,01 М раствор серебра нитрата
- 1.2.62 0,001 М раствор серебра нитрата
- 1.2.63 0,5 М (1 н.) раствор серной кислоты
- 1.2.64 0,05 М (0,1 н.) раствор серной кислоты
- 1.2.65 0,1 М раствор свинца(II) нитрата
- 1.2.66 0,05 М раствор свинца(II) нитрата
- 1.2.67 0,1 М раствор тетрабутиламмония гидроксида
- 1.2.68 0,1 М раствор тетрабутиламмония гидроксида в 2-пропаноле
- 1.2.69 0,01 М раствор тетрабутиламмония йодида
- 1.2.70 0,1 М раствор тетраэтиламмония гидроксида
- 1.2.71 1 М раствор хлористоводородной кислоты
- 1.2.72 0,5 М раствор хлористоводородной кислоты
- 1.2.73 0,1 М раствор хлористоводородной кислоты
- 1.2.74 0,01 М раствор хлористоводородной кислоты
- 1.
 2.75 0,1 М раствор хлористоводородной кислоты спиртовой
2.75 0,1 М раствор хлористоводородной кислоты спиртовой - 1.2.76 0,1 М раствор хлорной кислоты
- 1.2.77 0,05 М раствор хлорной кислоты
- 1.2.78 0,1 М раствор хлорной кислоты в метаноле
- 1.2.79 0,1 М раствор хлорной кислоты в нитрометане
- 1.2.80 0,1 М раствор уксусной кислоты
- 1.2.81 0,1 М раствор церия(IV) сульфата
- 1.2.82 0,05 М раствор цинка хлорида
- 1.2.83 0,1 М раствор цинка сульфата
- 1.2.84 Поделиться ссылкой:
- 1.1 Исходные стандартные вещества для титрованных растворов
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Титрованные растворы ОФС.1.3.0002.15
Взамен ГФ XII, 1ч., ОФС 42-0071-07
Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
Концентрация титрованного раствора (титранта) обычно выражается его молярной концентрацией, титром или титром по определяемому веществу.
Молярная концентрация (молярность) – это выраженное в молях количество растворённого вещества, содержащееся в 1 л раствора. Молярность вычисляется как отношение количества растворенного вещества к объему раствора:
СМ = М/V ,
где
СМ – молярная концентрация, моль/л;
М — количество растворённого вещества, моль;
V — общий объём раствора, л.
Раствор, содержащий x моль вещества в 1 л раствора, обозначают x М раствором.
Титр – это выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора (размерность – мг/мл).
Титр титранта по определяемому веществу – это выраженная в миллиграммах масса определяемого вещества, эквивалентная 1 мл данного титранта. Титр титранта по определяемому веществу вычисляют, исходя из молярной концентрации или титра титранта с учётом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ (размерность – мг/мл).
Иногда концентрацию раствора выражают числом грамм-эквивалентов вещества в 1 л раствора. Такие растворы называются нормальными и обозначаются символом «н.». Грамм-эквивалентом называется число граммов вещества, равное его эквиваленту. Эквивалент вещества – это такое количество вещества, которое может присоединять, высвобождать или другим способом быть эквивалентным катиону водорода в кислотно-основных (ионообменных) реакциях или электрону в окислительно-восстановительных реакциях. Величина эквивалентной массы вещества определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции, протекающей между определяемым веществом и титрованным раствором.
Для приготовления титрованных растворов применяют химически чистые вещества или промышленного производства стандарт-титры для титриметрии. Допускается приготовление титрованного раствора несколько большей концентрации, чем требуется по расчету, который при необходимости можно довести до нужной концентрации путем разбавления.
Для приготовления титрованных растворов используют мерные ёмкости исключительно класса А.
Приготовленные титрованные растворы стандартизуют двумя способами: по стандартному титрованному раствору или по точной навеске соответствующего стандартного образца. Перед стандартизацией титрованный раствор необходимо тщательно перемешать. Концентрацию титрованных растворов определяют путем достаточного количества титрований (не менее трех).
При ручном титровании используют бюретки с ценой деления в пределах 0,01 – 0,05 мл.
Если титрованный раствор используют в количественном анализе, в котором конечную точку титрования определяют электрометрическим методом (например, методом амперометрии или потенциометрии), раствор стандартизуют тем же методом. Состав среды, в которой стандартизуют титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
Для определения точной концентрация приготовленного титрованного раствора вычисляют поправочный коэффициент (К), представляющий собой отношение фактически полученной концентрации титрованного раствора к теоретически заданной. Поправочный коэффициент рассчитывают с точностью до четвёртого знака после запятой.
Поправочный коэффициент рассчитывают с точностью до четвёртого знака после запятой.
Вычисление поправочного коэффициента производят одним из указанных ниже способов.
Способ 1 – по навеске соответствующего стандартного образца:
где
а – навеска вещества, по которому устанавливают титр, мг;
Т – количество вещества, по которому устанавливается титр, соответствующее 1 мл раствора заданной молярной концентрации (титр титранта по определяемому веществу), мг/мл;
V – объем приготовленного раствора, израсходованный на титрование, мл.
Способ 2 – по титрованному раствору известной концентрации:
где
V0 – объем титрованного раствора, по которому устанавливается титр, мл;
V – объем приготовленного титрованного раствора, израсходованный на титрование, мл;
K0 – поправочный коэффициент титрованного раствора, по которому устанавливается титр.
Коэффициент К должен находиться в пределах от 0,98 до 1,02. Если коэффициент К отличается от указанных пределов (более чем на ± 2 %), то раствор следует разбавить или укрепить на основании следующего расчета.
Если коэффициент К отличается от указанных пределов (более чем на ± 2 %), то раствор следует разбавить или укрепить на основании следующего расчета.
В случае разбавления раствора из величины К вычитают единицу и полученную разность умножают на 1000. Результат умножения соответствует количеству воды в миллилитрах, которое следует прибавить к каждому литру разбавляемого раствора. В случае укрепления из единицы вычитают коэффициент К и разность умножают на количество граммов исходного вещества, взятое для приготовления 1 л раствора. Полученное количество добавляют на каждый литр раствора. После этого раствор тщательно перемешивают.
Относительное стандартное отклонение при определении коэффициента К не должно превышать 0,2 %.
Титрованные растворы меньшей молярной концентрации можно приготовить посредством точного разведения более концентрированных титрованных растворов водой, свободной от углерода диоксида. Поправочные коэффициенты полученных разбавленных растворов такие же, как у исходных растворов. Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Исключение составляют титрованные растворы для окислительно-восстановительного титрования, которые после разбавления нуждаются в повторной установке титра. Методика установки титра должна быть приведена в фармакопейной статье.
Растворы с молярной концентрацией ниже 0,1 М готовят непосредственно перед использованием.
Так как при хранении концентрация титрованного раствора может изменяться, необходимо перепроверять поправочные коэффициенты титрованных растворов в соответствии с установленными для них сроками хранения.
Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
Титрованные растворы хранят при комнатной температуре, защищая их, при необходимости, от воздействия углерода диоксида, влаги воздуха и прямых солнечных лучей.
Рекомендуется готовить, стандартизовать и использовать титрованные растворы при одной и той же температуре.
Исходные стандартные вещества для титрованных растворовИсходные стандартные вещества для установки концентрации титрованных растворов обозначают буквами РО (реактив основной) и готовят следующим образом.
КBrO3. (М.м. 167,00).
Калия бромат перекристаллизовывают из кипящей воды. Кристаллы собирают и сушат до постоянной массы при температуре 180 ºС.
Калия гидрофталат РОС8Н5КО4. (М.м. 204,22).
Калия гидрофталат перекристаллизовывают из кипящей воды. Кристаллы собирают при температуре выше 35 ºС и сушат до постоянной массы при температуре 120 ºС.
Калия дихромат РОK2Cr2O7. (М.м. 294,19).
Калия дихромат перекристаллизовывают из горячей воды. Кристаллы сушат до постоянной массы при температуре от 130 до 150 °С и растирают.
Кислота бензойная РОС7Н6О2. (М.м. 122,12).
Кислоту бензойную сублимируют.
Мышьяка оксид РОАs2О3. (М.м. 197,84).
Мышьяка оксид сублимируют.
Хранят над силикагелем безводным.
Натрия карбонат безводный РОNa2CO3. (М.м. 106,01).
Насыщенный раствор натрия карбоната фильтруют при комнатной температуре. Через фильтрат медленно пропускают поток углерода диоксида при постоянном охлаждении и перемешивании. Через 2 ч осадок собирают на стеклянном фильтре, промывают фильтр ледяной водой, насыщенной углерода диоксидом. Сушат при температуре от 100 до 105 ºС и прокаливают до постоянной массы при температуре от 270 до 300 ºС, периодически перемешивая.
Натрия хлорид РОNaCl. (М.м. 58,44).
К 1 объёму насыщенного раствора натрия хлорида прибавляют 2 объема хлористоводородной кислоты концентрированной. Полученные кристаллы собирают и промывают хлористоводородной кислотой 25 %, которую удаляют нагреванием на кипящей водяной бане. Прокаливают до постоянной массы при температуре 300 ºС.
Сульфаниловая кислота РОС6Н7NO3S. (М.м. 173,19).
(М.м. 173,19).
Сульфаниловую кислоту перекристаллизовывают из кипящей воды, фильтруют и сушат до постоянной массы при температуре от 100 до 105 ºС.
Цинк РОZn. (А.м. 65,37).
Используют цинк с содержанием не менее 99,9 % Zn.
Титрованные растворы1 М раствор азотной кислоты
96,9 мл азотной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого и титруют приготовленным раствором азотной кислоты до красновато-жёлтого окрашивания; кипятят в течение 2 мин, раствор снова приобретает жёлтую окраску, охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора азотной кислоты соответствует 53,00 мг Na2CO3.
0,1 М раствор аммония тиоцианата 0,1 М раствор аммония роданида.
7,612 г аммония тиоцианата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл 0,1 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и титруют приготовленным раствором аммония тиоцианата до появления красновато-желтого окрашивания.
1 мл 0,1 М раствора серебра нитрата соответствует 7,612 мг NH4SCN.
0,01 М раствор аммония тиоцианата0,01 М раствор аммония роданида.
100,0 мл 0,1 М раствора аммония тиоцианата разбавляют водой до объёма 1000,0 мл.
Установка титра. К 20,0 мл 0,01 М раствора серебра нитрата прибавляют 25 мл воды, 2 мл 2 М раствора азотной кислоты, 2 мл 10 % раствора железа аммония сульфата и далее поступают, как указано при установке титра 0,1 М раствора аммония тиоцианата.
1 мл 0,01 М раствора серебра нитрата соответствует 0,7612 мг NH4SCN.
Раствор, содержащий 56 мл серной кислоты концентрированной и 54,82 г аммония церия нитрата, взбалтывают в течение 2 мин, прибавляют последовательно 5 порций, по 100 мл каждая, воды, перемешивая после каждого прибавления. Доводят объем раствора водой до 1000,0 мл. Титр полученного раствора устанавливают через 10 сут.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 54,82 мг
(NH4)2Cе(NО3)6.
Хранят в защищенном от света месте.
0,01 М раствор аммония церия нитратаК 100,0 мл 0,1 М раствора аммония церия нитрата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
65,0 г аммония церия сульфата растворяют в смеси 500 мл воды и 30 мл серной кислоты концентрированной, охлаждают и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 2 г калия йодида и 150 мл воды. Немедленно титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 63,26 мг
2 (NH4)2SO4 · Cе(SО4)2 · 2 H2O.
К 100,0 мл 0,1 М раствора аммония церия сульфата прибавляют при охлаждении 30 мл серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,05 М раствор бария перхлората15,8 г бария гидроксида растворяют в смеси 75 мл воды и 7,5 мл хлорной кислоты, доводят рН раствора до 3,0 хлорной кислотой и фильтруют, если необходимо. Прибавляют 150 мл спирта 96 %, доводят объём раствора водой до 250 мл, затем доводят объём раствора буферным раствором рН 3,7 до 1000,0 мл.
Прибавляют 150 мл спирта 96 %, доводят объём раствора водой до 250 мл, затем доводят объём раствора буферным раствором рН 3,7 до 1000,0 мл.
Установка титра. К 5,0 мл 0,05 М раствора серной кислоты прибавляют 5 мл воды, 50 мл буферного раствора рН 3,7 и 0,5 мл 0,1 % раствора ализарина S; титруют приготовленным раствором бария перхлората до появления оранжево-красного окрашивания. Определение титра проводят непосредственно перед использованием.
1 мл 0,05 М раствора серной кислоты соответствует 16,81 мг Ba(ClO4)2.
0,025 М раствор бария перхлората500,0 мл 0,05 М раствора бария перхлората доводят ацетатным буферным раствором рН 3,7 до объёма 1000,0 мл.
0,1 М раствор бария хлорида24,4 г бария хлорида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл приготовленного раствора бария хлорида прибавляют 60 мл воды, 3 мл аммиака раствора концентрированного 25 %, от 0,5 до 1,0 мг фталеинового пурпурного и титруют 0,1 М раствором натрия эдетата. Когда окраска раствора начнет ослабевать, прибавляют 50 мл спирта 96 % и продолжают титрование до исчезновения синевато-фиолетового окрашивания.
Когда окраска раствора начнет ослабевать, прибавляют 50 мл спирта 96 % и продолжают титрование до исчезновения синевато-фиолетового окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 24,43 мг BaCl2 · 2 H2O.
0,004 М раствор бензэтония хлорида1,792 г бензэтония хлорида, предварительно высушенного до постоянной массы при температуре от 100 до 105 ºС, растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. Вычисляют молярность раствора, исходя из содержания С27Н42СlNO2 в высушенном бензэтония хлориде, определенного следующим образом. 0,350 г высушенного вещества растворяют в 30 мл уксусной кислоты безводной, прибавляют 6 мл 3,19 % раствора ртути (II) ацетата и титруют 0,1 М раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора хлорной кислоты соответствует 44,81 мг С27Н42СlNO2.
0,05 М раствор брома.
2,7835 г калия бромата РО и 13 г калия бромида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
0,1 М раствор железа(III) аммония сульфата50,0 г железа(III) аммония сульфата растворяют в смеси 300 мл воды и 6 мл серной кислоты концентрированной и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(III) аммония сульфата прибавляют 3 мл хлористоводородной кислоты концентрированной, 2 г калия йодида и через 10 мин титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 48,22 мг
FeNH4(SO4)2 · 12 H2O.
27,80 г железа(II) сульфата растворяют в 500 мл серной кислоты разведенной 9,8 % и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора железа(II) сульфата прибавляют 3 мл фосфорной кислоты концентрированной и тотчас титруют 0,02 М раствором калия перманганата. Определение титра проводят непосредственно перед использованием.
1 мл 0,02 М раствора калия перманганата соответствует 27,80 мг
FeSO4 · 7 H2O.
127,0 г йода и 200 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 2,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 50 мл воды. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1% раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,1 М (0,2 н.) раствор йодаОколо 25,5 г йода и 40 г калия йодида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 40 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,05 М (0,1 н.) раствор йода20 г калия йодида растворяют в минимальном количестве воды, прибавляют 12,7 г йода, растворяют при перемешивании и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 30 мл воды. Далее поступают, как указано при установке титра 0,5 М раствора йода.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Хранят в защищенном от света месте.
0,01 М (0,02 н.) раствор йода0,3 г калия йодида растворяют в 20,0 мл 0,05 М раствора йода и доводят объем раствора водой до 100,0 мл.
Установка титра. К 25,0 мл полученного раствора прибавляют 1 мл 2 М раствора уксусной кислоты и 25 мл воды и титруют 0,01 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,01 М раствора натрия тиосульфата соответствует 1,269 мг I2.
0,1 М раствор йода монохлорида (для определения йодного числа)11,06 г калия йодида и 7,10 г калия йодата помещают в склянку с притертой пробкой, прибавляют 50 мл воды и 50 мл концентрированной хлористоводородной кислоты, закрывают пробкой и встряхивают до полного растворения образующегося при реакции йода. Раствор переносят в делительную воронку и взбалтывают с 10 мл хлороформа. Если хлороформный слой окрашивается в фиолетовый цвет, то прибавляют при сильном взбалтывании по каплям 1 % раствор калия йодата до обесцвечивания хлороформного слоя. Если же хлороформный слой остается бесцветным, то прибавляют по каплям 1 % раствор калия йодида до появления бледно-розовой окраски. После отстаивания водный слой сливают в мерную колбу и доводят объем раствора водой до 1000,0 мл. Приготовленный раствор должен иметь лимонно-желтый цвет.
После отстаивания водный слой сливают в мерную колбу и доводят объем раствора водой до 1000,0 мл. Приготовленный раствор должен иметь лимонно-желтый цвет.
Установка титра. 25,0 мл приготовленного раствора йода монохлорида помещают в колбу с притертой пробкой, прибавляют 1 г калия йодида и оставляют в защищенном от света месте на 15 мин. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора
0,5 – 1 мл 1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 12,69 мг I2.
Титр раствора устанавливают каждый раз перед применением.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,033 М (0,2 н.) раствор калия бромата5,5110 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 10,0 мл полученного раствора прибавляют 50 мл воды, 10 мл 16,6 % раствора калия йодида и 5 мл 7 М раствора хлористоводородной кислоты. Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
Титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,02 М (0,12 н.) раствор калия бромата3,340 г калия бромата РО растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 15,0 мл полученного раствора прибавляют 45 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0167 М (0,1 н.) раствор калия бромата0,1 н. раствор калия бромата.
2,7889 г калия бромата PO растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора прибавляют 40 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
0,0083 М (0,05 н.) раствор калия бромата250,0 мл 0,033 М раствора калия бромата доводят водой до объёма 1000,0 мл.
Установка титра. К 40,0 мл полученного раствора добавляют 20 мл воды. Далее поступают, как указано при установке титра 0,033 М раствора калия бромата.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,783 мг KBrO3.
1 М раствор калия гидроксида
60 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой, свободной от углерода диоксида, до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 56,11 мг KOH.
0,1 М раствор калия гидроксида6 г калия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора тем же растворителем до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.
0,5 М раствор калия гидроксида в спирте 60 % (об/об)3 г калия гидроксида растворяют в спирте 60 % (об/об), свободном от альдегидов, и доводят объём раствора тем же растворителем до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида в спирте 60 % (об/об) титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,5 М раствор калия гидроксида спиртовой0,5 М раствор кали едкого спиртовой.
3 г калия гидроксида растворяют в 5 мл воды и доводят объем раствора спиртом 96 %, свободным от альдегидов, до 100,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия гидроксида спиртового титруют 0,5 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 28,06 мг KOH.
0,1 М раствор калия гидроксида спиртовой0,1 М раствор кали едкого спиртовоый.
20,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
Установка титра. 20,0 мл полученного раствора титруют 0,1 М раствором хлористоводородной кислоты, используя в качестве индикатора 0,5 мл 0,1 % раствора фенолфталеина.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,611 мг KOH.
0,01 М раствор калия гидроксида спиртовой2,0 мл 0,5 М раствора калия гидроксида спиртового доводят спиртом 96 %, свободным от альдегидов, до объёма 100,0 мл.
20,42 г калия гидрофталата PO растворяют в 800 мл уксусной кислоты безводной, полученный раствор нагревают на водяной бане до растворения, защищая от действия влаги. Охлаждают до температуры 20 ºС и доводят объём раствора уксусной кислотой безводной до 1000,0 мл.
0,0167 М (0,1 н.) раствор калия дихромата4,90 г калия дихромата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора калия дихромата прибавляют 1 г калия йодида, 7 мл хлористоводородной кислоты разведенной 7,3 %, 250 мл воды и титруют 0,1 М раствором натрия тиосульфата до перехода окраски от синей к светло-зеленой, используя в качестве индикатора 3 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
0,05 М раствор калия йодата10,7 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл приготовленного раствора калия йодата доводят водой до объема 100,0 мл. К 20,0 мл полученного раствора прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 %, и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
0,0167 М (0,1 н.) раствор калия йодата3,567 г калия йодата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 20,0 мл приготовленного раствора калия йодата помещают в колбу с притертой пробкой, прибавляют 100 мл воды, 25 мл серной кислоты разведенной 9,8 %, 2 г калия йодида и оставляют на 10 мин в защищенном от света месте. Выделившийся йод титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 3,567 мг KIO3.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света месте.
0,001 М раствор калия йодида10,0 мл раствора калия йодида 166 г/л доводят водой до объема 100,0 мл. 5,0 мл полученного раствора доводят водой до объема 500,0 мл.
0,02 М раствор калия перманганата0,1 н. раствор калия перманганата.
3,2 г калия перманганата растворяют в воде и доводят объем раствора водой до 1000,0 мл; полученный раствор нагревают на водяной бане в течение 1 ч, охлаждают и фильтруют через стеклянный фильтр.
Установка титра. К 20,0 мл приготовленного раствора калия перманганата прибавляют 2 г калия йодида, 10 мл серной кислоты разведенной 9,8 % и титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора тиосульфата натрия соответствует 3,161 мг KMnO4.
Титр устанавливают непосредственно перед использованием.
Хранят в защищенном от света месте.
0,1 М раствор лития метоксида0,694 г лития небольшими порциями растворяют в 150 мл метанола безводного и доводят объем раствора толуолом до 1000,0 мл.
Установка титра. К 10,0 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором лития метоксида до получения синего окрашивания раствора. Немедленно прибавляют 0,200 г бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором лития метоксида до повторного получения синего окрашивания раствора. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора лития метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора лития метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,05 М раствор магния сульфата12,5 г магния сульфата растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. 40,0 мл полученного раствора доводят водой до объёма 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 24,65 мг MgSO4 ∙ 7 H2O.
0,1 М раствор магния хлорида20,33 г магния хлорида растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 25,0 мл полученного раствора доводят водой до 300 мл. Прибавляют 10 мл аммонийного буфера pH 10,0 и 50 мг тритурации эриохрома черного. Нагревают до 40 ºС и титруют при этой температуре 0,1 М раствором натрия эдетата до перехода окраски от фиолетовой к синей.
1 мл 0,1 М раствора натрия эдетата соответствует 20,33 мг MgCl2 ∙ 6 H2O.
0,02 М раствор меди сульфата5,0 г меди сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл полученного раствора меди сульфата прибавляют 2 г натрия ацетата, 0,1 мл 0,1 % раствора пиридилазонафтола и титруют 0,02 М раствором натрия эдетата до перехода окраски от фиолетово-синей до ярко-зеленой; вблизи точки эквивалентности титруют медленно.
1 мл 0,02 М раствора натрия эдетата соответствует 4,994 мг СuSO4 × 5 H2O.
0,1 М раствор натрия арсенита4,946 г мышьяка оксида РО растворяют в смеси 20 мл 10 М раствора натрия гидроксида и 20 мл воды, доводят объем раствора водой до 400,0 мл и нейтрализуют хлористоводородной кислотой разведенной 7,3 % по лакмусовой бумаге. Растворяют в полученном растворе 2,0 г натрия гидрокарбоната и доводят объем раствора водой до 500,0 мл.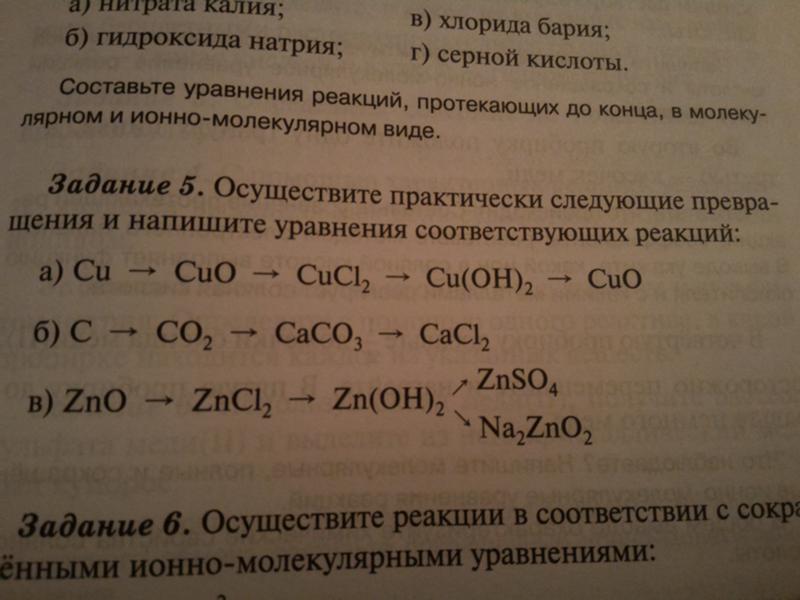
25 мл 0,1 М раствор натрия арсенита доводят водой до 100 мл.
0,001 М раствор натрия додецилсульфата0,2884 г натрия додецилсульфата, в пересчете на высушенное вещество (105 ºС в течение 2 ч), растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл полученного раствора прибавляют 15 мл хлороформа, 10 мл 1 М раствора серной кислоты и 1 мл раствора, содержащего по 0,003 % диметилового желтого и орацетового синего В в хлороформе. Титруют 0,004 М раствором бензэтония хлорида при энергичном встряхивании и разделении слоев после каждого добавления титранта до тех пор, пока хлороформный слой не приобретет постоянный (неисчезающий) зеленый цвет.
1 мл 0,004 М раствора бензэтония хлорида соответствует 1,154 мг C12H25NaO4S.
1 М раствор натрия гидроксида1 М раствор натра едкого.
42 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора водой до 1000,0 мл.
Проверка на содержание карбонатов. 45,0 мл 1 М раствора хлористоводородной кислоты титруют приготовленным раствором натрия гидроксида (индикатор – фенолфталеин). К оттитрованному раствору прибавляют по каплям 1 М раствор хлористоводородной кислоты до исчезновения розового окрашивания и упаривают при кипячении до объема ~ 20 мл. В процессе кипячения при возникновении розового окрашивания прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Раствор охлаждают и, при наличии розовой окраски, прибавляют 1 М раствор хлористоводородной кислоты до обесцвечивания. Суммарное количество прибавленного 1 М раствора хлористоводородной кислоты не должно превышать 0,1 мл.
Установка титра (1). 20,0 мл 1 М раствора хлористоводородной кислоты титруют полученным раствором натрия гидроксида, используя в качестве индикатора 0,5 – 1,0 мл 1 % раствора фенолфталеина.
1 мл 1 М раствора хлористоводородной кислоты соответствует 40,00 мг NaOH.
Установка титра (2). Около 5,00 г (точная навеска) калия гидрофталата PO, предварительного тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 75 мл воды и титруют приготовленным раствором натра едкого (индикатор – фенолфталеин).
1 мл 1 М раствора натрия гидроксида соответствует 204,22 мг C8H5KO4.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,5 М раствор натрия гидроксида0,5 М раствор натра едкого.
21 г натрия гидроксида растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45,0 мл 0,5 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,5 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 20,00 мг NaOH.
Установка титра (2). Около 2,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 50 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,5 М раствора натрия гидроксида соответствует 102,11 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида0,1 М раствор натра едкого.
100,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,1 М раствора хлористоводородной кислоты.
Для определения берут 45 мл 0,1 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,1 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 4,00 мг NaOH.
Установка титра (2). Около 0,50 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 20,42 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,05 М раствор натрия гидроксида0,05 М раствор натра едкого.
50,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,05 М раствора хлористоводородной кислоты.
Установка титра (1). 10,0 мл 0,05 М раствора хлористоводородной кислоты титруют, как указано при определении титра 1 М раствора натрия гидроксида.
Установка титра (2). Около 0,25 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,05 М раствора натрия гидроксида соответствует 10,21 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,02 М раствор натрия гидроксида0,02 М раствор натра едкого.
20,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,02 М раствора хлористоводородной кислоты.
Установка титра. Около 0,10 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,02 М раствора натрия гидроксида соответствует 4,084 мг C8H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,01 М раствор натрия гидроксида0,01 М раствор натра едкого.
10,0 мл 1 М раствора натрия гидроксида доводят водой, свободной от углерода диоксида, до объема 1000,0 мл.
Проверка на содержание карбонатов. Проводят, как описано при приготовлении 1 М раствора натрия гидроксида. Для определения берут 45 мл 0,01 М раствора хлористоводородной кислоты.
Для определения берут 45 мл 0,01 М раствора хлористоводородной кислоты.
Установка титра. Около 0,05 г (точная навеска) калия гидрофталата PO, предварительно тонко измельченного и высушенного при температуре 120 ºС в течение 2 ч, растворяют в 30 мл воды. Далее поступают, как указано при установке титра 1 М раствора натрия гидроксида.
1 мл 0,01 М раствора натрия гидроксида соответствует 2,042 мг C6H5KO4.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида этанольныйК 250 мл этанола безводного (спирт абсолютированный) прибавляют 3,3 г 10 М раствора натрия гидроксида.
Установка титра. 0,200 г (точная навеска) бензойной кислоты PO растворяют в 2 мл воды и 10 мл спирта 96 % и титруют приготовленным раствором натрия гидроксида этанольным, используя в качестве индикатора 0,2 мл 0,1 % раствора тимолфталеина.
1 мл 0,1 М раствора натрия гидроксида этанольного соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия гидроксида в смеси метанола и бензола4,2 г натрия гидроксида растворяют в 100 мл метанола в мерной колбе вместимостью 1000,0 мл. Объем раствора доводят бензолом и метанолом до метки, прибавляя их попеременно при помешивании. Соотношение метанола и бензола при приготовлении раствора должно быть примерно 1:4.
Примечание. В случае получения непрозрачного раствора его оставляют на 12 ч, после чего прозрачную жидкость быстро сливают с осадка.
Установка титра. Около 0,100 г (точная навеска) бензойной кислоты PO растворяют в 20 мл диметилформамида, нейтрализованного непосредственно перед титрованием по 1 % раствору тимолового синего в диметилформамиде, и титруют приготовленным раствором натрия гидроксида в присутствии того же индикатора до перехода окраски от желтой к синей.
1 мл 0,1 М раствора натрия гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
Примечание. Установку титра следует проводить в тщательно закрытых сосудах. Титрование рекомендуется проводить в атмосфере инертного газа.
Хранить в плотно закрытых ёмкостях из тёмного стекла.
0,1 М раствор натрия метоксида175 мл метанола безводного охлаждают в ледяной воде и прибавляют небольшими порциями около 2,5 г свеженарезанного натрия; когда металл растворится, доводят объём раствора толуолом до 1000,0 мл.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором натрия метоксида до синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и титруют приготовленным раствором натрия метоксида до повторного получения синего окрашивания. Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора натрия метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
Во время титрования раствор защищают от атмосферного углерода диоксида. Титр раствора натрия метоксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора натрия метоксида соответствует 12,21 мг С7Н6О2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор натрия нитрита7,5 г натрия нитрита растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,300 г (точная навеска) сульфаниловой кислоты РО растворяют в 50 мл 2 М раствора хлористоводородной кислоты, прибавляют 3 г калия бромида и охлаждают в бане со льдом. Полученный раствор титруют приготовленным раствором натрия нитрита, устанавливая конечную точку титрования электрометрически, используя в качестве индикаторного платиновый электрод, а в качестве электрода сравнения – хлорсеребряный или насыщенный каломельный, или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с тропеолином 00 проводят до перехода окраски от красной к желтой, со смесью тропеолина 00 с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин.
Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления раствора нитрита натрия, не будет немедленно вызывать синее окрашивание на бумаге. Параллельно проводят контрольный опыт. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье.
1 мл 0,1 М раствора натрия нитрита соответствует 17,32 мг С6Н7 NО3S.
0,1 М раствор натрия перйодата21,4 г натрия перйодата растворяют в 500 мл воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора прибавляют 5 мл хлорной кислоты, закрывают колбу пробкой и перемешивают. Доводят рН раствора до 6,4 насыщенным раствором натрия гидрокарбоната. Прибавляют 10 мл 16,6 % раствора калия йодида, закрывают пробкой, перемешивают, выдерживают 2 мин и титруют 0,025 М раствором натрия арсенита до слабо-желтого окрашивания, затем прибавляют 2 мл раствора крахмала и титруют до обесцвечивания раствора.
Доводят рН раствора до 6,4 насыщенным раствором натрия гидрокарбоната. Прибавляют 10 мл 16,6 % раствора калия йодида, закрывают пробкой, перемешивают, выдерживают 2 мин и титруют 0,025 М раствором натрия арсенита до слабо-желтого окрашивания, затем прибавляют 2 мл раствора крахмала и титруют до обесцвечивания раствора.
1 мл 0,025 М раствора натрия арсенита соответствует 5,348 мг NaIO4.
0,1 М раствор натрия тиосульфата25 г натрия тиосульфата и 0,2 г натрия карбоната растворяют в воде, свободной от углерода диоксида, и доводят объем раствора той же водой до 1000,0 мл.
Установка титра.
Способ 1. К 20,0 мл 0,0167 М раствора калия бромата прибавляют 40 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,1 М раствора натрия тиосульфата соответствует 2,784 мг КВrO3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в 50 мл воды в колбе с притертой пробкой, прибавляют 2 г калия йодида, 5 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 100 мл воды, промывая пробку водой, и титруют приготовленным раствором натрия тиосульфата до зеленовато-желтого окрашивания. Затем прибавляют 2 мл раствора крахмала и продолжают титровать до перехода синей окраски в светло-зеленую.
1 мл 0,1 М раствора натрия тиосульфата соответствует 4,903 мг K2Cr2O7.
Хранят в сосудах темного стекла с притертыми пробками в защищенном от света и углекислоты месте.
0,005 М раствор натрия тиосульфата25,0 мл 0,1 М раствора натрия тиосульфата доводят водой, свободной от углерода диоксида, до объема 500,0 мл.
Используют свежеприготовленный раствор.
Установка титра.
Способ 1. К 5,0 мл 0,0083 М раствора калия бромата прибавляют 35 мл воды, 10 мл 16,6 % раствора калия йодида, 5 мл 7 М раствора хлористоводородной кислоты и титруют приготовленным раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала. Индикатор прибавляют в конце титрования.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,139 мг КBrО3.
Способ 2. Около 0,15 г (точная навеска) калия дихромата РО растворяют в воде в мерной колбе вместимостью 250 мл, доводят объем раствора водой до метки и перемешивают. 25 мл полученного раствора калия дихромата помещают в колбу с притертой пробкой, прибавляют 0,2 г калия йодида, 3 мл хлористоводородной кислоты 25 %, закрывают пробкой, смоченной 10 % раствором калия йодида, и оставляют в защищенном от света месте на 10 мин. Прибавляют 50 мл воды, промывая пробку водой, и титруют как описано при установке титра 0,1 М раствора натрия тиосульфата по способу 2.
1 мл 0,005 М раствора натрия тиосульфата соответствует 0,2452 мг K2Cr2O7.
0,1 М раствор трилона Б.
37,5 г натрия эдетата растворяют в 500 мл воды, прибавляют 100 мл 1 М раствора натрия гидроксида и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,120 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и прибавляют 0,1 мл бромной воды; избыток брома удаляют кипячением, прибавляют 2 М раствор натрия гидроксида до слабокислой или нейтральной реакции, разбавляют водой до 200 мл, прибавляют 50 мг индикаторной смеси ксиленолового оранжевого и достаточное количество гексаметилентетрамина до фиолетово-розового окрашивания, прибавляют ещё 2 г гексаметилентетрамина и титруют приготовленным раствором натрия эдетата до изменения окраски от фиолетово-розовой к жёлтой.
1 мл 0,1 М раствора натрия эдетата соответствует 6,54 мг Zn.
0,05 М раствор натрия эдетата0,05 М раствор трилона Б.
18,6 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,060 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,05 М раствора натрия эдетата соответствует 3,269 мг Zn.
0,02 М раствор натрия эдетата7,444 г натрия эдетата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. 0,030 г цинка РО растворяют в 4 мл 7 М раствора хлористоводородной кислоты и добавляют 0,1 мл бромной воды. Далее поступают, как указано при установке титра 0,1 М раствора натрия эдетата.
1 мл 0,02 М раствора натрия эдетата соответствует 1,308 мг Zn.
0,05 М (0,1 н.) раствор ртути(II) нитрата0,05 М раствор ртути окисной нитрата.
17,2 г ртути(II) нитрата растворяют в 50 мл 1 М раствора азотной кислоты и разбавляют водой до 1000,0 мл.
Установка титра. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором ртути(II) нитрата, используя в качестве индикатора 0,5 мл 1 % спиртового раствора дифенилкарбазона.
1 мл 0,05 М раствора ртути окисной нитрата соответствует 5,844 мг NaCl.
0,1 М раствор серебра нитрата17,0 г серебра нитрата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра.
Способ 1. 0,150 г (точная навеска) натрия хлорида РО растворяют в 50 мл воды и титруют приготовленным раствором серебра нитрата до появления красноватого осадка, используя в качестве индикатора 5 % раствор калия хромата. Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 5,844 мг NaCl.
Способ 2. 0,100 г (точная навеска) натрия хлорида РО растворяют в 30 мл воды и титруют потенциометрически приготовленным раствором нитрата серебра. Параллельно проводят контрольный опыт.
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора нитрата серебра соответствует 5,844 мг NaCl.
Хранят в защищенном от света месте.
0,01 М раствор серебра нитрата50,0 мл 0,1 М раствора серебра нитрата разбавляют водой до объёма 500,0 мл.
0,001 М раствор серебра нитрата5,0 мл 0,1 М раствора серебра нитрата доводят водой до объёма 500,0 мл.
0,5 М (1 н.) раствор серной кислоты30 мл серной кислоты концентрированной осторожно вливают в воду и доводят объем раствора водой до 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет). Титруют приготовленным раствором серной кислоты до красновато-жёлтого окрашивания. Кипятят около 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и титруют вновь до повторного появления красновато-жёлтого окрашивания.
1 мл 0,5 М раствора серной кислоты соответствует 53,00 мг Na2CO3.
0,05 М (0,1 н.) раствор серной кислоты100,0 мл 0,5 М раствора серной кислоты доводят водой до объёма 1000,0 мл.
0,1 М раствор свинца(II) нитрата33 г свинца(II) нитрата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора свинца нитрата прибавляют 300 мл воды, 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания. Титруют 0,1 М раствором натрия эдетата до появления жёлтого окрашивания.
1 мл 0,1 М раствора натрия эдетата соответствует 33,12 мг Рb(NO3)2.
0,05 М раствор свинца(II) нитрата16,5 г свинца(II) нитрата растворяют в достаточном количестве воды и доводят объём раствора водой до 1000,0 мл.
Установка титра. К 50,0 мл приготовленного раствора добавляют 300 мл воды. Далее поступают, как указано в установке титра 0,1 М раствора свинца нитрата.
0,1 М раствор тетрабутиламмония гидроксида40 г тетрабутиламмония йодида растворяют в 90 мл метанола безводного, прибавляют 20 г тонко измельченного серебра оксида и энергично встряхивают в течение 1 ч. Центрифугируют несколько миллилитров смеси и проводят испытание жидкости над осадком на йодиды. При получении положительной реакции дополнительно прибавляют 2 г серебра оксида и встряхивают в течение последующих 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов. Смесь фильтруют через стеклянный фильтр, промывают реакционный сосуд и фильтр 3 порциями, по 50 мл каждая, толуола. К полученному фильтрату прибавляют промывной толуол и доводят объем раствора толуолом до 1000,0 мл. Через раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К 10 мл диметилформамида прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетрабутиламмония гидроксида до чистого синего окрашивания. Тотчас прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр раствора тетрабутиламмония гидроксида устанавливают по объему титранта, израсходованного в повторном титровании.
1 мл 0,1 М раствора тетрабутиламмония гидроксида соответствует 12,21 мг C7H6O2.
Титр устанавливают непосредственно перед использованием.
0,1 М раствор тетрабутиламмония гидроксида в 2-пропанолеРаствор готовят, как указано для 0,1 М раствора тетрабутиламмония гидроксида, используя в качестве растворителя 2-пропанол вместо толуола.
Установка титра. Титр устанавливают, как указано для 0,1 М раствора тетрабутиламмония гидроксида.
4 г тетрабутиламмония йодида растворяют в достаточном количестве воды и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора прибавляют 50 мл 0,01 М раствора серебра нитрата, 0,5 мл 2 М раствора азотной кислоты и титруют избыток серебра нитрата 0,01 М раствором аммония тиоцианата, используя в качестве индикатора 0,5 мл 0,2 % раствора железа(III) аммония сульфата.
1 мл 0,01 М раствора серебра нитрата соответствует 3,694 мг C16H36IN.
0,1 М раствор тетраэтиламмония гидроксида30 г тетраэтиламмония йодида растворяют в 200 мл метанола и встряхивают в течение 1 ч с 25 г тонко измельченного серебра оксида в стеклянном сосуде с притертой пробкой. По окончании встряхивания центрифугируют несколько миллилитров смеси и раствор испытывают на присутствие йодидов. При положительной реакции к основному раствору прибавляют еще 5 г серебра оксида и снова встряхивают 30 мин; эту процедуру повторяют до тех пор, пока жидкость не будет свободна от йодидов; смесь фильтруют через стеклянный фильтр. Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Реакционную колбу ополаскивают 3 порциями, по 50 мл каждая, сухого бензола, бензольный раствор фильтруют через тот же фильтр и прибавляют к фильтрату. Фильтрат доводят бензолом до объема 1000,0 мл. Через полученный раствор пропускают сухой азот, свободный от углерода диоксида, в течение 5 мин.
Установка титра. К смеси 5 мл метанола и 20 мл ацетона прибавляют 0,05 мл 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором тетраэтиламмония гидроксида до чистого синего окрашивания. Сразу же прибавляют 0,200 г (точная навеска) бензойной кислоты РО, перемешивают до растворения и продолжают титрование до синего окрашивания. Титр устанавливают по объему титранта, израсходованного при повторном титровании.
1 мл 0,1 М раствора тетраэтиламмония гидроксида соответствует 12,21 мг С7Н6О2.
1 М раствор хлористоводородной кислоты87,0 мл хлористоводородной кислоты концентрированной доводят водой до объёма 1000,0 мл.
Установка титра. 1,000 г (точная навеска) натрия карбоната безводного РО растворяют в 50 мл воды, прибавляют 0,1 мл 0,1 % раствора метилового оранжевого (раствор окрашивается в жёлтый цвет) и титруют приготовленным раствором хлористоводородной кислоты до красновато-жёлтого окрашивания. Кипятят в течение 2 мин (раствор снова приобретает жёлтое окрашивание), охлаждают и продолжают титрование до красновато-жёлтого окрашивания.
1 мл 1 М раствора хлористоводородной кислоты соответствует 53,00 мг Na2CO3.
0,5 М раствор хлористоводородной кислоты43,5 мл концентрированной хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
Установка титра. 0,600 г (точная навеска) натрия карбоната безводного РО растворяют в 100 мл воды. Далее поступают, как при установке титра 1 М раствора хлористоводородной кислоты.
1 мл 0,5 М раствора хлористоводородной кислоты соответствует 26,50 мг Na2CO3.
100,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,1 М раствора хлористоводородной кислоты соответствует 5,30 мг Na2CO3.
0,01 М раствор хлористоводородной кислоты10,0 мл 1 М раствора хлористоводородной кислоты доводят водой до объёма 1000,0 мл.
1 мл 0,01 М раствора хлористоводородной кислоты соответствует 0,53 мг Na2CO3.
0,1 М раствор хлористоводородной кислоты спиртовой9,0 мл хлористоводородной кислоты концентрированной доводят спиртом 96 %, свободным от альдегидов, до объёма 1000,0 мл.
0,1 М раствор хлорной кислотыК 900 мл уксусной кислоты ледяной прибавляют 8,5 мл 70 % или 11 мл 60 % раствора хлорной кислоты, перемешивают, добавляют 30 мл уксусного ангидрида и доводят объем раствора уксусной кислотой ледяной до 1000,0 мл, перемешивают и оставляют на 24 ч. Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Содержание воды определяют методом К. Фишера без добавления метанола и, если необходимо, прибавляют воду или уксусный ангидрид до содержания воды от 0,1 до 0,2 %. Оставляют на 24 ч.
Установка титра. 0,350 г (точная навеска) калия гидрофталата РО растворяют в 50 мл уксусной кислоты безводной, если необходимо, осторожно нагревая, охлаждают и титруют приготовленным раствором хлорной кислоты, используя в качестве индикатора 0,05 мл 0,5 % раствора кристаллического фиолетового, до перехода фиолетовой окраски раствора в голубовато-зелёную.
1 мл 0,1 М раствора хлорной кислоты соответствует 20,42 мг C8H5KO4.
Примечание. Если температура, при которой проводится количественное определение, отличается от температуры, при которой был установлен титр 0,1 М раствора хлорной кислоты, то вводят температурную поправку. Объем (Vc), необходимый для количественного определения, вычисляют по формуле:
Vc = V [1 + (t1 – t2) 0,0011],
где t1 – температура, при которой устанавливают титр;
t2 – температура, при которой проводят количественное определение;
V – объём, израсходованный на титрование фактически, мл.
50,0 мл 0,1 М раствора хлорной кислоты доводят уксусной кислотой безводной до объема 100,0 мл.
0,1 М раствор хлорной кислоты в метанолеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл метанола, очищенного от карбонилсодержащих соединений, и доводят объём раствора тем же метиловым спиртом до 1000,0 мл.
Установка титра. Около 0,1 г натрия салицилата (точная навеска), предварительно дважды перекристаллизованного из спирта 96 % и высушенного до постоянной массы, растворяют в 10 мл метанола, прибавляют равный объём ацетона, 2 капли 0,3 % раствора тимолового синего в метаноле и титруют приготовленным раствором хлорной кислоты до перехода окраски от жёлтой к розовой.
1 мл 0,1 М раствора хлорной кислоты соответствует 16,01 мг С7Н5NaO3.
0,1 М раствор хлорной кислоты в нитрометанеК 11 мл 60 % или 8,5 мл 70 % раствора хлорной кислоты прибавляют 500 мл нитрометана и доводят объём раствора нитрометаном до 1000,0 мл.
Установка титра. Как описано при установке титра 0,1 М раствора хлорной кислоты.
0,1 М раствор уксусной кислоты6,0 г уксусной кислоты ледяной доводят водой до объема 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора уксусной кислоты прибавляют 0,5 мл 0,1 % раствора фенолфталеина и титруют 0,1 М раствором натрия гидроксида.
1 мл 0,1 М раствора натрия гидроксида соответствует 6,01 мг С2Н4О2.
0,1 М раствор церия(IV) сульфата40,4 г церия(IV) сульфата растворяют в смеси 500 мл воды и 50 мл серной кислоты концентрированной; охлаждают и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 25,0 мл приготовленного раствора церия(IV) сульфата прибавляют 2,0 г калия йодида, 150 мл воды и тотчас титруют 0,1 М раствором натрия тиосульфата, используя в качестве индикатора 1 мл 0,1 % раствора крахмала.
1 мл 0,1 М раствора натрия тиосульфата соответствует 40,43 мг Се(SO4)2 × 4 H2O.
0,05 М раствор цинка хлорида6,82 г цинка хлорида растворяют в воде. Если необходимо, по каплям прибавляют хлористоводородную кислоту разведенную 7,3 % до исчезновения опалесценции и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка хлорида прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют до 200 мл водой, добавляют 50 мг тритурации ксиленолового оранжевого и достаточное количество гексаметилентетрамина до появления фиолетово-розового окрашивания, добавляют еще 2 г гексаметилентетрамина и титруют 0,1 М раствором натрия эдетата до перехода окрашивания от фиолетово-розового до жёлтого.
1 мл 0,1 М раствора натрия эдетата соответствует 13,63 мг ZnCl2.
0,1 М раствор цинка сульфата29 г цинка сульфата растворяют в воде и доводят объем раствора водой до 1000,0 мл.
Установка титра. К 20,0 мл приготовленного раствора цинка сульфата прибавляют 5 мл 2 М раствора уксусной кислоты, разбавляют водой до 200 мл. Далее поступают, как при установке титра 0,05 М раствора цинка хлорида.
1 мл 0,1 М раствора натрия эдетата соответствует 28,75 мг ZnSO4 · 7 H2O.
Скачать в PDF ОФС.1.3.0002.15 Титрованные растворы
Равновесие— Почему водные растворы хлорида натрия и нитрата серебра обмениваются ионами?
Задавать вопрос
Спросил
Изменено 2 года, 6 месяцев назад
Просмотрено 22k раз
$\begingroup$
Итак, мы знаем, что:
$$ \ce{NaCl(водн.) + AgNO3(водн.) -> NaNO3(водн.) + AgCl(тв.)}$$
(Другими словами, ионы меняются местами и образуется осадок).
Однако оба этих соединения кажутся довольно стабильными, поскольку катионы $\ce{Ag}$ и $\ce{Na}$ имеют заряд 1+, а $\ce{Cl}$ и $\ce{NO3 }$ оба имеют 1-заряд. Поскольку они стабильны, я бы предположил, что никакой реакции не произойдет, поскольку оба иона довольны ионами, с которыми они в настоящее время связаны (натрий и серебро соответственно).
Однако $\ce{Na}$ выше в ряду активности, чем $\ce{Ag}$, и мы знаем, что эти водные растворы на самом деле содержат диссоциированные ионы, поэтому я предполагаю, что это как-то связано с двойным замена. Но почему это? Почему происходит эта реакция, хотя исходные соединения на первый взгляд кажутся стабильными?
Редактировать
Я прочитал этот вопрос, и там написано
Принцип Ле Шателье только утверждает, что система, ранее находившаяся в равновесии, захочет остаться в равновесии, то есть, если мы воздействуем на нее, она попытается вернуться к равновесию.
Вышеупомянутые соединения хлорида натрия и нитрата серебра находятся в начальном равновесии, не так ли?
Редактировать 2
Вопрос не в том, почему хлорид серебра является твердым, а в том, почему происходит эта реакция, если исходные два соединения изначально стабильны?
- равновесие
$\endgroup$
5
$\begingroup$
В то время как растворы нитрата серебра и хлорида натрия сами по себе находятся в стабильном равновесии, после смешивания равновесие меняется. Когда соли растворяются, у вас больше нет серебра и нитрата или ионов натрия и хлорида, связанных друг с другом, у вас есть смесь отдельных ионов в растворе.
Когда соли растворяются, у вас больше нет серебра и нитрата или ионов натрия и хлорида, связанных друг с другом, у вас есть смесь отдельных ионов в растворе.
Но хлорид серебра имеет очень низкую растворимость, около 1 мг может раствориться в 1 л воды. Поэтому при встрече иона серебра и иона хлора они быстро выпадают из раствора. Таким образом, если бы у нас было равновесие между растворенными ионами и небольшим количеством «растворимого» хлорида серебра, это равновесие было бы смещено в сторону хлорида серебра в результате осаждения. Когда соединения покидают раствор, осаждаясь или испаряясь, они выводятся из равновесия, поэтому попытка заменить их для восстановления равновесия требует превращения большего количества свободных ионов в хлорид серебра и подталкивает реакцию к завершению.
$\endgroup$
2
$\begingroup$
Итак, мы знаем, что:
$$\ce{NaCl (водн.
) + AgNO3 (водн.) -> NaNO3 (водн.) + AgCl (тв.) v}$$
(другими словами, ионы меняются местами и образуется осадок).
Ах да, так всегда пишут на доске. Но помните, что ярлык (aq) на самом деле несет смысл. Это означает, что при растворении ни в коем случае нельзя говорить об ассоциированных ионах натрия и хлора, они отделяются и диффундируют через раствор самостоятельно.
$$\ce{NaCl (т) + h3O -> Na+ (водн.) + Cl- (водн.)}$$
Если вы возьмете одну пару ионов $\ce{NaCl}$ и окрасите их в розовый цвет, вы поймете, что два розовых иона проходят через раствор совершенно индивидуально. То же самое и с $\ce{AgNO3}$. Иногда ион натрия может встречаться с ионом хлорида (или ион серебра с ионом нитрата), но они просто приветствуют и идут дальше.
Теперь мы смешиваем два раствора. Внезапно в этом хаосе рассеянных повсюду ионов ионы серебра могут встретиться с ионами хлора. Они не просто здороваются, но и обнимают друг друга, потому что любят крепко держаться вместе. И таким образом они осаждаются. Реакцию гораздо лучше записать в виде:
И таким образом они осаждаются. Реакцию гораздо лучше записать в виде:
$$\ce{Cl- (водн.) + Ag+ (водн.) -> AgCl (тв.) v + h3O}$$
Подумайте об этом по-другому. Смешать раствор хлорида натрия и бромида калия и затем выпарить воду. Вы получите смесь $\ce{NaCl, NaBr, KCl}$ и $\ce{KBr}$. Почему? Поскольку все ионы распределены поровну и при удалении растворителя все они упадут вместе. Все соли будут образовываться в полностью статистическом распределении.
$\endgroup$
Твой ответ
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
7.5: Стехиометрия раствора — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 79574
- Пол Р. Янг
- Иллинойский университет в Чикаго via ChemistryOnline.com
Как мы узнали из главы 5, реакции двойного замещения включают реакцию между ионными соединениями в растворе, и в ходе реакции ионы в двух реагирующих соединениях «переключаются» (они заменяют друг друга ). Например, нитрат серебра и хлорид натрия реагируют с образованием нитрата натрия и нерастворимого соединения , хлорида серебра.
\[\ce{AgNO3 (водн. ) + NaCl (водн.) → AgCl (тв.) + NaNO3 (водн.)} \номер \]
) + NaCl (водн.) → AgCl (тв.) + NaNO3 (водн.)} \номер \]
Поскольку эти реакции происходят в водном растворе, мы можем использовать понятие молярности для непосредственного расчета количества молей образующихся продуктов и, следовательно, массы осадков. В приведенной выше реакции, если мы смешаем 123 мл 1,00 М раствора NaCl с 72,5 мл 2,71 М раствора AgNO 3 , мы могли бы рассчитать количество молей (и, следовательно, массу) AgCl, которое будет образовано следующим образом:
Сначала мы должны изучить стехиометрию реакции. В этой реакции один моль AgNO 3 реагирует с одним молем NaCl с образованием одного моля AgCl. Поскольку наши коэффициенты равны, нам не нужно включать их в уравнение. Далее нам нужно рассчитать количество молей каждого реагента:
\[0.123L\times \left ( \frac{1.00\: моль}{1.00\: L} \right )=0.123\: моли\: NaCl \nonumber \]
\[0,0725L\times \left ( \frac{2,71\: моль}{1,00\: L} \right )=0,196\: моли\: AgNO_{3} \nonumber \]
Поскольку это проблема лимитирующего реагента , нам нужно вспомнить, что количество молей продукта, которое может образоваться, будет равно меньшему числу молей двух реагентов. В этом случае NaCl является лимитирующим, а AgNO 3 избыточным. Поскольку наша стехиометрия один к одному, мы образуем 0,123 моля AgCl. Наконец, мы можем преобразовать это в массу, используя молярную массу AgCl:
В этом случае NaCl является лимитирующим, а AgNO 3 избыточным. Поскольку наша стехиометрия один к одному, мы образуем 0,123 моля AgCl. Наконец, мы можем преобразовать это в массу, используя молярную массу AgCl:
\[0,0725L\times \left ( \frac{2,71\: моль}{1,00\: L} \right )=0,196\: моли\: AgNO_{3} \nonumber \]
В реакции, где стехиометрия не является однозначной, вам просто нужно включить стехиометрическое соотношение в свои уравнения. Так, для реакции между нитратом свинца (II) и йодидом калия на каждый моль образующегося йодида свинца (II) требуется два моля йодида калия.
\[\ce{Pb(NO3)2 (водн.) + 2 KI (водн.) → PbI2 (тв.) + 2 KNO3 (водн.)} \номер \] Например: 1,78 грамма нитрата свинца (II) растворено в 17,0 мл воды и затем смешивают с 25,0 мл 2,5 М раствора йодида калия. Что 9{-3}\: моли\: \times \left ( \frac{461\: граммы}{1\: моль} \right )=1,44\: граммы\: PbI_{2} \nonumber \]
Для определения концентрации нитрата калия в конечном растворе необходимо учесть, что на каждый моль PbI образуется два моля нитрата калия 2 , или стехиометрическое соотношение \[\left ( \frac{2\: моль\: KNO_{3}}{1\: моль\: PbI_{2}} \право ) \номер\]
Наш окончательный объем равен (17,0 + 25,0) = 42,0 мл, а концентрация нитрата калия рассчитывается как: 9{-3}\: моль\:PbI_{2}\раз \влево ( \frac{2\: моль\: KNO_{3}}{1\: моль\: PbI_{2}} \вправо )}{0,0420 \: L}=0,148\; родинки\; KNO_{3}/л\; или же\; 0,148\; М \номер \]
- Образец 12,7 г сульфата натрия (Na 2 SO 4 ) растворяют в 672 мл дистиллированной воды.

- Какова молярная концентрация сульфата натрия в растворе?
- Какова концентрация иона натрия в растворе?
- Сколько молей сульфата натрия нужно добавить к водному раствору, содержащему 2,0 моля хлорида бария, чтобы осадить 0,50 моля сульфата бария?
- Если 1,0 г NaN 3 реагирует с 25 мл 0,20 М NaNO 3 в соответствии с приведенной ниже реакцией, сколько молей N 2 (г) образуется?
\[5 NaN3(т) + NaNO3(водн.) → 3 Na2O(т) + 8 N2(г) \номер \]
Пол Р. Янг, профессор химии, Иллинойский университет в Чикаго, Wiki : Спроси Ботаника; PRYaskthenerd.com — pyounguic.edu; ChemistryOnline.com
Эта страница под названием 7.5: Solution Stoichiometry распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Полом Р. Янгом (ChemistryOnline.com) посредством исходного контента, который был отредактирован в соответствии со стилем и стандарты платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Пол Р. Янг
- Лицензия
- СС BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Метки
- нерастворимое соединение
- ограничивающий реагент
- источник@https://en.
 wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online
нитрат серебра | Фразы примера
Словарь > Примеры для нитрата серебра
нитрата серебра n’est pas encore dans le Dictionnaire Cambridge. Vous pouvez nous помощник!
Добавление по определению
Бронзовый трофей, покрытый серебром нитратом патиной, весит 102 фунта (42,3 кг) и имеет высоту 16 (42 см).
Extrait de
Википедия
Cet provient of Wikipedia and peut être reutilisé sous la license CC BY-SA.
Поваренная соль (хлорид натрия) в белковой эмульсии образует хлорид серебра при контакте с нитратом серебра .
Extrait de
Wikipedia
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
По мере впитывания изображения выпадает белый мутный осадок хлорида серебра из реакции 9.0073 серебро нитрат с хлором в воде.
Extrait de
Wikipedia
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
Его монументальные полотна создаются в темной комнате, где он работает с серебряной — нитратной /масляной краской.
Экстра
Википедия
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
При необходимости продукты амплификации дополнительно анализировали на 6 % полиакриламидном геле, окрашенном 0,1 % нитратом серебра .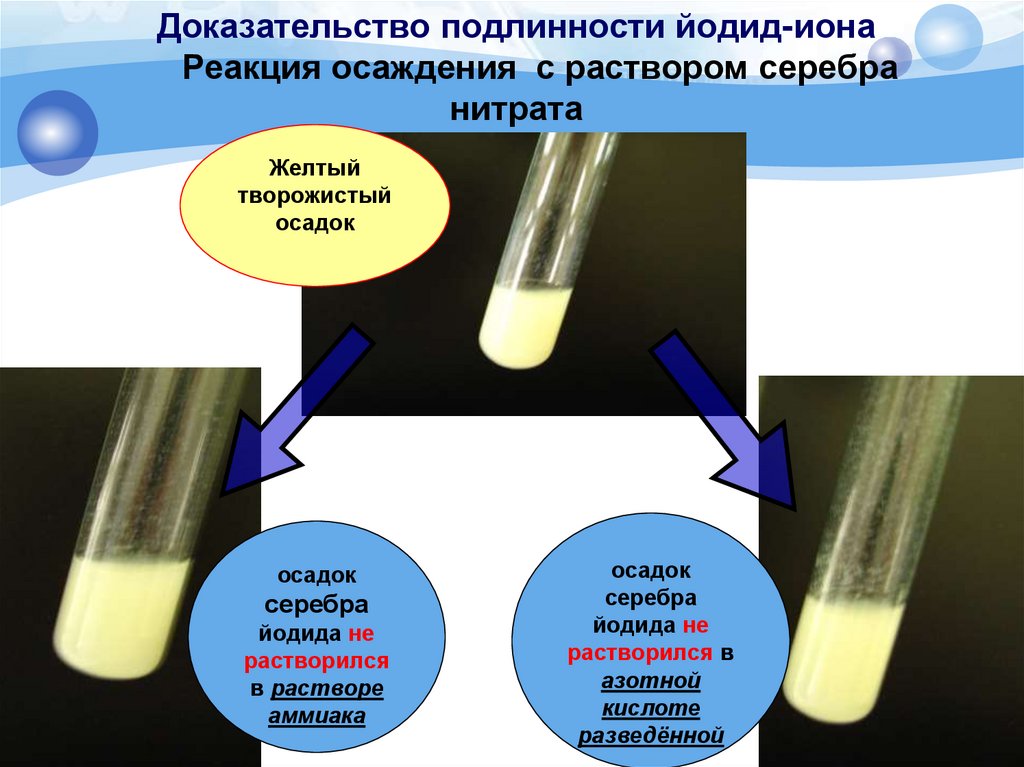
Extrait de Cambridge English Corpus
Выделившийся сероводород переносили в потоке азота до серебро нитрат улавливают и осаждают в виде сульфида серебра.
Extrait de Cambridge English Corpus
Предметное стекло погружали в альдегидно-дихроматную смесь, а затем в 1% нитрат серебра на несколько дней каждое.
Extrait de Cambridge English Corpus
Предметное стекло погружали в смесь альдегиддихромата, а затем в 1% нитрат серебра на несколько дней каждое.
Extrait de Cambridge English Corpus
Выделяющийся газообразный сероводород подавался в потоке азота в ловушку нитрата серебра и осаждался в виде сульфида серебра.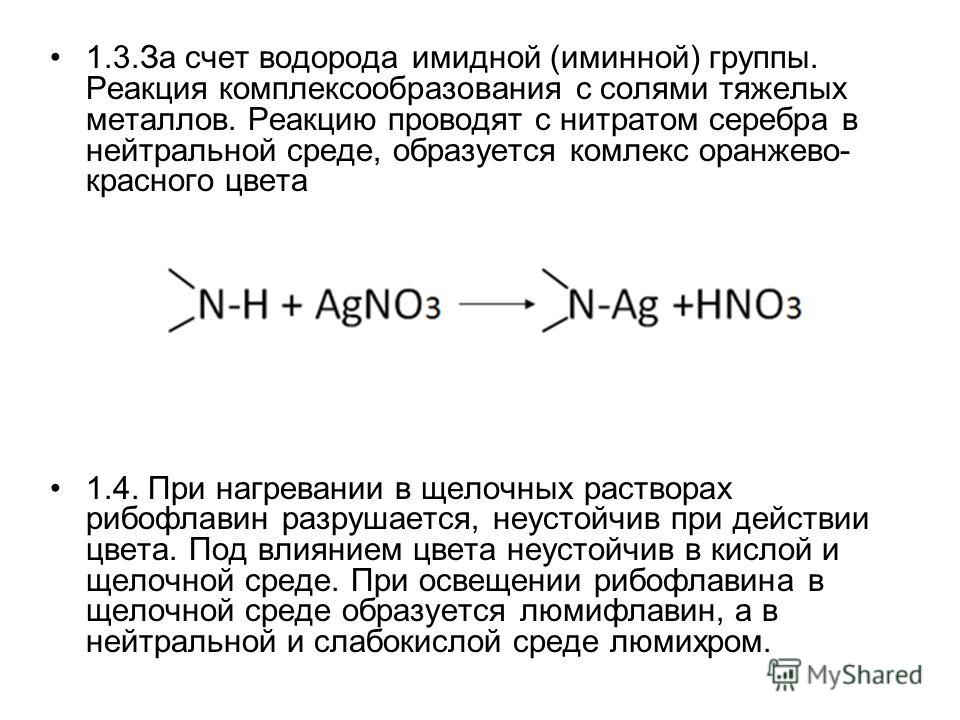
Extrait de Cambridge English Corpus
Выделившийся сероводород переносили в потоке азота в ловушку нитрата серебра и осаждали в виде сульфидов серебра.
Extrait de Cambridge English Corpus
Инструкция по производству «серебряного купороса» ( серебро нитрат ), однако содержат интересную деталь, указывающую на начало нового объяснения.
Extrait de Cambridge English Corpus
Вода в этом каноэ вступала в реакцию с солью при тестировании с серебром нитратом , хотя на вкус она не была соленой.
Extrait de Cambridge English Corpus
После фиксации в 10% уксусной кислоте и интенсивной промывки в дистиллированной воде гели окрашивали 0,1% нитратом серебра .
Extrait de Cambridge English Corpus
После тщательной промывки гель обрабатывали дитиотреитолом (0,5 мг на 100 мл) в течение 30 мин, а затем 0,1% водным раствором серебра нитрата 9.0074 (вес/объем).
Extrait de Cambridge English Corpus
Относительно дорогие вещества, такие как серебро нитрат , без которых не обойтись в аналитической химии, некоторым университетам не по карману.
Extrait de
Архив Hansard
Exemple tiré des archives de Hansard. Информационная парламентская лицензия Open Parliament License v3.0
С 1300 года художники начали использовать «серебряную морилку», которая была сделана из нитрата серебра .
Extrait de
Wikipedia
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
Более длинные наностержни (до соотношения сторон 25) могут быть получены в отсутствие серебро нитрат с использованием трехэтапной процедуры добавления.
Extrait de
Wikipedia
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
Это состояние легко лечится с помощью небольшой операции или нитрата серебра .
Экстра
Википедия
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
Добавление раствора нитрата серебра вызывает осаждение любых галогенидов в виде соответствующего галогенида серебра.
Extrait de
Wikipedia
Cet provient of Wikipedia et peut être reutilisé sous la license CC BY-SA.
Aucune мнение, exprimée данс ле примеров, ne reflète l’opinion де editeurs Кембриджского словаря, издательство Кембриджского университета или de ceux leur ayant уступить лицензию.
БЕТА
Добавлено определение
нитрата серебра, которое можно найти в Кембриджском словаре. Айдес-нус!
Грамматическая категория
Choisissez un nom, un verbe, etc.adjectifadverbeexclamationnomnombrepréfixesuffixverberbe
Определение
Кольцо
серебряный юбилей
положительная сторона
рынок серебра
Серебряная медаль
нитрат серебра БЕТА
серебряная бумага
столовое серебро
Серебряный Серфер
серебряная годовщина свадьбы
БЕТА
Aidez-nous à améliorer le Dictionnaire Cambridge
нитрат серебра без определения. Vous pouvez nous помощник!
Vous pouvez nous помощник!
Добавлено определение
Проверка словарного запаса с играми и изображениями
- {{randomImageQuizHook.copyright1}}
- {{randomImageQuizHook.copyright2}}
Credits image
Faites un jeu maintenant
Дневной день
бард
поэт
À ce sujet
Блог
Безграничная энергия и сила (язык энергии, часть 2)
Апрендре плюс
Nouveaux mots
Stealth Help
Encore plus de nouveau mots
Равновесие 15,5-лектуру Демонстрации-Университет химии-равновесия ›15,5
Равновное.
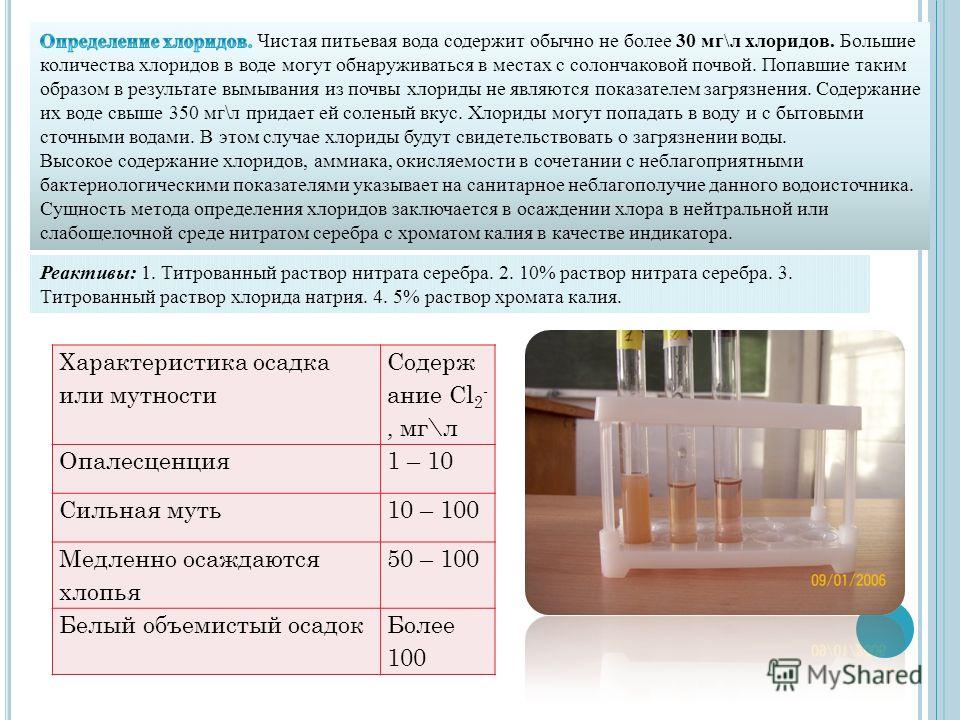 реакции, комплексные ионы, принцип Ле Шатлье
реакции, комплексные ионы, принцип Ле ШатльеОписание: Осадок хлорида серебра растворяется при добавлении прозрачной жидкости. Добавление второй прозрачной жидкости снова дает осадок.
Материалы (в шкафу — без корзины):
- 200 мл воды
- Стакан на 500 мл
- 10 мл 0,1 М нитрат серебра‡
- 30 мл 1,0 М хлорида натрия‡
- 35 мл 6,0 М водного раствора аммиака‡
- Уксусная кислота
- Мешалка
- Платформа для перемешивания*
- 2 мерных цилиндра (1 50 мл, 1 10 мл)
‡Решения находятся на полках с решениями. Аммиак и уксусная кислота находятся в шкафах под вытяжкой.
*Общий предмет: находится в верхнем ящике центральной скамьи напротив шкафов для хранения химикатов.
Предварительная подготовка:
1. Приготовить осадок хлорида серебра. Поместите 200 мл воды в химический стакан на 600 мл. Добавьте 10 мл 0,1 М нитрата серебра и 30 мл 1,0 хлорида натрия в химический стакан, чтобы образовался осадок.
Поместите 200 мл воды в химический стакан на 600 мл. Добавьте 10 мл 0,1 М нитрата серебра и 30 мл 1,0 хлорида натрия в химический стакан, чтобы образовался осадок.
Процедура:
1. Добавьте аммиак, чтобы растворить хлорид серебра и получить растворимый комплексный ион серебра и аммиака.
2. Предложите учащимся предположить, что произойдет при добавлении уксусной кислоты. Добавьте уксусную кислоту.
Обсуждение:
Этап 1 (этап перед классом): Добавление хлорида натрия к раствору нитрата серебра приводит к образованию осадка хлорида серебра.
AgNO 3 (водн.) -> Ag + (водн.) + NO 2 — (водн.)
AgNO 3 (водн.) + NaCl(водн.) –> AgCl(т) + NaNO 3 (водн.)
AgCl(т) <–> Ag + + + (водн.) (водн.) + Cl — (водн.) Ksp =1,8 x 10 -10
Стадия 2. При добавлении водного аммиака осадок хлорида серебра растворяется в пользу образования комплексного иона серебра и аммиака.
Ag + (водн.) + 2NH 3 (водн.) <–> [Ag(NH 3 ) 2+ ] (водн.) Kf = 1,6 x 10 7
Чистая реакция: AgCl(s) + 2NH 3 (водн.) <–> [Ag(NH 3 ) (водн.) + 1+ ] Cl — (водн.)
Knet = Ksp x Kf = (1,8 x 10 -10 )(1,6 x 10 7 ) = 2,9 x 10 -3
x 1 = = {[Ag(NH 3 ) 2+ ](Cl — )}/ [NH 3 ] 2Использование большой концентрации Nh4 приведет к образованию большой концентрации комплексного иона в растворе, поэтому растворимость хлорида серебра в водном растворе аммиака намного выше, чем в воде.
Стадия 3: Добавляют уксусную кислоту, возвращая реакцию обратно к реагенту, хлориду серебра, реформируя осадок.
[Ag(NH 3 ) 2 ] + (водн.) + Cl — + 2CH 3 CO 2 H(водн. ) 3 + 902Cl(т) CO 2 NH 4 (водн.)
) 3 + 902Cl(т) CO 2 NH 4 (водн.)
Принцип ЛеШатлье гласит, что система изменится, чтобы уменьшить или противодействовать последствиям изменения условий равновесия. В этом случае в раствор добавляли уксусную кислоту, нарушающую равновесие хлорида серебра и аммиака. Ионы ацетата реагируют с ионами аммиака с образованием ацетата аммония, увеличивая концентрацию ионов серебра, что приводит к общему ионному эффекту. Исключение аммиака и уксусной кислоты из уравнения дает исходное уравнение диссоциации хлорида серебра. Увеличение концентрации ионов серебра сдвигает реакцию влево, создавая более нерастворимый хлорид серебра.
AgCl(s) <–> Ag + (водн.) + Cl — (водн.)
Безопасность:
Нитрат серебра и его растворы, а также концентрированные растворы аммиака могут вызывать раздражение кожи и вызывать раздражение. горит. При выполнении этих экспериментов используйте надлежащее защитное снаряжение, включая перчатки и очки.
Каталожные номера:
1. Б.З. Шахашири; Химические демонстрации: Пособие для учителей химии ; Том 1; Висконсин; 1983 год; п. 307-313 (вариант)
2. Коц, Трейхель, Таунсенд. Химия и химическая реактивность, 7-е издание ; издание для учителей; Брукс/Коул; 2009
3. Л. Саммерлин, К. Боргфорд, Дж. Или; Химические демонстрации: справочник для учителей ; Том 2; 1987 год; п. 80 (более простая версия, производящая AgCl и [Ag(NH 3 ) 2 ] + только)
4. Prof. Fermann – вариант уксусной кислоты
Загрузить версию для печати
Металлацикл · Реакции осаждения
- Химия
- Водные растворы
- Реакции осаждения
Мы видели, что хотя многие ионные соли растворяются в воде, соли, характеризующиеся сильными ионными связями, не растворяются. Тогда мы можем задаться вопросом, что происходит, когда мы используем две отдельные соли для введения в раствор катиона и аниона, которые прочно связаны друг с другом. Катион и анион останутся в растворе? С точки зрения термодинамики ясно, что образование сильных ионных связей более чем компенсирует потерю ионно-дипольных взаимодействий вокруг каждого иона (именно это мы имеем в виду, когда говорим, что ионные связи «сильны»). В результате ионные связи будут образовываться спонтанно, и ионное твердое вещество будет выходить из раствора по мере того, как ионы объединяются в пары. Этот процесс противоположен растворению (буквально его термодинамическая противоположность), и он называется 9.0037 осадки .
Тогда мы можем задаться вопросом, что происходит, когда мы используем две отдельные соли для введения в раствор катиона и аниона, которые прочно связаны друг с другом. Катион и анион останутся в растворе? С точки зрения термодинамики ясно, что образование сильных ионных связей более чем компенсирует потерю ионно-дипольных взаимодействий вокруг каждого иона (именно это мы имеем в виду, когда говорим, что ионные связи «сильны»). В результате ионные связи будут образовываться спонтанно, и ионное твердое вещество будет выходить из раствора по мере того, как ионы объединяются в пары. Этот процесс противоположен растворению (буквально его термодинамическая противоположность), и он называется 9.0037 осадки .
Давайте кратко рассмотрим пример реакции осаждения. Нитрат серебра (AgNO 3 ) растворим в воде — в конце концов, это нитрат. Хлорид натрия (NaCl), разумеется, также растворим в воде. Однако при смешивании водного раствора азотнокислого серебра с раствором хлорида натрия из воды выпадает серое твердое вещество или осадок .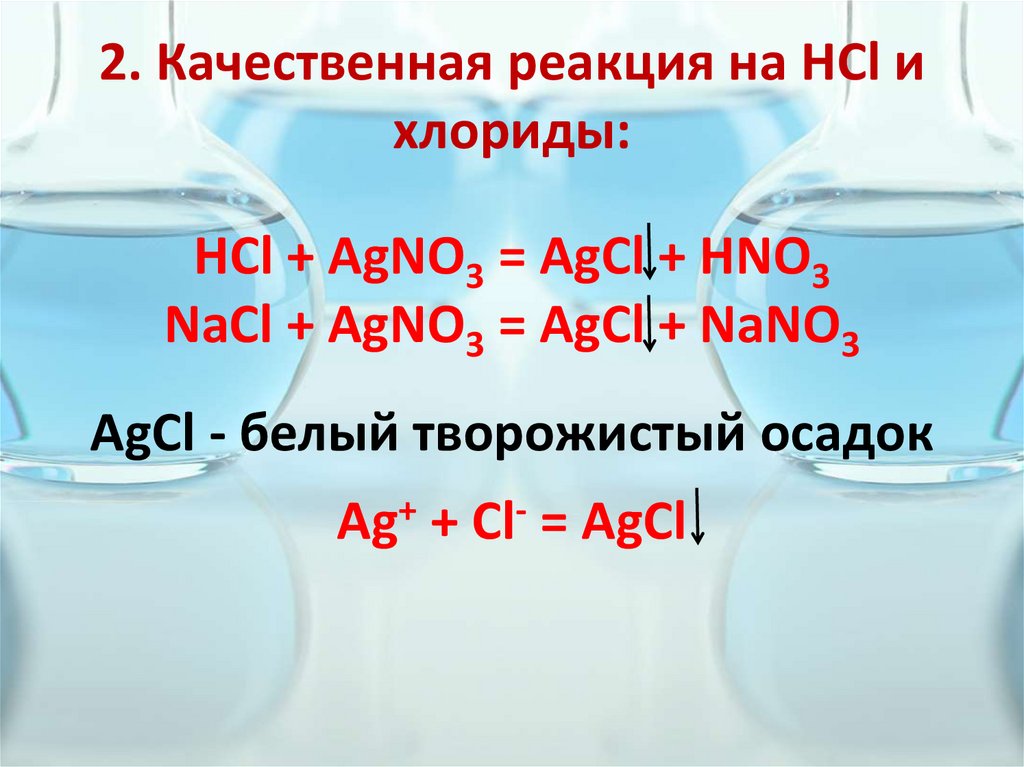 Это твердое вещество представляет собой хлорид серебра, соль, нерастворимую в самой воде. Обратите внимание, что сочетание соли серебра и соли хлорида в воде позволяет ионам серебра и хлорида образовывать пары. Они делают это спонтанно, потому что энергия, высвобождаемая при образовании ионной связи, больше, чем энергия, необходимая для разрушения сольватации.
Это твердое вещество представляет собой хлорид серебра, соль, нерастворимую в самой воде. Обратите внимание, что сочетание соли серебра и соли хлорида в воде позволяет ионам серебра и хлорида образовывать пары. Они делают это спонтанно, потому что энергия, высвобождаемая при образовании ионной связи, больше, чем энергия, необходимая для разрушения сольватации.
Обратите внимание, что противоионы серебра и хлорида, катион натрия и нитрат-анион остаются в растворе. Согласно правилам растворимости нитрат натрия является растворимой солью, поэтому следует ожидать, что он останется в растворе.
Прогнозирование результата смешивания двух растворов солей
Правила растворимости являются мощным инструментом, когда речь идет о реакциях осаждения. Соли, нерастворимые согласно правилам, выпадут в осадок из раствора, когда в нем присутствуют и катион, и анион. Следовательно, чтобы определить результаты потенциальной реакции осаждения, нам необходимо выполнить два шага.
- Запишите две новые соли, образованные из комбинаций реагирующих ионов.

- Подчините новые соли правилам растворимости, чтобы определить растворимость каждой из них в воде.
Рассмотрим комбинацию в водном растворе нитрата бария Ba(NO 3 ) 2 и сульфата лития Li 2 SO 4 . Чтобы записать новые соли, которые могут образоваться из этих реагентов, мы просто обмениваем катионы или анионы, стараясь сбалансировать заряды. Возможными солями в данном случае являются BaSO 4 и LiNO 3 (ионы Ba 2+ , Li + , NO 3 – , SO 4 0 2–9). Нитрат лития представляет собой соль катиона группы 1 с хорошо растворимым нитратным анионом и хорошо растворим в воде. Сульфат бария, напротив, нерастворим (см. правило 4). Таким образом, можно предсказать, что сульфат бария выпадет из раствора в осадок, а катионы лития и нитрат-анионы останутся в растворе.
Написание уравнений для осадков
Существует несколько различных способов записи уравнений осадков, каждый из которых имеет свои преимущества и недостатки. -}(aq) \rightarrow \mathrm{AgBr}(s)$$ 9-}(aq) \rightarrow \mathrm{PbI_2}(s)$$
-}(aq) \rightarrow \mathrm{AgBr}(s)$$ 9-}(aq) \rightarrow \mathrm{PbI_2}(s)$$
← Назад
Что такое теплота осадков?
by Veerendra
Что такое тепло осадков?
Теплота осаждения:
- Когда два водных раствора сливаются вместе и образуется осадок, эта реакция называется реакцией осаждения или двойным разложением. Эта реакция используется для получения нерастворимых солей.
- Теплота, выделяемая в реакции осаждения, называется теплотой осаждения.
- Теплота осаждения представляет собой изменение теплоты, когда один моль осадка образуется из его ионов в водном растворе при стандартных условиях.
Некоторые примеры реакций осаждения:
- При добавлении раствора хлорида бария к раствору сульфата натрия образуется белый осадок сульфата бария.
BaCl 2 (водн. ) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.)
) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.)
Ba 2+ (водн.) + SO 4 (водн.) → BaSO 4 (тв.) - При добавлении раствора нитрата серебра к соляной кислоте образуется белый осадок хлорида серебра.
AgNO 3 (водн.) + HCl (водн.) → AgCl (тв.) + HNO 3 (водн.)
Ag + (водн.) + Cl – (водн.) → AgCl (тв.) - Когда раствор нитрата свинца(II) добавляют к раствору иодида калия, выпадает желтый осадок – иодид свинца(II).
Pb(NO 3 ) 2 (вод) + 2KI(вод) → PbI 2 + 2KNO 3 (вод)
Pb 2+ (вод) → 61 – 906 (вод) + 2I 906 906 PbI 2 (s)
Люди также спрашивают
- Как энергия может быть изменена в химической реакции?
- Как диаграмма уровней энергии показывает, что эта реакция является экзотермической?
- Что такое энтальпия реакции?
- Что такое теплота смещения?
- Что такое энтальпия нейтрализации?
- Что такое теплота сгорания?
- Почему при образовании связи выделяется энергия?
- Применение экзотермических и эндотермических реакций в быту
- Что понимается под теплотворной способностью топлива?
Цель: Определить теплоту осаждения хлорида серебра.
Материалы: 0,5 моль дм -3 раствор азотнокислого серебра, 0,5 моль дм -3 раствор хлорида натрия.
Аппаратура: Термометр, пластиковые чашки с крышками, 50 см 3 мерные цилиндры.
Осторожно:
Сложите два раствора как можно быстрее.
Перемешивайте смесь на протяжении всего занятия.
Меры безопасности:
Обращайтесь с химикатами с осторожностью. Носите защиту для глаз.
Раствор нитрата серебра может оставить темные пятна на коже и одежде.
Процедура:
- 20 см 3 0,5 моль дм -3 раствор нитрата серебра отмеряют и наливают в пластиковый стаканчик.
- Начальная температура раствора нитрата серебра измеряется через несколько минут.
- 20 см 3 0,5 моль дм -3 раствор натрия хлорида мерный.
- Начальная температура раствора хлорида натрия измеряется через несколько минут.

- Раствор хлорида натрия быстро и осторожно добавляют к раствору нитрата серебра. Смесь перемешивают термометром.
- Измеряется и регистрируется самая высокая температура реагирующей смеси.
Результаты:
Интерпретация данных:
Обсуждение:
- При добавлении осадка образуется раствор белого хлорида натрия и нитрата серебра. Осадок представляет собой хлорид серебра.
- Химическое уравнение реакции:
AgNO 3 (водн.) + NaCl (водн.) → AgCl(s) + NaNO 3 (водн.) - Ионное уравнение реакции:
Ag + (водн.) + Cl – (водн.) → AgCl(s) - Термохимическое уравнение осаждения хлорида серебра:
AgNO 3 (водн.) + NaCl (водн.) → AgCl(т) + NaNO 3 (водн.) ΔH = -0,1 y кДж моль -1
или
Ag + (9060 Cl) – (водн.) → AgCl(s) ΔH = -0,1 y кДж моль -1 - Диаграмма уровней энергии для осаждения хлорида серебра:
- Теоретическое значение теплоты осаждения хлорида серебра составляет -65,5 кДж моль -1 .

- Значение теплоты осаждения хлорида серебра, полученное в результате этой деятельности, всегда меньше теоретического значения. Это связано с тем, что при расчете теоретического значения теплоты осадков предполагается, что тепло не передается в окружающую среду, а пластиковый стаканчик не поглощает тепло.
- Ниже приведены некоторые меры предосторожности, которые необходимо соблюдать при выполнении этой операции.
(a) Два раствора быстро смешивают, чтобы избежать слишком больших потерь тепла в окружающую среду.
(b) Используется пластиковый стаканчик, потому что пластик является хорошим теплоизолятором. Это уменьшит потери тепла в окружающую среду.
(c) Начальные температуры раствора нитрата серебра и раствора хлорида натрия измеряются через несколько минут, чтобы растворы достигли однородной температуры.
(d) Реакционную смесь медленно перемешивают на протяжении всего действия, чтобы обеспечить постоянство температуры смеси.
e) Следует наблюдать за показаниями термометра до тех пор, пока не будет зафиксирована самая высокая температура.
- Если действие повторить с использованием удвоенного объема раствора нитрата серебра и раствора хлорида натрия, но той же концентрации, изменение температуры будет таким же. Это происходит потому, что:
(а) Когда объемы обоих реагентов удваиваются, число молей обоих реагентов также удваивается. Это удваивает теплоотдачу, 2H.
(b) Масса раствора также удвоена, 2m.
(c) Тепловое изменение, H = mcθ
Когда объемы обоих реагентов удвоены, тепловое изменение, 2H = 2mcθ.
Сокращение числа 2 в обеих частях уравнения дает H = mcθ.
Таким образом, θ остается прежним.
Если раствор хлорида натрия заменить соляной кислотой той же концентрации, теплота осаждения останется прежней. Это связано с тем, что и раствор хлорида натрия, и соляная кислота обеспечивают одинаковое количество ионов хлорида. Ионы натрия, Na + и ионы водорода, H + — ионы-спектаторы. В реакции участвуют ионы Ag + и ионы Cl – .
Вывод:
Теплота осаждения хлорида серебра -0,1 y кДж моль -1 .
1. 50 см 3 0,5 моль дм -3 раствор азотнокислого серебра при 29,5°С 6 60 см 3 90 добавляют к 50 см 90 моль дм -3 раствор хлорида калия, находящийся при температуре 28,5°С. Смесь перемешивают, и максимальная достигнутая температура составляет 32,0°С. Рассчитайте теплоту осаждения хлорида серебра.
[Удельная теплоемкость раствора: 4,2 Дж г -1 °C -1 . Плотность раствора: 1 г см -3 ]
Раствор:
2. Термохимическое уравнение осаждения сульфата свинца(II) приведено ниже.
Pb 2+ (водн.) + SO 4 2- (водн.) → PbSO 4 (т) ΔH = -50,4 кДж ) раствор нитрата прибавляют к 100 см 3 0,5 моль дм -3 раствора сульфата натрия, сульфат свинца(II) осаждается. Как изменится температура реагирующей смеси в опыте?
[Удельная теплоемкость раствора = 4,2 Дж г -1 °C -1 . Плотность раствора = 1 г см -3 ]
Плотность раствора = 1 г см -3 ]
Решение:
3. , когда 50 см 3 из 2,0 моль -3 Свидец (II) раствор нитрата DM. -3 раствор сульфата калия, наблюдается повышение температуры на 10°C.
Как изменится температура, если
(а) 100 см 3 2,0 моль дм -3 раствор нитрата свинца(II) добавить к 100 см ?
(b) 50 см 3 1,0 моль дм -3 раствор нитрата свинца(II) добавляют к 50 см 3 1,0 моль дм -3 раствор сульфата калия?
(c) 50 см 3 2,0 моль дм -3 раствор нитрата свинца(II) добавляют к 50 см 3 1,0 моль дм -3 раствор сульфата калия?
(d) 50 см 3 2,0 моль дм -3 раствор сульфата калия заменен на 50 см 3 2,0 моль дм -3 раствор сульфата натрия?
Решение:
(a) Объемы обоих реагентов удвоены.
По расчету:
При использовании 50 см 3 2,0 моль дм -3 раствора нитрата свинца(II) и 50 см 3 2,0 моль дм -3 раствора сульфата калия 92, При использовании 100 см 3 2,0 моль дм -3 раствора нитрата свинца(II) и 100 см 3 2,0 моль дм -3 раствора сульфата калия,
По вычету:
Когда объемы обоих реагентов удваиваются, число молей обоих реагентов также удваивается. Это удваивает теплоотдачу, 2H.
Масса раствора тоже удвоена, 2т.
(b) Концентрация обоих реагентов уменьшается вдвое.
По расчету:
При использовании 50 см 3 1,0 моль дм -3 раствора нитрата свинца(II) и 50 см 3 1,0 моль днр 3 раствора сульфата калия,
Вычитанием:
Когда концентрации обоих реагентов уменьшаются вдвое, количество молей обоих реагентов также уменьшается вдвое.
(c) Концентрация раствора сульфата калия уменьшена вдвое. При использовании 50 см 3 2,0 моль дм -3 раствора нитрата свинца(II) и 50 см 3 1,0 моль дм -3 раствора сульфата калия
сульфат калия, таким образом, лимитирующим веществом является расчет основан на 0,05 моль SO 4 2- ионы.
Так как число молей вещества уменьшилось вдвое, то и произведенное тепло также уменьшилось вдвое.
Масса раствора та же, поэтому
(г) 50 см 3 2,0 моль дм -3 раствора сульфата калия заменяется на 50 см 3 6м 60 09 моль дм раствор сульфата натрия.
Эта реакция включает реакцию между ионами свинца (II) и ионами сульфата с образованием сульфата свинца (II), как показано ниже.
Pb 2+ (водн.) + SO 4 2- (водн.) → PbSO 4 (тв.)
Как раствор сульфата калия, так и раствор сульфата натрия содержат одинаковое количество молей сульфат-ионов.

 1.1 Калия бромат РО
1.1 Калия бромат РО 2.15 0,5 М (1 н.) раствор йода
2.15 0,5 М (1 н.) раствор йода 34 0,001 М раствор калия йодида
34 0,001 М раствор калия йодида 2.55 0,005 М раствор натрия тиосульфата
2.55 0,005 М раствор натрия тиосульфата 2.75 0,1 М раствор хлористоводородной кислоты спиртовой
2.75 0,1 М раствор хлористоводородной кислоты спиртовой ) + AgNO3 (водн.) -> NaNO3 (водн.) + AgCl (тв.) v}$$
) + AgNO3 (водн.) -> NaNO3 (водн.) + AgCl (тв.) v}$$
 wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online
 ) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.)
) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.) 

