Горение серы в кислороде — Справочник химика 21
Из уравнения реакции горения серы в кислороде [c.91]Опыт 32. Горение серы в кислороде [c.28]
На железную ложечку насыпать немного серного цвета или положить небольшой кусочек комовой серы, расплавить ее вскоре расплавленная сера загорается и горит на воздухе голубым пламенем. Ложечку с горящей серой внести в банку с кислородом. Наблюдать реакцию горения серы в кислороде. [c.23]
Запись данных опыта. Написать уравнения реакций горения серы в кислороде и взаимодействия полученного окисла серы с водой. К какому типу окислов следует отнести полученный окисел серы [c.127]
Выполнение работы. На маленькую железную ложечку взять кусочек серы величиной с рисовое зерно, нагреть слегка на горелке, открыть пробирку с кислородом и внести в нее ложечку с серой. После того как горение серы прекратится, вынуть ложечку и, закрыв пробирку пробкой, взболтать ее содержимое.
ГОРЕНИЕ СЕРЫ В КИСЛОРОДЕ [c.16]
Опыт 4. Горение серы в кислороде. Подожженный на воздухе кусочек серы вносят на ложечке в кислород. Она горит в нем ярким синеватым пламенем. [c.103]
Определить теоретическую температуру горения серы в кислороде. [c.156]
Горение серы в кислороде протекает при 280 °С, а на воздухе — при 360 °С. При этом образуется смесь 802 и 80з. Таким [c.181]
Горение серы в кислороде протекает при 280 С, а на воздухе — при 360 С. При этом образуется преимущественно 802- Таким образом, в соединениях с металлами и с водородом сера проявляет степень окисления —2, а в соединениях с кислородом + 4 и +6.
Горение веществ в кислороде. Опыт 6. При помощи прибора, изображенного на рис. 46, наполняют кислородом склянку объемом 500 мл. Под водой закрывают склянку пробкой, после этого переносят ее в вытяжной шкаф. При помощи железной ложечки вносят в склянку с кислородом небольшое количество зажженной на воздухе серы наблюдают горение серы в кислороде. После того как сера сгорит, вливают в склянку несколько миллилитров раствора лакмуса или метилового оранжевого, наблюдают изменение окраски индикатора. [c.193]
Сера тоже образует два окисла двуокись серы (сернистый газ) ЗОг и трехокись серы (серный ангидрид) 50з. Сернистый газ образуется при горении серы в кислороде или на воздухе. Серный ангидрид получают окислением сернистого газа в присутствии катализаторов (Р1 или У20а). Этот метод применяется в промышленном производстве серной кислоты контактным способом.
Горение серы — Справочник химика 21
Первый способ. Тепловой эффект реакции горения сероводорода равен сумме тепловых эффектов реакций разложения сероводорода, горения серы и водорода. Тепловой эффект реакции разложения сероводорода равен тепловому эффекту реакции образования сероводорода, взятому с противоположным знаком (см. табл. 6 приложения) [c.183]
Тепловой эффект реакции горения сероводорода равен сумме тепловых эффектов реакций разложения сероводорода, горения серы и водорода. Тепловой эффект реакции разложения сероводорода равен тепловому эффекту реакции образования сероводорода, взятому с противоположным знаком (см. табл. 6 приложения) [c.183] Опыт 32. Горение серы в кислороде [c.28]
Из уравнения реакции горения серы в кислороде [c.91]
Как изменится скорость реакции горения серы, если уменьшить объем системы в 3 раза [c.60]
Пример 10. Определить теоретическую температуру горения серы в во-здухе [c.140]
ГОРЕНИЕ СЕРЫ В КИСЛОРОДЕ [c.16]
Метод сжигания. Этот метод применяется при анализе многих материалов. Серу в каменном угле определяют путем спекания навески угля со смесью из окиси магния или окиси цинка с небольшим количеством (от / до Уз по отношению к 2пО или М О) углекислого натрия. Тугоплавкая окись магния (или окись цинка) играет роль колосников , обеспечивая доступ воздуха к частицам угля углекислый натрий поглощает образующийся при горении серы сернистый газ и, кроме того, способствует дальнейшему окислению Ыа ЗО, до Ыа ЗО . Применяется также метод сжигания в стальной калориметрической бомбе в атмосфере кислорода под давлением.
Тугоплавкая окись магния (или окись цинка) играет роль колосников , обеспечивая доступ воздуха к частицам угля углекислый натрий поглощает образующийся при горении серы сернистый газ и, кроме того, способствует дальнейшему окислению Ыа ЗО, до Ыа ЗО . Применяется также метод сжигания в стальной калориметрической бомбе в атмосфере кислорода под давлением.
Гетерогенное горение — это горение жидких и твердых горючих материалов в среде газового окислителя. К гетерогенному горению в печах относится горение серы, фосфора, мазута, антрацита, кокса и т. д. [c.35]
Горение серы в кислороде протекает при 280 С, а на воздухе — при 360 С. При этом образуется преимущественно 802- Таким образом, в соединениях с металлами и с водородом сера проявляет степень окисления —2, а в соединениях с кислородом + 4 и +6. [c.202]
Константа скорости к зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ. Закон действующих масс применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют и твердые вещества, концентрация которых постоянна, то скорость реакции изменяется в зависимости от концентраций газов или растворенных веществ. Например, скорость реакции горения серы (5 -Ь = = 502) пропорциональна только концентрации кислорода и = = /с[02]. [c.81]
Закон действующих масс применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют и твердые вещества, концентрация которых постоянна, то скорость реакции изменяется в зависимости от концентраций газов или растворенных веществ. Например, скорость реакции горения серы (5 -Ь = = 502) пропорциональна только концентрации кислорода и = = /с[02]. [c.81]
При сжигании серы в циклонной печи достигается постоянная концентрация сернистого газа, простое регулирование процесса горения серы и его автоматизация. [c.61]
Горение серы в кислороде протекает при 280 °С, а на воздухе — при 360 °С. При этом образуется смесь 802 и 80з. Таким [c.181]
Сложность заключается еще и в том, что на процесс горения серы оказывает существенное влияние печная среда, состоящая из серы, кислорода, азота, паров воды, обжиговых газов. Движение газового потока в печи осложняется теплообменными н физико-химическими явлениями из-за наличия в системе источников газообразования и тепловыделения.
Решение. Процесс горения серы описывается уравнением 5 + О2 = 50г. Производительность печи 60-10 /24 = 2500 кг/ч. Масса серы [c.12]
На 100 кг обжигаемого колчедана выделится тепла за счет горения серы [c.50]
Горение серы представляет гомогенную экзотермическую реакцию, которой предшествует процесс перехода твердой серы в жидкое состояние и ее последуюш ее испарение [c.175]
Опыт 10. Наполнить сосуд кислородом, закрыть его пробкой и перенести в вытяжной шкаф. При помощи железной ложечки внести в сосуд с кислородом небольшое количество зажженной на воздухе серы. После прекращения горения серы влить в сосуд несколько капель раствора лакмуса. Что наблюдается [c.138]
Опыт 245. Горение серы и фосфора в оксиде азота (II) [c. 136]
136]
Аналогичные опыты можно провести, взяв вместо фосфора серу, уголь. Как доказать, что при горении серы образуется 302, а не ЗОз [c.56]
Изучение окислительно-восстановительных свойств простых веществ. 6. (Работать под тягой ) В железной ложечке нагревают пламенем горелки немного порошка серы до ее воспламенения. Ложечку с горящей серой вносят в цилиндр, содержащий 10—15 мл воды. По окончании горения серы ложечку вынимают, взбалтывают воду в цилиндре и закрывают его часовым стеклом или пробкой. Раствор в цилиндре оставляют для теста 13. [c.186]
Задача б. Как зависит скорость горения серы от давления кислорода Решение. Запишем уравнение реакции горения серы [c.123]
Еще раньше Хейман наблюдал, что при медленном горении серы, сопровождающемся слабой фосфоресценцией, образуется характерный пахнущий камфарой газ, который Хейман принимал за 80. Позднее В. И. Кондратьев (1930) в спектре пламени серы обнаружил полосы оксида серы (П).
Реакция горения серы [c.183]
Отсюда следует, что скорость горения серы будет прямо пропорциональна давлению кислорода. [c.123]
Дезинфекция жилищ сернистым газом практиковалась еще очень давно. Любопытно даваемое этому объяснение, которое приводит в своей книге Плиний (1 I доп. 9) Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу . [c.329]
Оксид азота (1) N2O является сильным окислителем. Закончить уравнения реакций горения серы, фосфора и водорода в N2O [c.241]
Таким образом, найденная выше температура горения серы в воздухе /млкс. ( 1240 » С) является действительно тео )сти 1е-ской температурой горения, выше которой она при данных условиях быть не может. Максимальная теоретическая температура горения получается тогда, когда реагирующие компонент1л находятся в стехиометрическом соотношении. [c.142]
[c.142]
Решение. Записываем термохимическое уравнение реакции горения серы [c.135]
Верхний свод печи экранирован. Экранирование свода трубами, по которым течет вода, необходимо для более интенсивной работы печИд что достигается отнятием части тепла, выделяющегося при реакции горения серы, т. е. позволяет работать при более низких температурах обжига, но с более высокой нагрузкой. Следует отметить, что удельная тепловая нагрузка таких экранов меньше, чем в печах с кипящим слоем.
Двухкамерные печи снижают энергетические затраты за счет уменьшения аэродинамического сопротивления печи, представляют возможности работы с предельно низким избытком воздуха, имеют большой диапазон регулирования производительности по сжигаемой сере и т. д. Печи состоят из цилиндрического корпуса с двойной стальной обшивкой, футерованной огнеупорным кирпичом, и аэро-механического пережима. В кольцевое пространство, образованное наружным и внутренними кожухами, поступает воздух, подаваемый на горение серы и охлаждение наружного кожуха печи. Воздух па горение поступает в реакционную камеру через тангенциальные сопла и осевой закручиваемый аппарат с регистром, расположенным в торцевой стенке нечи. Для обеспечения постоянства выходных скоростей воздуха при работе на сниженных нагрузках каждое [c.58]
Воздух па горение поступает в реакционную камеру через тангенциальные сопла и осевой закручиваемый аппарат с регистром, расположенным в торцевой стенке нечи. Для обеспечения постоянства выходных скоростей воздуха при работе на сниженных нагрузках каждое [c.58]
В вихровом потоке у торцевой станки однокамерной печи происходит газификация и частичное сгорание серы. Основной процесс горения серы происходит в объеме реакционной камеры перед пережимом. [c.60]
Тепло, выделяющееся при горении серы, вычисляем иа осиоиа-нии теплового эффекта реакции [c.60]
Для сжигания серы используют печи форсуночного и циклонного типов. В форсуночных печах расплавленная сера распыляется в камере сгорания сжатым воздухом через форсунки, которые не могут обеспечить достаточно полного перемешивания паров серы с воздухом и необходимой скорости горения. В циклонных печах, работаюш их по принципу центробежных пылеуловителей (циклонов), достигается значительно лучшее смешение компонентор и обеспечивается высокая интенсивность процесса горения серы. [c.175]
[c.175]
Диоксид серы (сернистый газ) получается при горении серы, при обжиге сульфидов, при восстановлении серной кислоты. Это — бесцветный газ ( кип = —37°С), с резким запахом, сопровождающим горение серы, менее токсичен, чем сероводород, хорощо растворим в воде (40 об. в 1 об. Н2О). Водный раствор ЗОг назы-вaeteя сернистой кислотой, которая не существует в свободном виде. В растворе молекулы ЗО2 занимают полости между молекулами воды, увеличивая поляризацию связей О—Н, в результате чего раствор приобретает кислый характер [c.244]
8 класс. Химия. Химические свойства кислорода — Химические свойства кислорода
Комментарии преподавателяТепловой эффект химической реакции
Кислород поддерживает процессы дыхания и горения. В кислороде горят многие неметаллы. Например, уголь горит на воздухе, взаимодействуя при этом с кислородом. В результате этой реакции образуется углекислый газ и выделяется теплота. Из курса физики вы знаете, что теплота обозначается буквой «Q». Если в результате реакции теплота выделяется, то в уравнении пишут «+Q», если поглощается – то «-Q».
В результате этой реакции образуется углекислый газ и выделяется теплота. Из курса физики вы знаете, что теплота обозначается буквой «Q». Если в результате реакции теплота выделяется, то в уравнении пишут «+Q», если поглощается – то «-Q».
Теплота, которая выделяется или поглощается в ходе химической реакции, называется тепловым эффектом химической реакции.
Реакции, протекающие с выделением теплоты, называются экзотермическими.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
Запишем уравнение реакции горения угля на воздухе:
С + О2 = СО2 + Q
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе. То есть, скорость горения угля в кислороде выше, чем на воздухе.
Рис. 1. Горение угля в кислороде
Сера тоже горит на воздухе, при этом также выделяется теплота. Значит, реакцию взаимодействия серы с кислородом можно назвать экзотермической. В чистом кислороде сера сгорает быстрее, чем на воздухе.
В чистом кислороде сера сгорает быстрее, чем на воздухе.
Запишем уравнение реакции горения серы в кислороде, если при этом образуется оксид серы (IV):
S + O2 = SO2 + Q
Рис. 2. Горение серы в кислороде
Аналогично, можно провести реакцию горения фосфора на воздухе или в кислороде. Эта реакция также является экзотермической. Запишем ее уравнение, если в результате образуется оксид фосфора (V):
4Р + 5О2 = 2Р2О5 + Q
Рис. 3. Горение фосфора в кислороде
В атмосфере кислорода могут гореть некоторые металлы. Например, железо сгорает в кислороде с образованием железной окалины:
3Fe + 2O2 = Fe3O4 +Q
Рис. 4. Горение железа в кислороде
А вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II):
2Cu + O2 = 2CuO
Кислород способен реагировать не только с простыми, но и со сложными веществами.
Природный газ метан сгорает в кислороде с образованием оксида углерода (IV) и воды:
Ch5 + 2O2 = CO2 + 2h3O + Q
При неполном сгорании метана (в условиях недостаточного количества кислорода) образуется не углекислый, а угарный газ СО. Угарный газ – ядовитое вещество, чрезвычайно опасное для человека, т.к. человек не ощущает его отравляющего действия, а медленно засыпает с потерей сознания.
Угарный газ – ядовитое вещество, чрезвычайно опасное для человека, т.к. человек не ощущает его отравляющего действия, а медленно засыпает с потерей сознания.
Реакции простых и сложных веществ с кислородом называют окислением. При взаимодействии простых и сложных веществ с кислородом, как правило, образуются сложные вещества, состоящие из двух элементов, одним из которых является кислород. Эти вещества называются оксидами.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/himicheskie-svoystva-kisloroda
источник видео — http://www.youtube.com/watch?v=YW-YKCEqIKc
источник видео — http://www.youtube.com/watch?v=akuWJiPcxb8
источник прпезентации — http://ppt4web.ru/khimija/kislorod2.html
http://www.youtube.com/watch?v=3e8JIsERnCQ
http://himege. ru/kislorod-xarakteristika-elementa-svojstva/
ru/kislorod-xarakteristika-elementa-svojstva/
http://www.myshared.ru/slide/379773/#
http://infourok.ru/himicheskie_svoystva_kisloroda_prezentaciya_dlya_8_klassa-534446.htm
http://900igr.net/zip/khimija/KHarakteristika-elementa-kisloroda.html
Процесс горения. Практическая работа №2/Демонстрация «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
Краткосрочный план
урока по химии в 7 классе
Предмет: Химия | Школа: КГУ «Весёловская средняя общеобразовательная школа» | |||||
Дата: | Имя учителя: Зимина Л. | |||||
Класс: 7 кл | Количество отсутствующих: присутствующих: | |||||
Раздел 7.2В Воздух. Реакция горения Тема урока: Процесс горения. Практическая работа №2/Демонстрация «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде» | ||||||
Цели обучения, которые помогает достичь данный урок | 7.3.1.4 -знать условия горения вещества и продукты реакции горения 7.3.1.5 -приводить примеры легковоспламеняющихся, горючих и негорючих веществ 7.3.1.6 -понимать, что вещества лучше горят в чистом кислороде, чем на воздухе 7.3.1.7 — знать, что при горении металлов и неметаллов образуются оксиды | |||||
Цели урока | Учащиеся будут: Знать условия возникновения и прекращения горения, продукты реакции Уметь объяснять понятия «горение», «медленное окисление», «температура воспламенения» Уметь приводить примеры легковоспламеняющихся, горючих негорючих веществ. Уметь записывать уравнения реакций взаимодействия кислорода с простыми веществами Уметь ставить цели, выдвигать гипотезы, анализировать опыты, описывать результаты наблюдений, делать самостоятельно выводы на основе наблюдений. Уметь работать в группах | |||||
Критерии оценки | Все учащиеся смогут: | |||||
Объяснять необходимость присутствия сторон «треугольника огня» для горения Уметь объяснять понятия «горение», «медленное окисление», «температура воспламенения» Уметь записывать уравнения реакций взаимодействия кислорода с простыми веществами, называть продукты реакции Наблюдать опыты и записывать наблюдения | ||||||
Большинство учащихся смогут: | ||||||
Уметь ставить цели, анализировать опыты, описывать результаты наблюдений | ||||||
Некоторые учащиеся смогут: | ||||||
Выдвигать гипотезы, делать самостоятельно выводы на основе наблюдений, грамотно оформлять результаты исследования | ||||||
Языковые цели цел | Учащиеся могут: Читать и выделять основную информацию, правильно понимать текст и устную речь учителя, обмениваться мнениями друг с другом, рассказывать об условиях возникновения и прекращения реакции горения, продуктах реакции горения, записывать уравнения реакций, представлять отчет по практической работе в виде таблицы. Предметная лексика и терминология: реакция горения, окисление, оксиды Серия полезных фраз: Наши наблюдения показали, что на воздухе горение протекает менее интенсивно, чем в кислороде потому что … Для поддержания огня необходимы три условия… | |||||
Привитие ценностей | Ответственность, сотрудничество в процессе совместной деятельности при изучении материала, выполнении практических заданий; национальная безопасность и участие страны в решении всемирных, региональных проблем с глобальной точки зрения. | |||||
Межпредметная связь | Предусмотрены внутрипредметные и межпредметные связи с естествознанием, экологией | |||||
Предыдущее обучение | Учащиеся знакомы с понятием воздух, состав воздуха, простые и сложные вещества, физические и химические явления | |||||
Ход урока | ||||||
Запланированные сроки | Запланированные мероприятия (Деятельность учителя и учащихся) | Ресурсы | ||||
Начало урока 10 мин | (3 мин) Организационный момент Психологический настрой. Деление на группы Прием «Тематическая карточка» Учащиеся выбирают карточку с формулой простого или сложного вещества, примером физического или химического явления, далее определяют ее принадлежность к одной из групп классификаций. Делятся на группы, рассаживаются. (2мин) Побуждение Прием «Удивляй» На доске представлена картина «Прометей, несущий людям огонь» Если учащиеся затрудняются с ответом, учитель зачитывает отрывок из поэмы Эсхила «Прикованный Прометей» «…Огонь Я смертным дол и вот за что наказан, Похитил я божественную искру, Сокрыл в стволе сухого тростника, И людям стал огонь любезным братом, Помощником, учителем во всем…» Как вы думаете, каким образом картина связана с темой нашего урока? Какие явления сопровождаются выделением тепла и света? Какая реакция сопровождается пламенем Т. Итак, тема сегодняшнего урока- Процесс горения. Практическая работа №2/Демонстрация «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде». (2 мин) Определение целей урока Стратегия «Думай, Объединяйся, Делись» Исходя из темы урока, сформулируйте цели урока, что мы сегодня узнаем нового, чему научимся и как мы достигнем поставленных целей. Ученики записывают как можно больше идей , которые им приходят на ум (Думай), затем они объединяют свои идеи с партнерами по группе(Объединяйся) и далее идет обсуждения идей всего класса (Делись). (Все записи ведутся на макете Ладошки) (4 мин) Актуализация опорных знаний Стратегия «Кубик Блума» На гранях кубика написаны начала вопросов: «Почему», «Объясни», «Назови», «Предложи», «Придумай» Каждой группе выпадает один вопрос, на который необходимо дать ответ. Дайте характеристику физических свойств воздуха. Назовите основные компоненты воздуха? Приведите их формулы. Предложите какими опытами можно определить содержание кислорода и азота в воздухе? Объясните, как изменится состав воздуха в закрытом кабинете во время урока химии? Придумай, что будет, если на Земле исчезнет воздух. (Работа в группах. Каждая группа отвечает на один вопрос. Взаимооценивание групп) | Карточки с названиями простых и сложных веществ, физических и химических явлений. ПРИЛОЖЕНИЕ 1 Слайдовая презентация Слад 1 Слайдовая презентация Слайд 2 Учебник стр. «Сегодня на уроке» Макет Ладошки ПРИЛОЖЕНИЕ 2 Листы с вопросами Смайлики для формативного оценивания Отлично Правильно Старайся Можешь лучше | ||||
Середина урока 25 мин | ( 8 мин) Изучение нового материала (4 мин) Задание: 1. «V» — то, что уже известно “-“ – противоречит вашим представлениям “+”-новое “ ? “- хочу узнать (2 мин) 2. Заполнение таблицы. Вписывать в таблицу только ключевые слова (1 мин) 3.Обсуждение внутри группы что совпало, по мере обсуждения в таблицу могут вписываться дополнения. (1 мин) 4. Обсуждение результатов работы в классе. Выступление спикеров. Каждая группа представляет одну из граф таблицы. Обсуждение вопросов. Взаимооценивание работы групп прием «Две звезды и пожелание» Формативное оценивание Стратегия «Сигналы рукой» Предлагаю учащимся показать сигналы, обозначающие понимание или непонимание материала Я понимаю материал и могу объяснить (большой палец руки направлени вверх) Я все еще не понимаю (большой палер рукм направлен в сторону) Я не совсем уверен (помахать рукой) Постановка проблемного вопроса Как вы считаете с одинаковой ли скоростью будет происходить процесс горения кусочка угля в чистом кислороде и на воздухе? На сколько вы правы, поможет ответить выполнение практической работы. Мини-исследование (17 мин) Выполнение практической работы №2 «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде». Обзор заданий, краткий инструктаж по их выполнению. Работа в группах с картами-инструкциями Стратегия «Думай, Объединяйся, Делись» (2 мин) Задание: 1. Определить цель работы 2. Выдвинуть гипотезу. 3.Какие опыты необходимо поставить, чтобы доказать правильность или ложность выдвинутых предположений. (2 мин) Выступление спикеров. Обсуждение вопросов. Примерные ответы учащихся: Цель работы: Сравнить реакции горения металлов и неметаллов в воздухе и кислороде. Гипотеза: Если предположить, что вещества горят на воздухе медленно, то в кислороде процесс горения будет происходить быстро. Так ли это? (10 мин) Задание 2. Выполнение практической части работы. Заполнение таблицы. (3 мин) Представление результатов работы каждой группы. Выступление спикеров. Обсуждение вопросов. Примерные ответы учащихся: Вывод: В кислороде вещества горят более энергично, чем на воздухе, т.к. воздух есть смесь газов, в которой кислороду принадлежит по объему приблизительно 1/5 часть Подведение итогов работы учителем. Самооценивание работы учащимися согласно дискрипторам. Формативное оценивание учащихся учителем (похвала) В конце урока учащиеся сдают тетради на проверку учителю (2 мин) Физминутка Зарядка для глаз | Учебник стр.55 Слайдовая презентация Слайд 4 Слайд 5 Таблица Карты-инструкции Ноутбук Видеоролики ПРИЛОЖЕНИЕ 3 Карты – инструкции Дескрипторы Учащиеся получают оценку за работу в форме «Достиг или стремится» по анализу отчета. | ||||
Конец урока 10 мин | (5 мин) Закрепление изученного материала (на выбор по желанию) Задание А: Вставьте пропущенные слова. Кислород взаимодействует как с простыми веществами (с ___________________ и _________________________) , так и со сложными. Реакции взаимодействия веществ с кислородом называются реакциями _____________________. Для того, чтобы эти реакции начались во многих случаях необходимо____________________. Признаками большинства химических реакций с кислородом являются _________________________________. Такие реакции называются реакциями _____________________. В результате данных реакций образуются довольно прочные химические соединения, называемые______________________. Задание В: Работа пожарников сводится к устранению отдельных условий горения. 1) углекислым газом; 2) водой; 3) песком; 4) при помощи огнестойких перегородок. Задание С: Какие средства тушения пожара нужно использовать в следующих случаях: 1) загорелась одежда на человеке; 2) воспламенился бензин; 3) возник пожар на складе лесоматериалов; 4) загорелась нефть на поверхности воды. Задание D: Сорные куры строят гнездо из мусора и гниющих остатков растений. В него на определенную глубину они откладывают яйца. Самец время от времени частично раскидывает кучу сверху или, наоборот, делает ее выше. Какой процесс идет в гнезде? Объясните поведение птиц. (Взаимопроверка в парах. Взаимооценивание) Школа оценивания: 1 балл- задание выполнено частично 2 балла- задание выполнено с незначительными ошибками 3 балла – задание выполнено правильно (5 мин) Рефлексия Прочитайте еще раз цели урока. Достигли ли вы заданных целей? В какой степени? Стратегия «Ладошка» С. Знаю теорию, умею применять на практике В. Знаю теорию, испытываю затруднения с практикой А. Плохо знаю теорию, не могу применять на практике. Заполнение листов самооценивания (1 мин) Домашнее задание Прием «Почтальон» Каждый учащийся получает конверт с разноуровневым домашним заданием (уровень А, В, С) Уровень А: 1. Учебник § 9, стр. 58 №8 2. «Химический лабиринт» Уровень В: Решение логических задач Уровень С: Написать напишите эссе о пользе и вреде горения для природы и человека | Тематическая карточка Листы ответов Шкала оценивания ПРИЛОЖЕНИЕ 5 ПРИЛОЖЕНИЕ 6 ПРИЛОЖЕНИЕ 7 | ||||
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? | Оценивание – как Вы планируете проверить уровень усвоения материала учащихся? | Метапредметные связи | ||||
На этапе актуализации опорных знаний через прием «КУБИК БЛУМА», при изучении нового материала через стратегию «ИНСЕРТ» при выполнении ПРАКТИЧЕСКОЙ РАБОТЫ в малой группе, закреплении изученного материала через выполнение разноуровневых заданий «ТЕМАТИЧЕСКОЙ КАРТОЧКИ» будут проявляться учащиеся с более высоким уровнем знаний. Практическое задание «ТЕМАТИЧЕСКАЯ КАРТОЧКА» предполагает дифференциацию, так как учащиеся с более высоким уровнем подготовки смогут выполнить задание уровней синтез, анализ. Учитель оказывает индивидуальную поддержку учащимся при выполнении практической работы, заполнении таблицы, оформлении отчета. Также дифференцированно домашнее задание «ПОЧТАЛЬОН», т.к. учащиеся сами выбирают себе задание на знание, понимание, применение или задание творческого характера. Все учащиеся смогут: | Формативное оценивание учителем и учащимися «КУБИКА БЛУМА» способствует оценке уровня усвоения предыдущей темы. Формативное оценивание учителем ПРАКТИЧЕСКОЙ РАБОТЫ, «ТЕМАТИЧЕСКОЙ КАРТОЧКИ» способствует оценке уровня усвоения нового материала. Учащиеся получат оценку за работу в форме «Достиг или стремится» по анализу отчета. Учащиеся формативно оценивают себя на протяжении всего урока при выполнении заданий «СИГНАЛ РУКОЙ, «ЛАДОШКА» , в конце урока заполняют «ЛИСТ САМООЦЕНИВАНИЯ» т. Т.О. на каждом этапе деятельности производится формативное оценивание через отзыв учителя, рекомендации учащихся и самооценивания. | Предусмотрены внутрипредметные и межпредметные связи с естествознанием и экологией. Соблюдение правил техники безопасности во время проведения практической работы, способствует охране здоровья учащихся. Учащиеся должны осознать важность соблюдения техники безопасности при обращении с огнем в быту и на природе. | ||||
Объяснять необходимость присутствия сторон «треугольника огня» для горения Уметь объяснять понятия «горение», «медленное окисление», «температура воспламенения» Уметь записывать уравнения реакций взаимодействия кислорода с простыми веществами, называть продукты реакции Наблюдать опыты и записывать наблюдения | ||||||
Большинство учащихся смогут: | ||||||
Уметь ставить цели, анализировать опыты, описывать результаты наблюдений | ||||||
Некоторые учащиеся смогут: | ||||||
Выдвигать гипотезы, делать самостоятельно выводы на основе наблюдений, грамотно оформлять результаты исследования | ||||||
Размышления: Были ли цели урока/цели обучения реалистичными? Цели урока были реалистичными, достижимыми, измеримыми. Что учащиеся выучили сегодня? учащиеся закрепили направления монгольских завоеваний, совершенствовали навыки работы с картой Какая атмосфера царила в классе? Атмосфера творческая, взаимопомощи, внимания и ответственности Сработало ли дифференциация, проводимая мной? Использована скрытая дифференциация, она была эффективной Уложился(лась) ли я в сроки? | Все запланированные виды работ были выполненные в намеченное время Какие отступления были от плана урока и почему? Сценку можно заменить другой стратегией для обсуждения характера международных отношений в изучаемый период | |||||
Общая оценка Какие два аспекта урока прошли хорошо (подумайте, как о преподавании, так и об изучении)? 1: Деление на группы, оценивание индивидуальных ответов учащихся в игровой форме 2: Работа в группах/прах, атмосфера сотрудничества в группах Какие две вещи могли бы улучшить урок (подумайте, как о преподавании, так и об изучении)? 1: На рефлексию желательно отвести больше времени, чтобы учащиеся могли высказать побольше по обобщению темы урока 2: Было бы более эффективным использование общеклассного оценочного листа, который заполняется по мере выполнения заданий учащимися Что я узнал(а) за время урока о классе или отдельных учениках такого, что поможет мне подготовиться к следующему уроку? Класс активный, с положительной учебной мотивацией, учащиеся доброжелательные, организованные. | ||||||
ПРИЛОЖЕНИЕ 1
СКИСАНИЕ МОЛОКА | ИСПАРЕНИЕ ЖИДКОЙ РТУТИ |
ГОРЕНИЕ ДРЕВЕСИНЫ | ОБРАЗОВАНИЕ ЛЬДА |
ПОЧЕРНЕНИЕ СЕРЕБРЯНОЙ ЛОЖКИ | КИСЛОРОД |
РЖАВЛЕНИЕ ЖЕЛЕЗА | СЕРА |
ГНИЕНИЕ ЛИСТЬЕВ | ФОСФОР |
ИСПАРЕНИЕ ВОДЫ | ЖЕЛЕЗО |
ПЛАВЛЕНИЕ СЛИВОЧНОГО МАСЛА | УГОЛЬ |
ОБРАЗОВАНИЕ ТУМАНА | УГЛЕКИСЛЫЙ ГАЗ |
САХАР | ВОДА |
ПОВАРЕННАЯ СОЛЬ | МЕЛ |
ПРИЛОЖЕНИЕ 2
ПРИЛОЖЕНИЕ 3 Карта-инструкция
Практическая работа №2
«Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»
Цель работы: Сравнить реакции горения металлов и неметаллов в воздухе и кислороде.
Гипотеза: Если предположить, что вещества горят на воздухе медленно, то в кислороде процесс горения будет происходить быстро. Так ли это?
Необходимое оборудование и реактивы
Оборудование: ложки для сжигания веществ, шпатель, спиртовка, спички, колбы объемом 1 литр, пробки для колб, песок на дне колбы для сжигания железа.
Реактивы: кислород, сера, фосфор, железо.
Ход работы:
Опыт 1. Горение серы:
— насыпьте в железную ложечку немного серы с помощью шпателя;
— подожгите серу над пламенем спиртовки и запишите наблюдения;
— опустите ложечку с горящей серой в кислород, закройте пробкой колбу;
— запишите наблюдения и уравнение реакции в таблицу результатов.
— сделайте вывод.
Опыт 2. Горение фосфора:
— насыпьте в железную ложечку немного красного фосфора с помощью шпателя;
— подожгите фосфор над пламенем спиртовки и запишите наблюдения;
— опустите ложечку с горящим фосфором в кислород, закройте колбу пробкой;
— запишите наблюдения и уравнения реакции в таблицу результатов;
— сделайте вывод.
Опыт 3. Горение железа:
— поднесите к пламени спиртовки спираль из железной проволоки на продолжительное время;
— запишите наблюдения;
Опустите нагретую спираль из железной проволоки в кислород, закройте колбу.
— запишите наблюдения и уравнения реакции в таблицу результатов;
— сделайте вывод.
Таблица
Что делали? | Что наблюдали? | Уравнение реакции | Вывод |
1. Горение серы | Сделайте вывод об условиях горения неметаллов и металлов и продуктах их горения | ||
2. Горение фосфора | |||
3. Горение железа |
Дескриптор Обучающийся
— правильно ставит цель и определяет гипотезу;
— оформляет таблицу, в которой указывает: описание опыта, наблюдения, вывод;
— записывает уравнения реакции горения серы, фосфора и железа;
— указывает продукты реакции горения.
ВЫПОЛНЕНИЕ РАБОТЫ
Загрузите по очереди три следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Горение серы
2. Горение фосфора
3. Горение железа
Оформите отчет о проделанной работе
ПРИЛОЖЕНИЕ 4 ЛИСТЫ-ЗАДАНИЯ
Задание А: Вставьте пропущенные слова.
Кислород взаимодействует как с простыми веществами (с ___________________ и _________________________) , так и со сложными. Реакции взаимодействия веществ с кислородом называются реакциями _____________________. Для того, чтобы эти реакции начались во многих случаях необходимо____________________. Признаками большинства химических реакций с кислородом являются _________________________________. Такие реакции называются реакциями _____________________. В результате данных реакций образуются довольно прочные химические соединения, называемые______________________.
Задание В: Работа пожарников сводится к устранению отдельных условий горения. Определите для каждого из приведенных на рисунке случаев (стрелкой указано, какой фактор надо устранить) способ предупреждения или тушения огня:
Определите для каждого из приведенных на рисунке случаев (стрелкой указано, какой фактор надо устранить) способ предупреждения или тушения огня:
1) углекислым газом; 2) водой; 3) песком;
4) при помощи огнестойких перегородок.
Задание С: Какие средства тушения пожара нужно использовать в следующих случаях:
1) загорелась одежда на человеке; 2) воспламенился бензин; 3) возник пожар на складе лесоматериалов; 4) загорелась нефть на поверхности воды.
Задание D: Сорные куры строят гнездо из мусора и гниющих остатков растений. В него на определенную глубину они откладывают яйца. Самец время от времени частично раскидывает кучу сверху или, наоборот, делает ее выше. Какой процесс идет в гнезде? Объясните поведение птиц.
ПРИЛОЖЕНИЕ 5 ЛИСТ- ОТВЕТОВ
Задание А: Вставьте пропущенные слова.
Кислород взаимодействует как с простыми веществами (с углем, серой, фосфором, железом) , так и со сложными. Реакции взаимодействия веществ с кислородом называются реакциями окисления. Для того, чтобы эти реакции начались во многих случаях необходимо довести вещество до температуры воспламенения. Признаками большинства химических реакций с кислородом являются выделение теплоты и света Такие реакции называются реакциями горения. В результате данных реакций образуются довольно прочные химические соединения, называемые оксидами.
Реакции взаимодействия веществ с кислородом называются реакциями окисления. Для того, чтобы эти реакции начались во многих случаях необходимо довести вещество до температуры воспламенения. Признаками большинства химических реакций с кислородом являются выделение теплоты и света Такие реакции называются реакциями горения. В результате данных реакций образуются довольно прочные химические соединения, называемые оксидами.
Задание В: Работа пожарников сводится к устранению отдельных условий горения. Определите для каждого из приведенных на рисунке случаев (стрелкой указано, какой фактор надо устранить) способ предупреждения или тушения огня:
1) углекислым газом; 2) водой; 3) песком;
4) при помощи огнестойких перегородок.
Ответ: а-2; б-1; 3 в-4
Задание С: Какие средства тушения пожара нужно использовать в следующих случаях:
1) загорелась одежда на человеке; 2) воспламенился бензин; 3) возник пожар на складе лесоматериалов; 4) загорелась нефть на поверхности воды.
Ответ: Для возникновения горения необходимо нагревание до определенной температуры и обеспечение свободного доступа воздуха. Для прекращения горения необходимо охладить вещество ниже температуры воспламенения или прекратить доступ воздуха.
а) При загорании одежды на человеке необходимо накрыть его одеялом или чем-либо подобным — при этом прекращается доступ воздуха.
б) При возгорании бензина нужно пользоваться огнетушителем: содержащийся в нем оксид углерода (IV) не поддерживает горения и затрудняет доступ воздуха.
в) Для тушения лесоматериалов применяют воду. Она и охлаждает горящие предметы, и затрудняет доступ к ним воздуха.
г) Для тушения нефти на поверхности воды применяют специальную пену, которая покрывает горящую нефть и прекращает доступ к ней воздуха. Тушить нефть водой нельзя, так как нефть с водой не смешивается.
Задание D: Сорные куры строят гнездо из мусора и гниющих остатков растений. В него на определенную глубину они откладывают яйца. Самец время от времени частично раскидывает кучу сверху или, наоборот, делает ее выше. Какой процесс идет в гнезде? Объясните поведение птиц.
Самец время от времени частично раскидывает кучу сверху или, наоборот, делает ее выше. Какой процесс идет в гнезде? Объясните поведение птиц.
Ответ: Если вещество медленно взаимодействует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением. В процессе окисления мусора выделяется теплота.
ПРИЛОЖЕНИЕ 6
ЛИСТ САМООЦЕНИВАНИЯ
№ | Критерии | |||
Отлично | Хорошо | Я могу лучше | ||
1 | Я участвовал в формулировании темы и цели урока | |||
2 | У меня не возникло трудностей с заполнением таблицы «Инсерт» | |||
3 | Я помогал своей группе в выборе правильных решений | |||
4 | Я с уважением выслушивал предположения и идеи своих одноклассников | |||
5 | У меня не возникло трудностей при выполнении практической работы | |||
6 | Я помогал своей группе делать выводы и заключения | |||
7 | У меня не возникло трудностей при выполнении заданий «Тематическая карточка» | |||
8 | Я понял тему урока и смогу рассказать ее друзьям и родителям | |||
9 | Я смогу применить полученные знания в самостоятельной работе |
ПРИЛОЖЕНИЕ 7
Домашнее задание по теме: Процесс горения
Задание Уровень С (Знаю теорию, умею применять на практике)
Внимательно прочитайте ключевые слова и напишите эссе о пользе и вреде горения для природы и человека
Ключевые слова: варить, движение транспорта, сталь, пищу, друг, враг, Вечный огонь, отопление, пожар, взрыв, Прометей, Зевс, лес, поля, дома, люди, Олимпийские игры, загрязнение.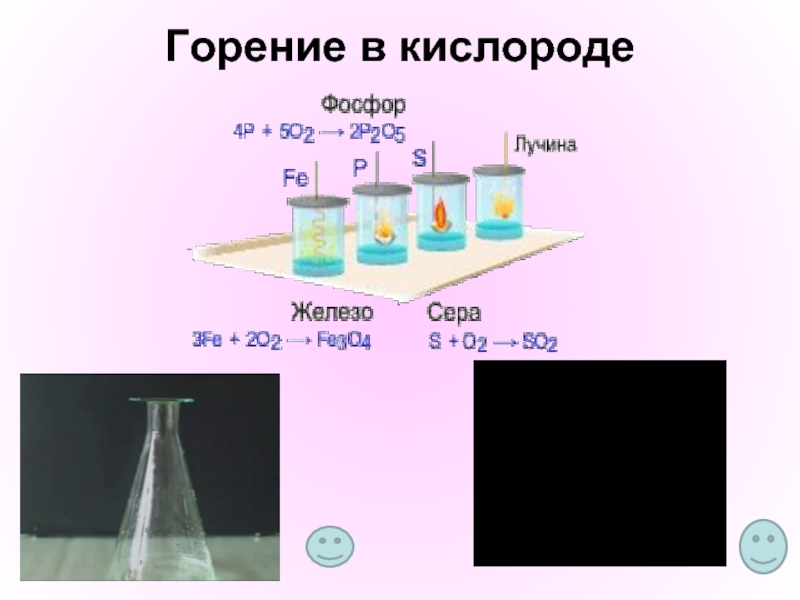
Задание Уровень В (Знаю теорию, испытываю затруднения с практикой)
Влажное зерно нельзя хранить в больших кучах: может произойти обугливание или самовозгорание. Объясните, почему это происходит. Чтобы сохранить зерно, его перелопачивают, т.е. перебрасывают с места на место. Объясните, почему это необходимо делать.
Задание Уровень А (Плохо знаю теорию, не могу применять на практике)
Задание 1: Учебник § 9, стр. 58 №8
Задание 2: «Химический лабиринт»
Чтобы добраться до финиша, начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжайте путь по стрелке с обозначением «да», если ошибочно, то по стрелке «нет».
№ | Критерии | |||
Отлично | Хорошо | Я могу лучше | ||
1 | Я участвовал в формулировании темы и цели урока | |||
2 | У меня не возникло трудностей с заполнением таблицы «Инсерт» | |||
3 | Я помогал своей группе в выборе правильных решений | |||
4 | Я с уважением выслушивал предположения и идеи своих одноклассников | |||
5 | У меня не возникло трудностей при выполнении практической работы | |||
6 | Я помогал своей группе делать выводы и заключения | |||
7 | У меня не возникло трудностей при выполнении заданий «Тематическая карточка» | |||
8 | Я понял тему урока и смогу рассказать ее друзьям и родителям | |||
9 | Я смогу применить полученные знания в самостоятельной работе |
Горение — сера — Большая Энциклопедия Нефти и Газа, статья, страница 3
Горение — сера
Cтраница 3
Воздух необходимый для горения серы забирается из атнос-феры через специальный фильтр представляющий собой набор полок с пластмассовыми кольцами смачиваемыми маслом. В фильтре воздух очищается от пыли.
[31]
В фильтре воздух очищается от пыли.
[31]
Сравним для примера горение серы в воздухе и кислороде. [32]
При анализе процесса горения серы и разработке математической модели используют модель частицы с невзаимодействующим ядром без учета образования зольной оболочки ( см. разд. [33]
Из-за неустойчивого режима горения серы процесс невозможно автоматизировать. При работе печи на битуминозной сере на поверхности расплава образуется шлакообразная корка, препятствующая испарению серы. Удаление корки — тяжелая и трудоемкая операция, приводящая к интенсивному выделению серных паров, неравномерное горение которых вызывает частые колебания концентрации сернистого газа. Это сказывается на его дальнейшей переработке. [34]
Как зависит скорость горения серы от давления кислорода. [35]
[35]
Однако в процессе горения серы выделяется едкий газ. Этот газ не испаряющаяся сера, а новое вещество, поскольку при охлаждении газа, образующегося при сгорании серы, не происходит осаждения серы. Следовательно, горение серы представляет собой химический процесс. [36]
Изменяется ли интенсивность горения серы к почему. [38]
Используя термохимическое уравнение горения серы S О2 SO2 297 кДж, вычислите количество теплоты, образуемое при сгорании: а) 7 2 моль серы; б) 6 4 г серы. [39]
Что получается при горении серы, фосфора и водорода в закиси азота. [40]
Что образуется при горении серы на воздухе. [41]
Вычислите тепловой эффект реакции горения серы в закиси азота, если известно, что ( ЛЯобр) н2о195 ккал / моль, а ( A o6p) so2 — 71 0 ккал / моль. [42]
[42]
Образуется сернистый газ при горении серы, при обжиге железного колчедана и сульфидов цветных металлов. [43]
Сернистый газ образуется при горении серы в кислороде или на воздухе. Этот метод применяется в промышленном производстве серной кислоты контактным способом. [44]
Тепло, выделяющееся при горении серы, в основном расходуется на нагревание образующихся газов. [45]
Страницы: 1 2 3 4
Диоксид серы в воздухе: что делать?
В Сибае сложилась кризисная экологическая ситуация из-за постоянных выбросов диоксида серы. Вещество образовалось из продуктов горения рудных пород в заброшенных карьерах местного филиала Учалинского горно-обогатительного комбината (УГОК). В этом месяце интенсивность выбросов увеличилась. Жители Сибая жалуются на ухудшение здоровья. На этой неделе зафиксировали 37-кратное превышение ПДК по диоксиду серы. «Idel.Реалии» подготовили карточки о том, что из себя представляет вещество, насколько оно опасно и как от него защититься.
В этом месяце интенсивность выбросов увеличилась. Жители Сибая жалуются на ухудшение здоровья. На этой неделе зафиксировали 37-кратное превышение ПДК по диоксиду серы. «Idel.Реалии» подготовили карточки о том, что из себя представляет вещество, насколько оно опасно и как от него защититься.
Диоксид серы — это бесцветный газ с характерным резким запахом (запах загорающейся спички), дымится на воздухе. В чистом виде вещество ядовитое. Оно растворяется в воде, при минусовой температуре переходит в жидкое состояние и образует сернистую кислоту.
ПДК максимально-разового воздействия – 0,5 мг/м3. Химическая формула SO2.
ПРАВДА, ЧТО ЕГО ИСТОЧНИКАМИ МОГУТ БЫТЬ И ВЫХЛОПНЫЕ ГАЗЫ?Правда, те самые выхлопные газы автомобилей. Помимо этого диоксид серы может выделяться в результате работы теплоэлектростанций (ТЭС) при сжигании бурого угля и мазута. Также образуется при сжигании ископаемых видов топлива и плавке минеральных руд, содержащих серу.
Если загрязнение длительное, мы получаем хронические заболевания или обострения имеющихся болезней
Непосредственно в Сибае вещество появилось в результате постоянных выбросов продуктов горения рудных пород из заброшенных карьеров горно-обогатительного комбината.
НАСКОЛЬКО ОПАСНО ВЕЩЕСТВО?Диоксид серы характеризуется высокой токсичностью. Это вещество третьего класса опасности. При повышенных концентрациях оно оказывает пагубное влияние как на человека, так и на окружающую природу и животных.
По данным ВОЗ, воздействию диоксида серы нельзя подвергаться дольше десяти минут при уровне концентрации в 500 мкг/м3. Председатель Союза экологов Башкортостана Александр Веселов сообщил «Idel.Реалии», что при повышенном уровне вещества в воздухе от него нельзя скрыться даже в квартире с закрытыми окнами.
— Если превышение опасного вещества в воздухе выше предельно допустимой концентрации, сколько бы вы в нем не находились, попадание в организм гарантировано. Если загрязнение длительное, мы получаем хронические заболевания или обострения имеющихся болезней, — сказал глава Союза экологов РБ.
Если загрязнение длительное, мы получаем хронические заболевания или обострения имеющихся болезней, — сказал глава Союза экологов РБ.
Необходимо носить марлевые повязки, потреблять молочные продукты
В атмосфере диоксид серы претерпевает ряд химических превращений, важнейшие из них — окисление и образование кислоты. В результате возможны кислотные осадки, которые губят растения, закисляют почву, увеличивают кислотность озер. Даже при среднем содержании оксидов серы в воздухе порядка 100 мкг/м3 растения приобретают желтоватый оттенок.
КАКИЕ ЗАБОЛЕВАНИЯ ВЫЗЫВАЕТ ИЛИ ОБОСТРЯЕТ ДИОКСИД СЕРЫ В ВОЗДУХЕ?По информации ВОЗ, воздействие диоксида серы в концентрациях выше ПДК может вызвать нарушение функций дыхания. Не исключено действие на слизистые оболочки, воспаление носоглотки, трахеи, бронхиты, кашель, хрипота и боль в горле. Особенно высокая чувствительность к действию диоксида серы у людей с хроническими нарушениями органов дыхания, с астмой. В дни с повышенными уровнями концентрации SO2 возрастает число случаев госпитализации с болезнями сердца и смертность.
В дни с повышенными уровнями концентрации SO2 возрастает число случаев госпитализации с болезнями сердца и смертность.
Александр Веселов считает, что при малейшем подозрении на превышение диоксида серы в воздухе, астматикам и детям нужно бежать из населенного пункта.
КАК СЕБЯ ОБЕЗОПАСИТЬ?— Естественно, необходимо носить марлевые повязки, потреблять молочные продукты, которые связывают попадающие через дыхательные органы в кровь вредные вещества и выводят их из организма. Взрослым для усиления обмена веществ можно принимать спиртное. Красное вино, например, — сообщил председатель Союза экологов Башкортостана.
По его словам, все эти варианты временные, чтобы переждать. Учитывая прогнозы по устранению аварии на Сибае (до 2,5 месяцев), он советует просто уезжать.
НО ДИОКСИД СЕРЫ ЕЩЕ И ПИЩЕВАЯ ДОБАВКА Е220. КАК ОН МОЖЕТ БЫТЬ ОПАСЕН, ЕСЛИ ЕГО ДОБАВЛЯЮТ В ЕДУ?Диоксид серы действительно используется и как пищевая добавка Е220, но суть в том, что концентрация вещества в продуктах в сотни раз ниже.
Консервант Е220 замедляет процесс ферментации свежих фруктов и овощей, отбеливает и сохраняет первоначальный вид продуктов. Используется в качестве консервирующего средства для увеличения срока хранения фруктовых и ягодных соков, вин и других напитков. Также им обрабатывают сухофрукты, чтобы они не темнели и не портились.
Дело не только в заброшенном карьере, но и в заводе по производству буровых растворов и автомобилях
В случае с напитками концентрация вещества предельно низкая, а сухофрукты рекомендуют отмачивать в воде.
В КАКИХ СТРАНАХ ВООБЩЕ ЭТО ВЕЩЕСТВО ПРЕВЫШАЛО ПДК?В 2016 году, по данным журнала Nature Geoscience, спутники NASA обнаружили 500 новых источников загрязнения воздуха, около 40 из которых были опасны диоксидом серы. Большинство очагов зафиксировали в России, Мексике и ближневосточных странах.
Например, территория предприятий «Норильского никеля» практически выжжена диоксидом серы и кислотными дождями. Такая ситуация, как рассказал Александр Веселов, стала нормальной для многих металлургических предприятий.
Такая ситуация, как рассказал Александр Веселов, стала нормальной для многих металлургических предприятий.
В случае с Сибаем, по его мнению, дело не только в заброшенном карьере, но и в заводе по производству буровых растворов и автомобилях. Сработал так называемый накопительный эффект.
КАК НЕЙТРАЛИЗОВАТЬ ОЧАГ КОНЦЕНТРАЦИИ? КОГДА МОЖНО БУДЕТ ДЫШАТЬ И НЕ БОЯТЬСЯ?Эксперты Учебно-методического центра по гражданской обороне, чрезвычайным ситуациям и пожарной безопасности рекомендуют обрабатывать участок либо раствором щелочи, либо известковым молоком, чтобы локализовать происшествие.
«Место разлива промывают большим количеством воды, изолируют песком, воздушно-механической пеной, обваловывают и не допускают попадания веществ в поверхностные воды. Для утилизации загрязненного грунта на месте разлива при нейтрализации сернистого ангидрида (диоксида серы) срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают водой в контрольных целях», — говорится в рекомендациях центра.
Места срезов засыпают свежим слоем грунта, промывают водой в контрольных целях», — говорится в рекомендациях центра.
Сейчас в Сибае карьер частично подтапливают щелочной водой. Руководство города гарантирует, что ситуация измениться в течение нескольких месяцев. Что делать людям в это время — неизвестно. Режим ЧС не вводят, эвакуация не началась.
Подписывайтесь на наш канал в Telegram. Говорим о том, о чем другие вынуждены молчать.
Лабораторная работа 1, выполненная лабораторная работа по химии на Автор24
Всего было 18 предложений, заказчик выбрал автора AfinochkaПомогите выполнить лабораторную работу по химии за 1 день, тема «Лабораторная работа 1»
Опыт 1. (Образец) Горение железа в кислороде.
Уравнение реакции: 3Fe + 2O2 = Fe2O3 + FeO (или Fe3O4)
Наблюдения: В ходе реакции наблюдалось выделение тепла и света. Железо сгорает в кислороде ярким искрящимся пламенем.
Вывод: при взаимодействии металлов с кислородом образуются оксиды металлов. Опыт 2. Горение угля в кислороде.
Уравнение реакции: напишите уравнение реакции горения угля в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении древесного угля. Опыт 3. Горение серы в кислороде.
Уравнение реакции: напишите уравнение реакции горения серы в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении серы. Каким пламенем горит сера? Опыт 4. Горение фосфора в кислороде.
Уравнение реакции: напишите уравнение реакции горения фосфора в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении фосфора.
Вывод (общий для опытов 2, 3 и 4): что образуется в реакции «неметалл + кислород»? Опыт 5.
(Образец) Горение железа в кислороде.
Уравнение реакции: 3Fe + 2O2 = Fe2O3 + FeO (или Fe3O4)
Наблюдения: В ходе реакции наблюдалось выделение тепла и света. Железо сгорает в кислороде ярким искрящимся пламенем.
Вывод: при взаимодействии металлов с кислородом образуются оксиды металлов. Опыт 2. Горение угля в кислороде.
Уравнение реакции: напишите уравнение реакции горения угля в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении древесного угля. Опыт 3. Горение серы в кислороде.
Уравнение реакции: напишите уравнение реакции горения серы в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении серы. Каким пламенем горит сера? Опыт 4. Горение фосфора в кислороде.
Уравнение реакции: напишите уравнение реакции горения фосфора в кислороде (в фильме озвучен продукт реакции).
Наблюдения: опишите наблюдаемые явления при горении фосфора.
Вывод (общий для опытов 2, 3 и 4): что образуется в реакции «неметалл + кислород»? Опыт 5.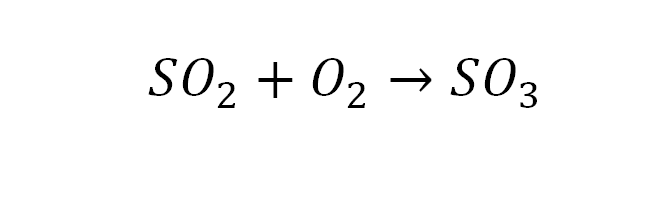 Получение и горение водорода.
Уравнение реакции 1: напишите уравнение получения водорода из цинка и серной кислоты с образованием соли — сульфата цинка и выделением водорода. Уравнение реакции 2: напишите уравнение горения водорода в кислороде.
Наблюдения: опишите процесс горения водорода .
Вывод: что образуется при горении водорода в кислороде? Уравнение реакции 3: напишите уравнение горения водорода в хлоре (Cl2).
Наблюдения: опишите процесс горения водорода в хлоре.
Вывод: какой продукт реакции образуется в реакции между водородом и хлором? Что получается при взаимодействии водорода с галогенами (элементами 7й группы главной подгруппы)? Опыт 6. Взаимодействие меди с хлором.
Уравнение реакции: напишите уравнение между медью и хлором, учитывая, что в результате образуется хлорид меди двухвалентной.
Наблюдения: опишите внешний эффект реакции. Опыт 7. Взаимодействие железа с хлором.
Уравнение реакции: напишите уравнение между железом и хлором, учитывая, что в результате образуется хлорид железа трехвалентного.
Получение и горение водорода.
Уравнение реакции 1: напишите уравнение получения водорода из цинка и серной кислоты с образованием соли — сульфата цинка и выделением водорода. Уравнение реакции 2: напишите уравнение горения водорода в кислороде.
Наблюдения: опишите процесс горения водорода .
Вывод: что образуется при горении водорода в кислороде? Уравнение реакции 3: напишите уравнение горения водорода в хлоре (Cl2).
Наблюдения: опишите процесс горения водорода в хлоре.
Вывод: какой продукт реакции образуется в реакции между водородом и хлором? Что получается при взаимодействии водорода с галогенами (элементами 7й группы главной подгруппы)? Опыт 6. Взаимодействие меди с хлором.
Уравнение реакции: напишите уравнение между медью и хлором, учитывая, что в результате образуется хлорид меди двухвалентной.
Наблюдения: опишите внешний эффект реакции. Опыт 7. Взаимодействие железа с хлором.
Уравнение реакции: напишите уравнение между железом и хлором, учитывая, что в результате образуется хлорид железа трехвалентного. Наблюдения: опишите внешний эффект реакции. Опыт 8. Взаимодействие сурьмы с хлором.
Уравнение реакции: напишите уравнение между сурьмой (Sb) и хлором, учитывая, что в результате образуется хлорид сурьмы пятивалентной (пентахлорид сурьмы).
Наблюдения: опишите внешний эффект реакции.
Вывод (общий для опытов 6, 7 и 8): что образуется в реакции между металлом и хлором? Опыт 9. Взаимодействие натрия с водой.
Уравнение реакции: напишите уравнение реакции между натрием и водой с образованием водорода и гидроксида натрия.
Наблюдения: опишите наблюдаемые явления. О чем свидетельствует появление малиновой окраски при добавлении в полученный раствор фенолфталеина? Опыт 10. Взаимодействие кальция с водой.
Уравнение реакции: напишите уравнение реакции между кальцием и водой с образованием водорода и гидроксида кальция.
Наблюдения: опишите наблюдаемые явления. Чем отличается реакция кальция и натрия с водой. О чем свидетельствует появление малиновой окраски при добавлении в полученный раствор фенолфталеина?
Вывод (общий для опытов 9 и 10): что образуется в реакции: «активный металл + вода»? Опыт 11.
Наблюдения: опишите внешний эффект реакции. Опыт 8. Взаимодействие сурьмы с хлором.
Уравнение реакции: напишите уравнение между сурьмой (Sb) и хлором, учитывая, что в результате образуется хлорид сурьмы пятивалентной (пентахлорид сурьмы).
Наблюдения: опишите внешний эффект реакции.
Вывод (общий для опытов 6, 7 и 8): что образуется в реакции между металлом и хлором? Опыт 9. Взаимодействие натрия с водой.
Уравнение реакции: напишите уравнение реакции между натрием и водой с образованием водорода и гидроксида натрия.
Наблюдения: опишите наблюдаемые явления. О чем свидетельствует появление малиновой окраски при добавлении в полученный раствор фенолфталеина? Опыт 10. Взаимодействие кальция с водой.
Уравнение реакции: напишите уравнение реакции между кальцием и водой с образованием водорода и гидроксида кальция.
Наблюдения: опишите наблюдаемые явления. Чем отличается реакция кальция и натрия с водой. О чем свидетельствует появление малиновой окраски при добавлении в полученный раствор фенолфталеина?
Вывод (общий для опытов 9 и 10): что образуется в реакции: «активный металл + вода»? Опыт 11. Получение углекислого газа.
Уравнение реакции: напишите уравнение реакции получения углекислого газа из карбоната кальция (СаСО3) и соляной кислоты, учитывая, что в реакции образуется угольная кислота, разлагающаяся на углекислый газ и воду, и хлорид кальция.
Напишите уравнение реакции растворения углекислого газа в воде с образованием угольной кислоты.
Наблюдения: объясните, почему при пропускании газа из аппарата Киппа через раствор синего лакмуса, лакмус приобретает красную окраску.
Вывод: углекислый газ можно получить… При растворении углекислого газа в воде образуется… Опыт 12. Химические свойства углекислого газа.
Уравнение реакции 1: напишите уравнение реакции между углекислым газом и известковой водой (Са(ОН)2) с образованием карбоната кальция.
Наблюдения: по каким признакам можно судить об образовании карбоната кальция в растворе? Уравнение реакции 2: напишите уравнение реакции между карбонатом кальция и избытком углекислого газа с образованием гидрокарбоната кальция Са(НСО3)2.
Получение углекислого газа.
Уравнение реакции: напишите уравнение реакции получения углекислого газа из карбоната кальция (СаСО3) и соляной кислоты, учитывая, что в реакции образуется угольная кислота, разлагающаяся на углекислый газ и воду, и хлорид кальция.
Напишите уравнение реакции растворения углекислого газа в воде с образованием угольной кислоты.
Наблюдения: объясните, почему при пропускании газа из аппарата Киппа через раствор синего лакмуса, лакмус приобретает красную окраску.
Вывод: углекислый газ можно получить… При растворении углекислого газа в воде образуется… Опыт 12. Химические свойства углекислого газа.
Уравнение реакции 1: напишите уравнение реакции между углекислым газом и известковой водой (Са(ОН)2) с образованием карбоната кальция.
Наблюдения: по каким признакам можно судить об образовании карбоната кальция в растворе? Уравнение реакции 2: напишите уравнение реакции между карбонатом кальция и избытком углекислого газа с образованием гидрокарбоната кальция Са(НСО3)2. Наблюдения: что происходит с раствором, содержащим свежеосажденный карбонат кальция, при пропускании через него избытка углекислого газа? Уравнение реакции 3: напишите уравнение разложения гидрокарбоната кальция при нагревании с образованием углекислого газа и карбоната кальция.
Наблюдения: опишите внешний эффект данной реакции. Вывод: при помощи каких реакций можно обнаружить углекислый газ? Опыт 13. Получение кремниевой кислоты.
Уравнение реакции: напишите уравнение реакции с образованием кремниевой кислоты из силиката натрия и соляной кислоты.
Наблюдения: опишите внешний эффект опыта.
Вывод: как можно получить слабую кислоту? Опыт 14. Разложение кремниевой кислоты.
Уравнение реакции: напишите уравнение разложения кремниевой кислоты.
Наблюдения: что наблюдаете в реакции?
Вывод: нерастворимая кремниевая кислота разлагается на… Опыт 15. Реакция между основным оксидом и кислотой.
Уравнение реакции: напишите уравнение реакции между оксидом меди CuO и серной кислотой.
Наблюдения: что меняется в растворе, содержащем оксид меди и кислоту при нагревании? Что получается, если выпарить воду из раствора, полученного после этой реакции?
Вывод: что образуется в реакции «основной оксид + кислота»?
Наблюдения: что происходит с раствором, содержащим свежеосажденный карбонат кальция, при пропускании через него избытка углекислого газа? Уравнение реакции 3: напишите уравнение разложения гидрокарбоната кальция при нагревании с образованием углекислого газа и карбоната кальция.
Наблюдения: опишите внешний эффект данной реакции. Вывод: при помощи каких реакций можно обнаружить углекислый газ? Опыт 13. Получение кремниевой кислоты.
Уравнение реакции: напишите уравнение реакции с образованием кремниевой кислоты из силиката натрия и соляной кислоты.
Наблюдения: опишите внешний эффект опыта.
Вывод: как можно получить слабую кислоту? Опыт 14. Разложение кремниевой кислоты.
Уравнение реакции: напишите уравнение разложения кремниевой кислоты.
Наблюдения: что наблюдаете в реакции?
Вывод: нерастворимая кремниевая кислота разлагается на… Опыт 15. Реакция между основным оксидом и кислотой.
Уравнение реакции: напишите уравнение реакции между оксидом меди CuO и серной кислотой.
Наблюдения: что меняется в растворе, содержащем оксид меди и кислоту при нагревании? Что получается, если выпарить воду из раствора, полученного после этой реакции?
Вывод: что образуется в реакции «основной оксид + кислота»?
 (Образец) Горение железа в кислороде.
Уравнение реакции: 3Fe + 2O2 = Fe2O3 + FeO (или Fe3O4)
Наблюдения: В ходе реакции наблюдалось выделение тепла и света. Железо сгорает в кислороде ярким искрящимся пламенем.
Вывод: при взаимодействии металлов с кислородом образуются оксиды металлов. Опыт 2. Горение угля в кислороде.
Подробнее
(Образец) Горение железа в кислороде.
Уравнение реакции: 3Fe + 2O2 = Fe2O3 + FeO (или Fe3O4)
Наблюдения: В ходе реакции наблюдалось выделение тепла и света. Железо сгорает в кислороде ярким искрящимся пламенем.
Вывод: при взаимодействии металлов с кислородом образуются оксиды металлов. Опыт 2. Горение угля в кислороде.
ПодробнееСбалансированные химические уравнения — Формулы и уравнения — OCR 21C — GCSE Chemistry (Single Science) Revision — OCR 21st Century
Напишите сбалансированное химическое уравнение для полного сгорания метана (CH 4 ) с кислородом (O 2 ) .
11cf47kpfj6.0.0.0.1:0.1.0.$0.$4.$7.3.$0″> Словесное уравнение: метан + кислород → диоксид углерода + водаПростое химическое уравнение: CH 4 + O 2 → CO 2 + H 2 O
Реагенты: 1 × C, 4 × H , 2 × O
Продукты: 1 × C, 3 × O, 2 × H несбалансированы
Попробуйте: CH 4 + O 2 → CO 1.0.$0.$4.$7.3.$4.$5″> 2 + 2H 2 O
Реагенты: 1 × C, 4 × H, 2 × O
Продукты: 1 × C, 4 × H, 4 × O несбалансированные
Попробуйте: CH 4 + 2O 2 → CO 2 + 2 H 2 O
Реагенты: 1 × C, 4 × H, 4 × O
Продукты: 1 × C, 4 × H, 4 × O сбалансированные
Сбалансированное химическое уравнение: CH 11cf47kpfj6.0.0.0.1:0.1.0.$0.$4.$7.3.$10.$1″> 4 + 2O 2 → CO 2 + 2H 2 O
окислительно-восстановительный потенциал — Полууравнения для сжигания диоксида серы
Ортокрезол уже достаточно указывал на то, что полуреакции являются бухгалтерским инструментом для электронов.Говоря об электролизе, может быть случайное совпадение между половинными реакциями и общим механизмом, но, как предполагается в формулировке, это не обязательно верно.
Многие реакции кажутся простыми на первый взгляд, но на второй взгляд они кажутся очень сложными системами различных равновесий. На самом деле, самые простые на вид реакции часто оказываются чрезвычайно сложными.
Я имею в виду настоящие полууравнения, которые выражают, как в действительности происходит горение.
Я думал, что для этого нам не нужны вода и кислота. Я ошибаюсь?
Поскольку вы спрашивали о «настоящих полуреакциях», я подумал, что дам немного больше информации о механизме.
Я нашел довольно старую публикацию о механизмах образования оксидов серы при горении. [1] Для иллюстрации сложности этого будет достаточно, но я вполне уверен, что сегодня доступны более современные подходы и кинетические и механистические исследования.
Сама реакция протекает только при умеренных температурах (400-600 ° C) и является слегка экзотермической.
$$ \ ce {SO2 + 1 / 2O2 <=> SO3 (г) + 99,0 $ ~ кДж} $$
Поскольку реакция протекает довольно медленно, катализаторы необходимы. Здесь вступает в игру то, что вы найдете в ответе Ортокрезола: вам нужен вид, который обеспечивает вас ионами кислорода (-2). На практике вы используете катализаторы $ \ ce {V2O5} $, например в синтезе серной кислоты. [2]
Сульфуртриоксид очень гигроскопичен, что указывает на то, что предложенные вами реакции не могут происходить, поскольку он немедленно гидролизуется в присутствии воды. $$ \ ce {SO3 + h3O -> h3SO4 (l)} $$
$$ \ ce {SO3 + h3O -> h3SO4 (l)} $$
Сульфуртриоксид имеет много модификаций, чаще всего он существует в виде $ \ ce {(SO3) 3} $ единиц в твердой фазе. Конденсация также является одной из движущих сил этой реакции, в газовой фазе равновесие между $ \ ce {SO2} $, $ \ ce {O2} $ и $ \ ce {SO3} $ не будет полностью зависеть от продукта. сторона.
Существует также множество других сульфуроксидов, которые, возможно, участвуют в этом сложном равновесии. Это связано с тем, что сульфуртриоксид является мощным окислителем.
Давайте взглянем на несколько реакций, которые участвуют в образовании. Сама реакция, скорее всего, протекает по радикальному пути в газовой фазе, где $ M $ является каким-то катализатором (это может быть стенка или какая-то инертная молекула): $$ \ begin {align} \ ce {SO2 + O2 & <=> SO3 + O} \\ \ ce {SO2 + O + $ M $ & <=> SO3 + $ M $} \ end {align} $$
Одна из важных реакций, нарушающих равновесие, — это
$$ \ ce {SO _ {$ n $} + O <=> SO _ {$ n-1 $} + O2}. $$
$$
Я также нашел публикацию о механизме в тропосфере, и там все становится еще сложнее. [3] Причиной тому является разбавление, разумное количество молекул в возбужденных состояниях и различные другие вовлеченные частицы. Эта тема стала интересной из-за загрязнения воздуха и кислотных дождей.
Я привожу лишь несколько примеров и опускаю много деталей, как было сказано ранее, это для иллюстративных целей.
$$ \ begin {align}
\ ce {SO2 + O2 & <=> SO4} \\
\ ce {SO4 + O2 & <=> SO3 + O3} \\
\ ce {SO2 + SO2 & <=> SO3 + SO} \\
\ ce {SO2 + O3 & <=> SO3 + O2} \\
& \ text {и т. д.}
\ end {align} $$
Если вы рассмотрите виды, которые обычно доступны в тропосфере, например $ \ ce {N2} $, $ \ ce {NO} $, $ \ ce {h3} $, $ \ ce {CO} $, $ \ ce {CO2} $ и т. д., все становится действительно сложным.
Заключение
Вы не можете написать уравнения половинной реакции для этого равновесия. Половинные реакции в целом не отражают механизм реакции; они всего лишь инструмент для создания общих уравнений реакции.
Механизм реакции значительно сложнее, чем только две полуреакции.
Вы не ошиблись, вам не нужна вода для горения, однако вам нужен какой-то катализатор, способный поглотить избыточную энергию связи.
Список литературы
- Артур Леви, Эрл Л. Мерриман, Уильям Томас Рид, Environ. Sci. Technol., 1970, 4 (8), 653–662.
Арнольд Ф. Холлеман, Нильс Виберг, Эгон Виберг: Lehrbuch der Anorganischen Chemie. 102. Auflage. Де Грюйтер: 2008.(на немецком языке)
Английская версия: Нильс Виберг, А. Ф. Холлеман, Эгон Виберг (ред.): Неорганическая химия Холлемана-Виберга. 1-е издание. Академическая пресса: 2001 г. (Amazon, Google books)Джек Г. Калверт, Фу Су, Ян В. Боттенхейм, Отто П. Страус, Атмосферная среда, 1978, 12 (1-3), 197-226.
диоксид серы | Определение, источники и применение
Диоксид серы , (SO 2 ), неорганическое соединение, тяжелый, бесцветный, ядовитый газ. Он производится в огромных количествах на промежуточных этапах производства серной кислоты.
Он производится в огромных количествах на промежуточных этапах производства серной кислоты.
Подробнее по этой теме
Загрязнение воздуха: диоксид серы
Бесцветный газ с резким удушающим запахом, диоксид серы, образуется при сгорании угля или нефти, которые содержат серу в качестве примеси ….
Двуокись серы имеет резкий раздражающий запах, похожий на запах только что зажатой спички.Встречающийся в природе в вулканических газах и в растворах в водах некоторых теплых источников, диоксид серы обычно получают промышленным способом путем сжигания на воздухе или в кислороде серы или таких соединений серы, как железный колчедан или медный пирит. При сгорании серосодержащего топлива образуется большое количество диоксида серы. В атмосфере он может соединяться с водяным паром с образованием серной кислоты, основного компонента кислотных дождей; во второй половине 20 века меры по борьбе с кислотными дождями получили широкое распространение. Диоксид серы является предшественником триоксида (SO 3 ), используемого для производства серной кислоты. В лаборатории газ можно приготовить путем восстановления серной кислоты (H 2 SO 4 ) до сернистой кислоты (H 2 SO 3 ), которая разлагается на воду и диоксид серы, или путем обработки сульфитов (солей серной кислоты) с сильными кислотами, такими как соляная кислота, снова образуя серную кислоту.
Диоксид серы является предшественником триоксида (SO 3 ), используемого для производства серной кислоты. В лаборатории газ можно приготовить путем восстановления серной кислоты (H 2 SO 4 ) до сернистой кислоты (H 2 SO 3 ), которая разлагается на воду и диоксид серы, или путем обработки сульфитов (солей серной кислоты) с сильными кислотами, такими как соляная кислота, снова образуя серную кислоту.
Диоксид серы можно сжижать при умеренном давлении и комнатной температуре; жидкость замерзает при -73 ° C (-99.4 ° F) и кипит при -10 ° C (14 ° F) при атмосферном давлении. Хотя его основное применение — приготовление серной кислоты, триоксида серы и сульфитов, диоксид серы также используется в качестве дезинфицирующего средства, хладагента, восстановителя, отбеливателя и пищевого консерванта, особенно в сухофруктах.
О соединениях серы и кислорода
[Flickr]В качестве примера образования соединений серы с кислородом можно привести реакцию горения химически чистой серы на воздухе:
S + O₂ → SO₂
[Депонировать фотографии]Существует также реакция, демонстрирующая переход SO₂ в SO₃:
2SO₂ + O₂ → 2SO₃.
Эта реакция протекает в промышленности в присутствии оксида ванадия, который действует как катализатор. Второе условие — температура + 400-500 ⁰С. Из оксида серы (VI) можно получить серную кислоту:
SO₃ + Н₂О → Н₂SO₄
Реакция горения серы является окислительно-восстановительной, т.е. элементы, участвующие в этой реакции, изменяют свою степень окисления. Мы можем поместить степени окисления в уравнение реакции:
S⁰ + О₂⁰ → S⁺⁴О₂⁻²
Сжигание серы [Викимедиа]Для удобства эту реакцию можно разделить на две: для кислорода и для серы.Тогда сразу становится понятно, куда движутся электроны:
О₂⁰ + 4е ̅ → О₂⁻² — кислород принимает электроны, поэтому является окислителем.
S⁰ — 4е ̅ → S⁺⁴ — сера отдает свои электроны, поэтому действует как восстановитель.
Щелкните здесь, чтобы узнать, как получить диоксид серы в домашних условиях. Получение оксида серы (VI) также является окислительно-восстановительной реакцией. Его уравнение с учетом степени окисления записывается следующим образом:
Получение оксида серы (VI) также является окислительно-восстановительной реакцией. Его уравнение с учетом степени окисления записывается следующим образом:
2S⁺⁴О₂⁻² + О₂⁰ -> 2S⁺⁶О₃⁻².
[Депонировать фотографии]Если мы покажем степени окисления в приведенном выше уравнении для получения серной кислоты, станет ясно, что этот процесс не является окислительно-восстановительной реакцией, то есть перенос электронов от одного атома к другому не происходит, а степени окисления элементов до и после реакции не изменяются:
S⁺⁶О₃⁻² + Н⁺₂О⁻² → Н₂⁺S⁺⁶O₄⁻²
Кислотный дождь | Химический факультет
Резюме
Расплавленная сера реагирует с кислородом воздуха с образованием SO2 и SO3, которые закручиваются в свободном пространстве над водой.Образовавшаяся серная кислота растворяется в растворе, который меняет универсальный индикатор с зеленого на желтый и с оранжевого на красный по мере падения pH.
Опасности
И диоксид серы, и триоксид серы токсичны.
Химические вещества и растворы
- универсальный индикаторный раствор
- сера порошковая
Материалы
- Плоскодонная колба для кипячения 500 мл
- Ложка для дефлаграции
- Горелка Бунзена и спички
- Универсальный индикаторный массив
- водопроводная вода
Процедура
- Наполните колбу примерно наполовину водопроводной водой и добавьте несколько капель универсального индикатора.Раствор должен быть зеленым.
- Налейте немного серы в ложку для дефлаграции и нагрейте ее в бунзеновской горелке, пока она не расплавится. Теперь поместите ложку для дефлаграции в свободное пространство колбы так, чтобы она не была погружена в воду.
- Осторожно покрутите колбу, пока цвет индикатора не изменится с зеленого на красный.
(В качестве альтернативы можно использовать флорентийскую колбу на 6000 мл. Объем воды можно увеличить, чтобы замедлить изменение индикатора)
Объем воды можно увеличить, чтобы замедлить изменение индикатора)
Обсуждение
При сгорании сера соединяется с кислородом с образованием диоксида серы и триоксида серы:
\ (\ ce {S _ {(s)} + O2 _ {(g)} -> SO2 _ {(aq)}} \)
\ (\ ce {2S _ {(s)} + 3O2 _ {(g)} -> 2SO3 _ {(aq)}} \)
Затем диоксид серы и триоксид серы объединяются с водой с образованием кислот:
\ (\ ce {SO2 _ {(g)} + h3O _ {(1)} -> h3SO3 _ {(aq)}} \)
\ (\ ce {SO3 _ {(g)} + h3O _ {(1)} -> h3SO4 _ {(aq)}} \)
Образовавшаяся кислота изменяет индикатор.
На сжигание ископаемого топлива в промышленности, на электростанциях и в домах приходится большая часть выбросов SO2 в атмосферу.
Диоксид серы окисляется до триоксида серы несколькими путями.
И диоксид серы, и триоксид серы реагируют с дождевой водой с образованием кислот.
Образующиеся кислоты могут разъедать здания из известняка и мрамора.
На северо-востоке США уровень pH осадков составляет 4.
Процесс сжигания угля и его продукты
Топливо — это любое сочетание органических и неорганических материалов.Горение — это быстрая химическая реакция, при которой топливо реагирует с кислородом с выделением тепла.
Предстоящий тренинг по химической очистке котлов и оборудования электростанций
- Сгорание — быстрая химическая реакция, при которой топливо реагирует с кислородом с выделением тепла.
Топливо — это любое сочетание органического и неорганического материала, которое во время химической реакции или превращения выделяет большое количество тепла
Вещества, которые горят в воздухе для выделения тепла, называются горючими веществами
.Для горения необходим воздух
Минимальная температура, при которой улавливается топливо, называется температурой воспламенения.
Различные виды топлива имеют разные температуры воспламенения, например: температура возгорания масла меньше угольной
Вещества с очень низкой температурой воспламенения называются легковоспламеняющимися веществами, например Бензин, СНГ, КПГ и т.
 Д.
Д.
Есть три вида топлива
Твердое топливо, например Древесина, уголь
Жидкое топливо e.грамм. керосин, бензин, дизельное топливо, масло
Газообразное топливо, например СУГ, КПГ, биогаз, водород
Следующие три условия необходимы для сгорания
- Топливо
- Воздух (для подачи кислорода)
- Нагрев (для повышения температуры выше или равной температуре воспламенения)
Существует три типа горения, как показано ниже:
Быстрое сгорание: это сгорание, при котором топливо сгорает быстро и выделяет тепло с помощью внешнего тепла.
Самовозгорание: это горение, при котором топливо сгорает самопроизвольно без какого-либо внешнего тепла.
Взрыв: это горение, при котором топливо внезапно сгорает и выделяет тепло с помощью внешнего тепла или давления.
Пламя:
- Пламя — зона горения
- Пламя имеет три зоны, как показано ниже:
- Внутренняя зона: Есть несгоревшие пары топлива
- Средняя зона: Здесь происходит частичное сгорание паров топлива
- Внешняя зона: здесь происходит полное сгорание паров топлива
Характеристики хорошего топлива
- Характеристики хорошего топлива следующие:
- Есть в наличии
- Дешёвый
- Легко хранить и транспортировать
- Горит с умеренной скоростью, поэтому горение легко контролировать
- Вырабатывает большое количество тепла
- Не оставляет нежелательных веществ после горения
- Не вызывает загрязнений
Характеристики угля
Уголь обладает многими характеристиками хорошего топлива, поэтому в Индии около 58% электроэнергии вырабатывается путем сжигания угля.
Уголь во многом отличается от других видов топлива, как показано ниже:
- Обычно в топливе, отличном от угля, есть определенные углеводороды, что означает, что C и H в топливе не очень много.
- Уголь является гетерогенным топливом и имеет только предполагаемую структуру C и H и сильно варьируется от шахты к шахте и даже в одной шахте от пласта к пласту.
- C и H в угле можно узнать только после проведения окончательного анализа, причем поведение этих углеводородов будет зависеть от их реакционной способности и от того, как этот уголь образуется.
- Завершение сжигания угля будет зависеть от того, как углеродные кольца сформированы и связаны.
- Некоторые угли горят медленно и требуют большего времени пребывания в печи
Для процесса сгорания наиболее важны температура, турбулентность и время
Температура: Топливо должно достигнуть температуры воспламенения и для стабильного пламени эту температуру необходимо поддерживать.
 Для угля температура воспламенения находится в диапазоне от 400 до 425 градусов по Цельсию
Для угля температура воспламенения находится в диапазоне от 400 до 425 градусов по ЦельсиюТурбулентность: турбулентность помогает каждой частице быстро контактировать с необходимой молекулой кислорода для быстрого сгорания с минимальным избытком воздуха
Время: в зависимости от размера частиц топлива требуется некоторое время для полного сгорания.Это время для полного сгорания сокращается за счет турбулентности и повышения температуры
Горение — это быстрая химическая реакция между топливом и кислородом. Во время горения горючие элементы угля, такие как углерод, сера, водород, соединяются с кислородом и выделяют тепло вместе с соответствующими оксидами. Источник кислорода — воздух. В воздухе присутствует 21% кислорода по объему, по массе — 23,2%
При сжигании угля с выделением тепла происходят следующие химические реакции:
C + O2 = CO2 + 8084 ккал / кг углерода (33940 кДж / кг)
S + O2 = SO2 + 2224 ккал / кг серы (9141 кДж / кг)
2 ч3 + O2 = 2 ч3О + 28922 ккал / кг водорода (142670 кДж / кг)
2C + O2 = 2CO + 2430 ккал / кг углерода (10120 кДж / кг)
При сжигании угля получают следующие продукты:
Зола (зольный остаток и зола-унос)
CO2
CO
SO2
h3O
NOX
Взвешенные твердые частицы
Вредное воздействие процесса сжигания угля
Сжигание угля вызывает следующие вредные эффекты:
Неполное сгорание угля дает окись углерода (CO), которая является ядовитым газом
При полном сгорании угля образуется двуокись углерода (CO2), которая вызывает повышение температуры воздуха.
 Это называется глобальным потеплением. Это вызывает таяние полярных льдов, повышение уровня моря и затопление прибрежных территорий.
Это называется глобальным потеплением. Это вызывает таяние полярных льдов, повышение уровня моря и затопление прибрежных территорий.SOX — диоксид серы (SO2), триоксид серы (SO3)
NOX — это оксид азота (N2O), оксид азота (NO), диоксид азота (N2O). Образование NOX при сжигании угля — сложный процесс. Оксид азота образуется из атмосферного азота, известного как термический NO, и химически связанного азота в топливе, известного как химический NO
.Производятся оксиды серы (SOX) и оксиды азота (NOX), которые растворяются в дождевой воде и образуют кислотные дожди, вредные для сельскохозяйственных культур, почвы и разрушающие здания.
Принимая во внимание все вышеперечисленное вредное воздействие сжигания угля, оптимизацию использования угля, т.е. уголь, необходимый на единицу выработки, необходимо минимизировать в максимально возможной степени за счет принятия всех доступных технологических разработок. Это также приведет к снижению удельных затрат на производство электроэнергии.

Экспериментальное исследование взрывов серной пыли постоянного объема
Пламя пыли изучается на протяжении десятилетий из-за их важности в
промышленная безопасность и предотвращение несчастных случаев.В последнее время пыльное пламя стало многообещающим кандидатом для противодействия биологической войне. В частности, сера является одним из элементов, представляющих интерес, но пламя серной пыли до конца не изучено. Температура пламени и
Скорость пламени измерялась для серного пламени с концентрацией частиц 280 и 560 г / м 3 и концентрацией кислорода от 10% до 42% по объему. Температура пламени увеличивалась с увеличением концентрации кислорода примерно от 900 К для случаев с 10% -ным содержанием кислорода до температур, превышающих 2000 К в условиях обогащения кислородом.Также наблюдалось небольшое повышение температуры с увеличением концентрации частиц. Наблюдалось увеличение скорости пламени с приблизительно 10 см / с с 10% кислорода до 57 и 81 см / с с 42% кислорода для случаев 280 и 560 г / м 3 соответственно. Масштабный анализ показал, что пламя, горящее в 21% и 42% кислорода, ограничено диффузией. Наконец, было определено, что данные давления и времени, вероятно, могут быть использованы для измерения скорости пламени при взрывах пыли постоянного объема.
Масштабный анализ показал, что пламя, горящее в 21% и 42% кислорода, ограничено диффузией. Наконец, было определено, что данные давления и времени, вероятно, могут быть использованы для измерения скорости пламени при взрывах пыли постоянного объема.
1.Введение
Горение облака серной пыли является потенциальным кандидатом на противодействие биологическому оружию. Серная пыль использовалась как пестицид [1]. Однако более интригующий аспект облаков серной пыли состоит в том, что они производят оксиды серы, которые являются химическими предшественниками серной кислоты [1]. Хорошо известно, что серная кислота чрезвычайно агрессивна и опасна для живых организмов. Идея состоит в том, что горящие облака серы будут производить оксиды серы. В присутствии воды может образоваться серная кислота.Считается, что образовавшаяся серная кислота в сочетании с повышенными температурами и производимым ультрафиолетовым излучением убьет споры. Было показано, что другие сильные кислоты обладают спорицидной тенденцией [2].
В последние годы изучались составы для применения в биоразрушении. Механические сплавы алюминия и йода [3, 4], а также термиты из пятиокиси алюминия и йода были изучены [5] и показали, что они эффективны в уничтожении биологических спор, по крайней мере частично, за счет высвобождения йода.С этой целью были исследованы и другие механические сплавы титана и бора [3, 6, 7].
По сути, пламя серной пыли уникально. Сера — одна из двух элементарных видов пыли, продукты сгорания которой при стандартных условиях (298 К, 1 атм) являются газообразными, а другой — углеродом. В отличие от углерода, температуры плавления и кипения серы намного ниже, чем температура адиабатического пламени пламени сера-воздух. Такое сочетание факторов создает условия для пылевого пламени с потенциально сильной газовой составляющей.
На сегодняшний день очень мало исследований посвящено изучению облаков серной пыли. Ограниченная работа Пруста [8] о пламени серной пыли — одна из немногих, в которых это делается; тем не менее, эта работа предоставила мало подробностей о механизме горения. Таким образом, основная цель текущей работы состоит в том, чтобы измерить фундаментальные аспекты горения облака серной пыли с точки зрения фундаментальных величин (например, скорости пламени) и получить представление о задействованных физических и химических механизмах. Кроме того, исследуется использование данных давления-времени от взрывов пыли постоянного объема для определения скорости пламени.
Таким образом, основная цель текущей работы состоит в том, чтобы измерить фундаментальные аспекты горения облака серной пыли с точки зрения фундаментальных величин (например, скорости пламени) и получить представление о задействованных физических и химических механизмах. Кроме того, исследуется использование данных давления-времени от взрывов пыли постоянного объема для определения скорости пламени.
2. Экспериментальные методы
В данном исследовании используется кубическая камера объемом 31 л для максимального оптического доступа. Пять сторон (включая дверь) имеют акриловые окна с круглыми обзорными площадками диаметром 6,7 мм. Каждое окно крепится к стенке камеры с помощью трубного фланца 6 размера. Порты датчиков газа, вакуума и давления расположены сверху и по бокам камеры. Используется пьезорезистивный датчик давления Kulite (XTM-190-250G), а сигналы обрабатываются кондиционером Endevco PR Conditioner модели 106.На дне (шестая сторона) пять портов диаметром 1 дюйм. Один порт расположен в центре, а остальные четыре на расстоянии 3 дюймов от центра, каждый в разном направлении (то есть влево, вправо, спереди и сзади). Один смещенный от центра порт используется для прохода проволоки для источника зажигания.
Один порт расположен в центре, а остальные четыре на расстоянии 3 дюймов от центра, каждый в разном направлении (то есть влево, вправо, спереди и сзади). Один смещенный от центра порт используется для прохода проволоки для источника зажигания.
Порт в центре камеры имеет насадку с сорока отверстиями диаметром 0,889 мм (сверло № 65) под углом 45 градусов. Инжектор твердых частиц, состоящий из двух частей, установлен под центральным портом камеры.Первая деталь крепится к камере винтами In-20. Он содержит порт сбоку, который присоединяется к линии сжатого воздуха, и трубку из нержавеющей стали, которая проходит к центру и изогнута на 90 градусов вниз. Порошок помещается в алюминиевый держатель с коническим дном (от сверла диаметром 1 дюйм), который крепится ко второй части инжектора. Центрированное колено дюймовой трубки направляет поток воздуха вниз в держатель порошка. Взрыв под давлением отскакивает от дна порошкового держателя и уносит частицы вверх через сопло в камеру.Камера герметизирована уплотнительными кольцами на окнах, форсунке и двери. Дополнительные описания камеры приведены в [9].
Дополнительные описания камеры приведены в [9].
Использовали порошок серы (-325 меш) от Alfa Aesar. Анализ размера частиц проводили с использованием сканирующего электронного микроскопа Jeol 6060LV (SEM). Частицы имели средний диаметр 22,4 мкм при среднем диаметре по Заутеру 30,4 мкм. Средство, предотвращающее слеживание, Aerosil 200 (Evonik) использовалось для улучшения характеристик диспергирования серы. По данным производителя, средний диаметр порошка Aerosil 200 составлял 12 нм.Распределение по размерам не измеряли, поскольку частицы были слишком малы для разрешения с помощью SEM. Серу смешивали с 1% Aerosil 200 по массе в низкоэнергетическом барабане в течение 3 часов. Было обнаружено, что добавление антислеживающего агента оказывает заметное влияние на текучесть и диспергирование серы. Более подробная информация о выборе антислеживающего агента приведена в [9].
В инжектор поместили смесь серы известной массы. Массу порошка, оставшегося в инжекторе после испытания, измеряли для определения фактического количества впрыснутого порошка. Зажимы типа «крокодил» на штырях зажигания удерживали воспламенитель в центре камеры. Воспламенитель мощностью 4 Дж (пирогенный мостик, Estes) был использован для инициирования горения. Заряд зажигали путем разряда конденсатора емкостью 1 Ф при 4000 В от пожарной установки RISI (модель FS-43).
Зажимы типа «крокодил» на штырях зажигания удерживали воспламенитель в центре камеры. Воспламенитель мощностью 4 Дж (пирогенный мостик, Estes) был использован для инициирования горения. Заряд зажигали путем разряда конденсатора емкостью 1 Ф при 4000 В от пожарной установки RISI (модель FS-43).
Перед испытанием камера была помещена под вакуум и заполнена до давления немного ниже атмосферного (2 дюйма ртутного столба), так что газ, используемый для впрыска, довел общее давление до 1 атмосферы. Для впрыскивания порошка использовали выброс воздуха 100 фунтов на кв. Дюйм.Инъекция длилась всего одну секунду при постоянном давлении. Возгорание произошло через 400 мс после окончания закачки, что позволило сформировать однородное облако и рассеять турбулентность.
Определение времени воспламенения было выполнено путем анализа двумерных измерений концентрации частиц. Эти измерения лазерной экстинкции предоставили количественную информацию о том, как концентрация частиц развивалась во времени и пространстве. Интенсивность пикселей из изображений, полученных до впрыска порошка, была усреднена и использована в качестве интенсивности падающего излучения в Законе Бирса:
Интенсивность пикселей из изображений, полученных до впрыска порошка, была усреднена и использована в качестве интенсивности падающего излучения в Законе Бирса:
. Интенсивность каждого пикселя в последующих изображениях позволяла определять концентрацию частиц, поскольку эффективность экстинкции () из теории Ми были известны средний диаметр Заутера, длина пути (355 мм) и плотность серы.Среднее арифметическое и стандартное отклонение концентрации частиц для всех пикселей были рассчитаны, чтобы обеспечить статистический анализ однородности облака. Время воспламенения принималось как момент времени, когда пространственно усредненная концентрация приближалась к ожидаемому значению (основанному на количестве впрыснутого порошка), а стандартное отклонение приближалось к минимуму или уменьшалось.
Этот метод также обеспечил визуальное свидетельство рассеяния турбулентности. Хотя турбулентность никогда не измерялась напрямую, считается, что это количественное измерение концентрации частиц дает достаточное представление о процессе нагнетания. Более того, все экспериментальные условия в этой работе имеют одинаковые условия впрыска и зажигания (например, задержка зажигания и противодавление впрыска). Сравнение результатов для каждого условия должно увидеть минимальное влияние турбулентности. Читателю предлагается обратиться к [9] для получения дополнительных сведений и обсуждения этих измерений.
Более того, все экспериментальные условия в этой работе имеют одинаковые условия впрыска и зажигания (например, задержка зажигания и противодавление впрыска). Сравнение результатов для каждого условия должно увидеть минимальное влияние турбулентности. Читателю предлагается обратиться к [9] для получения дополнительных сведений и обсуждения этих измерений.
2.1. Диагностика
Измерения скорости пламени проводились ионизационными датчиками, аналогично работе Наира и Гупты [10], но применялись к пламени пыли, а не к изученному ими газообразному пламени.Два из смещенных от центра отверстия диаметром 1 использовались для пропуска проводов для ионизационных датчиков, где провода заканчивались коннектором термопары R-типа (Omega). Две вольфрамовые проволоки диаметром 0,01 пропускались через трубку из оксида алюминия с двумя отверстиями и внешним диаметром. Примерно дюйм каждого провода выходит за пределы керамической трубки. Другой конец каждого провода был присоединен к дополнительному разъему термопары. Расположение ионизационных датчиков показано на рисунке 1, где относительное расположение двух гребенок ионизационных датчиков было выбрано для получения информации о симметрии пламени.Расстояние между зондами в каждой гребенке составляло мм.
Расположение ионизационных датчиков показано на рисунке 1, где относительное расположение двух гребенок ионизационных датчиков было выбрано для получения информации о симметрии пламени.Расстояние между зондами в каждой гребенке составляло мм.
Сигналы регистрировались с помощью пары осциллографов Picoscope 4424, которые собирали 200 000 выборок за 2-секундный период. Пара следов ионизационного зонда от серного пламени показана на рисунке 3. Время, когда первое падение напряжения достигало минимума для каждого следа, принималось за время, когда фронт пламени достигал зонда. Лазерный теневой снимок качественно подтвердил это прибытие, как показано на рисунке 2. Красная кривая указывает местоположение фронта пламени.Наблюдалось, что эта функция достигает ионизационного зонда в то же самое время (то есть в пределах временного разрешения камеры) следа напряжения от ионизационного зонда (рисунок 3). Измерение теневой диаграммы также предоставило качественную информацию о форме пламени. Хотя участки фронта гладкие, фронт пламени не симметричен. Причина этого, вероятно, заключается в сочетании остаточной турбулентности и естественной конвекции.
Хотя участки фронта гладкие, фронт пламени не симметричен. Причина этого, вероятно, заключается в сочетании остаточной турбулентности и естественной конвекции.
Показанное на рисунке 3 было использовано для расчета скорости пламени.Неопределенность номинального значения была связана с каждым измерением, что в основном связано с измерением времени прибытия. Поправки к плотности рассчитывались с использованием Cantera [11] и механизма SOx из Университета Лидса [12].
Измерения температуры проводились с помощью термопар и пирометрии. Термопары (50 мкм, м R-типа, Omega part P13R-002) были покрыты тонким слоем аэрозольной краски из оксида алюминия (ZYP Coating, A аэрозоль) для минимизации каталитических эффектов.Термопары были прикреплены к разъемам внутри камеры взрыва пыли таким же образом, как и ранее описанные ионизационные зонды. Удлинительный провод термопары был подключен к системе сбора данных (DAQ) Omega (часть OMB-DAQ-3005). Температура измерялась каждые 100 мк с в течение первых 2 секунд каждого теста. Система сбора данных запускалась импульсом TTL, генерируемым генератором задержки. В измерения вносились поправки на радиационные и кондуктивные потери.
Температура измерялась каждые 100 мк с в течение первых 2 секунд каждого теста. Система сбора данных запускалась импульсом TTL, генерируемым генератором задержки. В измерения вносились поправки на радиационные и кондуктивные потери.
Пирометрия измеряет температуру конденсированных фаз путем сравнения теплового фона с уравнением Планка (с учетом коэффициента излучения).Трехцветный пирометр использовался для получения информации о температуре с временным разрешением путем мониторинга излучения на 700, 825 и 900 нм. Фотоумножители (ФЭУ) Hamamatsu R928 использовались для каналов 700 и 825 нм, а ФЭУ R636-10 использовались для канала 900 нм. Свет собирался в тройной оптоволоконный кабель, где каждая из трех ветвей шла к разному ФЭУ. Счетверенный предусилитель Stanford Research System (SRS) 300 МГц (SRS модель SR445) приводил в соответствие каждый сигнал перед записью с помощью Picoscope.
Спектрометр Ocean Optics Jaz с волоконно-оптической связью также использовался для пирометрических измерений. Этот спектрометр регистрирует спектры от 200 до 870 нм. Однако из-за особенностей спектра от ультрафиолета до видимой области спектра и от ультрафиолета до видимой области спектра для определения температуры конденсированной фазы использовалось только тепловое излучение в диапазоне от 600 до 850 нм. Калибровка интенсивности для обоих устройств проводилась с помощью вольфрамовой лампы (Ocean Optics LS Cal 1) с известной спектральной интенсивностью для исследуемых спектральных областей.
Этот спектрометр регистрирует спектры от 200 до 870 нм. Однако из-за особенностей спектра от ультрафиолета до видимой области спектра и от ультрафиолета до видимой области спектра для определения температуры конденсированной фазы использовалось только тепловое излучение в диапазоне от 600 до 850 нм. Калибровка интенсивности для обоих устройств проводилась с помощью вольфрамовой лампы (Ocean Optics LS Cal 1) с известной спектральной интенсивностью для исследуемых спектральных областей.
3. Результаты и обсуждение
Измерения повышения давления, температуры и скорости пламени были выполнены для 6 различных условий. Были использованы две разные концентрации смеси сера / антислеживающий агент (280 и 560 г / м 3 ) и три разные концентрации кислорода (10, 21 и 42% по объему). Оставшийся остаток газа составлял азот. Стехиометрические условия составляли 280 г / м 3 в 21% кислороде и 560 г / м 3 в 42% кислорода. Выбор этих условий был основан на рассмотрении заявки (т. е. горение на воздухе) и способность изолировать эффекты концентрации частиц и стехиометрии. Из-за сложности создания пламени при более низких концентрациях частиц не удалось использовать эти концентрации. Склонность серы к агломерации, особенно при более высоких концентрациях серы, дает верхний предел используемых концентраций частиц. Более подробно проблема агломерации рассмотрена в [9].
е. горение на воздухе) и способность изолировать эффекты концентрации частиц и стехиометрии. Из-за сложности создания пламени при более низких концентрациях частиц не удалось использовать эти концентрации. Склонность серы к агломерации, особенно при более высоких концентрациях серы, дает верхний предел используемых концентраций частиц. Более подробно проблема агломерации рассмотрена в [9].
3.1. Данные по давлению
Типичная кривая зависимости давления от времени и ее первая временная производная показаны на рисунке 4.Максимальный рост давления показан на рисунке 5 вместе с теоретическим максимальным ростом давления и был определен по программе НАСА CEA [13] при постоянном объеме. Было замечено, что рост давления увеличивается с концентрацией частиц и увеличением концентрации кислорода. Эти данные согласуются с работой Кэшдоллара [14] после масштабирования их данных о давлении для учета различных объемов камеры между объектами, используемыми в каждом соответствующем исследовании.
Условия 560 г / м 3 в среде 21% кислорода привели к повышению давления, превышающему максимальное давление.Этот результат может быть связан с оседанием частиц из-за увеличения агломерации во время эксперимента. Об увеличении агломераций при более высоких загрузках частиц сообщалось в [9]. Если из суспензии выпадут дополнительные частицы, это приблизит коэффициент эквивалентности к стехиометрическому для этих условий. Максимальное давление увеличится и приблизится к значению, наблюдаемому при более низкой загрузке частиц. Аналогичный эффект осаждения частиц следует ожидать для условий 10% и 42% кислорода.Разница в максимальном росте давления на 10% незначительна, поскольку максимальные теоретические подъемы давления практически идентичны. Рисунок 5 показывает, что максимальное давление (пунктирные линии) в случае обогащенного кислородом было бы ниже, если бы осаждение частиц увеличивалось. Это уменьшение согласуется с тем, что наблюдалось экспериментально. Для всех этих условий сложно количественно оценить, насколько должно измениться давление теоретически, поскольку фактическая масса осевших частиц неизвестна.
Для всех этих условий сложно количественно оценить, насколько должно измениться давление теоретически, поскольку фактическая масса осевших частиц неизвестна.
Было видно, что максимальная скорость повышения давления, рис. 6, монотонно увеличивается с увеличением концентрации кислорода. Для концентраций кислорода выше по объему скорость роста давления тем выше, чем выше концентрация частиц. Скорость повышения давления показывает, как быстро отводится тепло. Важность этой величины будет видна в (2), где скорость максимального повышения давления прямо пропорциональна скорости пламени.
3.2. Достоверность данных «давление-время» для измерения скорости пламени
Данные «давление-время» также могут использоваться для определения скорости пламени.Дахо и де Гоуи [15] проанализировали взрывы постоянного объема (не обязательно взрывы пыли) с термодинамической точки зрения, чтобы связать данные давление-время со скоростью ламинарного пламени. Это уравнение показано, где и — мгновенное давление, — начальное и максимальное давления, соответственно, и — сферический эквивалентный радиус, принимаемый за радиус сферы того же объема, что и камера, используемая в текущем исследовании. Отношение удельных теплоемкостей принималось постоянным (и приблизительно равным 1.4 здесь из-за использования воздуха), и — ламинарная скорость пламени. Анализ, проведенный Дахо и де Гоуи [15] по этому методу, включал дополнительное предположение о линейной зависимости от давления массовой сгоревшей фракции (3). Работа Luijten et al. [16] использовали многозонный подход для разработки более строгого определения для, хотя оно здесь не показано из-за его длины.
Отношение удельных теплоемкостей принималось постоянным (и приблизительно равным 1.4 здесь из-за использования воздуха), и — ламинарная скорость пламени. Анализ, проведенный Дахо и де Гоуи [15] по этому методу, включал дополнительное предположение о линейной зависимости от давления массовой сгоревшей фракции (3). Работа Luijten et al. [16] использовали многозонный подход для разработки более строгого определения для, хотя оно здесь не показано из-за его длины.
Вывод (2) основан на идеальных предположениях, которые на практике могут не соответствовать действительности для взрывов пыли.Они заключаются в следующем: (1) Камера хорошо изолирована и предполагается, что она заполнена реагентами, которые идеально перемешаны и застаиваются. (2) Смесь воспламеняется из центра, и образующийся фронт пламени имеет сферическую форму, бесконечно тонкий и без складок. (3) Фронт пламени разделяет камеру на две области: сгоревший и несгоревший газы, где смеси внутри каждой зоны однородны (например, по составу и температуре). (4) Поскольку камера имеет фиксированный объем и тепло не может выйти из-за хорошо утепленных стен, давление повышается из-за подвода тепла.Более того, горячие продукты сгорания внутри сферического пламени будут расширяться, изоэнтропически сжимая несгоревший газ.
(4) Поскольку камера имеет фиксированный объем и тепло не может выйти из-за хорошо утепленных стен, давление повышается из-за подвода тепла.Более того, горячие продукты сгорания внутри сферического пламени будут расширяться, изоэнтропически сжимая несгоревший газ.
Две концентрации смеси серы были испытаны, чтобы определить, подходит ли использование данных давления-времени для измерения скорости пламени для взрыва пыли. Концентрация, близкая к стехиометрической, составляющая 3 г / м, и состояние с высоким содержанием топлива г / м 3 были воспламенены на воздухе пиротехническим воспламенителем. Выделение энергии воспламенителем не оказало существенного влияния на измерения [9].Неопределенность в концентрации связана с распределением измеренной массы введенного порошка.
Две гребенки ионизационных зондов, описанные выше, использовались для непосредственного измерения скорости распространения пламени и сравнения со значениями, рассчитанными по (2) и (3). Расчетная скорость пламени, основанная на данных «давление-время», показанных на рисунке 4, отображается на рисунке 7.
Расчетная скорость пламени, основанная на данных «давление-время», показанных на рисунке 4, отображается на рисунке 7.
Расчетная скорость ламинарного пламени первоначально значительно колеблется из-за низкого отношения сигнал / шум от сигнала датчика давления.Эти колебания затухают по мере повышения давления. Несмотря на колебательный характер, каждая расчетная кривая колеблется вокруг постоянного значения до момента, когда достигается максимум. Время максимальной скорости повышения давления показано вертикальными линиями на рисунках 4 и 7. Скорость ламинарного пламени из данных о давлении была принята как средняя скорость от 20 мс после воспламенения до момента достижения времени. Время 20 мс использовалось для ограничения влияния низкого отношения сигнал / шум данных давления очень близко к моменту воспламенения.Снижение скорости ламинарного пламени после этого также наблюдалось Santhanam et al. [17]. Причина уменьшения скорости пламени, скорее всего, связана с потерями тепла. Когда пламя приближается к стенкам сосуда, дополнительное тепло теряется на стенках, температура которых близка к комнатной. Скорость повышения давления, которая связана со скоростью тепловыделения, уменьшается, потому что часть этой энергии поглощается стенками камеры. Скорость повышения давления пропорциональна скорости пламени (см. (2)), поэтому наблюдается уменьшение скорости пламени.Анализ первичного режима передачи тепла от пламени обсуждается в следующем разделе.
Когда пламя приближается к стенкам сосуда, дополнительное тепло теряется на стенках, температура которых близка к комнатной. Скорость повышения давления, которая связана со скоростью тепловыделения, уменьшается, потому что часть этой энергии поглощается стенками камеры. Скорость повышения давления пропорциональна скорости пламени (см. (2)), поэтому наблюдается уменьшение скорости пламени.Анализ первичного режима передачи тепла от пламени обсуждается в следующем разделе.
3.2.1. Анализ тепловых потерь
Считалось, что снижение скорости пламени после этого связано с потерями тепла. С увеличением количества теплового излучения от пыльного пламени необходимо определить важность различных режимов теплопередачи, в частности теплопроводности и излучения.
Количество энергии, потерянной стенками камеры, трудно определить количественно из-за сложности проблемы.Однако относительную важность проводимости по сравнению с потерями на излучение можно проанализировать качественно. Отношение теплопроводных потерь к радиационным потерям (4) было аппроксимировано для различных температур пламени и местоположения (т.е. расстояния между пламенем и стенкой), где — теплопроводность, — коэффициент излучения, — постоянная Стефана-Больцмана, — расстояние между пламенем и стеной, а — температура в месте, обозначенном нижним индексом. Переменной является соотношение площади поверхности частиц в пламени и площади передней поверхности пламени.Поскольку коэффициент излучения порошка неизвестен, отношение тепловых потерь было рассчитано как функция коэффициента излучения. На рисунке 8 показаны результаты этих расчетов. Рассмотрим
Отношение теплопроводных потерь к радиационным потерям (4) было аппроксимировано для различных температур пламени и местоположения (т.е. расстояния между пламенем и стенкой), где — теплопроводность, — коэффициент излучения, — постоянная Стефана-Больцмана, — расстояние между пламенем и стеной, а — температура в месте, обозначенном нижним индексом. Переменной является соотношение площади поверхности частиц в пламени и площади передней поверхности пламени.Поскольку коэффициент излучения порошка неизвестен, отношение тепловых потерь было рассчитано как функция коэффициента излучения. На рисунке 8 показаны результаты этих расчетов. Рассмотрим
Расчетные отношения, показанные на рисунке 8, предполагали, что отношение площади поверхности частицы к площади пламени равно единице. Это предположение нереально, поскольку частицы составляют лишь часть фронта пламени для данной толщины пламени. Величину можно определить, исходя из геометрических соображений, среднего диаметра частиц и толщины пламени. Santhanam et al. [17] рассчитали толщину пламени пламени алюминиевой пыли, умножив скорость пламени на время горения отдельной частицы Al. Эта же оценка более сложна для серной пыли, поскольку время горения отдельной частицы неизвестно. Будет обсуждаться влияние толщины пламени.
Santhanam et al. [17] рассчитали толщину пламени пламени алюминиевой пыли, умножив скорость пламени на время горения отдельной частицы Al. Эта же оценка более сложна для серной пыли, поскольку время горения отдельной частицы неизвестно. Будет обсуждаться влияние толщины пламени.
Высокие температуры и большие значения коэффициента излучения способствуют тепловым потерям с преобладанием излучения, когда этого и следовало ожидать, поскольку тепловое излучение зависит от этих двух параметров.Для большинства условий в этом наборе расчетов излучение либо доминирует, либо сравнимо с проводимостью, как показано на рисунке 8. Однако, когда учитывается фактическая площадь поверхности частиц по сравнению с фронтом пламени, значение уменьшается с единицы до приблизительно 0,35 и 0,038 при толщине пламени 1 и 10 мм соответственно. Этот фактор будет определять отношение от (4) к проводимости. Следовательно, если толщина факела составляет порядка нескольких миллиметров или больше, маловероятно, что наблюдаемое снижение расчетной скорости пламени будет преобладать за счет радиационных потерь, если только коэффициент излучения, температура и диаметр пламени (т. е.е., вплотную к стене) большие. Хотя для точного определения толщины пламени требуется дополнительная информация, это открытие все же имеет значение. В тепловых потерях от пламени серной пыли не может преобладать радиация, что противоречит тому, что было сделано в отношении других пыльных пламен (например, Al), где продукт также является твердым [17].
е.е., вплотную к стене) большие. Хотя для точного определения толщины пламени требуется дополнительная информация, это открытие все же имеет значение. В тепловых потерях от пламени серной пыли не может преобладать радиация, что противоречит тому, что было сделано в отношении других пыльных пламен (например, Al), где продукт также является твердым [17].
3.2.2. Обсуждение
Измеренные скорости пламени в ходе всех испытаний для обоих методов измерения показаны на рисунке 9. Наблюдается большой разброс данных для обеих концентраций.Считается, что наблюдаемый диапазон скоростей пламени, по крайней мере, частично связан с турбулентностью, которая осталась в системе после процесса впрыска. Было замечено, что скорости пламени, измеренные в каждом направлении для одного эксперимента, в некоторых случаях изменялись более чем на 50%. Более того, были случаи, когда сигналы от двух зондов в одной паре указывали на то, что пламя появилось одновременно. Это наблюдение, вероятно, связано с тем, что пламя приближается к паре ионизационных зондов сбоку, а не в лоб, как можно было бы ожидать от сферического пламени. Эта точка зрения дополнительно подтверждается асимметрией, наблюдаемой сильно нерегулярным фронтом, наблюдаемым при измерениях теневого изображения [9].
Эта точка зрения дополнительно подтверждается асимметрией, наблюдаемой сильно нерегулярным фронтом, наблюдаемым при измерениях теневого изображения [9].
Рассчитанные скорости ламинарного пламени на основе данных давления и ионизационных датчиков показаны на рис. 9. Видно разумное согласие между двумя методами измерения. Скорости пламени, указанные Прустом [8], были приблизительно ниже, чем стехиометрическая скорость пламени, измеренная в текущей работе. Этот результат предполагает, что может использовать данные давление-время для оценки скорости ламинарного пламени.Измеренные здесь более высокие скорости пламени, вероятно, частично связаны с повышенной турбулентностью здесь, хотя это трудно доказать без каких-либо сомнений, поскольку уровень турбулентности не измерялся ни в одном исследовании. Естественная конвекция потенциально также сыграла свою роль. Горящие частицы серы производят горячие газы, которые, конечно, поднимутся вверх. Затем восходящая тяга искажает фронт пламени, потенциально увеличивая площадь поверхности. Свидетельство эффекта естественной конвекции можно наблюдать на рисунке 2, где пламя явно распространяется вверх больше, чем вниз.
Свидетельство эффекта естественной конвекции можно наблюдать на рисунке 2, где пламя явно распространяется вверх больше, чем вниз.
Следовательно, использование этого метода для определения ламинарной скорости пламени нецелесообразно из-за того, как турбулентность и естественная конвекция влияют на форму пламени. Он лучше представляет скорость пламени эквивалентного сферического пламени с той же скоростью расхода массы. При этом данные давления-времени действительно обеспечивают измерение скорости пламени на основе степени турбулентности. Этот результат должен по-прежнему позволять сравнивать пламя в разных условиях, пока степень турбулентности остается постоянной (т.е., параметры впрыска, задержка зажигания и энергия).
3.3. Температура пламени
Температуру пламени серы измеряли термопарой и пирометрией. Оба измерения использовались для определения максимальной температуры. Термопара обеспечивала пиковую температуру локально, в то время как измерения пирометром указывали пиковую температуру в поле зрения пирометра. Пространственно интегрированный сигнал пирометрии всегда смещен в сторону наиболее горячих областей из-за сильной зависимости температуры от интенсивности теплового излучения.Данные пирометрии были собраны с помощью 3-цветного пирометра PMT и спектрометра Jaz Ocean Optics. Следует отметить, что использовались только сигналы 825 нм и 905 нм, поскольку канал 700 нм не обеспечивал достаточный уровень сигнала. Время интегрирования всех данных, собранных спектрометром, составляло 10 мс.
Пространственно интегрированный сигнал пирометрии всегда смещен в сторону наиболее горячих областей из-за сильной зависимости температуры от интенсивности теплового излучения.Данные пирометрии были собраны с помощью 3-цветного пирометра PMT и спектрометра Jaz Ocean Optics. Следует отметить, что использовались только сигналы 825 нм и 905 нм, поскольку канал 700 нм не обеспечивал достаточный уровень сигнала. Время интегрирования всех данных, собранных спектрометром, составляло 10 мс.
Типичные кривые данных с временным разрешением, предоставленные пирометром ФЭУ, показаны на рисунке 10 с расчетной температурой с использованием приближения серого тела. Ранний пик, показанный на рисунке 10, был обусловлен излучением пиротехнического воспламенителя.Было замечено, что максимальная температура от взрыва серы произошла примерно в то время, когда скорость повышения давления была максимальной. Пиковая температура регистрировалась для каждого эксперимента.
На рисунке 11 показан спектр, снятый спектрометром Jaz. Серое тело считалось наиболее подходящим допущением для спектральной излучательной способности, потому что это или может не подходить для всех материалов [18], а также из-за больших оптических глубин, создаваемых пылевым облаком [19]. Измеренные пиковые температуры пирометрией и термопарами показаны на рисунке 12.Только данные термопары были получены из тестов 10% кислорода, потому что сигналы пирометрии были очень слабыми и намного ниже уровня шума. Пирометр PMT использовался только для 21% из-за спектральной интерференции около 900 нм, когда уровень кислорода был увеличен до 42% по объему. Тепловой фон от спектрометра Jaz соответствовал каждому тесту в условиях обогащения кислородом. Таким образом, для этих условий не было получено данных с временным разрешением.
Серое тело считалось наиболее подходящим допущением для спектральной излучательной способности, потому что это или может не подходить для всех материалов [18], а также из-за больших оптических глубин, создаваемых пылевым облаком [19]. Измеренные пиковые температуры пирометрией и термопарами показаны на рисунке 12.Только данные термопары были получены из тестов 10% кислорода, потому что сигналы пирометрии были очень слабыми и намного ниже уровня шума. Пирометр PMT использовался только для 21% из-за спектральной интерференции около 900 нм, когда уровень кислорода был увеличен до 42% по объему. Тепловой фон от спектрометра Jaz соответствовал каждому тесту в условиях обогащения кислородом. Таким образом, для этих условий не было получено данных с временным разрешением.
Пунктирными линиями показаны максимальные температуры пламени, рассчитанные в условиях равновесия.Температуру регулировали с учетом тепла, поглощаемого антислеживающим агентом. Это изменение температуры было минимальным (обычно менее 10 К). Следует отметить, что эта корректировка является приближением первого порядка, поскольку она не включает в себя равновесный состав, который необходимо пересчитать при конечной температуре.
Следует отметить, что эта корректировка является приближением первого порядка, поскольку она не включает в себя равновесный состав, который необходимо пересчитать при конечной температуре.
Было замечено, что пиковая температура постоянно увеличивалась для более низкой концентрации частиц от приблизительно 800 K до приблизительно 1300 K для измерений с помощью термопары (с поправкой на радиационные потери) по мере увеличения содержания кислорода с 10% до 42%.Повышение температуры с 21% до 42% кислорода по результатам пирометрических измерений было намного больше, поскольку максимальная температура превышала 2000 К. Эта большая разница, вероятно, связана с тем фактом, что измерения пирометрии смещены в сторону самых высоких температур в пределах области измерений. вид, пока термопары измеряют местную температуру.
Большая разница температур между измерениями пирометрии и термопары также наблюдалась для тестов 21% и 42% кислорода при более высокой загрузке частиц.Наблюдалось повышение температуры с загрузкой частиц для всех концентраций кислорода. Средняя пиковая температура для случая 10% кислорода была самой низкой из условий для испытаний 560 г / м 3 при 909 К.
Средняя пиковая температура для случая 10% кислорода была самой низкой из условий для испытаний 560 г / м 3 при 909 К.
Повышение температуры при увеличении концентрации кислорода, вероятно, было связано с количеством энергии, выделяемой в каждое условие. Данные по давлению показали, что максимальное повышение давления (т.е. тепловыделение), рис. 5, увеличивается с концентрацией кислорода.
3.4. Скорость пламени
Поскольку данные давления и времени были определены как точный способ измерения скорости пламени внутри взрывной камеры постоянного объема, было решено использовать эту диагностику для определения того, как концентрации частиц и кислорода влияют на скорость пламени. Тот же подход, который использовался для определения скорости пламени, как обсуждалось выше, был применен к другим условиям. Данные для всех концентраций частиц и кислорода приведены на рисунке 13.
Отдельные точки данных для случая кислорода были отображены в предыдущем разделе (см. Рисунок 9).Средние значения при этой концентрации кислорода также включают дополнительные точки данных, полученные после завершения этой части работы. Наблюдалось монотонное увеличение скорости пламени с увеличением концентрации кислорода. Аналогичная тенденция показана на рисунке 6 для данных. Поскольку скорость пламени была рассчитана на основе данных давления (и масштабируется), ожидается, что будет наблюдаться аналогичная зависимость. Для данной концентрации кислорода условия более высокой загрузки частиц (т.е. более высокая степень эквивалентности) имеют более высокую скорость пламени.
Рисунок 9).Средние значения при этой концентрации кислорода также включают дополнительные точки данных, полученные после завершения этой части работы. Наблюдалось монотонное увеличение скорости пламени с увеличением концентрации кислорода. Аналогичная тенденция показана на рисунке 6 для данных. Поскольку скорость пламени была рассчитана на основе данных давления (и масштабируется), ожидается, что будет наблюдаться аналогичная зависимость. Для данной концентрации кислорода условия более высокой загрузки частиц (т.е. более высокая степень эквивалентности) имеют более высокую скорость пламени.
4. Обсуждение механизма горения
Газофазные выбросы оксидов серы и, как сообщается в [9], предполагают, что сера имеет газофазный компонент, но степень химического состава газовой фазы неизвестна. Однако данные ничего не говорят об ограничивающем процессе (ах) во время горения, а именно о том, горит ли сера кинетически или диффузионно ограниченным образом.
4.1. Анализ числа Дамкелера
Расчет ключевого числа Дамкелера поможет в этом обсуждении. Это число Дамкелера представляет собой соотношение химической и диффузионной шкал времени. Химическая шкала времени была определена путем моделирования адиабатического реактора постоянного объема с идеальным перемешиванием (PSR) с механизмом из Университета Лидса [12]. В качестве начальных условий использовались соотношения серы, кислорода и азота, которые присутствовали в камере после закачки при атмосферном давлении. Для начала реакции необходима начальная температура 1300 К. Шаг по времени был установлен на 1 микросекунду.Химические временные шкалы были взяты как время, за которое температура снизится с 10% до 90% от общего изменения температуры. Изменение температуры представляло собой разницу от 1300 К до температуры адиабатического пламени.
Это число Дамкелера представляет собой соотношение химической и диффузионной шкал времени. Химическая шкала времени была определена путем моделирования адиабатического реактора постоянного объема с идеальным перемешиванием (PSR) с механизмом из Университета Лидса [12]. В качестве начальных условий использовались соотношения серы, кислорода и азота, которые присутствовали в камере после закачки при атмосферном давлении. Для начала реакции необходима начальная температура 1300 К. Шаг по времени был установлен на 1 микросекунду.Химические временные шкалы были взяты как время, за которое температура снизится с 10% до 90% от общего изменения температуры. Изменение температуры представляло собой разницу от 1300 К до температуры адиабатического пламени.
Масштаб времени диффузии обратно пропорционален коэффициенту диффузии, который был рассчитан по кинетической теории [20]. Коэффициент бинарной диффузии кислорода через азот был рассчитан с использованием измеренных пиковых температур. Коэффициент диффузии изменяется как и. Из-за этого масштабирования, даже если бы температура увеличилась на 1700 K (доведя температуру до примерно 3100 K, температуры адиабатического пламени, для самых горячих измеренных условий), масштаб времени диффузии уменьшился бы только примерно в раз. 2.8. Точно так же, если бы учитывалась диффузия двух других видов, помимо и (то есть,, и), шкала времени диффузии изменилась бы менее чем в 2 раза (увеличение или уменьшение). Следовательно, коэффициент диффузии существенно не изменится (т.е.е., на порядок) для смесей соединений серы, кислорода и азота. Для этого расчета давление было принято равным 1 атм. Обоснованием этого предположения было то, что в то время, когда фронт пламени проходил через термопары и ионизационные зонды, давление внутри камеры существенно не повышалось.
Из-за этого масштабирования, даже если бы температура увеличилась на 1700 K (доведя температуру до примерно 3100 K, температуры адиабатического пламени, для самых горячих измеренных условий), масштаб времени диффузии уменьшился бы только примерно в раз. 2.8. Точно так же, если бы учитывалась диффузия двух других видов, помимо и (то есть,, и), шкала времени диффузии изменилась бы менее чем в 2 раза (увеличение или уменьшение). Следовательно, коэффициент диффузии существенно не изменится (т.е.е., на порядок) для смесей соединений серы, кислорода и азота. Для этого расчета давление было принято равным 1 атм. Обоснованием этого предположения было то, что в то время, когда фронт пламени проходил через термопары и ионизационные зонды, давление внутри камеры существенно не повышалось.
Рассчитанные числа Дамкелера относятся друг к другу (т. Е. Не абсолютны), чтобы исключить проблемы с подходящей областью, которую следует использовать для обезразмеривания значения, и поскольку максимальное давление существенно не изменяется (т. е.е., менее чем на порядок). Числа, приведенные в таблице 1, нормализованы к значению 21% для каждой соответствующей концентрации частиц, так что отдельные значения не имеют значения, но относительное изменение важно.
е.е., менее чем на порядок). Числа, приведенные в таблице 1, нормализованы к значению 21% для каждой соответствующей концентрации частиц, так что отдельные значения не имеют значения, но относительное изменение важно.
| ||||||||||||||||||||||||||
 Это увеличение говорит о том, что по мере увеличения концентрации кислорода диффузия становится более важной, что на первый взгляд кажется нелогичным. Учитывая, что изменилось не только количество кислорода, этот результат оправдан. Температура также увеличилась, и это влияет на химию более значительно, чем диффузия (т.е. экспоненциально по сравнению с). Показатель температуры (1.65) включает температурную зависимость из интеграла столкновений [21]. Более интригующий аспект этого наблюдения заключается в том, что для обеих нагрузок частиц диффузия становится более важной по мере того, как пламя переходит от состояния с высоким содержанием топлива к стехиометрическому.Стехиометрия для концентраций 280 г / м 3 и 560 г / м 3 соответствует концентрации кислорода 21% и 42% по объему соответственно.
Это увеличение говорит о том, что по мере увеличения концентрации кислорода диффузия становится более важной, что на первый взгляд кажется нелогичным. Учитывая, что изменилось не только количество кислорода, этот результат оправдан. Температура также увеличилась, и это влияет на химию более значительно, чем диффузия (т.е. экспоненциально по сравнению с). Показатель температуры (1.65) включает температурную зависимость из интеграла столкновений [21]. Более интригующий аспект этого наблюдения заключается в том, что для обеих нагрузок частиц диффузия становится более важной по мере того, как пламя переходит от состояния с высоким содержанием топлива к стехиометрическому.Стехиометрия для концентраций 280 г / м 3 и 560 г / м 3 соответствует концентрации кислорода 21% и 42% по объему соответственно.4.2. Анализ масштабирования скорости пламени
Вышеупомянутое обсуждение предоставило только понимание того, как пламя в каждом состоянии горит относительно друг друга. Анализ скорости и температуры пламени может быть использован для уточнения механизма горения и любых ограничивающих явлений.
Анализ скорости и температуры пламени может быть использован для уточнения механизма горения и любых ограничивающих явлений.
Масштаб скорости пламени должен зависеть от механизма горения.Ландау и Лифшиц [22] утверждают, что скорость пламени для волны горения, вызванной тепловым воздействием, масштабируется как, где — масштаб времени горения. Горошин и др. [23] утверждали, что для пламени, ограниченного диффузией, масштабы обратно пропорциональны коэффициенту диффузии газа. Если пламя ограничено диффузией, скорость пламени должна масштабироваться как. Горошин и др. [23] утверждали, что если это тепловое пламя ограничено кинетически, разница в коэффициенте диффузии по массе газовых смесей (т.е. в каждом состоянии) не должна играть роли, поэтому скорость пламени должна масштабироваться.Эта логика использовалась для текущей работы. Теоретический масштаб для диффузионного и кинетически ограниченного пламени показан в таблицах 2 и 3 соответственно. Соотношения скоростей из данных текущей работы показаны в таблице 4.
| ||||||||||||||||||||||||
| ||||||||||||||||
| ||||||||||||||||||||||||||

 А.
А.

 Приветствие «Здравствуйте! Ребята здороваются с соседом справа и слева в любой форме.
Приветствие «Здравствуйте! Ребята здороваются с соседом справа и слева в любой форме. о. Горение – это первая химическая реакция, с которой познакомился человек.
о. Горение – это первая химическая реакция, с которой познакомился человек.
 Работа с текстом учебника, прием «Инсерт». Каждый учащийся, читая текст учебника, на полях с правой стороны ставит маркировки (выражает свое отношение к прочитанному).
Работа с текстом учебника, прием «Инсерт». Каждый учащийся, читая текст учебника, на полях с правой стороны ставит маркировки (выражает свое отношение к прочитанному).
 Выводы.
Выводы.
 Определите для каждого из приведенных на рисунке случаев (стрелкой указано, какой фактор надо устранить) способ предупреждения или тушения огня:
Определите для каждого из приведенных на рисунке случаев (стрелкой указано, какой фактор надо устранить) способ предупреждения или тушения огня:

 е. имеют возможность определить уровень усвоения материала. Формативное взаимооценивание при выполнении заданий «ТЕМАТИЧЕСКОЙ КАРТОЧКИ» также способствует определению уровня усвоения материала урока. Проверка домашнего задания «ПОЧТАЛЬОН» даст возможность формативно оценить уровень усвоения изученного материала.
е. имеют возможность определить уровень усвоения материала. Формативное взаимооценивание при выполнении заданий «ТЕМАТИЧЕСКОЙ КАРТОЧКИ» также способствует определению уровня усвоения материала урока. Проверка домашнего задания «ПОЧТАЛЬОН» даст возможность формативно оценить уровень усвоения изученного материала.
 Есть несколько учащихся, намного опережающих большинство класса по уровню интеллектуального развития, которые всегда первыми поднимают руку, быстро мыслят и обладают самостоятельным критическим мышлением. Для этих учащихся следует ежеурочно продумывать индивидуальные виды заданий, более усложненные.
Есть несколько учащихся, намного опережающих большинство класса по уровню интеллектуального развития, которые всегда первыми поднимают руку, быстро мыслят и обладают самостоятельным критическим мышлением. Для этих учащихся следует ежеурочно продумывать индивидуальные виды заданий, более усложненные. Я думал, что для этого нам не нужны вода и кислота. Я ошибаюсь?
Я думал, что для этого нам не нужны вода и кислота. Я ошибаюсь? Д.
Д. Для угля температура воспламенения находится в диапазоне от 400 до 425 градусов по Цельсию
Для угля температура воспламенения находится в диапазоне от 400 до 425 градусов по Цельсию Это называется глобальным потеплением. Это вызывает таяние полярных льдов, повышение уровня моря и затопление прибрежных территорий.
Это называется глобальным потеплением. Это вызывает таяние полярных льдов, повышение уровня моря и затопление прибрежных территорий.
 Этот результат в сочетании с предыдущим обсуждением предполагает, что пламя обогащенной кислородом серной пыли горит в пределе диффузии.
Этот результат в сочетании с предыдущим обсуждением предполагает, что пламя обогащенной кислородом серной пыли горит в пределе диффузии. Эксперименты с более высокими концентрациями кислорода дали очень согласованные данные, тогда как концентрации кислорода 10% имели больший разброс.Данные, представленные здесь, не очень хорошо отражают больший спред. Во многих случаях испытания 10% кислорода не приводили к возгоранию (для обеих концентраций порошка). Вполне возможно, что эти обедненные кислородом условия приблизились к единице воспламеняемости.
Эксперименты с более высокими концентрациями кислорода дали очень согласованные данные, тогда как концентрации кислорода 10% имели больший разброс.Данные, представленные здесь, не очень хорошо отражают больший спред. Во многих случаях испытания 10% кислорода не приводили к возгоранию (для обеих концентраций порошка). Вполне возможно, что эти обедненные кислородом условия приблизились к единице воспламеняемости.