Ответы на контрольную работу по теме «Неметаллы» (Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +8 имеют атомы химического элемента:
Б. Кислорода.
2. Число общих электронных пар в молекуле хлора:
В. Три.
3. Ковалентная полярная связь имеется в молекуле вещества, формула которого:
Б. СО2.
4. Степень окисления азота в ряду веществ, формулы которых N2—NO—NО2—HNО3:
А. Повышается от 0 до +5.
5. Структурная формула водородного соединения элемента Э главной подгруппы VI группы Периодической системы:
В. Н—Э—Н.
6. Уравнение химической реакции h3S + С12 = 2НС1 + S соответствует схеме превращения хлора:
A. Cl0→Cl-1
7. Вещество X в ряду превращений С02→ X→Са(НСО3)2→ CО2↑ имеет формулу:
В. СаСО3.
8. Реактивом на хлорид-анион является катион:
Б. Ag+.
9. Химическая реакция возможна между веществами, формулы которых:
Г. h3SО4 и MgO.
h3SО4 и MgO.
10. Оксид азота (IV) образуется при взаимодействии веществ, формулы которых:
В. НNО3(конц) и Ag.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
2P + 3Zn = Zn3P2
Zn3P2 + 3h3O + 4O2 = 3Zn(OH)2 + P2O5
P2O5 + 3h3O = 2h4PO4
2h4PO4 + 6Na = 2Na3PO4 + 3h3
Na3PO4 + 3AgNO3 = Ag3PO4↓+ 3NaNO3
12. Превращение 2 из задания 11 рассмотрите с точки зрения ОВР.
Zn3P2-3 + 3h3O + 4O20 = 3Zn(OH)2 + P2+5O5-2
O2 0 → 2O -2 +2 e, окислитель
P -3 → P +5 – 8 е, восстановитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + PO4 3-+ 3Ag+ + 3NO3- = Ag3PO4↓+ 3Na+ + 3NO3-
PO4 3-+ 3Ag+= Ag3PO4↓
14. Вычислите массу (в кг) хлороводорода, который получается при взаимодействии 4,48 м3 хлора с избытком водорода.
n(Cl2) = 4480дм3/22,4 дм3/моль = 200моль
n (НСl) = 2n (Cl2) = 400 моль
m (НСl) = 400моль*36,5г/моль = 14600 г = 14,6 кг
15. Назовите химический элемент, имеющий изотоп, в ядре которого отсутствуют нейтроны.
Назовите химический элемент, имеющий изотоп, в ядре которого отсутствуют нейтроны.
водород
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +17 имеют атомы химического элемента:
Г. Хлора.
2. Число общих электронных пар в молекуле водорода:
А. 1.
3. Ковалентная неполярная связь имеется в молекуле вещества, формула которого:
А. N2.
4. Степень окисления фосфора в ряду веществ, формулы которых Са3Р2—Р—Р2О3—Р2О5:
Б. Повышается от -3 до +5.
5. Структурная формула водородного соединения элемента Э главной подгруппы V группы Периодической системы:
Г. Н—Э—Н.
Н
6. Уравнение химической реакции 2SО2 + О2 = 2SО3 соответствует схеме превращения серы:
В. S+4→ S+6.
7. Вещество X в ряду превращений N2→ Nh4→ X→ NО2 имеет формулу:
Б. NO.
8. Реактивом на карбонат-анион является катион:
А. Н+.
9. Химическая реакция возможна между веществами, формулы которых:
Химическая реакция возможна между веществами, формулы которых:
В. Р2О5 и NaOH.
10. Оксид серы (IV) не образуется при взаимодействии веществ, формулы которых:
Г. СаСО3 и h3SО4.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
1. Mg + S = MgS
2. 2 MgS + ЗО2 = 2MgО + 2SО2↑,
3. 2SO2 + O2 = 2SO3
4. SO3 + Na2O = Na2SO4
5. Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl
12. Превращение 2 из задания 11 рассмотрите с точки зрения ОВР.
2 MgS-2 + ЗО20 = 2MgО-2 + 2S+4О2-2↑,
S-2 → S+4 , -6e, восстановитель
O20 → 2O-2 +2*2е, окислитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl
SO42- + Ba2+ = BaSO4 ↓
14. Вычислите массу (в кг) аммиака, который получается при взаимодействии 2 кмоль азота с избытком водорода.
N2 + 3h3 = 2Nh4
n(Nh4) = 2n(N2) = 4кмоль = 4000 моль
m(Nh4) = 4000 моль *17 г/моль = 68000 г = 68 кг.
15. Назовите химический элемент, который в соединениях никогда не проявляет положительную степень окисления.
Фтор
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +14 имеют атомы химического элемента:
В. Кремния.
2. Число общих электронных пар в молекуле брома:
А. 1.
3. Ковалентная полярная связь имеется в веществе, формула которого:
Б. h3S.
4. Степень окисления серы в ряду веществ, формулы которых SО3—SО2—S—h3S:
Г. Понижается от +6 до -2.
5. Структурная формула водородного соединения элемента Э главной подгруппы VII группы Периодической системы:
А. Н—Э.
6. Уравнение химической реакции 4Nh4 + 5О2 = 4NO + 6Н2О соответствует схеме превращения азота:
В. N-3→ N+2.
7. Вещество X в ряду превращений РН3→ Р2О5 → X→ Са3(РО4)2 имеет формулу:
А. Н3РО4.
8. Реактивом на сульфат-анион является катион:
В. Ва2+.
Ва2+.
9. Химическая реакция возможна между веществами, формулы которых:
А. СО2 и NaOH.
10. Оксид углерода (IV) образуется при взаимодействии веществ, формулы которых:
Б. СаСО3 и НС1.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
Sih5→ SiО2 →Na2SiО3→ h3SiО3 →SiО2→ Si.
1. Sih5 + 2O2 = SiO2 + 2h3O
2. SiO2 + Na2O = Na2SiO3
3. Na2SiO3 + 2HCl = h3SiO3↓ + 2NaCl
4. h3SiO3 = SiO2 + h3O
5. SiO2+2C—> Si + 2CO
12. Превращение 5 из задания 11 рассмотрите с точки зрения ОВР.
Si+4O2+2C0—> Si0 + 2C+2O
Si+4 →Si0 +4е, окислитель
C0 →C+2 -2е, восстановитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na2SiO3 + 2HCl = h3SiO3↓ + 2NaCl
SiO32- + 2H+ = h3SiO3↓
14. Вычислите массу (в кг) хлорида аммония, который образуется при взаимодействии 11,2 м3 хлороводорода с избытком аммиака.
HCl + Nh4 = Nh5Cl
n(HCl) = n(Nh5Cl) = 11200 дм3/ 22,4 дм3/моль = 500 моль
m(Nh5Cl) = 500 моль *56,5 г/моль = 28250 г = 28,250 кг.
15. Расположите химические элементы фосфор, кислород, серу, хлор в порядке увеличения неметаллических свойств.
Фосфор, сера, кислород, хлор
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +16 имеют атомы химического элемента:
В. Серы.
2. Число общих электронных пар в молекуле азота:
В. 3.
3. Ковалентная неполярная связь имеется в веществе, формула которого:
В. О2.
4. Степень окисления углерода в ряду веществ, формулы которых СН4—С—СО—СО2:
Б. Повышается от -4 до +4.
5. Структурная формула водородного соединения элемента Э главной подгруппы IV группы Периодической системы:
В. Н—Э—Н
6. Уравнение химической реакции Си + 4HNО3 = CU(NО3)2 + 2NО2↑ + 2Н2О соответствует схеме превращения азота:
Г. N+5 →N+4.
N+5 →N+4.
7. Вещество X в ряду превращений S→ S02→ X→ Na2SО3 имеет формулу:
Г. h3SО3.
8. Реактивом на фосфат-анион является катион:
Г. Ag+.
9. Химическая реакция возможна между веществами, формулы которых:
Б. СО2 и Са(ОН)2.
10. Кремниевая кислота образуется при взаимодействии веществ, формулы которых:
В. Na2SiО3 и НС1.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
N2 →Nh4 →NО→NО2→ HNО3→ KNО3.
1. N2 + 3h3 =2Nh4
2. 4Nh4 + 5O2 = 4NO + 6h3O
3. 2NO + O2 = 2NO2
4. 4NO2 + О2 + 2Н2О → 4HNO3
5. HNO3 + KOH =KNO3 + h3O
12. Превращение 2 в задании 11 рассмотрите с точки зрения ОВР.
4N-3h4 + 5O20 = 4N+2O-2 + 6h3O
N-3 ->N+2, -5е, восстановитель
O20-> 2O-2 ,+ 2*2е, окислитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
HNO3 + KOH =KNO3 + h3O
H+ + OH- = h3O
14. Вычислите массу (в кг) оксида серы (IV), образовавшегося при сгорании 4,48 м3 сероводорода в избытке кислорода.
2h3S + 3O2 = 2SO2 + 2h3O
n(h3S) = n(SO2) = 44800 дм3/ 22,4 дм3/моль = 2000 моль
m(SO2) = 2000 моль *64 г/моль = 128000 г = 128 кг
15. Назовите химический элемент самый распространенный:
А. В земной коре:
кислород
Б. Во Вселенной:
водород
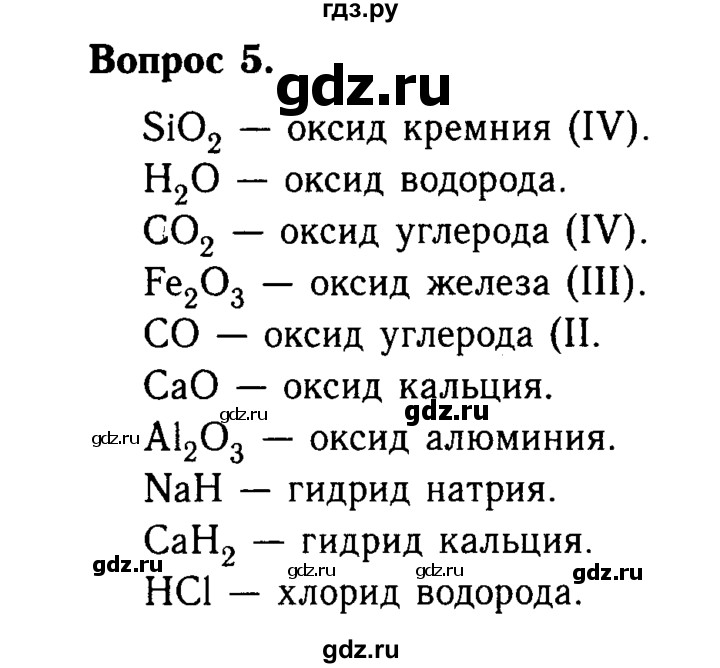
Gdz v chémii 8 e) Symboly, názvy a jednotky merania niektorých fyzikálnych veličín používaných v chémii
Kniha riešení z chémie pre 8. ročník Gabrielyan je súbor hotových domácich úloh, vrátane vyriešených úloh, vypočítaných reakčných rovníc, prevzatých z učebnice Gabrielyan O.S., ktorá je klasickým základom pre štúdium chémie na ruských stredných školách 8. ročníka.
Решебник с химией 8. рочник Габриелян О.С. 2013-2019
Улоги и реактивные ровницы в курзе химии су жажке практические улоги, кто не вшетци школа докажу на првыкрат. Žiaci ôsmeho ročníka môžu mať osobitné ťažkosti pripavave domácich úloh: v 8. ročníku dostávajú žiaci dostatočne veľké množstvo domácich ú ú č úajujujujujujujujujujujujujujujujejujujujuj
Žiaci ôsmeho ročníka môžu mať osobitné ťažkosti pripavave domácich úloh: v 8. ročníku dostávajú žiaci dostatočne veľké množstvo domácich ú ú č úajujujujujujujujujujujujujujujujejujujujuj
Наша веб-страница для обучения студентов ГДЗ в химии до 8 лет.
На закладе приправеных одповеди и ришени можу родичия контроли покроки свои дети в химии и помахать им с домашними улогами.
Náš zdroj má niekoľko významných výhod:
- požadovanú ucebnicu может быть ľahko nájsť pomocou vyhľadávacieho panela;
- кликните по количеству проблем в таблице, вы можете воспользоваться услугами онлайн-продавца;
- страница je dostupná nielen na počítačoch – má aktuálnu verziu pre tablety a phone.
Следующее за актуализацией базы данных riešiteľov a snažíme sa, aby na jednu úlohu pripadalo viacero online odpovedí.
Одповеде ГДЗ учебная химия до 8. рочник Габриелян
В сучности программы средний уровень школы в Руску зоставы на складе учебника Габиелян О.С., который 3.02встроил выдачу 9.0003
Учебная база с водной частью (6 единиц) и 5 главных капиталовложений, которые покрываются таке долежите темами также:
- Штруктура атома и атомная зольность;
- Jednoduché latky, ich vlastnosti;
- Zmesi latok and roztokov;
- Reakcie výmeny iónov;
- Окислительно-восстановительный процесс.
V rámci učebnice sú decentovane dve chemické dielne (laboratorne práce). Všetky časti učebnice sú podporené praktickými otázkami, ulohami, cvičeniami, ktoré umožňujú efektivne zvladnuť teóriu predmetu.
Ключевой слова: Chémia 8. ročník. Сборы и определения, символические физические значения, средние значения, расчеты на определение мерных значений, взводы медьединками, химические сборы, закладные определения, конструкции, таблицы, диаграммы.
niektoré fyzikálne velichiny používané v chemi
| Физическое множество | Означение | еднотка мерания |
| час | т | с |
| Тлак | р | Па, кПа |
| Множество домов | ν | Кртко |
| Hmotnosť hmoty | м | кг, г |
| Хмотностный зломок | ω | Безрозмерный |
| Моларна Хмота | М | кг/моль, г/моль |
| Молярный объект | В н | м 3 /моль, л/моль |
| Объем хмоты | В | м 3 , л |
| Объемный зломок | Безрозмерный | |
| Относительная атомная защита | Ар | Безрозмерный |
| Пан | Безрозмерный | |
| Относительная высота плиты А опоры плиты Б | Д Б (А) | Безрозмерный |
| Густота хмоты | Р | кг/м3, г/см3, г/мл |
| Авогадро Конштанта | Н/Д | 1/моль |
| Абсолютная теплота | Т | К (Кельвин) |
| Цельсия теплота | т | °С (ступень Цельсия) |
| Tepelný účinok chemickej reakcie | В | кДж/моль |
 Взгляд медзи единотки физикалныч величин 3. Химический сбор в 8. Рочник 4. Заводское определение в 8. Рочник
Взгляд медзи единотки физикалныч величин 3. Химический сбор в 8. Рочник 4. Заводское определение в 8. Рочник - Atóm — наименьшая химическая неделительная частичная латка.
- Химический првок určitý typ atómu.
- Молекула — наименьшая часть латки, которая закрывает свое производство и химическую власть в складе с атомами.
- Jednoduché latky Латки, которые молекулы су творены атомами ровного типа.
- Комплексные лакты Латки, которые молекулы созданы с помощью розных типов атомов.
- Качественное злоложение латки ukazuje, z akých atómov sa skladá.
- Многоквартирное здание Латки
- Chemický vzorec — присвоенный знак квалификационного и квантитативного злоупотребления латки pomocou chemických značiek a indexov.

- Еднотка атомовей хмотности (аму) — единая мерания hmotnosti atómu, ktorá sa rovná hmotnosti 1/12 atómu uhlíka 12 C.
- Кртко — множество латки, которая обслужит частную ровную почту атомов в 0,012 кг угля 12C.
- Авогадро Константа ( Na = 6*10 23 моль-1) — počet častíc obsiahnutých v jednom mole.
- Моловы hmotnosť latky ( M ) je hmotnosť latky prijatá v množstve 1 mol.
- Relativna atómová hmotnosť prvok ALE р — pomer hmotnosti atómu daného prvku m 0 k 1/12 hmotnosti atómu uhlíka 12 C.
- Релятивная молекулярная масса латок M р — Помер плотности молекулы даней латки к 1/12 плотности атома углерода 12 C. Релятивная молекулярная вязкость са ровна сучту релятивных атомных хмотностей химич.
- Hmotnostný zlomok chemický prvok ω(X) ukazuje, akú časť relatívnej molekulovej hmotnosti latky X pripadá na tento prvok.

АТОМОВО-МОЛЕКУЛЯРНЫЕ СТУДИИ
1. Существуют молекулярные и немолекулярные структуры.
2. Медзи молекулы су медзеры, кто розмеры зависиа од ставу агрегасье латки а теплоты.
3. Молекулы су в непретржитом погибе.
4. Молекулы на складе атомов.
6. Atómy sa vyznačujú určitou hmotnosťou a veľkosťou.
Pri fyzikálnych javach sa molekuly zachovávajú, pri chemických javach sa spravidla ničia. Atómy v chemických javach sa preskupujú a vytvárajú molekuly nových latok.
ЗАКОН О СТАЛОМ ЗЛОМЕНИ ЛАТКИ
Каждая химия Чистая латка молекулярных структур, без оглядки на способ приведения в действие, обладающий постоянной ценностью и эффективностью.
VALENCE
Valencia je vlastnosť atómu chemického prvku pripojiť alebo nahradiť určitý počet atómov iného prvku.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция je proces, pri ktorom z jednej latky vzniká in latka. Činidlá sú latky, ktoré vstupujú do chemickej reakcie. Reakčné produkty sú latky, ktoré vznikajú ako výsledok reakcie.
Reakčné produkty sú latky, ktoré vznikajú ako výsledok reakcie.
Знак химической реакции:
1. Увольнение тепла (светла).
2. Змена фарбы.
3. Взгляд воне.
4. Зражки.
5. Увольнование плыну.
- chemická rovnica — zaznamenávanie chemickej reakcie pomocou chemických vzorcov. Ukazuje, аке латки а в аком множестве reagujú а vznikajú ако výsledok reakcie.
ЗАКОН ЗАЩИТЫ ХМОТЫ
Хмотност латок, кто вступили в химическую реакцию, са ровна хмотности латок вытворених в доследку реакции. В доследку химических реакций атомы nezmiznú и nevznikajú, але dochádza kich preskupeniu.
Журнал лекций „Хемия 8. Рочник. Взрывы и определение.
Тема: «».
GDZ z chemie pre 8. ročník Gabrielyan je kniha riešení alebo zbierka hotových homeacich uloh, vyriešených príkladov a problemov, vypočitaných reakčných rovníc. Я поставил на закладе учебную химию до осмаков, кто поставил cтены ведец Руська — Габриелян О.С.
Я поставил на закладе учебную химию до осмаков, кто поставил cтены ведец Руська — Габриелян О.С.
odpovede na otázky z chémie 8. ročník gabrielyan — Pomoc žiakovi ôsmeho ročníka
Габрилан 8 химическое решение Vám umoňuje vyrieShiť dve -dôležité úlohyáuboleshyčboleshyáboleshyáboleshyáshyčtáboleáshyčtáboleshyátáboleshyátáboleshyátáboleshyátáboleshyáuboleshyáthyáuboleáshyčuječuje vyrieShiShiShoveShoveShoveShoveShoveShoveShovečuj0024
Kniha riešení prezentuje nielen výsledky riešenia úloh and reakčných rovníc, ale aj postupný algoritmus na ich executeáciu. Vďaka tomu sú hotové riešenia zrozumiteľné pre deti aj rodičov.
Наша страна производит наивходнейшие подменные средства на приеме одповеди на улоги школьного химического курса до 8. рочник:
- Do vyhľadávacieho riadku na každej Stránke Môžete zadať číslo úlogy alebo uryvok z jej stavu — systém Automaticky vygeneruje zoznam inhodných riešení;
- Служба может производить покупки с помощью планшета или смартфона.

Keďže knihy riešení prezentované na stránke sú pravidelne aktualizované, študenti by nemali mať žiadne pochybnosti o schéme návrhu problemu alebo rovnice. Единая служба интеллигентного производства и производства до эффективного использования.
ГДЗ с химией пре 8. рочник Габриелян О.С. — hlavné časti učebnice 2013.
voshetky hotové online odpovede učebnice chémie pre 8. ročník boli zostavené na základe učebnice gabrielan o.s., ktorá vyshla v druhom vydaní vroma zna vousta vousta vousta vousta vousta vousta vousha roku.
Kniha obsahuje pať tematických kapitol, кто покрывает:
- Структура атома и процесс атомной комбинации химических веществ;
- Подстата однодуховных латок, их власти и главные изменения, которые са в них выскютую;
- Zmesi latok и roztokov;
- Reakcie iónovej výmeny and redoxné processy.
Všetky časti učebnice sú podporené praktickými úlohami a cvičeniami, ktoré umožňujú efektivne sa učiť latku.
Наша веб-страница, представляющая собой предварительную подготовку и задание, которая вам может помочь, может быть эффективной в работе с домашним хозяйством, а также при правлении на штатную заверенную сертификацию.
Образцы обоих учебных по образцу на страничке тейто странных лен ако иллюстративный материал (Чланок 1274, одсек 1 штвртей части Общегосударственного закона Российской Федерации)
- 8. Ручка с химией. Проблемная книга Кузнецова, Левкин Вентана-гроф
- 8. Рочник с химией. GEF Drop gabrielsky
- Zbierka úloh a cvicení z chemie 8. ročník Chomčenkova nova vlna
- 8. ročník z chemie. GEF Rudzitis, Feldman Vzdelávanie
- Контролируйте и переусердствуйте с химией 8. Рочник. ГЭФ Габриелян, Краснова дроп
- Троегубова Вако
- Контроль продажи материалов (КИМ) в химии 8. Рочник. ФГОС Корощенко сквушка
Праковне Зошиты
- Практический зоощит с химией 8. Рочник Еремин Дроздов капля
- Габриелян Сладков капелька
- Зоощит на годнотение качества ведомостей из химии 8.
 рочник. ГЭФ Габриелян, Купцова дроп
рочник. ГЭФ Габриелян, Купцова дроп - Практич. зошит с химией 8. Рочник. ФГОС Габрусева просвещения
- Ноутбук-тренажер в химии 8. ручник. GEF Gara osvietenie
- Skúšajúci zošit z chemie 8. ročník. ГЭФ Бобылева, Бирюлина Взрыв
- Практичний зоощит с химией 8. Рочник. ГЭФ Боровский. Учебники Рудзитис Скушка
- Правовой щит с 8. ручником. ГЭФ Микитюк. Ку Габриеляновей учебной школы Skúška
Testy
Riesenie pre chemiu pre ročník 8
Chemie O Gabrielyanovi 8. Proch Je gabrielyanovo online řešení lepshí než tutor
čs na čtení: 40003
GdzI. , vyřešených příkladů a problemů, vypočítaných reakčních rovnic. Ето заложено на студии производства в химии про жаки осмич тржид, ктороу поставил важены ведец Руска — Габриелян О.С.
Odpovědi na otázky z chemie 8. ročník Gabrielyan — pomoc žákovi osmého ročníku
Gabrielyan’s Grade 8 Chemistry Solution vám umožňuje řešit dva důležité úkoly v procesu výuky školáků:
- Jednak pomoci školákům s obtížnými domácími úkoly z chemie;
- За друх, подпоровать родиче прши контроль покроку свих детей.

Kniha řešení představuje nejen výsledky řešení úloh a reakčních rovnic, ale také postupný algoritmus pro jejich appendaci. Díky tomu jsou hotová řešení srozumitelná pro děti i rodiče.
Naše stránka vytváří nejpříhodnější podmínky pro přijímání odpovědí na úkoly školní kurz chemie pro 8. třídu:
- Ve vyhledávacím řádku uvedeném na každé stránce můžete zadat číslo úkolu nebo výpis z jeho stavu — systém automaticky vygeneruje seznam vhodných řešení;
- Служба может продавать с почтой, таблеткой или телефоном.
Protože knihy řešení Presentované na webu jsou pravidelně aktualizovány, studenti by neměli mít žádné pochybnosti o schématu návrhu problemu nebo rovnice. Единая служба chytrého vyhledávání je základem efektivní úspory času.
ГДЗ в химии про 8. рочник Габриелян О.С. — hlavní části učebnice 2013.
voshny hotové online odpovědi do knihy řeШení chemie pro ročník 8 sestaveny na základě učebnice gabrielan o.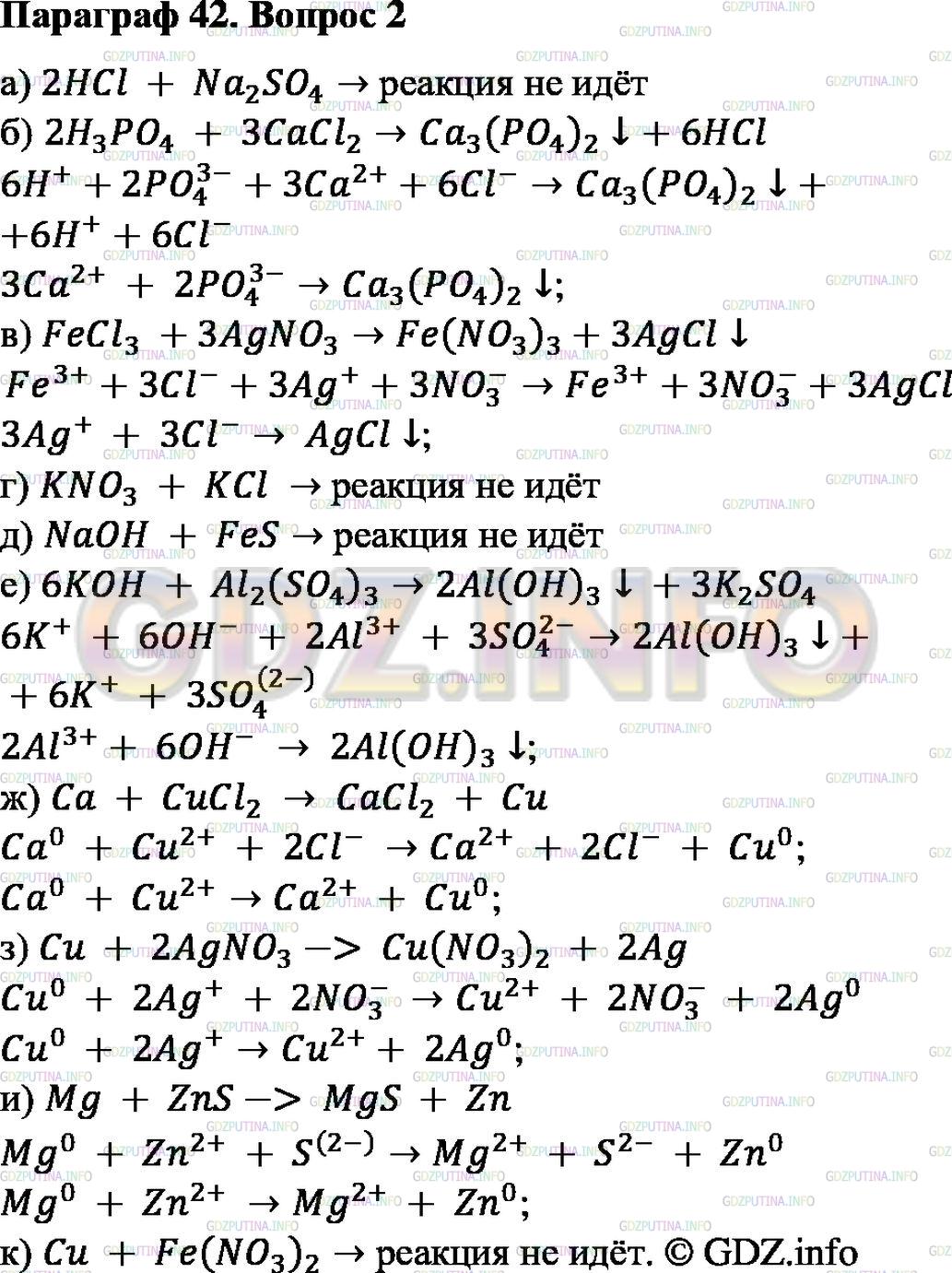 s., která vyshla verhémémématratratratratratratratratratratratratratraste.
s., která vyshla verhémémématratratratratratratratratratratratratratraste.
Kniha obsahuje pět tematických kapitol, které pokrývají:
- Структура атома и процесс объединенных атомов химические првки;
- Podstata jednoduchých latek, jejich vlastnosti and glavní změny v nich probíhající;
- Смеси латки и розтока;
- Ионтоменические реакции и окислительно-восстановительные процессы.
Всеобщие учебные пособия содержат практические руководства и курсы, которые могут быть эффективными для обучения.
Наше веб-страничное оборудование для мастерских и мастерских, которые могут помочь вам в работе, а также эффективно докончить домашнюю практику, стойку, как правило, на производстве стационарных изделий.
Chemie je poměrně fascinující a rozsáhlá věda. Právě ona pomohla lidem naučit se získávat různé materiály a přeměnit jednu latku na úplně jinou. Chemie nás naučila, jak dovedně využívat dary přírody a aplikovat je v moderním průmyslu. A názorným příkladem toho je výroba různých léků, které neustále zachraňují životy obrovského počtu lidí.
A názorným příkladem toho je výroba různých léků, které neustále zachraňují životy obrovského počtu lidí.
A v 8. třídě se školáci budou muset s tímto fascinujícím předmětem seznámit a připravit si pevný základ, na kterem se budou v budoucnu stavět znalosti. О.С. se v této věci pro osmáky stane věrným pomocníkem a spolehlivým soudruhem. Габриелян. Ctěný učitel a odborník ve svem oboru napsal knihu řešení pro školní ucebnici chemie pro 8. ročník.
Sbírka GDZ je nedílnou součástí vzdělávacího a methodicého complexu v chemii, vyvinutého pro studenty střední škola. Připravené odpovědi Jsou Navrženy Tak, Aby Se S S S S S S S S S S S S Nimi žák Osmé Třídy Vypořádal Složité termíny a Koncepty, Odpověd na voshny otázky Ze -čtyřiceti Prěti odstavců nauichit otázky ze čtyřiceti prěti odstavců nauichit otázky ze čtyřiceti prěti otavis otazky chetyřiceti odstavců naaucy otavesshity.
nejprve GDZ v chemii pro 8. ročník Gabrielyan poskytnout zakladní chemické pojmy. A od první kapitoly již začne studium atomů všech chemických prvků. Další budou témata o jednoduché latky a o sloučeninách chemických prvků. Čtvrtá kapitola bude vyprávět o změnách, ke kterým dochází u některých látek. A nejrozsáhlejší poslední kapitola obsahuje informace o rozpoustění, roztocích a o ionexových and redoxních reakcích.
Další budou témata o jednoduché latky a o sloučeninách chemických prvků. Čtvrtá kapitola bude vyprávět o změnách, ke kterým dochází u některých látek. A nejrozsáhlejší poslední kapitola obsahuje informace o rozpoustění, roztocích a o ionexových and redoxních reakcích.
Autoři do sbírky zařadili i hotové odpovědi na chemické dílny č. 1 a 2. První představuje algoritmy pro řešení praktických prací, které jsou založeny na nejjjednoduššších operacích s hmotou. Školáci totiž budou muset pozorovat změny, ke kterým dochází s hořící svíčkou, budou muset rozebrat vlastnosti půdy a vody. Небольшой знак химической реакции, а также для выпочета hmotnostního zlomku cukru v roztoku budou muset žáci osmých tříd absolvovat také první Workshop.
Други мастерская je věnován vlastnostem elektrolytů. Jeho prací proto bude stanovení iontové reakce; reakce mezi roztoky elektrolytů; vlastnosti kyselin, zasad, oxidů a solí a bude nutné řešit i Experimentální problémy. Na konci návodu jsou odpovědi na Laboratorní pokusy.
ГДЗ до практической работы в химии про 8. триду Габриелян О.С. lze stahnout.
ГДЗ до сешиту про годноцени квалификационные знания из химии про рочник 8 Габриелян О.С. lze stahnout.
Po přechodu do osmé třídy se žáci začínají seznamovat se zcela novou disciplinou – chemií. Mnoho školáků se na studium tohoto předmětu těší, protože zahrnuje práci s baňkami, Periodkou tabulkou a chemickými reakcemi. Stává se ale, že po projití prvních témat se zájem o vědu začne vytracet a najednou se ukáže, že vše není zdaleka tak jednoduché, jak se zdálo. А перед лабораторной практикой, je nutné mít nejen teoretické znalosti, ale také se zapojit do řešení problemů. ГДЗ к учебным заведениям Chemie pro 8. ročník vydání O.S. Gabrielyan dárky k your pozornosti připraveny zkušební papíry, praktickou práci s popisem pokusů, odpověďmi na otázky k tématu a také doplňujícími informacemi, se kterými se učení stane snadný
ГДЗ в химии про 8. рочник Габриелян йсоу в соуладу с общим одставкой в пивных учебниках а про студента небуде вубец тежке нажит одповеди.



 рочник. ГЭФ Габриелян, Купцова дроп
рочник. ГЭФ Габриелян, Купцова дроп