Схемы (цепочки) превращений органических веществ
Предлагаем вам задания-аналоги части В с подробными видео-объяснениями из ЦТ, РТ и ДРТ всех лет по теме: Схемы превращений органических веществ.
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то у вас появится ссылка красного цвета, а если верный — то зелёного цвета. С помощью ссылки вы можете просмотреть подробное видео-объяснение этого задания, но помните, что ссылка неактивная, поэтому для просмотра видео-объяснения вам необходимо скопировать эту ссылку и вставить на новую страницу и нажать клавишу Enter, как результат у вас откроется видео на YouTube). В середине страницы вы увидите текстовые условия заданий, для которых видео-объяснения даны сразу после каждого задания, а текстовые ответы представлены в конце страницы.
1. ЦТ по химии 2005. В5. Укажите число вторичных атомов углерода в основном органическом веществе Г в схеме превращений:
В5. Укажите число вторичных атомов углерода в основном органическом веществе Г в схеме превращений:
1) 2,3-диметил-1-хлорбутан + KOH, H2O → А;
2) A + H2SO4 (k), 180C →Б;
3) Б + HBr → B;
4) B + Na(изб) → Г.
2. ЦТ по химии 2007. В2. Укажите сумму молярных масс (г/моль) органических веществ Г и Е, которые образуются в результате превращений:
3. ЦТ 2017.
4. РТ по химии 2014/2015 (3 этап). В4. Укажите сумму относительных молекулярных масс органических веществ В и Д в следующих превращениях:
Гидролиз целлюлозы в присутствии серной кислоты при нагревании с образованием вещества А.

Вещество А подвергается спиртовому брожению с образованием вещества Б.
На вещество Б действуют окислителем K2Cr2O7 с образованием вещества В.
Вещество В подвергают каталитическому окислению в токе кислорода с образованием вещества Г.
К раствору вещества Г приливают избыток NaOH, в результате образуется вещество Д.
5. РТ по химии 2015/2016 (3 этап). В4. Укажите молярную массу (г/моль) хлоросодержащего органического вещества Д, который образуется в результате превращения:
6. РТ по химии 2016/2017 (2 этап). В4. Определите сумму молярных масс (г/моль) всех зашифрованных органических веществ, полученных в результате превращений:
youtube.com/embed/HFT53d6L-DY?feature=oembed» frameborder=»0″ allowfullscreen=»allowfullscreen» data-mce-fragment=»1″/>
7. ЦТ 2019
Ответы:
1. 0
2. 646
3. 622
4. 126
5. 137
6. 657
7. 139
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.
Все материалы сайта используются исключительно в образовательных целях.
В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:
Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
Статья 32. Свободное использование объектов авторского права и смежных прав
Пункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.
Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Схемы превращений в органической химии | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс):
№1.С помощью каких реакций можно осуществить превращения по схеме:
СН4 → СН3Br → С2Н6 → С2Н5Cl → С2Н5ОН → СН3 СОН → СН3СООН → СН3СООС2Н5
Решение.
1. СН4 + Br2 → Ch4Br + HBr
2. реакция с металлическим натрием (реакия Вюрца)
2 Ch4Br + 2 Na → h4C – Ch4 + 2 NaBr
свет
3. C2H6 + Cl 2 → Ch4Ch3 Cl + НCl
1. Для превращения галогенпроизводного в спирт необходимо заменить атом галогена в молекуле на гидроксильную группу, что можно сделать, осуществив реакцию нуклеофильного замещения (гидролиз в щелочной среде):
h3O
С2Н5Cl + KOH → C2H5OH + KCl
5. Для того чтобы превратить спирт в альдегид (см. свойства спиртов или получение карбонильных соединений), нужно увеличить степень окисления атома углерода при функциональной группе, т.е. подействовать мягким (не разрушающих молекулу) окислителем:
Для того чтобы превратить спирт в альдегид (см. свойства спиртов или получение карбонильных соединений), нужно увеличить степень окисления атома углерода при функциональной группе, т.е. подействовать мягким (не разрушающих молекулу) окислителем:
t
C2H5OH + CuO → Ch4 – CHO + Cu + h3O
6. Дальнейшее окисление (см. свойства карбонильных соединений или способы получения карбоновых кислот) приведет к преобразованию альдегидной группы в карбоксильную:
t
Ch4 – CHO +2Cu(OН)2 → Ch4 – COOH + Cu2O+2h3O
7. Реакции карбоновых кислот со спиртами приводят к образованию сложных эфиров:
H+
Ch4 – COOH + HO – Ch3 – Ch4 → Ch4 – COO – Ch3 – Ch4 + h3O
№2. С помощью каких реакций можно осуществить превращения по схеме:
СН3СООNa→Ch4 – Ch4→Ch3=Ch3→ Ch3Br– Ch3Br → CH≡CH→KOOC – COOK
Решение.
- Для получения этана из ацетата натрия воспользуемся синтезом Кольбе: электролизом водного раствора соли карбоновой кислоты (см.
 способы получения алканов): эл-з
способы получения алканов): эл-з - 2СН3СООNa + 2Н2О → Ch4 – Ch4+Н2O +2NaHCO3
2. Для превращения этана в этен осуществим реакцию дегидрирования:
t,Ni
Ch4 – Ch4 → Ch3=Ch3 + Н2
3. Для получения дигалогеналкана из алкена воспользуемся реакцией бромирования:
Ch3=Ch3 +Br2→ Ch3Br– Ch3Br
4. Для получения этина из дибромэтана необходимо осуществить реакцию дегидрогалогенирования, для этого используют спиртовый раствор КОН:
Ch3Br– Ch3Br +2 КОНспирт. р-р→ CH≡CH +2 КВr +2Н2О
5. Этин обесцвечивает водный раствор KMnO4:
3CH≡CH +8KMnO4→3KOOC – COOK +8MnO2 +2КОН +2Н2О
Введение в молекулу четырех атомов кислорода соответствует потере 8 электронов, поэтому перед MnO2cтавим коэффициент 8. Mn меняет степень окисления от +7 до +4, что соответствует приобретению 3- х электронов, поэтому перед органическим веществом ставим коэффициент 3.
Обратите внимание на уравнения реакций 1 и 5: синтез Кольбе и окисление алкинов водным раствором перманганата калия.
Примечание:
В кислой среде перманганат-ион восстанавливается до Mn2+, а этин окисляется до щавелевой кислоты:
5CH≡CH +8KMnO4 +12h3SO4 →5HOOC – COOH +8MnSO4 +4К2SO4 +12Н2О
Химические цепочки превращений: примеры и способы решения
Химические цепочки превращений — это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
- Выписав отдельно цепочку химических превращений, пронумеруйте количество необходимых реакций (они обозначены стрелочками от одного вещества к другому).

- Определите, к какому классу веществ относится каждый член цепочки и, если необходимо, выпишите на черновике отдельно в столбик каждое вещество из цепочки и его класс. В случае когда имеются неназванные вещества и их класс неизвестен, проанализируйте, какие вещества могут быть получены из исходного и какого класса вещество должно выступить исходным для следующего после неназванного вещества элемента цепочки.
- Проанализируйте, каким образом можно получить вещество этого класса из исходного для каждого элемента цепочки. В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
- Составьте схему уравнения первой из необходимых реакций. Не забудьте расставить коэффициенты в уравнении.
- Последовательно осуществите цепочку химических превращений, рассматривая каждую реакцию в отдельности. Проверьте себя, уделяя внимание оформлению реакций.

Пример решения цепочки превращений
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
- Для того чтобы из 1,2-дибромэтана получить ацетилен, нужно воздействовать на него спиртовым раствором щелочи при нагревании. В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
- Далее, исходя из условий протекания реакции, вы делаете вывод, что это реакция М. Г. Кучерова. Она приводит к образованию ацетальдегида.
- Ацетальдегид, реагируя в присутствии серной кислоты с дихроматом калия, дает уксусную кислоту.
- Гидрокарбонат вступает в реакцию обмена с раствором кислоты.
- Полученный ацетат щелочноземельного металла при нагревании разлагается, образуя карбонат металла и кетон.

Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
Цепочки по органической химии с ответами, этен этан хлорэтан
Химия, Биология, подготовка к ГИА и ЕГЭ
1) Ch4-Ch4 +Cl2 -> (свет) Ch4-Ch3-Cl + HCl
2) Ch4-Ch3-OH + HCl -> Ch4-Ch3- Cl +h3O
3) Сh4-Ch3-Cl + KOH (водный р-р.) -> Ch4-Ch3-OH +KCl
4) Ch4-C=O + h3 -> (Ni) Ch4-Ch3-OH
|
H
5) Ch4-Ch3-OH -> ( [O] KMnO4) Ch4-C=O
|
H
6) Ch4-Ch3-OH -> (h3SO4(к. ) t<140град) Ch3=Ch3
) t<140град) Ch3=Ch3
7)Ch3=Ch3 + HOH -> (h3SO4 (к)) Ch4-Ch3-OH
8) Ch3=Ch3 + h3 -> (Ni t) Ch4-Ch4
9) Ch4-Ch4 -> (Ni t) Ch3=Ch3
10) Ch3=Ch3 ->(Ni t) h3 + CHтройная связьСH
11)CHтройная связьСH + h3 ->(Ni t) Ch3=Ch3
12)CHтройная связьСH + h3 ->(Ni t) Ch3=Ch3
Ch3=Ch3+ h3 -> (Ni t) Ch4-Ch4
13)Ch4-Ch4 -> (Ni t) 2h3 + CHтройная связьСH
14) Ch4-C=O + [Ag(Nh4)2]OH -> (t) Ch4-COOH + Ag↓ + Nh4+ h3O
|
H
15)Ch4-COOH + Cl2 -> ( P красный) Ch3 — COOH + HCL
|
Cl
16)
17) Ch3=Ch3 + h3 -> (Ni t) Ch4-Ch4
Ch4-Ch4 +Cl2 -> (свет) Ch4-Ch3-Cl + HCl
18) Ch4-Ch3-Cl + KOH (спирт.
р-р) -> Ch3=Ch3
в решении не уверена, надеюсь поможет))
АЛКАНЫ
1. Бутан →этан →хлорэтан → бутан → изобутан
2. Ацетат натрия →метан → хлорметан → этан → этен
3. Метан → ацетилен → этан → пропан → 1-хлорпропан
4. Углерод → метан → бромметан → этан → хлорэтан → бутан
Углерод → метан → бромметан → этан → хлорэтан → бутан
5. 1-хлорпропан → гексан → пропан → 2-хлорпропан → 2,3-диметилбутан
6. Ацетат натрия → метан → этен → этан → хлорэтан → пропан → оксид углерода (4)
7. Пропионат натрия → этан → бромэтан → бутан → этан →1,1- дихлорэтан
АЛКЕНЫ
1. Метан → хлорметан → этан → этилен → полиэтилен
2. Этанол → этилен → хлорэтан → этилен → этанол
3. Бутан → этен → хлорэтан → бутен-1 → 2-бромбутан
4. Метан → ацетилен → этан → бромэтан → пропан → пропен
5. Этанол
6. Пропионат натрия → этан → этен → 1,2-дибромэтан → этен → этанол
7. 1,2-дибромбутан → бутен-1 → 2-хлорбутан → бутен-2 → 2,3-дибромбутан
8. 1-хлорпропан → пропен → 2-хлорпропан → пропен → пропанол-2
9. 2-хлорбутан → бутен-2 → 2,3-дибромбутан → бутен -2 → 2-бромбутан
2-хлорбутан → бутен-2 → 2,3-дибромбутан → бутен -2 → 2-бромбутан
Пропан → пропен → 2-хлорпропан → пропен → полипропилен
АЛКИНЫ
1. Карбонат кальция → оксид кальция → карбид кальция → ацетилен → винилхлорид → поливинилхлорид
2. Этан → хлорэтан → этен → хлорэтен → этин
3. Углерод → карбид кальция → ацетилен → этилен → этанол → этилен → ацетилен
4. Этанол → этилен → ацетилен → винилхлорид → хлорэтан
5. 1-бромпропан → пропен → 1,2-дихлорпропан → пропин → 2-бромпропен
6. Метан → хлорметан → этан → этин → 1,2-дихлорэтен → 1,2-дихлорэтан
7. Этин → этен → этихлорид → бутан → изобутан
8. Метан → 1,2-дибромэтан → ацетилен → бензол
9. Карбид алюминия → метан → ацетилен→ этилен → этан
Карбид алюминия → метан → ацетилен→ этилен → этан
Ацетат натрия → метан → ацетилен → винилхлорид → поливинилхлорид
11. Этанол → этилен → 1,2-дихлорэтан → ацетилен → оксид углерода (4)
Этан → хлорэтан → этилен → 1,2-дибромэтан → ацетилен
АЛКАДИЕНЫ
1. Метан → этилен
2. Карбонат кальция → карбид кальция → ацетилен → этилен → этанол → бутадиен-1,3 → бутен-2 → бутандиол -2,3
3. 1-хлорпропан → пропен → бутан → бутадиен-1,3 → 1,4 дибромбутен-2
4. Метан → этан → ацетилен → винилацетилен → хлоропреновый каучук
5. Метан → пропен → изопентан → изопрен → изопреновый каучук
6. Пропан → пентан → 2-метилбутан → 2-метилбутадиен-1,3 → изопреновый каучук
7.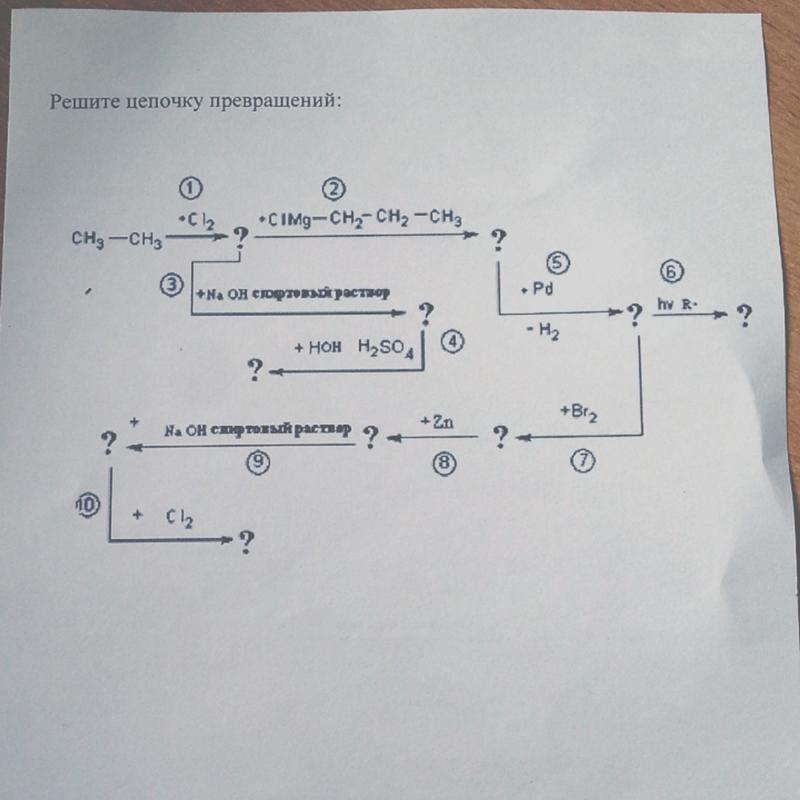 Кальций → этин → винилхлорид → бутан → бутадиен-1,3
Кальций → этин → винилхлорид → бутан → бутадиен-1,3
8. Этан → этилен → бутадиен-1,3 → бутен-2 → 2-хлорбутан
9. Ацетилен → этилен → этанол → бутадиен-1,3 →
бутадиеновый каучукМетан → хлорметан → этан → этилхлорид → бутадиен-1,3
АРЕНЫ
1. Метан → ацетилен → бензол → толуол → бензойная кислота
2. Ацетилен → бензол → хлорбензол → толуол → 2,4,6 тринитротолуол
3. Этан → 1,2-дибромэтан → этилен → бензол → гексахлорциклогексан
4. Пропан → гексан → бензол → бромбензол → толуол
5. 1,2-дихлоэтан → ацетилен → бензол → нитробензол → азот
6. Этен → 1,2-дибромэтан → бензол → циклогексан
7. Гексан → циклогексан → бромбензол → метилбензол → 1-метил-2,4,6 – тринитробензол
8. Гексан → циклогексан → бензол → толуол → бензойная кислота
Гексан → циклогексан → бензол → толуол → бензойная кислота
Оксид кальция → карбид кальция → ацетилен → хлорбензол → бензойная кислота
ОДНОАТОМНЫЕ СПИРТЫ
1. Углерод → метан → бромметан → метанол → диметиловый эфир
2. Бутан → этилен → этанол → диэтиловый эфир → оксид углерода (4)
3. Этан → пропан → 1-хлорпропан → пропанол – 1 → пропионовая кислота
4. Пропин → пропанол – 1 → пропен → пропанол – 2 → 2-хлорпропан
5. Карбонат кальция → этан → этанол → бутан → этанол → диэтиловый эфир
6. Пропанол-1 → 2-бромпропан → пропен → 1,2-дибромпропан → пропин
7. Пропан → пропен → 2-хлорпропан → пропанол -2 → изопропилат кальция
8.
МНОГОАТОМНЫЕ СПИРТЫ
1. Метан → 1,2-дибромэтан → этиленгликоль → 1,2-дихлорэтан → ацетилен
2. Этин → этанол → этандиол — 1,2, → 1,2 – дихлорэтан → этилен → этилат натрия
3. Бутан → бутен -1 → 1,2-дибромбутан → бутандиол — 1,2 → 1,2 –дихлорбутан
4. Карбонат кальция → этин → этанол → бутен – 2 → — бутандиол- 2, 3
5. Метан → этан → хлорэтан → этанол → бутадиен – 1,3 → 1,2,3,4 тетрабромбутан
6. Кальций → ацетилен → этанол → бутан → этанол → уксусная кислота
7. Ацетат натрия → ацетилен → этилен → этанол → этилат натрия → этанол → ацетальдегид
ФЕНОЛЫ
1. Метан
2.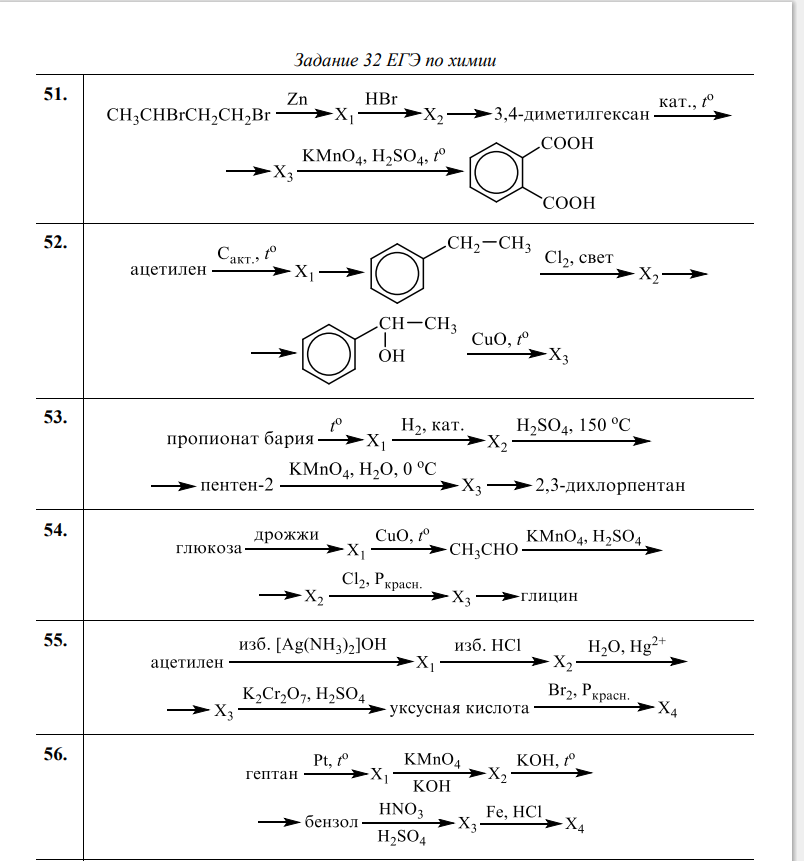 Ацетат натрия → ацетилен → бромбензол → фенол → 2,4,6 тринитрофенол
Ацетат натрия → ацетилен → бромбензол → фенол → 2,4,6 тринитрофенол
3. Гексан → бензол → фенол → фенолят калия → 2,4,6 трибромфенол
4. Метан → этин → бензол → изопропилбензол → фенол
5. Пропан → гексан → хлорбензол → фенолят натрия → пикриновая кислота
АЛЬДЕГИДЫ
1. Карбонат кальция → карбид кальция → ацетилен → ацетальдегид → уксусная кислота
2. Карбид кальция → этаналь → этанол → этилат натрия → этанол
3. Метан → хлорметан → метанол → метаналь → метановая кислота
4. Этилен → бутан → этилен → этаналь → этанол
5. Метан → этилен → этанол → этаналь → этанол
6. Метан → формальдегид → метанол → метаналь → муравьиная кислота → оксид углерода (2)
7.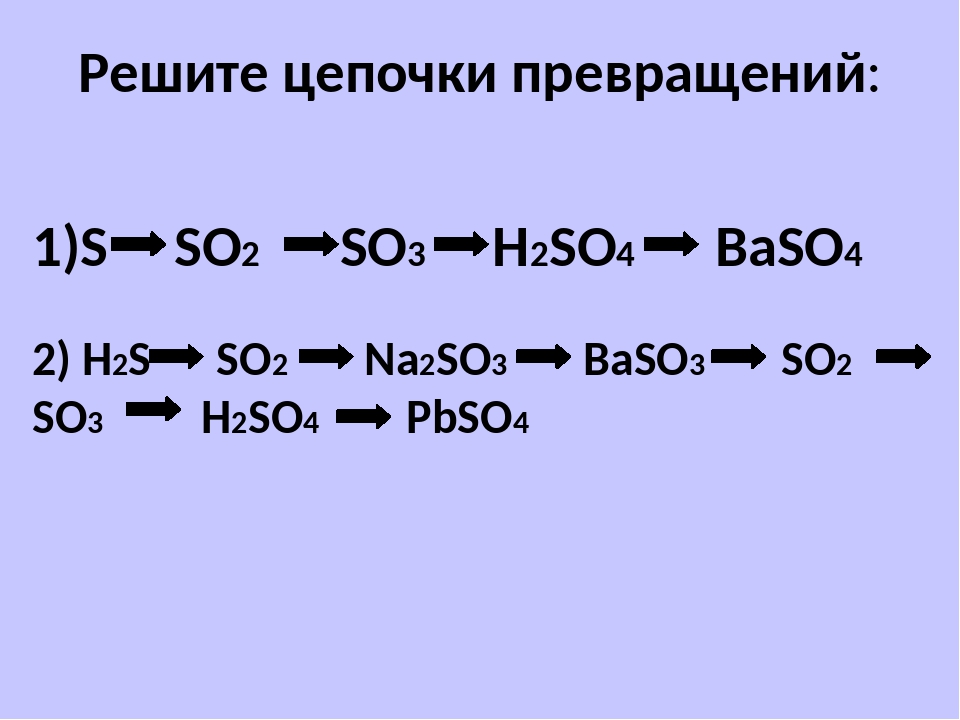 Оксид углерода (2)→ метаналь → оксид углерода (4) → метанол → формальдегид
Оксид углерода (2)→ метаналь → оксид углерода (4) → метанол → формальдегид
8. Этан → хлорэтан → этанол → этаналь → этанол
9. Ацетальдегид → этанол → бромэтан → этанол → этаналь
Метан → ацетилен → этаналь → этанол → бутадиен – 1,3
11. Этаналь → этанол → этилен → этин → этаналь
12. Метан → ацетилен → этаналь → этанол → этилен
КАРБОНОВЫЕ КИСЛОТЫ
1. Ацетилен → этанол → этилен → уксусная кислота → ангидрид уксусной кислоты → уксусная кислота
2. Карбонат кальция → карбид кальция → ацетилен → этановая кислота → этанол
3. Оксид кальция → карбид кальция → уксусная кислота → оксид углерода (4)
4. Метанол → метаналь → формиат натрия → муравьиная кислота → угольная кислота
5. Этилен → этанол → этановая кислота → ацетат аммония → уксусная кислота
Этилен → этанол → этановая кислота → ацетат аммония → уксусная кислота
6. Метан → бромметан → этанол → уксусная кислота → хлоруксусная кислота
7. Бензол → толуол → бензойная кислота → этилбензоат → бензоат натрия
8. Бутан → этановая кислота → этанол → этилен → этиленгликоль
9. Ацетилен → этанол→ ацетальдегид → уксусная кислота → изопропилацетат
Этан → пропан → 1 – хлорпропан → пропанол – 1 → пропионовая кислота
11. Оксид углерода (2) → метанол → метановая кислота → метанол → матаналь
12. Этилен → этанол → уксусная кислота → ацетат натрия → метан → хлорметан → метанол → этановая кислота → этанол → этаналь
Хлорметан → метанол → этановая кислота → этанол → этаналь
14. Метан → хлорметан → метаналь → метановая кислота → оксид углерода (2)
Метан → хлорметан → метаналь → метановая кислота → оксид углерода (2)
СЛОЖНЫЕ ЭФИРЫ
1. Карбид кальция → ацетилен → уксусная кислота → этилацетат → оксид углерода (4)
2. Этанол → этилен → уксусная кислота → метилацетат → метанол
3. Пентан → этилен → ацетальдегид → уксусная кислота → изопропилацетат → ацетат натрия
4. Метан → хлорметан → метанол → муравьиная кислота → метилформиат → формиат натри → муравьиная кислота
5. Пропанол – 1 → пропаналь → пропионовая кислота → этилпропионат → этилат натрия → этанол
6. Оксид углерода (4) → метанол → этановая кислота → пропилацетат → пропионат кальция
7. Метан → ацетилен → уксусная кислота → ацетат натрия → этилацетата
8. Углерод → оксид углерода (2) → формиат натрия → муравьиная кислота → оксид углерода (2)→ водород
9.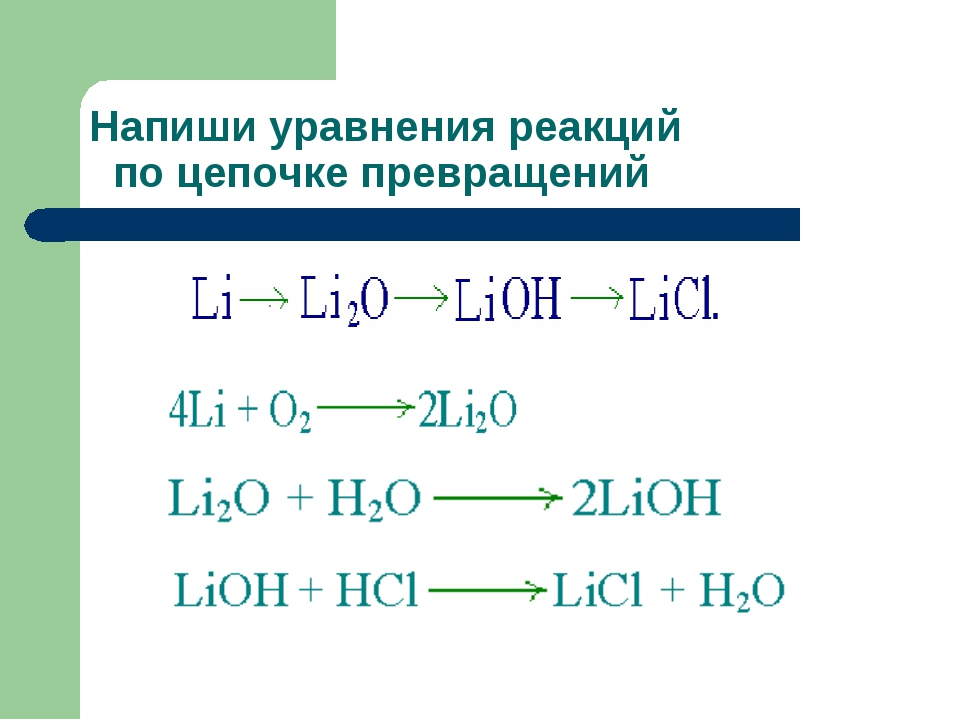 Метан → метанол → этановая кислота → этилацетат → уксусная кислота → метан
Метан → метанол → этановая кислота → этилацетат → уксусная кислота → метан
Фрормальдегид → метанол → хлорметан → этанол → ацетат натрия → ацетилен
11. Метанол → метилацетат → ацетат натрия → уксусная кислота → этанол
12. Метилацетат → метанол → метаналь → метановая кислота → угольная кислота
13. Этилен → этилбромил → этанол → этилацетат → ацетат натрия → ацетилен → полихлорвинил
Этилацетат → этанол → этановая кислота → 2-хлорэтановая кислота → метиловый эфир 2-хлорэтановой кислоты
Этилацетат → уксусная кислота → фенилацетат → фенолят натрия → фенол
16. Бензол → толуол → бензойная кислота → этилбензоат → бензоат натрия
Метан → ацетилен → хлорбензол → фенол → фенилацетат → фенолят натрия
18. Метан → хлорметан → меттанол → метилацетат → оксид углерода (4)
Метан → хлорметан → меттанол → метилацетат → оксид углерода (4)
Ацетилен → этановая кислота → ацетат натрия → этилацетат → этилат натрия → эжтанол
20. Окисид углерода (2) → метанол → метаналь → этилформиат → этанол
21. Бутан → этановая кислота → этанол → этилат натрия → этилацетат
22. Этилен → этилацетат → этанол → этилен → ацетилен → этанол → этановая кислота → метилацетат
ЖИРЫ, МЫЛА
1. Глицерин → триглицерид стеариновой кислоты → стеарат натрия → стеариновая кислота → стеарат кальция
2. Олеиновая кислота → триглицерид олеиновой кислоты → триглицерид стеариновой кислоты → стеариновая кислота → стеарат натрия
3. Триглицерид олеиновой кислоты → олеиновая кислота → триглицерид стеариновой кислоты → глицерин → тринитроглицерин
УГЛЕВОДЫ
1. Крахмал → глюкоза → этанол → этилен → этанол
Крахмал → глюкоза → этанол → этилен → этанол
2. Сахароза → глюкоза → этанол → этилформиат → этилат натрия
3. Сахароза → фруктоза → углекислый газ → глюкоза → молочная кислота → метиловый эфир молочной кислоты
4. Крахмал → глюкоза → этанол → метилацетат→ ацетат натрия
5. Крахмал → этанол → уксусная кислота → этанол → 1,2-дибромэтан
6. Целлюлоза → глюкоза → этанол → бутадиен – 1,3 → бутадиеновый каучук
7. Мальтоза → глюкоза → уксусная кислота → хлоруксусная кислота → этиловый эфир хлоруксусной кислоты
8. Крахмал → мальтоза → глюкоза → масляная кислота → метиловый эфир масляной кислоты
9. Углекислый газ → глюкоза → молочная кислота → этиловый эфир молочной кислоты → оксид углерода (4)
Сахароза → глюкоза → сорбит
11. Сахароза → углекислый газ → глюкоза → глюконовая кислота
Сахароза → углекислый газ → глюкоза → глюконовая кислота
12. Формальдегид → муравьиная кислота → формиат натрия → формальдегид → глюкоза
13. Карбонат кальция → ацетилен → оксид углерода (4) → глюкоза → молочная кислота
Цепочки химических превращений для органических веществ с ответами
Карбонат кальция → глюкоза → целлюлоза → т ринитроцеллюлоза (триацетат целлюлозы)
15. Глюкоза → мальтоза→ крахмал→ бутадиен – 1,3 → бутен – 2
Мальтоза → глюкоза → сахароза → фруктоза → оксид углерода (4)
17. Фруктоза → сахароза → глюкоза → масляная кислота
АМИНЫ
1. Метан → карбид кальция → ацетилен → бензол → анилин → азот
2. Этанол → ацетилен → бензол → анилин → 2,4,6 – триброманилин
3.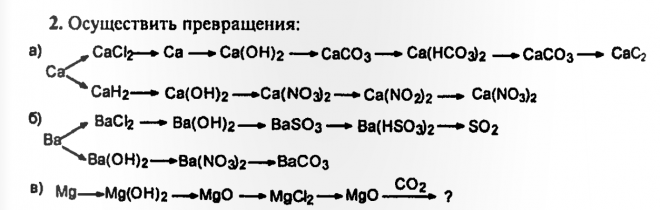 Гексан → циклогексан → анилин → хлоридфениламин → анилин
Гексан → циклогексан → анилин → хлоридфениламин → анилин
4. Этан → нитроэтан → хлорид этиламмония → этиламин → оксид углерода (4)
5. Гексан → циклогексан → бензол→ нитробензол → сульфат фениламин
6. Этиламин→ хлорид этиламмония → этиламин→ оксид углерода (4) → глюкоза
7. Гексан → бензол → анилин → гидросульфид фениламмония → сульфат фениламмония → анилин
8. Метан → нитрометан → гидроксид метиламин → хлорид метиламин → нитрат метиламин → нитрат натрия
9. Нитроэтан → этиламин → сульфат этиламмония → этиламин → оксид углерода (4)
АМИНОКИСЛОТЫ
1. 1-Хлорпропан → пропанол -1 → пропановая кислота → α – хлорпропановая кислота → α- аланин
2. Этилен → этаовая кислота → глицин → глициналанин → α – аланин
3.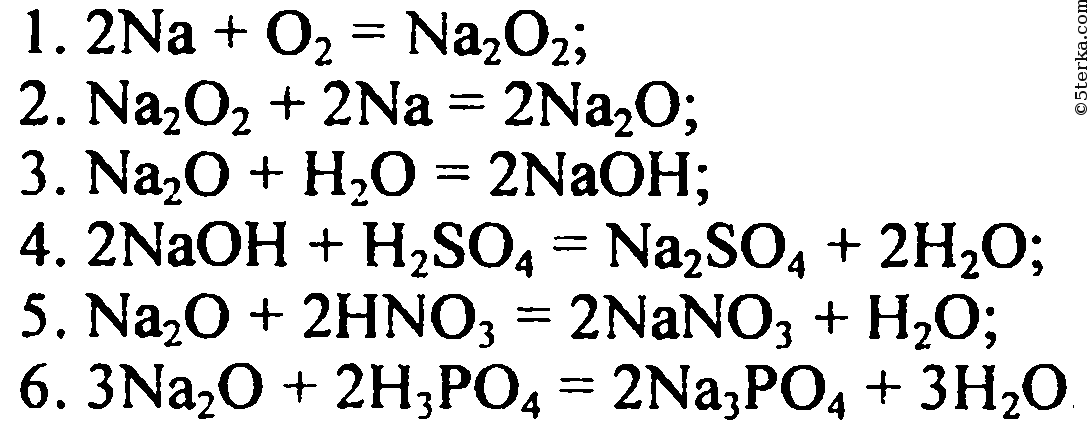 Бутан → уксусная кислота → монохлоруксусная кислота → глицин к→ алиевая соль глицина
Бутан → уксусная кислота → монохлоруксусная кислота → глицин к→ алиевая соль глицина
4. Глюкоза → этанол → уксусная кислота→ глицин → глицилглицин
5. Метанол → метановая кислота → этанол → этановая кислота → аминоэтановая кислота → хлорид глицина
6. Бутаналь → масляная кислота → α – хлормасляная кислота → α – аминомасляная кислота → натриевая соль 2 – аминобутановой кислоты
7. Сахароза → этанол → этаналь → 2 – хлорэтановая кислота → метиловый эфир 2 – хлорэтановой кислоты метанол
8. Метан→ ацетилен → уксусная кислота → глицин→ глицилглицин → глицин
9. Мальтоза→ глюкоза→ этановая кислота → глицин → глицилаланин → аланин
Этанол → уксусная кислота → хлоруксусная кислота → аланилглицин → глицин
11.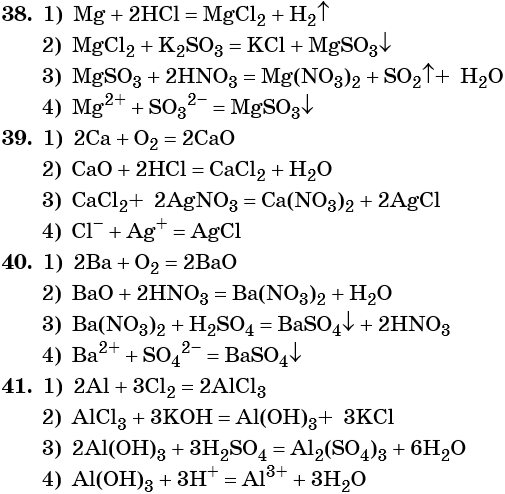 Бутан → этилен → уксусная кислота → монохлоруксусная кислота → глицин
Бутан → этилен → уксусная кислота → монохлоруксусная кислота → глицин
Этан→ этилен → этановая кислота → аминоэтановая кислота → метиловый эфир аминоэтановой кислоты
13. Этан → бромэтан→ этанол → уксусная кислота → аминоуксусная кислота
Ацетальдегид → уксусная кислота → хлоруксусная кислота → глицин → натриевая соль глицина
15. Ацетилен → уксусная кислота → этилацетат → этановая кислота → аминоэтановая кислота
Задание с ответами: химия.
300 попроще и 300 посложнее Задания-цепочки по органической химии
ЕГЭ — 2018
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ | |
| A) ацетат натрия и соляная кислота Б) ацетат натрия и гидроксид натрия (прокаливание) В) фенолят натрия и бромметан Г) фенолят натрия и угольная кислота | 1) фенол 2) бензойная кислота 3) метилфениловый эфир 4) метанол 5) метан 6) уксусная кислота |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам.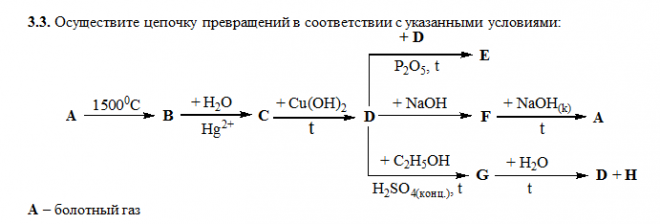
Сведения для решения
Установим соответствие.
А) Реакция ацетата натрия с соляной кислотой — обменная реакция соли и кислоты, в ходе которой образуется другая соль (хлорид натрия) и другая кислота (уксусная кислота).
Б) При прокаливании ацетата натрия с гидроксидом натрия образуется карбонат натрия и метан.
Это один из методов получения алканов.
В) При взаимодействии фенолята натрия с бромметаном происходит обменная реакция с образованием бромида натрия и простого метилфенилового эфира.
Г) Реакция соли с кислотой, образуется другая соль (карбонат натрия) и другая кислота (фенол).
Правильный ответ: 6531.
Правильный ответ: 6531
Рубрики Актуальная литература по предметуМетки Список литературы
Цепочки по органической химии
РЕШЕНИЕ
C(_{10})O + KBr
n(бромбензола=35г/157(г)/моль=0.223 моль
n(фенолят калия= 31г/132(г)/моль=0.235 моль
Фенолят калия дан в избытке, поэтому расчет ведём по бромбензолу данному в недостатке.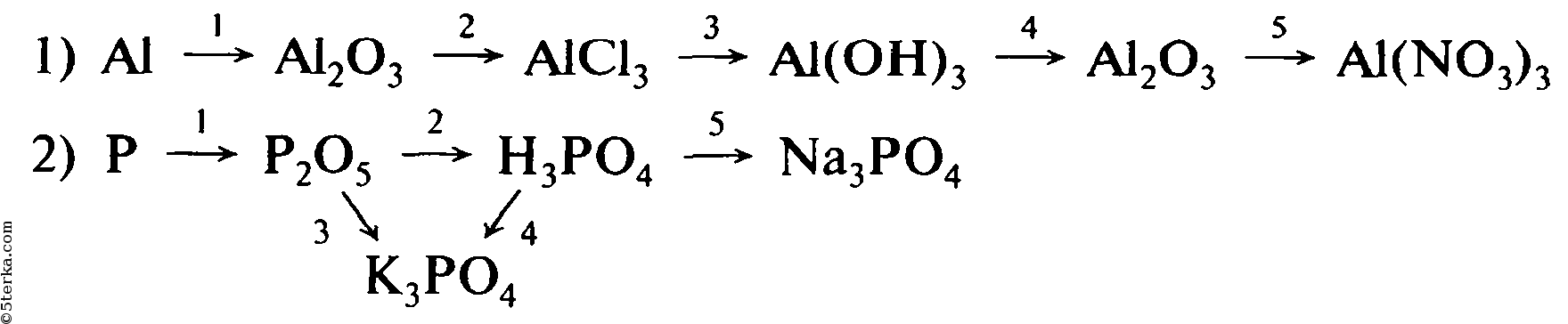 Количество бромбензола будет равно (эквимолярное соотношение количеству эфира. Значит в результате этой реакции можно получить 0.223 моль дифенилового эфира.
Количество бромбензола будет равно (эквимолярное соотношение количеству эфира. Значит в результате этой реакции можно получить 0.223 моль дифенилового эфира.
Ответ: 0.223 моль
Структурная формула
Истинная, эмпирическая, или брутто-формула: C2h4Cl
Рациональная формула: Ch3=CHCl
Химический состав Винилхлорида
СимволЭлементАтомный весЧисло атомовПроцент массы
| C | Углерод | 12.011 | 2 | 38,4% |
| H | Водород | 1.008 | 3 | 4,8% |
| Cl | Хлор | 35.453 | 1 | 56,8% |
Молекулярная масса: 62,498
Винилхлори́д (хло́ристый вини́л, хлорвини́л, хлорэтиле́н, хлорэте́н, этиленхлори́д) — органическое вещество; бесцветный газ со слабым сладковатым запахом, имеющий формулу C2h4Cl и представляющий собой простейшее хлорпроизводное этилена.
Вещество является чрезвычайно огне- и взрывоопасным, выделяя при горении токсичные вещества. Винилхлорид — сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие.
Винилхлорид — сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие.
Промышленное производство винилхлорида входит в первую десятку производства крупнейших многотоннажных продуктов основного органического синтеза; при этом почти весь производимый объём используется для дальнейшего синтеза поливинилхлорида (ПВХ), мономером которого и является винилхлорид.
Впервые винилхлорид был получен профессором химии Гиссенского университета Юстусом Либихом в 30-х годах XIX века действием на дихлорэтан спиртового раствора гидроксида калия.
Винилхлорид при нормальных условиях представляет собой бесцветный газ со слабым сладковатым запахом, напоминающим запах хлороформа.
Цепочки превращений по органической химии 10 класс
Порог ощущения запаха в воздухе составляет приблизительно 3000 частей на миллион. Малорастворим в воде (около 0,95 масс.% при 15—85 °С), легко растворим в спирте, хлороформе и дихлорэтане, растворим в диэтиловом эфире.
Винилхлорид — активное химическое соединение, чьи химические свойства определяются как наличием двойной связи, так и атома хлора.
Подобно алкенам, винилхлорид вступает в реакции присоединения по кратной связи, при этом атом хлора выступает в роли электронакцепторного заместителя, тем самым снижая реакционную способность соединения в реакциях электрофильного присоединения и повышая реакционную способность соединения в реакциях нуклеофильного присоединения.
Атом хлора в винилхлориде очень инертен, что связано с влиянием двойной связи, поэтому реакции замещения, связанные с ним, для винилхлорида не характерны.
В то же время именно это свойство позволяет относительно легко отщеплять от него молекулу хлороводорода.
Наибольший интерес представляет реакция полимеризации винилхлорида, имеющая огромное практическое значение.
примеры и способы решения — OneKu
Содержание статьи:Химические цепочки превращений — это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
 В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.Пример решения цепочки превращений
Вам будет интересно:Каково значение слова «транспарентность»?
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
 В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
Источник
8 Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. Аккумуляторы
Лекция 8
Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. Аккумуляторы.
Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их комбинации. Различают три основных типа электрохимических систем, часто называемых электрохимическими цепями.
1. Система составлена из двух химически одинаковых электродов, на которых совершается одна и та же электродная реакция. ЭДС таких систем была бы равна нулю, если бы физические свойства электродов, а следовательно, и их стандартные потенциалы были одинаковыми. Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой — в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние.
Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой — в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние.
2. Два электрода совпадают по своим физическим свойствам, качественному химическому составу и природе электродной реакции. Они отличаются лишь тем, что активность одного или нескольких участников реакции на электродах неодинакова. Электрохимические цепи, в которых электроды отличаются только активностью (концентрацией) участников электродной реакции, называются концентрационными цепями. Источником электрической энергии в концентрационных цепях служит энергия переноса вещества от большей активности к меньшей.
3. Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции.
Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции.
ФИЗИЧЕСКИЕ ЦЕПИ.
ГРАВИТАЦИОННЫЕ ЦЕПИ. Такие цепи состоят обычно из двух жидких электродов разной высоты, изготовленных из одного и того же металла. Электроды погружены в раствор соли данного металла. Подобную цепь с ртутными электродами высотой h1 и h2 (h1 > h2), опущенными в раствор соли ртути HgA, можно представить следующей схемой :
Hg êHgA êHg
(h1) (h2)
Электрод большей высоты (h1) обладает повышенным запасом свободной энергии по сравнению с электродом менее высоким, поэтому он растворяется с образованием ионов ртути :
Hg (h1) ® 1/2 Hg22+ + e
тогда как на правом электроде, с меньшим запасом энергии, ионы ртути разряжаются и выделяется металлическая ртуть :
1/2 Hg22+ + e ® Hg (h2)
Суммарный процесс в гравитационной цепи состоит, следовательно, в переносе ртути от высокого электрода к низкому :
Hg (h1) ® Hg (h2)
Этот самопроизвольный процесс продолжается до тех пор, пока высоты электродов не сравняются. Т.о., гравитационные цепи представляют собой электрохимические системы, в которых механическая энергия, обусловленная разницей электродов по силе тяжести, превращается в электрическую энергию благодаря протекающим в них электрохимическим реакциям.
Т.о., гравитационные цепи представляют собой электрохимические системы, в которых механическая энергия, обусловленная разницей электродов по силе тяжести, превращается в электрическую энергию благодаря протекающим в них электрохимическим реакциям.
ЭДС гравитационных цепей зависит от разности высот; она обычно очень мала : составляет, например, для ртути при Dh = 1м всего около 2×10-5 В. Такие цепи не имеют практического значения, но они интересны тем, что говорят о возможности генерирования электрической энергии в системах с химически одинаковыми электродами.
АЛЛОТРОПИЧЕСКИЕ ЦЕПИ. Электродами служат две модификации одного и того же металла (Мa и Мb), погруженного в раствор или расплав его ионопроводящего соединения. При данной Т только одна из модификаций устойчива (если это не Т фазового превращения, при которой существуют в равновесии обе модификации), другая находится в метастабильном состоянии. Электрод, изготовленный из металла в метастабильном состоянии (пусть это будет Мb), обладает повышенным запасом свободной энергии. Он играет роль отрицательного электрода элемента и посылает ионы металла в раствор :
Он играет роль отрицательного электрода элемента и посылает ионы металла в раствор :
Мb = Мn+ + ne
На электроде, изготовленном из устойчивой a-модификации, происходит разряд металлических ионов :
Мn+ + ne = Мa
Т.о., общая реакция в аллотропической цепи
Мb êМА êМa
заключается в переносе металла от метастабильной модификации к устойчивой : Мb ® Мa , т.е. в электрохимическом превращении неустойчивой модификации в устойчивую. Возникающие разности потенциалов обычно малы, но в некоторых процессах (в частности, в процессах коррозии) их необходимо принимать во внимание.
КОНЦЕНТРАЦИОННЫЕ ЦЕПИ.
КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ПЕРВОГО РОДА. К концентрационным цепям первого рода относят системы, состоящие из двух электродов, одинаковых по своей природе, но отличающихся по количественному составу; оба электрода погружены в один и тот же раствор.
Типичным примером концентрационных цепей являются амальгамные цепи, в которых отличие между электродами сводится лишь к неодинаковой активности металла, растворенного в амальгаме :
Hg, M êMA êM, Hg
(aI) (aII)
Если aI > aII , то на левом электроде металл растворяется и переходит в раствор в виде ионов :
MHg (aI) = Mn+ + ne + Hg
а на правом электроде совершается та же реакция, но в обратном направлении:
Mn+ + ne + Hg = MHg (aII)
Суммарный процесс сводится к переносу металла от концентрированной амальгамы к разбавленной :
MHg (aI) ® MHg (aII)
ЭДС такой системы равна :
Е = ln
Перенос происходит до тех пор, пока сохраняется различие в концентрациях (активностях) амальгам, использованных в качестве электродов.
Примером амальгамной цепи служит элемент, изготовленный из амальгам калия разной активности и раствора хлорида калия :
Hg, K êKCl êK, Hg
(aI) (aII)
Другим примером концентрационных цепей первого рода служат простые газовые цепи, составленные из двух одинаковых газовых электродов, отличающихся лишь давлением газа. ЭДС таких систем можно найти из механической работы, совершаемой при переходе 1 моля газа от высокого давления р¢ к низкому р¢¢ :
Е = ln
Например, ЭДС водородной газовой цепи
Pt êH2 êHCl êH2 êPt
() ()
определяется уравнением :
Е = ln
На левом электроде будет наблюдаться ионизация водородного газа, а на правом — разряд водородных ионов и переход водорода в газовую фазу. Из уравнения для ЭДС следует, что для газов типа водорода и хлора с n = 2 ЭДС газовой цепи при отношении р¢/р¢¢ = 10 и при 25оС составит около 0,030 В. Для кислородной газовой цепи (n = 4) при тех же условиях ЭДС равна 0,015 В.
Из уравнения для ЭДС следует, что для газов типа водорода и хлора с n = 2 ЭДС газовой цепи при отношении р¢/р¢¢ = 10 и при 25оС составит около 0,030 В. Для кислородной газовой цепи (n = 4) при тех же условиях ЭДС равна 0,015 В.
КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ВТОРОГО РОДА. Эти цепи включают в себя два одинаковых электрода, погруженных в растворы одного и того же электролита различной активности. В зависимости от того, по отношению к каким ионам электролита обратимы электроды, концентрационные цепи второго рода разделяются на катионные, например :
I II
Hg, K êKCl¦KCl êK, Hg
(aI) (aII)
и на анионные, например :
Ag êAgCl êHCl¦HCl êAgCl êAg
(aI) (aII)
Процесс, вызывающий появление ЭДС в цепях такого рода, заключается в переносе электролита из концентрированного раствора в разбавленный; концентрационные цепи второго рода называются поэтому также цепями с переносом. Существование между растворами границы, через которую совершается перенос ионов и где локализуется диффузионный потенциал, позволяет определять их также как цепи с жидкостной границей.
Существование между растворами границы, через которую совершается перенос ионов и где локализуется диффузионный потенциал, позволяет определять их также как цепи с жидкостной границей.
Рассмотрим процесс образования ЭДС в концентрационных цепях второго рода на примере анионной цепи. Пусть aI > aII , тогда у левого электрода будет протекать реакция
Ag + Cl—I = AgCl + e
и совершаться перенос ионов в соответствии с их числами переноса
— t+H+I + t—Cl—I
У правого электрода будут протекать те же процессы, но в обратном направлении : во-первых, превращение хлорида серебра в металлическое серебро и ионы хлора
AgCl + e = Ag + Cl—II
и, во-вторых, перенос ионов
t+H+II — t—Cl—II
Сумма всех электродных процессов дает общее уравнение электрохимической реакции в анионной цепи :
t+H+I + t+Cl—I = t+H+II + t+Cl—II
Т. о., источником электрической энергии в данной концентрационной цепи является перенос t+ молей HCl от более концентрированного раствора к менее концентрированному. Выражение для ЭДС анионной концентрационной цепи второго рода имеет вид :
о., источником электрической энергии в данной концентрационной цепи является перенос t+ молей HCl от более концентрированного раствора к менее концентрированному. Выражение для ЭДС анионной концентрационной цепи второго рода имеет вид :
Е = Ео + ln = t+ ln
поскольку Ео = jо1 + jо2 = 0 для системы с двумя одинаковыми электродами, включенными навстречу друг другу.
Свяжем активность отдельных ионов электролита с его средней активностью:
а+а— = а±2
Тогда : Е = 2 t+ 2,303 lg
Аналогично выводится уравнение для ЭДС катионной концентрационной цепи второго рода. Так, для вышеприведенной амальгамной цепи :
Е = 2 t— 2,303 lg
Из уравнений следует, что, измерив ЭДС цепи с переносом при различных концентрациях электролита, можно найти числа переноса образующих его ионов.
ХИМИЧЕСКИЕ ЦЕПИ.
Химические цепи принято разделять на простые и сложные. В простых химических цепях один из электродов обратим по отношению к катионам электролита, а другой — к его анионам. В сложных химических цепях это условие не соблюдается.
ПРОСТЫЕ ХИМИЧЕСКИЕ ЦЕПИ.
В водородно-кислородном элементе
М1 êН2 êН2О êО2 êМ2
источником электрической энергии служит химическая энергия реакции между кислородом и водородом с образованием воды :
Н2 + 1/2 О2 = Н2О
Выражение для ЭДС водородно-кислородного элемента имеет вид :
Е = Ео + ln
К этому же уравнению можно прийти, рассмотрев частные электродные реакции. На водородном электроде протекает реакция ионизации водорода
Н2 = 2Н+ + 2е
а на кислородном — реакция ионизации кислорода с образованием гидроксильных ионов
1/2 О2 + Н2О + 2е = 2ОН—
Сумма электродных реакций дает общую реакцию в химической цепи :
Н2 + 1/2 О2 + Н2О = 2Н+ + 2ОН—
Е = Ео¢ + ln
Преобразуем выражение, положив = 1 и учтя, что = Kw :
Е = Ео¢ — ln Kw + ln
Полученное выражение совпадает с вышеприведенным выражением для ЭДС при
Ео = Ео¢ — ln Kw
При 25оС Ео = + — ln Kw =
= 0 + 0,401 — 0,059 lg 10-14 = 0,401 + 0,829 = 1,230 В
Е = 1,230 + 0,03 lg
Видно, что ЭДС водородно-кислородного элемента зависит от парциальных давлений водорода и кислорода, увеличиваясь с их ростом по логарифмическому закону. Она не зависит от рН среды и должна быть одной и той же в чистой воде и в растворах щелочи или кислоты. Т.к. электропроводность чистой воды очень низка, то на практике применяют растворы щелочи, чаще всего раствор КОН :
Она не зависит от рН среды и должна быть одной и той же в чистой воде и в растворах щелочи или кислоты. Т.к. электропроводность чистой воды очень низка, то на практике применяют растворы щелочи, чаще всего раствор КОН :
М1 êН2 êКОН êО2 êМ2
Другим примером простых химических цепей может служить стандартный элемент Вестона
Pt êHg, Cd êCdSO4 êHg2SO4 êHg êPt
ЭДС которого отличается очень большим постоянством во времени и малым температурным коэффициентом. В элементе Вестона левый электрод обратим по отношению к ионам кадмия
Cd = Cd2+ + 2e
а правый — по отношению к сульфат-ионам
Hg2SO4 + 2e = 2Hg + SO42-
Общая реакция, протекающая в элементе :
Cd + Hg2SO4 = Cd2+ + SO42- + 2Hg
При учете постоянства активностей твердых веществ ЭДС элемента Вестона описывается уравнением :
Е = Ео — ln = Ео — ln
Следовательно, его ЭДС определяется активностью раствора сульфата кадмия. В электрохимической практике для измерения ЭДС компенсационным методом чаще всего применяют элементы Вестона с насыщенным раствором CdSO4. Амальгамный электрод в таком элементе содержит 12,5% кадмия. ЭДС насыщенного элемента Вестона при Т, близкой к комнатной, находят по уравнению :
В электрохимической практике для измерения ЭДС компенсационным методом чаще всего применяют элементы Вестона с насыщенным раствором CdSO4. Амальгамный электрод в таком элементе содержит 12,5% кадмия. ЭДС насыщенного элемента Вестона при Т, близкой к комнатной, находят по уравнению :
Et = 1,0183 — 4,0×10-5 (t — 20)
Третьим примером простых химических цепей может служить свинцовый, или кислотный , аккумулятор (см. ниже, «Аккумуляторы»).
СЛОЖНЫЕ ХИМИЧЕСКИЕ ЦЕПИ. Примером сложных химических цепей является элемент Даниэля-Якоби :
Zn êZnSO4¦CuSO4 êCu
в котором протекает реакция
Zn + Cu2+ = Zn2+ + Cu
Левый электрод — отрицательный полюс элемента — обратим по отношению к ионам цинка, а правый — положительный полюс элемента — по отношению к ионам меди. ЭДС элемента Даниэля-Якоби зависит поэтому от отношения активностей ионов меди и цинка :
ЭДС элемента Даниэля-Якоби зависит поэтому от отношения активностей ионов меди и цинка :
Е = Ео + ln
В этом элементе имеется граница между двумя растворами, на которой возникает диффузионный потенциал, поэтому ЭДС элемента в действительности сложнее. Однако, поскольку подвижности ионов меди и цинка не слишком отличаются друг от друга и концентрации сульфата меди и цинка близки между собой, диффузионный потенциал не играет существенной роли в создании ЭДС этого элемента.
СДВОЕННЫЕ ХИМИЧЕСКИЕ ЦЕПИ. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностью электролита, имеют один общий электрод и, т.о., электрически соединены через проводник первого рода в единую цепь. Например, простые цепи с хлорсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом :
I II
Ag êAgCl êHCl êH2 êPt êH2 êHCl êAgCl êAg
(aI) (aII)
В каждой из двух ячеек цепи протекает одна и та же реакция
Ag + H+ + Cl— = AgCl + 1/2 H2
но в противоположных направлениях, причем если aI > aII , то в первой ячейке реакция идет слева направо, а во второй — справа налево :
Ag + H+I + Cl—I = AgCl + 1/2 H2
AgCl + 1/2 H2 = Ag + H+II + Cl—II
Суммарный процесс эквивалентен переносу 1 моль ионов водорода и 1 моль ионов хлора из первой ячейки во вторую :
H+I + Cl—I = H+II + Cl—II
хотя фактический перенос в этой системе из-за отсутствия непосредственной границы раздела между растворами исключен и изменение содержания HCl обусловлено не переносом ионов, а химическими реакциями, протекающими в цепи. Сдвоенные химические цепи называют поэтому часто цепями без переноса или цепями без жидкостной границы. На основании уравнения реакции ЭДС системы будет равна :
Сдвоенные химические цепи называют поэтому часто цепями без переноса или цепями без жидкостной границы. На основании уравнения реакции ЭДС системы будет равна :
Е = Ео + ln = 2 ln
причем стандартная ЭДС Ео равна 0, т.к. в обеих ячейках протекает одна и та же реакция, но в противоположных направлениях. При этом на одной стороне водородного электрода (общего для обеих ячеек) совершается катодный процесс Н+ + е = 1/2 Н2 , а на другой — анодный 1/2 Н2 = Н+ + е. Подобные электроды называются биполярными и широко используются электрохимической промышленностью.
И по характеру процесса, и по форме уравнения для ЭДС двойная химическая цепь напоминает концентрационные цепи второго рода. Однако в сдвоенных химических цепях нет диффузионного потенциала и связанных с ним осложнений. Сопоставление ЭДС сдвоенной химической цепи и ЭДС концентрационной цепи с переносом с тем же электролитом позволяет определить его числа переноса. Сопоставление ЭДС двойной химической цепи с ЭДС соответствующей его простой цепи дает возможность с большой точностью находить стандартные потенциалы их электродов и коэффициенты активности электролитов.
Сопоставление ЭДС двойной химической цепи с ЭДС соответствующей его простой цепи дает возможность с большой точностью находить стандартные потенциалы их электродов и коэффициенты активности электролитов.
АККУМУЛЯТОРЫ.
Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока.
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен.
Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен.
Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы.
СВИНЦОВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой элемент :
(-) Pb êPbSO4 êH2SO4 (32-34 %) êPbO2 êPb (+)
Здесь имеется два электрода второго рода : свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод).
При работе аккумулятора протекают следующие электродные реакции:
на левом электроде (свинцово-сульфатном)
Pb + SO42- PbSO4 (т) + 2е
на правом электроде (свинцово-диоксидном)
PbO2 (т) + 4H+ + SO42- + 2e PbSO4 (т) + 2H2O
Суммарная реакция в цепи :
Pb + PbO2 (т) + 4H+ + SO42- 2 PbSO4 (т) + 2H2O
Откуда ЭДС цепи равна :
Е = Ео + ln = Ео + ln = Ео + ln
(поскольку — общей активности серной кислоты)
При 25оС Е = 2,04 + 0,059 lg
В свинцовых аккумуляторах применяются концентрированные растворы серной кислоты, поэтому активность воды здесь не будет постоянной и ее нельзя включать в величину Ео.
Токообразующие процессы отвечают теории двойной сульфатации Гладстона и Трайба. По этой теории оба электрода при разряде переходят в сульфат свинца. Когда они становятся одинаковыми по своему химическому составу, т.е. превращаются в электроды второго рода SO42- êPbSO4 êPb , ЭДС цепи падает до 0. Продукт электродных реакций — твердый сульфат свинца — обладает способностью удерживаться на поверхности электродов. Поэтому при прохождении тока в обратном направлении (при подключении внешнего источника тока) реакции идут справа налево, в сторону регенерации исходных веществ — металлического свинца и диоксида свинца. После регенерации электрохимическая цепь снова может стать источником электрической энергии. Такие циклы разряда и заряда могут повторяться много раз, и после каждого нового заряда восстанавливается исходное состояние системы.
Рассмотренная цепь была первым аккумулятором; идея его создания была высказана Якоби и осуществлена в 1859 г. Планте. В ХХ веке были предложены щелочные аккумуляторы : железо-никелевый (Эдиссон), кадмий-никелевый (Юнгер) и цинк-серебряный (Андре).
Планте. В ХХ веке были предложены щелочные аккумуляторы : железо-никелевый (Эдиссон), кадмий-никелевый (Юнгер) и цинк-серебряный (Андре).
КАДМИЕВО-НИКЕЛЕВЫЙ АККУМУЛЯТОР в заряженном состоянии представляет собой электрохимический элемент
(-) Cd êCd(OH)2, KOH (20%) êêKOH (20%), Ni(OH)2, Ni(OH)3 êNi (+)
Суммарная реакция в этом элементе
Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2
Значение DG для этой реакции не должно зависеть от концентрации щелочи, т.к. в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентраций у двух электродов :
Cd + 2OH— Cd(OH)2 + 2e
2Ni(OH)3 + 2e 2Ni(OH)2 + 2OH—
Тем не менее, в результате естественного перемешивания в условиях близости электродов эта разность концентраций практически не возникает. ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В.
ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В.
ЖЕЛЕЗО-НИКЕЛЕВЫЙ АККУМУЛЯТОР. В этом щелочном аккумуляторе кадмий и окись кадмия заменены железом и закисью железа.
СЕРЕБРЯНО-ЦИНКОВЫЙ АККУМУЛЯТОР. Анодом является пористая цинковая пластинка, катодом — окислы серебра Ag2O и AgO. Электролит — концентрированный раствор КОН, насыщенный цинкатом калия Zn(OK)2. Заряженный аккумулятор может быть представлен в виде :
(-) Zn êZn(OK)2, KOH (40%) êAgO или Ag2O êAg (+)
Суммарная реакция в этом элементе
AgO + Zn ZnO + Ag
Процесс идет в две стадии : AgO восстанавливается сначала до Ag2O, затем — до металлического серебра. ЭДС элементов с катодом AgO равна 1,86 В, с катодом Ag2O — 1,58-1,60 В (при 25оС). После разряда аккумулятора имеем
(-) Zn êZnO êZn(OK)2, KOH (40%) êAg (+)
В этих аккумуляторах в отличие от свинцовых и щелочных электролит в реакциях заряда и разряда не участвует, поэтому его можно брать очень мало. Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию : электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера.
Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию : электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера.
4.3: Цепные реакции I — Химия LibreTexts
Цепные реакции обычно состоят из множества повторяющихся элементарных стадий, каждая из которых имеет носитель цепи. После запуска цепные реакции продолжаются до тех пор, пока не закончатся реагенты. Пожар и взрывы — это некоторые из явлений, связанных с цепными реакциями. Носители цепи — это некоторые промежуточные звенья, которые появляются на повторяющихся элементарных этапах. Обычно это свободных радикалов .
После запуска повторение элементарных шагов продолжается до тех пор, пока не будут исчерпаны реагенты. Когда повторяющиеся шаги генерируют больше носителей цепи, они называются реакциями разветвления цепи , что приводит к взрывам. Если повторяющиеся элементарные этапы не приводят к образованию нового продукта, они называются реакциями ингибирования цепи . Добавление других материалов в реакционную смесь может привести к реакции ингибирования, чтобы предотвратить реакцию распространения цепи. Когда носители цепи взаимодействуют друг с другом с образованием стабильного продукта, элементарные стадии называются реакциями обрыва цепи .
Когда повторяющиеся шаги генерируют больше носителей цепи, они называются реакциями разветвления цепи , что приводит к взрывам. Если повторяющиеся элементарные этапы не приводят к образованию нового продукта, они называются реакциями ингибирования цепи . Добавление других материалов в реакционную смесь может привести к реакции ингибирования, чтобы предотвратить реакцию распространения цепи. Когда носители цепи взаимодействуют друг с другом с образованием стабильного продукта, элементарные стадии называются реакциями обрыва цепи .
Взрывы, полимеризация и порча пищевых продуктов часто связаны с цепными реакциями. В ядерных реакторах задействован механизм цепной реакции; в этом случае носителями цепи являются нейтроны. Механизмы, описывающие цепные реакции, являются полезными моделями для описания химических реакций. В большинстве цепных химических реакций есть очень реактивные промежуточные продукты, называемые свободными радикалами . Промежуточный продукт, поддерживающий цепную реакцию, называется носителем цепи . Эти атомы или фрагменты обычно происходят из стабильных молекул в результате фото- или тепловой диссоциации.
Промежуточный продукт, поддерживающий цепную реакцию, называется носителем цепи . Эти атомы или фрагменты обычно происходят из стабильных молекул в результате фото- или тепловой диссоциации.
Обычно свободный радикал обозначается точкой рядом с символом (\ (\ ce {*} \)), который представляет нечетный электрон, существующий в данном веществе. Этот нечетный электрон делает промежуточное звено очень реактивным. Например, радикалы кислорода, хлора и этила представлены как \ (\ ce {O *} \), \ (\ ce {Cl *} \) и \ (\ ce {C2H5 *} \) соответственно. Радикалы \ (\ ce {Cl *} \) могут образовываться в результате реакции гомолитической фотодиссоциации:
Механизм цепных реакций
Элементарные ступени, используемые для механизмов цепных реакций, можно сгруппировать в следующие категории:
- этап инициации
- шаги распространения цепи
- ступени разветвления цепи
- шаги запрета цепи
- шаги завершения цепи
Например, хлорирование этана — цепная реакция, и ее механизм объясняется следующим образом.
Если мы смешаем хлор, \ (\ ce {Cl2} \), и этан, \ (\ ce {Ch4Ch4} \), вместе при комнатной температуре, реакции не обнаружится. Однако, когда смесь подвергается воздействию света, реакция внезапно начинается и взрывается. Чтобы объяснить это, предлагается следующий механизм.
Этап инициации
Light (\ (\ ce {h \ nu} \)) часто можно использовать для инициирования цепных реакций, так как они могут генерировать свободнорадикальные промежуточные продукты посредством реакции фотодиссоциации. Шаг инициации можно записать как:
\ [\ ce {Cl2 + h \ nu \ rightarrow Cl * + * Cl} \]
Шаг распространения цепи
Элементарные шаги, на которых количество израсходованных свободных радикалов равно количеству образовавшихся свободных радикалов, называются стадиями распространения цепи. После инициирования следующие этапы развития цепи повторяются бесконечно или до тех пор, пока не будут исчерпаны реагенты:
\ [\ ce {Cl * + \; h4CCh4 \ rightarrow Clh3CCh4 + \; H *} \]
\ [\ ce {Cl * + \; h4CCh4 \ rightarrow h4CCh3 * + \; HCl} \]
\ [\ ce {H * + \; Cl_2 \ rightarrow HCl + Cl *} \]
и многие другие возможности.
На каждом из этих этапов радикал расходуется, а другой радикал генерируется. Таким образом, цепные реакции продолжаются, выделяя тепло и свет.Тепло и свет вызывают образование большего количества радикалов. Таким образом, этапы роста цепи вызывают реакций разветвления цепи .
Ступеньки разветвления цепи
Реакции разветвления — это элементарные стадии, которые генерируют больше свободных радикалов, чем потребляют. Реакции разветвления приводят к взрыву. Например, при реакции водорода с кислородом может иметь место следующая реакция:
\ [\ ce {H * + \; O2 \ rightarrow HO * + * O *} \]
, где \ (\ ce {* O *} \) — дирадикал, потому что атом \ (\ ce {O} \) имеет электронную конфигурацию 2 s 2 2 p x 2 2 p y 1 2 p z 1 .На этом элементарном этапе генерируются три радикала, а расходуется только один.
Дирадикал может реагировать с молекулой \ (\ ce {h3} \) с образованием двух радикалов.
\ [\ ce {* O * + \, h3 \ rightarrow HO * + \, H *} \]
Таким образом, вместе реакции цепного разветвления увеличивают количество носителей цепи. Реакции разветвления способствуют быстрому взрыву водородно-кислородных смесей, особенно если смеси имеют правильные пропорции.
Шаги подавления цепи
Стадии, не приводящие к образованию продуктов, называются реакциями ингибирования или стадиями.Например, следующие шаги — реакции ингибирования.
\ [\ ce {Cl * + \; Clh3CCh4 \ rightarrow h4CCh3 * + \; Cl2} \]
\ [\ ce {Cl * + \; HCl \ rightarrow H * + \; Cl2} \]
\ [\ ce {H * + \; Clh3CCh4 \ rightarrow h4CCh4 + Cl *} \]
Кроме того, иногда в систему может быть добавлено другое реактивное вещество \ (\ ce {* A} \) для уменьшения переносчиков цепи и ингибирования цепных реакций.
\ (\ ce {Cl * + * A \ rightarrow ClA \: (не \: реактивный)} \)
Вид \ (\ ce {A *} \) часто называют поглотителем радикалов . В пищевой промышленности акцепторы радикалов добавляют для предотвращения порчи из-за окисления; их называют биологическими окислителями.
В пищевой промышленности акцепторы радикалов добавляют для предотвращения порчи из-за окисления; их называют биологическими окислителями.
Механизмы цепных реакций часто довольно сложны. Когда промежуточные соединения обнаружены, может быть предложен разумный механизм. Добавление поглотителя радикалов для предотвращения порчи пищевых продуктов — важное применение в пищевой химии. Это приложение возникло в результате применения модели цепной реакции к природным явлениям.
Шаги обрыва цепи
Шаги обрыва цепи — это элементарные шаги, которые потребляют радикалы.Когда реагенты исчерпаны, свободные радикалы соединяются друг с другом, давая стабильные молекулы (поскольку неспаренные электроны становятся спаренными). Эти элементарные шаги отвечают за прекращение цепных реакций:
\ [\ ce {Cl * + * Cl \ rightarrow Cl-Cl} \]
\ [\ ce {H * + * H \ rightarrow H-H} \]
\ [\ ce {H * + * Cl \ rightarrow H-Cl} \]
\ [\ ce {h4CCh3 * + * h3CCh4 \ rightarrow Ch4Ch3-Ch3Ch4 \: (образуя \: a \: димер)} \]
и другие возможности
В цепных реакциях образуется много продуктов.
Расширение цепей — Большая химическая энциклопедия
Форполимер с концевыми гидроксильными группами был синтезирован Hiltunen et al. с 1,4-бутандиол изоцианатом затем использовали в качестве удлинителя цепи для увеличения молекулярной массы. Согласно их исследованиям, на реакцию полиаддиллона влияли структура и функциональность мономеров, характеристики гидроксильной группы, температура полимеризации, время полимеризации и соотношение -ОН / -NCO [12].[Pg.863] Gu et al. сообщили, что высокомолекулярный биоразлагаемый полимер молочной кислоты был успешно синтезирован в два этапа. Сначала мономер молочной кислоты был олигомеризован до низкомолекулярного преполимера с концевыми гидроксильными группами, затем молекулярная масса была увеличена за счет удлинения цепи с использованием 1,6-гексаметилендиизоцианата в качестве удлинителя цепи. Результаты показали, что полученный полимер имел M 27 500 г-моль и Af 116 900 г-моль после 40 мин удлинения цепи при 180 ° C [13]. [Pg.863]
[Pg.863]
Ren et al. изучили влияние различных диизоцианатов как удлинителей цепи на удлинение цепи олигомеров молочной кислоты. Результаты показали, что диизоцианат можно использовать в качестве удлинителей цепи для получения высокомолекулярных полимеров LA с цепной связью. 1,6-гексаметилендиизоцианат [HDI] как удлинитель цепи был лучше, чем метилендифенилдиизоцианат [MDI] и изофорондиизоцианат (IPDI) [14]. [Pg.863]
Кроме того, карбоксильные и гидроксильные удлинители цепи были использованы вместе при полимеризации молочной кислоты Tuominen et al.Добавление высокореакционноспособных удлинителей цепи во время заключительной стадии поликонденсации привело к полимерам с более высоким [Pg.863]
. При приготовлении форполимера прилагаются все усилия для предотвращения образования любых незапланированных разветвлений, таких как группы биурета. Форполимер является по существу линейным, за исключением случаев, когда некоторые участки поперечной сшивки были введены с использованием многофункционального изоцианата или триола. [Стр.29]
[Стр.29]
Крупнозернистые модели имеют давнюю историю в науке о полимерах.Длинноцепочечные молекулы обладают многими общими мезоскопическими характеристиками, которые не зависят от атомистической структуры повторяющихся химических единиц [4, 5 и 6]. Самоподобная структура [7, 8, 9 и 10] на больших масштабах длины характеризуется только одной шкалой длины, удлинением цепи R. [Pg.2364]
Реакция используется для удлинения цепи альдоз в синтез новых или необычных сахаров. В этом случае исходный материал ларабиноза является обильным природным продуктом и обладает правильными конфигурациями в своих трех центрах хиральности для превращения в относительно редкие l-энантиомеры глюкозы и маннозы. После образования циангидрина цианогруппы превращаются в альдегид функционирует путем гидрирования в водном растворе. В этих условиях -C = N восстанавливается до -CH = NH и быстро гидролизуется до -CH = 0. Использование отравленного катализатора палладий на сульфате бария предотвращает дальнейшее восстановление до альдитов. .. [Стр.1056]
.. [Стр.1056]
Удлинение цепи альдопентозы (-) арабинозы посредством денведенного циангидна дало смесь (+) глюкозы и (+) маннозы … [Стр.1068]
Последовательные повторения шаги, показанные на рис. 26 3, дают неразветвленные ацильные группы, содержащие 68 10 12 14 и 16 атомов углерода. В каждом случае происходит удлинение цепи … [Pg.1075]
Также в первой пробирке присутствует синтетический аналог АТФ в в котором 2 и 3 гидроксильные группы были заменены атомами водорода. Это соединение называется 2 3 дидезоксиаденосме трифосфатом (ddATP). Подобным образом ddTTP добавляется во вторую пробирку ddGTP в третью и ddCTP в четвертую Каждая пробирка также содержит праймер. короткий участок комплементарной цепи ДНК, который был помечен радиоактивным изотопом фосфора (P). Когда гель для электрофореза исследуют в конце эксперимента, положения ДНК, образованные удлинением цепи праймера, определяются методом называется авторадиогр aphy, который обнаруживает частицы, испускаемые изотопом P. .. [Pg.1181]
.. [Pg.1181]
Кетоза (Раздел 25 1) Углевод, содержащий карбонильную группу кетона в форме открытой цепи Синтез Килиама-Фишера (Раздел 25 20) Синтетический метод удлинения углеводной цепи Новая связь углерод-углерод IS образуется путем превращения альдозы в ее циангиднн. Восстановление цианогруппы до альдегидной функции завершает синтез … [Pg.1287]
Стабилизаторы и пигменты обычно суспендируют с макрогликолем и добавляют к заряду полимерного гликоля перед нанесением добавление диизоцианата.Следовательно, необходимо соблюдать осторожность, чтобы избежать добавок, которые значительно реагируют с диизоцианатами или диаминами в условиях обработки. Кроме того, следует выбирать стабилизаторы, которые не оказывают отрицательного каталитического действия на форполимер или реакции удлинения цепи. [Pg.307]
Стабилизаторы, пигменты и другие добавки измельчают в прядильном растворителе, обычно вместе с небольшими количествами уретанового полимера для улучшения стабильности дисперсии, эта дисперсия затем смешивается с раствором полимера после удлинения цепи до желаемой концентрации. Большинство производителей объединяют форполимеризацию, удлинение цепи, добавление и смешивание добавок в единую интегрированную производственную линию непрерывного действия. [Стр.307]
Большинство производителей объединяют форполимеризацию, удлинение цепи, добавление и смешивание добавок в единую интегрированную производственную линию непрерывного действия. [Стр.307]
Основное промышленное применение алкилпероксиэфиров — инициирование свободнорадикальных цепных реакций, в первую очередь для полимеризации виниловых мономеров. Разложение несимметричных дипероксиэфиров, в которых две пероксиэфирные функции разлагаются с разной скоростью, приводит к образованию полимеров с увеличенной молекулярной массой, предположительно из-за удлинения цепи при последовательном инициировании (204).[Pg.131]
Исследования относительной скорости гидролиза и конденсации многофункциональных силанов Si (OR) при кислотном и основном катализе показали, что первая (OR) группа гидролизуется намного легче, чем последующие группы (195). Конденсация сданола-сданола происходит намного медленнее, чем конденсация сданола-алкоксисилана, даже если алкоксисилан является монофункциональным, что позволяет предположить, что удлинение цепи незначительно из-за присутствия сшивающего агента (196-199).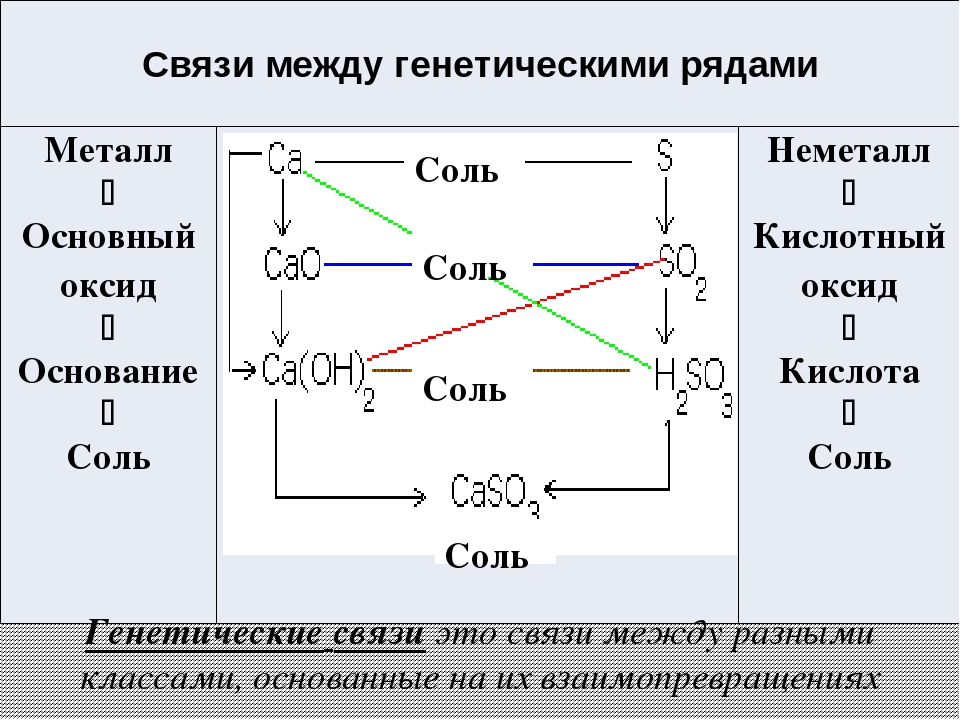 [Стр.49]
[Стр.49]
Клеи на водной основе являются предпочтительными из-за ограничений на использование растворителей.Форполимеры с низкой вязкостью эмульгируют в воде с последующим удлинением цепи водорастворимыми гликолями или диаминами. В качестве сшивающего агента можно использовать PMDI, срок хранения которого в воде составляет от 5 до 6 часов. Водоразбавляемые полиуретановые покрытия используются для вакуумного формования пленок из ПВХ для оболочек из АБС в дверных панелях автомобилей, для ламинирования пленки из АБС / ПВХ с обработанной полипропиленовой пеной для использования в автомобильных панелях, в качестве грунтовки для металла для рулевых колес, в гибких ламинирование упаковки, в качестве клея для подошв обуви и в качестве связующего слоя для тканей с полиуретановым покрытием.PMDI также используется в качестве связующего для восстановленных деревянных изделий и в качестве связующего для литейных стержней. [Pg.350]
Рис. 1. Семейство D-альдоз происходит от D-глицеральдегида за счет удлинения цепи у карбонильного атома углерода. |
В присутствии органического сиГката соли тяжелых металлов запускают реакции удлинения цепи и сшивания, которые приводят к siHcone mbber и летучий этанол в качестве побочного продукта. Полезные металлические мыла включают октаноат олова [1912-83-0], октаноат цинка [557-09-5], дибутилоловодилаурат [77-58-7] и диацетат дибутилолова [1067-33-0]. Реакционная способность различных солей значительно различается.Отверждение октаноата олова составляет 0,5–2 мин. Циакоктаноат может потребовать 24–96 ч, дилаурата дибутилолова — 10–20 мин.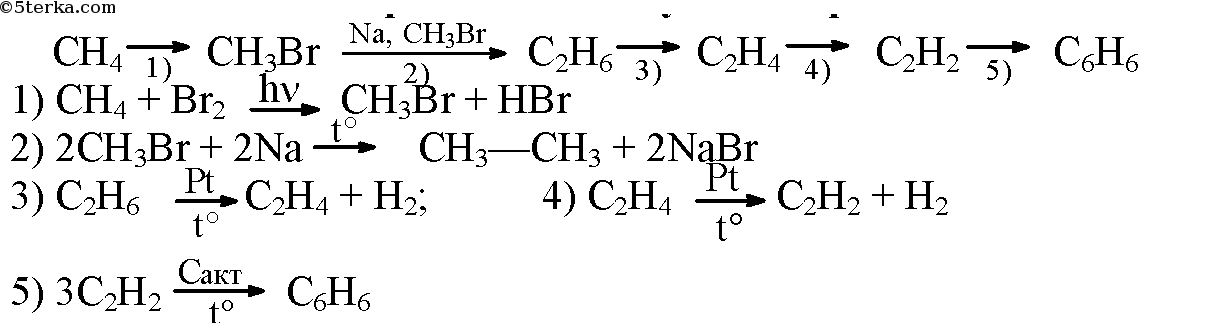 Тепло и влага ускоряют скорость отверждения, но в меньшей степени, чем, например, в случае полисульфидных смесей. [Pg.492]
Тепло и влага ускоряют скорость отверждения, но в меньшей степени, чем, например, в случае полисульфидных смесей. [Pg.492]
Этот процесс основан на очень высокой реакционной способности изоцианатной группы по отношению к присутствующему водороду, включая гидроксильные группы, амины, воду и т.д., так что реакция удлинения цепи может протекать с выходом 90% или выше. Таким образом, когда линейный полимер образуется путем удлинения цепи полиэфира или простого полиэфира с молекулярной массой 1000-3000, конечный полиуретан может иметь молекулярную массу 100000 или выше (см. Уретановые полимеры).[Pg.471]
Помимо линейного удлинения цепи, избыток диизоцианата приводит к сшиванию ячеистой сети, поскольку диизоцианатные группы могут также реагировать с атомами водорода групп -NH-, например цепей. Кроме того, хорошо известная полиуретановая пена может быть получена добавлением воды к смеси, потому что изоцианатные группы активно реагируют с водой с образованием газообразного диоксида углерода Hberate следующим образом . .. [Pg.471]
.. [Pg.471]
Образованные таким образом аминогруппы могут также активно взаимодействуют с изоцианатными группами, продолжая реакции удлинения цепи и сшивания.Следовательно, в системах одновременно протекают реакции вспенивания, полимеризации и сшивания, в результате которых образуются вспененные эластомеры (или пластмассы). [Pg.471]
Полимер Hquid затем смешивается с оксидами или пероксидами металлов в качестве наполнителей (технический углерод) и может подвергаться холодной вулканизации, то есть удлинению цепи и образованию поперечных связей в такой матрице. Он широко используется в качестве герметика и прокладочного материала для лужаек, автомобильных ветровых стекол и т. Д. [Pg.471]
В последние годы в предварительно катализированные смолы Hquid были добавлены патентованные катализаторы для усовершенствования.Таким образом, для производства эпоксидных смол такого типа требуется только добавление бисфенола А. Заявлено использование катализаторов для получения смол без разветвлений, которые могут возникнуть в обычных процессах плавления (10). Кроме того, использование катализаторов приводит к быстрым реакциям удлинения цепи из-за большого количества тепла, выделяемого при обработке. [Pg.367]
Кроме того, использование катализаторов приводит к быстрым реакциям удлинения цепи из-за большого количества тепла, выделяемого при обработке. [Pg.367]
Видно, что реакции (7.5b) и (7.5c), если они происходят более одного раза на молекулу углеводорода (радикал), приведут к удлинению цепи и, если в среднем более чем в два раза, к пересечению -ссылка.[Pg.135]
Путем введения точек разветвления в полимерные цепи, например, путем включения около 2% 1,2,3, -трихлорпропана в рецепт полимеризации, удлинение цепи может происходить более чем в двух направлениях, и это приводит к образование сетей за счет химических поперечных связей. Однако в этих конструкциях реакции обмена происходят при повышенных температурах и вызывают снятие напряжений в напряженных частях и, в свою очередь, высокую остаточную деформацию при сжатии. [Pg.553]
Эти полимеры представляют собой жидкости, которые можно отливать или использовать для пропитки и герметика.Кроме того, они могут быть вулканизированы с помощью различных агентов, якобы путем удлинения цепи. Однако следует отметить, что эти полимеры обычно содержат небольшие количества трихлорпропана в исходной смеси мономеров, так что трехмерное удлинение цепи приведет к сшиванию. [Pg.553]
Однако следует отметить, что эти полимеры обычно содержат небольшие количества трихлорпропана в исходной смеси мономеров, так что трехмерное удлинение цепи приведет к сшиванию. [Pg.553]
Такие реакции позволяют происходить удлинению цепи и / или поперечному сшиванию без удаления небольших молекул, таких как вода, т.е. они реагируют посредством реакции типа перегруппированной полимеризации.В результате эти материалы демонстрируют меньшую усадку при отверждении, чем многие другие типы термореактивных пластмасс. [Pg.744]
См. Также в источнике #XX — [ Стр. 321 , Стр.368 , Стр.382 ]
См. Также в источнике #XX — [ Стр.370 ]
См. Также в источнике №XX — [ Стр.10 , Стр.17 , Стр.18 , Стр.21 , Стр.86 , Стр.91 ]
См. Также в источнике №XX — [ Стр.140 , Стр.146 ]
См. Также в источнике №XX — [ Стр.15 ]
См.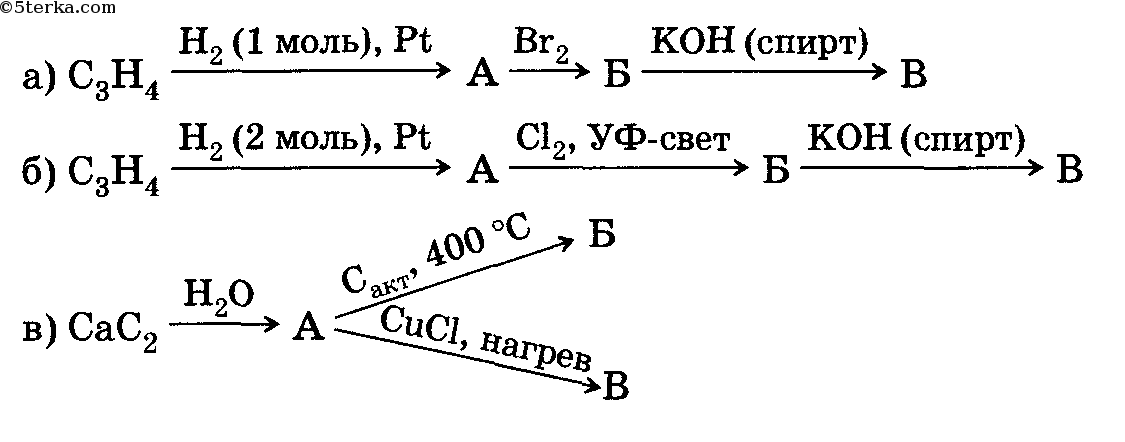 Также в источнике №XX — [ Стр.229 ]
Также в источнике №XX — [ Стр.229 ]
См. Также в источнике №XX — [ Стр.29 , Стр.30 , Стр.31 , Стр.32 , Стр.33 , Стр.34 , Стр.35 , Стр.36 ]
См. Также в источнике №XX — [ Стр.89 ]
См. Также в источнике №XX — [ Стр.428 ]
См. Также в источнике №XX — [ Стр.241 ]
См. Также в источнике №XX — [ Стр.121 ]
См. Также в источнике №XX — [ Стр.517 , Стр.1091 ]
См. Также в источнике №XX — [ Стр.257 , Стр.368 ]
См. Также в источнике №XX — [ Стр.140 , Стр.146 ]
См. Также в источнике №XX — [ Стр.206 ]
См. Также в источнике №XX — [ Стр.80 ]
См. Также в источнике №XX — [ Стр.21 , Стр.32 ]
См. Также в источнике №XX — [ Стр.32 , Стр.33 ]
См. Также в источнике №XX — [ Стр.190 , Стр.335 , Стр.344 ]
Также в источнике №XX — [ Стр.190 , Стр.335 , Стр.344 ]
См. Также в источнике №XX — [ Стр.18 ]
См. Также в источнике №XX — [ Стр.15 ]
См. Также в источнике №XX — [ Стр.370 ]
См. Также в источнике №XX — [ Стр.13 ]
См. Также в источнике №XX — [ Стр.175 , Стр.191 ]
См. Также в источнике №XX — [ Стр.72 ]
См. Также в источнике №XX — [ Стр.56 , Стр.58 , Стр.144 , Стр. 248 , Стр. 266 ]
ОРГАНИЧЕСКАЯ ХИМИЯ — Тематические тексты
Главная → ОРГАНИЧЕСКАЯ ХИМИЯ — Тематические текстыТекст 1
Органическая химия — это изучение соединений, содержащих углерод. Его называют «органическим», потому что раньше ученые считали, что эти соединения обнаружены только в живых существах или окаменелостях.Однако теперь в лабораториях и на фабриках можно искусственно производить огромное количество различных углеродсодержащих соединений для использования в промышленности. Например, лекарства, пластмассы и пестициды — все это синтетические органические вещества. Около 4. 5 миллионов из 5 миллионов известных сегодня соединений содержат углерод.
Например, лекарства, пластмассы и пестициды — все это синтетические органические вещества. Около 4. 5 миллионов из 5 миллионов известных сегодня соединений содержат углерод.
Текст 2
Углерод, важный неметаллический элемент, встречается в природе в трех формах, или аллотропах. Есть графит, алмаз и бакминстер-фуллерен. Углерод может образовывать миллионы различных соединений (комбинаций элементов).Это связано с тем, что атом углерода может связываться с четырьмя атомами (углерода или других элементов) и потому, что атомы углерода могут соединяться в цепочки и кольца разных размеров и форм.
Текст 3 (96)
Органические (углеродсодержащие) соединения можно разделить на две основные группы — алифатические и ароматические соединения — в зависимости от способа связи атомов углерода. В алифатических соединениях атомы углерода связаны в цепочки. Эти цепочки могут содержать от двух до многих тысяч атомов углерода, при этом к каждому атому углерода присоединены другие типы атомов. В ароматических соединениях атомы углерода объединены в кольцо.
В ароматических соединениях атомы углерода объединены в кольцо.
Текст 4 (94)
Кислоты — это вещества, выделяющие в воду ионы водорода. Щелочи — это вещества, выделяющие в воду ионы гидроксида (ионы, состоящие из водорода и кислорода). Если смешать кислоты и щелочи, два типа ионов нейтрализуют друг друга, и образуется новое вещество, называемое химической солью. Кислотность или щелочность вещества можно измерить с помощью шкалы pH (потенциала водорода), которая находится в диапазоне от 1 до 14.Все кислоты имеют pH ниже 7; чем сильнее кислота, тем ниже pH. Все щелочи имеют pH больше 7; чем сильнее щелочь, тем выше ph. Нейтральные вещества, такие как вода, не являются ни кислотными, ни щелочными. У них pH 7.
Текст 5 (93)
Земля дает нам все необходимое сырье. Проблема состоит в том, чтобы отделить вещества, которые мы хотим, от смесей, в которых они существуют естественным образом. Химики используют множество различных методов разделения в зависимости от типа смеси и свойств содержащихся в ней веществ. Иногда нам нужно разделить вещества и дома. Например, в кофеварке фильтр отделяет молотые кофейные зерна от жидкого кофе. Это называется фильтрацией.
Иногда нам нужно разделить вещества и дома. Например, в кофеварке фильтр отделяет молотые кофейные зерна от жидкого кофе. Это называется фильтрацией.
Текст 6 (47)
Разделение различных частей соединения с помощью электричества называется электролизом. Чтобы это работало, соединение должно быть либо в расплавленном виде, либо растворенным в воде, и оно должно содержать ионы. Две электропроводящие пластины (называемые электродами) помещаются в разделяемое соединение (называемое электролитом).Когда пластины подключаются к батарее, через соединение проходит электрический ток, который постепенно разделяется на две части. Это происходит потому, что отрицательный электрод (катод) имеет избыток отрицательно заряженных частиц, поэтому он притягивает положительные ионы соединения. Положительный электрод (анод) притягивает отрицательные ионы.
Текст 7 (97)
При превращении веществ в новые вещества происходит химическая реакция. Чтобы это произошло, связи между атомами и молекулами должны разорваться и переформироваться по-разному. Поскольку связи могут быть прочными, для начала реакции часто требуется энергия, обычно в виде тепла. Новые вещества (продукты) имеют свойства, отличные от свойств исходных веществ (реагентов). Химические реакции происходят не только в лабораториях; они случаются повсюду вокруг нас — например, когда ржавеют машины или когда готовится еда.
Поскольку связи могут быть прочными, для начала реакции часто требуется энергия, обычно в виде тепла. Новые вещества (продукты) имеют свойства, отличные от свойств исходных веществ (реагентов). Химические реакции происходят не только в лабораториях; они случаются повсюду вокруг нас — например, когда ржавеют машины или когда готовится еда.
Текст 8 (103)
Раствор образуется, когда одно вещество (обычно твердое) растворяется в другом (обычно в жидкости). Твердое вещество (называемое растворенным веществом) распадается на крошечные частицы и распространяется по жидкости (растворителю), так что твердое вещество больше не видно.Решения всегда ясны; если смесь мутная, это суспензия. Твердые частицы распространяются по жидкости, но частицы больше, чем у раствора. Если оставить суспензию отстояться, большая часть твердых частиц в конечном итоге утонет. Таким образом раствор не отделится.
Текст 9 (104)
При комнатной температуре вода представляет собой прозрачную жидкость без вкуса и запаха.

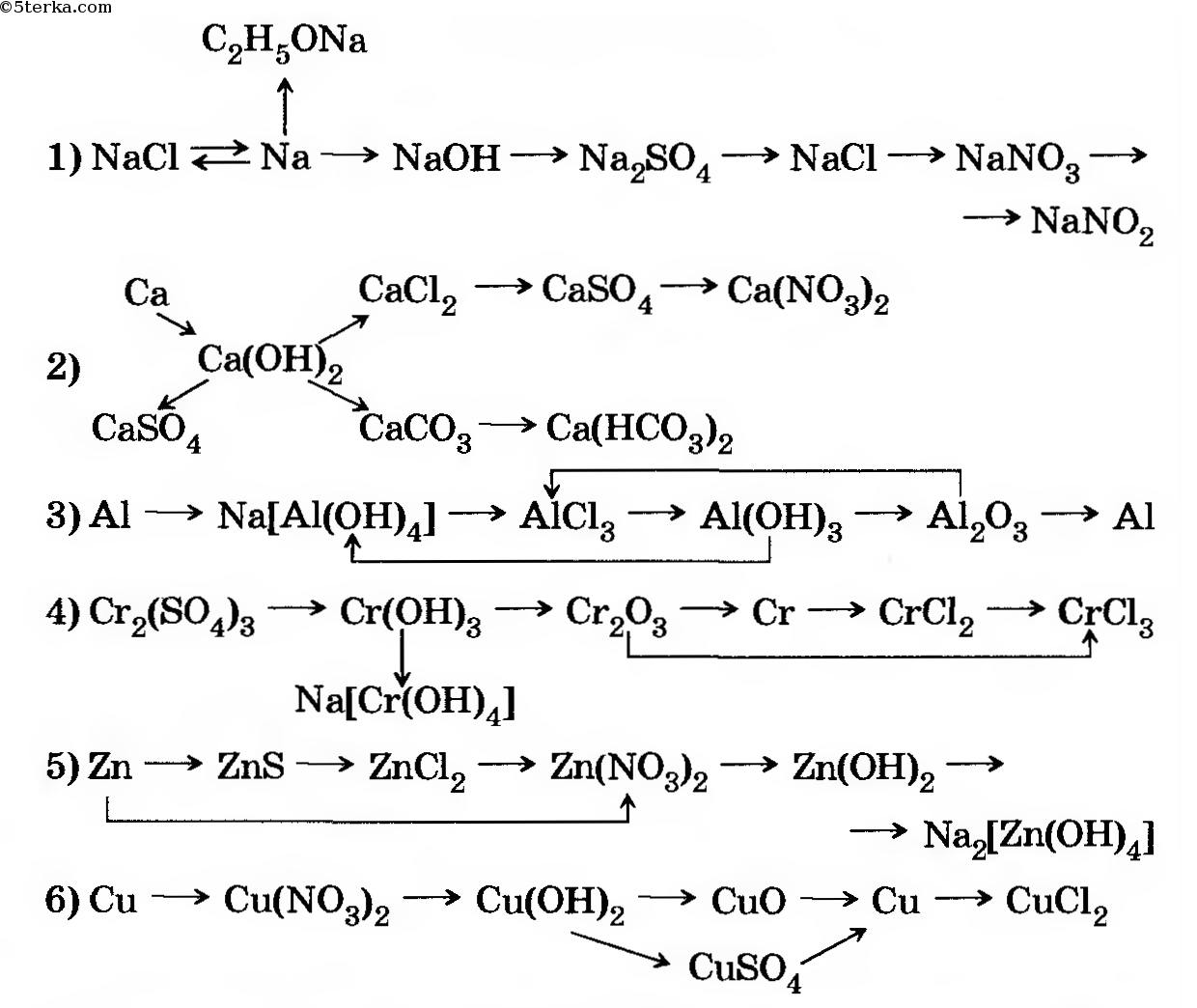 В5. Укажите число вторичных атомов углерода в основном органическом веществе Г в схеме превращений:
В5. Укажите число вторичных атомов углерода в основном органическом веществе Г в схеме превращений: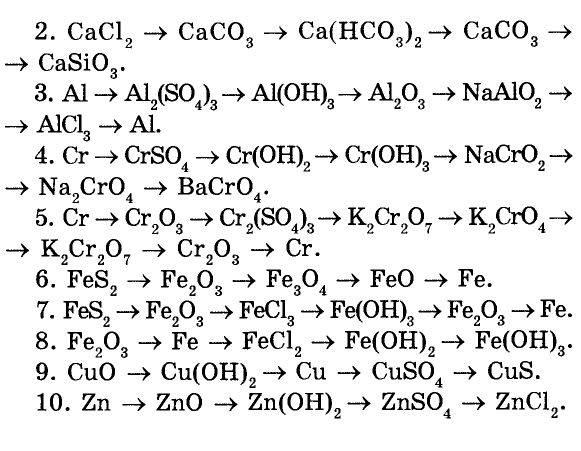
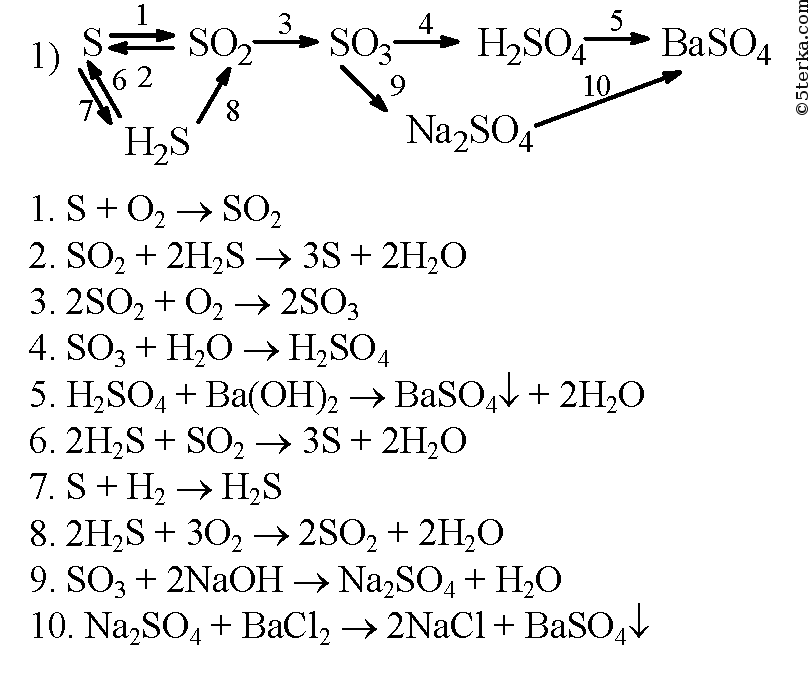 Все материалы сайта используются исключительно в образовательных целях.
Все материалы сайта используются исключительно в образовательных целях. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях. способы получения алканов): эл-з
способы получения алканов): эл-з