вопросы и ответы – Рамблер/класс
1070 вопросов
1097 ответов
Привет. Помогите ответить. Вопрос 6 § 24-29 Химия 9 класс Рудзитис, Фельдман
С помощью каких явлений, которые вы наблюдаете в жизни, можно доказать, что хлеб, молоко, мясо содержат углерод?
ГДЗХимия9 классРудзитис Г.Е.
Выберите молекулярную формулу бензола. вопрос 1 параграф 15 Химия 10 класс Рудзитис
Доброй ночи) Сижу над учебником(( кто подскажет? Из перечисленных формул веществ: С6Н6; С6Н14; С6Н12; С6Н10 выберите молекулярную (Подробнее…)
ГДЗШкола10 классХимияРудзитис Г.Е.
вопрос 15 параграф 19 Химия Рудзитис 10 класс
Всем привет! Расскажите : Какие основные продукты получают при коксовании каменного угля?
ГДЗ10 классХимияРудзитис Г.Е.
Задание на составление уравнений реакций по химии, 8 класс, параграф 30, 3 вопрос. Рудзитис и Фельдман
Рудзитис и Фельдман
Здравствуйте всем. Помогите с заданием, пожалуйста.
Составьте уравнения реакций, при помощи которых можно получить следующие (Подробнее…)
ГДЗХимия8 классРудзитис Г.Е.
Составьте уравнение реакций для получения водорода из кислот и соли. Химия, 8 класс, параграф 26, 5 вопрос. Рудзитис и Фельдман
Привет, всем кто шарит, помогите решить плиз.
Водород можно получить при взаимодействии алюминия с растворами соляной и (Подробнее…)
ГДЗХимия8 классРудзитис Г.Е.
Оксид меди. самостоятельные выводы вопрос 3 параграф 8 химия 10 класс Рудзитис
всем привет! кто разбирал уже вопрос? поделитесь ответом) Что образовалось из оксида меди(Н) и какие наблюдения это подтверждают? (Подробнее…)
ГДЗШкола10 классХимияРудзитис Г.Е.
Привет. Помогите выбрать правильный ответ. Вопрос 2 § 34-38 Химия 9 класс Рудзитис, Фельдман
Наиболее ярко выраженные металлические свойства проявляет простое вещество, образованное атомами, строение электронной оболочки (Подробнее. ..)
..)
ХимияРудзитис Г.Е.9 классГДЗ
Какие минералы, содержащие кальций, вам известны: Вопрос 3 § 40-41 Химия 9 класс Рудзитис, Фельдман
Какие минералы, содержащие кальций, вам известны и как их используют?
ХимияРудзитис Г.Е.9 классГДЗ
Помогите выбрать правильное Вопрос 2 § 24-29 Химия 9 класс Рудзитис, Фельдман
В ряду
С → S i → Gе → Sn → Рb
неметаллические свойства химических элементов и образованных ими простых веществ (Подробнее…)
ГДЗХимия9 классРудзитис Г.Е.
Химия Рудзитис 10 класс 1 вопрос параграф 16
Подскажите правильный ответ) мысли есть, но не уверенна! Какие главные природные ис-
точники углеводородов вам известны?
ГДЗХимияШколаРудзитис Г.Е.
Процесс образования целлюлозы из глюкозы. химия 10 класс вопрос 18 параграф 35
Привет! А давайте вместе ответим)) Нужно объяснить процесс образования молекул целлюлозы из молекул глюкозы.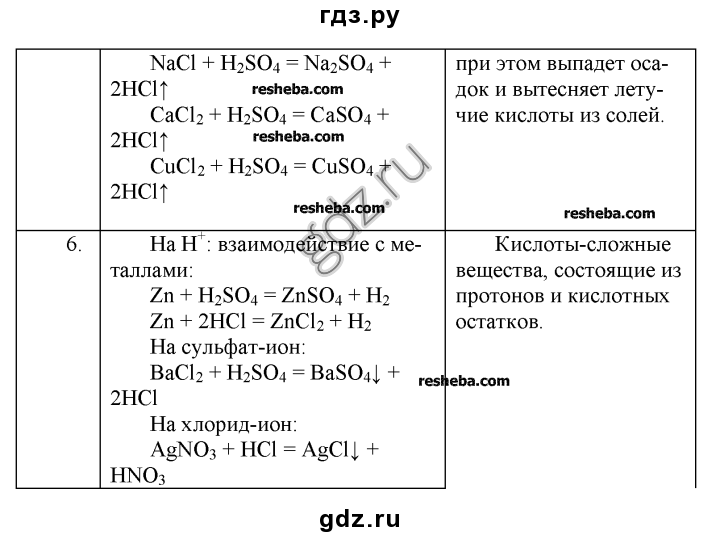 Чем отличаются по строению (Подробнее…)
Чем отличаются по строению (Подробнее…)
ГДЗШколаХимияРудзитис Г.Е.10 класс
Перегонка нефти. химия 10 класс Рудзитис/Фельдман вопрос 11 параграф 17
Всем привет! Помогите девушке в таком не женском вопросе))) Почему при прямой перегонке нефти удается получить не более 20% бензина? (Подробнее…)
ГДЗШкола10 классХимияРудзитис Г.Е.
Укажите черты сходства и различия в составе растворов. § 17-18, вопрос 12. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
Привет. у меня вечные проблемы с заданиями со звездочкой((
Укажите черты сходства и различия в составе растворов ортофосфата (Подробнее…)
ГДЗХимияРудзитис Г.Е.11 класс
Какие реакции называют реакциями полимеризации? химия Рудзитиса за 10 класс вопрос 15 параграф 10
всем привет, не могу разобраться в вопросе! Подскажите суть: какие реакции называют реакциями полимеризации? Напишите уравнение (Подробнее. ..)
..)
ГДЗШкола10 классРудзитис Г.Е.Химия
Вопрос для автомобилистов: 13 § 40-41 Химия 9 класс Рудзитис, Фельдман
Автомобилисты, отзовитесь!
Почему жесткую воду нельзя использовать для охлаждения двигателей машин? Ответ подтвердите уравнением (Подробнее…)
ХимияРудзитис Г.Е.9 классГДЗ
Вопрос 11 § 24-29 Химия 9 класс Рудзитис, Фельдман. Как получают оксид углерода(II)
Кто может помочь с ответом?
Как получают оксид углерода(II) в лаборатории и в промышленности? Напишите уравнения (Подробнее…)
ГДЗХимия9 классРудзитис Г.Е.
Вопрос 11 § 34-38 Химия 9 класс Рудзитис, Фельдман Какой из металлов химически более активен: литий или натрий?
Помогите с ответом
Какой из металлов химически более активен: литий или натрий? Чем можно объяснить, что в электрохимическом ряду (Подробнее…)
ХимияРудзитис Г.Е.9 классГДЗ
Сколько оксида алюминия в граммах можно получить? § 3-5, задача 3. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
Решали уже это, можете поделиться??
Сколько оксида алюминия в граммах можно получить из 100 г кристаллогидрата хлорида (Подробнее…)
ГДЗХимия11 классРудзитис Г.Е.
вопросы к §18-21 4. Охарактеризуйте физические и химические свойства кислорода. Рудзитис, Фельдман химия 8 класс
4. Охарактеризуйте физические и химические свойства кислорода. Составьте уравнения соответствующих химических реакций. Под формулами (Подробнее…)
ГДЗХимияРудзитис Г.Е.8 класс
Не могу конспекты составить Химия, 8 класс, параграф 32, 9 вопрос. Рудзитис и Фельдман
Привет, вот что нужно..
Составьте конспект ответа о свойствах соляной, серной и ортофосфор- ной кислот, придерживаясь обычного (Подробнее…)
ГДЗХимияРудзитис Г.Е.8 класс
похожие темы
Экскурсии
Мякишев Г. Я.
Я.
Досуг
Кузнецова Л. В.
Урок по теме «Окислительно-восстановительные реакции». 9-й класс
Учебник: Рудзитис Г.Е, Фельдман Ф.Г. Химия: учебник для 9 класса общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – 12-е изд. – М.: Просвещение, ОАО “Московские учебники”, 2009. – 191 с
Цель: сформировать представление учащихся о окислительно-восстановительных процессах, их механизме
Ожидаемые результаты
Предметные:
В ходе работы учащиеся
приобретут
- способность анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды
- умение устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, объяснять причины многообразия веществ, зависимость свойств веществ от их строения;
овладеют научным подходом к составлению уравнению окислительно-восстановительных реакций
Метапредметные
В ходе работы учащиеся смогут
- определять понятия, создавать обобщения, устанавливать аналогии, классифицировать, самостоятельно выбирать основания и критерии для классификации, устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение (индуктивное, дедуктивное и по аналогии) и делать выводы;
- создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач;
- применять экологическое мышление в познавательной, коммуникативной, социальной практике и профессиональной ориентации
Личностные
В ходе работы учащиеся приобретут
- основы экологической культуры соответствующей современному уровню экологического мышления, опыт экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях;
Элементы содержания, проверяемые заданиями КИМ ОГЭ
2. 1. Химическая реакция. Условия и признаки протекания
химических реакций. Химические уравнения.
1. Химическая реакция. Условия и признаки протекания
химических реакций. Химические уравнения.
2.2. Классификация химических реакций по изменению степеней окисления химических элементов
2.6. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Умения и виды деятельности, проверяемые КИМ ГИА
Знать/понимать
- химическую символику: формулы химических веществ, уравнения химических реакций
- важнейшие химические понятия:, степень окисления, окислитель и восстановитель, окисление и восстановление, основные типы реакций в неорганической химии
1.2.1. характерные признаки важнейших химических понятий
1.2.2. о существовании взаимосвязи между важнейшими химическими понятиями
Уметь
2.5.3. уравнения химических реакций.
Форма проведения: урок с использованием ИКТ,
включением парных, индивидуальных форм
организации учебно-познавательной деятельности
учащихся.
Продолжительность учебного занятия: 45 минут.
Использование педагогических технологий: метод эвристического обучения, обучение в сотрудничестве
Ход урока
I. Проблематизация, актуализация, мотивация – 10 мин.
Фронтальная беседа
- Что такое атомы и ионы.
- Чем они отличаются?
- Что такое электроны?
- Что такое степень окисления?
- Как рассчитывается степень окисления?
На доске учащимся предлагается расставить степени окисления в следующих веществах:
Сl2O7
, SO3, H3PO4, P2O5, Na2CO3, CuSO4, Cl2, HClO4, K2Cr2O7, Cr2(SO4)3, Al(NO3)3, CaSO4,NaMnO4, MnCl2, HNO3, N2, N2O, HNO2, H2S, Ca3(PO4)2
II. Изучение нового материала. Объяснение
учителя. 15 мин.
Изучение нового материала. Объяснение
учителя. 15 мин.
Основные понятия (слайд 2):
Окислительно-восстановительные реакции – это реакции, в которых изменяются степени окисления двух элементов, один из которых является восстановителем, а другой – окислителем
Восстановитель – это тот элемент, который в процессе реакции отдает электроны, и сам при этом окисляется
Окислитель
Правила составления окислительно-восстановительных уравнений (слайд 3)
1. Запишем уравнение реакции (слайд 4).
CuS+HNO3 —>Cu(NO3)2+ S + NO+H2O
2. Расставим степени окисления всех элементов
Cu+2S-2 +H+1N+5O-23 —> Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
3. Выделим элементы, которые поменяли степени
окисления
Выделим элементы, которые поменяли степени
окисления
Cu+2S-2 +H+1N+5O-23
—> Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
Видим, что в результате реакции поменяли степени окисления два элемента –
- сера (S) поменяла полностью (от – 2 до 0)
- aзот (N) поменял частично (от +5 до +2 поменял), часть осталась +5
4. Выпишем те элементы, которые поменяли степени окисления и покажем переход электронов (слайд 5.)
CuS-2 +HN+5O3 —> Cu(N+5O3)2+ S0 + N+2O+H2O
N+5 +3e N+2
S-2 — 2e S0
5. Составим электронный баланс, найдем
коэффициенты
Составим электронный баланс, найдем
коэффициенты
| Переход е– | Число переданных элементом электронов | Наименьшее общее кратное между числом переданных электронов | Коэффициенты (находятся делением наименьшего общего кратного на число переданных электронов) |
| 3 | 6 | 2 | |
| 2 | 3 |
6. Подставим в уравнение коэффициенты, найденные в балансе (коэффициенты ставятся у веществ, элементы в которых поменяли степень окисления) (слайд 6).
CuS-2 +HN+5O3 —> Cu(N +5O3)2+ 3S0 + 2N+2O+H2O
7. Доставим недостающие коэффициенты методом
уравнивания
Доставим недостающие коэффициенты методом
уравнивания
3CuS-2 +8HN+5O3 —> 3Cu(N+5O3)2+ 3S0 + 2N+2O+4H2O
8. По кислороду проверим правильность составления уравнения (слайд 7).
До реакции кислорода 24 атома = После реакции кислорода 24 атома
9. Выдели окислитель и восстановитель и процессы – окисления и восстановления
S-2 (в CuS) является восстановителем, т.к. отдает электроны
N+5 (в HNO3) является окислителем, т.к. отдает электроны
III. Закрепление изученного материала (25 мин)
Учащимся предлагается выполнить задание в парах.
Задание 1. 10 мин. (слайд 8)
Учащимся предлагается составить уравнение реакции в соответствии с алгоритмом.
Mg+H2SO4 —> MgSO4+ H2S + H2O
Проверка задания
4Mg0+5H2+1S+6O4-2 —> 4Mg+2S+6O4-2+ H2+1S-2 + 4H2+1O-2
| Переход е – | Число электронов | НОК | Коэффициенты |
| 2 | 8 | 4 | |
| 8 | 1 |
Задание 2. 15 мин. (слайды 9, 10)
15 мин. (слайды 9, 10)
Учащимся предлагается выполнить тест (в парах). Задания теста проверяются и разбираются на доске.
Вопрос № 1
Какое уравнение соответствует окислительно-восстановительной реакции?
- CaCO3= CaO + CO2
- BaCl2 + Na2SO4 = BaSO4 + 2NaCl
- Zn + H2SO4 = ZnSO4 + H2
- Na2CO3 + CO2 + H2O = 2NaHCO3
Вопрос № 2
В уравнении реакции 2Al + 3Br2=2AlBr3 коэффициент перед формулой восстановителя равен
- 2
- 3
- 1
- 4
Вопрос № 3
В уравнении реакции 5Сa + 12HNO3 = 5Ca(NO3)2 + N2 + 6H2O окислителем является
- Ca
- Ca(NO3)2
- HNO3
- H2O
Вопрос № 4
Какая из предложенных схем будет соответствовать восстановителю
- S0 > S-2
- S+4 —> S+6
- S-2 > S-2
- S+6 —> S+4
Вопрос № 5
В уравнении реакции 2SO2 + O2 —> 2 SO3 сера
- окисляется
- восстанавливается
- ни окисляется, ни восстанавливается
- и окисляется, и восстанавливается
Вопрос № 6
Какой элемент является восстановителем в уравнении реакции
2KClO3 —> 2KCl + 3O2
- калий
- хлор
- кислород
- водород
Вопрос № 7
Схема Br-1 —> Br+5 соответствует элементу
- окислителю
- восстановителю
- и окислителю, и восстановителю
Вопрос № 8
Соляная кислота является восстановителем в реакции
- PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O
- Zn + 2HCl = ZnCl2 + H2
- PbО + 2HCl = PbCl2 + H2О
- Na2CO3 + 2HCl = 2NaCl+ CO2 + H2O
Ответы на вопросы теста.
