Лабораторная работа по химии на тему «Алюминий и его соединения»
Лабораторная работа
Алюминий и его соединения.
Цель работы: экспериментальное изучение химических свойств алюминия, методов получения и свойств его соединений; формирование навыков выполнения химического эксперимента.
Опыт 1. Взаимодействие алюминия с кислородом.
Пластинку алюминия очистили наждачной бумагой.
На очищенную поверхность нанесли каплю раствора хлорида ртути (II). При этом в области нанесения наблюдалось частичное разрушение
структуры металла – в области нанесения образовалось пятно похожее на только
что застывший оловянный припой. При это в области нанесения стали
образовываться небольшие рыхлые кусочки белого цвета. Результатом взаимодействия
хлорида ртути с алюминиевой пластиной явилось выделение ртути, которая
растворила алюминий, в результате чего образовалась амальгама. На поверхности
амальгамы алюминия защитная оксидная пленка не образуется, поэтому алюминий в
виде амальгамы активно реагирует с кислородов с образованием оксида алюминия.
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
Hg+2 + 2e = Hg0 3; Hg+2 – окислитель;
Каплю раствора смыли с пластинки, ее поверхность протерли фильтровальной бумагой. Металл находился на воздухе. Наблюдалось образование белого порошка – оксида алюминия.
4Al + 3O2 = 2Al2O3
Al0 – 3e = Al+3 12 4; Al0 – восстановитель;
O02 + 4e = 2O-2 3; O02 – окислитель;
Опыт 2. Взаимодействие алюминия с щелочами.
В пробирку было налито 5 мл.
раствора гидроксида натрия. С помощью спиртовки раствор был нагрет до кипения,
после чего в него была опущена алюминиевая пластинка. Наблюдалось выделение
бесцветного газа, который был собран в пробирку, в горлышко которой была
внесена тлеющая лучинка.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
2H+ + 2e = H02 3; H+ — окислитель;
Образующийся гидроксокомплекс – тетрагидроксоалюминат натрия.
Опыт 3. Взаимодействие алюминия с водой.
В пробирку было помещено небольшое количество
опилок алюминия, к ним было прилито 5 мл дистиллированной воды. Видимые
признаки реакции при это отсутствовали. Объяснить это можно тем, что оксидная
пленка, наличествующая на поверхности металла, не реагирует с водой и, тем
самым, не допускает протекания реакции с водой алюминия. После этого опилки
прокипятили, добавив в пробирку 3 мл. раствора гидроксида натрия. Полученную
жидкость слили, опилки промыли водой для удаления щелочи и добавили их в воду.
2Al + 6H2O = 2Al(OH)3 + 3H2
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
2H+ + 2e = H02 3; H+ — окислитель;
Реакция взаимодействия алюминия с водой возможна лишь при отсутствии на поверхности металла оксидной пленки.
Опыт 4. Взаимодействие алюминия с кислотами.
А) В электрохимическом ряду напряжений металлов алюминий занимает место после щелочноземельных металлов, это говорит о его достаточной восстановительной активности.
Значение величины стандартного электродного потенциала алюминия:
ϕ0(Al+3 / Al(тв.)) = — 1,67 В.
Значение величины стандартного электродного потенциала водорода:
ϕ0(2H+ / H2) = 0,00 В.
Окислительно-восстановительная реакция, характеризующаяся окислением алюминия и восстановлением водорода, является принципиально возможной, так как
Э.Д.С. = ϕ(окислителя) – ϕ(восстановителя).
Э.Д.С. = 1,67 В.
Э.Д.С. > 0.
В этой связи взаимодействие алюминия с разбавленными растворами серной и соляной кислот, как частный случай определенной выше окислительно-восстановительной реакции, также возможно теоретически. При этом продуктами реакций будут являться соответвующие соли алюминия и водород.
Теоретические рассуждения были подтверждены в результате опыта.
В две пробирки было помещено немного опилок
алюминия, после чего, в одну из них было добавлено 2 мл. раствора соляной
кислоты, а в другую – 2 мл. раствора серной кислоты. При этом наблюдалось
выделения бесцветного газа, причем в случае реакции с раствором серной кислоты
образование газа происходило интенсивнее, чем в случае реакции с соляной
кислотой. При нагревании пробирок скорость обеих реакций возрастает. Выделяющийся газ был проверен тлеющей лучинкой, характерный хлопок указал на
то, что это водород.
Выделяющийся газ был проверен тлеющей лучинкой, характерный хлопок указал на
то, что это водород.
1. 2Al + 6HCl = 2AlCl3 + 3H2
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
2H+ + 2e = H02 3; H+ — окислитель;
2Al + 6HCl = 2AlCl 3 + 3H2
2Al + 6H+ + 6Cl— = 2Al3+ + 6Cl— + 3H2
2Al + 6H+ = 2Al3+ + 3H2
2. 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
2H+ + 2e = H02 3; H+ — окислитель;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 6H+ + 3SO2-4 = 2Al3+ + 3SO2-4 +3H2
2Al + 6H+ = 2Al3+ + 3H2
Б) В пробирку поместили немного опилок
алюминия и добавили 3 мл. концентрированной серной кислоты, пробирку нагрели на
пламени спиртовки. Наблюдалось помутнение жидкости в пробирке вследствие
выделения серы.
концентрированной серной кислоты, пробирку нагрели на
пламени спиртовки. Наблюдалось помутнение жидкости в пробирке вследствие
выделения серы.
2Al + 4H2SO4(конц.) = Al2(SO4)3 + S + 4H2O
Al0 – 3e = Al+3 6 2; Al0 – восстановитель;
S+6O2-4 + 8H+ + 6e = S0 + 4H2O 1; S+6 – окислитель;
2Al + SO2-4 + 8H+ = 2Al3+ + S0 + 4H2O
2Al + 4H2SO4 = Al2(SO4)3 + S + 4H2O
В) В пробирку поместили кусочек алюминия и прилили немного концентрированной азотной кислоты. При этом видимые признаки реакции отсутствовали. Пробирку нагрели, в результате чего наблюдалось выделение бурого газа – диоксида азота.
Al + 6HNO3(конц.
Al0 – 3e = Al+3 3 1; Al0 – восстановитель;
N+5O—3 + 2H+ + e = N+4O2 + H2O 3; N+5 – окислитель;
Al + 3NO—3 + 6H+ = Al3+ + 3NO2 + 3H2O
Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3H2O
Отсутствие реакции алюминия с азотной кислотой на холоде можно объяснить наличием на поверхности металла прочной оксидной пленки, устойчивой к действию концентрированной азотной кислоты при данных условиях (происходит пассивация алюминия).
Опыт 5. Получение и свойства гидроксида алюминия.
А) К раствору хлорида алюминия по каплям прилили раствор гидроксида натрия до образования белого студенистого осадка.
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
Al3+ + 3Cl— + 3Na+ + 3OH— = Al(OH)3 + 3Na+ + 3Cl—
Al3+ + 3OH— = Al(OH)3
Б) Полученный осадок разделили на две
пробирки. К одной части добавили раствор соляной кислоты. При этом наблюдалось
растворение осадка.
К одной части добавили раствор соляной кислоты. При этом наблюдалось
растворение осадка.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl— = Al3+ + 3Cl— + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
К другой части осадка добавили раствор гидроксида натрия. При этом наблюдалось растворение осадка.
Al(OH)3 + NaOH = Na[Al(OH)4]
Al(OH)3 + Na+
+ OH— = Na+ + [Al(OH)4]—Al(OH)3 + OH— =[Al(OH)4]—
Реагируя и с кислотами, и с основаниями, гидроксид алюминия проявляет свойства амфотерного соединения.
Согласно протолитической теории в насыщенном растворе гидроксида алюминия устанавливается равновесие, которое можно выразить схемой:
H+ + AlO—2 + H2O(1) Al(OH)3 Al3+ + 3OH—(2)
В случае гидроксида алюминия имеет место и
кислотный тип диссоциации (1), и основный тип диссоциации (2).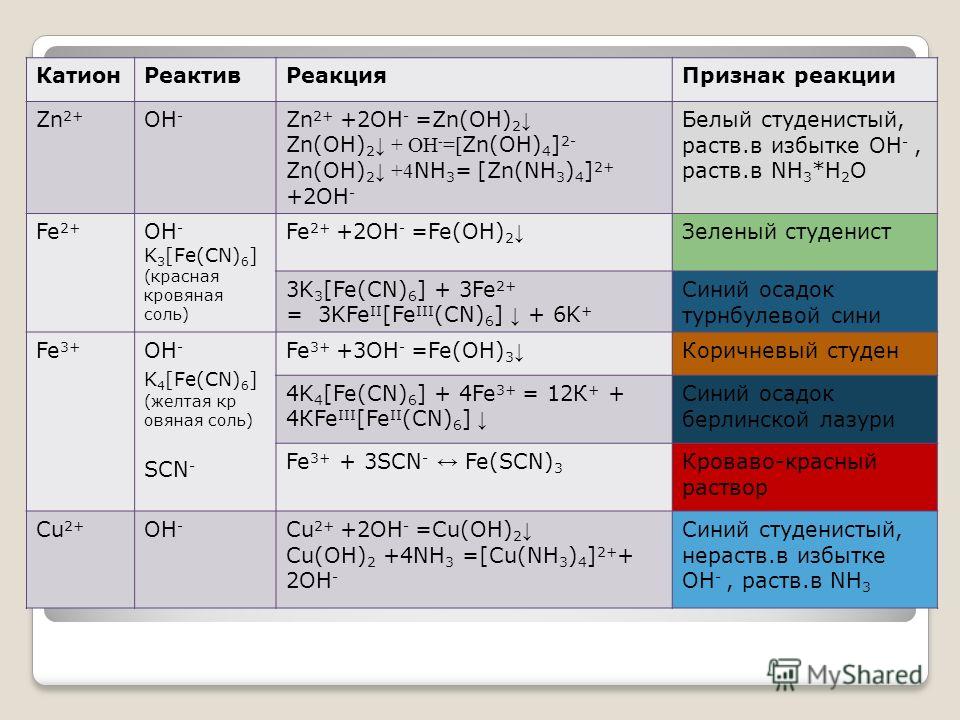 При добавлении
избытка щелочи равновесие будет смещаться в сторону диссоциации по кислотному
типу, при добавлении избытка кислоты – по основному типу.
При добавлении
избытка щелочи равновесие будет смещаться в сторону диссоциации по кислотному
типу, при добавлении избытка кислоты – по основному типу.
В) Получили осадок гидроксида алюминия, отфильтровали его. Промыли осадок на фильтре. Через фильтр с осадком пропустили слабоокрашенный раствор органического растворителя. При этом наблюдалось появление у фильтрата окраски. Явление обусловлено тем, что за счет развитой поверхности гидроксид алюминия обладает высокими адсорбционными свойствами, сорбирует на себя красящие вещества.
Опыт 6. Гидролиз солей алюминия.
В пробирку налили 2 мл. раствора хлорида алюминия и прилили несколько капель лакмуса. Раствор приобрел красный цвет. Можно сказать, что гидроксид алюминия является слабым основанием.
Первая ступень гидролиза
AlCl3 + HOH AlOHCl2 + HCl
Al3+ + 3Cl— + HOH AlOH2+ + 2Cl— + H+ + Cl—
Al3+ + HOH AlOH2+ + H+
Вторая ступень гидролиза
AlOHCl2 + H2O Al(OH)2Cl + HCl
AlOH2+ + 2Cl— + H2O Al(OH)2+ + Cl— + H+ + Cl—
AlOH2+ + H2O Al(OH)2+ + H+
Третья ступень гидролиза
Al(OH)2Cl + H2O Al(OH)3 + HCl
Al(OH)2+ + Cl— + H2O Al(OH)3 + H+ + Cl—
Al(OH)2+ + H2O Al(OH)3 + H+
Запись трех
ступеней гидролиза во многом условна, так как третья ступень практически не
протекает, вследствие накопления к этому времени в растворе ионов водорода с
смещения процесса в сторону исходных веществ.
Б) К раствору хлорида алюминия прилили раствор сульфида натрия. При этом наблюдалось выпадение осадка. Полученный осадок отфильтровали промыли водой и разделили на две части. К одной части прилили раствор соляной кислоты, а к другой – раствор гидроксида натрия. В обоих случаях наблюдалось растворение осадков. Осадок является гидроксидом алюминия – амфотерным соединением, реагирующим и кислотами, и с щелочами.
Взаимодействие хлорида алюминия с сульфидом натрия характеризуется протекание совместного гидролиза. Так как данные соли создают разную реакцию среды в растворе, они усиливают гидролиз друг друга, который в этом случае идет до конца.
2AlCl3 + 3Na2S + 6H2O = 6NaCl + 2Al(OH)3 + 3H2S
2Al3+ + 6Cl— + 6Na+ + 3S2- + 6H2O = 6Na+ + 6Cl— + 2Al(OH)3 + 3H2S
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S
Взаимодействие осадка (гидроксида алюминия) с соляной кислотой и гидроксидом натрия
1. Al(OH)3 +
3HCl = AlCl3 + 3H2O
Al(OH)3 +
3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl— = Al3+ + 3Cl— + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
2. Al(OH)3 + NaOH = Na[Al(OH)4]
Al(OH)3 + Na+ + OH— = Na+ + [Al(OH)4]—
Al(OH)3 + OH— =[Al(OH)4]—
Практическая работа по химии 9 класс «Амфотерные свойства алюминия»
Мастер класс конкурс «Учитель года 2017»
На мастер классе сегодня я покажу как использую проблемный метод для формирования метапредметных УУД (способы деятельности применимые в рамках образовательного процесса, так и при решение проблем в реальных жизненных ситуациях -самостоятельности, умения взаимодействовать друг с другом, развитие познавательного интереса, борьба с хемофобией)
Тема Практическая работа «Амфотерные свойства алюминия» 9 класс
Здравствуйте, сегодня у нас практическая работа « Амфотерных свойств алюминия».
У меня вопрос (показываю мельхиоровую ложку)
Можно ли очистить столовые приборы с помощью алюминия на собственной кухне?
Да, можно, если знать особые химические свойства алюминия — амфотерные.
И цель практической работы «на практике убедится в том, что алюминий обладает амфотерными свойствами».
Что такое амфотерность?.
Это способность веществ проявлять кислотные и основные свойства, то есть реагировать с кислотой и с основанием,
Вещества — алюминий, соляная кислота, гидроксид натрия, уксусная кислота, пищевая сода, вода, две мельхиоровые ложки.
Оборудование — две пробирки, штатив для пробирок, держатели для пробирок, источник нагревания, два стакана, тигельные щипцы, поддон с песком, большой лабораторный штатив.
Опыт 1.
Цель. Определить взаимодействует ли алюминий с кислотой.
Определить взаимодействует ли алюминий с кислотой.
В первой пробирке находится соляная кислота. Осторожно опускаем в нее
кусочек алюминия. В держатель вставляем пробирку. Закрепляем его у горлышка. Прогревам всю пробирку, затем только раствор. Горлышко пробирки направляем от себя и соседа. Что наблюдаем? Записываем наблюдение и уравнения реакции в таблицу.
№. | наблюдение | Уравнение реакции |
1. |
Промежуточный вывод. (ответ на цель опыта1).
Опыт 2
Цель. Взаимодействует ли алюминий с основанием?
Во второй пробирке находится основание – гидроксид натрия. Также опускаем кусочек алюминия. Нагреваем пробирку осторожно, держа горлышко в сторону от себя и соседа. Что наблюдаем? Заносим наблюдение и уравнение в таблицу.
Нагреваем пробирку осторожно, держа горлышко в сторону от себя и соседа. Что наблюдаем? Заносим наблюдение и уравнение в таблицу.
№ | Наблюдение | Уравнение реакции |
2. |
Промежуточный вывод (ответ на цель опыта 2)
Общий вывод (ответ на общую цель)
Мы выяснили, что алюминий может взаимодействовать и с кислотой и с основанием, то есть обладает амфотерностью.
Теперь Вам понятно «Почему современные хозяйки избавляются от столовых приборов и кастрюль из алюминия?»
Потому что, пища это агрессивная среда или щелочная или кислая, и при готовке в алюминиевой кастрюле происходит растворение алюминия, а это опасно.
Теперь дети должны ответить на проблемный вопрос «Можно ли очистить столовые приборы из мельхиора с помощью алюминия?
Обращаю внимание детей, что они наблюдают выделение газа, и этот газ водород. Вспоминаем, что водород прекрасный восстановитель, то есть он восстанавливает металлы из их оксидов.
А мельхиор представляет собой сплав меди и никеля. Медь окисляется и превращаются в черный оксид меди(II). Это и есть потемнение металла и водород прекрасно очищает черноту.
Какое взаимодействие выбрать с кислотой или с основанием. Теоретически можно пользоваться любой. Кислоту заменить на уксусную, а основание получить, растворив питьевую соду. Вспоминаем, что этот процесс называется гидролиз (дети с ним уже знакомы). Можно попросить написать уравнение реакции и убедится, в наличии щелочной среды.
Мы также растворяем соду и опускаем туда лакмусовую бумажку. Среда щелочная.
Опыт 3 (выполняет дети как отличники – это поощрение, так и неуспешные – для усиления интереса к предмету )
Кладем на дно стаканов алюминиевую фольгу. Рвем ее на кусочки почему?
Чтобы быстрее шла реакция.
В первый стакан заливаем раствор уксуса опускаем ложку и нагреваем 1-2 минуты держа стакан на большом штативе. Снимаем стакан, ставим на песок. Вынимаем ложку тигельными щипцами, промываем ее в воде. Осматриваем. Делаем выводы.
Затем во второй стакан заливаем раствор соды (1столовая ложка на стакан воды) Опускаем мельхиоровую ложку в стакан и подогреваю 1-2 минуты. вынимаем ложку, промываем, осматриваем.
Делаем выводы.
Итак Почему не использую первую реакцию? На кухне есть только уксусная кислота, а она по шкале «сила кислот» слабая. Реакция будет идти, но очень долго и будет сильно пахнуть уксусом. Поэтому все и я используем именно реакцию в щелочной среде.
А можно ли использовать реакцию с щелочью для очистки серебряных и золотых украшений?
Можно. Серебро темнее со временем, т.е. образуется оксид. В золоте 585 пробы всего 58,5% золота, остальное медь. Ее добавляют, что бы золотое изделие было более твердым. А медь имеет свойство окисляться. Особенно, щелочная среда важна если золотое украшение с жемчугом. Кислота разъедает его, так как жемчуг карбонат кальция.
Ответ на проблемный вопрос
————————————————————————————————-
Таким образом, обычная практическая работа показала, что многие процессы используемые в быту опираются на научные знания.
Ведь мы их учим видеть мир и красоту,
А красота всегда у счастья на посту,
И мудрости обычнейших вещей
Мы учим любознательных детей.
Приложение к практической работе
Инструкция к практической работе на мастер-классе
«Амфотерные свойства алюминия»
Цель «на практике убедится в том, что алюминий обладает амфотерными свойствами».
Вещества: алюминий, соляная кислота, гидроксид натрия, уксусная кислота, пищевая сода, вода, две мельхиоровые ложки, лакмусовая бумажка.
Оборудование: две пробирки, штатив для пробирок, держатели для пробирок, источник нагревания, два стакана, тигельные щипцы, поддон с песком, большой лабораторный штатив.
Техника безопасности
Приступать к работе только с разрешения учителя. Внимательно прочитать инструкцию. Работать аккуратно. В пробирки не заглядывать. Если испачкали пальцы, то сказать учителю и вымыть руки. Убрать длинные волосы под одежду. Зажигает источник нагревания только учитель. При нагревании направлять отверстие пробирки от себя и соседа.
Опыт 1.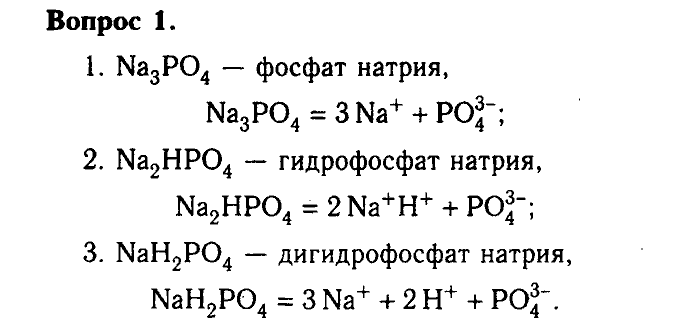
Цель. Определить взаимодействует ли алюминий с кислотой.
В первой пробирке находится соляная кислота. Осторожно опускаем в нее кусочек алюминия. В держатель вставляем пробирку. Закрепляем его у горлышка. Прогревам всю пробирку, затем только раствор. Горлышко пробирки направляем от себя и соседа. Что наблюдаем? Записываем наблюдение и уравнения реакции в таблицу.
№. | наблюдение | Уравнение реакции |
1. | …Al + …HCl = … … + … … |
Промежуточный вывод. (ответ на цель опыта1).
Опыт 2
Цель. Взаимодействует ли алюминий с основанием?
Во второй пробирке находится основание – гидроксид натрия. Также опускаем кусочек алюминия. Нагреваем пробирку осторожно, держа горлышко в сторону от себя и соседа. Что наблюдаем? Заносим наблюдение и уравнение в таблицу.
№ | Наблюдение | Уравнение реакции |
2. | 2Al +2NaOH + 6H2O=…Na[Al(OH)4] + … … |
Промежуточный вывод (ответ на цель опыта 2)
Общий вывод (ответ на общую цель)
Термитная реакция алюминия с оксидом железа(III) | Эксперимент
- Пять из пяти
На этой демонстрации учащиеся наблюдают за сильно экзотермической реакцией между алюминием и оксидом железа (III), в результате которой образуется расплавленное железо. Эта конкурентная реакция доказывает, что алюминий является более активным металлом, чем железо, а эксперимент также дает пример протекания окислительно-восстановительной реакции
Реакция бурная, но безопасная при точном соблюдении процедур. У некоторых учителей были несчастные случаи при выполнении процедуры на улице при сильном ветре; пороха взорвались в пламя, загорелись и вызвали ожоги рук и/или лица. Размещение демонстрации в вытяжном шкафу привело к повреждению шкафа.
У некоторых учителей были несчастные случаи при выполнении процедуры на улице при сильном ветре; пороха взорвались в пламя, загорелись и вызвали ожоги рук и/или лица. Размещение демонстрации в вытяжном шкафу привело к повреждению шкафа.
Описанный здесь метод выполняется на лабораторном столе и дает ограниченное количество дыма. НЕ выполняйте эту демонстрацию в вытяжном шкафу или на открытом воздухе. Он дает результат в течение нескольких секунд после включения, потому что вода очень быстро охлаждает утюг. Репетиция необходима, если этот эксперимент не проводился ранее.
Иногда сообщалось о взрывах при использовании подобных методов. Крайне важно не превышать указанные количества и чтобы демонстратор и студенты были защищены защитными экранами.
Скамейка должна быть очищена от горючих материалов и защищена листом ДВП или термостойкими матами. У демонстранта должно быть место, чтобы быстро отойти на безопасное расстояние.
Демонстрация занимает около 10 минут, если прибор настроен и твердые реагенты взвешены заранее.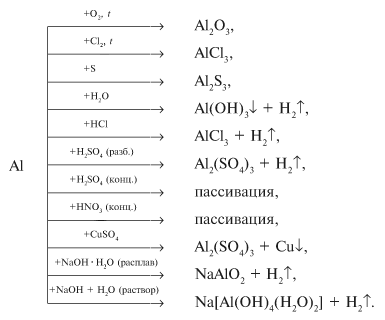
Оборудование
Аппаратура
- Защита глаз (примечание 2)
- Защитные экраны (примечание 3)
- Фильтровальная бумага, диаметр 11 см
- Треугольник из пластилина
- Штатив
- Стакан пластиковый или толстостенный стеклянный, 1 дм 3 (должен помещаться между ножками штатива)
- Песок (см. схему)
- Маты термостойкие
- Пластиковый магнитный извлекатель или маленький стержневой магнит
Химикаты
Для термитной смеси (примечание 6):
- Алюминиевая пудра (среднесортная) (ЛЕГКО ВОСПЛАМЕНЯЕМАЯ), 3 г
- Оксид железа(III), 9 г
Для воспламенителя (примечания 9 и 10):
- Бенгальский огонь, длина 16 см (продается для использования в помещении)
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Демонстрант и все наблюдатели должны носить защитные очки. Для демонстранта это должны быть защитные очки или лицевой щиток.
- Защитные экраны должны окружать аппарат. Помимо защиты глаз, учащиеся должны находиться на расстоянии более 4 м от места реакции.
- Демонстратор должен быть в лабораторном халате (в конце эксперимента может получиться грязно).
- Термитная реакция может привести к срабатыванию датчиков тепла или дыма; вы не можете провести эксперимент в лаборатории, оснащенной датчиками дыма.
- Важно, чтобы оксид железа(III), использованный в этой демонстрации, был абсолютно сухим. Должно хватить часа или около того в теплой духовке или нагревания в испарителе над пламенем Бунзена. Оксид должен полностью остыть перед смешиванием. Навески оксида железа(III) (9г максимум) и алюминиевый порошок (максимум 3 г) можно предварительно тщательно перемешать, несколько раз пересыпая смесь туда и обратно между двумя кусочками скрап-бумаги (никогда не перемешивая металлическим шпателем), а затем хранить для демонстрации в подходящем контейнере с маркировкой «термитная смесь».

- Алюминиевый порошок, Al(s), (ЛЕГКО ОГНЕОПАСНЫЙ) – см. карточку опасности CLEAPSS HC001A.
- Оксид железа(III), Fe 2 O 3 (s) – см. карточку опасности CLEAPSS HC055A.
- Воспламенитель для реакции — это домашний бенгальский огонь. Это должен быть один для использования в помещении, но не обязательно, чтобы его можно было держать в руке. Бенгальский огонь должен быть длиннее 10 см, чтобы было время отступить на безопасное расстояние. Длина бенгальских огней 16 см идеальна, а ручку следует отрезать ножницами по металлу или плоскогубцами. Бенгальские огни длиннее 16 см могут стать тяжелыми. Избегайте разрезания лишнего взрывчатого вещества; это приводит к тому, что он трескается, и он может опасно упасть, прежде чем демонстрант сможет удалиться на безопасное расстояние.
- В соответствии с Положением о взрывчатых веществах Великобритании от 2014 года, альтернативные воспламеняющие смеси (такие как порошок магния, нитрат бария и магниевая лента) на весах с общим весом более 0,5 г нельзя использовать в школах без сертификата о взрывчатых веществах, выданного полицией.
 Воспламенительные смеси в количестве 0,5 г или ниже приводят к менее надежному воспламенению, поэтому следует использовать бенгальский огонь.
Воспламенительные смеси в количестве 0,5 г или ниже приводят к менее надежному воспламенению, поэтому следует использовать бенгальский огонь.Демонстрант может захотеть (или его убедит публика) провести повторную демонстрацию. В этом случае важно держать второй комплект материалов подальше от первого демонстрационного участка.
- Утилизация: если бенгальский огонь не взорвет термитную смесь, утилизируйте непрореагировавшую смесь, вылив ее в разбавленную (2 М) соляную кислоту (1200 см 3 ) или серную кислоту (600 см 3 ) в стакане в вытяжной шкаф и оставить на ночь. Вы можете использовать 1 М разбавленную кислоту, но вам потребуется удвоить объем используемой кислоты. Отфильтруйте твердые частицы, а затем поместите их в неперерабатываемые отходы и разбавьте жидкость большим количеством воды.
Процедура
Источник: Королевское химическое общество
Оборудование, необходимое для демонстрации термитной реакции. №
№
- Сложите одну фильтровальную бумагу диаметром 11 см в форме конуса.
- В стакан емкостью 1 дм 3 насыпать песок до заполнения на две пятых (2/5), а затем добавить воды до заполнения на четыре пятых (4/5).
- Застелите часть стола несколькими термостойкими ковриками и поместите стакан в центр. Установите оборудование, как показано на схеме выше, и окружите его защитными экранами. Добавьте термитную смесь (см. примечание 6) в конус из фильтровальной бумаги, находящийся в треугольнике из глины. ВНИМАНИЕ: плотно вставьте конус из фильтровальной бумаги в треугольник, чтобы он не выскочил.
- Вставьте бенгальский огонь вертикально в термитную смесь. 3–4 см следует закопать под смесь, а остальную часть выдвинуть над конусом из фильтровальной бумаги. Зажгите бенгальский огонь пламенем горелки Бунзена и отойдите на безопасное расстояние за защитные экраны. Должна последовать очень бурная реакция с полетом искр вверх. Очень горячий остаток, содержащий расплавленное железо, провалится в воду.

- Когда реакция остановится, выньте стакан и слейте воду в раковину. Извлеките железо, образовавшееся с помощью магнита. Промойте утюг под проточной водой.
Учебные заметки
Реакция: оксид железа(III) + алюминий → оксид алюминия + железо.
Это показывает, что алюминий стоит выше железа в ряду реактивности.
В ходе реакции реакция сильно экзотермична, температура быстро достигает 2000 °C, что значительно превышает температуру плавления железа (1535 °C).
Практическое использование этой реакции для сварки железнодорожных путей и может быть упомянуто.
Термитная смесь стабильна до тех пор, пока не будет применен сильный нагрев, поэтому для инициирования реакции необходим бытовой бенгальский огонь. Некоторые из воспламеняющих смесей, которые обычно использовались в прошлом, теперь подпадают под действие Положений Великобритании о взрывчатых веществах 2014 года. Это означает, что можно использовать не более 0,5 г таких смесей, если у школы нет сертификата о взрывчатых веществах, выданного полицией.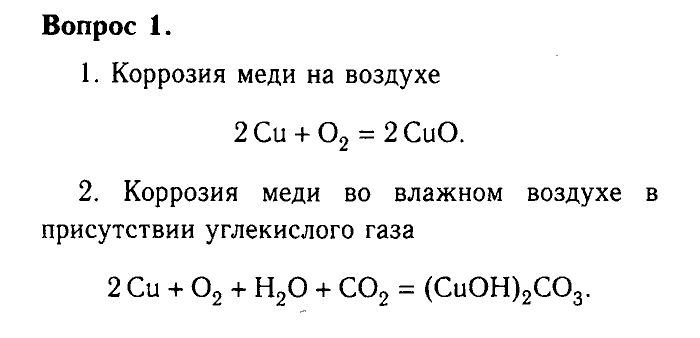 Метод бенгальских огней предпочтительнее, потому что воспламеняющие смеси в масштабе 0,5 г или меньше менее надежны.
Метод бенгальских огней предпочтительнее, потому что воспламеняющие смеси в масштабе 0,5 г или меньше менее надежны.
Если вы решите показать учащимся видеоролики о термитных реакциях из Интернета, старайтесь избегать тех, которые проводятся в масштабе и опасным образом.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
Этот ресурс был проверен и обновлен с учетом рекомендаций CLEAPSS в соответствии с Положениями Великобритании о взрывчатых веществах 2014 г.
- Пять из пяти
Производство и коммерциализация алюминия методом Холла — Национальный исторический памятник химии
- Вы здесь:
- СКУД
- Студенты и преподаватели
- Исследуйте химию
- Химические достопримечательности
- Процесс Холла: алюминий с помощью электрохимии
Посвящен 17 сентября 1997 г.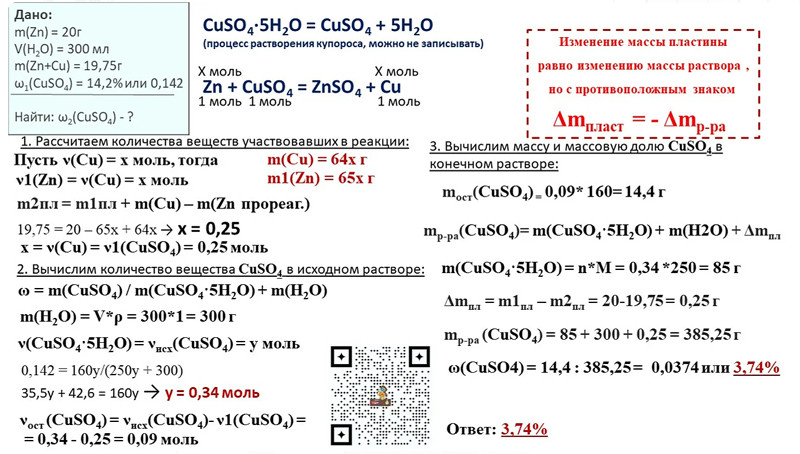 в Оберлин-колледже в Оберлине, штат Огайо, и 2 ноября 2001 г. в компании Alcoa Inc. в Питтсбурге, штат Пенсильвания.
в Оберлин-колледже в Оберлине, штат Огайо, и 2 ноября 2001 г. в компании Alcoa Inc. в Питтсбурге, штат Пенсильвания.
Памятный буклет: Электрохимическое производство металлического алюминия (PDF)
Памятный буклет: Коммерциализация алюминия (PDF)
23 февраля 1886 года в своей лаборатории в дровяном сарае в семейном доме на Ист-Колледж-стрит Чарльзу Мартину Холлу удалось получить металлический алюминий, пропуская электрический ток через раствор оксида алюминия в расплавленном криолите. Алюминий был полудрагоценным металлом до того, как Холл открыл этот экономичный метод выделения его из руды. Его изобретение, запущенное в промышленное производство компанией Pittsburgh Reduction Company (теперь известной как Alcoa), сделало этот легкий, блестящий и нержавеющий металл легко доступным и стало основой алюминиевой промышленности в Северной Америке.
Содержание
- История алюминия
- Алюминиевая команда: Чарльз Мартин Холл и Фрэнк Фаннинг Джуэтт
- Ранние эксперименты Холла с алюминием
- Электрохимическое производство алюминия: процесс Холла-Эру
- Коммерциализация процесса Холла: The Pittsburgh Reduction Company
- Как производятся алюминиевые изделия
- Дополнительное чтение
- Обозначение достопримечательности и благодарности
- Процитировать эту страницу
История алюминия
До 1886 года алюминий был полудрагоценным металлом, сравнимым по цене с серебром. Третий по распространенности элемент в земной коре — и самый распространенный металл — алюминий производится из бокситов, красновато-коричневой породы, обнаруженной в Ле-Бо, Франция, в 1821 году.
Третий по распространенности элемент в земной коре — и самый распространенный металл — алюминий производится из бокситов, красновато-коричневой породы, обнаруженной в Ле-Бо, Франция, в 1821 году.
гончарные изделия из глины, содержащей окись алюминия. Три тысячелетия спустя древние египтяне использовали другие соединения алюминия в лекарствах, красителях и косметике. Но поскольку алюминий имеет высокое сродство к кислороду и никогда не встречается в природе в металлической форме, его оказалось трудно изолировать. В 1808 году сэр Хамфри Дэви дал название алюминию. В 1825 году датский химик Ганс Христиан Эрстед, наконец, получил образец, хотя и очень нечистый, с использованием тепла и смеси на основе калия. В течение следующих 20 лет немецкий химик Фридрих Вёлер усовершенствовал этот процесс, используя металлический калий.
Хотя этот элемент исследовался многими европейскими учеными, единственным способом получения металла был сложный и трудный процесс, который завершился реакцией металлического натрия с хлоридом алюминия.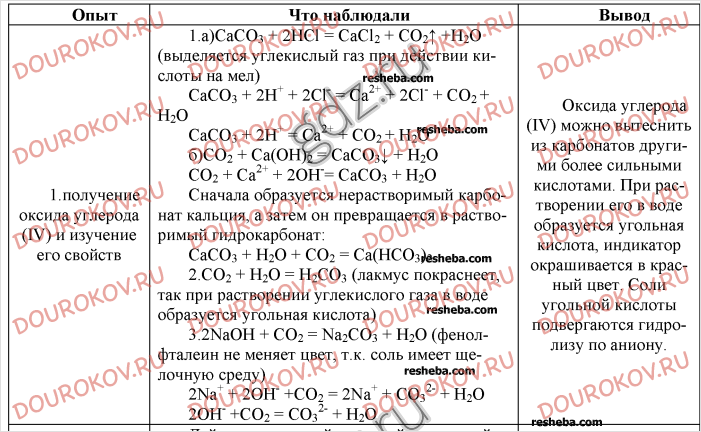 Когда в 1884 году был завершен монумент Вашингтона, шестифунтовая пирамида из этого дорогого алюминия была помещена в качестве украшения на самый верх. Он также служил наконечником системы громоотводов, практического применения высокой электропроводности и коррозионной стойкости этого замечательного металла. Однако для извлечения алюминия из содержащихся в изобилии минералов требовались экономичные методы, которые, по наблюдениям Анри Сент-Клера Девиля, великого французского химика, «можно было найти в каждом глиняном банке».
Когда в 1884 году был завершен монумент Вашингтона, шестифунтовая пирамида из этого дорогого алюминия была помещена в качестве украшения на самый верх. Он также служил наконечником системы громоотводов, практического применения высокой электропроводности и коррозионной стойкости этого замечательного металла. Однако для извлечения алюминия из содержащихся в изобилии минералов требовались экономичные методы, которые, по наблюдениям Анри Сент-Клера Девиля, великого французского химика, «можно было найти в каждом глиняном банке».
Наверх
Алюминий Команда: Чарльз Мартин Холл и Фрэнк Фэннинг Джуэтт
Франк Фаннинг Джуэтт получил высшее образование и сделал несколько дипломных работ по химии и минералогии в Йельском университете. С 1873 по 1875 год он продолжал изучать химию в Геттингенском университете в Германии. Там он хорошо познакомился с современной европейской наукой и заинтересовался перспективами алюминия. Он встретил профессора Фридриха Вёлера, который выделил алюминий как металл в 1827 году по инициативе Х. К. Эрстеда в 1825 году. Прежде чем Джуэтт вернулся в Америку в 1875 году, чтобы стать личным помощником Оливера Уолкотта Гиббса в Гарвардском университете, он получил образец металлического алюминия. В 1876 году президент Йельского университета назначил его преподавателем естественных наук в Императорском университете в Токио, где он был одним из небольшой группы представителей Запада. В 1880 году в возрасте 36 лет Джуэтт стал профессором химии и минералогии в Оберлин-колледже.
Он встретил профессора Фридриха Вёлера, который выделил алюминий как металл в 1827 году по инициативе Х. К. Эрстеда в 1825 году. Прежде чем Джуэтт вернулся в Америку в 1875 году, чтобы стать личным помощником Оливера Уолкотта Гиббса в Гарвардском университете, он получил образец металлического алюминия. В 1876 году президент Йельского университета назначил его преподавателем естественных наук в Императорском университете в Токио, где он был одним из небольшой группы представителей Запада. В 1880 году в возрасте 36 лет Джуэтт стал профессором химии и минералогии в Оберлин-колледже.
Чарльз Мартин Холл впервые изучил химию серьезным юношей в городе Оберлин, прочитав учебник 1840-х годов, который он нашел на полках кабинета своего отца-министра. Он также проводил эксперименты дома, что положило начало увлечению экспериментальной работой на всю жизнь. Заядлый читатель во многих областях, он жадно следил за популярной литературой по изобретениям в журнале Scientific American .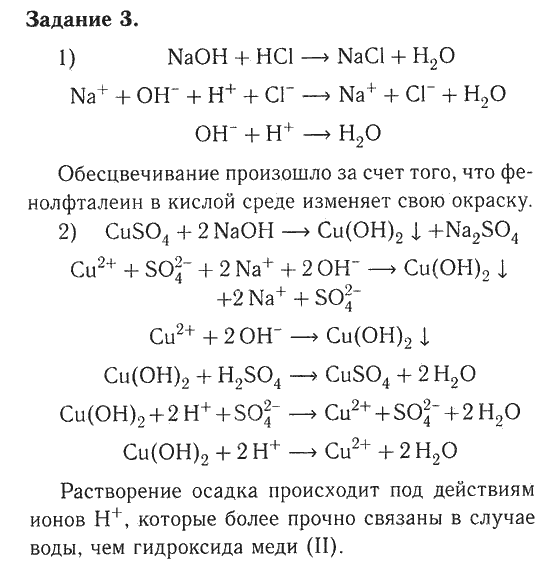 Холл уже был заинтригован романтикой алюминия, когда осенью 1880 года, будучи 16-летним первокурсником Оберлин-колледжа, он пошел в химическую лабораторию, чтобы получить некоторые предметы для своей домашней лаборатории. Там он встретил профессора Джуэтта.
Холл уже был заинтригован романтикой алюминия, когда осенью 1880 года, будучи 16-летним первокурсником Оберлин-колледжа, он пошел в химическую лабораторию, чтобы получить некоторые предметы для своей домашней лаборатории. Там он встретил профессора Джуэтта.
Их сотрудничество в течение следующих пяти с половиной лет привело к открытию практического процесса получения алюминия из руды с помощью электрического тока. В течение еще трех лет Холл производил чистый алюминий в промышленных масштабах. Алюминий, диковинка, стал широко используемым материалом, и молодой человек достиг своей цели, сделав финансово успешную карьеру в области технологий и промышленности.
Вернуться к началу
Ранние эксперименты Холла с алюминием
Холл прошел свой первый формальный курс химии на первом курсе колледжа. Ранее, под руководством и поддержкой Джуэтта, он работал над химией алюминия и другими проектами в лаборатории Джуэтта и в своей собственной домашней лаборатории. Он прослушал лекцию Джеветта по химии алюминия, показал свой образец металла и предсказал удачу, ожидающую человека, который изобретет экономичный метод получения алюминия из его оксидной руды. Однокурснику Холл заявил, что намеревался стать этим человеком.
Однокурснику Холл заявил, что намеревался стать этим человеком.
После многих неудачных экспериментов с химическими методами восстановления алюминиевых руд до металла Джуэтт и Холл обратились к электрическому току, чтобы обеспечить необходимые мощные условия восстановления. Чтобы получить электричество в студенческом городке в 1880-х годах, нужно было собирать батареи. Холл и Джуэтт использовали ячейки Бунзен-Гроува, которые состоят из большого электрода из металлического цинка в растворе серной кислоты, который окружает пористую керамическую чашку, содержащую угольный стержень, погруженный в концентрированную азотную кислоту. Сборка достаточного количества этих элементов, чтобы обеспечить достаточное количество электроэнергии для производства алюминия, была большой задачей. В конечном лабораторном процессе для получения одной унции алюминия использовалось около одного фунта цинковых электродов, отлитых вручную Холлом.
Холл провел первые эксперименты с электричеством в лаборатории Джуэтта, когда он учился на последнем курсе в 1884/85 году. Он приготовил фтористый алюминий из опасной плавиковой кислоты в специальных свинцовых сосудах и пропускал ток через растворенный в воде фтористый алюминий. К сожалению, эта система производила только нежелательный газообразный водород и гидроксид алюминия на отрицательном электроде.
Он приготовил фтористый алюминий из опасной плавиковой кислоты в специальных свинцовых сосудах и пропускал ток через растворенный в воде фтористый алюминий. К сожалению, эта система производила только нежелательный газообразный водород и гидроксид алюминия на отрицательном электроде.
После выпуска Холл продолжил работу в дровяном сарае за домом своей семьи. Он экспериментировал с расплавленными солями фтора в качестве безводных растворителей. Он знал, что фторидные соли имеют то преимущество перед изученными ранее хлоридными солями, что не поглощают воду из воздуха. Холл знал об успехе Ричарда Гритцеля в получении металлического магния с помощью электрического тока в расплаве хлорида магния, как сообщалось в Scientific American в 1885 году.
Для работы с расплавленными фторидными солями ему нужна была печь, способная производить и поддерживать более высокие температуры, чем угольная печь в его более ранних экспериментах. Для этой цели Холл приспособил бывшую в употреблении бензиновую печь для обогрева внутренней части железной трубы, облицованной глиной. Несмотря на более высокую температуру этой печи, он не мог плавить фториды кальция, алюминия или магния. Фториды калия и натрия плавились, но не растворяли полезные количества оксида алюминия.
Несмотря на более высокую температуру этой печи, он не мог плавить фториды кальция, алюминия или магния. Фториды калия и натрия плавились, но не растворяли полезные количества оксида алюминия.
Холл перешел к экспериментам с криолитом (фторид натрия-алюминия) в качестве растворителя. Он сделал криолит, обнаружил, что он плавится в его печи, и показал, что он растворяет более 25% по весу оксида алюминия. Температура плавления криолита составляет 1000°С, что является исключительно высокой температурой для электрохимии. Он провел этот решающий эксперимент в начале февраля 1886 года и повторил его на следующий день, чтобы его сестра Джулия стала свидетельницей.
Шесть дней спустя Холл впервые попытался получить металлический алюминий, пропуская электрический ток через раствор оксида алюминия в расплавленном криолите. Он погрузил графитовые стержневые электроды в огненный раствор в глиняном тигле и пустил на некоторое время ток. В присутствии Юлии он вылил расплав на сковороду и разломал остывшую массу, но алюминия не обнаружил.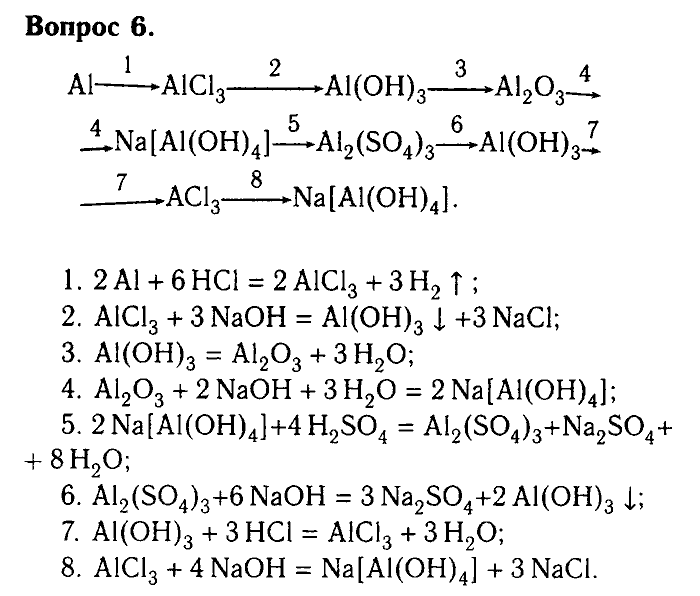 На отрицательном электроде был только сероватый налет, который не имел блестящего металлического вида алюминия. Повторив этот процесс несколько раз, Холл понял, что это отложение, вероятно, представляет собой кремний из силикатов, растворенных в глиняном тигле. Если бы он не был знаком с внешним видом металлического алюминия, увидев образец Джеветта, Холл мог бы медленнее интерпретировать этот ложный результат.
На отрицательном электроде был только сероватый налет, который не имел блестящего металлического вида алюминия. Повторив этот процесс несколько раз, Холл понял, что это отложение, вероятно, представляет собой кремний из силикатов, растворенных в глиняном тигле. Если бы он не был знаком с внешним видом металлического алюминия, увидев образец Джеветта, Холл мог бы медленнее интерпретировать этот ложный результат.
Вернуться к началу
Электрохимическое производство алюминия:
Процесс Холла-Эру
Из большого графитового стержня Холл сделал графитовый тигель, чтобы выровнять глиняный тигель. Он также понизил температуру плавления криолитового раствора, добавив фторид алюминия. Первый эксперимент с этой новой системой был проведен 23 февраля 1886 года. Электрический ток шел несколько часов, и он еще раз охладил расплав и вскрыл его в присутствии трех своих сестер и отца. На этот раз они нашли несколько маленьких серебристых шариков, которые он проверил с помощью соляной кислоты.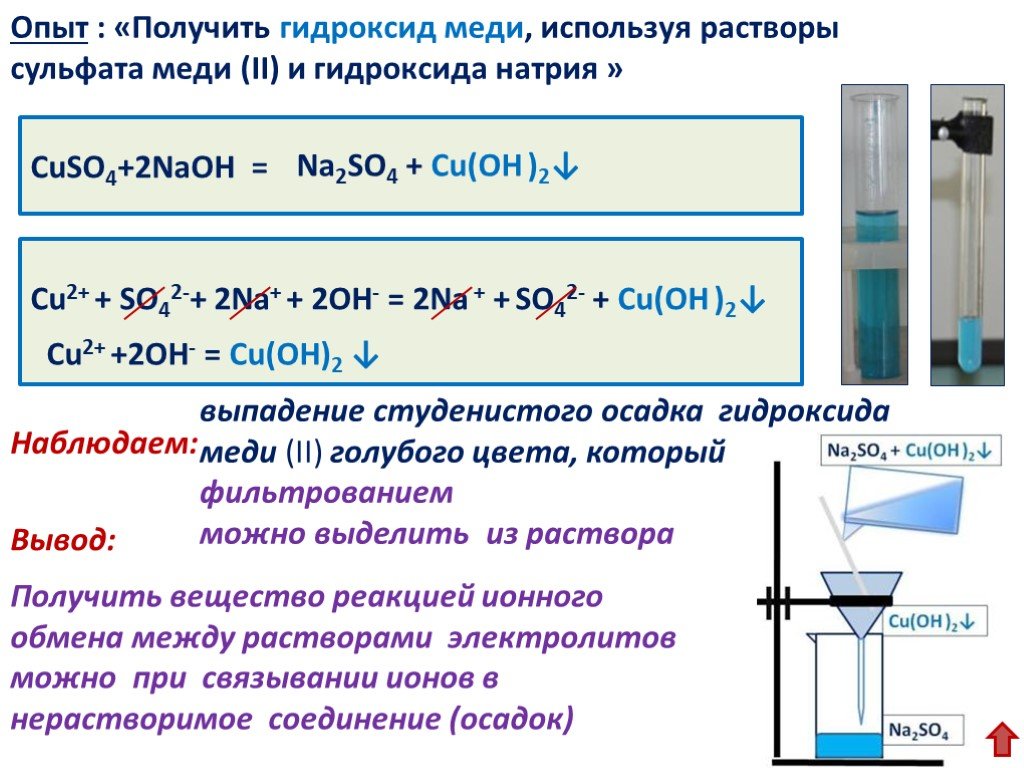 Он отнес их Джуэтту, который подтвердил, что они алюминиевые.
Он отнес их Джуэтту, который подтвердил, что они алюминиевые.
9 июля 1886 года Холл подал заявку на патент. Тем временем Пол Л.Т. 23 апреля 1886 г. Эру получил французский патент на аналогичный процесс на основе криолита и оксида алюминия; в мае он также подал заявку на патент США. Это означало, что Холл должен был доказать, что он изготовил алюминий новым методом до даты французского патента, чтобы получить патентную защиту в Соединенных Штатах. Свидетельства его семьи и Джуэтта, в том числе два письма с почтовым штемпелем его брату Джорджу, помогли установить приоритет открытия Холла в Соединенных Штатах в постановлении, вынесенном патентным экспертом. Патентные права Холла также были подтверждены в двух последующих судебных спорах с Cowles Electric Smelting Co. из Кливленда, штат Огайо, которая производила медно-алюминиевый сплав.
Как могло случиться, что Поль Эру в Париже, Франция, и Чарльз Холл в Оберлине, Огайо, сделали почти одновременное, но независимое открытие одного и того же процесса рафинирования алюминия? По-видимому, этому способствовало множество факторов. Поиск экономичного процесса рафинирования алюминия был широко признан главной целью изобретателей. Электрохимия начала развиваться как прикладная наука. Крупные генераторы электроэнергии разрабатывались в коммерческих целях. Возник интерес к химии фторсодержащих веществ. Хотя Холл работал в небольшом студенческом городке США, у него был доступ к последним достижениям науки под руководством Джуэтта. Близость к Кливленду и его развивающимся техническим отраслям, таким как Standard Oil для бензина, Brush Electric для больших графитовых стержней и Grasselli для химикатов, также сыграла свою роль.
Поиск экономичного процесса рафинирования алюминия был широко признан главной целью изобретателей. Электрохимия начала развиваться как прикладная наука. Крупные генераторы электроэнергии разрабатывались в коммерческих целях. Возник интерес к химии фторсодержащих веществ. Хотя Холл работал в небольшом студенческом городке США, у него был доступ к последним достижениям науки под руководством Джуэтта. Близость к Кливленду и его развивающимся техническим отраслям, таким как Standard Oil для бензина, Brush Electric для больших графитовых стержней и Grasselli для химикатов, также сыграла свою роль.
Холл, как и Эру, был находчивым экспериментатором, который не только изобрел метод получения металлического алюминия, но и изготовил большую часть своего оборудования и приготовил многие из своих химикатов. Как и Эру, Холл страстно желал стать успешным изобретателем и промышленником. В знак признания вклада этих двух молодых людей в развитие этого электрохимического процесса по обе стороны Атлантики он теперь называется процессом Холла-Эру.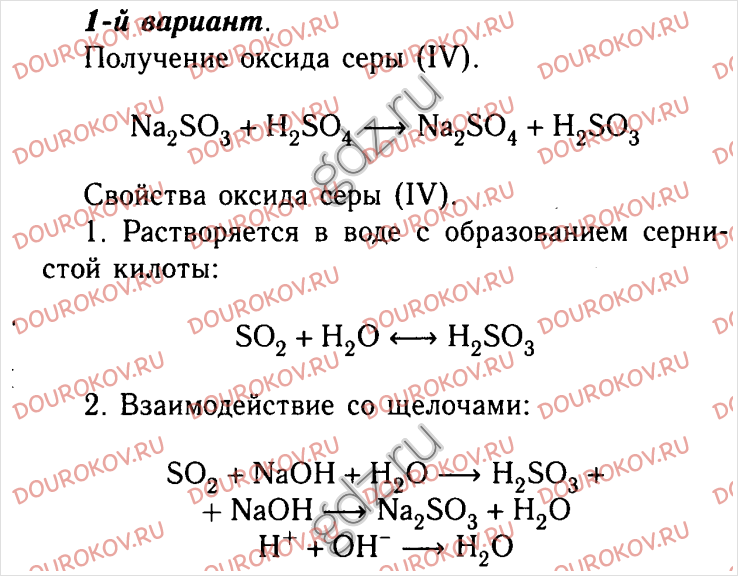
Вернуться к началу
Коммерциализация процесса Холла: The Pittsburgh Reduction Company
Летом 1888 года группа из шести промышленников во главе с Альфредом Э. Хантом, выпускником Массачусетского технологического института, занимавшимся металлургическим бизнесом в Питтсбурге, оказала финансовую поддержку, которая позволила Холлу основать Pittsburgh Reduction Company в 1888 году. До этого года Отсутствовали, Холл и его первый сотрудник Артур Вининг Дэвис произвели первый коммерческий алюминий на экспериментальном заводе на Смоллман-стрит в Питтсбурге.
Вскоре процесс был упрощен за счет использования внутреннего нагрева, вызванного электрическим сопротивлением в реакционных емкостях, для достижения и поддержания расплавленного состояния. Электричество обеспечивали паровые динамо-машины Westinghouse. Дальнейшее снижение затрат произошло позже за счет использования гидроэлектроэнергии. Когда Холл усовершенствовал свой процесс, цена алюминиевых слитков упала с 4,86 доллара за фунт в 1888 году до 78 центов за фунт в 189 году. 3. Поскольку производители не хотели использовать незнакомый металл, компания разработала прототипы продуктов, таких как первый чайник из литого алюминия, для использования в качестве инструментов продаж.
3. Поскольку производители не хотели использовать незнакомый металл, компания разработала прототипы продуктов, таких как первый чайник из литого алюминия, для использования в качестве инструментов продаж.
Компания Pittsburgh Reduction Company стала Американской алюминиевой компанией (Alcoa) в 1907 году, как раз перед тем, как истекли патентные права. Сначала алюминий был решением для решения проблемы, но постепенно бизнес рос, поскольку производители осознали преимущества этого легкого, но прочного металла, в самых разных областях применения, от самолетов и других видов транспорта до линий электропередач для передачи электроэнергии на большие расстояния, строительства. , хранения продуктов питания и украшения. В середине 19В 30-х годах промышленный дизайнер Генри Дрейфус предсказал, что «алюминий будет играть большую и значительную роль» в «величайший период редизайна, который когда-либо знал мир». К концу 1930-х фунт алюминия стоил всего 20 центов; его использование насчитывало более 2000.
В 1911 году Холл стал пятым обладателем медали Перкина, которая была присуждена за «ценную работу в области прикладной химии» Обществом химической промышленности (Американская секция) при поддержке Электрохимического общества и Американского химического общества. Поль Эру присутствовал на церемонии награждения в Нью-Йорке и внес изящный вклад в выступления. Холл ответил с такой же теплотой.
После смерти Холла в конце 1914 года его акции Alcoa составили значительное состояние, большую часть которого он завещал учебным заведениям в этой стране и за рубежом.
Вернуться к началу
Как производятся алюминиевые изделия
Этап 1: Добыча бокситов
Четыре тонны бокситов дают одну тонну алюминия — этого достаточно для изготовления банок для более чем 60 000 безалкогольных напитков. Бокситы образуются в течение миллионов лет в результате химического выветривания горных пород, содержащих силикаты алюминия, с образованием руды, богатой оксидом алюминия. Сегодня бокситы добываются в основном в Африке, Австралии и Карибском бассейне.
Сегодня бокситы добываются в основном в Африке, Австралии и Карибском бассейне.
Этап 2: Рафинирование глинозема
Руда измельчается и смешивается с известью и едким натром, затем нагревается в резервуарах высокого давления. Оксид алюминия растворяют едким натром, осаждают из раствора, промывают и нагревают для удаления воды. Полученный оксид алюминия представляет собой белый порошок, напоминающий сахар.
Стадия 3: Плавка в алюминий
В процессе электролитического восстановления, известном как плавка, глинозем растворяется в криолитовой ванне внутри футерованных углеродом ячеек или ванн. Мощный электрический ток, проходящий через ванну, отделяет металлический алюминий от химического раствора, и металл сифонируется. Плавка — это промышленная версия процесса, разработанного в 1886 году Чарльзом Мартином Холлом в его лаборатории дровяного сарая.
Этап 4: Изготовление алюминиевых изделий
Алюминий поступает из плавильного котла в печь для смешивания с другими металлами. Эти сплавы обладают особыми свойствами для конкретных целей. Флюс очищает металл, который затем заливают в формы или отливают в слитки. Изготовление может включать ковку, литье, прокатку, волочение или экструзию для создания различных готовых изделий от автомобилей до самолетов.
Эти сплавы обладают особыми свойствами для конкретных целей. Флюс очищает металл, который затем заливают в формы или отливают в слитки. Изготовление может включать ковку, литье, прокатку, волочение или экструзию для создания различных готовых изделий от автомобилей до самолетов.
Этап 5: Переработка алюминия
Переработка продлевает жизненный цикл изделий из алюминия, самого ценного материала в потоке отходов. После использования алюминиевые изделия могут быть возвращены на перерабатывающие предприятия для переплавки и изготовления новых алюминиевых изделий.
Наверх
Факты об алюминии
Каждую минуту каждого дня перерабатывается в среднем более 123 000 алюминиевых банок.
С 1972 года было переработано около 660 с лишним миллиардов банок из-под напитков — если поставить их встык, они могут растянуться до Луны почти 300 раз.
Средний срок службы алюминиевой банки для напитков составляет шесть недель, включая время, необходимое для производства, наполнения, продажи, переработки и восстановления.
Переработка одной алюминиевой банки экономит энергию, достаточную для того, чтобы 100-ваттная лампочка могла гореть почти четыре часа, или для обеспечения питания телевизора в течение трех часов.
Бросание алюминиевой банки тратит впустую столько же энергии, сколько выливание половины объема бензина из этой банки. Если каждый человек ежемесячно перерабатывает одну алюминиевую банку, экономия энергии составит от 1750 до 3500 галлонов газа.
Американские потребители и промышленность выбрасывают достаточно алюминия, чтобы каждые три месяца восстанавливать весь коммерческий воздушный флот США.
Алюминий составлял 1,5 процента от общего объема твердых бытовых отходов в Соединенных Штатах в 1994 году. Общий показатель для алюминиевой упаковки составлял 55 процентов.
В 1884 году общий объем производства алюминия в США составил 125 фунтов. В том году литая алюминиевая пирамида весом 100 унций, установленная на вершине монумента Вашингтона, представляла двадцать процентов этого производства.
Из четырех тонн боксита получается одна тонна алюминия — этого достаточно для изготовления 60 000 банок из-под напитков или каркасов для семи полноразмерных автомобилей или 40 000 дисков компьютерной памяти.
Один фунт алюминия может заменить в два раза больший вес стали в большинстве случаев.
Рубины, изумруды и сапфиры состоят в основном из кристаллического оксида алюминия.
Производители использовали технологии времен холодной войны, чтобы сделать летучие мыши Малой лиги из алюминия.
Алюминий легкий, прочный, устойчивый к коррозии, немагнитный, нетоксичный и естественно красивый.
(Факты опубликованы в 2001 г.)
Вернуться к началу
Дополнительная литература
- 125 лет компании Alcoa (Alcoa Inc.)
- Чарльз Мартин Холл (Оберлинский колледж и консерватория, факультет химии и биохимии)
Наверх
Обозначение памятника и благодарности
Обозначение ориентира
Американское химическое общество присвоило открытие Чарльзом Мартином Холлом процесса производства металлического алюминия с помощью электрохимии как Национальную историческую химическую достопримечательность в Оберлин-колледже в Оберлине, штат Огайо, 17 сентября 1997 года. Мемориальная доска в память об открытии гласит:
Мемориальная доска в память об открытии гласит:
23 февраля 1886 года в своей лаборатории в дровяном сарае в семейном доме на Ист-Колледж-стрит Чарльзу Мартину Холлу удалось получить металлический алюминий, пропуская электрический ток через раствор оксида алюминия в расплавленном состоянии. криолит. Алюминий был полудрагоценным металлом до того, как Холл открыл этот экономичный метод выделения его из руды. Его изобретение, которое сделало доступным этот легкий, блестящий и не ржавеющий металл, стало основой алюминиевой промышленности в Северной Америке.
Американское химическое общество объявило коммерциализацию алюминиевого процесса Холла Национальным историческим химическим памятником в компании Alcoa Inc. в Питтсбурге, штат Пенсильвания, 2 ноября 2001 г. Табличка в память об этой разработке гласит:
Мартин Холл изобрел экономичный электрохимический процесс выделения алюминия из руды. До этого этот легкий, блестящий и не ржавеющий металл был редким и дорогим. Группа питтсбургских инвесторов во главе с металлургом Альфредом Э. Хантом согласилась поддержать коммерциализацию процесса Холла и основала Pittsburgh Reduction Company. В 1888 году Холл с помощью Артура Вининга Дэвиса начал производить алюминий на экспериментальном заводе компании на Смоллман-стрит. В 1907 компания стала Алюминиевой Компанией Америки (Alcoa). С тех пор алюминий стал частью повседневной жизни с множеством применений — от чайников в первые дни до самолетов, линий электропередач, строительных материалов, упаковки для пищевых продуктов и произведений искусства.
Группа питтсбургских инвесторов во главе с металлургом Альфредом Э. Хантом согласилась поддержать коммерциализацию процесса Холла и основала Pittsburgh Reduction Company. В 1888 году Холл с помощью Артура Вининга Дэвиса начал производить алюминий на экспериментальном заводе компании на Смоллман-стрит. В 1907 компания стала Алюминиевой Компанией Америки (Alcoa). С тех пор алюминий стал частью повседневной жизни с множеством применений — от чайников в первые дни до самолетов, линий электропередач, строительных материалов, упаковки для пищевых продуктов и произведений искусства.
Благодарности
Адаптировано для Интернета из документов «Производство металлического алюминия с помощью электрохимии» (1997 г.) и «Коммерциализация алюминия» (2001 г.), подготовленных в рамках программы «Национальные исторические химические достопримечательности» Американского химического общества.
Вернуться к началу
Процитировать страницу
Стиль ACS
Американское химическое общество National Historic Chemical Landmarks.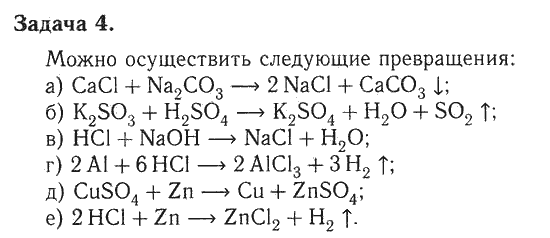



 Воспламенительные смеси в количестве 0,5 г или ниже приводят к менее надежному воспламенению, поэтому следует использовать бенгальский огонь.
Воспламенительные смеси в количестве 0,5 г или ниже приводят к менее надежному воспламенению, поэтому следует использовать бенгальский огонь.