Практические работы по химии (9 класс) | Химия
Автор: Фаттахова Галина Александровна
Организация: МБОУ «Мари-Турекская СОШ»
Населенный пункт: Республика Марий Эл, пгт. Мари-Турек
Практическая работа №1.
Влияние различных факторов на скорость химической реакции
Цель: изучение условий, влияющих на скорость химической реакции.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
|
Как определить реакцию способность металлов и галогенов по периодической таблице химических элементов Д. |
|
|||
|
|
|
|
Во сколько раз изменяется скорость реакции при повышении температуры? |
|
|||
|
|
|
|
Почему при увеличении концентрации реагента возрастает скорость реакции? |
|
|||
|
|
|
|
Что такое катализатор? Что такое ингибитор? Что такое фермент? |
Вывод:
Практическая работа №2.
Решение экспериментальных задач по теме
«Растворы. Электролитическая диссоциация»
Цель: изучение условий прохождения реакций ионного обмена до конца; закрепление умения пользоваться таблицей растворимости кислот, оснований и солей.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций в молекулярном, полном и сокращенном ионных видах;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите первое условие протекания реакции ионного обмена до конца |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите второе условие протекания реакции ионного обмена до конца |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Напишите третье условие протекания реакции ионного обмена до конца |
Вывод:
Практическая работа №3.
Получение аммиака и изучение его свойств
Цель: рассмотреть способ получения аммиака в лаборатории; изучить его основные свойства; составить уравнения химических реакций, подтверждающие свойства аммиака
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций
- Ответьте на вопросы
- Сделайте общий вывод по окончании практической работы
- Сделайте фото работы и отправьте его на адрес электронной почты учителю
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Из каких веществ получают аммиак в лаборатории? Каким способом собирают аммиак и почему? |
|
|||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
Влияют ли условия проведения реакции на образующееся продукты? |
|
|||
|
|
|
|
Какова растворимость аммиака в воде? Какой тип свойств характерен аммиаку? |
|
|||
|
|
|
|
Что такое донорно-акцепторный механизм протекания реакции? Донором или акцептором является аммиак? |
Вывод:
Практическая работа №4.
Получение оксида углерода (IV) и изучение его свойств
Цель: рассмотрение способа получения аммиака в лаборатории; изучение его основных свойств; составление уравнений химических реакций, подтверждающих свойства аммиака
Ход выполнения работы:
- Посмотрите виртуальный эксперимент;
- Опишите ход эксперимента в таблице;
- Составьте уравнения реакций
- Ответьте на вопросы
- Сделайте общий вывод по окончании практической работы
- Сделайте фото работы и отправьте его на адрес электронной почты учителю
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Из каких веществ получают углекислый газ в лаборатории? Каким способом собирают углекислый газ и почему? |
|
|||
|
|
|
|
Объясните, почему углекислый газ не поддерживает горение. |
|
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
При каких условиях образуется кислая соль? |
|
|||
|
|
|
|
Объясните наблюдаемый процесс |
| |||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
К какому типу относится данная реакция? |
Вывод:
Практическая работа №5.
Решение экспериментальных задач по теме «Металлы»
Цель: изучение свойств металлов (на примере алюминия) и изучение его свойств.
Ход выполнения работы:
- Посмотрите виртуальный эксперимент
Опыт 1 (1:05)
Опыт 2 (1:10)
Опыт 3 (1:25)
Опыт 4 (1:06)
- Опишите ход эксперимента в таблице по схеме:
А → В → С → В
↓
С
- Составьте уравнения реакций;
- Ответьте на вопросы;
- Сделайте общий вывод по окончании практической работы;
- Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
Опишите реакцию по схеме А → В |
|||
|
|
|
|
В каком случае металлы взаимодействуют с кислотами? |
|
Опишите реакцию по схеме В → С |
|||
|
|
|
Рассмотрите с точки зрения реакции ионного обмена |
Каковы условия получения нерастворимого основания? |
|
Опишите реакцию по схеме С → В |
|||
|
|
|
|
Как называются реакции взаимодействия щелочи с кислотой? Относится ли данная реакция к таковым и почему? |
|
Опишите реакцию по схеме А → С |
|||
|
|
|
Рассмотрите с точки зрения окислительно-восстановительной реакции |
При каких условиях данный металл взаимодействует с водой? |
Вывод:
Практическая работа №6.
Минеральные удобрения
Цель: ознакомление с минеральными удобрениями как источником питания растительных организмов; распознавание минеральных удобрений с помощью качественных реакций на ионы.
Ход выполнения работы:
1) Посмотрите виртуальный эксперимент
опыт (5:09)
2) Опишите ход эксперимента в таблице;
3) Составьте уравнения реакций;
4) Сделайте общий вывод по окончании практической работы;
5) Сделайте фото работы и отправьте его на адрес электронной почты учителю.
|
Что делали |
Что наблюдали |
Уравнение реакции |
Вывод |
|
Определение первого неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
|
|
|
|
|
Определение второго неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
Определение третьего неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
|
|
|
|
|
|
Определение четвертого неизвестного удобрения |
|||
|
|
|
|
Неизвестное удобрение – это … |
Вывод:
Список использованных источников
Литература:
- Кузнецова, Н.
 Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с.
Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с. - Основы химического эксперимента и занимательные опыты по химии: учебное пособие для вузов и школ / Ю.В. Бахтиярова,Р.Р. Миннуллин, В.И. Галкин. – Казань: Изд-во Казан.ун-та, 2014. – 144 с.
- Полупаненко, Е.Г.Школьный химический эксперимент: учебное пособие. — Луганск: Книта, 2018. – 176 с.
Интернет-источники:
- Амфотерные свойства гидроксида алюминия — Режим доступа: URL: https://www.youtube.com/watch?v=64P2B4loGsM (дата обращения 12.04.2020).
- Взаимодействие алюминия с соляной кислотой — Режим доступа: URL: https://www.youtube.com/watch?v=XN9U4Q8993Q (дата обращения 12.04.2020).
- Взаимодействие алюминия со щёлочью и водой — Режим доступа: URL: https://www.youtube.com/watch?v=5RvUC-3uY6c (дата обращения 12.04.2020).
- Взаимодействие аммиака с хлороводородом — Режим доступа: URL: https://www.
 youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020). - Влияние температуры на скорость реакции — Режим доступа: URL: https://www.youtube.com/watch?v=z8ig_koe9q8 (дата обращения 29.09.2020).
- Горение аммиака в кислороде — Режим доступа: URL: https://www.youtube.com/watch?v=lMIpFie0UTY (дата обращения 26.03.2020).
- Горение магния в углекислом газе – Режим доступа: URL: https://www.youtube.com/watch?v=3zL6ZTs922M (дата обращения 22.04.2020).
- Зависимость скорости реакции от концентрации реагентов — Режим доступа: URL: https://www.youtube.com/watch?v=cKLD1ejTJg4 (дата обращения 29.09.2020).
- Зависимость скорости химической реакции от катализаторов — Режим доступа: URL: https://www.youtube.com/watch?v=f8hsZMo9x3Q (дата обращения 29.09.2020).
- Зависимость скорости химической реакции от природы реагирующих веществ — Режим доступа: URL: https://www.youtube.com/watch?v=Gah0VEO7Ps0 (дата обращения 29.09.2020).

- Изучение взаимодействия оксида углерода(IV) со щелочью — Режим доступа: URL: https://www.youtube.com/watch?v=Y4mQ0R1LGUg (дата обращения 22.04.2020).
- Исследование возможности реакции оксида углерода(IV) с хлоридом кальция — Режим доступа: URL: https://www.youtube.com/watch?v=j_cSr2-SeLU (дата обращения 22.04.2020).
- Качественная реакция на сульфат-ионы — Режим доступа: URL: https://www.youtube.com/watch?v=4yFyNl6Wb8A (дата обращения 26.09.2020).
- Отношение оксида углерода(IV) к горению — Режим доступа: URL: https://www.youtube.com/watch?v=w6vNxqxtPsY (дата обращения 22.04.2020).
- Получение аммиака — Режим доступа: URL: https://www.youtube.com/watch?v=zbwg1XwvdVw (дата обращения 26.03.2020).
- Получение гидроксида алюминия — Режим доступа: URL: https://www.youtube.com/watch?v=95vUHth8NHo (дата обращения 12.04.2020).
- Получение и собирание оксида углерода (IV) — Режим доступа: URL: https://www.
 youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020).
youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020). - Распознавание минеральных удобрений — Режим доступа: URL: https://www.youtube.com/watch?v=liHlzMqPOFA (дата обращения 06.05.2020).
- Растворение аммиака в воде — Режим доступа: URL: https://www.youtube.com/watch?v=Wh37wEk5wB8 (дата обращения 26.03.2020).
- Реакция нейтрализации — Режим доступа: URL: https://www.youtube.com/watch?v=IJIzzhYmTSU (дата обращения 26.09.2020).
Приложения:
- file0.docx.. 29,5 КБ
Практическая работа 6 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Практическая работа 6 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Решение экспериментальных задач.
1. В четырех пробирках для двух вариантов даны следующие кристаллические вещества: А. а) хлорид кальция; б) гидроксид натрия; в) карбонат калия; г) хлорид стронция. Б. а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) хлорид калия. Опытным путем определите, в какой пробирке находится какое вещество. Пользуясь таблицей 3 (с. 14—15), напишите уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
2. Проделайте следующие превращения:
а) СаСl2 → Са(ОН)2 → СаСO3 → Са(НСO3)2 → СаСO3 → СаСl2
б) МgСO3 → МgСl2 → Мg(ОН)2 → МgSO4
Составьте уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде.
ответы
1. А. Добавляем раствор соляной кислоты. В
пробирке с карбонатом калия выделяется газ.
Раствор гидроксида натрия определяем по изме-
нению окраски индикатора. Так, например, фенол-
Так, например, фенол-
фталеин окрасится в розовый цвет.
Хлорид кальция от хлорида стронция можно
отличить по реакции с гипсовой водой (насыщенный
раствор)
Образуется белый кристаллический осадок суль-
фата стронция.
Подтвердить наличие хлорида кальция в остав-
шейся пробирке можно с помощью карбоната на-
трия:
Б. Добавляем соляную кислоту. В пробирке с
карбонатом кальция выделяется газ.
Добавляем хлорид бария. В пробирке с суль-
фатом натрия образуется белый осадок сульфата
бария:
Затем определяем хлорид калия реакцией с
нитратом серебра:
Образуется белый творожистый осадок хлорида
серебра. В оставшейся пробирке — нитрат строн-
ция. Подтвердить наличие нитрата стронция можно
реакцией с серной кислотой и металлической ме-
дью:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 3
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
IB Химия примечания к пересмотру и программа
Программа IB (первый экзамен 2016 г.)
Новая программа первых экзаменов 2016 г. содержит несколько изменений по сравнению с предыдущей (2009 г.) версией.
Только на короткое время — самопроверка викторин с несколькими вариантами ответов с ответами на главной странице: www.ibchem.com отношения
- 1.1 — Введение в дисперсионная природа материи
- 1.
 2 — Концепция крота
2 — Концепция крота - 1.3 — Реагирующие массы и тома
- 2.1 — Ядерный атом
- 2.2 — Электронная конфигурация
- 12.1 — Электроны в атомы
- 3.1 — Периодическая таблица
- 3.2 — Периодические тренды
- 13.1 — D-блок первого ряда элементы
- 13.2 — окрашенные комплексы
- 4.1 — Ионная связь и структура
- 4.2 — Ковалентная связь
- 4.3 — Ковалентные структуры
- 4.4 — межмолекулярные силы
- 4.5 — Металлическое соединение
- 14.1 — Электронный домен и молекулярная геометрия
- 14.2 — Гибридизация
- 5.
 1 — Измерение энергии
изменения
1 — Измерение энергии
изменения - 5.2 — Закон Гесса
- 5.3 — Энтальпии связи
- 15.1 — Энергетические циклы
- 15.2 — Энтропия и спонтанность
- 6.1 — Теория столкновений и скорости реакции
- 16.1 — Выражение скорости и реакционный механизм
- 16.2 — Энергия активации
- 7.1 — Равновесие
- 17.1 — Равновесие закон
- 8.1 — Теории кислот и базы
- 8.2 — Свойства кислоты и основания
- 8.3 — Шкала pH
- 8.4 — Сильный и слабый кислоты и основания
- 8.5 — Кислотное осаждение
- 18.1 — кислоты Льюиса и базы
- 18.
 2 — Расчеты
с участием кислот и оснований
2 — Расчеты
с участием кислот и оснований - 18.3 — Кривые pH
- 9.1 — Окисление и сокращение
- 9.2 — Электрохимический ячейки (ядро)
- 19.1 — Электрохимический ячейки (АГЛ)
- 10.1 — Основы органической химии
- 10.2 — Функциональная группа химия
- 20.1 — Типы органических реакции
- 20.2 — Синтетические маршруты
- 20.3 — Стереоизомерия
- 11.1 — Неопределенности и ошибки измерения
- 11.2 — Графические методы
- 11.3 — Спектроскопический идентификация органических соединений (ядро)
- 21.
 1 — Спектроскопический
идентификация органических соединений (АГЛ)
1 — Спектроскопический
идентификация органических соединений (АГЛ)
Объяснение нового формата программы можно прочитать здесь
Варианты 2016
Изучается один вариант из четырех ниже на выбор:
Никаких вариантов для студентов, готовящихся к экзаменационной сессии 2022 года, не ожидается.
Вариант A — Материалы
- A.1 Введение в материаловедение
- A.2 Металлы и спектроскопия с индуктивно связанной плазмой (ИСП)
- А.3 Катализаторы
- А.4 Жидкие кристаллы
- А.5 Полимеры
- А.6 Нанотехнологии
- A.7 Экологически безопасные пластмассы
Дополнительные темы более высокого уровня (10 часов)
- A.8 Сверхпроводящие металлы и рентгеновская кристаллография
- А.9 Конденсационные полимеры
- A.10 Воздействие на окружающую среду – тяжелые металлы
Вариант B – Биохимия
- B.
 1 Введение в биохимию
1 Введение в биохимию - В.2 Белки и ферменты
- B.3 Липиды
- B.4 Углеводы
- B.5 Витамины
- B.6 Биохимия и окружающая среда
Дополнительные темы более высокого уровня
- B.7 Белки и ферменты
- B.8 Нуклеиновые кислоты
- B.9 Биологические пигменты
- B.10 Стереохимия биомолекул
Вариант C — Энергия
- C.1 Источники энергии
- C.2 Ископаемое топливо
- C.3 Ядерный синтез и деление
- C.4 Солнечная энергия
- C.5 Воздействие на окружающую среду — глобальное потепление
Дополнительные темы более высокого уровня
- C.6 Электрохимия, перезаряжаемые батареи и топливные элементы
- C.7 Ядерный синтез и деление ядер
- C.8 Фотоэлектрические и сенсибилизированные красителем солнечные элементы
Вариант D – Медицинская химия
- D.
 1 Фармацевтические продукты и действие лекарств
1 Фармацевтические продукты и действие лекарств - D.2 Аспирин и пенициллин
- D.3 Опиаты
- D.4 Регулирование рН желудка
- D.5 Противовирусные препараты
- D.6 Воздействие некоторых лекарств на окружающую среду
Дополнительные темы более высокого уровня
- D.7 Таксол-хиральный вспомогательный пример
- D.8 Ядерная медицина
- D.9 Обнаружение и анализ наркотиков
Практическая работа
Практическая внутренняя оценка 2016
Внутренняя оценка и внешняя модерация
Все учебные материалы, воспроизведенные в этой книге, защищены авторским правом оригинальный издатель руководства по химии, © International Baccalaureate Organization 2016. Этот материал может быть скопирован для только для личного обучения.
Решения Selina для краткой научной химии 1, класс 9 ICSE, глава 9 — Практическая работа [Последнее издание]
Решения Selina для краткой научной химии 1, класс 9Глава 9 ICSE (Практическая работа) включает все вопросы с решением и подробным объяснением. Это избавит студентов от сомнений по любому вопросу и улучшит навыки применения при подготовке к экзаменам. Подробные пошаговые решения помогут вам лучше понять концепции и устранить путаницу, если таковая имеется.
Shaalaa.com предлагает решения ICSE по краткой научной химии 1 класса 9 CISCE, которые помогают учащимся лучше и быстрее понять основные понятия.
Это избавит студентов от сомнений по любому вопросу и улучшит навыки применения при подготовке к экзаменам. Подробные пошаговые решения помогут вам лучше понять концепции и устранить путаницу, если таковая имеется.
Shaalaa.com предлагает решения ICSE по краткой научной химии 1 класса 9 CISCE, которые помогают учащимся лучше и быстрее понять основные понятия.
Кроме того, мы в Shaalaa.com предоставляем такие решения, чтобы студенты могли подготовиться к письменным экзаменам. Решения Selina для учебников могут быть основным подспорьем для самообучения и идеальным руководством для самопомощи для студентов.
Понятия, изложенные в краткой научной химии 1, класс 9, глава 9 ICSE, практическая работа: материя (вещество), молекулы, чистые вещества, элементы, символы, используемые для представления атомов различных элементов, валентность, переменная валентность, химическая формула или молекулярная формула, наименование Химические соединения, Расчет валентности по формуле, Химическое уравнение, Балансирующее химическое уравнение, Атомная масса, Молекулярная масса, Процентный состав, Эмпирическая и молекулярная формулы, Эмпирическая формула соединения, Водород, Ионы (радикалы) и их типы, Химическая формула или молекулярная формула, классификация молекул, классификация изменений: химические изменения, условия, необходимые для химических реакций, типы химических изменений или химических реакций, реакция прямого соединения (или синтеза), реакции разложения, реакции одинарного замещения, реакция двойного замещения, изменение энергии in Химические реакции, Химическая реакция, Вода, Наш спасательный круг, Вода — универсальный растворитель, S alts, Удаление жесткости воды, Высолы, гигроскопические и разжижающие вещества, Высушивающие и обезвоживающие вещества, Классификация воды: мягкая и жесткая вода, Причины жесткости, Преимущества и недостатки жесткой воды, Физические свойства воды, Химические свойства воды , Растворы как «смеси» твердых веществ в воде, Компоненты растворов, Различные типы растворов, Насыщенные растворы, Концентрация раствора, Растворимость, Кристаллы и кристаллизация, Гидратированные и безводные вещества, Предотвращение загрязнения воды, Химическая связь, История атома , Элементы, Атомы: строительные блоки материи, Открытие заряженных частиц в материи, электроны (e), протоны (p), ядра, нейтроны (n), модель атома Дж. Дж. Томсона, модель атома лорда Резерфорда, модель атома Нильса Бора , структура атома, атомный номер (Z), массовое число (A) и количество нейтронов (n), атомная масса, электронная конфигурация атома, валентные электроны, причина химической активности Атом, изотопы, изобары, электровалентная (или ионная) связь, образование электровалентной (или ионной) связи, типы ковалентной связи, образование ковалентной связи, ковалентная связь, атомная теория Дальтона, типы элементов: металлы, история периодических Таблица: ранние попытки классификации элементов, триады Доберейнера, закон октав Ньюленда, периодическая таблица Менделеева, достоинства и недостатки периодической таблицы Менделеева, современный периодический закон, современная периодическая таблица, типы элементов на основе периодической таблицы, преимущество и недостатки современной периодической таблицы, периодические свойства, периодические свойства: оболочки (орбиты), периодические свойства: валентность, периодические свойства: свойства элементов, периодические свойства: атомный радиус или размер атома, периодические свойства: металлический характер, изучение конкретных групп в Периодическая таблица, группа II (щелочноземельные металлы), группа I (щелочные металлы), группа VIIA или группа 17 (галогены), группа 0 или группа 18 (благородные газы), использование периодов c Таблица, Положение водорода в периодической таблице, Сходства между водородом и щелочными металлами, Применение ряда активности при получении водорода, Лабораторное получение водорода, Сходства между водородом и галогенами, Водород, Получение водорода, Производство водорода, Химические свойства водорода, окисления, восстановления и окислительно-восстановительных реакций, использования водорода, физических свойств водорода, молекулярного движения: взаимосвязь температуры, давления и объема, температуры, газовые законы, шкалы термометров, газовое уравнение, стандартное температурное давление (STP), Влияние влаги и давления, Газы и их характеристики, Зависимость давления от объема или закон Болье, Зависимость объем-температура или закон Шарля, Абсолютный ноль, Причины кислотных дождей, Глобальное потепление, Истощение озонового слоя, Загрязнение воздуха и его причины, Атмосферные Загрязнение, последствия загрязнения воздуха, предотвращение загрязнения воздуха, газообразные загрязнители и их воздействие, кислотный рай n, парниковый эффект, преимущество парникового эффекта, меры по предотвращению глобального потепления, озон.
Дж. Томсона, модель атома лорда Резерфорда, модель атома Нильса Бора , структура атома, атомный номер (Z), массовое число (A) и количество нейтронов (n), атомная масса, электронная конфигурация атома, валентные электроны, причина химической активности Атом, изотопы, изобары, электровалентная (или ионная) связь, образование электровалентной (или ионной) связи, типы ковалентной связи, образование ковалентной связи, ковалентная связь, атомная теория Дальтона, типы элементов: металлы, история периодических Таблица: ранние попытки классификации элементов, триады Доберейнера, закон октав Ньюленда, периодическая таблица Менделеева, достоинства и недостатки периодической таблицы Менделеева, современный периодический закон, современная периодическая таблица, типы элементов на основе периодической таблицы, преимущество и недостатки современной периодической таблицы, периодические свойства, периодические свойства: оболочки (орбиты), периодические свойства: валентность, периодические свойства: свойства элементов, периодические свойства: атомный радиус или размер атома, периодические свойства: металлический характер, изучение конкретных групп в Периодическая таблица, группа II (щелочноземельные металлы), группа I (щелочные металлы), группа VIIA или группа 17 (галогены), группа 0 или группа 18 (благородные газы), использование периодов c Таблица, Положение водорода в периодической таблице, Сходства между водородом и щелочными металлами, Применение ряда активности при получении водорода, Лабораторное получение водорода, Сходства между водородом и галогенами, Водород, Получение водорода, Производство водорода, Химические свойства водорода, окисления, восстановления и окислительно-восстановительных реакций, использования водорода, физических свойств водорода, молекулярного движения: взаимосвязь температуры, давления и объема, температуры, газовые законы, шкалы термометров, газовое уравнение, стандартное температурное давление (STP), Влияние влаги и давления, Газы и их характеристики, Зависимость давления от объема или закон Болье, Зависимость объем-температура или закон Шарля, Абсолютный ноль, Причины кислотных дождей, Глобальное потепление, Истощение озонового слоя, Загрязнение воздуха и его причины, Атмосферные Загрязнение, последствия загрязнения воздуха, предотвращение загрязнения воздуха, газообразные загрязнители и их воздействие, кислотный рай n, парниковый эффект, преимущество парникового эффекта, меры по предотвращению глобального потепления, озон.

 И.Менделеева?
И.Менделеева?
 Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с.
Е. Химия: 9 класс: учебник для общеобразовательных учреждений / Н.Е.Кузнецова, И.М.Титова, Н.Н. Гара. – М.: Вентана-Граф, 2019. – 321 с. youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
youtube.com/watch?v=6YCy5nWffbk (дата обращения 26.03.2020).
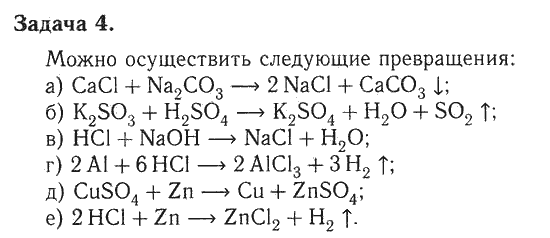 youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020).
youtube.com/watch?v=Yv8FIc-3tvI (дата обращения 22.04.2020). 2 — Концепция крота
2 — Концепция крота 1 — Измерение энергии
изменения
1 — Измерение энергии
изменения 2 — Расчеты
с участием кислот и оснований
2 — Расчеты
с участием кислот и оснований 1 — Спектроскопический
идентификация органических соединений (АГЛ)
1 — Спектроскопический
идентификация органических соединений (АГЛ) 1 Введение в биохимию
1 Введение в биохимию 1 Фармацевтические продукты и действие лекарств
1 Фармацевтические продукты и действие лекарств