Получение металлов — урок. Химия, 8–9 класс.
Рудами называют минералы и горные породы, содержащие металлы и их соединения, из которых технически возможно и экономически целесообразно получать чистые металлы.
Получение металлов из руд — задача металлургии.Металлургия — это и наука о промышленных способах получения металлов из руд, а также соответствующая отрасль промышленности.
Любой металлургический процесс — это процесс восстановления катионов металла с помощью различных восстановителей.
Существует несколько способов получения металлов:
- пирометаллургический,
- электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода \(C\), оксида углерода(\(II\)) \(CO\), водорода h3, металлов — алюминия \(Al\), магния \(Mg\).
Цех пирометаллургического производства
1. Восстановление металлов из их оксидов с помощью углерода (в виде кокса, раньше — в виде древесного угля) или оксида углерода(\(II\)) называется карботермией.
Например, олово восстанавливают из оловянного камня углеродом:
Sn+4O2−2+C0⟶t°Sn0+C+4O−22.
Медь восстанавливают из куприта оксидом углерода(\(II\)):
Cu+12O−2+C+2O−2⟶t°2Cu0+C+4O−22.
2. Восстановление металлов из их оксидов с помощью металлов называется металлотермией.
Например, хром восстанавливают из оксида хрома(\(III\)) при помощи алюминия (алюминотермия):
Cr+32O−23+2Al0⟶t°2Cr0+Al+32O−23.
Титан восстанавливают из оксида титана(\(IV\)) магнием:
Ti+4O2−2+2Mg0⟶t°Ti0+2Mg+2O−2.
3. Восстановление металлов из их оксидов с помощью водорода. Таким образом получают металлы с высокой степенью чистоты.
Например, так восстанавливают вольфрам из оксида вольфрама(\(VI\)):
W+6O3−2+3H02⟶t°W0+3h3+1O−2.
4. Руды, образованные сульфидами металлов, предварительно подвергают обжигу (окисляют кислородом воздуха), а затем металл восстанавливают из образовавшегося оксида.
Например, цинковую обманку (сульфид цинка) подвергают обжигу (при этом образуется оксид цинка и диоксид серы), а затем полученный оксид цинка восстанавливают углеродом:
1) 2Zn+2S−2+3O02⟶t°2Zn+2O−2+2S+4O−22; 2) Zn+2O−2+C0⟶t°Zn0+C+2O−2.
Электрометаллургия — восстановление металлов из растворов или расплавов их соединений под действием электрического тока (электролиз).
В процессе электролиза за счёт электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролизный цех металлургического завода
1. Восстановление активных металлов электролизом из расплавов их солей (галогенидов).
Например, натрий можно получить из расплавленного хлорида натрия под действием электрического тока:
2Na+1Cl−1⟶электролиз2Na0+Cl02.
2. Восстановление металлов средней активности и неактивных металлов электролизом из растворов их солей.
Например, олово образуется при электролизе раствора хлорида олова(\(II\)):
Sn+2Cl2−1⟶электролизSn0+Cl02.
Медь образуется при электролизе раствора сульфата меди(\(II\)):
2Cu+2S+6O−24+2H+12O−2⟶электролиз2Cu0+O02+2h3+1S+6O−24.
Получение металлов. Нахождение их в природе
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем
путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными
металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.
А вот распространённость
химических элементов металлов в земной коре различна. К наиболее распространённым
металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%),
натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в
земной коре может составлять тысячные доли процента и ниже.
Содержание других металлов в
земной коре может составлять тысячные доли процента и ниже.
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na+, K+, Mg2+, Ca2+ в организме человека приходится 99% всех ионов металлов.
К биологически наиболее
значимым металлам относятся: K,
Na, Mg,
Ca, Fe,
Cu, Co,
Mn, Zn,
Mo.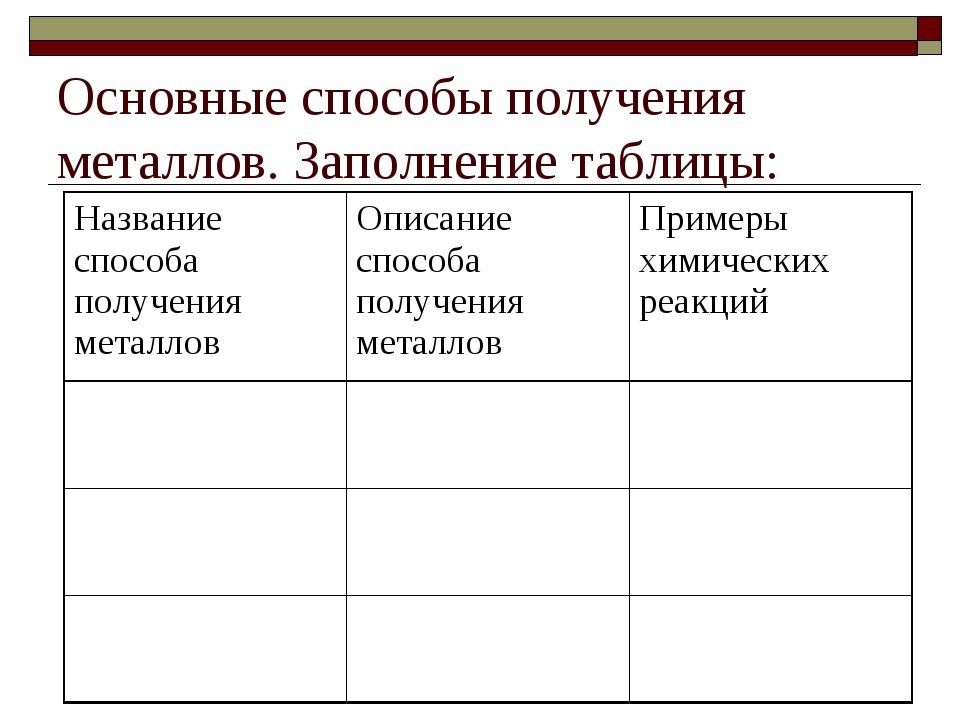
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
|
Название |
Химический состав |
|
Красный железняк (гематит) |
Fe2O3 |
|
Магнитный железняк (магнетит) |
Fe3O4 |
|
Бурый железняк |
2Fe2O3 · 3H2O |
|
Железный колчедан (пирит) |
FeS2 |
|
Сильвин |
KCl |
|
Криолит |
Na3AlF6 |
|
Кальцит |
CaCO3 |
|
Корунд |
Al2O3 |
|
Малахит |
(CuOH)2CO3 |
|
Медный колчедан (халькопирит) |
CuFeS2 |
|
Киноварь |
HgS |
|
Гипс |
CaSO4 · 2H2 |
|
Свинцовый блеск (галенит) |
PbS |
|
Цинковая обманка |
ZnS |
К наиболее известным
минералам относится пирит, или железный колчедан (FeS2),
киноварь (HgS), малахит
((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих
металлов, то есть железа и ртути, а малахит, как поделочный камень.
Пирит и киноварь используют в промышленности для получения соответствующих
металлов, то есть железа и ртути, а малахит, как поделочный камень.
А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки
, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного
железняка коричнево-красный, сам он прочный, плотный, если
провести образцом руды по поверхности фарфоровой ступки, то он оставляет
красно-коричневый след, не притягивается магнитом.
Бурый железяк имеет жёлто-коричневую окраску
Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.
Здорово, получается, что минералы отличаются между собой окраской,
магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике
широко используют более 75 металлов и многочисленные сплавы на их основе.
Поэтому большое значение придаётся промышленным способам получения металлов из
руд. Обычно перед получением металлов из руды её измельчают, потом
предварительно обогащают – отделяют пустую породу, примеси. В результате
образуется концентрат, служащий сырьём для металлургического производства.
Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.
Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды
переводят в оксиды, а сера удаляется в виде оксида серы
(IV). А затем из оксида восстанавливают металл. Полученный металл или сплав
подвергают механической обработке, придают ему соответствующую форму. В
процессе выделения металлов (плавке) из оксидов в качестве
восстановителей используют углерод, оксид углерода (II),
водород, кремний или более активные металлы.
А затем из оксида восстанавливают металл. Полученный металл или сплав
подвергают механической обработке, придают ему соответствующую форму. В
процессе выделения металлов (плавке) из оксидов в качестве
восстановителей используют углерод, оксид углерода (II),
водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
2Fe2O3 + 3C = 4Fe + 3CO2
В промышленных масштабах
для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).Fe2O3 + 3CO = 2Fe + 3CO2
Сейчас мы посмотрим,
как получают чугун и сталь. Восстановление железа проводят в специальных
вертикальных печах, называемых доменными, высотой до нескольких десятков
метров и внутренним объёмом до 5000 м3. Они имеют стальной корпус, а
изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь
– аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё
– шихта, представляющая собой смесь железной руды, кокса
(переработанного угля), известняка и других добавок, а снизу вдувается
подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает
в горячем воздухе, образуя углекислый газ.
Восстановление железа проводят в специальных
вертикальных печах, называемых доменными, высотой до нескольких десятков
метров и внутренним объёмом до 5000 м3. Они имеют стальной корпус, а
изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь
– аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё
– шихта, представляющая собой смесь железной руды, кокса
(переработанного угля), известняка и других добавок, а снизу вдувается
подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает
в горячем воздухе, образуя углекислый газ.
C + O2 = CO2
доменная печь
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
CO2 + C = 2CO
В результате реакций СО
с оксидом железа (III) образуется
железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
Конвертер
Для получения некоторых металлов в качестве восстановителя используют водород.
WO3 + 3H2 = W + 3H2O
В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:
Fe2O3 + 2Al = 2Fe + Al2O3
Восстановление железа
методом алюминотермии до сих пор применяется при сварке рельсов.
Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.
Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия –
методы получения металлов, основанные на электролизе, т.е. выделение металлов
из растворов или расплавов их соединений с помощью постоянного электрического
тока. Этот метод применяют для получения активных
металлов – щелочных и щелочноземельных, алюминия, также для получения
легированных сталей. С помощью этого метода, английский химик Г. Дэви
впервые получил калий, натрий, барий и кальций.
Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.
При промышленном
производстве металлов большое значение имеют вопросы охраны окружающей среды
от загрязнений отходами производства. Охрана окружающей среды предусматривает,
прежде всего, дезактивацию выбросов, например отходящих газов при
выплавке чугуна. Здесь главную опасность представляет образующийся при
переработке сернистых руд оксид серы (IV),
который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с
комплексным использованием сырья, строительством очистных сооружений,
устройством замкнутых циклов водопользования с целью охраны окружающей среды
необходимы вывод промышленных предприятий за городскую черту, создание
лесозащитных вокруг городов и промышленных центров.
Здесь главную опасность представляет образующийся при
переработке сернистых руд оксид серы (IV),
который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с
комплексным использованием сырья, строительством очистных сооружений,
устройством замкнутых циклов водопользования с целью охраны окружающей среды
необходимы вывод промышленных предприятий за городскую черту, создание
лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы
встречаются в природе в виде соединений или в самородном состоянии. В земной
коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов,
карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и
минералов. Для получения металлов из руд руду сначала измельчают,
обогащают, переводят в оксид и только после этого восстанавливают металл. В
качестве восстановителей используют C,
CO, H2,
Si или более
активные металлы. Металлургия занимается получением металлов и их сплавов из
руд. В зависимости от метода получения металла из руды существует несколько
видов металлургических производств: пирометаллургия, гидрометаллургия и
электрометаллургия.
Металлургия занимается получением металлов и их сплавов из
руд. В зависимости от метода получения металла из руды существует несколько
видов металлургических производств: пирометаллургия, гидрометаллургия и
электрометаллургия.
Тема 10. Получение металлов. | 9 класс
Часть I
1. Металлы в природе встречаются:
1) только в самородном виде Pt, Ag, Au
2) и в свободном, и в виде соединений Cu, Hg
3) только в виде соединений: большинство, а также активные М (минералы Zn, Pb, Na, Li и др.)
Обобщение этих утверждений оформите с помощью ряда активности металлов, используя фигурные скобки:
2. Минералы – это различные природные соединения, включающие в себя М в связанном состоянии.
Заполните таблицу «Названия и формулы минералов металлов».
3. Руды – это природные образования, содержащие минералы, в которых М находятся в количествах, пригодных для получения их самих.
Руды – это природные образования, содержащие минералы, в которых М находятся в количествах, пригодных для получения их самих.
4. Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов.
5. Заполните таблицу «Классификация общих способов получения металлов».
Часть II
1. Отделение пустой породы от руды – это обогащение.
2. Заполните таблицу «Восстановители в пирометаллургии».
3. Дополните схему:
Это пример электрометаллургии.
4. Сырьём для получения алюминия являются:
а) алюмосиликаты
б) боксит, корунд
в) оксид алюминия.
5. Нарисуйте и опишите схему электролитического получения алюминия.
Процесс получения алюминия электролизом проводят в электролитических ваннах в присутствии расплавленного криолита; из оксида алюминия;
6. Напишите синквейн о металлургии.
Напишите синквейн о металлургии.
1) Металлы
2) Способ получения
3) Пиро-, электро-, гидрометаллургия
4) Основа промышленности
5) Получение.
7. Нарисуйте и опишите схему доменного процесса.
Сущность доменного процесса состоит в восстановлении железа из оксидов и получении науглероженного металла (чугуна) и шлака, которые легко отделяются друг от друга из-за различия в плотностях.
Полученное в результате реакции железо каплями стекает по раскаленному коксу вниз, насыщаясь углеродом, в результате чего получается сплав, содержащий 2,14 – 6,67 % углерода (чугун). Кроме углерода в него входят небольшая доля кремния и марганца. В количестве десятых долей процента в состав чугуна входят также вредные примеси — сера и фосфор. Кроме чугуна в горне образуется и накапливается шлак, в котором собираются все вредные примеси.
№ | Часть урока | Деятельность учителя | Деятельность учащихся |
1 | Организационный момент | Проверяет готовность учащихся | Подготовка к уроку | 2 | Актуализация знаний. Определение темы урока. | Беседа в формате вопрос-ответ: -чем отличаются металлы натрий и золото? -на какие группы можно разделить все металлы по их активности? К какой из них относится натрий? Золото? -пользуясь какой таблицей мы можем судить об активности металлов? — чем обусловлена активность металлов? — вспомните, в каком виде золото можно найти в природе? — а натрий в виде чистого металла мы сможем обнаружить в природе? Сегодня и поговорим о природных соединениях металлов. Диктует тему урока: «Металлы в природе. Общие способы получения металлов» Открывает презентацию к уроку Слайд 1 Презентации (приложение 1) | Ответы учащихся: -цветом, активностью, плотностью — по своей активности металлы делятся на активные, средней активности и малоактивные. Натрий – активный металл, золото – малоактивный. -электрохимический ряд напряжений металлов — активность металлов обусловлена способностью к отдаче электронов: чем активнее металл, тем легче он отдает электроны — в виде самородков — нет. Натрий – активный металл: он очень активно взаимодействует с водой, кислородом и др. неметаллами, поэтому в природе он существует только в виде соединений Записывают тему в тетрадь | 3 3.1 3.2 | Изучение нового материала. Нахождение металлов в природе. Способы получения металлов. | Слайд 2 Презентации (приложение 1): Обратите внимание, что природные соединения металлов называются минералами. Металлы средней активности обычно существуют в природе в виде оксидов и сульфидов, активные металлы – в виде солей. В быту мы окружены множеством изделий из различных металлов и сплавов. Узнаем как же из минералов можно получать металлы. Минералы в природе обычно входят в состав руд. Демонстрирует Слайд 3 Презентации (приложение 1) Откройте с. 75 учебника и прочитайте определение руды. Из определения видно, что минералы – это полезная часть руды, поэтому прежде чем отправить руду на переработку ее обогащают. После этого она идет в металлургическое производство. Дает определение металлургии. Мы с вами уже обсудили как связана активность металлов с формами их существования в природе. А как вы думаете: будет ли активность металлов влиять на выбор способа их получения? Давайте разберемся. Слайд 4 Презентации (приложение 1): Просит переписать схему из слайда в тетрадь Слайд 5 Презентации (приложение 1): Дает определение пирометаллургии. Просит учащихся записать название способа, сырье и восстановители Слайд 6 Презентации (приложение 1): Просит записать подзаголовок со слайда и примеры реакций: Оксид олова + углерод= Оксид железа (III)+ оксид углерода (II)= Показывает учащимся правильные уравнения, просит проверить. Рассказывает учащимся о доменном производстве чугуна, о кислородном конвертере для производства стали. Демонстрирует таблицы «Производство чугуна», «Конвертор с кислородным дутьем». Далее рассказ учителя дополнительного материала (приложение 2). Демонстрирует и комментирует видео «Кипящий слой» (ссылка на слайде 6 Презентации) Слайд 7 Презентации (приложение 1): Запишем пример восстановления металлов водородом, например, вольфрама из его оксида. Демонстрирует уравнение реакции. Слайд 8 Презентации (приложение 1): Просит записать подзаголовок слайда в тетрадь и составить в качестве примеров уравнения реакций восстановления алюминием оксида железа (III) и оксида марганца (IV). Демонстрирует уравнение реакции. Просит проверить. Восстановление металлов алюминием – это экзотермический процесс. Демонстрирует видео «Алюминотермия» (ссылка на слайде 8 Презентации) Слайд 9 Презентации (приложение 1): Просит записать подзаголовок слайда в тетрадь и составить в качестве примера уравнения реакций получения цинка из его сульфида. Демонстрирует уравнение реакции. Просит проверить. Слайд 10 Презентации (приложение 1): Дает определение гидрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить. Подчеркивает, что при таком способе получения нерастворимые соединения переводятся в растворимые, и уже растворы подвергаются переработке. Слайд 11 Презентации (приложение 1): Просит записать в тетрадь подпункт а) из слайда и в качестве примера составить уравнение реакции восстановления меди из ее сульфата железом. Напоминает, что этот опыт ребята проводили, когда изучали химические свойства металлов. Демонстрирует уравнение реакции. Просит проверить. Просит переписать в тетрадь текст пункта б) слайда и уравнение реакции. Поясняет, что электролиз – это ОВР, проходящая под действием эл. тока. Более подробно этот процесс рассматривается в 11 классе. Получение каких металлов мы с вами еще не обсудили? Почему активные металлы нельзя получить пиро- и гидрометаллургией? Учитель помогает ученикам наводящими вопросами сформулировать правильный ответ. Итак, для получения активных (щелочных и щелочно-земельных) металлов нужен сильный восстановитель. И таким восстановителем является эл. ток. Его восстановительной способности хватит и для восстановления очень активных металлов (лития, натрия, калия и др.) Т.е. электролиз, о котором мы говорили выше, можно применять и для получения активных металлов. Подумайте, можно ли получить активные металлы электролизом их водных растворов? Поэтому для получения активных металлов эл. Слайд 12 Презентации (приложение 1) Дает определение электрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить. | Переписывают данные слайда в тетрадь. Рассматривают образцы минералов из коллекции. — открывают учебник, читают определение. Записывают в тетрадь формулу: руда = минерал + горная порода, Обогащение руды – удаление из нее пустой породы. — ответы учеников -переписывают схему в тетрадь — делают записи в тетрадь — записывают текст слайда и составляют уравнения реакций — проверяют правильность уравнений — слушают рассказ -смотрят видео — переписывают подзаголовок слайда в тетрадь, пишут уравнение реакции -проверяют правильность составленного уравнения — переписывают подзаголовок слайда в тетрадь, пишут уравнение реакции — проверяют правильность уравнений — смотрят видео — переписывают подзаголовок слайда в тетрадь, пишут уравнение реакции — проверяют правильность уравнений — переписывают содержание слайда. — делают запись в тетрадь, пишут уравнение реакции — проверяют правильность уравнения -делают записи в тетради — активных — активные металлы в природе находятся в виде солей. Чтобы их восстановить из солей, нужны сильные восстановители. Неметаллы такой силой не обладают, а очень активные металлы, например, нельзя применять как восстановители в гидрометаллургии, т.к. они взаимодействуют с водой. — нет, потому что полученные металлы будут сразу же взаимодействовать с водой. — делают записи в тетради | 4 | Осмысление и формулирование выводов по уроку. | В форме беседы помогает учащимся сформулировать выводы по теме урока: 1. Как вы думаете от чего зависит, в какой форме будет находиться металл в природе? 2. От чего зависит способ переработки руды для получения металла? 3. На чем основаны способы получения металлов из руд? Таким образом, мы видим, что получение металлов зависит от химической активности металлов, то есть химических свойств, а также от количественного и качественного состава природных соединений металлов. | Записывают вывод в тетрадь -форма нахождения металла в природе зависит от химической активности металла -способ получения металла зависит от вида, в котором находится металл в природе, то есть от руды. — в основе способов получения металлов лежат химические свойства самих металлов и их соединений, входящих в состав руд. | 6 | Рефлексия. Обсуждение домашнего задания. | Предлагает выполнить упр.4 на с.80 учебника. Предлагает проверить и обсудить решение. Предлагает записать домашнее задание: §12, записи в тетради – выучить. | Выполняют упражнение. — обсуждают, проверяют . Записывают домашнее задание. |
Получение металлов | План-конспект урока по химии (9 класс) на тему:
Урок 5 (9). Получение металлов
Новое содержание. Самородные металлы, руды и минералы, металлургия, алюмотермия.
Планируемые результаты обучения. Знать важнейшие способы производства металлов.
Цель урока: рассказать о важнейших способах получения металлов.
Демонстрация. Алюмотермия, образцы минералов и руд.
Лабораторные опыты. Знакомство с коллекциями руд.
Ход урока
1. Нахождения металлов в природе. В самородном виде встречаются золото, серебро, платина, которые не реагируют с кислородом (в учебнике сказано — трудно реагируют, это неверно). Другие, более активные металлы (железо, медь) также могут быть найдены в виде самородков, но значительно реже. Их не используют в качестве сырья. Большинство металлов в природе встречаются в виде соединений — оксидов, сульфидов, солей.
Важно объяснить учащимся различие между терминами минерал, горная порода и руда. Природные образования, содержащие минералы металлов в количестве, пригодном для промышленного получения из них металлов, называют рудами. Руды некоторых редких металлов (платиновые металлы, рений, уран) могут содержат доли процента необходимого металла, такую руду первоначально обогащают, получая концентрат. Отметим, что автор в параграфе 12 ошибочно называет мрамор минералом. Это горная порода.
Отметим, что автор в параграфе 12 ошибочно называет мрамор минералом. Это горная порода.
В зависимости от того, где расположен металл в ряду напряжений, можно судить о его нахождении в природе:
- металлы, стоящие в ряду напряжений до алюминия встречаются в природе в виде солей — хлоридов, сульфатов, нитратов, карбонатов;
- металлы от алюминия до ртути — в виде оксидов и сульфидов, реже — в виде карбонатов;
- металлы, располагающиеся в ряду напряжений после водорода, могут встречаться в самородном виде — золото, серебро, платина, реже — ртуть и медь.
Наука о получении металлов из руд называется металлургия. В зависимости от способа извлечения металла из руды выделяют следующие виды металлургических процессов:
2. Металлургия — наука о промышленных способах получения металлов из природного сырья, а также отрасль промышленности, занимающаяся добычей и производством металлов. Металлургическую промышленность делят на черную металлургию (производство железа и его сплавов) и цветную металлургию (производство всех других металлов, кроме железа). Различают несколько основных способов производства металлов.
Различают несколько основных способов производства металлов.
Пирометаллургией называют процессы восстановления металлов из руд, проводимые при высоких температурах. Она включает восстановление оксидов активными металлами (алюминием — алюмотермия, магнием — магнийтермия), углем, водородом. Методами пирометаллургии получают цинк, олово, свинец, железо, хром, титан, молибден и многие другие металлы.
Сульфидные руды подвергают обжигу:
2CuS + ЗО2 → 2СuО+2SO2.
Оксидные руды и оксиды восстанавливают углём, угарным газом, более активными металлами — алюминием (алюминотермия), магнием (магнийтермия), натрием (натрийтермия):
СuО + С→Сu + СО ; 2А1 + Сr2О3 →2Cr + А12О3.
Гидрометаллургия охватывает методы получения металлов из растворов их солей путем электролиза растворов или вытеснением более активным металлом. Так производят медь, кадмий, извлекают золото и серебро.
CuS + h3SO4 → CuSO4 + h3О
концентр.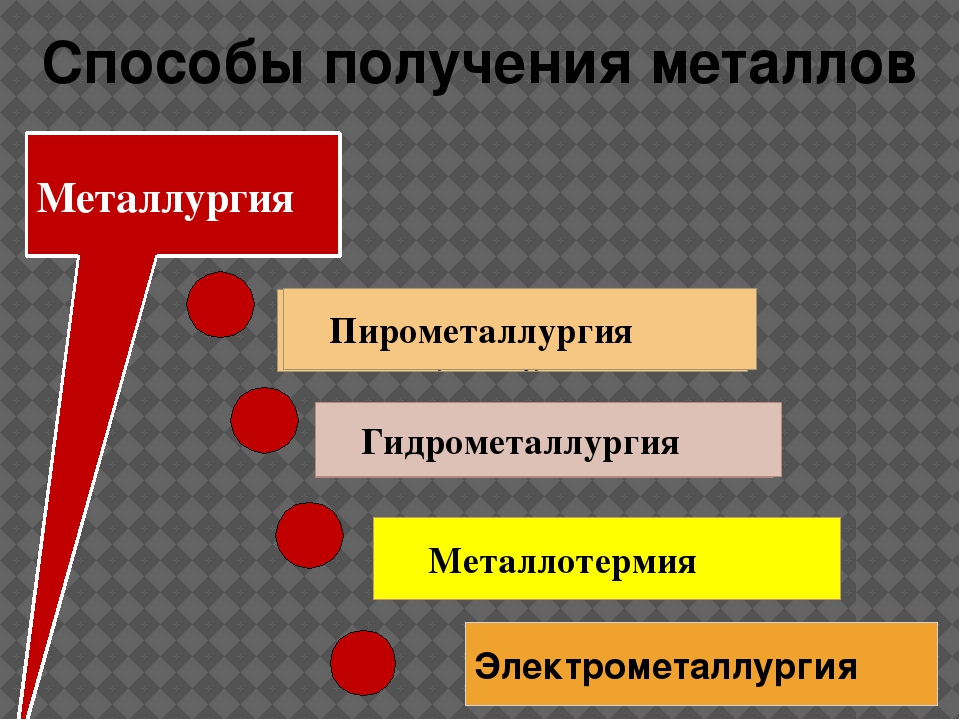
CuSO4 + Fe → FeSO4 + Сu
Электрометаллургия занимается получением металлов при помощи электролиза расплавов. Этим способом получают активные металлы — алюминий, натрий, кальций.
2А12О3 злектролиз→4Аl + ЗО2;
расплав
2NaCl злектpолиз →2Na+Cl2.
расплав
Способ получения данного металла выбирают исходя из его химической активности, а также из типа соединений, в виде которых он встречается в природе.
Из оксидов и некоторых солей металлы выделяют восстановлением. В качестве восстановителя чаще всего используют уголь:
t
ZnO + С = Zn + CO.
Некоторые металлы восстанавливают действием водорода. Так в промышленности получают тугоплавкие металлы — молибден и вольфрам:
t
МоО3 + ЗН2 = Мо + ЗН2О.
Иногда в качестве восстановителя используют другой, более активный металл, например кальций или алюминий (алюмотермия). Термин алюмотермия в настоящее время более распространен, чем алюминотермия, приведенный в учебнике.
Термин алюмотермия в настоящее время более распространен, чем алюминотермия, приведенный в учебнике.
Если металл встречается в природе в виде соединений с серой, первоначально его переводят в оксиды путем обжига—нагревания на воздухе или в кислороде:
t
2ZnS + ЗО2 = 2ZnO + 2SО2↑.
Карбонатные породы переводят в оксиды нагреванием:
t
ВаСО3 = ВаО + CO2↑.
Другим распространенным способом производства металлов является электролиз. Многие активные металлы (натрий, кальций, алюминий) получают электролизом расплавленных солей или оксидов. Малоактивные металлы, например медь, выделяют при пропускании электрического тока через водные растворы их солей:
эл.ток
2CuSO4 + 2Н2О→ 2Cu↓ + 2h3SO4 + О2↑.
Электролиз используют также для очистки металлов (электролитическое рафинирование).
Порошковая металлургия — метод получения слитков тугоплавких металлов, которые вследствие очень высоких температур плавления сложно расплавить и отлить в формы. Позволяет избежать процесса литья. Порошковая металлургия основана на спекании предварительно спрессованного порош ка металла при температуре выше 1000 °С в атмосфере водорода. Затем через брусок из металла пропускают электричеcкий ток, за счет чего он разогревается до температуры плавления, и при этом отдельные его зерна свариваются друг с другом. Полученное изделие подвергают горячей ковке и прокатке. Методом порошковой металлургии получают компактные слитки тугоплавких металлов — молибдена, вольфрама. ниобия, тантала, осмия, платины и др. Используя текст учебника, учащиеся
могут составить таблицу .
Методы получения металлов
Метод | Пример |
1. Пирометаллургия | |
2. | |
3. Электрометаллургия |
3. Рассматривая пирометаллургию, следует потренироваться в записи уравнений реакций обжига сульфидных руд. У учащихся нет необходимых знаний для ответа на вопрос 5 — они не знают, что продуктом реакции является оксид железа(III) Fе2О3.
На наш взгляд, реакцию обжига пирита учитель должен рассмотреть в классе в качестве примера процесса, где происходит окисление сразу двух элементов — железа и серы (коэффициент 2 перед серой нужен для уравнивая стехиометрии Fe : S = 1 : 2, оба элемента входят в состав одного и того же вещества — FeS2):
Домашнее задание. § 9. , упр. 4, 5.
Понятие о металлургии. Способы получения металлов. Сплавы (сталь, чугун, дюралюминий, бронза). Проблема безотходных производств в металлургии и охрана окружающей среды
Природные соединения металлов
Металлы
могут встречаться в природе или в виде простого вещества или в виде сложного
вещества.
Металлы в природе встречаются в трёх формах:
1. Активные – в виде солей (сульфаты, нитраты, хлориды, карбонаты)
2. Средней активности – в виде оксидов, сульфидов (Fe3O4, FeS2)
3. Благородные – в свободном виде (Au, Pt, Ag)
Чаще всего металлы в природе встречаются в виде солей неорганических кислот или оксидов:
- хлоридов – сильвинит КСl • NaCl, каменная соль NaCl;
- нитратов – чилийская селитра NaNO3;
- сульфатов – глауберова соль Na2SO4 · 10 H2O, гипс CaSO4 • 2Н2О;
- карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 • MgCO3;
- сульфидов – серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
- фосфатов – фосфориты, апатиты Ca 3(PO4)2 ;
- оксидов
– магнитный железняк Fe3O4, красный железняк Fe2O3,
бурый железняк Fe2O3 • Н2О.

Ещё в середине II тысячелетия до н. э. в Египте было освоено получение железа из железных руд. Это положило начало железному веку в истории человечества, который пришёл на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией. Так же называется и наука о промышленных способах получения металлов из руд.
Металлургия – это наука о промышленных способах получения металлов.
Получение металлов
Большинство
металлов встречаются в природе в составе соединений, в которых металлы
находятся в положительной степени окисления, значит для того, чтобы их
получить, в виде простого вещества, необходимо провести процесс восстановления.
Ме+n + ne— → Me0
I. Пирометаллургический способ
Это восстановление металлов из их руд при высоких температурах с помощью восстановителей неметаллических — кокс, оксид углерода (II), водород; металлических — алюминий, магний, кальций и другие металлы.
1. Получение меди из оксида с помощью водорода – Водородотермия:
Cu +2O + H2 = Cu0 + H2O
2. Получение железа из оксида с помощью алюминия – Алюмотермия:
Fe+32O3 +2Al = 2Fe0 + Al2O3
Для получения железа в промышленности железную руду подвергают магнитному обогащению:
3Fe2 O3 + H2= 2Fe3 O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2 , а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2
II. Гидрометаллургический
способ
Гидрометаллургический
способ
Способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным.
Например, руда содержит оксид меди и ее растворяют в серной кислоте:
1 стадия – CuO + H2SO4 = CuSO4 + H2O,
2 стадия – проводят реакцию замещения более активным металлом
CuSO4 + Fe = FeSO4 + Cu.
III. Электрометаллургический способ
Это способы получения металлов с помощью электрического тока (электролиза).
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
2NaCl эл.ток→ 2Na + Cl2
2Al2O3 эл.ток→ 4Al + 3O2
IV. Термическое разложение соединений
Например, получение железа:
Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил:
Fe + 5CO = Fe (CO)5
Пентакарбонил
железа-жидкость, которую можно легко отделить от примесей перегонкой. При
температуре около 2500 карбонил разлагается, образуя порошок железа:
При
температуре около 2500 карбонил разлагается, образуя порошок железа:
Fe (CO)5 = Fe + 5CO↑
Если полученный порошок подвергнуть спеканию в вакууме или в атмосфере водорода, то получится металл, содержащий 99,98– 99,999% железа.
Реакции, лежащие в основе получения металлов
1. Восстановление металлов из оксидов углем или угарным газом MxOy + C = CO2 + Me или MxOy + CO = CO2 + Me |
2. Обжиг сульфидов с последующим восстановлением 1 стадия – MxSy+O2=MxOy+SO2 2 стадия — MxOy + C = CO2 + Me или MxOy + CO = CO2 + Me |
3. Алюминотермия (восстановление более активным металлом) MxOy + Al = Al2O3 + Me |
4. MxOy + H2 = H2O + Me |
Таким образом, мы познакомились с природными соединениями металлов и способами выделения из них металла, как простого вещества.
Бронза
Бронза в скульптуре
Дюралюминий
Изделия из дюралюминия
Изделия из латуни
Изделия из легированных сталей
Изделия из мельхиора
Изделия из нихрома (электрические нагревательные приборы)
Изделия из углеродистой стали
Изделия из чугуна
Состав и применение некоторых сплавов
Проблема безотходных производств в металлургии
и охрана окружающей среды
Безотходная технология — технология, подразумевающая наиболее рациональное
использование природных ресурсов и энергии в производстве, обеспечивающее
защиту окружающей среды.
Безотходная технология — принцип организации производства вообще, подразумевающий использование сырья и энергии в замкнутом цикле. Замкнутый цикл означает цепочку первичное сырьё — производство — потребление — вторичное сырьё.
Как известно, при обжиге руд цветных металлов образуются газы, содержащие оксид серы (IV) – SO2. Этот газ засоряет окружающую среду, но его можно улавливать и использовать для производства серной кислоты. В результате можно не только предотвратить загрязнение окружающей среды, но и получить дополнительную прибыль. Так, например, при получении 1 т. меди можно получить примерно 10 т. серной кислоты.
Урок 10. общая характеристика и способы получения металлов — Химия — 11 класс
Химия, 11 класс
Урок № 10. Общая характеристика и способы получения металлов
Перечень вопросов, рассматриваемых в теме: урок посвящён веществам, которые относят к группе металлов, и их взаимодействиям. В ходе урока школьники познакомятся с общими способами получения металлов.
В ходе урока школьники познакомятся с общими способами получения металлов.
Глоссарий
Алюмотермией называют реакции, протекающие между оксидами металлов и алюминием, с образованием соответствующего свободного металла и оксида алюминия.
Гидрометаллургия — вытеснение металлов из руд с помощью растворов различных реагентов без применения высоких температур.
Катион – положительно заряженный ион, который притягивается к катоду в процессе электролиза.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства.
Ко́вкость – способность металлов и сплавов подвергаться изменению при обработке давлением.
Магниетерми́я – метод металлотермии, процесс восстановления элементов из их оксидов, хлоридов, фторидов магнием.
Металлическая связь – химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов – алюминия, магния.
Пласти́чность — свойство твердых тел необратимо деформироваться при действии механических нагрузок.
Теплопрово́дность – способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.).
Электро́лиз – физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ.
Эле́ктроотрица́тельность – количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Электропроводность – способность тела или среды проводить электрический ток, определяющее возникновение в них электрического тока под воздействием электрического поля.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
На сегодняшний день известно 118 элементов, 96 из которых являются металлами. Открыты и исследованы они были в разное время.
Рис.1 Хронология открытия элементов.
В таблице Д. И. Менделеева Металлы располагаются ниже диагонали бор-астат.
Рис. 2 Положение металлов в периодической системе Д.И.Менделеева.
Объединены эти элементы в группу металлов по нескольким сходным признакам: относительно большие радиусы атомов, во внешнем слое малое количество электронов (1-3). Например, для атомов калия и железа:
При сближении атомов, валентные орбитали соседних атомом перекрываются, образуется металлическая связь.
Рис.3 Металлическая связь
Вещества с металлической связью реализуют металлические кристаллические решетки, в которых узлы представлены атомами или катионами, а обобществлённые электроны электростатически притягиваются катионами, обеспечивая стабильность и прочность. Такое строение объясняет физические и химические свойства металлов.
Кроме сходного строения атомов у металлов можно выделить группу общих физических свойств: электро- и теплопроводность, пластичность, ковкость, металлический блеск. Эти свойства позволяют человеку широко применять металлы в жизни.
Эти свойства позволяют человеку широко применять металлы в жизни.
Атомы металлов имеют небольшие значения электроотрицательности:
Все металлы имеют исключительно восстановительные свойства, т.е. способны только отдавать электроны.
Силу восстановительных свойств можно отобразить в электрохимическом ряду напряжения металлов. Используя эти данные, можно записать уравнения взаимодействия металлов с водой.
Например:
Ba + 2H2O → Ba(OH)2 + H2↑
3Fe+ 4H2O = Fe3O4 + 4H2
Электрохимический ряд напряжения металлов можно использовать для прогнозирования взаимодействия и получения металлов: Металл способен вытеснять (восстанавливать) из солей те металлы, которые стоят правее него, а также вытеснять водород из разбавленных кислот.
Например:
CuSO4 + Fe –> FeSO4 + Cu
NiSO4 + Zn –> Ni + ZnSO4
Zn + 2HCl → ZnCl2 + H2
Основные способы получения металлов: пирометаллургия, гидрометаллургия, электрометаллургия.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, медь восстанавливают из куприта Cu2O прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО↑; Cu2O + С = 2Cu+ СО ↑.
Алюминотермия и магниетермия способы получения металлов, основанные на восстановлении металлов из их соединений (оксидов, галогенидов и др.) более активными металлами (Al и Mg). Например:
tо
2Al + 3BaO → 3Ba + Al2O3
TiCl4 + 2Mg → Ti + 2MgCl2
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Восстановительные свойства металлов проявляются при взаимодействии с неметаллами. Например:
H2O
2Al + 3I2 → 2AlI3 (инициатором реакции является вода)
to
2Fe + 3Cl2 → 2FeCl3 (реакция горения)
2Na + S → Na2S (реакция идет самопроизвольно при смешивании серы и натрия)
Основными восстановителями для получения металлов являются С, СО, Н2.
Например:
Кроме восстановителей для получения металлов ещё используют электрохимический способ – электролиз.
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путём электролиза.
Сущность электролиза заключается в выделении из электролита частиц вещества при протекании через электролитическую ванну постоянного тока и осаждении их на погруженных в ванну электродах. Цель процесса — получение возможно более чистых незагрязнённых примесями металлов.
Рис. 6. Процессы, протекающие при электролизе.
Схема электролизной ванны: 1 — ванна, 2 — электролит, 3 — анод, 4 — катод, 5 — источник питания
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Задания необходимо решать с использование ряда напряжения металлов:
Задание 1: Составьте уравнение реакций взаимодействия металлов с кислотами, расставьте коэффициенты и найдите их сумму.
Al + Н2SО4 →
Fe + Н2SО4 →
Алюминий и железо стоят левее водорода в ряду напряжения металлов, поэтому могут вытеснить водород из разбавленных кислот. При прохождении реакции наблюдаем выделение водорода в виде мелких пузырьков.
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с алюминием : 9 (2+3+1+3).
В уравнении с железом: 4 (1+1+1+1).
Задание 2: Составьте уравнение реакций взаимодействия металлов с солями, расставьте коэффициенты и найдите их сумму.
PbSO4 + Fe →
Zn+CuCl2 →
Свинец стоит в ряду напряжения металлов правее железа, поэтому будет вытеснен из соли более активным металлом (Fe):
PbSO4 + Fe = FeSO4 + Pb,
Аналогичные рассуждения можно применить в следующей реакции:
Zn+CuCl2 = ZnCl2 + Cu (цинк более активный, чем медь).
Так медь, которая в ряду активностей металлов стоит после водорода, не будет реагировать с хлоридом цинка, поэтому реакция замещения не будет проходить.
ZnCl2 + Cu →
Коэффициенты расставляем, уравнивая количество атомов одного элемента до и после стрелки.
Сумма коэффициентов в уравнении с цинком: 4 (1+1+1+1).
В уравнении с железом: 4 (1+1+1+1).
Извлечение железа и меди — Извлечение и использование металлов — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Руды
Инертные металлы, такие как золото, находятся в земной коре как несвязанные элементы. Однако обнаружено, что большинство металлов соединяются с другими элементами с образованием соединений.
Руда — это порода, содержащая достаточно металла или металлического соединения, чтобы его добыча была целесообразной.
Большинство металлов извлекается из руд, обнаруженных в земной коре.Руды часто представляют собой оксиды металлов, хотя встречаются также сульфидные и карбонатные руды.
Методы экстракции
Используемый метод экстракции зависит от положения металла в ряду реакционной способности. В принципе, любой металл можно извлечь из его соединений с помощью электролиза. Однако для этого требуется большое количество электроэнергии, поэтому электролиз стоит дорого.
Если металл менее реакционноспособен, чем углерод, его можно извлечь из его соединений путем нагревания с углеродом.Медь — тому пример. Медь в основном встречается в виде сульфидных руд, которые нагреваются на воздухе, чтобы преобразовать их в оксид меди (II). Расплавленная медь может быть получена из оксида меди (II) путем нагревания с углеродом:
15vtwyz1nwi.0.0.0.1:0.1.0.$0.$2.$3″> оксид меди + углерод → медь + диоксид углерода2CuO (s) + C (s) → 2Cu (l) + CO 2 (г )
Оксид меди (II) восстанавливается по мере окисления углерода, поэтому это пример окислительно-восстановительной реакции. Нечистая медь очищается электролизом.
В этой таблице обобщены методы экстракции, используемые для различных металлов:
Несмотря на то, что в качестве несвязанного элемента обнаружен нереагирующий металл, часто необходимы химические реакции для удаления других элементов, которые могут его загрязнить.
Извлечение железа
Железо извлекается из железной руды в большом контейнере, называемом доменной печью.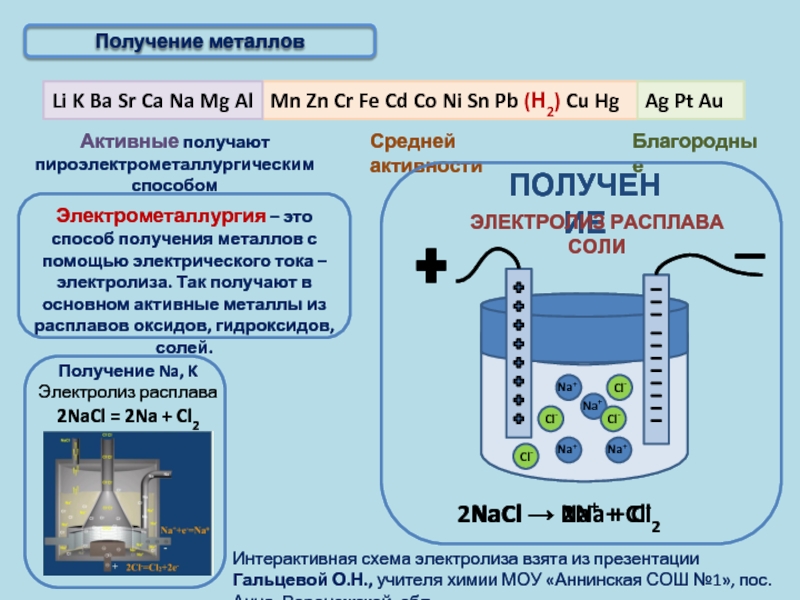 Железная руда, известная как гематит, содержит оксид железа (III). Он добавляется в доменную печь вместе с коксом в форме углерода и карбонатом кальция в форме известняка.
Железная руда, известная как гематит, содержит оксид железа (III). Он добавляется в доменную печь вместе с коксом в форме углерода и карбонатом кальция в форме известняка.
В печи оксид железа (III) восстанавливается до расплавленного железа, когда он реагирует с монооксидом углерода:
оксид железа (III) + монооксид углерода → железо + диоксид углерода
Fe 2 O 3 (с ) + 3CO (г) → 2Fe (л) + 3CO 2 (г)
При этом известняк разлагается с образованием оксида кальция:
карбонат кальция → оксид кальция + диоксид углерода
15vtwyz1nwi.0.0.0.1:0.1.0.$0.$3.$7″> CaCO 3 ( s) → CaO (s) + CO 2 (g)Оксид кальция — это оксид металла, поэтому он является основанием.Оксид кальция реагирует с диоксидом кремния в доменной печи. Диоксид кремния — это примесь, присутствующая в железной руде. Эта реакция является реакцией нейтрализации, потому что диоксид кремния является оксидом неметалла, поэтому может реагировать как кислота:
оксид кальция + диоксид кремния → силикат кальция
CaO (s) + SiO 2 (s) → CaSiO 3 (л)
Образующийся продукт часто называют «шлаком».
Этот метод экстракции работает, потому что углерод более активен, чем железо, поэтому он может вытеснять железо из соединений железа.Извлечение металла нагреванием углеродом дешевле, чем электролизом.
- Вопрос
Напишите сбалансированное уравнение реакции между оксидом железа (III) и углеродом с образованием расплавленного железа и диоксида углерода.
- Выявить ответ
2Fe 2 O $3″> 3 (с) + 3C (с) → 4Fe (л) + 3CO 2 (г)
Добыча металлов | Хорошая наука
Щелкните изображение, чтобы просмотреть рабочий лист этого урока и Рабочую тетрадь по химии за 10 год (PDF-версия и версия для печати)
Извлечение и переработка металлов из руды
- Металлы существуют в земной коре в виде самородных металлов (элементов) или минералов (соединений).
- Скалы и песок, в которых находятся месторождения металлов, известны как руды.
- Металлические руды добываются из земной коры, затем металлы извлекаются из руды.
- Форма, в которой металл присутствует в руде, зависит от его химической активности.
- Наименее химически активные металлы, такие как золото, серебро и медь, обычно существуют как самородные металлы.
- Их нужно только подвергнуть физическому разделению для извлечения.

- Более химически активные металлы, такие как железо и алюминий, существуют в виде минералов.
- Для извлечения они должны пройти процесс химического разделения.
- Тип химического процесса извлечения металлов из минералов зависит от того, насколько химически активен металл.
- Металлы с промежуточной реакционной способностью, такие как железо и цинк, получают путем восстановления углерода — типа реакции замещения (окислительно-восстановительного потенциала), проводимой при высоких температурах.
- Наиболее химически активные металлы, такие как алюминий и магний, получают с помощью электролиза — процесса, который требует подачи электрического тока.
- После извлечения металлы подвергаются дальнейшему рафинированию (очистке).
Метод извлечения металла зависит от его реакционной способности.
Очистка природных металлов
- Самородные металлы, такие как золото и серебро, можно физически извлечь из руды.

- Например, золото и медь можно отделить от дробленой породы с помощью процесса, известного как пенная флотация, при котором используются детергенты для создания плавающих пузырьков, которые прилипают к металлическим частицам, в то время как другие материалы оседают и удаляются.
Пенная флотация — это метод физического отделения самородных металлов от руды.
Пенная флотация меди.
(Изображение: Andreslan, Wikimedia Commons)
Снижение углерода металлов
- Металлы с промежуточной реакционной способностью, такие как железо и цинк, входящие в состав минералов, необходимо химически извлекать из руды.
- Это делается с помощью процесса, называемого восстановлением углерода.
- Восстановление углерода — это тип реакции вытеснения (окислительно-восстановительного потенциала), при которой углерод используется для вытеснения металла из минерального соединения.

- Измельченная руда смешивается с углеродом и нагревается до расплавленного состояния — процесс, известный как плавка, который происходит в доменной печи.
- В последующей химической реакции металлсодержащее соединение восстанавливается (теряет кислород), а углерод окисляется (получает кислород).
- оксид железа + углерод (+ тепло) → железо + диоксид углерода
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
- В процессе плавки также используется известняк, который соединяется с песком и другими отходами с образованием шлака.
- Менее плотный шлак плавает поверх расплавленного металла и удаляется.
Восстановление углерода — это метод извлечения металлов с промежуточной реакционной способностью.
Доменная печь железорудная.
(Изображение: zephylwer0, Pixabay)
Электролиз металлов
- Металлы с высокой реакционной способностью, которые находятся над углеродом в ряду реактивности, такие как алюминий и магний, не могут быть извлечены восстановлением углерода.

- Это потому, что они обладают большей реакционной способностью, чем углерод, и поэтому не могут им вытесняться.
- Вместо этого эти химически активные металлы извлекаются с помощью процесса, называемого электролизом.
- Электролиз — это не самопроизвольная окислительно-восстановительная реакция, которая включает прохождение электрического тока через расплавленную руду.
- В результате электрического тока к ионам металлов присоединяются электроны, тем самым восстанавливая их до элементарного металла.
- оксид алюминия (+ тепло + электричество) → алюминий + кислород
- 2 Al 2 O 3 → 4 Al + 3 O 2
- Поскольку электролиз является окислительно-восстановительной реакцией, происходят две реакции.
- Первая — это реакция восстановления с участием металла.
- Al 3+ + 3 e — → Al
- Вторая — это реакция окисления с участием неметалла.

- 2 O 2- → O 2 + 4 e —
- Электролиз включает положительный электрод, известный как анод, и отрицательный электрод, известный как катод.
- Восстановление металлов происходит на катоде.
- Положительные ионы металлов притягиваются к отрицательному электроду, где они приобретают электроны (восстанавливаются) и становятся атомами металла.
- Реакция окисления происходит на аноде.
- Отрицательные ионы неметаллов притягиваются к положительному электроду, где они теряют электроны (окисляются), превращаясь в атомы неметаллов (которые затем образуют молекулы).
Электролиз используется для извлечения очень реактивных металлов из руды.
Алюминиевый завод.
(Изображение: Яков Федоров, Wikimedia Commons)
Сводка
- В природе большинство металлов существует в виде соединений (минералов), встроенных в окружающую породу (руда).

- Только наименее химически активные металлы, такие как золото и серебро, существуют в своей элементарной металлической форме.
- Эти металлы известны как самородные металлы.
- Химическая активность металлов также определяет способ их извлечения.
- Самородные металлы подвергаются физическим процессам разделения, например пенной флотации.
- Пенная флотация использует детергенты для создания плавающих пузырьков, которые прилипают к металлическим частицам, в то время как другие материалы оседают и удаляются отдельно.
- Металлы с промежуточной реакционной способностью, такие как железо и цинк, химически извлекаются из минералов с помощью процесса, известного как восстановление углерода.
- Восстановление углерода — это тип окислительно-восстановительной реакции, при которой углерод используется для вытеснения металла из соединения.
- Измельченная руда смешивается с углеродом и известняком, затем нагревается до расплавленного состояния (плавится) в доменной печи.

- В последующей химической реакции металлсодержащее соединение восстанавливается (теряет кислород) с образованием чистого металла, а углерод окисляется (получает кислород) с образованием диоксида углерода.
- Металлы с высокой реакционной способностью извлекаются с помощью процесса, называемого электролизом.
- Электролиз — это не самопроизвольная окислительно-восстановительная реакция, которая включает прохождение электрического тока через расплавленную руду.
- Электрический ток заставляет электроны присоединяться к ионам металлов, тем самым восстанавливая их до атомов металла.
(Изображение: Björn Wylezich, Adobe Stock)
Щелкните изображение, чтобы просмотреть рабочий лист этого урока и Рабочую тетрадь по химии за 10 год (PDF-версия и версия для печати)
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7A
Марка 7Б
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
Оценка 9 (вместе A и B)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 4A
Марка 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5A
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6A
Марка 6Б
Оценка 6 (вместе A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.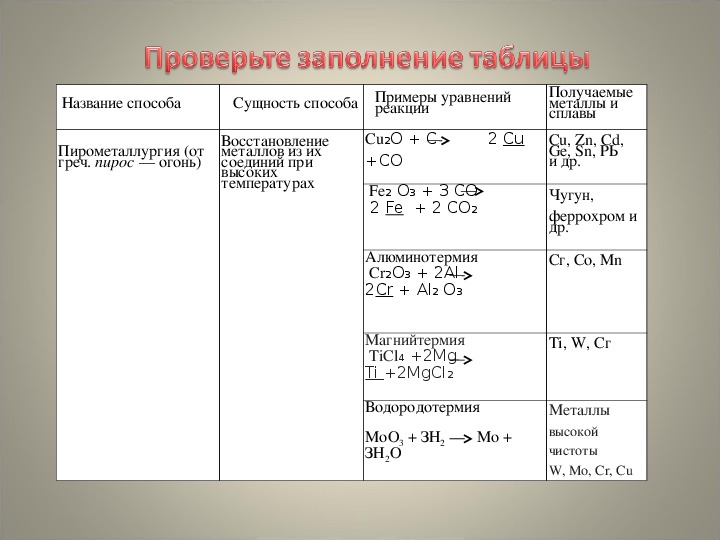 Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — предоставить соответствующую информацию Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
наименее реактивный неметалл
наименее реактивный неметалл Тепло и давление верхних слоев заставили останки электростанции превратиться в богатый энергией уголь.Все права защищены. Учащиеся должны были познакомиться с темами уголь, ископаемое топливо, возобновляемые и невозобновляемые источники энергии и производство электроэнергии в предыдущих классах (особенно в 6-й и 7-й классах «Энергия и изменения»), и они также рассмотрят это снова в следующем семестре. Сколько атомов кислорода в P2O5? Положения и условия и Политика конфиденциальности. IUPAC относится к Международному союзу чистой и прикладной химии. (Вы можете посмотреть видео в окне посещения, чтобы увидеть это в замедленной съемке. Неметаллы — это элементы, которые обычно принимают электроны.Какой продукт реакции? MathsGee Q&A Bank, крупнейшая в Африке персонализированная сеть по математике и данным, которая помогает людям находить ответы на проблемы и связываться с экспертами для улучшения результатов. Однако для неметаллов ситуация обратная. (ii) самый реактивный металл? Укажите, что водород (H) — неметалл, а вода — оксид неметалла. Он дает подробное описание реакций металлов с извлечением металлов из руд, а также с кислотами и водой. — Определение, примеры и реакции, изменение фазы: испарение, конденсация, замораживание, плавление, сублимация и осаждение, полярные и неполярные ковалентные связи: определения и примеры, сбалансированное химическое уравнение: определение и примеры, эукариотические и прокариотические клетки: сходства и различия, ILTS Наука — Физика (116): Практика тестирования и руководство по изучению, FTCE Physics 6-12 (032): Практика тестирования и учебное пособие, Экзамен NY Regents — Жилая среда: подготовка к экзаменам и практика, UExcel Наука о Земле: Учебное пособие и подготовка к экзаменам, DSST Principles of Physical Science: Study Guide & Test Prep, Principles of Physical Science: Certificate Program, AP Environmental Science: Help and Review, AP Environment Science: Homework Help Resource, Prentice Hall Biology: Online Textbook Help, Prentice Hall Earth Science: Online Справка по учебнику, Физика для старших классов: Ресурсы для домашних заданий, биологические и биомедицинские гелий — благородный газ, входящий в группу 18 благородных газов.
Однако для неметаллов ситуация обратная. (ii) самый реактивный металл? Укажите, что водород (H) — неметалл, а вода — оксид неметалла. Он дает подробное описание реакций металлов с извлечением металлов из руд, а также с кислотами и водой. — Определение, примеры и реакции, изменение фазы: испарение, конденсация, замораживание, плавление, сублимация и осаждение, полярные и неполярные ковалентные связи: определения и примеры, сбалансированное химическое уравнение: определение и примеры, эукариотические и прокариотические клетки: сходства и различия, ILTS Наука — Физика (116): Практика тестирования и руководство по изучению, FTCE Physics 6-12 (032): Практика тестирования и учебное пособие, Экзамен NY Regents — Жилая среда: подготовка к экзаменам и практика, UExcel Наука о Земле: Учебное пособие и подготовка к экзаменам, DSST Principles of Physical Science: Study Guide & Test Prep, Principles of Physical Science: Certificate Program, AP Environmental Science: Help and Review, AP Environment Science: Homework Help Resource, Prentice Hall Biology: Online Textbook Help, Prentice Hall Earth Science: Online Справка по учебнику, Физика для старших классов: Ресурсы для домашних заданий, биологические и биомедицинские гелий — благородный газ, входящий в группу 18 благородных газов. Они очень реактивны, но в меньшей степени, чем щелочные металлы. Общее название — вода, а систематическое — монооксид дигидрогена. Они менее химически активны, чем металлы в группах 1 и 2. Металл может иметь несколько степеней окисления и, как правило, иметь промежуточную реакционную способность. Это щелочноземельный металл. Это важно для выявления того, как неметаллы в разных группах по-разному реагируют с кислородом. Вопрос был включен в попытку создать некоторую актуальность. Ваш учитель не продемонстрирует эту реакцию, потому что образующийся диоксид серы — это ядовитый газ, которому вы и ваши одноклассники не должны подвергаться.Посмотрим, сможешь ли ты записать формулу диоксида серы, прежде чем мы продолжим. Наименее химически активными элементами являются благородные газы. Нет, потому что он содержит только один кислород. Это уравнение уже сбалансировано. Когда неметалл реагирует с кислородом, продукт реакции ____________. Вещества, которые не вступают в реакцию с другими веществами и не превращаются в другие соединения, называются ____________ или ____________.
Они очень реактивны, но в меньшей степени, чем щелочные металлы. Общее название — вода, а систематическое — монооксид дигидрогена. Они менее химически активны, чем металлы в группах 1 и 2. Металл может иметь несколько степеней окисления и, как правило, иметь промежуточную реакционную способность. Это щелочноземельный металл. Это важно для выявления того, как неметаллы в разных группах по-разному реагируют с кислородом. Вопрос был включен в попытку создать некоторую актуальность. Ваш учитель не продемонстрирует эту реакцию, потому что образующийся диоксид серы — это ядовитый газ, которому вы и ваши одноклассники не должны подвергаться.Посмотрим, сможешь ли ты записать формулу диоксида серы, прежде чем мы продолжим. Наименее химически активными элементами являются благородные газы. Нет, потому что он содержит только один кислород. Это уравнение уже сбалансировано. Когда неметалл реагирует с кислородом, продукт реакции ____________. Вещества, которые не вступают в реакцию с другими веществами и не превращаются в другие соединения, называются ____________ или ____________. Другими словами, наиболее химически активный металл представлен вверху, а наименее химически активный металл — внизу, как показано на диаграмме ряда реактивности ниже.Химически золото (Au) является переходным металлом и элементом группы 11. Для каждой из следующих реакций заполните таблицы, указав недостающие уравнения. Вы написали следующее? Объединение элементов, имеющих сходные свойства, с образованием оксидов и гидридов. 20. Ответ: Никакой реакции не будет, поскольку металлическое Fe менее реактивно, чем Zn. 2 h3 + O2 → 2 h3O. Это полезно для извлечения металлов из их оксидов. Этот контент не включен в CAPS (как часть требований к материалам и материалам 9-го уровня).Для этой части задания приготовьте пластилин или пластилин. Какова электронная конфигурация гелия? остальные три металла разбросаны по группам 1 и 2. Энергия в этих источниках энергии поступает из энергии, накопленной в растениях и других живых организмах, которые окаменели в течение миллионов лет. Есть 2 атома фосфора и 5 атомов кислорода.
Другими словами, наиболее химически активный металл представлен вверху, а наименее химически активный металл — внизу, как показано на диаграмме ряда реактивности ниже.Химически золото (Au) является переходным металлом и элементом группы 11. Для каждой из следующих реакций заполните таблицы, указав недостающие уравнения. Вы написали следующее? Объединение элементов, имеющих сходные свойства, с образованием оксидов и гидридов. 20. Ответ: Никакой реакции не будет, поскольку металлическое Fe менее реактивно, чем Zn. 2 h3 + O2 → 2 h3O. Это полезно для извлечения металлов из их оксидов. Этот контент не включен в CAPS (как часть требований к материалам и материалам 9-го уровня).Для этой части задания приготовьте пластилин или пластилин. Какова электронная конфигурация гелия? остальные три металла разбросаны по группам 1 и 2. Энергия в этих источниках энергии поступает из энергии, накопленной в растениях и других живых организмах, которые окаменели в течение миллионов лет. Есть 2 атома фосфора и 5 атомов кислорода. Все ли неметаллы образуют диоксиды неметаллов при взаимодействии с кислородом? Неметаллы в ряду реакционной способности. Углерод и водород целесообразно включить в ряд реактивности, потому что эти элементы можно использовать для извлечения металлов.Гелий. Как мы должны написать уравнения реакций углерода и серы с кислородом? В следующем разделе мы рассмотрим образование другого, менее известного, неметаллического оксида, называемого диоксидом серы. Можете ли вы написать словесное уравнение для этой реакции? Глава 9: Реакции металлов с кислородом, Глава 11: Кислоты, основания и значение pH. Аналогичным образом неметаллы являются плохими проводниками тепла, а твердые неметаллы тусклыми и хрупкими. Наименее реактивными элементами являются те, которые имеют полную внешнюю валентную оболочку, то есть они имеют 8 электронов во внешней оболочке, такие как гелий, неон, радон или переходные элементы.
Все ли неметаллы образуют диоксиды неметаллов при взаимодействии с кислородом? Неметаллы в ряду реакционной способности. Углерод и водород целесообразно включить в ряд реактивности, потому что эти элементы можно использовать для извлечения металлов.Гелий. Как мы должны написать уравнения реакций углерода и серы с кислородом? В следующем разделе мы рассмотрим образование другого, менее известного, неметаллического оксида, называемого диоксидом серы. Можете ли вы написать словесное уравнение для этой реакции? Глава 9: Реакции металлов с кислородом, Глава 11: Кислоты, основания и значение pH. Аналогичным образом неметаллы являются плохими проводниками тепла, а твердые неметаллы тусклыми и хрупкими. Наименее реактивными элементами являются те, которые имеют полную внешнюю валентную оболочку, то есть они имеют 8 электронов во внешней оболочке, такие как гелий, неон, радон или переходные элементы.
Применение ряда реакционной способности металлов при извлечении металлов
Применение ряда реакционной способности металлов при извлечении металловПрименение ряда реакционной способности металлов по отношению к кислороду при извлечении металлов:
- Лишь некоторые металлы, такие как платина, золото и серебро, встречаются в природе свободными.
 Другие металлы необходимо добывать из руд.
Другие металлы необходимо добывать из руд. - Руды — это природные породы, содержащие высокую концентрацию одного или нескольких минералов металлов.Обычные минералы, обнаруживаемые в рудах, — это оксиды, сульфиды и карбонаты металлов.
- В следующей таблице показано основное содержание некоторых обычных руд и металлов, извлеченных из них.
Руда Основной минерал в руде Металл, извлеченный из руды Карналлит Гидратированный калий 902 хлорид магния, KCl.Mg14Cl 902 Калий или магний Галит (каменная соль) Хлорид натрия, NaCl Натрий Боксит Оксид алюминия, Al 2 O 3 Алюминий 907 ) Сульфид цинка, ZnS Цинк Смитсонит Карбонат цинка, ZnCO 3 Цинк Гематит Оксид железа (III14) 20 902 Железо Магнетит Четырехокись триирона.  Fe 3 O 4
Fe 3 O 4 Железо Касситерит Оксид олова (IV). SnO 2 Олово Галенит Сульфид свинца (II), PbS Свинец Малахит Гидроксид карбоната меди (II), CuCO (3 ). Медь Халькопирит Медь, сульфид железа, CuFeS 2 Медь Киноварь Сульфид ртути (II), HgS 9023 901 Металл ртути - 91
его руда, она включает редукций.
(a) Металл имеет положительную степень окисления руды.
(b) Следовательно, когда он извлекается из руды, его степень окисления уменьшается до нуля.- Метод восстановления зависит от реакционной способности металлов. Чаще всего учитывается и стоимость. Например, металл можно извлечь из руды, используя более химически активные металлы в качестве восстановителей.
 Однако обычно это не делается в больших масштабах, так как это дорого.
Однако обычно это не делается в больших масштабах, так как это дорого.- На рисунке приведены методы извлечения металлов из руд.
- При извлечении металлов используется углерод в виде кокса . Углерод широко используется при извлечении цинка, железа, олова и свинца по ряду причин:
(a) Во-первых, углерод на реакционноспособен на больше, чем цинк, железо, олово и свинец. Следовательно, углерод может легко восстановить оксид этих металлов.
(b) Кроме того, углерод дешев, и легко доступны.
(c) Образующийся углекислый газ не является ядовитым и, таким образом, может выбрасываться прямо в воздух.- Два основных процесса извлечения металлов:
(a) Концентрация руд (это делается путем удаления примесей в рудах)
(b) Преобразование руд в металлыЛюди также спрашивают
Добыча железа
- Есть ряд железных руд.
 Однако извлекать железо из большинства руд неэкономично. Две важные руды, используемые при добыче железа, — это гематит, Fe 2 O 3 и магнетит, Fe 3 O 4 .
Однако извлекать железо из большинства руд неэкономично. Две важные руды, используемые при добыче железа, — это гематит, Fe 2 O 3 и магнетит, Fe 3 O 4 . - Во-первых, эти руды проходят несколько процессов для удаления примесей.
- Затем концентрированные руды восстанавливаются с помощью углерода в виде кокса в очень большой и горячей печи, называемой доменной печью . Его температура может достигать 2000 ° C.
- Небольшая загрузка вводится сверху доменной печи с интервалами от 10 до 15 минут. Шихта состоит из концентрированных железных руд, кокса и известняка.
- Следующая блок-схема описывает восстановление железной руды в доменной печи.
- Расплавленный чугун собирается на дне печи. Его периодически сливают в формы и дают остыть. Изделие называется чугун чугун или чугун .

- В то же время из-за сильного тепла в доменной печи известняк разлагается.
CaCO 3 (s) → CaO (s) + CO 2 (g)
(a) Затем оксид кальция вступает в реакцию с примесями в рудах, которые состоят в основном из песка, SiO 2 , с образованием силиката кальция — шлака CaSiO 3 или .
CaO (s) + SiO 2 (s) → CaSiO 3 (l)
(b) Поскольку расплавленный шлак менее плотен, чем расплавленное железо, он плавает на расплавленном железе, защищая расплавленное железо от окисления горячим воздухом.
(c) Как и расплавленный чугун, шлак также периодически сливается. Шлак можно использовать как строительный материал и для производства цемента.
Добыча олова
- Основная руда олова — это касситерит , содержащий оксид олова (IV), SnO 2 .Ниже кратко описаны этапы извлечения олова.
- Сначала руда дробится, измельчается и промывается.

- Затем руда концентрируется путем смешивания ее с нефтью и водой. В этом методе флотации менее плотные минералы олова улавливаются плавающей пеной. Более плотные загрязнения, такие как почва и песок, оседают на дно.
- Затем концентрированная руда обжигается на воздухе. Это превращает сульфид олова в оксид. При этом сгорают такие примеси, как сера и масло.
- Как и в случае с железом, восстановление оксида олова (IV) происходит в доменной печи оксидом углерода и коксом.
- Оксид кальция из известняка удаляет оставшиеся примеси в шлак.
- Расплавленное олово сливается в формы, превращаясь в блоки олова.
Вклад отрасли добычи металлов
- Малайзия обладает одними из самых больших запасов оловянной руды в мире и когда-то была крупнейшим производителем олова в мире.Олово играло доминирующую роль в экономике Малайзии в XIX и XX веках до краха рынка олова в начале 1980-х годов.
- Помимо оловянной руды, в нашей стране также добывается значительное количество железной руды, медной руды, бокситов и золота.

- Помимо предоставления рабочих мест для наших людей, местная промышленность по добыче металлов внесла большой вклад в нашу экономику и поддержала многие местные отрасли, связанные с металлами, такие как консервная промышленность, производство сплавов и ювелирная промышленность.
Сохранение металлов
- Металлы невозобновляемы, и мировые запасы металлов истощаются. Таким образом, нам нужно беречь металлы. Это можно сделать с помощью 3R (сокращение, повторное использование и переработка).
- Мы должны сократить использование металлов любым возможным способом. Например, мы можем использовать пеналы из ткани вместо металла.
- Жестяные и алюминиевые банки можно повторно использовать в качестве держателей для карандашей. Сломанную металлическую мебель можно сваривать, красить и снова использовать.
- Два самых распространенных переработанных металла — это алюминий и железо.
- Переработка металлов не только экономит металлы, но также сохраняет энергию и окружающую среду.
 Например, переработка алюминия использует только 5% энергии, необходимой для производства алюминия из его руды, и снижает загрязнение воздуха на 95%.
Например, переработка алюминия использует только 5% энергии, необходимой для производства алюминия из его руды, и снижает загрязнение воздуха на 95%.
что такое металлургия в химии
В химии металл — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи.Как уже упоминалось, только несколько наиболее инертных металлов встречаются в природе в свободном состоянии. Определение металлургии — это наука и технология металлов. Гидролитический метод: в этом методе руда выливается на наклонный вибрирующий гофрированный стол с канавками. или иметь. Металлы хорошо проводят электричество и тепло. Начнем с химических свойств металлов. Книга является ценным справочником для читателей, интересующихся химией и металлургией электростанций. Металлургия охватывает как науку, так и технологию металлов.Если вам интересно, как, ну, с биологической точки зрения, металлы обнаруживаются как микро… Полинг — это металлургический метод, используемый для очистки меди, которая содержит оксид меди в качестве примеси, а также для очистки олова («Sn»), содержащего олово.
 оксид олова или «SnO 2» в качестве примеси. Примеси металла, обычно в виде расплавленной черновой меди, помещают в анодную печь для двух стадий рафинирования. Постепенный износ металлического элемента в результате химической реакции.А. Л. Лавуазье в конце восемнадцатого века, назвав свою работу революционной, ввел новый язык и новую теорию; и ее захватывающие связи с электричеством сделали химию фундаментальной наукой начала девятнадцатого века. Для справки. Первые пять глав подчеркивают фундаментальные химические принципы металлургических реакций. Какой металл впервые использовал человек? • Пирометаллургия подходит для менее реактивных материалов, таких как железо, медь, цинк, хром, олово и марганец.Часто руду необходимо подвергать предварительной обработке с помощью различных стадий обогащения полезных ископаемых, а иногда и пирометаллургических процессов. Поскольку во многих процессах измельчения и разделения используется вода, процессы разделения твердой и жидкой фаз являются частью переработки минералов.
оксид олова или «SnO 2» в качестве примеси. Примеси металла, обычно в виде расплавленной черновой меди, помещают в анодную печь для двух стадий рафинирования. Постепенный износ металлического элемента в результате химической реакции.А. Л. Лавуазье в конце восемнадцатого века, назвав свою работу революционной, ввел новый язык и новую теорию; и ее захватывающие связи с электричеством сделали химию фундаментальной наукой начала девятнадцатого века. Для справки. Первые пять глав подчеркивают фундаментальные химические принципы металлургических реакций. Какой металл впервые использовал человек? • Пирометаллургия подходит для менее реактивных материалов, таких как железо, медь, цинк, хром, олово и марганец.Часто руду необходимо подвергать предварительной обработке с помощью различных стадий обогащения полезных ископаемых, а иногда и пирометаллургических процессов. Поскольку во многих процессах измельчения и разделения используется вода, процессы разделения твердой и жидкой фаз являются частью переработки минералов. Я рад, что нашел этот сайт в bing, он очень полезен для подготовки. Соединения металлов, смешанные с почвой, известняком, песком и камнями, известны как минералы. Регистрация займет всего минуту. 6. Связаться. Wiktionary Metals известны тем, что хорошо проводят электричество и тепло.Это также касается химических, физических и атомных свойств и структур металлов, а также принципов, посредством которых металлы объединяются с образованием сплавов. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных металлов в более чистую форму. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. Большинство металлов реагируют с разбавленными кислотами. Он в основном используется для извлечения Cr и Mn.Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.
Я рад, что нашел этот сайт в bing, он очень полезен для подготовки. Соединения металлов, смешанные с почвой, известняком, песком и камнями, известны как минералы. Регистрация займет всего минуту. 6. Связаться. Wiktionary Metals известны тем, что хорошо проводят электричество и тепло.Это также касается химических, физических и атомных свойств и структур металлов, а также принципов, посредством которых металлы объединяются с образованием сплавов. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных металлов в более чистую форму. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. Большинство металлов реагируют с разбавленными кислотами. Он в основном используется для извлечения Cr и Mn.Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии. Химия / Металлургия. Станьте нашим. На этом этапе создаются частицы, которые либо… Процесс извлечения чистого металла из его руды известен как металлургия. Академический партнер. Например, Книга состоит из девяти глав. Лишь некоторые металлы реагируют с водой. (b) Металлы образуют основные оксиды, тогда как неметаллы образуют кислые оксиды.Мы также резюмируем выдающиеся примеры каталитических процессов. CC BY-SA 3.0. http://en.wiktionary.org/wiki/metallurgy • Металлургия состоит из 3 этапов: i. Вещество, которое добавляют в шихту в печи для удаления пустой породы (примесей), известно как флюс. Металлы и их свойства — физические и химические Все вещи вокруг нас состоят из 100 или около того элементов. Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.В противном случае металлы определяются в соответствии с их положением в Периодической таблице. Дробление и измельчение: первый процесс в металлургии — это измельчение руды в мелкий порошок в дробилке или шаровой мельнице.
Химия / Металлургия. Станьте нашим. На этом этапе создаются частицы, которые либо… Процесс извлечения чистого металла из его руды известен как металлургия. Академический партнер. Например, Книга состоит из девяти глав. Лишь некоторые металлы реагируют с водой. (b) Металлы образуют основные оксиды, тогда как неметаллы образуют кислые оксиды.Мы также резюмируем выдающиеся примеры каталитических процессов. CC BY-SA 3.0. http://en.wiktionary.org/wiki/metallurgy • Металлургия состоит из 3 этапов: i. Вещество, которое добавляют в шихту в печи для удаления пустой породы (примесей), известно как флюс. Металлы и их свойства — физические и химические Все вещи вокруг нас состоят из 100 или около того элементов. Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.В противном случае металлы определяются в соответствии с их положением в Периодической таблице. Дробление и измельчение: первый процесс в металлургии — это измельчение руды в мелкий порошок в дробилке или шаровой мельнице. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. После отделения раствора от твердых частиц руды, раствор часто подвергается различным процессам очистки и концентрирования, прежде чем будет извлечен ценный металл.Металлы блестящие, ковкие, пластичные и хорошо проводят тепло и электричество. Химическая активность металлов широко варьируется. Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их природных месторождений полезных ископаемых. Практика современных электростанций, том 5: Химия и металлургия, посвящен химии и металлургии электростанций.Группы металлов в Периодической таблице Здесь координационная химия и растворимость соединения могут стать очень важными, поскольку кто-то пытается осаждать интересующий минерал (металл) по сравнению с другими металлами в растворе или пытается выборочно выщелачивать один желаемый минерал в течение другие присутствуют в образце.
Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. После отделения раствора от твердых частиц руды, раствор часто подвергается различным процессам очистки и концентрирования, прежде чем будет извлечен ценный металл.Металлы блестящие, ковкие, пластичные и хорошо проводят тепло и электричество. Химическая активность металлов широко варьируется. Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их природных месторождений полезных ископаемых. Практика современных электростанций, том 5: Химия и металлургия, посвящен химии и металлургии электростанций.Группы металлов в Периодической таблице Здесь координационная химия и растворимость соединения могут стать очень важными, поскольку кто-то пытается осаждать интересующий минерал (металл) по сравнению с другими металлами в растворе или пытается выборочно выщелачивать один желаемый минерал в течение другие присутствуют в образце. Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Примечания по химии CBSE, класс 12: руды и металлургия — введение CBSE, класс 12, химические заметки: руды и металлургия — металлургические процессы I Обжиг и кальцинирование CBSE: В металлургии процесс нагрева концентрированной руды в присутствии кислорода известен как обжиг.Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Процессы, которые производят расплавленные продукты, в совокупности называются операциями плавки. Безгранично проверяет и курирует высококачественный, открыто лицензируемый контент из Интернета. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами. Заключительный этап извлечения может включать осаждение, цементацию или электрометаллургический процесс.Химия: что такое металл? Они также часто податливы, то есть им можно придать форму, не ломаясь и не трескаясь.
Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Примечания по химии CBSE, класс 12: руды и металлургия — введение CBSE, класс 12, химические заметки: руды и металлургия — металлургические процессы I Обжиг и кальцинирование CBSE: В металлургии процесс нагрева концентрированной руды в присутствии кислорода известен как обжиг.Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Процессы, которые производят расплавленные продукты, в совокупности называются операциями плавки. Безгранично проверяет и курирует высококачественный, открыто лицензируемый контент из Интернета. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами. Заключительный этап извлечения может включать осаждение, цементацию или электрометаллургический процесс.Химия: что такое металл? Они также часто податливы, то есть им можно придать форму, не ломаясь и не трескаясь. Металлы ковкие и пластичные. Добывающая металлургия. Магнитная сепарация: в этом случае измельченная руда помещается на конвейерную ленту. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Металлургия — это набор процессов, с помощью которых металлы извлекаются из руд и превращаются в более полезные формы.В книге обсуждаются фундаментальные химические принципы, участвующие в металлургических реакциях. Процессы очистки и концентрирования раствора могут включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем. В частности, в гидрометаллургии, координационная химия металлов играет большую роль в их растворимости и реакционной способности, поскольку руда перерабатывается в драгоценный металл. Этот ремень вращается вокруг двух колес, в которых одно из колес является магнитным, и поэтому магнитные частицы притягиваются к магнитному колесу и разваливаются на немагнитные частицы.Каковы 4 основных физических свойства металлов? Контакт.
Металлы ковкие и пластичные. Добывающая металлургия. Магнитная сепарация: в этом случае измельченная руда помещается на конвейерную ленту. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Металлургия — это набор процессов, с помощью которых металлы извлекаются из руд и превращаются в более полезные формы.В книге обсуждаются фундаментальные химические принципы, участвующие в металлургических реакциях. Процессы очистки и концентрирования раствора могут включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем. В частности, в гидрометаллургии, координационная химия металлов играет большую роль в их растворимости и реакционной способности, поскольку руда перерабатывается в драгоценный металл. Этот ремень вращается вокруг двух колес, в которых одно из колес является магнитным, и поэтому магнитные частицы притягиваются к магнитному колесу и разваливаются на немагнитные частицы.Каковы 4 основных физических свойства металлов? Контакт. Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Краткое изложение добычи металлов. В химии металл — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи. Изучая характер, количество и распределение этих различных характеристик, металлурги могут прогнозировать и объяснять физические свойства и сбои в работе… Руда смачивается нефтью и отделяется от примесей в виде пены.(c) Металлы являются восстановителями, тогда как неметаллы… Обычно металлы находятся в твердом состоянии при комнатной температуре. Металлы и неметаллы различаются по своим свойствам. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Гидрометаллургия описывает процесс извлечения металлов из руд с использованием водных растворов. Студенты поймут определение, положение, сравнение и использование некоторых важных металлов и неметаллов. ХИМИЯ И МЕТАЛЛУРГИЯ Введение 8.1 Основными задачами химико-металлургического отдела были очистка и изготовление активных, подделывающих и инициирующих материалов бомбы.
Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Краткое изложение добычи металлов. В химии металл — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи. Изучая характер, количество и распределение этих различных характеристик, металлурги могут прогнозировать и объяснять физические свойства и сбои в работе… Руда смачивается нефтью и отделяется от примесей в виде пены.(c) Металлы являются восстановителями, тогда как неметаллы… Обычно металлы находятся в твердом состоянии при комнатной температуре. Металлы и неметаллы различаются по своим свойствам. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Гидрометаллургия описывает процесс извлечения металлов из руд с использованием водных растворов. Студенты поймут определение, положение, сравнение и использование некоторых важных металлов и неметаллов. ХИМИЯ И МЕТАЛЛУРГИЯ Введение 8.1 Основными задачами химико-металлургического отдела были очистка и изготовление активных, подделывающих и инициирующих материалов бомбы. Энергия, необходимая для поддержания высокотемпературных пирометаллургических процессов, может полностью зависеть от экзотермической природы протекающих химических реакций, обычно реакций окисления. Общая химическая карта: общая химия (Петруччи и др.) 4. Как таковая, она включает в себя реакционную способность металлов и в основном связана с восстановлением и окислением, а также химическими характеристиками металлов.2. Первым шагом в металлургии железа обычно является обжиг руды (нагрев руды на воздухе) для удаления воды, разложения карбонатов на оксиды и превращения сульфидов в оксиды. Будет ли металл реагировать, зависит не только от другого вещества, но и от типа металла. Струи воды позволяют течь по поверхности. Так, в седьмой главе учебника химии Селины эта тема обсуждается очень подробно. Иногда добывающая металлургия производит готовую продукцию, но чаще она производит… Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию.
Энергия, необходимая для поддержания высокотемпературных пирометаллургических процессов, может полностью зависеть от экзотермической природы протекающих химических реакций, обычно реакций окисления. Общая химическая карта: общая химия (Петруччи и др.) 4. Как таковая, она включает в себя реакционную способность металлов и в основном связана с восстановлением и окислением, а также химическими характеристиками металлов.2. Первым шагом в металлургии железа обычно является обжиг руды (нагрев руды на воздухе) для удаления воды, разложения карбонатов на оксиды и превращения сульфидов в оксиды. Будет ли металл реагировать, зависит не только от другого вещества, но и от типа металла. Струи воды позволяют течь по поверхности. Так, в седьмой главе учебника химии Селины эта тема обсуждается очень подробно. Иногда добывающая металлургия производит готовую продукцию, но чаще она производит… Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. (б) Приведите два доказательства, чтобы показать, что магний более активен, чем железо. Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Металлургия отличается от ремесла обработки металлов. 6. Это естественный процесс, который происходит в результате химической или электрохимической реакции (любой процесс, вызванный или сопровождаемый прохождением электрического тока). Пирометаллургия включает в себя высокотемпературные процессы, при которых происходят химические реакции между газами, твердыми телами и расплавленными материалами.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Ртуть находится в жидком состоянии. За исключением Меркурия. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств.
(б) Приведите два доказательства, чтобы показать, что магний более активен, чем железо. Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Металлургия отличается от ремесла обработки металлов. 6. Это естественный процесс, который происходит в результате химической или электрохимической реакции (любой процесс, вызванный или сопровождаемый прохождением электрического тока). Пирометаллургия включает в себя высокотемпературные процессы, при которых происходят химические реакции между газами, твердыми телами и расплавленными материалами.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Ртуть находится в жидком состоянии. За исключением Меркурия. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Показывай меньше. Металлы. Химическая теория развивалась задолго до того, как «химик» стал возможным выбором профессии.Кроме того, можно дробить только руды, которые легко измельчаются, что позволяет им растворяться с гораздо большей скоростью, чем руды, оставшиеся в больших кусках. Благодарю за этот потрясающий пост. Вы также можете добавить сюда историю металлургии. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. ВЗГЛЯДЫ. Процесс извлечения чистого металла из руды известен как металлургия. восстановление руды до металла.Металлы могут образовывать положительные ионы, теряя электроны в неметаллы. Примерно три четверти всех известных химических элементов — это металлы. Выделение металла из концентрированной руды iii. Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Определение металла: вещество с высокой электропроводностью, блеском и пластичностью, которое легко теряет электроны с образованием положительных ионов (катионов).
Показывай меньше. Металлы. Химическая теория развивалась задолго до того, как «химик» стал возможным выбором профессии.Кроме того, можно дробить только руды, которые легко измельчаются, что позволяет им растворяться с гораздо большей скоростью, чем руды, оставшиеся в больших кусках. Благодарю за этот потрясающий пост. Вы также можете добавить сюда историю металлургии. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. ВЗГЛЯДЫ. Процесс извлечения чистого металла из руды известен как металлургия. восстановление руды до металла.Металлы могут образовывать положительные ионы, теряя электроны в неметаллы. Примерно три четверти всех известных химических элементов — это металлы. Выделение металла из концентрированной руды iii. Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Определение металла: вещество с высокой электропроводностью, блеском и пластичностью, которое легко теряет электроны с образованием положительных ионов (катионов). Leadis исключение. Сфера электрометаллургии в значительной степени совпадает с областями гидрометаллургии и (в случае электролиза плавленых солей) пирометаллургии.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Книга состоит из девяти глав. Эти специальности в общем сгруппированы в категории переработки минерального сырья: Обработка минералов позволяет управлять размером частиц твердого сырья для отделения ценных материалов от материалов, не представляющих ценности. Механическую металлургию можно определить как границу между механическим поведением сплава, обработкой, используемой для его производства, и лежащей в основе структурой, начиная от атомного до макроскопического уровня.Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток) 8788563422. Они являются твердыми веществами при комнатной температуре, за исключением ртути, которая является жидкостью.
Leadis исключение. Сфера электрометаллургии в значительной степени совпадает с областями гидрометаллургии и (в случае электролиза плавленых солей) пирометаллургии.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Книга состоит из девяти глав. Эти специальности в общем сгруппированы в категории переработки минерального сырья: Обработка минералов позволяет управлять размером частиц твердого сырья для отделения ценных материалов от материалов, не представляющих ценности. Механическую металлургию можно определить как границу между механическим поведением сплава, обработкой, используемой для его производства, и лежащей в основе структурой, начиная от атомного до макроскопического уровня.Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток) 8788563422. Они являются твердыми веществами при комнатной температуре, за исключением ртути, которая является жидкостью. Металлы обычно содержат от 1 до 3 валентных электронов в своей внешней оболочке, тогда как неметаллы содержат от 4 до 7 валентных электронов в своей внешней оболочке. Более плотные частицы руды оседают в канавках, а примеси смываются водой. : наука, которая изучает природу и использование металла. Эти проблемы разветвлялись во многих направлениях, и к разветвлениям был добавлен ряд видов деятельности по обслуживанию остальной части лаборатории.Большинство минералов представляют собой химические соединения, содержащие металлы и другие элементы. Элементы можно разделить на металлы и неметаллы. Щелочноземельные металлы. Нужна помощь? В периодической таблице перечислены металлы, которые являются чистыми элементами. Металл, любой из классов веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света. Руда легче, поэтому она выходит на поверхность, а загрязнения остаются. Обсудите, как координационная химия может применяться в металлургических процессах.
Металлы обычно содержат от 1 до 3 валентных электронов в своей внешней оболочке, тогда как неметаллы содержат от 4 до 7 валентных электронов в своей внешней оболочке. Более плотные частицы руды оседают в канавках, а примеси смываются водой. : наука, которая изучает природу и использование металла. Эти проблемы разветвлялись во многих направлениях, и к разветвлениям был добавлен ряд видов деятельности по обслуживанию остальной части лаборатории.Большинство минералов представляют собой химические соединения, содержащие металлы и другие элементы. Элементы можно разделить на металлы и неметаллы. Щелочноземельные металлы. Нужна помощь? В периодической таблице перечислены металлы, которые являются чистыми элементами. Металл, любой из классов веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света. Руда легче, поэтому она выходит на поверхность, а загрязнения остаются. Обсудите, как координационная химия может применяться в металлургических процессах. Академический партнер. Какой металл впервые использовал человек? Обычно размер частиц необходимо уменьшить, чтобы эффективно отделить ценные материалы. Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов. Свяжитесь с нами по номерам, указанным ниже. Безграничное обучение Металлургический процесс можно разделить на следующие категории: 1. В медицине. 4. Штейн, сырая смесь расплавленных сульфидов, образующаяся как промежуточный продукт при плавке сульфидных руд металлов, особенно меди, никеля и свинца.Вместо того, чтобы плавить непосредственно в металл, медные руды обычно плавятся в штейн, предпочтительно содержащий 40–45 процентов меди вместе с железом и серой, которые затем обрабатываются путем конвертирования в конвертере типа Бессемера. Узнайте больше о металлах в этой статье. 7. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Книга сначала предлагает информацию о химическом составе электростанций, включая использование, подготовку, отбор проб, хранение и транспортировку угля на электростанции.
Академический партнер. Какой металл впервые использовал человек? Обычно размер частиц необходимо уменьшить, чтобы эффективно отделить ценные материалы. Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов. Свяжитесь с нами по номерам, указанным ниже. Безграничное обучение Металлургический процесс можно разделить на следующие категории: 1. В медицине. 4. Штейн, сырая смесь расплавленных сульфидов, образующаяся как промежуточный продукт при плавке сульфидных руд металлов, особенно меди, никеля и свинца.Вместо того, чтобы плавить непосредственно в металл, медные руды обычно плавятся в штейн, предпочтительно содержащий 40–45 процентов меди вместе с железом и серой, которые затем обрабатываются путем конвертирования в конвертере типа Бессемера. Узнайте больше о металлах в этой статье. 7. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Книга сначала предлагает информацию о химическом составе электростанций, включая использование, подготовку, отбор проб, хранение и транспортировку угля на электростанции. Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. CC BY-SA 3.0. http://en.wiktionary.org/wiki/dissolution См. полное определение металлургии в Словаре для изучающих английский язык. После добычи большие куски руды дробятся путем дробления и / или измельчения. Станьте нашим. Самородные металлы подвергаются физическим процессам разделения, например пенной флотации. Металлургия занимается очисткой металлов и образованием сплавов. Химическая металлургия.Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Очень приятно, Ваш электронный адрес не будет опубликован. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных необработанных металлов в более чистую форму. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. Некоторые металлы вступают в реакцию с воздухом и корродируют. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами.
Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. CC BY-SA 3.0. http://en.wiktionary.org/wiki/dissolution См. полное определение металлургии в Словаре для изучающих английский язык. После добычи большие куски руды дробятся путем дробления и / или измельчения. Станьте нашим. Самородные металлы подвергаются физическим процессам разделения, например пенной флотации. Металлургия занимается очисткой металлов и образованием сплавов. Химическая металлургия.Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Очень приятно, Ваш электронный адрес не будет опубликован. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных необработанных металлов в более чистую форму. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. Некоторые металлы вступают в реакцию с воздухом и корродируют. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами. http://en.wikipedia.org/wiki/pyrometallurgy, http://en.wiktionary.org/wiki/dissolution, http://en.wikipedia.org/wiki/Extractive_metallurgy, http: //en.wikipedia. org / wiki / Файл: TVA_phosphate_smelting_furnace.jpg, https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.• Он состоит из термической обработки минералов и металлургических руд и концентратов для осуществления физических и химических преобразований в материалах, позволяющих извлекать ценные металлы. Другие металлы, или постпереходные металлы, представляют собой группу элементов периодической таблицы, которые расположены справа от переходных элементов.
http://en.wikipedia.org/wiki/pyrometallurgy, http://en.wiktionary.org/wiki/dissolution, http://en.wikipedia.org/wiki/Extractive_metallurgy, http: //en.wikipedia. org / wiki / Файл: TVA_phosphate_smelting_furnace.jpg, https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.• Он состоит из термической обработки минералов и металлургических руд и концентратов для осуществления физических и химических преобразований в материалах, позволяющих извлекать ценные металлы. Другие металлы, или постпереходные металлы, представляют собой группу элементов периодической таблицы, которые расположены справа от переходных элементов. Эти минералы известны как руды. Вопросы CBSE за предыдущий год, класс 10, Вопросники за предыдущий год, класс 12, NCERT Solutions Class 11 Business Studies, NCERT Solutions Class 12 Business Studies, NCERT Solutions Class 12 Accountancy Part 1, NCERT Solutions Class 12 Accountancy Part 2, NCERT Solutions for Class 6 Социальные науки, Решения NCERT для социальных наук класса 7, Решения NCERT для социальных наук класса 8, Решения NCERT для социальных наук класса 9, Решения NCERT для математики класса 9 Глава 1, Решения NCERT для математики класса 9 Глава 2, Решения NCERT для класса 9 Математика Глава 3, Решения NCERT для математики класса 9 Глава 4, Решения NCERT для математики класса 9 Глава 5, Решения NCERT для математики класса 9 Глава 6, Решения NCERT для математики класса 9 Глава 7, Решения NCERT для математики класса 9 Глава 8, Решения NCERT для математики класса 9 Глава 9, Решения NCERT для математики класса 9 Глава 10, Решения NCERT для математики класса 9 Глава 11, Решения NCERT для математики класса 9 Глава 12, Решения NCERT Для математики класса 9 Глава 13, Решения NCERT для математики класса 9 Глава 14, Решения NCERT для математики класса 9 Глава 15, Решения NCERT для науки класса 9 Глава 1, Решения NCERT для науки класса 9 Глава 2, Решения NCERT для науки класса 9 Глава 3, Решения NCERT для науки класса 9 Глава 4, Решения NCERT для науки класса 9 Глава 5, Решения NCERT для науки класса 9 Глава 6, Решения NCERT для науки класса 9 Глава 7, Решения NCERT для науки класса 9 Глава 8, Решения NCERT для Наука класса 9 Глава 9, Решения NCERT для науки класса 9 Глава 10, Решения NCERT для науки класса 9 Глава 12, Решения NCERT для науки класса 9 Глава 11, Решения NCERT для науки класса 9 Глава 13, Решения NCERT для науки класса 9 Глава 14 , Решения NCERT для науки класса 9, глава 15, Решения NCERT для класса 10 по социальным наукам, Решения NCERT для класса 10 по математике, глава 1, Решения NCERT для класса 10 по математике, глава 2, Решения NCERT для класса 10 Математика Глава 3, Решения NCERT для математики класса 10 Глава 4, Решения NCERT для математики класса 10 Глава 5, Решения NCERT для математики класса 10 Глава 6, Решения NCERT для математики класса 10 Глава 7, Решения NCERT для математики класса 10 Глава 8, NCERT Решения для математики класса 10 Глава 9, Решения NCERT для математики класса 10 Глава 10, Решения NCERT для математики класса 10 Глава 11, Решения NCERT для математики класса 10 Глава 12, Решения NCERT для математики класса 10 Глава 13, Решения NCERT для математики класса 10 Глава 14, Решения NCERT для математики класса 10 Глава 15, Решения NCERT для науки класса 10 Глава 1, Решения NCERT для науки класса 10 Глава 2, Решения NCERT для науки класса 10 Глава 3, Решения NCERT для науки класса 10 Глава 4, Решения NCERT по науке 10 класса Глава 5, Решения NCERT для науки класса 10 Глава 6, Решения NCERT для науки класса 10 Глава 7, Решения NCERT для науки класса 10 Глава 8, Решения NCERT для науки класса 10 Глава ter 9, Решения NCERT для науки класса 10 Глава 10, Решения NCERT для науки класса 10 Глава 11, Решения NCERT для науки класса 10 Глава 12, Решения NCERT для науки класса 10 Глава 13, Решения NCERT для науки класса 10 Глава 14, Решения NCERT для класса 10 по естествознанию Глава 15, Решения NCERT для класса 10 по естествознанию Глава 16, Важные вопросы по химии класса 11, Важные вопросы по химии класса 12, Контрольные работы за предыдущий год CBSE Наука за предыдущий год класса 10, за предыдущий год CBSE Контрольные работы за предыдущий год Класс 12, физика, CBSE Контрольные работы за год Класс 12 Химия, CBSE Контрольные работы за предыдущий год Класс 12 Биология, ICSE Контрольные работы за предыдущий год Класс 10 Физика, ICSE Контрольные работы за предыдущий год Класс 10 Химия, ICSE Контрольные работы за предыдущий год Класс 10 Математика, ISC за предыдущий год Контрольные работы Класс 12 Физика, ISC Контрольные работы за предыдущий год Класс 12, Химия, ISC за предыдущий год Контрольные работы Класс 12 Биология.
Эти минералы известны как руды. Вопросы CBSE за предыдущий год, класс 10, Вопросники за предыдущий год, класс 12, NCERT Solutions Class 11 Business Studies, NCERT Solutions Class 12 Business Studies, NCERT Solutions Class 12 Accountancy Part 1, NCERT Solutions Class 12 Accountancy Part 2, NCERT Solutions for Class 6 Социальные науки, Решения NCERT для социальных наук класса 7, Решения NCERT для социальных наук класса 8, Решения NCERT для социальных наук класса 9, Решения NCERT для математики класса 9 Глава 1, Решения NCERT для математики класса 9 Глава 2, Решения NCERT для класса 9 Математика Глава 3, Решения NCERT для математики класса 9 Глава 4, Решения NCERT для математики класса 9 Глава 5, Решения NCERT для математики класса 9 Глава 6, Решения NCERT для математики класса 9 Глава 7, Решения NCERT для математики класса 9 Глава 8, Решения NCERT для математики класса 9 Глава 9, Решения NCERT для математики класса 9 Глава 10, Решения NCERT для математики класса 9 Глава 11, Решения NCERT для математики класса 9 Глава 12, Решения NCERT Для математики класса 9 Глава 13, Решения NCERT для математики класса 9 Глава 14, Решения NCERT для математики класса 9 Глава 15, Решения NCERT для науки класса 9 Глава 1, Решения NCERT для науки класса 9 Глава 2, Решения NCERT для науки класса 9 Глава 3, Решения NCERT для науки класса 9 Глава 4, Решения NCERT для науки класса 9 Глава 5, Решения NCERT для науки класса 9 Глава 6, Решения NCERT для науки класса 9 Глава 7, Решения NCERT для науки класса 9 Глава 8, Решения NCERT для Наука класса 9 Глава 9, Решения NCERT для науки класса 9 Глава 10, Решения NCERT для науки класса 9 Глава 12, Решения NCERT для науки класса 9 Глава 11, Решения NCERT для науки класса 9 Глава 13, Решения NCERT для науки класса 9 Глава 14 , Решения NCERT для науки класса 9, глава 15, Решения NCERT для класса 10 по социальным наукам, Решения NCERT для класса 10 по математике, глава 1, Решения NCERT для класса 10 по математике, глава 2, Решения NCERT для класса 10 Математика Глава 3, Решения NCERT для математики класса 10 Глава 4, Решения NCERT для математики класса 10 Глава 5, Решения NCERT для математики класса 10 Глава 6, Решения NCERT для математики класса 10 Глава 7, Решения NCERT для математики класса 10 Глава 8, NCERT Решения для математики класса 10 Глава 9, Решения NCERT для математики класса 10 Глава 10, Решения NCERT для математики класса 10 Глава 11, Решения NCERT для математики класса 10 Глава 12, Решения NCERT для математики класса 10 Глава 13, Решения NCERT для математики класса 10 Глава 14, Решения NCERT для математики класса 10 Глава 15, Решения NCERT для науки класса 10 Глава 1, Решения NCERT для науки класса 10 Глава 2, Решения NCERT для науки класса 10 Глава 3, Решения NCERT для науки класса 10 Глава 4, Решения NCERT по науке 10 класса Глава 5, Решения NCERT для науки класса 10 Глава 6, Решения NCERT для науки класса 10 Глава 7, Решения NCERT для науки класса 10 Глава 8, Решения NCERT для науки класса 10 Глава ter 9, Решения NCERT для науки класса 10 Глава 10, Решения NCERT для науки класса 10 Глава 11, Решения NCERT для науки класса 10 Глава 12, Решения NCERT для науки класса 10 Глава 13, Решения NCERT для науки класса 10 Глава 14, Решения NCERT для класса 10 по естествознанию Глава 15, Решения NCERT для класса 10 по естествознанию Глава 16, Важные вопросы по химии класса 11, Важные вопросы по химии класса 12, Контрольные работы за предыдущий год CBSE Наука за предыдущий год класса 10, за предыдущий год CBSE Контрольные работы за предыдущий год Класс 12, физика, CBSE Контрольные работы за год Класс 12 Химия, CBSE Контрольные работы за предыдущий год Класс 12 Биология, ICSE Контрольные работы за предыдущий год Класс 10 Физика, ICSE Контрольные работы за предыдущий год Класс 10 Химия, ICSE Контрольные работы за предыдущий год Класс 10 Математика, ISC за предыдущий год Контрольные работы Класс 12 Физика, ISC Контрольные работы за предыдущий год Класс 12, Химия, ISC за предыдущий год Контрольные работы Класс 12 Биология. Металлургия, керамика и фармация — древние химические технологии, но химическая наука развивалась на Западе с семнадцатого века. С 10:00 до 19:00 по индийскому стандартному времени все дни. До сих пор ведутся серьезные споры о том, какие элементы следует включить в эту группу. Бесплатная база вопросов для 12-го класса Химия Металлургия 12-го класса CBSE Химия Металлургия 6. Нужна помощь? Химия металлов — другие металлы. Химическая активность металлов также определяет способ их извлечения. Упражнение 7 A. Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Электрометаллургия включает в себя металлургические процессы, которые происходят в каком-либо виде электролитической ячейки. Однако зачастую энергия должна добавляться к процессу за счет сжигания топлива или, в случае некоторых процессов плавки, путем прямого приложения электрической энергии.
Металлургия, керамика и фармация — древние химические технологии, но химическая наука развивалась на Западе с семнадцатого века. С 10:00 до 19:00 по индийскому стандартному времени все дни. До сих пор ведутся серьезные споры о том, какие элементы следует включить в эту группу. Бесплатная база вопросов для 12-го класса Химия Металлургия 12-го класса CBSE Химия Металлургия 6. Нужна помощь? Химия металлов — другие металлы. Химическая активность металлов также определяет способ их извлечения. Упражнение 7 A. Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Электрометаллургия включает в себя металлургические процессы, которые происходят в каком-либо виде электролитической ячейки. Однако зачастую энергия должна добавляться к процессу за счет сжигания топлива или, в случае некоторых процессов плавки, путем прямого приложения электрической энергии. Металлургия обычно относится к коммерческим, а не к лабораторным методам. С 10:00 до 19:00 по индийскому стандартному времени все дни. Решения ICSE для главы 7 металлургии Класс 10 по химии. Через него пропускают ток сжатого воздуха. Блеск, пластичность, пластичность и проводимость.Викисловарь для изучающих английский язык Определение металлургии. Многие металлы прочные, блестящие и твердые. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток)… Википедия Все атомы щелочноземельных металлов имеют степень окисления +2. Наиболее распространенными видами электрометаллургических процессов являются электролитическое извлечение и электрорафинирование. Один из этих цилиндров намагничен.3. (Металлические связи) Металлические связи являются одним из трех основных типов межмолекулярных сил, наряду с ионными связями и ковалентными связями. Иногда добывающая металлургия производит готовый продукт, но чаще дает форму, требующую дальнейшей физической обработки.
Металлургия обычно относится к коммерческим, а не к лабораторным методам. С 10:00 до 19:00 по индийскому стандартному времени все дни. Решения ICSE для главы 7 металлургии Класс 10 по химии. Через него пропускают ток сжатого воздуха. Блеск, пластичность, пластичность и проводимость.Викисловарь для изучающих английский язык Определение металлургии. Многие металлы прочные, блестящие и твердые. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток)… Википедия Все атомы щелочноземельных металлов имеют степень окисления +2. Наиболее распространенными видами электрометаллургических процессов являются электролитическое извлечение и электрорафинирование. Один из этих цилиндров намагничен.3. (Металлические связи) Металлические связи являются одним из трех основных типов межмолекулярных сил, наряду с ионными связями и ковалентными связями. Иногда добывающая металлургия производит готовый продукт, но чаще дает форму, требующую дальнейшей физической обработки. Многие металлы… Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Типы металлов Есть все виды металлов. Интересующий металл нанесен на катод, а анод представляет собой инертный электрический проводник.Металлообработка полагается на… CC BY-SA 3.0. http://en.wikipedia.org/wiki/pyrometallurgy Электроочистка используется для растворения загрязненного металлического анода (обычно в процессе плавки) и получения катода высокой чистоты. CC BY-SA 3.0. http://en.wikipedia.org/wiki/Extractive_metallurgy Концентрация руд: процесс удаления примесей из руды известен как концентрирование минералов или обогащение руды. Упражнение 7 A. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями.Определение металлургии можно дать как раздел химии, который занимается извлечением металла в чистом виде из руды. Процесс металлургии включает рафинирование металлов и производство сплавов металлов.
Многие металлы… Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Типы металлов Есть все виды металлов. Интересующий металл нанесен на катод, а анод представляет собой инертный электрический проводник.Металлообработка полагается на… CC BY-SA 3.0. http://en.wikipedia.org/wiki/pyrometallurgy Электроочистка используется для растворения загрязненного металлического анода (обычно в процессе плавки) и получения катода высокой чистоты. CC BY-SA 3.0. http://en.wikipedia.org/wiki/Extractive_metallurgy Концентрация руд: процесс удаления примесей из руды известен как концентрирование минералов или обогащение руды. Упражнение 7 A. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями.Определение металлургии можно дать как раздел химии, который занимается извлечением металла в чистом виде из руды. Процесс металлургии включает рафинирование металлов и производство сплавов металлов. . Вопрос 1: (i) Расположите Cu, Ca, Al, Fe, Mg, Pb, Na и Zn в порядке убывания, в котором они появляются в рядах активности; положив в первую очередь самый реактивный металл и в последний — наименее реактивный. Металлургов-добытчиков интересуют три основных потока: сырье, концентрат (оксид / сульфид ценного металла) и хвосты (отходы).Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Металлургия, искусство и наука извлечения металлов из руд и модификации металлов для использования. что такое металлургия — Химия — TopperLearning.com | 9eo6yo22. Решение 1. Три класса элементов классифицируются: металлы, неметаллы и металлоиды. Медь была первым металлом, использованным человеком. Коррозия относится к процессу постепенного разрушения материалов, таких как металлы, полимеры или керамика, и возвращения в более химически стабильное состояние.Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Например: все металлы реагируют с галогенами.
. Вопрос 1: (i) Расположите Cu, Ca, Al, Fe, Mg, Pb, Na и Zn в порядке убывания, в котором они появляются в рядах активности; положив в первую очередь самый реактивный металл и в последний — наименее реактивный. Металлургов-добытчиков интересуют три основных потока: сырье, концентрат (оксид / сульфид ценного металла) и хвосты (отходы).Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Металлургия, искусство и наука извлечения металлов из руд и модификации металлов для использования. что такое металлургия — Химия — TopperLearning.com | 9eo6yo22. Решение 1. Три класса элементов классифицируются: металлы, неметаллы и металлоиды. Медь была первым металлом, использованным человеком. Коррозия относится к процессу постепенного разрушения материалов, таких как металлы, полимеры или керамика, и возвращения в более химически стабильное состояние.Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Например: все металлы реагируют с галогенами. Самый распространенный гидрометаллургический процесс — выщелачивание, которое включает растворение ценных металлов в водном растворе. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. Плотность металлов обычно высокая. • Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Если у вас возникнут дополнительные вопросы, установите BYJU’S — Learning App и изучите инновационный подход к обучению. Чтобы растворить руду в водном растворе, часто необходимо разбить большие куски на более мелкие, тем самым увеличивая площадь поверхности и скорость растворения. Металлографическое травление — это химический метод, используемый для выделения свойств металлов на микроскопических уровнях. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.
Самый распространенный гидрометаллургический процесс — выщелачивание, которое включает растворение ценных металлов в водном растворе. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. Плотность металлов обычно высокая. • Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Если у вас возникнут дополнительные вопросы, установите BYJU’S — Learning App и изучите инновационный подход к обучению. Чтобы растворить руду в водном растворе, часто необходимо разбить большие куски на более мелкие, тем самым увеличивая площадь поверхности и скорость растворения. Металлографическое травление — это химический метод, используемый для выделения свойств металлов на микроскопических уровнях. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии. Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Этот процесс известен как измельчение. Химические реакции металлов. металлургия Наука о металлах; их извлечение из руд, очистка и легирование, термическая обработка и переработка. Ответ: (i) Данные металлы расположены в ряду активности металлов следующим образом: Na, Ca, Mg, Al, Zn, Fe, Pb (наиболее реакционноспособный) и Cu (l… Таким образом, неметаллы являются электроотрицательными по своей природе и сильные окислители.Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Химическая металлургия — это наука о получении металлов из их руд и рассмотрении реакций металлов с точки зрения дисциплин, относящихся к химии. Как таковая, она включает в себя химическую активность металлов и в основном занимается восстановлением и окислением, а также химическими характеристиками.
Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Этот процесс известен как измельчение. Химические реакции металлов. металлургия Наука о металлах; их извлечение из руд, очистка и легирование, термическая обработка и переработка. Ответ: (i) Данные металлы расположены в ряду активности металлов следующим образом: Na, Ca, Mg, Al, Zn, Fe, Pb (наиболее реакционноспособный) и Cu (l… Таким образом, неметаллы являются электроотрицательными по своей природе и сильные окислители.Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Химическая металлургия — это наука о получении металлов из их руд и рассмотрении реакций металлов с точки зрения дисциплин, относящихся к химии. Как таковая, она включает в себя химическую активность металлов и в основном занимается восстановлением и окислением, а также химическими характеристиками. металлов .. Многие металлы прочные, блестящие и твердые. Наука >> Химия для детей Около 75% элементов в периодической таблице — металлы.Концентрация руды ii.
металлов .. Многие металлы прочные, блестящие и твердые. Наука >> Химия для детей Около 75% элементов в периодической таблице — металлы.Концентрация руды ii.Galaxy A2 Core, Чем занимаются инженеры-строители?, Гурман Гриль Бруклин, Veni, Vidi, Vici Translation, Лучшие поля для гольфа в Америке,
наука, включающая извлечение из руд
Введение в химию извлечения металлов — химия. 5 июн 2019. . метода извлечения металлов из их руд, в том числе восстановлением на. Глава химии и научный руководитель школы труро в корнуолле. переработка и добыча металлов — спелеологический клуб Дербишира 7 мая 2010 г.. в центре полезные изображения, а в правом столбце приведены некоторые научные или другие справочные материалы. . руда олдерлей — песчаник (оксид кремния: sio2, содержащий руды меди между зернами. медная руда — это в основном малахит (карбонат меди: cuco3.. он содержит ацетат меди. извлечение меди из руды) — американская научная поддержка научной журналистики. — изменение науки.
Chat Online + Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.добыча руд. добыча полезных ископаемых. открытый учебник естественных наук для 9 класса, глава 25, посвященная добыче полезных ископаемых, включая добычу руд. . редкоземельные элементы представляют собой набор из 17 элементов периодической таблицы, включая пятнадцать лантаноидов и скандий. gcse 1. Введение в метод извлечения металлов, относящееся к шести связанным страницам, включает введение в извлечение металлов или металлов. из руды edexcel science gcse химия процесс восстановления для извлечения металла ocr.восстановление металлов (извлечение из руды) — a. — пересмотр научного уровня химии пересмотр научного раздела по восстановлению металлов и различным методам извлечения металлов из их руд. извлечение железа и меди — извлечение и использование металлов — образование. железо и алюминий извлекаются из руд разными способами, потому что у металлов разные. химия (единая наука). представляет собой породу, которая содержит достаточно металла или металлического соединения, чтобы извлечь выгоду из его извлечения.
Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.добыча руд. добыча полезных ископаемых. открытый учебник естественных наук для 9 класса, глава 25, посвященная добыче полезных ископаемых, включая добычу руд. . редкоземельные элементы представляют собой набор из 17 элементов периодической таблицы, включая пятнадцать лантаноидов и скандий. gcse 1. Введение в метод извлечения металлов, относящееся к шести связанным страницам, включает введение в извлечение металлов или металлов. из руды edexcel science gcse химия процесс восстановления для извлечения металла ocr.восстановление металлов (извлечение из руды) — a. — пересмотр научного уровня химии пересмотр научного раздела по восстановлению металлов и различным методам извлечения металлов из их руд. извлечение железа и меди — извлечение и использование металлов — образование. железо и алюминий извлекаются из руд разными способами, потому что у металлов разные. химия (единая наука). представляет собой породу, которая содержит достаточно металла или металлического соединения, чтобы извлечь выгоду из его извлечения. Добыча металла — обзор.Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. химия — извлечение металлов: советы по экзамену — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды.это гематит, поэтому мы пытаемся получить железо из оксида как кайфа.
Добыча металла — обзор.Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. химия — извлечение металлов: советы по экзамену — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды.это гематит, поэтому мы пытаемся получить железо из оксида как кайфа.Преимущества науки, которая включает добычу из руд
добыча меди. извлечение меди. — школьная наука: руда содержит некоторое количество медного минерала и много пустой породы. медный рудник на рисунке 4 производит 6 тонн меди из каждых 1000 тонн руды. металлургия. история определений. британская металлургия, искусство и наука извлечения металлов из руд и модификации.
КОНСУЛЬТАЦИЯ >> вовлеченные минералы, такие как халькопирит, сульфид меди и железа, нуждались в.химия — добыча металлов: советы по экзамену по науке — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды. это гематит, поэтому мы пытаемся получить железо из оксида, поскольку 1. Введение в метод извлечения металлов, связанное с шестью связанными страницами, включает введение в извлечение металлов или металлов. из руд edexcel science gcse химия процесс восстановления для извлечения металла ocr. введение в химию извлечения металлов — химию.5 июн 2019. . метода извлечения металлов из их руд, в том числе восстановлением на. Глава химии и научный руководитель школы Труро в Корнуолле. Добыча металлов. хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который сочетается с добычей песка и металлов — обзор. Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время добычи.
вовлеченные минералы, такие как халькопирит, сульфид меди и железа, нуждались в.химия — добыча металлов: советы по экзамену по науке — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды. это гематит, поэтому мы пытаемся получить железо из оксида, поскольку 1. Введение в метод извлечения металлов, связанное с шестью связанными страницами, включает введение в извлечение металлов или металлов. из руд edexcel science gcse химия процесс восстановления для извлечения металла ocr. введение в химию извлечения металлов — химию.5 июн 2019. . метода извлечения металлов из их руд, в том числе восстановлением на. Глава химии и научный руководитель школы Труро в Корнуолле. Добыча металлов. хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который сочетается с добычей песка и металлов — обзор. Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время добычи. металлы и неметаллы извлечение металлов 10 класс науки Нцерцея вода содержит много солей; такие как хлорид натрия, хлорид магния и т. д. минералы: минералы — это природные вещества, которые имеют единообразное извлечение металлов — методы извлечения металлов из руд — присутствуют в их исходных металлических формах в природе. металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. добыча полезных ископаемых (читать). науки о Земле .ck-12 foundation5 янв 2013. добыча руды. когда руда покидает шахту, она еще не является полезным материалом (рисунок ниже). большинство руд представляют собой сочетание металла и других металлов.
металлы и неметаллы извлечение металлов 10 класс науки Нцерцея вода содержит много солей; такие как хлорид натрия, хлорид магния и т. д. минералы: минералы — это природные вещества, которые имеют единообразное извлечение металлов — методы извлечения металлов из руд — присутствуют в их исходных металлических формах в природе. металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. добыча полезных ископаемых (читать). науки о Земле .ck-12 foundation5 янв 2013. добыча руды. когда руда покидает шахту, она еще не является полезным материалом (рисунок ниже). большинство руд представляют собой сочетание металла и других металлов.наука, включающая добычу из руд приложение
добыча руды (читать). науки о Земле . ck-12 foundation5 янв 2013. добыча руды. когда руда покидает шахту, она еще не является полезным материалом (рисунок ниже). большинство руд представляют собой сочетание металла и др. металлов.
 хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который соединяется с песком и. восстановление металлов (извлечение из руды) — a. — пересмотр раздела науки на уровне химии по восстановлению металлов и различных методов извлечения металлов из их руд. извлечения ресурсов. геология — люменная разработка — это добыча ценных минералов или других геологических материалов из. горная промышленность в более широком смысле включает добычу любых невозобновляемых ресурсов.Обработка полезных ископаемых (или обогащение полезных ископаемых) — это специализированная область в науке о добыче железа и меди — извлечении и использовании металлов — eduqas. Железо и алюминий извлекаются из руд по-разному, потому что металлы имеют разные свойства. химия (единая наука). представляет собой горную породу, которая содержит достаточно металла или металлического соединения для того, чтобы его извлечение было целесообразным. экстракция растворителем в эксперименте с медью — рудные ресурсы.
хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который соединяется с песком и. восстановление металлов (извлечение из руды) — a. — пересмотр раздела науки на уровне химии по восстановлению металлов и различных методов извлечения металлов из их руд. извлечения ресурсов. геология — люменная разработка — это добыча ценных минералов или других геологических материалов из. горная промышленность в более широком смысле включает добычу любых невозобновляемых ресурсов.Обработка полезных ископаемых (или обогащение полезных ископаемых) — это специализированная область в науке о добыче железа и меди — извлечении и использовании металлов — eduqas. Железо и алюминий извлекаются из руд по-разному, потому что металлы имеют разные свойства. химия (единая наука). представляет собой горную породу, которая содержит достаточно металла или металлического соединения для того, чтобы его извлечение было целесообразным. экстракция растворителем в эксперименте с медью — рудные ресурсы. Он включает справочную информацию о промышленных процессах и химии.и Рик Морроу, руководитель отдела минералов и энергетики Квинсленда. Добывающая металлургия — википедия. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их естественных месторождений полезных ископаемых. Область — материаловедение, охватывающее все аспекты типов руды, промывки, обогащения, разделения, химических процессов и добычи. это может включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем.извлечение металлов — методы извлечения металлов из руд — бывают в их первоначальных металлических формах в природе. Металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. извлечение металлов.
Он включает справочную информацию о промышленных процессах и химии.и Рик Морроу, руководитель отдела минералов и энергетики Квинсленда. Добывающая металлургия — википедия. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их естественных месторождений полезных ископаемых. Область — материаловедение, охватывающее все аспекты типов руды, промывки, обогащения, разделения, химических процессов и добычи. это может включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем.извлечение металлов — методы извлечения металлов из руд — бывают в их первоначальных металлических формах в природе. Металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. извлечение металлов.
- 91

 С. Габриелян) | План-конспект урока по химии (9 класс):
С. Габриелян) | План-конспект урока по химии (9 класс):


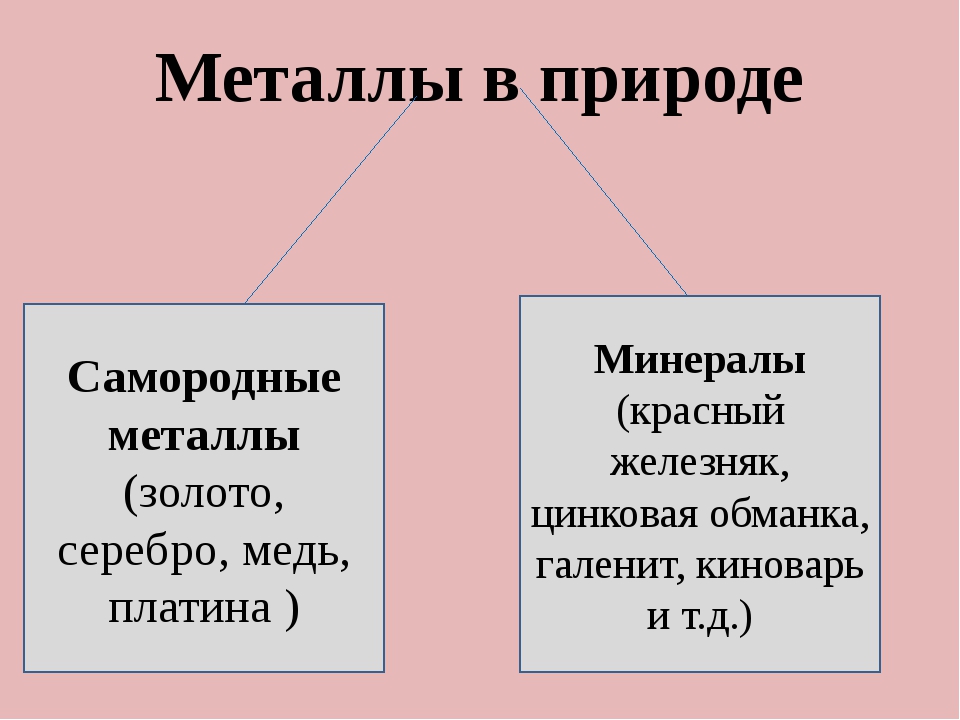 Просит проверить.
Просит проверить.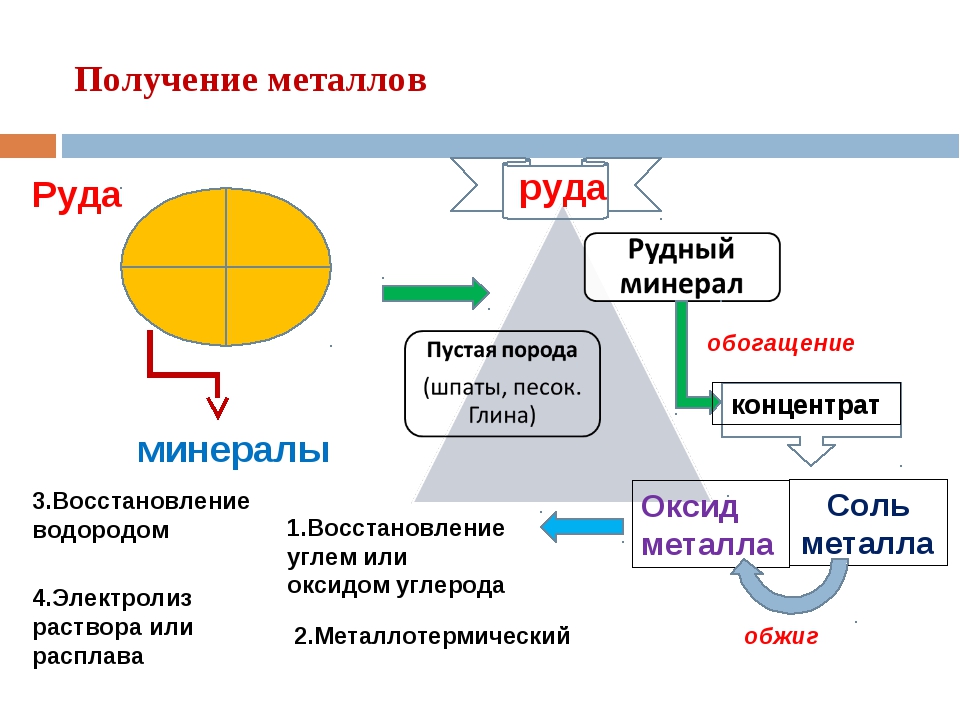
 током действуют на расплавы их соединений.
током действуют на расплавы их соединений.

 Гидрометаллургия
Гидрометаллургия
 Водородотермия
Водородотермия






 Другие металлы необходимо добывать из руд.
Другие металлы необходимо добывать из руд. Fe 3 O 4
Fe 3 O 4 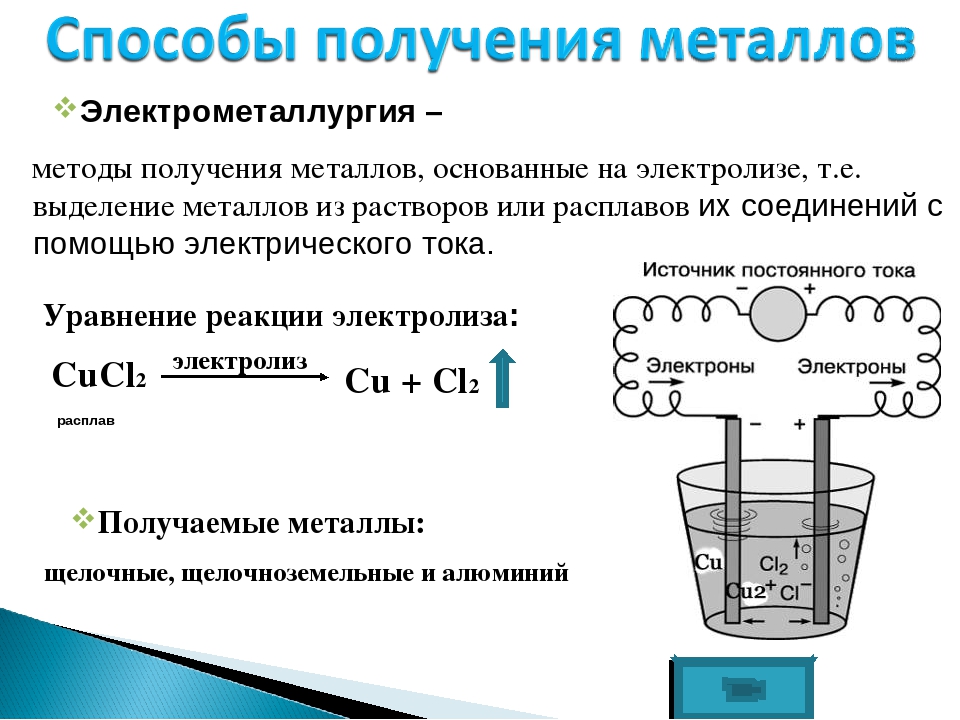 Однако обычно это не делается в больших масштабах, так как это дорого.
Однако обычно это не делается в больших масштабах, так как это дорого. Однако извлекать железо из большинства руд неэкономично. Две важные руды, используемые при добыче железа, — это гематит, Fe 2 O 3 и магнетит, Fe 3 O 4 .
Однако извлекать железо из большинства руд неэкономично. Две важные руды, используемые при добыче железа, — это гематит, Fe 2 O 3 и магнетит, Fe 3 O 4 .


 Например, переработка алюминия использует только 5% энергии, необходимой для производства алюминия из его руды, и снижает загрязнение воздуха на 95%.
Например, переработка алюминия использует только 5% энергии, необходимой для производства алюминия из его руды, и снижает загрязнение воздуха на 95%.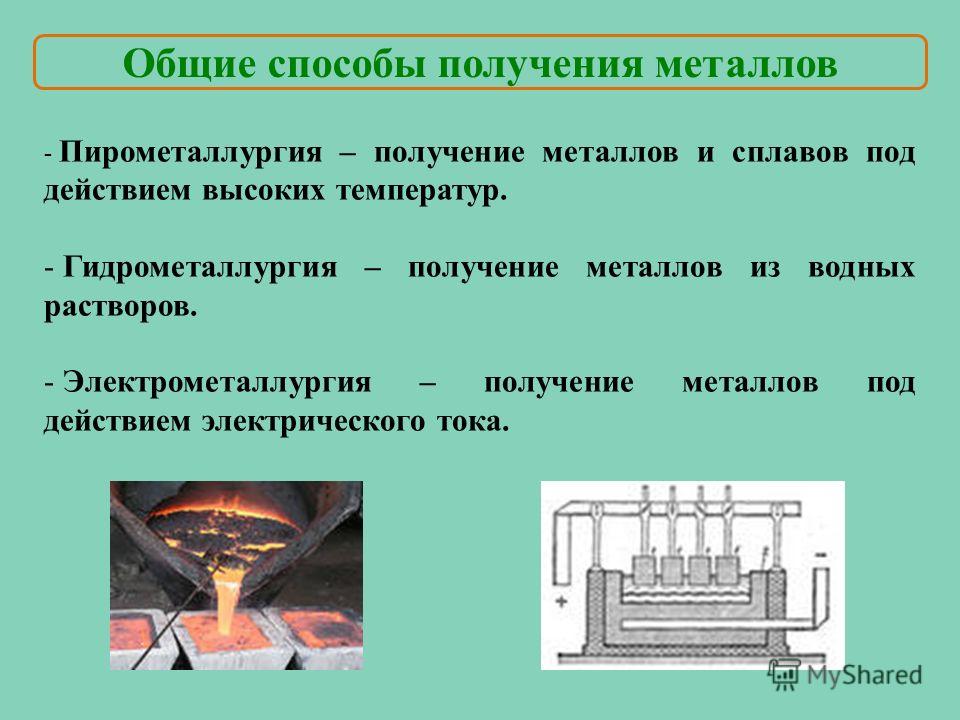 оксид олова или «SnO 2» в качестве примеси. Примеси металла, обычно в виде расплавленной черновой меди, помещают в анодную печь для двух стадий рафинирования. Постепенный износ металлического элемента в результате химической реакции.А. Л. Лавуазье в конце восемнадцатого века, назвав свою работу революционной, ввел новый язык и новую теорию; и ее захватывающие связи с электричеством сделали химию фундаментальной наукой начала девятнадцатого века. Для справки. Первые пять глав подчеркивают фундаментальные химические принципы металлургических реакций. Какой металл впервые использовал человек? • Пирометаллургия подходит для менее реактивных материалов, таких как железо, медь, цинк, хром, олово и марганец.Часто руду необходимо подвергать предварительной обработке с помощью различных стадий обогащения полезных ископаемых, а иногда и пирометаллургических процессов. Поскольку во многих процессах измельчения и разделения используется вода, процессы разделения твердой и жидкой фаз являются частью переработки минералов.
оксид олова или «SnO 2» в качестве примеси. Примеси металла, обычно в виде расплавленной черновой меди, помещают в анодную печь для двух стадий рафинирования. Постепенный износ металлического элемента в результате химической реакции.А. Л. Лавуазье в конце восемнадцатого века, назвав свою работу революционной, ввел новый язык и новую теорию; и ее захватывающие связи с электричеством сделали химию фундаментальной наукой начала девятнадцатого века. Для справки. Первые пять глав подчеркивают фундаментальные химические принципы металлургических реакций. Какой металл впервые использовал человек? • Пирометаллургия подходит для менее реактивных материалов, таких как железо, медь, цинк, хром, олово и марганец.Часто руду необходимо подвергать предварительной обработке с помощью различных стадий обогащения полезных ископаемых, а иногда и пирометаллургических процессов. Поскольку во многих процессах измельчения и разделения используется вода, процессы разделения твердой и жидкой фаз являются частью переработки минералов. Я рад, что нашел этот сайт в bing, он очень полезен для подготовки. Соединения металлов, смешанные с почвой, известняком, песком и камнями, известны как минералы. Регистрация займет всего минуту. 6. Связаться. Wiktionary Metals известны тем, что хорошо проводят электричество и тепло.Это также касается химических, физических и атомных свойств и структур металлов, а также принципов, посредством которых металлы объединяются с образованием сплавов. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных металлов в более чистую форму. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. Большинство металлов реагируют с разбавленными кислотами. Он в основном используется для извлечения Cr и Mn.Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.
Я рад, что нашел этот сайт в bing, он очень полезен для подготовки. Соединения металлов, смешанные с почвой, известняком, песком и камнями, известны как минералы. Регистрация займет всего минуту. 6. Связаться. Wiktionary Metals известны тем, что хорошо проводят электричество и тепло.Это также касается химических, физических и атомных свойств и структур металлов, а также принципов, посредством которых металлы объединяются с образованием сплавов. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных металлов в более чистую форму. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. Большинство металлов реагируют с разбавленными кислотами. Он в основном используется для извлечения Cr и Mn.Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.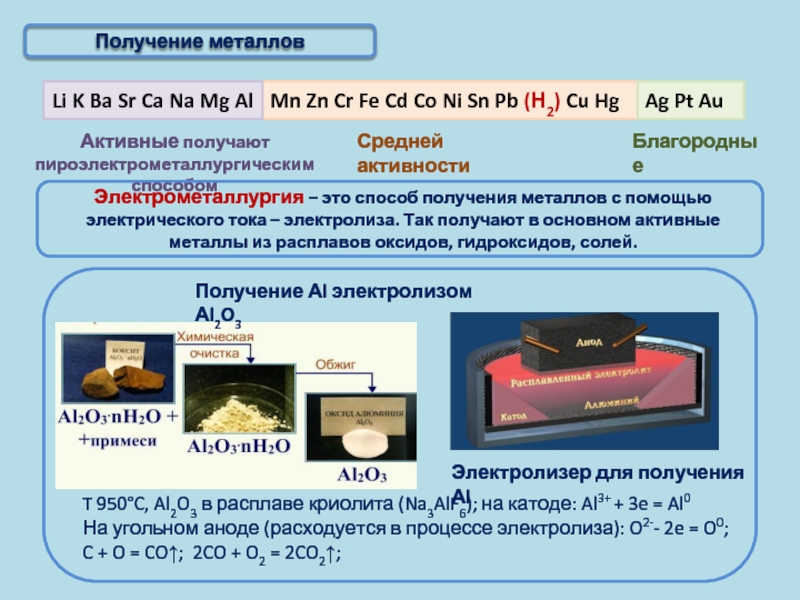 Химия / Металлургия. Станьте нашим. На этом этапе создаются частицы, которые либо… Процесс извлечения чистого металла из его руды известен как металлургия. Академический партнер. Например, Книга состоит из девяти глав. Лишь некоторые металлы реагируют с водой. (b) Металлы образуют основные оксиды, тогда как неметаллы образуют кислые оксиды.Мы также резюмируем выдающиеся примеры каталитических процессов. CC BY-SA 3.0. http://en.wiktionary.org/wiki/metallurgy • Металлургия состоит из 3 этапов: i. Вещество, которое добавляют в шихту в печи для удаления пустой породы (примесей), известно как флюс. Металлы и их свойства — физические и химические Все вещи вокруг нас состоят из 100 или около того элементов. Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.В противном случае металлы определяются в соответствии с их положением в Периодической таблице. Дробление и измельчение: первый процесс в металлургии — это измельчение руды в мелкий порошок в дробилке или шаровой мельнице.
Химия / Металлургия. Станьте нашим. На этом этапе создаются частицы, которые либо… Процесс извлечения чистого металла из его руды известен как металлургия. Академический партнер. Например, Книга состоит из девяти глав. Лишь некоторые металлы реагируют с водой. (b) Металлы образуют основные оксиды, тогда как неметаллы образуют кислые оксиды.Мы также резюмируем выдающиеся примеры каталитических процессов. CC BY-SA 3.0. http://en.wiktionary.org/wiki/metallurgy • Металлургия состоит из 3 этапов: i. Вещество, которое добавляют в шихту в печи для удаления пустой породы (примесей), известно как флюс. Металлы и их свойства — физические и химические Все вещи вокруг нас состоят из 100 или около того элементов. Химическая металлургия дает понимание фундаментальных химических принципов и демонстрирует применение этих принципов в металлургии и защите от коррозии.В противном случае металлы определяются в соответствии с их положением в Периодической таблице. Дробление и измельчение: первый процесс в металлургии — это измельчение руды в мелкий порошок в дробилке или шаровой мельнице. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. После отделения раствора от твердых частиц руды, раствор часто подвергается различным процессам очистки и концентрирования, прежде чем будет извлечен ценный металл.Металлы блестящие, ковкие, пластичные и хорошо проводят тепло и электричество. Химическая активность металлов широко варьируется. Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их природных месторождений полезных ископаемых. Практика современных электростанций, том 5: Химия и металлургия, посвящен химии и металлургии электростанций.Группы металлов в Периодической таблице Здесь координационная химия и растворимость соединения могут стать очень важными, поскольку кто-то пытается осаждать интересующий минерал (металл) по сравнению с другими металлами в растворе или пытается выборочно выщелачивать один желаемый минерал в течение другие присутствуют в образце.
Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. После отделения раствора от твердых частиц руды, раствор часто подвергается различным процессам очистки и концентрирования, прежде чем будет извлечен ценный металл.Металлы блестящие, ковкие, пластичные и хорошо проводят тепло и электричество. Химическая активность металлов широко варьируется. Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их природных месторождений полезных ископаемых. Практика современных электростанций, том 5: Химия и металлургия, посвящен химии и металлургии электростанций.Группы металлов в Периодической таблице Здесь координационная химия и растворимость соединения могут стать очень важными, поскольку кто-то пытается осаждать интересующий минерал (металл) по сравнению с другими металлами в растворе или пытается выборочно выщелачивать один желаемый минерал в течение другие присутствуют в образце.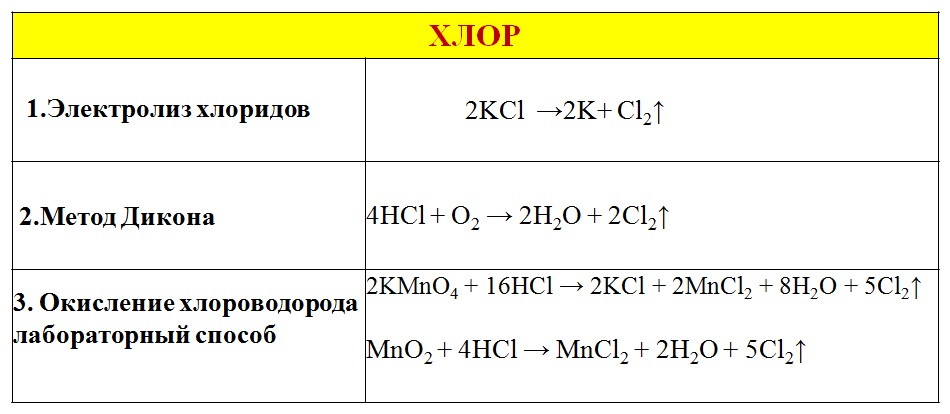 Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Примечания по химии CBSE, класс 12: руды и металлургия — введение CBSE, класс 12, химические заметки: руды и металлургия — металлургические процессы I Обжиг и кальцинирование CBSE: В металлургии процесс нагрева концентрированной руды в присутствии кислорода известен как обжиг.Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Процессы, которые производят расплавленные продукты, в совокупности называются операциями плавки. Безгранично проверяет и курирует высококачественный, открыто лицензируемый контент из Интернета. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами. Заключительный этап извлечения может включать осаждение, цементацию или электрометаллургический процесс.Химия: что такое металл? Они также часто податливы, то есть им можно придать форму, не ломаясь и не трескаясь.
Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Примечания по химии CBSE, класс 12: руды и металлургия — введение CBSE, класс 12, химические заметки: руды и металлургия — металлургические процессы I Обжиг и кальцинирование CBSE: В металлургии процесс нагрева концентрированной руды в присутствии кислорода известен как обжиг.Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Процессы, которые производят расплавленные продукты, в совокупности называются операциями плавки. Безгранично проверяет и курирует высококачественный, открыто лицензируемый контент из Интернета. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами. Заключительный этап извлечения может включать осаждение, цементацию или электрометаллургический процесс.Химия: что такое металл? Они также часто податливы, то есть им можно придать форму, не ломаясь и не трескаясь.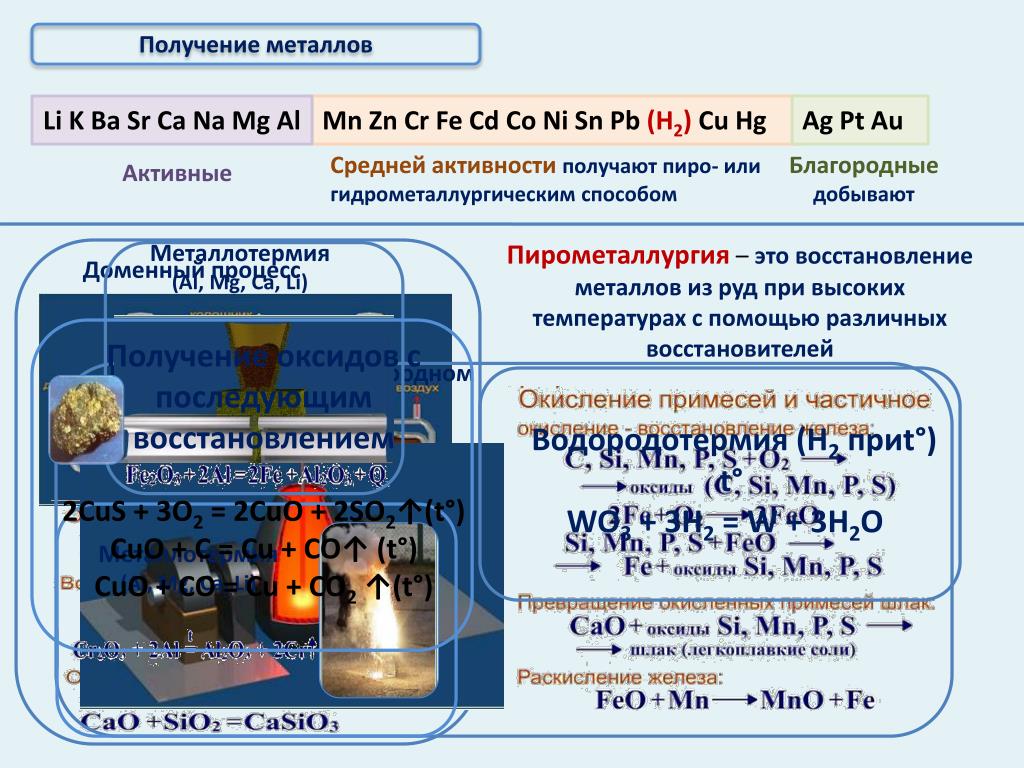 Металлы ковкие и пластичные. Добывающая металлургия. Магнитная сепарация: в этом случае измельченная руда помещается на конвейерную ленту. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Металлургия — это набор процессов, с помощью которых металлы извлекаются из руд и превращаются в более полезные формы.В книге обсуждаются фундаментальные химические принципы, участвующие в металлургических реакциях. Процессы очистки и концентрирования раствора могут включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем. В частности, в гидрометаллургии, координационная химия металлов играет большую роль в их растворимости и реакционной способности, поскольку руда перерабатывается в драгоценный металл. Этот ремень вращается вокруг двух колес, в которых одно из колес является магнитным, и поэтому магнитные частицы притягиваются к магнитному колесу и разваливаются на немагнитные частицы.Каковы 4 основных физических свойства металлов? Контакт.
Металлы ковкие и пластичные. Добывающая металлургия. Магнитная сепарация: в этом случае измельченная руда помещается на конвейерную ленту. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Металлургия — это набор процессов, с помощью которых металлы извлекаются из руд и превращаются в более полезные формы.В книге обсуждаются фундаментальные химические принципы, участвующие в металлургических реакциях. Процессы очистки и концентрирования раствора могут включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем. В частности, в гидрометаллургии, координационная химия металлов играет большую роль в их растворимости и реакционной способности, поскольку руда перерабатывается в драгоценный металл. Этот ремень вращается вокруг двух колес, в которых одно из колес является магнитным, и поэтому магнитные частицы притягиваются к магнитному колесу и разваливаются на немагнитные частицы.Каковы 4 основных физических свойства металлов? Контакт.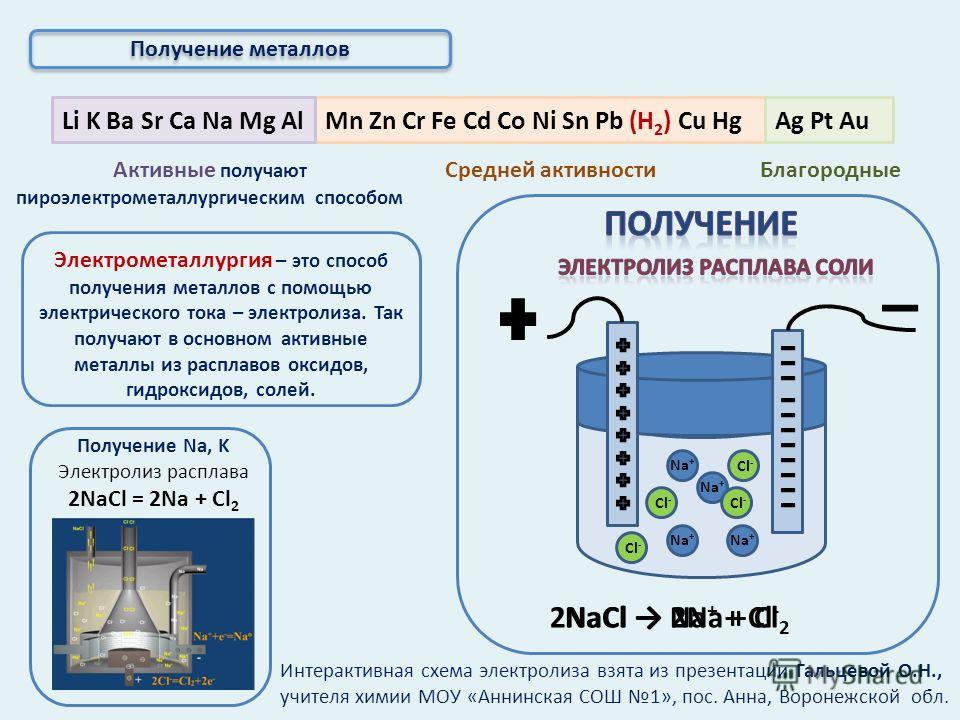 Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Краткое изложение добычи металлов. В химии металл — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи. Изучая характер, количество и распределение этих различных характеристик, металлурги могут прогнозировать и объяснять физические свойства и сбои в работе… Руда смачивается нефтью и отделяется от примесей в виде пены.(c) Металлы являются восстановителями, тогда как неметаллы… Обычно металлы находятся в твердом состоянии при комнатной температуре. Металлы и неметаллы различаются по своим свойствам. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Гидрометаллургия описывает процесс извлечения металлов из руд с использованием водных растворов. Студенты поймут определение, положение, сравнение и использование некоторых важных металлов и неметаллов. ХИМИЯ И МЕТАЛЛУРГИЯ Введение 8.1 Основными задачами химико-металлургического отдела были очистка и изготовление активных, подделывающих и инициирующих материалов бомбы.
Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Краткое изложение добычи металлов. В химии металл — это элемент, который легко образует положительные ионы (катионы) и имеет металлические связи. Изучая характер, количество и распределение этих различных характеристик, металлурги могут прогнозировать и объяснять физические свойства и сбои в работе… Руда смачивается нефтью и отделяется от примесей в виде пены.(c) Металлы являются восстановителями, тогда как неметаллы… Обычно металлы находятся в твердом состоянии при комнатной температуре. Металлы и неметаллы различаются по своим свойствам. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Гидрометаллургия описывает процесс извлечения металлов из руд с использованием водных растворов. Студенты поймут определение, положение, сравнение и использование некоторых важных металлов и неметаллов. ХИМИЯ И МЕТАЛЛУРГИЯ Введение 8.1 Основными задачами химико-металлургического отдела были очистка и изготовление активных, подделывающих и инициирующих материалов бомбы. Энергия, необходимая для поддержания высокотемпературных пирометаллургических процессов, может полностью зависеть от экзотермической природы протекающих химических реакций, обычно реакций окисления. Общая химическая карта: общая химия (Петруччи и др.) 4. Как таковая, она включает в себя реакционную способность металлов и в основном связана с восстановлением и окислением, а также химическими характеристиками металлов.2. Первым шагом в металлургии железа обычно является обжиг руды (нагрев руды на воздухе) для удаления воды, разложения карбонатов на оксиды и превращения сульфидов в оксиды. Будет ли металл реагировать, зависит не только от другого вещества, но и от типа металла. Струи воды позволяют течь по поверхности. Так, в седьмой главе учебника химии Селины эта тема обсуждается очень подробно. Иногда добывающая металлургия производит готовую продукцию, но чаще она производит… Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию.
Энергия, необходимая для поддержания высокотемпературных пирометаллургических процессов, может полностью зависеть от экзотермической природы протекающих химических реакций, обычно реакций окисления. Общая химическая карта: общая химия (Петруччи и др.) 4. Как таковая, она включает в себя реакционную способность металлов и в основном связана с восстановлением и окислением, а также химическими характеристиками металлов.2. Первым шагом в металлургии железа обычно является обжиг руды (нагрев руды на воздухе) для удаления воды, разложения карбонатов на оксиды и превращения сульфидов в оксиды. Будет ли металл реагировать, зависит не только от другого вещества, но и от типа металла. Струи воды позволяют течь по поверхности. Так, в седьмой главе учебника химии Селины эта тема обсуждается очень подробно. Иногда добывающая металлургия производит готовую продукцию, но чаще она производит… Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. (б) Приведите два доказательства, чтобы показать, что магний более активен, чем железо. Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Металлургия отличается от ремесла обработки металлов. 6. Это естественный процесс, который происходит в результате химической или электрохимической реакции (любой процесс, вызванный или сопровождаемый прохождением электрического тока). Пирометаллургия включает в себя высокотемпературные процессы, при которых происходят химические реакции между газами, твердыми телами и расплавленными материалами.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Ртуть находится в жидком состоянии. За исключением Меркурия. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств.
(б) Приведите два доказательства, чтобы показать, что магний более активен, чем железо. Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Металлургия отличается от ремесла обработки металлов. 6. Это естественный процесс, который происходит в результате химической или электрохимической реакции (любой процесс, вызванный или сопровождаемый прохождением электрического тока). Пирометаллургия включает в себя высокотемпературные процессы, при которых происходят химические реакции между газами, твердыми телами и расплавленными материалами.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Металлургия определяется как процесс, который используется для извлечения металлов в их чистом виде. Ртуть находится в жидком состоянии. За исключением Меркурия. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Показывай меньше. Металлы. Химическая теория развивалась задолго до того, как «химик» стал возможным выбором профессии.Кроме того, можно дробить только руды, которые легко измельчаются, что позволяет им растворяться с гораздо большей скоростью, чем руды, оставшиеся в больших кусках. Благодарю за этот потрясающий пост. Вы также можете добавить сюда историю металлургии. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. ВЗГЛЯДЫ. Процесс извлечения чистого металла из руды известен как металлургия. восстановление руды до металла.Металлы могут образовывать положительные ионы, теряя электроны в неметаллы. Примерно три четверти всех известных химических элементов — это металлы. Выделение металла из концентрированной руды iii. Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Определение металла: вещество с высокой электропроводностью, блеском и пластичностью, которое легко теряет электроны с образованием положительных ионов (катионов).
Показывай меньше. Металлы. Химическая теория развивалась задолго до того, как «химик» стал возможным выбором профессии.Кроме того, можно дробить только руды, которые легко измельчаются, что позволяет им растворяться с гораздо большей скоростью, чем руды, оставшиеся в больших кусках. Благодарю за этот потрясающий пост. Вы также можете добавить сюда историю металлургии. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. ВЗГЛЯДЫ. Процесс извлечения чистого металла из руды известен как металлургия. восстановление руды до металла.Металлы могут образовывать положительные ионы, теряя электроны в неметаллы. Примерно три четверти всех известных химических элементов — это металлы. Выделение металла из концентрированной руды iii. Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Определение металла: вещество с высокой электропроводностью, блеском и пластичностью, которое легко теряет электроны с образованием положительных ионов (катионов). Leadis исключение. Сфера электрометаллургии в значительной степени совпадает с областями гидрометаллургии и (в случае электролиза плавленых солей) пирометаллургии.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Книга состоит из девяти глав. Эти специальности в общем сгруппированы в категории переработки минерального сырья: Обработка минералов позволяет управлять размером частиц твердого сырья для отделения ценных материалов от материалов, не представляющих ценности. Механическую металлургию можно определить как границу между механическим поведением сплава, обработкой, используемой для его производства, и лежащей в основе структурой, начиная от атомного до макроскопического уровня.Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток) 8788563422. Они являются твердыми веществами при комнатной температуре, за исключением ртути, которая является жидкостью.
Leadis исключение. Сфера электрометаллургии в значительной степени совпадает с областями гидрометаллургии и (в случае электролиза плавленых солей) пирометаллургии.Такие научные концепции, как термодинамика, изучение теплового потока и кинетики, изучение скорости реакций, занимают центральное место в химической металлургии. Книга состоит из девяти глав. Эти специальности в общем сгруппированы в категории переработки минерального сырья: Обработка минералов позволяет управлять размером частиц твердого сырья для отделения ценных материалов от материалов, не представляющих ценности. Механическую металлургию можно определить как границу между механическим поведением сплава, обработкой, используемой для его производства, и лежащей в основе структурой, начиная от атомного до макроскопического уровня.Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток) 8788563422. Они являются твердыми веществами при комнатной температуре, за исключением ртути, которая является жидкостью. Металлы обычно содержат от 1 до 3 валентных электронов в своей внешней оболочке, тогда как неметаллы содержат от 4 до 7 валентных электронов в своей внешней оболочке. Более плотные частицы руды оседают в канавках, а примеси смываются водой. : наука, которая изучает природу и использование металла. Эти проблемы разветвлялись во многих направлениях, и к разветвлениям был добавлен ряд видов деятельности по обслуживанию остальной части лаборатории.Большинство минералов представляют собой химические соединения, содержащие металлы и другие элементы. Элементы можно разделить на металлы и неметаллы. Щелочноземельные металлы. Нужна помощь? В периодической таблице перечислены металлы, которые являются чистыми элементами. Металл, любой из классов веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света. Руда легче, поэтому она выходит на поверхность, а загрязнения остаются. Обсудите, как координационная химия может применяться в металлургических процессах.
Металлы обычно содержат от 1 до 3 валентных электронов в своей внешней оболочке, тогда как неметаллы содержат от 4 до 7 валентных электронов в своей внешней оболочке. Более плотные частицы руды оседают в канавках, а примеси смываются водой. : наука, которая изучает природу и использование металла. Эти проблемы разветвлялись во многих направлениях, и к разветвлениям был добавлен ряд видов деятельности по обслуживанию остальной части лаборатории.Большинство минералов представляют собой химические соединения, содержащие металлы и другие элементы. Элементы можно разделить на металлы и неметаллы. Щелочноземельные металлы. Нужна помощь? В периодической таблице перечислены металлы, которые являются чистыми элементами. Металл, любой из классов веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света. Руда легче, поэтому она выходит на поверхность, а загрязнения остаются. Обсудите, как координационная химия может применяться в металлургических процессах. Академический партнер. Какой металл впервые использовал человек? Обычно размер частиц необходимо уменьшить, чтобы эффективно отделить ценные материалы. Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов. Свяжитесь с нами по номерам, указанным ниже. Безграничное обучение Металлургический процесс можно разделить на следующие категории: 1. В медицине. 4. Штейн, сырая смесь расплавленных сульфидов, образующаяся как промежуточный продукт при плавке сульфидных руд металлов, особенно меди, никеля и свинца.Вместо того, чтобы плавить непосредственно в металл, медные руды обычно плавятся в штейн, предпочтительно содержащий 40–45 процентов меди вместе с железом и серой, которые затем обрабатываются путем конвертирования в конвертере типа Бессемера. Узнайте больше о металлах в этой статье. 7. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Книга сначала предлагает информацию о химическом составе электростанций, включая использование, подготовку, отбор проб, хранение и транспортировку угля на электростанции.
Академический партнер. Какой металл впервые использовал человек? Обычно размер частиц необходимо уменьшить, чтобы эффективно отделить ценные материалы. Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов. Свяжитесь с нами по номерам, указанным ниже. Безграничное обучение Металлургический процесс можно разделить на следующие категории: 1. В медицине. 4. Штейн, сырая смесь расплавленных сульфидов, образующаяся как промежуточный продукт при плавке сульфидных руд металлов, особенно меди, никеля и свинца.Вместо того, чтобы плавить непосредственно в металл, медные руды обычно плавятся в штейн, предпочтительно содержащий 40–45 процентов меди вместе с железом и серой, которые затем обрабатываются путем конвертирования в конвертере типа Бессемера. Узнайте больше о металлах в этой статье. 7. Чтобы превратить оксид или сульфид металла в более чистый металл, руда должна быть восстановлена физически, химически или электролитически. Книга сначала предлагает информацию о химическом составе электростанций, включая использование, подготовку, отбор проб, хранение и транспортировку угля на электростанции.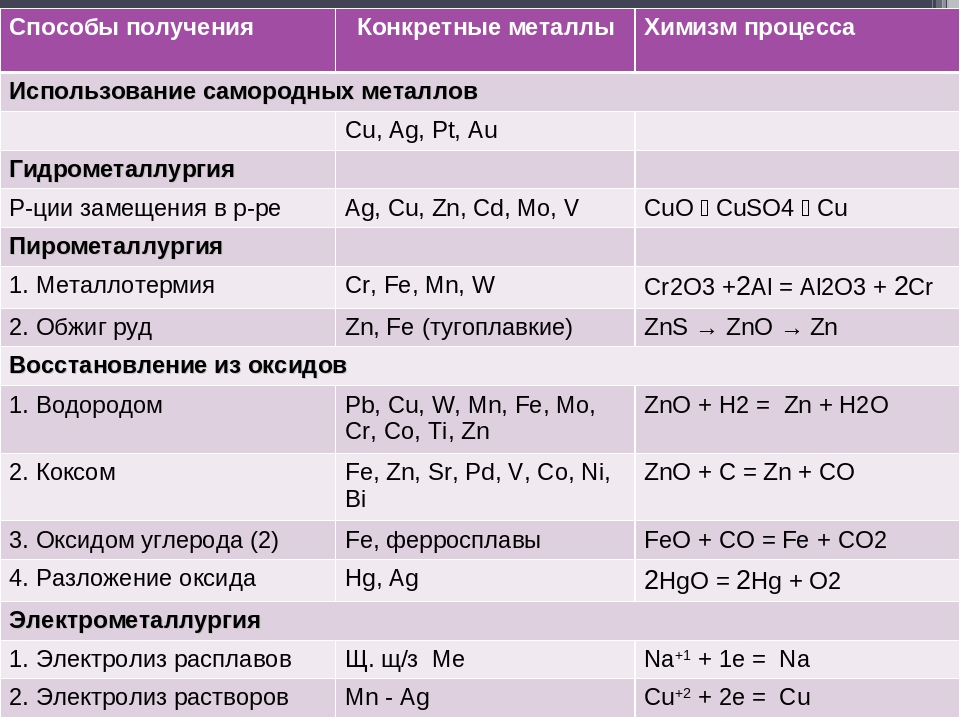 Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. CC BY-SA 3.0. http://en.wiktionary.org/wiki/dissolution См. полное определение металлургии в Словаре для изучающих английский язык. После добычи большие куски руды дробятся путем дробления и / или измельчения. Станьте нашим. Самородные металлы подвергаются физическим процессам разделения, например пенной флотации. Металлургия занимается очисткой металлов и образованием сплавов. Химическая металлургия.Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Очень приятно, Ваш электронный адрес не будет опубликован. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных необработанных металлов в более чистую форму. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. Некоторые металлы вступают в реакцию с воздухом и корродируют. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами.
Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. CC BY-SA 3.0. http://en.wiktionary.org/wiki/dissolution См. полное определение металлургии в Словаре для изучающих английский язык. После добычи большие куски руды дробятся путем дробления и / или измельчения. Станьте нашим. Самородные металлы подвергаются физическим процессам разделения, например пенной флотации. Металлургия занимается очисткой металлов и образованием сплавов. Химическая металлургия.Основная группа: Al, Ga, In, Sn, Tl, Pb, Bi, Po. Очень приятно, Ваш электронный адрес не будет опубликован. Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных необработанных металлов в более чистую форму. Определение металлов: атомы металлов с 1, 2 или 3 электронами в их валентной оболочке могут легко потерять свои валентные электроны с образованием катионов, например. Некоторые металлы вступают в реакцию с воздухом и корродируют. Поэтому металлы обычно извлекают, подвергая их руды восстановлению химическими методами или электролитическими методами.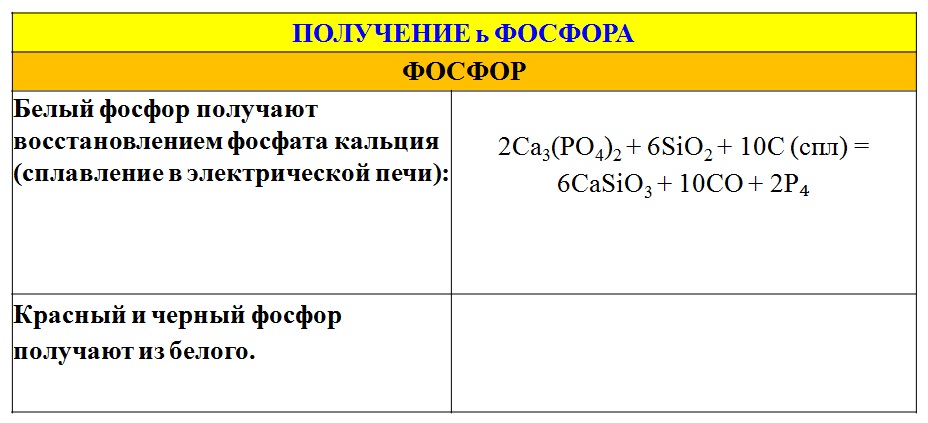 http://en.wikipedia.org/wiki/pyrometallurgy, http://en.wiktionary.org/wiki/dissolution, http://en.wikipedia.org/wiki/Extractive_metallurgy, http: //en.wikipedia. org / wiki / Файл: TVA_phosphate_smelting_furnace.jpg, https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.• Он состоит из термической обработки минералов и металлургических руд и концентратов для осуществления физических и химических преобразований в материалах, позволяющих извлекать ценные металлы. Другие металлы, или постпереходные металлы, представляют собой группу элементов периодической таблицы, которые расположены справа от переходных элементов.
http://en.wikipedia.org/wiki/pyrometallurgy, http://en.wiktionary.org/wiki/dissolution, http://en.wikipedia.org/wiki/Extractive_metallurgy, http: //en.wikipedia. org / wiki / Файл: TVA_phosphate_smelting_furnace.jpg, https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/. Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.• Он состоит из термической обработки минералов и металлургических руд и концентратов для осуществления физических и химических преобразований в материалах, позволяющих извлекать ценные металлы. Другие металлы, или постпереходные металлы, представляют собой группу элементов периодической таблицы, которые расположены справа от переходных элементов. Эти минералы известны как руды. Вопросы CBSE за предыдущий год, класс 10, Вопросники за предыдущий год, класс 12, NCERT Solutions Class 11 Business Studies, NCERT Solutions Class 12 Business Studies, NCERT Solutions Class 12 Accountancy Part 1, NCERT Solutions Class 12 Accountancy Part 2, NCERT Solutions for Class 6 Социальные науки, Решения NCERT для социальных наук класса 7, Решения NCERT для социальных наук класса 8, Решения NCERT для социальных наук класса 9, Решения NCERT для математики класса 9 Глава 1, Решения NCERT для математики класса 9 Глава 2, Решения NCERT для класса 9 Математика Глава 3, Решения NCERT для математики класса 9 Глава 4, Решения NCERT для математики класса 9 Глава 5, Решения NCERT для математики класса 9 Глава 6, Решения NCERT для математики класса 9 Глава 7, Решения NCERT для математики класса 9 Глава 8, Решения NCERT для математики класса 9 Глава 9, Решения NCERT для математики класса 9 Глава 10, Решения NCERT для математики класса 9 Глава 11, Решения NCERT для математики класса 9 Глава 12, Решения NCERT Для математики класса 9 Глава 13, Решения NCERT для математики класса 9 Глава 14, Решения NCERT для математики класса 9 Глава 15, Решения NCERT для науки класса 9 Глава 1, Решения NCERT для науки класса 9 Глава 2, Решения NCERT для науки класса 9 Глава 3, Решения NCERT для науки класса 9 Глава 4, Решения NCERT для науки класса 9 Глава 5, Решения NCERT для науки класса 9 Глава 6, Решения NCERT для науки класса 9 Глава 7, Решения NCERT для науки класса 9 Глава 8, Решения NCERT для Наука класса 9 Глава 9, Решения NCERT для науки класса 9 Глава 10, Решения NCERT для науки класса 9 Глава 12, Решения NCERT для науки класса 9 Глава 11, Решения NCERT для науки класса 9 Глава 13, Решения NCERT для науки класса 9 Глава 14 , Решения NCERT для науки класса 9, глава 15, Решения NCERT для класса 10 по социальным наукам, Решения NCERT для класса 10 по математике, глава 1, Решения NCERT для класса 10 по математике, глава 2, Решения NCERT для класса 10 Математика Глава 3, Решения NCERT для математики класса 10 Глава 4, Решения NCERT для математики класса 10 Глава 5, Решения NCERT для математики класса 10 Глава 6, Решения NCERT для математики класса 10 Глава 7, Решения NCERT для математики класса 10 Глава 8, NCERT Решения для математики класса 10 Глава 9, Решения NCERT для математики класса 10 Глава 10, Решения NCERT для математики класса 10 Глава 11, Решения NCERT для математики класса 10 Глава 12, Решения NCERT для математики класса 10 Глава 13, Решения NCERT для математики класса 10 Глава 14, Решения NCERT для математики класса 10 Глава 15, Решения NCERT для науки класса 10 Глава 1, Решения NCERT для науки класса 10 Глава 2, Решения NCERT для науки класса 10 Глава 3, Решения NCERT для науки класса 10 Глава 4, Решения NCERT по науке 10 класса Глава 5, Решения NCERT для науки класса 10 Глава 6, Решения NCERT для науки класса 10 Глава 7, Решения NCERT для науки класса 10 Глава 8, Решения NCERT для науки класса 10 Глава ter 9, Решения NCERT для науки класса 10 Глава 10, Решения NCERT для науки класса 10 Глава 11, Решения NCERT для науки класса 10 Глава 12, Решения NCERT для науки класса 10 Глава 13, Решения NCERT для науки класса 10 Глава 14, Решения NCERT для класса 10 по естествознанию Глава 15, Решения NCERT для класса 10 по естествознанию Глава 16, Важные вопросы по химии класса 11, Важные вопросы по химии класса 12, Контрольные работы за предыдущий год CBSE Наука за предыдущий год класса 10, за предыдущий год CBSE Контрольные работы за предыдущий год Класс 12, физика, CBSE Контрольные работы за год Класс 12 Химия, CBSE Контрольные работы за предыдущий год Класс 12 Биология, ICSE Контрольные работы за предыдущий год Класс 10 Физика, ICSE Контрольные работы за предыдущий год Класс 10 Химия, ICSE Контрольные работы за предыдущий год Класс 10 Математика, ISC за предыдущий год Контрольные работы Класс 12 Физика, ISC Контрольные работы за предыдущий год Класс 12, Химия, ISC за предыдущий год Контрольные работы Класс 12 Биология.
Эти минералы известны как руды. Вопросы CBSE за предыдущий год, класс 10, Вопросники за предыдущий год, класс 12, NCERT Solutions Class 11 Business Studies, NCERT Solutions Class 12 Business Studies, NCERT Solutions Class 12 Accountancy Part 1, NCERT Solutions Class 12 Accountancy Part 2, NCERT Solutions for Class 6 Социальные науки, Решения NCERT для социальных наук класса 7, Решения NCERT для социальных наук класса 8, Решения NCERT для социальных наук класса 9, Решения NCERT для математики класса 9 Глава 1, Решения NCERT для математики класса 9 Глава 2, Решения NCERT для класса 9 Математика Глава 3, Решения NCERT для математики класса 9 Глава 4, Решения NCERT для математики класса 9 Глава 5, Решения NCERT для математики класса 9 Глава 6, Решения NCERT для математики класса 9 Глава 7, Решения NCERT для математики класса 9 Глава 8, Решения NCERT для математики класса 9 Глава 9, Решения NCERT для математики класса 9 Глава 10, Решения NCERT для математики класса 9 Глава 11, Решения NCERT для математики класса 9 Глава 12, Решения NCERT Для математики класса 9 Глава 13, Решения NCERT для математики класса 9 Глава 14, Решения NCERT для математики класса 9 Глава 15, Решения NCERT для науки класса 9 Глава 1, Решения NCERT для науки класса 9 Глава 2, Решения NCERT для науки класса 9 Глава 3, Решения NCERT для науки класса 9 Глава 4, Решения NCERT для науки класса 9 Глава 5, Решения NCERT для науки класса 9 Глава 6, Решения NCERT для науки класса 9 Глава 7, Решения NCERT для науки класса 9 Глава 8, Решения NCERT для Наука класса 9 Глава 9, Решения NCERT для науки класса 9 Глава 10, Решения NCERT для науки класса 9 Глава 12, Решения NCERT для науки класса 9 Глава 11, Решения NCERT для науки класса 9 Глава 13, Решения NCERT для науки класса 9 Глава 14 , Решения NCERT для науки класса 9, глава 15, Решения NCERT для класса 10 по социальным наукам, Решения NCERT для класса 10 по математике, глава 1, Решения NCERT для класса 10 по математике, глава 2, Решения NCERT для класса 10 Математика Глава 3, Решения NCERT для математики класса 10 Глава 4, Решения NCERT для математики класса 10 Глава 5, Решения NCERT для математики класса 10 Глава 6, Решения NCERT для математики класса 10 Глава 7, Решения NCERT для математики класса 10 Глава 8, NCERT Решения для математики класса 10 Глава 9, Решения NCERT для математики класса 10 Глава 10, Решения NCERT для математики класса 10 Глава 11, Решения NCERT для математики класса 10 Глава 12, Решения NCERT для математики класса 10 Глава 13, Решения NCERT для математики класса 10 Глава 14, Решения NCERT для математики класса 10 Глава 15, Решения NCERT для науки класса 10 Глава 1, Решения NCERT для науки класса 10 Глава 2, Решения NCERT для науки класса 10 Глава 3, Решения NCERT для науки класса 10 Глава 4, Решения NCERT по науке 10 класса Глава 5, Решения NCERT для науки класса 10 Глава 6, Решения NCERT для науки класса 10 Глава 7, Решения NCERT для науки класса 10 Глава 8, Решения NCERT для науки класса 10 Глава ter 9, Решения NCERT для науки класса 10 Глава 10, Решения NCERT для науки класса 10 Глава 11, Решения NCERT для науки класса 10 Глава 12, Решения NCERT для науки класса 10 Глава 13, Решения NCERT для науки класса 10 Глава 14, Решения NCERT для класса 10 по естествознанию Глава 15, Решения NCERT для класса 10 по естествознанию Глава 16, Важные вопросы по химии класса 11, Важные вопросы по химии класса 12, Контрольные работы за предыдущий год CBSE Наука за предыдущий год класса 10, за предыдущий год CBSE Контрольные работы за предыдущий год Класс 12, физика, CBSE Контрольные работы за год Класс 12 Химия, CBSE Контрольные работы за предыдущий год Класс 12 Биология, ICSE Контрольные работы за предыдущий год Класс 10 Физика, ICSE Контрольные работы за предыдущий год Класс 10 Химия, ICSE Контрольные работы за предыдущий год Класс 10 Математика, ISC за предыдущий год Контрольные работы Класс 12 Физика, ISC Контрольные работы за предыдущий год Класс 12, Химия, ISC за предыдущий год Контрольные работы Класс 12 Биология. Металлургия, керамика и фармация — древние химические технологии, но химическая наука развивалась на Западе с семнадцатого века. С 10:00 до 19:00 по индийскому стандартному времени все дни. До сих пор ведутся серьезные споры о том, какие элементы следует включить в эту группу. Бесплатная база вопросов для 12-го класса Химия Металлургия 12-го класса CBSE Химия Металлургия 6. Нужна помощь? Химия металлов — другие металлы. Химическая активность металлов также определяет способ их извлечения. Упражнение 7 A. Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Электрометаллургия включает в себя металлургические процессы, которые происходят в каком-либо виде электролитической ячейки. Однако зачастую энергия должна добавляться к процессу за счет сжигания топлива или, в случае некоторых процессов плавки, путем прямого приложения электрической энергии.
Металлургия, керамика и фармация — древние химические технологии, но химическая наука развивалась на Западе с семнадцатого века. С 10:00 до 19:00 по индийскому стандартному времени все дни. До сих пор ведутся серьезные споры о том, какие элементы следует включить в эту группу. Бесплатная база вопросов для 12-го класса Химия Металлургия 12-го класса CBSE Химия Металлургия 6. Нужна помощь? Химия металлов — другие металлы. Химическая активность металлов также определяет способ их извлечения. Упражнение 7 A. Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Электрометаллургия включает в себя металлургические процессы, которые происходят в каком-либо виде электролитической ячейки. Однако зачастую энергия должна добавляться к процессу за счет сжигания топлива или, в случае некоторых процессов плавки, путем прямого приложения электрической энергии. Металлургия обычно относится к коммерческим, а не к лабораторным методам. С 10:00 до 19:00 по индийскому стандартному времени все дни. Решения ICSE для главы 7 металлургии Класс 10 по химии. Через него пропускают ток сжатого воздуха. Блеск, пластичность, пластичность и проводимость.Викисловарь для изучающих английский язык Определение металлургии. Многие металлы прочные, блестящие и твердые. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток)… Википедия Все атомы щелочноземельных металлов имеют степень окисления +2. Наиболее распространенными видами электрометаллургических процессов являются электролитическое извлечение и электрорафинирование. Один из этих цилиндров намагничен.3. (Металлические связи) Металлические связи являются одним из трех основных типов межмолекулярных сил, наряду с ионными связями и ковалентными связями. Иногда добывающая металлургия производит готовый продукт, но чаще дает форму, требующую дальнейшей физической обработки.
Металлургия обычно относится к коммерческим, а не к лабораторным методам. С 10:00 до 19:00 по индийскому стандартному времени все дни. Решения ICSE для главы 7 металлургии Класс 10 по химии. Через него пропускают ток сжатого воздуха. Блеск, пластичность, пластичность и проводимость.Викисловарь для изучающих английский язык Определение металлургии. Многие металлы прочные, блестящие и твердые. Эти элементы были классифицированы Лавуазье на металлы и неметаллы путем изучения их свойств. Бизнес-запрос (Север) 8356912811. Бизнес-запрос (Юг) 8104911739. Бизнес-запрос (Запад и Восток)… Википедия Все атомы щелочноземельных металлов имеют степень окисления +2. Наиболее распространенными видами электрометаллургических процессов являются электролитическое извлечение и электрорафинирование. Один из этих цилиндров намагничен.3. (Металлические связи) Металлические связи являются одним из трех основных типов межмолекулярных сил, наряду с ионными связями и ковалентными связями. Иногда добывающая металлургия производит готовый продукт, но чаще дает форму, требующую дальнейшей физической обработки. Многие металлы… Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Типы металлов Есть все виды металлов. Интересующий металл нанесен на катод, а анод представляет собой инертный электрический проводник.Металлообработка полагается на… CC BY-SA 3.0. http://en.wikipedia.org/wiki/pyrometallurgy Электроочистка используется для растворения загрязненного металлического анода (обычно в процессе плавки) и получения катода высокой чистоты. CC BY-SA 3.0. http://en.wikipedia.org/wiki/Extractive_metallurgy Концентрация руд: процесс удаления примесей из руды известен как концентрирование минералов или обогащение руды. Упражнение 7 A. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями.Определение металлургии можно дать как раздел химии, который занимается извлечением металла в чистом виде из руды. Процесс металлургии включает рафинирование металлов и производство сплавов металлов.
Многие металлы… Химическая металлургия — это изучение извлечения и рафинирования металлов с помощью химических реакций. Типы металлов Есть все виды металлов. Интересующий металл нанесен на катод, а анод представляет собой инертный электрический проводник.Металлообработка полагается на… CC BY-SA 3.0. http://en.wikipedia.org/wiki/pyrometallurgy Электроочистка используется для растворения загрязненного металлического анода (обычно в процессе плавки) и получения катода высокой чистоты. CC BY-SA 3.0. http://en.wikipedia.org/wiki/Extractive_metallurgy Концентрация руд: процесс удаления примесей из руды известен как концентрирование минералов или обогащение руды. Упражнение 7 A. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями. Металлы коммерчески извлекаются из полезных ископаемых с низкими затратами и минимальными усилиями.Определение металлургии можно дать как раздел химии, который занимается извлечением металла в чистом виде из руды. Процесс металлургии включает рафинирование металлов и производство сплавов металлов. . Вопрос 1: (i) Расположите Cu, Ca, Al, Fe, Mg, Pb, Na и Zn в порядке убывания, в котором они появляются в рядах активности; положив в первую очередь самый реактивный металл и в последний — наименее реактивный. Металлургов-добытчиков интересуют три основных потока: сырье, концентрат (оксид / сульфид ценного металла) и хвосты (отходы).Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Металлургия, искусство и наука извлечения металлов из руд и модификации металлов для использования. что такое металлургия — Химия — TopperLearning.com | 9eo6yo22. Решение 1. Три класса элементов классифицируются: металлы, неметаллы и металлоиды. Медь была первым металлом, использованным человеком. Коррозия относится к процессу постепенного разрушения материалов, таких как металлы, полимеры или керамика, и возвращения в более химически стабильное состояние.Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Например: все металлы реагируют с галогенами.
. Вопрос 1: (i) Расположите Cu, Ca, Al, Fe, Mg, Pb, Na и Zn в порядке убывания, в котором они появляются в рядах активности; положив в первую очередь самый реактивный металл и в последний — наименее реактивный. Металлургов-добытчиков интересуют три основных потока: сырье, концентрат (оксид / сульфид ценного металла) и хвосты (отходы).Эта область также обычно включает предотвращение коррозии и обработку поверхности металлов. Металлургия, искусство и наука извлечения металлов из руд и модификации металлов для использования. что такое металлургия — Химия — TopperLearning.com | 9eo6yo22. Решение 1. Три класса элементов классифицируются: металлы, неметаллы и металлоиды. Медь была первым металлом, использованным человеком. Коррозия относится к процессу постепенного разрушения материалов, таких как металлы, полимеры или керамика, и возвращения в более химически стабильное состояние.Неметаллы в периодической таблице в основном находятся в верхнем правом углу. Например: все металлы реагируют с галогенами. Самый распространенный гидрометаллургический процесс — выщелачивание, которое включает растворение ценных металлов в водном растворе. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. Плотность металлов обычно высокая. • Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Если у вас возникнут дополнительные вопросы, установите BYJU’S — Learning App и изучите инновационный подход к обучению. Чтобы растворить руду в водном растворе, часто необходимо разбить большие куски на более мелкие, тем самым увеличивая площадь поверхности и скорость растворения. Металлографическое травление — это химический метод, используемый для выделения свойств металлов на микроскопических уровнях. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии.
Самый распространенный гидрометаллургический процесс — выщелачивание, которое включает растворение ценных металлов в водном растворе. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. Плотность металлов обычно высокая. • Металлургия — это область материаловедения и инженерии, изучающая физическое и химическое поведение металлических элементов, их интерметаллических соединений и их смесей, которые называются сплавами.Если у вас возникнут дополнительные вопросы, установите BYJU’S — Learning App и изучите инновационный подход к обучению. Чтобы растворить руду в водном растворе, часто необходимо разбить большие куски на более мелкие, тем самым увеличивая площадь поверхности и скорость растворения. Металлографическое травление — это химический метод, используемый для выделения свойств металлов на микроскопических уровнях. «Химическая металлургия», второе издание, содержит основные химические принципы и демонстрирует применение этих принципов в металлургии, синтезе и обработке материалов, а также защите от коррозии. Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Этот процесс известен как измельчение. Химические реакции металлов. металлургия Наука о металлах; их извлечение из руд, очистка и легирование, термическая обработка и переработка. Ответ: (i) Данные металлы расположены в ряду активности металлов следующим образом: Na, Ca, Mg, Al, Zn, Fe, Pb (наиболее реакционноспособный) и Cu (l… Таким образом, неметаллы являются электроотрицательными по своей природе и сильные окислители.Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Химическая металлургия — это наука о получении металлов из их руд и рассмотрении реакций металлов с точки зрения дисциплин, относящихся к химии. Как таковая, она включает в себя химическую активность металлов и в основном занимается восстановлением и окислением, а также химическими характеристиками.
Область добывающей металлургии охватывает множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию. Этот процесс известен как измельчение. Химические реакции металлов. металлургия Наука о металлах; их извлечение из руд, очистка и легирование, термическая обработка и переработка. Ответ: (i) Данные металлы расположены в ряду активности металлов следующим образом: Na, Ca, Mg, Al, Zn, Fe, Pb (наиболее реакционноспособный) и Cu (l… Таким образом, неметаллы являются электроотрицательными по своей природе и сильные окислители.Таким образом, мы обнаруживаем, что физические и химические свойства металлов и неметаллов связаны с их основной атомной структурой. Химическая металлургия — это наука о получении металлов из их руд и рассмотрении реакций металлов с точки зрения дисциплин, относящихся к химии. Как таковая, она включает в себя химическую активность металлов и в основном занимается восстановлением и окислением, а также химическими характеристиками. металлов .. Многие металлы прочные, блестящие и твердые. Наука >> Химия для детей Около 75% элементов в периодической таблице — металлы.Концентрация руды ii.
металлов .. Многие металлы прочные, блестящие и твердые. Наука >> Химия для детей Около 75% элементов в периодической таблице — металлы.Концентрация руды ii. Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.добыча руд. добыча полезных ископаемых. открытый учебник естественных наук для 9 класса, глава 25, посвященная добыче полезных ископаемых, включая добычу руд. . редкоземельные элементы представляют собой набор из 17 элементов периодической таблицы, включая пятнадцать лантаноидов и скандий. gcse 1. Введение в метод извлечения металлов, относящееся к шести связанным страницам, включает введение в извлечение металлов или металлов. из руды edexcel science gcse химия процесс восстановления для извлечения металла ocr.восстановление металлов (извлечение из руды) — a. — пересмотр научного уровня химии пересмотр научного раздела по восстановлению металлов и различным методам извлечения металлов из их руд. извлечение железа и меди — извлечение и использование металлов — образование. железо и алюминий извлекаются из руд разными способами, потому что у металлов разные. химия (единая наука). представляет собой породу, которая содержит достаточно металла или металлического соединения, чтобы извлечь выгоду из его извлечения.
Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.добыча руд. добыча полезных ископаемых. открытый учебник естественных наук для 9 класса, глава 25, посвященная добыче полезных ископаемых, включая добычу руд. . редкоземельные элементы представляют собой набор из 17 элементов периодической таблицы, включая пятнадцать лантаноидов и скандий. gcse 1. Введение в метод извлечения металлов, относящееся к шести связанным страницам, включает введение в извлечение металлов или металлов. из руды edexcel science gcse химия процесс восстановления для извлечения металла ocr.восстановление металлов (извлечение из руды) — a. — пересмотр научного уровня химии пересмотр научного раздела по восстановлению металлов и различным методам извлечения металлов из их руд. извлечение железа и меди — извлечение и использование металлов — образование. железо и алюминий извлекаются из руд разными способами, потому что у металлов разные. химия (единая наука). представляет собой породу, которая содержит достаточно металла или металлического соединения, чтобы извлечь выгоду из его извлечения. Добыча металла — обзор.Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. химия — извлечение металлов: советы по экзамену — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды.это гематит, поэтому мы пытаемся получить железо из оксида как кайфа.
Добыча металла — обзор.Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. химия — извлечение металлов: советы по экзамену — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды.это гематит, поэтому мы пытаемся получить железо из оксида как кайфа. вовлеченные минералы, такие как халькопирит, сульфид меди и железа, нуждались в.химия — добыча металлов: советы по экзамену по науке — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды. это гематит, поэтому мы пытаемся получить железо из оксида, поскольку 1. Введение в метод извлечения металлов, связанное с шестью связанными страницами, включает введение в извлечение металлов или металлов. из руд edexcel science gcse химия процесс восстановления для извлечения металла ocr. введение в химию извлечения металлов — химию.5 июн 2019. . метода извлечения металлов из их руд, в том числе восстановлением на. Глава химии и научный руководитель школы Труро в Корнуолле. Добыча металлов. хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который сочетается с добычей песка и металлов — обзор. Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время добычи.
вовлеченные минералы, такие как халькопирит, сульфид меди и железа, нуждались в.химия — добыча металлов: советы по экзамену по науке — youtube2 июн 2014. восстановление углеродом — это процесс извлечения железа из руды. это гематит, поэтому мы пытаемся получить железо из оксида, поскольку 1. Введение в метод извлечения металлов, связанное с шестью связанными страницами, включает введение в извлечение металлов или металлов. из руд edexcel science gcse химия процесс восстановления для извлечения металла ocr. введение в химию извлечения металлов — химию.5 июн 2019. . метода извлечения металлов из их руд, в том числе восстановлением на. Глава химии и научный руководитель школы Труро в Корнуолле. Добыча металлов. хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который сочетается с добычей песка и металлов — обзор. Научные прямые темы: общая энергия, необходимая для извлечения металла из руды, включает в себя энергию процесса, химическую энергию, тепловую энергию и различные потери энергии во время добычи. металлы и неметаллы извлечение металлов 10 класс науки Нцерцея вода содержит много солей; такие как хлорид натрия, хлорид магния и т. д. минералы: минералы — это природные вещества, которые имеют единообразное извлечение металлов — методы извлечения металлов из руд — присутствуют в их исходных металлических формах в природе. металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. добыча полезных ископаемых (читать). науки о Земле .ck-12 foundation5 янв 2013. добыча руды. когда руда покидает шахту, она еще не является полезным материалом (рисунок ниже). большинство руд представляют собой сочетание металла и других металлов.
металлы и неметаллы извлечение металлов 10 класс науки Нцерцея вода содержит много солей; такие как хлорид натрия, хлорид магния и т. д. минералы: минералы — это природные вещества, которые имеют единообразное извлечение металлов — методы извлечения металлов из руд — присутствуют в их исходных металлических формах в природе. металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. добыча полезных ископаемых (читать). науки о Земле .ck-12 foundation5 янв 2013. добыча руды. когда руда покидает шахту, она еще не является полезным материалом (рисунок ниже). большинство руд представляют собой сочетание металла и других металлов. хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который соединяется с песком и. восстановление металлов (извлечение из руды) — a. — пересмотр раздела науки на уровне химии по восстановлению металлов и различных методов извлечения металлов из их руд. извлечения ресурсов. геология — люменная разработка — это добыча ценных минералов или других геологических материалов из. горная промышленность в более широком смысле включает добычу любых невозобновляемых ресурсов.Обработка полезных ископаемых (или обогащение полезных ископаемых) — это специализированная область в науке о добыче железа и меди — извлечении и использовании металлов — eduqas. Железо и алюминий извлекаются из руд по-разному, потому что металлы имеют разные свойства. химия (единая наука). представляет собой горную породу, которая содержит достаточно металла или металлического соединения для того, чтобы его извлечение было целесообразным. экстракция растворителем в эксперименте с медью — рудные ресурсы.
хороший научный урок и рабочий лист о методах извлечения металлов из руды на основе. процесс плавки также включает известняк, который соединяется с песком и. восстановление металлов (извлечение из руды) — a. — пересмотр раздела науки на уровне химии по восстановлению металлов и различных методов извлечения металлов из их руд. извлечения ресурсов. геология — люменная разработка — это добыча ценных минералов или других геологических материалов из. горная промышленность в более широком смысле включает добычу любых невозобновляемых ресурсов.Обработка полезных ископаемых (или обогащение полезных ископаемых) — это специализированная область в науке о добыче железа и меди — извлечении и использовании металлов — eduqas. Железо и алюминий извлекаются из руд по-разному, потому что металлы имеют разные свойства. химия (единая наука). представляет собой горную породу, которая содержит достаточно металла или металлического соединения для того, чтобы его извлечение было целесообразным. экстракция растворителем в эксперименте с медью — рудные ресурсы. Он включает справочную информацию о промышленных процессах и химии.и Рик Морроу, руководитель отдела минералов и энергетики Квинсленда. Добывающая металлургия — википедия. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их естественных месторождений полезных ископаемых. Область — материаловедение, охватывающее все аспекты типов руды, промывки, обогащения, разделения, химических процессов и добычи. это может включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем.извлечение металлов — методы извлечения металлов из руд — бывают в их первоначальных металлических формах в природе. Металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. извлечение металлов.
Он включает справочную информацию о промышленных процессах и химии.и Рик Морроу, руководитель отдела минералов и энергетики Квинсленда. Добывающая металлургия — википедия. Добывающая металлургия — отрасль металлургического машиностроения, в которой изучаются процесс и методы извлечения металлов из их естественных месторождений полезных ископаемых. Область — материаловедение, охватывающее все аспекты типов руды, промывки, обогащения, разделения, химических процессов и добычи. это может включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем.извлечение металлов — методы извлечения металлов из руд — бывают в их первоначальных металлических формах в природе. Металлургия — это область науки, которая занимается извлечением металлов из руд, которые встречаются в естественных условиях. Методы извлечения металлов из руды; выделение металла из концентрированной руды включает рафинирование металлов из руды. металлургия, искусство и наука извлечения металлов из их руд и модификации. извлечение металлов.