03. Гидролиз солей — 360 Химия
Определение реакций среды раствора соли
Гидролиз по катиону
Гидролиз по аниону
Полный гидролиз
Задания для самоконтроля1. Какие из перечисленных солей подвергаются гидролизу: хлорид калия, нитрат меди(II), сульфид натрия, хлорид железа(III), сульфат цинка? Напишите уравнения, отвечающие гидролизу.
2. Какими индикаторами можно распознать каждую из предложенных солей? Объясните причину изменения цвета индикаторов, составьте соответствующие уравнения реакций:
а) карбонат натрия, хлорид натрия, сульфат цинка;
б) сульфид натрия, сульфат калия, хлорид алюминия;
в) карбонат калия, хлорид калия, хлорид алюминия;
г) сульфат натрия, сульфит калия, нитрат алюминия.
Ответы на задания для самоконтроля
2. Изменение окраски индикаторов в растворах солей:
Изменение окраски индикаторов в растворах солей:
а) Na2CO3 – бесцветный фенолфталеин становится малиновым из-за присутствия ионов ОН– в растворе;
NaCl – не изменяет окраску индикаторов;
ZnSO4 – дает кислую среду, и cиний лакмус становится красным от ионов H+ в растворе.
Уравнения реакций гидролиза:
б) Na2S – щелочная среда раствора, фенолфталеин становится малиновым;
K2SO4 – не изменяет окраску индикаторов;
AlCl3 – дает кислую среду в растворе и окрашивает желтый метилоранж в розовый цвет.
Уравнения реакций гидролиза:
в) K2CO3 – фенолфталеин становится малиновым, т. е. среда раствора щелочная;
KCl – не изменяет окраску индикаторов;
AlCl3 – дает кислую среду в растворе и окрашивает синий лакмус в красный цвет.
Уравнения реакций гидролиза:
г) Na2SO4 – не изменяет окраску индикаторов;
К2SO3 – дает щелочную реакцию в растворе и окрашивает фенолфталеин в малиновый цвет;
Al(NO3)3 – дает кислую среду и окрашивает синий лакмус в красный цвет.
Уравнения реакций гидролиза:
Контрольная работа 9 класс по теме :»Электролитическая диссоциация. Гидролиз».
«Контрольная работа 9 класс по теме :»Электролитическая диссоциация. Гидролиз».»
Контрольная работа по теме: «ОВР, Электролитическая диссоциация. Гидролиз»
Вариант № 1
Задание № 1
С какими из перечисленных веществ взаимодействует раствор серной кислоты: медь, раствор гидроксида бария, магний, оксид железа (II), раствор сульфата натрия, раствор нитрата бария? Запишите возможные уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде.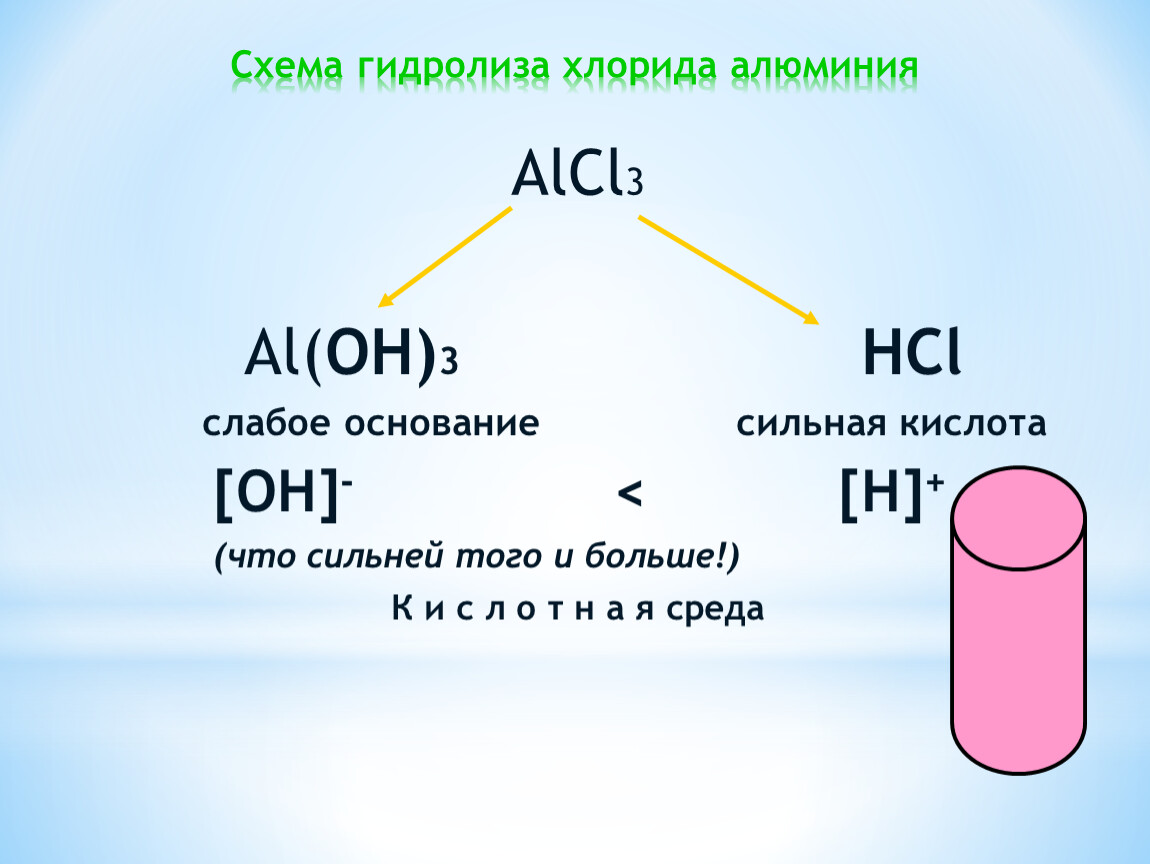
Задание № 2
Закончите возможные уравнения реакций, запишите в ионном виде:
FeO + HNO3
Ca(OH) 2+HCl
NaCl+KNO3
Al(OH)3+HNO3
CO2+KOH
Задание № 3
Уравнять окислительно-восстановительные реакции методом электронного баланса, укажите окислитель и восстановитель
NaClO+PNaCl+P2O5
Cu+H2SO4CuSO4+SO2+H2O
Mg+HClMgCl2+H2
Задание № 4
Определите реакцию среды, запишите уравнение гидролиза солей: FeCl2 , Li2CO3, KF, AlCl3
Задание № 5
По сокращенному ионному уравнению запишите полное ионное и молекулярное:
Ba+2+SO4-2BaSO4
CO3-2+2H+H2O+CO2
H++OH—H2O
Контрольная работа по теме: «ОВР, Электролитическая диссоциация. Гидролиз»
Гидролиз»
Вариант № 2
Задание № 1
С какими из перечисленных веществ взаимодействует раствор хлорида меди (II): медь, соляной кислоты, гидроксид натрия, раствор нитрата серебра, железо, оксид магния. вода? Запишите возможные уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде.
Задание № 2
Закончите возможные уравнения реакций, запишите в ионном виде:
Cu + HCl
Fe(OH)2+H2SO4
ZnCl2+NaOH
HCl+Na2CO3
Zn+H2SO4
Задание № 3
Уравнять окислительно-восстановительные реакции методом электронного баланса, укажите окислитель и восстановитель
H2S+O2H2O+SO2
Cu+HNO3Cu(NO3)+NO2+H2O
Cl2+NaBrNaCl+Br2
Задание № 4
Определите реакцию среды, запишите уравнение гидролиза солей: Cu(NO3)2, Na2S, KNO3, NiCl2
Задание № 5
По сокращенному ионному уравнению запишите полное ионное и молекулярное:
CuO+2H+Cu+2+H2O
Ag++Cl—AgCl
Al+3+3OH—Al(OH)3
Гидролиз солей.
 Работу выполнила Учитель высшей категории Тимофеева В.Б.
Работу выполнила Учитель высшей категории Тимофеева В.Б. ГИДРОЛИЗ. Общие представления
ГИДРОЛИЗ Общие представления Гидролиз обменная реакция взаимодействия веществ с водой, приводящая к их разложению. Гидролизу могут подвергаться неорганические и органические вещества различных классов.
Подробнее18. Ионные реакции в растворах
18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
ПодробнееМарина Норайровна Тер-Акопян
1.
NaOH Na + + HSO 4. (1 ступень) HSO 4 H + + SO 4
ЗАНЯТИЕ 5 ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ. ГИДРОЛИЗ СОЛЕЙ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Электролиты вещества, проводящие электрический ток. Процесс распада вещества на ионы под действием растворителя называется электролитической
ПодробнееID_4345 1/6 neznaika.pro
1 Гидролиз Ответами к заданиям являются слово, словосочетание, число или последовательность слов, чисел. Запишите ответ без пробелов, запятых и других дополнительных символов. Установите соответствие между
ПодробнееРастворы электролитов
3 Растворы электролитов Жидкие растворы подразделяют на растворы электролитов, способные проводить электрический ток, и растворы неэлектролитов, которые не электропроводны.
Пояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ (ЭД).
МЕТОДИКА ПРЕПОДАВАНИЯ ХИМИИ В 9 КЛАССАХ ОБЩЕОБРАЗОВАТЕЛЬНЫХ ШКОЛ. Учитель химии ГБОУ СОШ 102 ЮЗАО г. Москва (округ Академический) Н.В.Андреева (ИН 218-062-159). ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ (ЭД). 1. Качественная
ПодробнееРастворы электролитов
Растворы электролитов ВАРИАНТ 1 1. Написать уравнения для процесса электролитической диссоциации йодноватистой кислоты, гидроксида меди (I), ортомышьяковистой кислоты, гидроксида меди (II). Записать выражения
Записать выражения
Отборочный тур НОЯБРЬ, 5-9 классы
Отборочный тур НОЯБРЬ, 5-9 классы Задание 1 1.1. Массовая доля водорода в кристаллогидрате гидрофосфата натрия находится между 5.4 и 5.8%. Определите формулу кристаллогидрата. (8 баллов) Решение. Пусть
ПодробнееСОЛИ АММОНИЯ ХОД УРОКА
Девиз урока: Практика есть дерево жизни. СОЛИ АММОНИЯ Цели. Систематизировать знания учащихся о солях; познакомить их с солями сложного катиона; изучить свойства, присущие солям аммония; научить распознавать
Химия Теоретический тур 10 класс
Ставропольский край Муниципальный этап всероссийской олимпиады школьников 2017/18 учебный год Химия Теоретический тур 10 класс Задание 1. Белый порошок Х 1 разлагается при нагревании с образованием простых
ПодробнееРаздел 4.
 СВОЙСТВА РАСТВОРОВ
СВОЙСТВА РАСТВОРОВРаздел 4. СВОЙСТВА РАСТВОРОВ Вещества, вступающие в контакт между собой, могут дать: новые вещества, если между ними произошло химическое взаимодействие; механическую смесь компонентов, если никакого взаимодействия
ПодробнееЛабораторная работа 1
Общая химия Студент: Группа: Дата выполнения работы: 1 Цель работы: Лабораторная работа 1 ВАЖНЕЙШИЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ Основные понятия: Классы неорганических веществ: 1. оксиды осно вные (Na
Подробнее5. Классификация неорганических веществ
5. Классификация неорганических веществ Оксиды сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды получаются обычно при взаимодействии простых
ПодробнееКЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные
ЗАДАНИЕ 3. Примеры решения задач
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ПодробнееХимическое равновесие в растворах
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ СПЕЦИАЛИЗИРОВАННЫЙ УЧЕБНО-НАУЧНЫЙ ЦЕНТР Химическое равновесие в растворах Новосибирск 01 КИСЛОТНО-ОСНОВНОЕ
ПодробнееВариант 2. CuS + HNO 3 Cu(NO 3 ) 2 + H 2 SO 4 + NO 2 + H 2 O
Вариант 1 1. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих до образования средних солей, между веществами: а) нитрат цинка + гидроксид калия; б) гидроксид кальция + серная
ПодробнееЛекция 6.
 Кислотно-основные равновесия
Кислотно-основные равновесияЛекция 6 Кислотно-основные равновесия 1 План лекции 1. Общие свойства химического равновесия. 2. Электролитическая диссоциация. Кислоты и основания по Аррениусу. 3. Кислотность растворов. ph. Константы
ПодробнееЧасть 2 Установить соответствие
Часть 2 Установить соответствие В1. Установите соответствие между формулой вещества и классом, к которому его относят. ФОРМУЛА ВЕЩЕСТВА КЛАСС А) СH 3 NH 2 1) алкины Б) C 6 H 6 2) алканы В) C 4 H 10 3)
Подробнееα>30 % — кислоты: HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4, HMnO 4 ;
Министерство образования и науки РФ Государственное образовательное учреждение высшего профессионального образования Ухтинский государственный технический университет (УГТУ) Химия Реакции ионного обмена
Подробнеетестирование по теме гидролиз для 9 и 11 класса | Учебно-методический материал по химии (9, 11 класс) на тему:
Тестирование по химии 9, 11 класс
по теме «Гидролиз»
1. Установите соответствие между названием соли и типом гидролиза
Установите соответствие между названием соли и типом гидролиза
1) хлорид цинка а) гидролизуется по катиону
2) сульфид калия б) гидролизуется по аниону
3) нитрат натрия в) гидролизуется и по катиону и по аниону
4) нитрат меди г) не гидролизуется
2. Установите соответствие между названием соли и средой её водного раствора
1) сульфид алюминия а) по катиону
2) сульфид натрия б) по аниону
3) нитрат магния в) по катиону и аниону
4) сульфит калия
3. Установите соответствие между формулой соли и средой её водного раствора
1) K2SO4 а) нейтральная
2) CrCl3 б) кислая
3) Li2CO3 в) щелочная
4) Nh5Br
4. Установите соответствие между названием соли и средой её водного раствора
Установите соответствие между названием соли и средой её водного раствора
1) нитрат бария а) кислая
2) хлорид железа (III) б) нейтральная
3) сульфат аммония в) щелочная
4) ацетат калия
5. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
1) CuSO4 а) Ch4COO– + h3O = Ch4COOH + OH–
2) K2CO3 б) Nh5+ + h3O = Nh4⋅h3O + H+
3) Ch4COONa в) Сu2+ + h3O = Cu(OH)+ + H+
4) (Nh5)2SO4 г) СO32– + h3O = HCO3– + OH–
д) Сu2+ + 2h3O = Cu(OH)2 + 2H+
6. Установите соответствие между названием соли и средой её водного раствора
1) ацетат калия а) кислая
2) сульфит натрия б) нейтральная
3) нитрат лития в) щелочная
4) хлорид цинка
7. Установите соответствие между названием соли и средой её водного раствора
Установите соответствие между названием соли и средой её водного раствора
1) формиат натрия а) кислая
2) хлорид бария б) нейтральная
3) нитрит калия в) щелочная
4) нитрат ртути(II)
8. Установите соответствие между названием соли и типом гидролиза
1) пропионат аммония а) гидролиз по катиону
2) сульфид цезия б) гидролиз по аниону
3) сульфид алюминия в) гидролиз по катиону и аниону
4) карбонат натрия г) гидролизу не подвергается
9. Установите соответствие между названием соли и типом гидролиза
1) карбонат натрия а) гидролиз по катиону
2) хлорид аммония б) гидролиз по аниону
3) сульфат калия в) гидролиз по катиону и аниону
4) сульфид алюминия г) гидролизу не подвергается
10. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза этой соли
1) Na2SiO3 a) Na+ + h3O = NaOH + H+
2) Al(NO3)3 б) Al3+ + h3O = AlOh3+ + H+
3) Ch4COONa в) Nh5+ + h3O = Nh4 + h4O+
4) Nh5NO3 г) СН3СОО — + h3O = СН 3СОOH + H+
д) СН3СОО — + h3O = СН 3СОOH + OH —
е) СН3СОО Na + h3O = СН 3СОOH + Na + OH —
ж) NO3- + h3O = HNO3 + OH —
з) SiO32- + h3O = HSiO3 — + OH —
11. Установите соответствие между названием соли и типом гидролиза
1) хлорид аммония а) гидролизуется по аниону
2) сульфат калия б) гидролизуется по катиону
3) карбонат натрия в) гидролиз не происходит
4) сульфид алюминия г) необратимый гидролиз
12. Установите соответствие между формулой соли и её способностью к гидролизу
Установите соответствие между формулой соли и её способностью к гидролизу
1) Сr2(S04)з а) гидролиз по катиону
2) Na 2SO4 б) гидролиз по аниону
3) ВаСl2 в) гидролиз по катиону и аниону
4) AI 2S3 г) гидролизу не подвергается
13 Установите соответствие между названием соли и отношением ее к гидролизу
1) хлорид цинка а) гидролизуется по катиону
2) сульфид калия б) гидролизуется по аниону
3) нитрат натрия в) гидролизуется по катиону и аниону
4) нитрат меди г) не гидролизуется
14. Установите соответствие между формулой соли и типом её гидролиза
Установите соответствие между формулой соли и типом её гидролиза
1) BeSO4 а) по катиону
2) KNO2 б) по аниону
3) CuCl2 в) по катиону и по аниону
4) Pb (NO3)2 г) не гидролизуется
15. Установите соответствие между названием соли и её способностью к гидролизу
1) хлорид аммония а) гидролиз по катиону
2) сульфат калия б) гидролиз по аниону
3) карбонат натрия в) гидролиз не происходит
4) карбонат железа(III) г) необратимый гидролиз
- Установите соответствие между названием соли и кислотностью среды в растворе этой соли
1) нитрит калия а) нейтральная
2) фенолят натрия б) кислая
3) хлорид аммония в) щелочная
4) сульфат калия
- Установите соответствие между формулой соли и её способностью к гидролизу
1) FeCl3 а) по катиону
2) BaS б) по аниону
3) KF в) по катиону и по аниону
4) ZnSO4 г) не гидролизуется
18. Установите соответствие между формулой соли и окраской индикатора лакмуса в её водном растворе.
Установите соответствие между формулой соли и окраской индикатора лакмуса в её водном растворе.
1) Cu (NO3)2 а) красная
2) Li2S б) синяя
3) Na2SO3 в) фиолетовая
4) CaCl2 г) не окрашен
19. Установите соответствие между названием соли и её способностью к гидролизу
1) нитрат железа(II) а) гидролиз по катиону
2) сульфат меди б) гидролиз по аниону
3) сульфид бария в) гидролиз не происходит
4) нитрат кальция г) гидролиз по катиону и аниону
20. Установите соответствие между формулой соли и окраской индикаторов в её водном растворе.
Установите соответствие между формулой соли и окраской индикаторов в её водном растворе.
1) KF а) лакмус красный, фенолфталеин красный
2) Al2(S04)з б) лакмус красный, фенолфталеин бесцветный
3) KCl в) лакмус синий, фенолфталеин красный
4) Na 3PO4 г) лакмус синий, фенолфталеин бесцветный
д) лакмус фиолетовый, фенолфталеин красный
21. Установите соответствие между названиями веществ и продуктами их гидролиза
1) трипальмитин а) C15h41COOH и C3H5(OH)3
2) нитрид кальция б) ZnOHCl и HCl
3) хлорид цинка в)Nh4 и Ca(OH)2
4) триацетат целлюлозы г) (C6h20O5)n и Ch4COOH
д) Ca(NO3)2 и Nh4
е) Zn(OH)2 и HCl
22. Установите соответствие между названием соли и цветом индикаторов в растворе этой соли.
Установите соответствие между названием соли и цветом индикаторов в растворе этой соли.
1) нитрат бария а) фенолфталеин красный, лакмус синий
2) хлорид железа(III) б) фенолфталеин бесцветный, лакмус красный
3) сульфат аммония в) фенолфталеин бесцветный, лакмус фиолетовый
4) ацетат калия г) фенолфталеин красный, лакмус красный
23. Установите соответствие между названием соли и средой её водного раствора
1) хлорид хрома(III) а) нейтральная
2) сульфат хрома (II) б) кислая
3) сульфид натрия в) щелочная
4) сульфат цезия
24. Установите соответствие между названием соли и её способностью к гидролизу
1) сульфат рубидия а) гидролизу не подвергается
2) сульфид аммония б) гидролизуется по катиону
3) фосфат калия в) гидролизуется по аниону
4) сульфид лития г) гидролизуется по катиону и по аниону
25. Установите соответствие между названием соли и её способностью к гидролизу
Установите соответствие между названием соли и её способностью к гидролизу
1) сульфид натрия а) гидролизу не подвергается
2) нитрат бария б) гидролизуется по катиону
3) сульфат калия в) гидролизуется по аниону
4) карбонат аммония г) гидролизуется по катиону и по аниону
26. Установите соответствие между названием соли и её способностью к гидролизу
1) стеарат аммония а) гидролизу не подвергается
2) пальмитат калия б) гидролизуется по катиону
3) перхлорат натрия в) гидролизуется по аниону
4) сульфат цезия г) гидролизуется по катиону и по аниону
27. Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое
1) сульфат натрия а) сульфид калия
2) хлорид алюминия б) сульфид аммония
3) ортофосфат цезия в) сульфат железа (II)
4) ацетат аммония г) нитрат бария
28. Установите соответствие между названиями веществ и рН их водного раствора
Установите соответствие между названиями веществ и рН их водного раствора
1) гидроксид лития, сульфид калия,
силикат натрия а) рН больше 7
2) хлорид бария, хромат калия, б) рН меньше 7
перманганат натрия в) рН равно 7
3) формиат натрия, нитрит калия, г) нет однозначного ответа
гипохлорит кальция
4) хлорид кадмия(II), сульфат хрома (III),
нитрат аммония
29. Установите соответствие между формулами веществ и рН среды, характерной для их водных растворов
1) Nh5Cl, FeBr3, CdSO4 а) рН больше 7
2) Na(HCOO), Cs2S, LiNO2 б) рН меньше 7
3) NaMnO4, KCLO4, K2Cr2O7 в) рН равно 7
4) (Nh5)2Cr2O7, BeI2, ZnCl2 г) нет однозначного ответа
30. Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое
Установите соответствие между двумя солями, отношение которых к гидролизу одинаковое
1) Fe2(CO3)3 а) K2S
2) NaCl б) (Nh5)2SiO3
3) Cs3PO4 в) FeSO4
4) Nh5NO3 д) Ba(NO3)2
Таблица правильных ответов:
1 | абга | 11 | бваг | 21 | авег |
2 | вбаб | 12 | аггв | 22 | вбба |
3 | абвб | 13 | абга | 23 | ббва |
4 | баав | 14 | абаа | 24 | агвв |
5 | вгаб | 15 | авбг | 25 | вааг |
6 | ввба | 16 | ввба | 26 | гваа |
7 | вбва | 17 | абба | 27 | гваб |
8 | вбвб | 18 | аббв | 28 | аваб |
9 | багв | 19 | аабв | 29 | бабв |
10 | збдв | 20 | вббв | 30 | бдав |
Контрольная работа 9 класс
Контрольная работа №1 по химии для учащихся 9 класса
Тема. Классификация химических реакций. Электролитическая
Классификация химических реакций. Электролитическая
диссоциация.
Цель: определить уровень знаний учащихся по теме: «Химические реакции и
«Электролитическая диссоциация», выявить затруднения в усвоении
учебного материала и определить пути их преодоления.
Базовые термины и понятия: химические реакции: окислительно-
восстановительные, экзо- и эндотермические, термохимические, реакции
ионного обмена, обратимые и необратимые; окислитель, восстановитель,
химическое равновесие, катализаторы, ионы, катод и анод.
Методы обучения: методы контроля.
Тип урока: контроль знаний.
Вариант 1
1. Дайте определение окислительно – восстановительные реакции и степень
окисления. (0,5 балла)
2. Будут ли подвергаться гидролизу соли АlCl3,BaSO4? Ответ обосновать.
Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие
данному
Составьте две реакции ионного обмена, соответствующие
данному
ионному уравнению: Al3+ + 3ОН- = Al(ОН)3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель. А. FeCl3 + Кl= FeCl2 +l2+КСl (1,5 балла)
Б. Mg + N2= Mg3N2
5. Определите возможные химические реакции для следующих пар веществ:
А. азотная кислота и хлорид бария;
Б. хлорид железа (ll) и гидроксид натрия;
В. Сульфат алюминия и хлорид кальция.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 2
1. Дайте определение солей, оснований с точки зрения теории
электролитической диссоциации. (0,5 балла)
2. Будут ли подвергаться гидролизу основания Cr(ОН)2, Ba(ОН)2? Ответ
обосновать. Какова реакция среды в растворах этих
оснований? (0,5 балла)
Какова реакция среды в растворах этих
оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Мg2+ +2 F- = Мg F2.
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. НСl + CrO3=Сl2 +CrCl3 + Н2О (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 3
1. Дайте определение обратимые и необратимые реакции. (0,5 балла)
2. Будут ли подвергаться гидролизу соли NaHCO3, АgСl?
Ответ обосновать.
Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Са2+ + S2- = СаS
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Mg + N2= Mg3N2 (1,5 балла)
Б. Fe2О3+Н2= Fe + Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид натрия;
Б. хлорид серебра и гидроксид калия;
В. Карбонат натрия и соляная кислота.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 4
1. Дайте определение экзотермические и эндотермические реакции.
(0,5 балла)
2. Будут ли подвергаться гидролизу соли Na2CO3, АgI? Ответ
обосновать.
Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Ве2+ +2 ОН- = Ве(ОН)2
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. НСl + CrO3=Сl2 +CrCl3 + Н2О (1,5 балла)
Б. Se+Н2О+НNO3 (раз)= Н2SeO4+NO
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и нитрат натрия;
Б. хлорид магния и гидроксид калия;
В. Карбонат натрия и хлорид бария.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 5
1. Дайте определение электролиты и
неэлектролиты. (0,5 балла)
(0,5 балла)
2. Будут ли подвергаться гидролизу соли AlCl3, Hg3PO4? Ответ обосновать.
Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Си2+ +SO3 2- = Си SO3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Fe + Cl2 = FeCl3 (1,5 балла)
Б. Nh4+О2=NО+Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. соляная кислота и нитрат серебра;
Б. сульфат меди (ll) и азотная кислота;
В. хлорид алюминия и бромид натрия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая
диссоциация.
Вариант 6
1. Дайте определение сильные и слабые электролиты. (0,5 балла)
2. Будут ли подвергаться гидролизу основания Cr(ОН)2, Ba(ОН)2? Ответ
обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Мg2+ +2 F- = Мg F2.
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. СrCl3 + Zn= Сr+ ZnCl2 (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 7
1. Дайте определение обратимые реакции и катализатор. (0,5 балла)
2. Будут ли подвергаться гидролизу соли NaHCO3, АgСl? Ответ обосновать.
Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Са2+ + SО32- = СаSО3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Mg + О2= MgО (1,5 балла)
Б. Аl2О3+Н2= Аl + Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид натрия;
Б. хлорид серебра и гидроксид калия;
В. Карбонат натрия и соляная кислота.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 8
1. Дайте определение экзотермические и эндотермические реакции.
(0,5 балла)
2. Будут ли подвергаться гидролизу соли NaНCO3, АgВr? Ответ обосновать.
Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Мg2+ + 2ОН- = Mg(ОН)2
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. НСl + FeO=Сl2 +FeCl3 + Н2О (1,5 балла)
Б. Se+Н2О+НNO3 (раз)= Н2SeO4+NO
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и нитрат натрия;
Б. хлорид магния и гидроксид калия;
В. Карбонат натрия и хлорид бария.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 9
1. Дайте определение химическое равновесие и обратимые реакции.
(0,5 балла)
2. Будут ли подвергаться гидролизу соли ВеCl2, Мg3PO4? Ответ
обосновать. Какова реакция среды в растворах этих солей? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Са2+ +СO3 2- = СаСO3
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Mg + Cl2 = M𝑔Cl2(1,5 балла)
Б. Са+О2=СаО
5. Определите возможные химические реакции для следующих пар веществ:
А. соляная кислота и нитрат серебра;
Б. сульфат меди (ll) и азотная кислота;
В. хлорид алюминия и бромид натрия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 10
1. Чем отличается экзотермическая реакция от эндотермической? (0,5 балла)
2. Будут ли подвергаться гидролизу основания КОН, Ba(ОН)2? Ответ
обосновать. Какова реакция среды в растворах этих оснований? (0,5 балла)
3. Составьте две реакции ионного обмена, соответствующие данному
ионному уравнению: Мg2+ +2 F- = Мg F2.
Привести молекулярные и полные ионные уравнения. (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. НCl + Zn= Н2+ ZnCl2(1,5 балла)
Б. С+Н2SО4= СО2 + SO2 +Н2
5. Определите возможные химические реакции для следующих пар веществ:
А. серная кислота и хлорид бария;
Б. хлорид натрия и гидроксид калия;
хлорид натрия и гидроксид калия;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 11
1. Дайте определение следующим понятиям: катион, катод. (0,5 балла)
2. Укажите простые вещества, имеющие только окислительные свойства:
1) F2; 2)S; 3)Fe; 4)Аr (0,5 балла)
3. Укажите правильно написанное уравнение эндотермической реакции:
1)2Н2(г) + O2(г)=2 Н2О(ж) + 484кДж
2) 3O2(г)= 2O3(г) – 284кДж (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель. А. Н2+ N2 =Nh4 (1,5 балла)
Б. SO2+О2= SO3
5. Определите массовую долю воды в гипсе СаSO4*2 Н2О
(1,5 балла)
Определите массовую долю воды в гипсе СаSO4*2 Н2О
(1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 12
1. Дайте определение экзотермической реакции. Приведите пример подобной
реакции. (0,5 балла)
2. Вещество, являющееся электролитом:
1) кислород 2) метан 3)азот 4)хлорид калия. (0,5 балла)
3. Составьте ступенчатую диссоциацию для Н2SO3 и NaHCO3 (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Мg + НCl = МgCl2 + Н2 (1,5 балла)
Б. МnО2+ НCl = МnCl2 + Cl2+Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
Б. гидроксид натрия и соляная кислота;
гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 13
1. Дайте определение следующим понятиям: анион, анод. (0,5 балла)
2. Укажите простые вещества, имеющие только восстановительные свойства:
1) F2; 2)S; 3)Fe; 4)Аr (0,5 балла)
3. Укажите правильно написанное уравнение экзотермической реакции:
1)2Н2(г) + O2(г)=2 Н2О(ж) + 484кДж 2) 3O2(г)= 2O3(г) – 284кДж (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Н2+ О2 =h3О (1,5 балла)
Б. NaI+Cl2= NaCl+ I2
5. Определите массовую долю воды в медном купоросе СиSO4*5 Н2О (1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая
диссоциация.
Электролитическая
диссоциация.
Вариант 14
1. Дайте определение экзотермической реакции. Приведите пример подобной
реакции. (0,5 балла)
2. Укажите заряды и напишите формулы следующих анионов:
1) хлорид 2) нитрат 3)карбонат (0,5 балла)
3. Напишите уравнение диссоциации одноосновных кислот: НСl, HClO4 и НNO3 (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. СrCl3 + Zn= Сr+ ZnCl2 (1,5 балла)
Б. Аg+Н2SO4 (кон) =Аg2 SO4+ SO2 +Н2О
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
Б.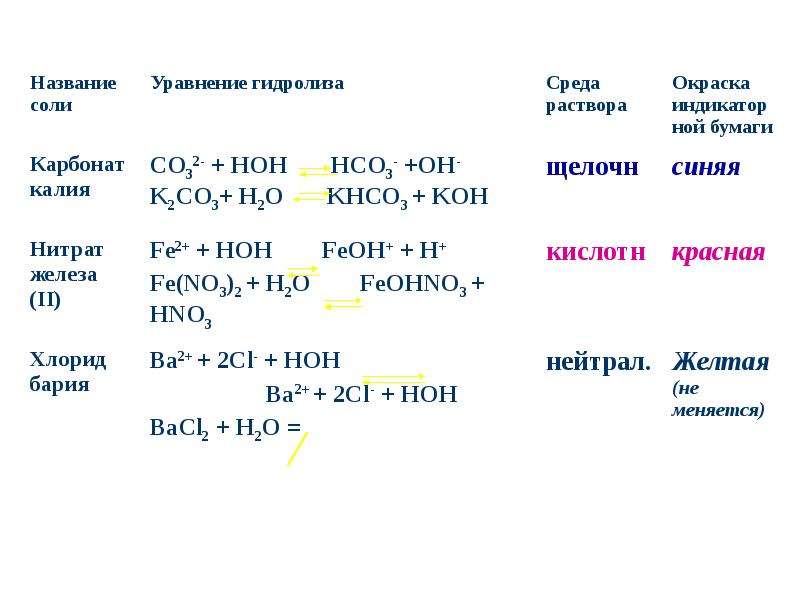 гидроксид натрия и соляная кислота;
гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 15
1. Дайте определение следующим понятиям: анион, катод. (0,5 балла)
2. Укажите характерные степени окисления в сложных веществах для
следующих атомов: 1) Н; 2)О; 3)Вe; 4)Аl (0,5 балла)
3. Среди ниже перечисленных соединений укажите те, которые относятся к сильным электролитам:
а) h3О б) NaСl в) Н2SO4 г)КОН (1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите
окислитель и восстановитель.
А. Си + О2 =СиО (1,5 балла)
Б. Na+ h3О = NaОН+ Н2
Na+ h3О = NaОН+ Н2
5. Определите массовую долю воды в кристаллической соде Na 2CO3*10 Н2О (1,5 балла)
Контрольная работа №1
Классификация химических реакций. Электролитическая диссоциация.
Вариант 16
1. Дайте определение эндотермической реакции. Приведите пример
подобной реакции. (0,5 балла)
2. Укажите заряды и напишите формулы следующих катионов:
1) натрия 2) алюминия 3)цинк (0,5 балла)
3. Напишите уравнение диссоциации кислых солей: NaНSO3, К2НРO4 и NaНS(1 балл)
4.Подберите коэффициент методом электронного баланса. Укажите окислитель и восстановитель.
А. Nh4+О2=NО+Н2О (1,5 балла)
Б. Mg + N2= Mg3N2
5. Определите возможные химические реакции для следующих пар веществ:
А. гидроксид меди (II) и серная кислота;
гидроксид меди (II) и серная кислота;
Б. гидроксид натрия и соляная кислота;
В. Сульфат алюминия и хлорид калия.
Составьте для них молекулярные, полные и сокращенные ионные уравнения
реакций.
Литература:
1. Учебник Г.Е. Рудзитис, Ф. Г. Фельдман Химия 9 класс
М; «Просвещение» 2014г.
2. Сборник задач и упражнений по химии к учебнику Г.Е.
Рудзитис, Ф. Г. Фельдман Химия 9 класс М.А. Рябов «Экзамен»
М.2017
3. Дидактический материал 8/9 класс А. М. Радецкий М.
«Просвещение» 2016.
Скачать материал
Поделиться…
Скачано с www.znanio.ru
▶▷▶ тема теория электролитической диссоциации контрольная работа
▶▷▶ тема теория электролитической диссоциации контрольная работа| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 03-11-2018 |
тема теория электролитической диссоциации контрольная работа — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Контрольная работа по теме «Теория электролитической kopilkaurokovru/himiya/prochee/kontrol-naia Cached Контрольная работа по теме » Теория электролитической диссоциации » на два варианта для Контрольная работа по теме: quot;Электролитическая infourokru/kontrolnaya-rabota-po-teme Cached Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления Тестовая контрольная работа в 9 классе по теме: «Теория infourokru/testovaya-kontrolnaya-rabota-v Cached Контрольная работа №1 по теме: « Теория электролитической диссоциации » Вариант 1 Контрольная работа по химии в 9 классе на тему Теория wwwmetod-kopilkaru/kontrolnaya_rabota_po_himii Cached Скачать: контрольная работа по химии в 9 классе на тему теория электролитической Контрольная работа «Теория электролитической диссоциации» nsportalru/shkola/khimiya/library/2011/09/28/ Cached Методическая разработка по химии (9 класс) по теме: Контрольная работа » Теория Контрольная работа по теме «Электролитическая диссоциация wwwmetod-kopilkaru/kontrolnaya_rabota_po_teme Cached Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Урок №15 Контрольная работа №1 по теме «Электролитическая sitesgooglecom/site/himulacom/zvonok-na-urok/9 Версия 1 1 Напишите уравнения электролитической диссоциации следующих веществ: Проверочные и контрольные работы по теме «Электролитическая videourokinet/razrabotki/provierochnyie-i Cached Теория электролитической диссоциации Проверочная работа «Электролитическая диссоциация Контрольная работа №2 по теме: «Электролитическая диссоциация» lib2podeliseru/docs/16302/index-27299-6html Cached Контрольная работа №3 Тема : «Металлы» Учебно-тематический план Предмет химия, класс 9 (базовый уровень, 2 часа в неделю, всего 68 часов) № п п Тест по химии для 8 класса «Электролитическая диссоциация» globuss24ru/doc/test-po-himii-dlya-8-klassa Cached Контрольная работа для 8 класса «Атомы химических элементов, химическая связь» Контрольная работа для 8 класса «Водород», «Вода Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28,400 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
- карбонат магния
- 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты
3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например
могут ли
- easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28
- химическая связь» Контрольная работа для 8 класса «Водород»
- smarter
тема теория электролитической диссоциации контрольная работа — Все результаты КарточкаКонтрольная работа по теме: «Теория — Инфоурок › Химия 16 мая 2018 г — Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 1 1Что такое катод и анод Контрольная работа по теме «Теория — Инфоурок › Химия Похожие 11 окт 2016 г — 9 класс Контрольная работа по теме « Теория электролитической диссоциации » 1 вариант 1 Составьте возможные уравнения Контрольная работа по теме: «Теория электролитической 16 мар 2013 г — Материал по химии (9 класс) по теме : Контрольная работа по теме : « Теория электролитической диссоциации » Опубликовано Тест по химии (9 класс) на тему: Контрольная работа по химии 9 15 сент 2018 г — Контрольная работа по теме « теория электролитической диссоциации » Вариант №1 Часть А выбрать только ОДИН правильный Тестовая контрольная работа по теме: «Теория — Урокрф 8 нояб 2017 г — Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 1 Часть 1 При выполнении заданий Контрольная работа по теме «Теория электролитической Похожие 15 окт 2015 г — Контрольная работа по теме Теория электролитической диссоциации на два варианта для учащихся 9 класса к учебнику Рудзитис ГЕ, Контрольная работа по химии «Теория электролитической Похожие 23 окт 2014 г — Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в Урок-конкурс по теме «Теория электролитической диссоциации» 8 открытыйурокрф/статьи/594230/ закрепление и обобщение знаний по теме , подготовка к контрольной работе ,; развитие творческой и познавательной активности учащихся, Теория электролитической диссоциации (3) — Лабораторная работа Лабораторная работа №1 Тема : Теория электролитической диссоциации 1 Цель: Провести реакции ионного обмена между электролитами 2 Контрольная работа по химии в 9 классе на тему Теория Похожие 5 янв 2015 г — Урок № 17 Тема : Контрольная работа Цель: Обобщение, повторение и закрепление темы « Электролитическая диссоциация » Задачи Контрольная работа по химии 9 класс по теме «Теория newteacherjournalru//1438-kontrolnaya-rabota-po-khimii-9-klass-po-teme-teoriya 13 февр 2017 г — Контрольная работа по химии 9 класс по теме » Теория электролитической диссоциации » Автор: Виктория Юрьевна Сергеева вкл Коваленко Л | Теория электролитической диссоциации | Журнал him1septemberru/articlephp?ID=200404512 Похожие Поэтому я предлагаю разработку урока коррекции, проведенного после контрольной работы по теме « Теория электролитической диссоциации », МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ ИЗУЧЕНИЯ ТЕМЫ «ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ Полная версия работы доступна во вкладке «Файлы работы» в формате PDF Контрольная работа по теме « Теория электролитической диссоциации » химия 9 wwwsc109ru/content/distant/chime/9html Похожие Закончится повторение контрольной работой , которая определит готовность учащихся к Тема 1 Теория электролитической диссоциации (10 уроков) контрольная работа 9 класс — Химия — Мультиурок Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между веществами: Подготовка к контрольной работе по теме «Теория iighjghblogspotcom/2012/10/blog-post_31html 31 окт 2012 г — Напишите уравнение электролитический диссоциации: к контрольной работе по теме » Теория электролитической диссоциации » Контрольная работа «Химические реакции Растворы Теория uchitelyacom/himiya/66665-kontrolnaya-rabota-himicheskie-reakcii-rastvoryhtml «Химические реакции Растворы Теория электролитической диссоциации » Контрольная работа по теме «Химические реакции Растворы Теория контрольная работа по теме: «Строение вещества Теория wwwzavuchru/methodlib/134/55724/ Похожие Теория электролитической диссоциации » Методической библиотеки портала Контрольная работа для учащихся 9 класса в виде теста по теме Контрольная работа по теме «Теория электролитической wwwseznaikaru › Химия/ › Контрольные/ Контрольная работа по теме » Теория электролитической диссоциации » 11 класс Вариант 1 Какие из следующих жидкостей проводят электрический Контрольная работа по теме: «Теория электролитической pedsovetpro/indexphp?option=com_content&view=article&id=16036 19 мар 2016 г — Вариант №1 1 Напишите уравнения возможных реакций между веществами: а) нитратом бария и сульфатом калия; б) сульфатом контрольная работа теория электролитической диссоциации 9 класс riggiru/userfiles/kontrolnaia-rabota-teoriia-elektroliticheskoi-dissotsiatsii-9-klassxml контрольная работа теория электролитической диссоциации 9 класс — Все результаты Контрольная работа по теме «Теория — Инфоурок › Химия Теория электролитической диссоциации — Электролитическая › › Электролитическая диссоциация Для объяснения особенностей водных растворов электролитов шведским ученым САррениусом в 1887 г была предложена теория электролитической Вопросы по теме «Теория электролитической диссоциации» www150solradymedusiteru/p270aa1html Вопросы по теме « Теория электролитической диссоциации » Как разделили все электролиты по степени диссоциации? 10 Контрольная работа Методика изучения темы «Теория электролитической диссоциации» Место и значение темы » Теория электролитической диссоциации » в курсе химии Основные понятия и контрольная работа , добавлен 17012018 4 Теория электролитической диссоциации Гидролиз солей (14 часа) Раздел № 1, Теория электролитической диссоциации лабораторных опытов – 2, · расчетных задач – 1, · контрольная работа — 1, 14 ч п\п, Дата, Наименование раздела, темы 1 четверть, количество часов, всего часов, Д/з Контрольная работа по теме: «Теория — Pandiaru Контрольные работы Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа 2 по теме «Электролитическая диссоциация Контрольная работа 2 по теме «Электролитическая диссоциация» последнее превращение с точки зрения теории электролитической диссоциации Химия 9 класс Теория электролитической диссоциации > Реакции Тест по предмету Химия для 9 класса по теме Теория электролитической Контрольная работа по математике 6 класс, по теме : » Делимость чисел» Контрольная работа по теме «Теория Электролитической nenudaru/контрольная-работа-по-теме-теория-электролитической-диссоцhtml Контрольная работа по теме « Теория Электролитической диссоциации » Задание 1 Сильным электролитом является Тема I Электролитическая диссоциация Работа 3 Химические Тема I Электролитическая диссоциация Работа 3 Химические свойства кислот, солей и оснований в свете теории электролитической диссоциации Реферат: Теория электролитической диссоциации — Xreferatcom Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и Контрольная работа по теме: «Теория электролитической › Библиотека › Химия Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме : « Теория электролитической диссоциации » Контрольная работа по теме Теория электролитической › Учителю › Химия 1 окт 2016 г — Материал по химии Контрольная работа по теме Теория электролитической диссоциации , 9 класс, Химия, УМК ФГФельдман, Теория электролитической диссоциации — ПОМОЩЬ — Форум химиков на forumxumukru › Школьникам и студентам — решение задач › ПОМОЩЬ 11 окт 2011 г — Здраствуйте, проверьте пожалуйста задание Домашняя контрольная по теме » Теория Электролитической диссоциации » Вариант 1 Контрольная работа по теме: «Теория электролитической 27 нояб 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между Контрольная работа по теме: «Теория электролитической studydocru/doc//kontrol_naya-rabota-po-teme—«teoriya-e-lektroliticheskoj-dis Похожие Скачать No category Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс Вариант №1 1 К кислотам относится каждое из [DOC] Тема 6 Теория электролитической диссоциации и свойства Свойства солей в свете теории электролитической диссоциации 16, 9, Контрольная работа №1 по теме «Атомы химических элементов», 1 Тема 3 [DOC] ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Программа по химии разработана Похожие Основные положения теории электролитической диссоциации Тепловые Контрольная работа по теме « Теория электролитической диссоциации » 1 Теория электролитической диссоциации : Лабораторная работа Похожие Лабораторная работа Тема : ” Теория электролитической диссоциации ” Опыт № 1 Разная сущность взаимодействия разбавленной и [DOC] Контрольные работы по русскому языку — Школа № 939 sch939umskobrru/files/obwie%20svedenia/himiyadoc Контрольные работы по химии ( темы контроля) Классы Учитель Тема контроля 8 А К/р №4 Теория электролитической диссоциации ; 8 Б Электролитическая диссоциация — Википедия Похожие Перейти к разделу Классическая теория электролитической диссоциации — Классическая теория электролитической диссоциации была создана С [DOC] Электролитическая диссоциация (10ч+1) — Джинабинская СОШ djinabidagschoolcom/_http_schools/1718/djinabi//5_%20%20%20doc физическую и химическую теорию растворов; насыщенные и ненасыщенные Контрольная работа №1 по теме « Электролитическая диссоциация » Контрольная работа по химии по теме Теория электролитической 5 сент 2017 г — Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1 С какими из перечисленных веществ может Контрольная работа по теме: «Теория электролитической › Каталог › Остальные рефераты 15 авг 2016 г — Контрольная работа по теме : « Теория электролитической диссоциации » 9 класс 1Напишите уравнения возможных реакций между контрольна работа по теме теория электролитической диссоциации hkonlinecomhk//kontrolna-rabota-po-teme-teoriia-elektroliticheskoi-dissotsiatsiix контрольна работа по теме теория электролитической диссоциации — Все результаты Тестовая контрольная работа в 9 классе по теме : «Теория [PDF] Поурочное планирование по химии 9 класс s_39_specedu54ru/DswMedia/ximiya9klassrppdf основных положениях теории электролитической диссоциации , отработки умений учащихся по теме и проведения контрольной работы • Введен Реферат: Теория электролитической диссоциации — BestReferatru Название: Теория электролитической диссоциации Раздел: Биология и химия Тип: реферат Добавлен 00:56:58 13 января 2004 Похожие работы Контрольная работа для 9 класса по теме: «Теория — Педпортал Похожие Контрольная работа для 9 класса по теме : » Теория электролитической диссоциации » (Разное) Учебное пособие для учителей Курсовая работа (Теория) на тему «Определение константы studentlibcom/kursovaya_rabota_teoriya-133370-opredelenie_konstanty_dissociacii_ 20 авг 2016 г — Курсовая работа ( Теория ) по химии на тему : Определение При электролитической диссоциации разрываются обычно лишь [DOC] Таблица 1 Тематическое планирование курса «Химия 9 класс» из 10/10 Контрольная работа № 1, 1 Тема 2 Химическая реакция, 17 1/11 соединений в свете теории электролитической диссоциации , 1 8/18 Вместе с тема теория электролитической диссоциации контрольная работа часто ищут ответы на контрольную работу по химии электролитическая диссоциация контрольная работа по теме теория электролитической диссоциации ответы 8 класс тест по теме теория электролитической диссоциации вариант 2 теория электролитической диссоциации вариант 1 тест 6 теория электролитической диссоциации 8 класс контрольная работа № 1 по теме электролитическая диссоциация контрольная работа по химии 9 класс рудзитис электролитическая диссоциация контрольная работа по химии 8 класс электролитическая диссоциация Навигация по страницам 1 2 3 Следующая Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Музыка Переводчик Диск Почта Коллекции Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Контрольная работа по химии « Теория » videourokinet › …rabota…teoriya…dissotsiatsiihtml Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими Читать ещё Контрольная работа по теме « Теория электролитической диссоциации » 9 класс Вариант 1 1 Написать уравнения реакций в молекулярном и ионном виде между следующими веществами: а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) карбонатом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Скрыть 2 Контрольная работа по теме : « Теория » pandiaru › text/80/295/4728php Показать ещё с сайта Пожаловаться Информация о сайте « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Читать ещё « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 а) нитратом бария и сульфатом калия; б) сульфатом меди (II) и сульфидом натрия; в) сульфидом натрия и соляной кислотой; г) оксидом углерода (IV) и гидроксидом натрия Задания для вступительных контрольных работ по математике Задания для вступительных контрольных работ по физике Основные порталы, построенные редакторами Домашний очаг Скрыть 3 Методическая разработка по химии (9 класс) по теме nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » 1Напишите уравнения возможных реакций между веществами: Вариант №1 Контрольная работа по химии 9 класс Тема контрольной работы » Теория электролитической диссоциации » на два варианта Мне нравится Поделиться Скрыть 4 Карточка Контрольная работа по теме : « Теория » infourokru › …rabota…teme-teoriya…dissociacii-dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации » для 8-9 классов вариант 2 1Что такое электролиты и не электролиты определения с примерами веществ 2Что такое ионы и какие они бывают и как называются Какие из формулы веществ не электролиты выберите : гидроксид натрия, углекислый газ, хлорид железа 2, кремниевая кислота, оксид меди 2, сульфат калия, карбонат магния, этиловый спирт, азотная кислота, 3При взаимодействии раствором каких веществ одним из продуктов реакции является вода: а)гидроксид натрия и фосфорная кислота) б) HNO3и Скрыть 5 Тестовая контрольная работа по теме : « Теория » урокрф › …testovaya_kontrolnaya_rabota_po…teoriya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) Читать ещё Какая масса соли получилась при этом? Тестовая контрольная работа по теме : « Теория электролитической диссоциации » Вариант 2 Часть 1 При выполнении заданий выберите номер одного правильного ответа 1Соединение с ковалентной полярной связью 1) 2) 3) 4)Н2 2Соединение с ионной связью 1) 2) 3) 4) 3К электролитам относится 1) (раствор) 2) (газ) 3)глюкоза (раствор) 4) (газ) 4Электролитом является раствор Скрыть 6 « Теория электролитической диссоциации » nsportalru › …kontrolnaya…teoriya…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Сайт – выбор пользователей Подробнее о сайте Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Читать ещё Контрольная работа по теме : « Теория электролитической диссоциации »Вариант №1 1Напишите уравнения возможны Материал по химии (8 класс) по теме : контрольная работа теория электролитической диссоциации Опубликовано 17012014 — 20:38 — Тусупаева Валерия Темирбековна Контрольная работа по теме : « Теория электролитической диссоциации » Вариант №1 1Напишите уравнения возможных реакций между Скрыть 7 Тема I Электролитическая диссоциация Работа 5terkacom › Электролитическая диссоциация Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти) Читать ещё Решебник по химии за 9 класс к дидактическому материалу АМРадецкий Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Начните вводить часть условия (например, могут ли, чему равен или найти): Тема I Электролитическая диссоциация Работа 5 Итоговая по теме I Скрыть 8 Контрольная работа по теме » Теория » kopilkaurokovru › himiya…naia-rabota…dissotsiatsii Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Читать ещё Просмотр содержимого документа « Контрольная работа по теме » Теория электролитической диссоциации » » Контрольная работа по теме « Теория электролитической диссоциации » 1Составьте уравнения возможных реакций в молекулярном и ионном виде Вариант 1 Скрыть 9 Тема теория электролитической диссоциации контрольная работа — смотрите картинки ЯндексКартинки › тема теория электролитической диссоциации Пожаловаться Информация о сайте 27 октября Ещё картинки 10 Тест по теме « Теория электролитической » znanijacom › task/28097474 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Нажми, чтобы увидеть ответ на свой вопрос: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Читать ещё Нажми, 👆 чтобы увидеть ответ на свой вопрос ✍️: Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ио… Тест по теме « Теория электролитической диссоциации » напишите только буквы 1 Процесс распада электролита на ионы при растворении в воде или расплавлении – это а) гидратация б) диссоциация в) ассоциация в) гидролиз 2Электрический ток в водном растворе не проводят вещества с а) ковалентной сильно полярной связью б) ионной связью в) ковалентной неполярной связью г) другой вариант ответа Скрыть Контрольная работа по теме » Электролитическая » metod-kopilkaru › kontrolnaya_rabota…teme…ovr_dlya… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации Читать ещё Контрольная работа содержит 4 основных варианта для обычных классов и 2 базовых варианта для очень слабых классов Часть А каждого варианта — это тестовые задания с выбором одного правильного ответа Часть Б состоит из 4 заданий с развернутыми ответами, последнее из которых — качественная задача Задания типовые, ориентированы на формат заданий итоговой аттестации Задания включают элементы знаний по следующим разделам темы : 1) электролиты и неэлектролиты; 2) электролитическая диссоциация ; 3) кислоты, основания и соли с позиции теории диссоциации ; 4) степень диссоциации , сильные и слабые элект Скрыть 1 2 3 4 5 дальше Браузер Для безопасных прогулок в сети 0+ Скачать
ПЛАН-КОНСПЕКТ проблемного урока по химии для учащихся 9 класса «Гидролиз солей» 9 класс
ПЛАН-КОНСПЕКТ
проблемного урока по химии для учащихся 9 класса
Тема урока: «Гидролиз солей»
Тип урока: урок изучения нового материала.
Вид урока: комбинированный, проблемный.
Форма проведения урока: лабораторный опыт, беседа.
Цель урока:
Способствовать формированию у учащихся понятия «гидролиз», умения писать краткие ионные уравнения реакций гидролиза,
Развивать у учащихся память, наблюдательность, логическое мышление,
Воспитывать у учащихся аккуратность, уважение к окружающим, любовь к предмету.
Оборудование: на столах учащихся: растворы хлорида натрия, сульфата алюминия, карбоната натрия, лакмуса, штатив с пробирками, чистые листочки и карточки для проведения проверочной работы, таблица растворимости, периодическая система.
На столе у учителя: демонстрационный штатив с четырьмя пронумерованными пробирками с растворами хлорида натрия, сульфата алюминия, карбоната натрия, карбоната кальция, вода.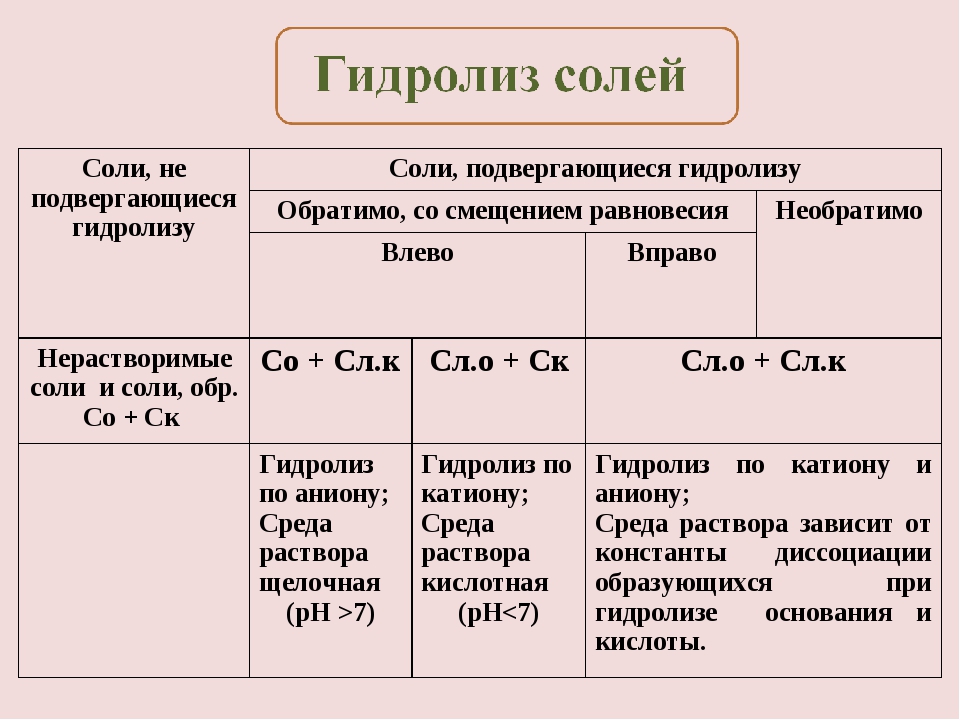
1 этап: постановка учебной проблемы (15 минут)
1. Первому учащемуся (левая часть доски)
-записать на доске окраску индикатора в различных средах
Нейтральная кислая щелочная
Лакмус
Фенолфталеин
Метиловый оранжевый
2. (средняя часть доски)
— на какие ионы диссоциируют следующие вещества? Допишите уравнения реакций.
Второй учащийся третий учащийся четвертый учащийся
H Cl → Na OH→ NaCO→
H NO → KOH→ Al(SO)3 →
HSO→ Ba(OH)→ Na Cl →
3. Третий учащийся (правая часть доски)
Запиши по две формулы веществ сильных электролитов
Кислоты Основания Соли
? ? ?
? ? ?
В это время с классом учитель проводит фронтальный опрос по следующим вопросам:
Какие вещества называются электролитами?
Вещества с какой связью относятся к электролитам?
Какие вещества называются неэлектролитами?
Вещества с какой связью относятся к неэлектролитам?
Разбираем ответы учащихся у доски.
Вопросы первому учащемуся:
-какие вещества называются индикаторами?
Вопросы второму учащемуся:
—дать определение кислотам с точки зрения теории электролитической диссоциации.
-почему все кислоты одинаково изменяют окраску индикаторов?
Вопросы третьему учащемуся:
— дать определение щелочам с точки зрения теории электролитической диссоциации.
-почему все щелочи одинаково изменяют окраску индикаторов?
Вопросы четвертому учащемуся:
— дать определение солям с точки зрения теории электролитической диссоциации.
Вопросы пятому учащемуся:
— какие электролиты называются сильными?
— какие электролиты относятся к слабым?
Постановка проблемы
Вопрос к классу:
— будут ли растворы солей изменять окраску индикаторов? (ПРОБЛЕМА!)
Выдвижение гипотез
Обсуждаем.
Да. Почему?
Нет. Почему?
Учащиеся должны сказать: «Скорее всего, нет, так как нет ионов водорода и нет гидроксид ионов.»
Проверка гипотез
2 этап : лабораторный опыт (4 мин)
Проделаем опыт: (напомнить о ТБ)
Налейте в три пробирки по 2 мл. следующих солей
1пробирка — карбонат натрия
2 пробирка — сульфат алюминия
3 пробирка – хлорид натрия
и прилейте в каждую из них несколько капель лакмуса. Запишите цвет раствора в тетради, определите среду раствора.
Запись в тетради и на доске должна быть следующая:
1 пробирка 2 пробирка 3 пробирка
Na2 CO3 Al2 (SO4)3 NaCl
+ + +
Лакмус лакмус лакмус
Окр. ? ? ?
? ? ?
Среда ? ? ?
Выдвижение новой проблемы.
Вопрос к классу: Почему же соли изменяют окраску индикаторов? (ПРОБЛЕМА)
Подводящий к теме диалог:
Почему соли изменяют окраску индикаторов?
Откуда появляется избыток ионов водорода, избыток гидроксид ионов?
Какое вещество кроме соли находиться в растворе? Или Что является растворителем соли?
Может ли происходить взаимодействие ионов соли и воды?
3 этап Объяснение новой темы. (12 мин)
Называю тему урока и цель.
Записываем в словарь определение гидролиза.
(от греческого «гидро»- вода, «лизис» — разложение).
Объясняем первый случай.
Na 2CO3 → 2 Na+ + CO32 – определяем генезис соли (происхождение)
С.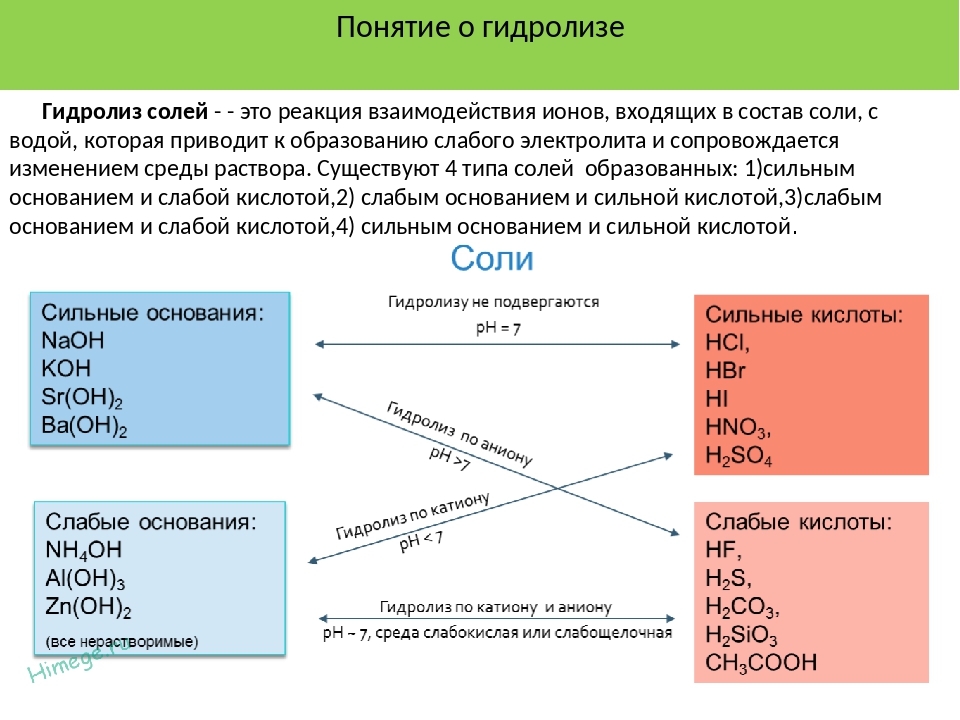 Сл.
Сл.
С водой всегда взаимодействует ион, вошедший в состав соли из слабого электролита.
CO3 2- + HOH → HCO3— + OH— (краткое ионное уравнение реакции гидролиза по первой ступени) среда щелочная
Записываем вывод в тетрадь: гидролиз солей, образованных сильным основанием и слабой кислотой происходит по аниону, среда щелочная (лакмус окрашивается в синий цвет).
Объясняем второй случай.
2. Al 2 (SO 4)3 → 2Al 3+ + 3SO 2-
Сл. С.
Al3+ + HOH → Al (OH)2+ + H+
Записываем вывод в тетрадь: гидролиз солей, образованных слабым основанием и сильной кислотой происходит по катиону, среда кислая (лакмус окрашивается в красный цвет)
Na Cl → Na+ + Cl—
С. С. Гидролиз не происходит (лакмус фиолетовый).
С. Гидролиз не происходит (лакмус фиолетовый).
Ca CO3→ Ca + CO32-
Сл. Сл.
Ca2+ + HOH→ CaOH+ + H+
CO3 2- +HOH → HCO— + OH—
H+ + OH— →HOH
Записываем вывод в тетрадь: гидролиз солей, образованных слабым основанием и слабой кислотой происходит и по катиону, и по аниону, среда нейтральная (лакмус фиолетовый).
4 этап реализация продукта.(3 мин)
Делаем выводы.
Что такое гидролиз? Как происходит гидролиз солей, образованных сильным основанием и слабой кислотой? Как происходит гидролиз солей, образованных слабым основанием и сильной кислотой? Как происходит гидролиз солей образованных сильным основанием и сильной кислотой? Как происходит гидролиз солей, образованных слабым основанием и слабой кислотой? Составляем шпаргалку:
Сл. Силь.- кислая
Силь.- кислая
Сильн. слаб. – щелочная
Сл. Сл. – нейтр.
Сильн. Сильн. — нейтральная
Записываем ДЗ. (записано заранее на левой обратной стороне доски): параграф 6, упр. 8 стр. 20.
Работаем устно. Назовите среду раствора следующих солей (правая обратная сторона доски, записано заранее).
Na NO 3 Fe Cl3 Ba CO3 Na2 S Ca CO3
Выставить оценки, прокомментировать.
Проверочная письменная работа (Обучающая 5 минут).
Задание на листочках у каждого на столе (карточки 25 вариантов)
1 вариант. Написать краткие ионные уравнения гидролиза солей по первой ступени:
хлорид калия, сульфид натрия, нитрат цинка
Собрать листочки. Урок закончен.
МОУ «Мочалищенская СОШ» Звениговский район РМЭ
КОНСПЕКТ
открытого проблемного урока по химии по теме «Гидролиз солей»
(9 класс)
Автор: Филатова Е. Н.учитель химии
МОУ «Мочалищенская СОШ»
1 кв. категория
2008
5
14.4 Гидролиз солевых растворов — Химия
Цели обучения
К концу этого раздела вы сможете:
- Предсказать, будет ли солевой раствор кислым, основным или нейтральным
- Расчет концентраций различных веществ в солевом растворе
- Опишите процесс, при котором растворы некоторых ионов металлов становятся кислыми.
Как мы видели в разделе о химических реакциях, когда кислота и основание смешиваются, они подвергаются реакции нейтрализации.Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это верно, но соли, которые образуются в этих реакциях, могут обладать собственными кислотными или основными свойствами, как мы сейчас увидим.
Раствор считается нейтральным, если он содержит равные концентрации ионов гидроксония и гидроксида. Когда мы смешиваем растворы кислоты и основания, происходит кислотно-щелочная реакция нейтрализации. Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным.Он может содержать либо избыток ионов гидроксония, либо избыток гидроксид-ионов, поскольку природа образующейся соли определяет, будет ли раствор кислотным, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут возникать после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
- Сильная кислота и сильное основание, такие как HCl ( водн. ) и NaOH ( водн. ), будут реагировать с образованием нейтрального раствора, поскольку получаемые конъюгированные партнеры имеют незначительную силу (см. Главу 14.3 Относительная сила кислот и оснований):
[латекс] \ text {HCl} (aq) \; + \; \ text {NaOH} (aq) \; {\ rightleftharpoons} \; \ text {NaCl} (aq) \; + \; \ text {H } _2 \ text {O} (l) [/ латекс]
- Сильная кислота и слабое основание дают слабокислый раствор не из-за задействованной сильной кислоты, а из-за сопряженной кислоты слабого основания.
- Слабая кислота и сильное основание дают слабощелочной раствор. Раствор слабой кислоты реагирует с раствором сильного основания с образованием сопряженного основания слабой кислоты и сопряженной кислоты сильного основания.Конъюгированная кислота сильного основания является более слабой кислотой, чем вода, и не влияет на кислотность полученного раствора. Однако сопряженное основание слабой кислоты является слабым основанием и слегка ионизируется в воде. Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.
- Слабая кислота плюс слабое основание могут давать кислотный, основной или нейтральный раствор. Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и конъюгат основания имеют неодинаковые силы, раствор может быть либо кислотным, либо основным, в зависимости от относительной силы двух конъюгатов.Иногда слабая кислота и слабое основание будут иметь одинаковую силу и , поэтому их соответствующие конъюгированные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным. Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения конъюгатов K .
Желудочные антациды
Наши желудки содержат раствор примерно 0,03 M HCl, который помогает нам переваривать пищу, которую мы едим.Чувство жжения, связанное с изжогой, является результатом утечки желудочной кислоты через мышечный клапан в верхней части желудка в нижнюю часть пищевода. Выстилка пищевода не защищена от разъедающего воздействия желудочной кислоты, как слизистая оболочка желудка, и результаты могут быть очень болезненными. Когда у нас изжога, мы чувствуем себя лучше, если уменьшаем избыток кислоты в пищеводе с помощью антацидов. Как вы уже догадались, антациды — это основы.Одним из наиболее распространенных антацидов является карбонат кальция CaCO 3 . Реакция,
[латекс] \ text {CaCO} _3 (s) \; + \; 2 \ text {HCl} (aq) \; {\ rightleftharpoons} \; \ text {CaCl} _2 (aq) \; + \; \ текст {H} _2 \ text {O} (l) \; + \; \ text {CO} _2 (g) [/ latex]
не только нейтрализует желудочную кислоту, но и производит CO 2 ( г, ), что может вызвать удовлетворительную отрыжку.
Молоко магнезии представляет собой суспензию труднорастворимого основного гидроксида магния, Mg (OH) 2 .{-} \; {\ rightleftharpoons} \; 2 \ text {H} _2 \ text {O} (l) [/ latex]
При этой реакции не образуется углекислый газ, но антациды, содержащие магний, могут оказывать слабительное действие.
Некоторые антациды содержат гидроксид алюминия, Al (OH) 3 , в качестве активного ингредиента. Гидроксид алюминия имеет тенденцию вызывать запоры, а некоторые антациды используют гидроксид алюминия вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Кулинарные аспекты химии
Кулинария — это синтетическая химия, которую можно употреблять в пищу.В кулинарном мире существует ряд примеров кислотно-щелочной химии. Одним из примеров является использование пищевой соды или бикарбоната натрия в выпечке. NaHCO 3 — это база. Когда он вступает в реакцию с кислотой, такой как лимонный сок, пахта или сметана в жидком тесте, в результате разложения образовавшейся угольной кислоты образуются пузырьки углекислого газа, и тесто «поднимается». Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислотных солей, которые вступают в реакцию, когда два химических вещества вступают в контакт с водой в жидком тесте.
Многие люди любят добавлять в приготовленную рыбу лимонный сок или уксус, которые являются кислотами (рис. 1). Оказывается, в системе рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кислый» вкус, который нам нравится.
Рис. 1. Реакция нейтрализации происходит между лимонной кислотой в лимонах или уксусной кислотой в уксусе и основаниями в мясе рыбы.Маринование — это метод консервирования овощей в кислой среде естественного происхождения. Овощ, например огурец, помещают в герметичную банку, погруженную в рассол. Рассол способствует росту полезных бактерий и подавляет рост вредных бактерий. Полезные бактерии питаются крахмалом в огурце и производят молочную кислоту в качестве побочного продукта в процессе, называемом ферментацией. Молочная кислота в конечном итоге увеличивает кислотность рассола до уровня, который убивает любые вредные бактерии, которым необходима щелочная среда.Без вредных бактерий, потребляющих огурцы, они могут прожить гораздо дольше, чем если бы они были незащищенными. Побочный продукт процесса маринования изменяет вкус овощей из-за кислоты, делая их кислыми на вкус.
Когда мы нейтрализуем слабое основание сильной кислотой, продукт представляет собой соль, содержащую сопряженную кислоту слабого основания. Эта сопряженная кислота является слабой кислотой. Например, хлорид аммония, NH 4 Cl, представляет собой соль, образованную реакцией слабого основного аммиака с сильной кислотой HCl:
[латекс] \ text {NH} _3 (aq) \; + \; \ text {HCl} (aq) \; {\ longrightarrow} \; \ text {NH} _4 \ text {Cl} (aq) [/ латекс]
Раствор этой соли содержит ионы аммония и ионы хлорида.{\; \; +} [/ latex] из значения константы ионизации воды, K w и K b , константы ионизации сопряженного основания, NH 3 , используя следующие отношения:
[латекс] K _ {\ text {w}} = K _ {\ text {a}} \; \ times \; K _ {\ text {b}} [/ latex]
Это соотношение сохраняется для любого основания и сопряженной с ним кислоты или для любой кислоты и сопряженного с ним основания. {\; \; +} [/ latex] равно 2.{\; \; +} [/ latex] — более сильная кислота.
Когда мы нейтрализуем слабую кислоту сильным основанием, мы получаем соль, которая содержит сопряженное основание слабой кислоты. Это сопряженное основание обычно является слабым основанием. Например, ацетат натрия, NaCH 3 CO 2 , представляет собой соль, образованную реакцией слабокислой уксусной кислоты с сильным основным гидроксидом натрия:
[латекс] \ text {CH} _3 \ text {CO} _2 \ text {H} (aq) \; + \; \ text {NaOH} (aq) \; {\ longrightarrow} \; \ text {NaCH} _3 \ text {CO} _2 (aq) \; + \; \ text {H} _2 \ text {O} (aq) [/ latex]
Раствор этой соли содержит ионы натрия и ионы ацетата.{-10} [/ латекс]
В некоторых справочниках не указаны значения K b . Они сообщают только константы ионизации для кислот. Если мы хотим определить значение K, , b , используя один из этих справочников, мы должны найти значение K a для конъюгированной кислоты и преобразовать его в значение K b . {\; \; -}] = 0.{-10} [/ латекс]
Решая это уравнение, мы получаем [CH 3 CO 2 H] = 1,1 × 10 −5 M .
Проверьте свои знания
Каков pH 0,083– M раствора CN –? Используйте 4,9 × 10 −10 как K и для HCN. Подсказка: нам, вероятно, потребуется преобразовать pOH в pH или найти [H 3 O + ], используя [OH — ] на заключительных этапах решения этой проблемы.
В растворе соли, образованной реакцией слабой кислоты и слабого основания, чтобы предсказать pH, мы должны знать как K a слабой кислоты, так и K b кислоты. слабая база.Если K a > K b , раствор является кислым, а если K b > K a , раствор является основным.
Пример 3
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) KBr
(б) NaHCO 3
(в) NH 4 Класс
(г) Na 2 HPO 4
(e) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на pH раствора, как показано здесь:
(a) Катион K + и анион Br — являются зрителями, поскольку они являются катионом сильного основания (KOH) и анионом сильной кислоты (HBr) соответственно.{\; \; +} [/ latex] составляет 5,6 × 10 −10 , что кажется очень маленьким, но K b F — составляет 1,4 × 10 −11 , поэтому решение является кислым, так как K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) К 2 CO 3
(б) CaCl 2
(в) KH 2 PO 4
(г) (NH 4 ) 2 CO 3
(e) AlBr 3
Ответ:
(а) базовый; (б) нейтральный; (в) базовая; (г) базовая; (д) кислая
Если мы измерим pH растворов различных ионов металлов, мы обнаружим, что эти ионы действуют как слабые кислоты, когда находятся в растворе.{\; \; -} (водн.) [/ латекс]
Мы часто видим формулу этого иона просто как «Al 3+ ( водн. )», без явного упоминания шести молекул воды, которые являются ближайшими к иону алюминия, и просто описывая ион как сольватированный в воде. (гидратированный). Это похоже на упрощение формулы иона гидроксония, H 3 O + до H + . Однако в этом случае гидратированный ион алюминия является слабой кислотой (рис. 2) и отдает протон молекуле воды.{+} (aq) \; + \; \ text {Al (H} _2 \ text {O}) _ 3 (\ text {OH}) _ 3 (aq) \ end {array} [/ latex]
Обратите внимание, что некоторые из этих разновидностей алюминия проявляют амфипротическое поведение, поскольку они действуют как кислоты, когда они появляются в левой части выражений равновесия, и как основания, когда они появляются в правой части.
Рис. 2. Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.Однако ионизация катиона, несущего более одного заряда, обычно не происходит за пределами первой стадии.{2 +}] [/ latex] в 0,15- M растворе Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы получить [H 3 O + ] до 0,10 M ?
Константы для различных стадий ионизации для многих ионов металлов неизвестны, поэтому мы не можем рассчитать степень их ионизации. Однако практически все гидратированные ионы металлов, кроме ионов щелочных металлов, ионизируются с образованием кислых растворов. Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Характерные свойства водных растворов кислот Бренстеда-Лоури обусловлены присутствием ионов гидроксония; водные растворы оснований Бренстеда-Лоури обусловлены присутствием гидроксид-ионов. Нейтрализация, которая происходит при объединении водных растворов кислот и оснований, является результатом реакции ионов гидроксония и гидроксида с образованием воды. Некоторые соли, образующиеся в реакциях нейтрализации, могут сделать растворы продуктов слабокислыми или слабощелочными.
Растворы, содержащие соли или гидратированные ионы металлов, имеют pH, который определяется степенью гидролиза ионов в растворе. PH растворов может быть рассчитан с использованием известных методов равновесия, или он может быть качественно определен как кислотный, основной или нейтральный в зависимости от относительных K a и K b вовлеченных ионов.
Химия: упражнения в конце главы
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) Al (НЕТ 3 ) 3
б)
РБИ(в) KHCO 2
(г) CH 3 NH 3 Br
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) FeCl 3
(б) К 2 CO 3
(в) NH 4 Br
(г) KClO 4
- Новокаин, C 13 H 21 O 2 N 2 Cl, представляет собой соль основного прокаина и соляной кислоты.Константа ионизации новокаина составляет 7 × 10 -6 . Кислый или щелочной раствор новокаина? Что такое [H 3 O + ], [OH — ] и pH 2,0% -ного по массе раствора новокаина, при условии, что плотность раствора составляет 1,0 г / мл.
Решения
Ответы на упражнения по химии в конце главы
2. (а) кислая; (б) базовый; (в) кислая; (г) нейтральный
Гидролиз солей: уравнения | Химия для неосновных
Цели обучения
- Определите гидролиз соли.
- Напишите уравнения солей, образующих основные растворы.
- Напишите уравнения для солей, образующих кислые растворы.
- Напишите уравнения солей, образующих нейтральные растворы.
Печенье лучше
Выпечка кажется легкой со всеми доступными смесями в коробках («просто добавьте воды и перемешайте»). Однако выпечка включает в себя много химии — независимо от того, работаете ли вы с коробкой или с ингредиентами, которые вы отмеряете.
Одним из важных компонентов любого печенья является бикарбонат натрия (более известный как разрыхлитель).Если у вас рецепт без дрожжей, любая взбитость готового печенья обычно возникает из-за углекислого газа, образующегося из разрыхлителя. Одна популярная марка упакованной смеси использует комбинацию бикарбоната натрия и сульфата натрия и алюминия для производства CO 2 . Реакция видна ниже:
Если все пойдет хорошо, печенье поднимется, блины будут воздушными, и все будут довольны.
Гидролиз солей: уравнения
Соль — это ионное соединение, которое образуется, когда кислота и основание нейтрализуют друг друга.Хотя может показаться, что солевые растворы всегда будут нейтральными, они часто могут быть кислыми или щелочными.
Рассмотрим соль, образовавшуюся при нейтрализации слабокислой фтористоводородной кислоты сильным основным гидроксидом натрия. Молекулярные и чистые ионные уравнения показаны ниже.
Поскольку фторид натрия растворим, ион натрия является ионом-наблюдателем в реакции нейтрализации. Фторид-ион способен в небольшой степени реагировать с водой, принимая протон.
Ион фтора действует как слабое основание Бренстеда-Лоури. Ион гидроксида, который образуется в результате вышеуказанной реакции, делает раствор слегка щелочным. Гидролиз соли — это реакция, в которой один из ионов соли реагирует с водой, образуя кислотный или щелочной раствор.
Соли, образующие базовые растворы
Когда твердый фторид натрия растворяется в воде, он полностью диссоциирует на ионы натрия и ионы фтора. Ионы натрия не обладают способностью к гидролизу, но фторид-ионы гидролизуются с образованием небольшого количества фтористоводородной кислоты и гидроксид-иона.
Соли, полученные в результате нейтрализации слабой кислоты (HF) сильным основанием (NaOH), всегда будут давать солевые растворы, которые являются основными.
Соли, образующие кислотные растворы
Хлорид аммония (NH 4 Cl) представляет собой соль, которая образуется, когда сильная кислота HCl нейтрализуется слабым основанием NH 3 . Хлорид аммония растворим в воде. Образовавшийся хлорид-ион не может гидролизоваться, потому что он является сопряженным основанием сильной кислоты HCl.Другими словами, ион Cl — не может принимать протон из воды с образованием HCl и OH — , как это сделал ион фтора в предыдущем разделе. Однако ион аммония способен незначительно реагировать с водой, отдавая протон и, таким образом, действуя как кислота.
Соли, образующие нейтральные растворы
Соль, полученная в результате реакции сильной кислоты с сильным основанием, образует раствор с pH 7. Примером является хлорид натрия, образующийся при нейтрализации HCl с помощью NaOH.Раствор NaCl в воде не обладает ни кислотными, ни основными свойствами, поскольку ни один ион не способен гидролизоваться. Другие соли, образующие нейтральные растворы, включают нитрат калия (KNO 3 ) и бромид лития (LiBr). В приведенной ниже таблице показано, как определить кислотность или основность солевого раствора.
| Соль, образованная из: | Солевой раствор |
| Сильная кислота + сильное основание | нейтральный |
| Сильная кислота + Слабое основание | Кислый |
| Слабая кислота + сильное основание | Базовый |
Соли, образующиеся в результате реакции слабой кислоты и слабого основания, труднее анализировать из-за конкурирующих реакций гидролиза между катионом и анионом.Эти соли не будут рассматриваться в этой концепции.
Сводка
- Определен гидролиз солей.
- Описаны реакции гидролиза солей с образованием кислых, основных или нейтральных растворов.
Практика
Выполните задачи 1, 2, 3 и 5 в ChemWiki.
Отзыв
- Каким образом F — дает базовое решение?
- Как ион аммония производит кислый раствор?
- Почему растворенный NaCl дает нейтральный раствор?
Глоссарий
- гидролиз соли: Реакция, в которой один из ионов соли реагирует с водой, образуя кислотный или щелочной раствор.
18,7: Растворимость и pH — Chemistry LibreTexts
Цели обучения
- Чтобы понять, почему растворимость многих соединений зависит от pH.
Растворимость многих соединений сильно зависит от pH раствора. Например, анион во многих труднорастворимых солях представляет собой конъюгированное основание слабой кислоты, которая может протонироваться в растворе. {-}}] \]
Согласно принципу Ле Шателье, больше МА будет растворяться до тех пор, пока не будет \ (Q = K_ {sp} \).{2+} (водн.) + 2HF (водн.) \ Label {17.20} \]
Пример \ (\ PageIndex {1} \) показывает, как рассчитать эффект растворимости при добавлении сильной кислоты к раствору труднорастворимой соли.
Трудно растворимые соли, полученные из слабых кислот, обычно лучше растворяются в кислых растворах.
Пример \ (\ PageIndex {1} \)
Оксалат свинца (PbC 2 O 4 ), иодид свинца (PbI 2 ) и сульфат свинца (PbSO 4 ) все довольно нерастворимы, со значениями K sp , равными 4.8 × 10 −10 , 9,8 × 10 −9 и 2,53 × 10 −8 соответственно. Как влияет добавление сильной кислоты, такой как хлорная кислота, на их относительную растворимость?
Дано: K sp значения для трех соединений
Запрошено: относительная растворимость в растворе кислоты
Стратегия:
Напишите сбалансированное химическое уравнение растворения каждой соли. Поскольку на самое сильное сопряженное основание больше всего повлияет добавление сильной кислоты, определите относительную растворимость по относительной основности анионов.{2 -} _ {4 (водн.)} \ Nonumber \]
Добавление сильной кислоты будет иметь наибольшее влияние на растворимость соли, которая содержит сопряженное основание слабой кислоты в качестве аниона. Поскольку HI является сильной кислотой, мы прогнозируем, что добавление сильной кислоты к насыщенному раствору PbI 2 не сильно повлияет на его растворимость; кислота просто диссоциирует с образованием H + (водн.) и соответствующего аниона. Напротив, оксалат представляет собой полностью депротонированную форму щавелевой кислоты (HO 2 CCO 2 H), которая представляет собой слабую дипротонную кислоту (p K a1 = 1.+ (водн.) \ rightarrow HO_2CCO_2H (водн.) \ nonumber \]
Эти реакции будут уменьшаться [C 2 O 4 2-], вызывая растворение большего количества оксалата свинца для снятия нагрузки на систему. -_ {4 (aq)} \ nonumber \]
Поскольку HSO 4 — имеет pKa, равное 1.99, эта реакция будет лежать в основном слева, как написано. Следовательно, мы прогнозируем, что влияние добавленной сильной кислоты на растворимость PbSO 4 будет значительно меньше, чем для PbC 2 O 4 .
Упражнение \ (\ PageIndex {1} \)
Какая из следующих нерастворимых солей — AgCl, Ag 2 CO 3 , Ag 3 PO 4 и / или AgBr — будет значительно более растворимой в 1,0 M HNO 3 , чем в чистой воде?
- Ответ
Ag 2 CO 3 и Ag 3 PO 4
Пещеры и связанные с ними вершины и каменные шпили представляют собой один из самых впечатляющих примеров pH-зависимой растворимости Equilbria (часть (a) на рисунке \ (\ PageIndex {1} \) :).{2−} 3 (водн.) \ Rightleftharpoons CaCO3 (s)} \ label {17. −_ {3 (водный)} \ rightleftharpoons CaCO_ {3 (s)} + CO_ {2 (g)} + H_2O (l) \ label {17.24} \]
Прямое направление — это та же реакция, при которой образуется твердое вещество, называемое накипью, в чайниках, кофеварках, водонагревателях, бойлерах и других местах, где жесткая вода постоянно нагревается.
Рисунок \ (\ PageIndex {1} \): Химия образования пещер. (а) Эта пещера в Кампанете, Майорка, Испания, и связанные с ней образования являются примерами рН-зависимых равновесий растворимости. (b) Пещера образуется, когда грунтовые воды, содержащие атмосферный CO 2 , образуя кислый раствор, растворяют известняк (CaCO 3 ) в процессе, который может занять десятки тысяч лет.Когда грунтовые воды просачиваются в пещеру, вода испаряется из раствора CaCO 3 в воде, обогащенной CO 2 , образуя перенасыщенный раствор и сдвиг равновесия, вызывающий осаждение CaCO 3 . Отложенный известняк в конечном итоге образует сталактиты и сталагмиты.Когда содержащий подземные воды атмосферный CO 2 (уравнения \ (\ ref {17.21} \) и \ (\ ref {17.22} \)) попадает в микроскопические трещины в отложениях известняка, CaCO 3 растворяется в кислотный раствор в обратном направлении уравнения \ (\ ref {17.24} \). Трещины постепенно увеличиваются с 10–50 мкм до 5–10 мм, и этот процесс может длиться до 10 000 лет. В конце концов, примерно через 10 000 лет образуется пещера. Подземные воды с поверхности просачиваются в пещеру и цепляются за потолок, где вода испаряется и вызывает смещение равновесия в уравнении \ (\ ref {17.24} \) вправо. Осаждение круглого слоя твердого CaCO 3 приводит к образованию длинного полого шпиля из известняка, называемого сталактитом, который растет с потолка.Ниже, где капли падают с потолка, аналогичный процесс вызывает рост другого шпиля, называемого сталагмитом. Те же процессы, которые вырезают под землей, работают и над землей, в некоторых случаях создавая фантастически запутанные пейзажи, такие как провинция Юньнань в Китае (рис. \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \): Растворимость уравновешивает формирование карстовых ландшафтов. Такие пейзажи, как крутые известняковые вершины Каменного леса в провинции Юньнань, Китай, образованы в результате того же процесса, который создает пещеры и связанные с ними образования.Кислые, основные и амфотерные оксиды и гидроксиды
Одна из первых классификаций веществ была основана на их растворимости в кислых растворах по сравнению с основными, что привело к классификации оксидов и гидроксидов как основных или кислых. Основные оксиды и гидроксиды либо реагируют с водой с образованием основного раствора, либо легко растворяются в водной кислоте. Кислые оксиды или гидроксиды реагируют с водой с образованием кислого раствора или растворимы в водном основании.- (водн.) \ Label {17.25} \]
\ [SO_ {3 (g)} + H_2O (l) \ rightarrow H_2SO_ {4 (aq)} \ label {17.26} \]
Оксид цезия реагирует с водой с образованием основного раствора гидроксида цезия, тогда как триоксид серы реагирует с водой с образованием раствора серной кислоты — действительно очень разные поведения.
Оксиды металлов обычно реагируют с водой с образованием основных растворов, тогда как оксиды неметаллов образуют кислые растворы.
Разница в реакционной способности происходит из-за разницы в связывании двух видов оксидов.Из-за низкой электроотрицательности металлов в крайней левой части периодической таблицы их оксиды лучше всего рассматривать как содержащие дискретные катионы M n + и анионы O 2-. На другом конце спектра — оксиды неметаллов; из-за своей более высокой электроотрицательности неметаллы образуют оксиды с ковалентными связями с кислородом. Однако из-за высокой электроотрицательности кислорода ковалентная связь между кислородом и другим атомом, E, обычно поляризована: E δ + –O δ– .{2 -} _ {4 (водн.)} + H_2O (l) \ label {17.27} \]
Рисунок \ (\ PageIndex {3} \): Классификация оксидов элементов основной группы по их кислотному или основному характеру. В периодической таблице происходит постепенный переход от основных оксидов к кислотным оксидам из нижнего левого угла в верхний правый. Оксиды металлических элементов обычно представляют собой основные оксиды, которые либо реагируют с водой с образованием основного раствора, либо растворяются в водной кислоте. Напротив, оксиды неметаллических элементов представляют собой кислые оксиды, которые либо реагируют с водой с образованием кислого раствора, либо растворимы в водном основании.Оксиды промежуточного характера, называемые амфотерными оксидами, расположены вдоль диагональной линии между двумя крайними значениями. Амфотерные оксиды растворяются в кислоте с образованием воды или растворяются в основании с образованием растворимого комплексного иона. (Радиоактивные элементы не классифицируются.)Как показано на рисунке \ (\ PageIndex {3} \), происходит постепенный переход от основных оксидов металлов к кислым оксидам неметаллов, когда мы идем от нижнего левого угла к верхнему правому в периодическом таблица, с широкой диагональной полосой оксидов промежуточного характера, разделяющей две крайние точки.Многие оксиды элементов в этой диагональной области периодической таблицы растворимы как в кислотных, так и в основных растворах; следовательно, они называются амфотерными оксидами (от греческого слова ampho, что означает «оба», как в амфипротическом). Амфотерные оксиды растворяются в кислоте с образованием воды или растворяются в основании с образованием растворимого комплекса. Как показано на видео \ (\ PageIndex {1} \), например, смешивание амфотерного оксида Cr (OH) 3 (также обозначаемого как Cr 2 O 3 • 3H 2 O) с водой дает мутная, пурпурно-коричневая суспензия.-}} \ mathrm {(aq)} \ label {17.29} \]
Видео \ (\ PageIndex {1} \): Гидроксид хрома (III) [Cr (OH) 3 или Cr 2 O 3 • 3H 2 O] является примером амфотерного Окись. Все три стакана изначально содержали суспензию коричневато-пурпурного Cr (OH) 3 (s) (в центре). Когда концентрированную кислоту (6 MH 2 SO 4 ) добавляли в стакан слева, Cr (OH) 3 растворялся с образованием фиолетового [Cr (H 2 O) 6 ] 3+ ионов и вода.Добавление концентрированного основания (6 M NaOH) в стакан справа привело к растворению Cr (OH) 3 с образованием зеленых ионов [Cr (OH) 4 ] — . Для более полного описания см. Https://www.youtube.com/watch?v=IQNcLH6OZK0
.Пример \ (\ PageIndex {2} \)
Гидроксид алюминия, записываемый как Al (OH) 3 или Al 2 O 3 • 3H 2 O, является амфотерным. Напишите химические уравнения, описывающие растворение гидроксида алюминия в (а) кислоте и (б) в основании.
Дано: амфотерное соединение
Запрошено: реакции растворения в кислоте и основании
Стратегия:
Используя уравнения \ (\ ref {17.28} \) и \ (\ ref {17.29} \) в качестве руководства, запишите реакции растворения в растворах кислоты и основания.
Решение
- Кислота отдает протоны гидроксиду с образованием воды и гидратированного иона металла, поэтому гидроксиду алюминия, который содержит три иона OH — на Al, требуется три иона H + :
\ [Al (OH) _ {3 (s)} + 3H ^ + (aq) \ rightarrow Al ^ {3+} (aq) + 3H_2O (l) \ nonumber \]
В водном растворе Al 3 + образует комплексный ион [Al (H 2 O) 6 ] 3+ .2 _ {- (водн.)} \ Nonumber \]
Селективное осаждение с использованием pH
Многие растворенные ионы металлов могут быть отделены путем селективного осаждения катионов из раствора при определенных условиях. В этом методе pH часто используется для контроля концентрации аниона в растворе, который определяет, какие катионы выпадают в осадок.
Концентрацию анионов в растворе часто можно контролировать, регулируя pH, тем самым обеспечивая селективное осаждение катионов.{2−}] \ label {17.33c} \]
Таким образом, концентрации сульфидов от 1,6 × 10 −21 M до 8,0 × 10 −24 M будут приводить к осаждению CdS из раствора, но не ZnS. Как нам получить такую низкую концентрацию сульфида? Насыщенный водный раствор H 2 S содержит 0,10 M H 2 S при 20 ° C. P K a1 для H 2 S составляет 6,97, а p K a2 , соответствующее образованию [S 2-], составляет 12,90. — (aq) \ label {17.{−13} \ label {17.34d} \]
Мы можем показать, что концентрация S 2− составляет 1,3 × 10 −13 , сравнив K a1 и K a2 и признав, что вклад в [H + ] от диссоциация HS — незначительна по сравнению с [H + ] от диссоциации H 2 S. Таким образом, подставляя 0,10 M в уравнение для K a1 для концентрации H 2 S, который практически постоянен независимо от pH, дает следующее:
\ [K _ {\ textrm {a1}} = 1.{2 -}}] \]
Хотя [S 2-] в растворе H 2 S очень мало (1,3 × 10 -13 M), барботирование H 2 S через раствор до его насыщения приведет к осаждению иона обоих металлов, потому что концентрация S 2- тогда будет намного больше, чем 1,6 × 10 -21 М. Таким образом, мы должны отрегулировать [S 2-], чтобы оставаться в желаемом диапазоне. Самый прямой способ сделать это — отрегулировать [H + ], добавив кислоту к раствору H 2 S (вспомните принцип Ле Шателье), тем самым установив равновесие в уравнении \ (\ ref {17.+}] & = 0.94 \ end {align} \ label {17.38} \]
Таким образом, добавление сильной кислоты, такой как HCl, для получения 0,94 M раствора в H + предотвратит осаждение более растворимого ZnS, обеспечивая при этом осаждение менее растворимого CdS при насыщении раствора H 2 S.
Пример \ (\ PageIndex {3} \)
Раствор содержит 0,010 М Ca 2 + и 0,010 М La 3 + . Какая концентрация HCl необходима для осаждения La 2 (C 2 O 4 ) 3 • 9H 2 O, но не Ca (C 2 O 4 ) • H 2 O если концентрация щавелевой кислоты равна 1.0 М? K sp значения: 2,32 × 10 −9 для Ca (C 2 O 4 ) и 2,5 × 10 −27 для La 2 (C 2 O 4 ) 3 ; p K a1 = 1,25 и p K a2 = 3,81 для щавелевой кислоты.
Дано: концентрации катионов, K значения sp и значения концентрации и p K a для щавелевой кислоты
Запрошено: концентрация HCl, необходимая для селективного осаждения La 2 (C 2 O 4 ) 3
Стратегия:
- Запишите каждое выражение произведения растворимости и рассчитайте концентрацию оксалата, необходимую для выпадения осадка.Определите диапазон концентраций, необходимый для селективного осаждения La 2 (C 2 O 4 ) 3 • 9H 2 O.
- Сложите уравнения для первой и второй диссоциации щавелевой кислоты, чтобы получить общее уравнение для диссоциации щавелевой кислоты до оксалата. Подставьте [ox 2- ], необходимый для осаждения La 2 (C 2 O 4 ) 3 • 9H 2 O, в общее уравнение диссоциации щавелевой кислоты, чтобы рассчитать необходимое [ H + ]. {2−}] = (0.+}] & = \ textrm {6,1 M} \ end {align} \ nonumber \]
Таким образом, добавление достаточного количества HCl, чтобы получить [H + ] = 6,1 M, вызовет осаждение только La 2 (C 2 O 4 ) 3 • 9H 2 O из раствора.
Упражнение \ (\ PageIndex {3} \)
Раствор содержит 0,015 M Fe 2 + и 0,015 M Pb 2 + . Какая концентрация кислоты необходима для того, чтобы Pb 2 + выпадал в осадок в виде PbS в насыщенном растворе H 2 S, но Fe 2 + не выпадал в осадок в виде FeS? K sp значения 6.3 × 10 −18 для FeS и 8,0 × 10 −28 для PbS.
- Ответ
0,018 М В +
Сводка
Анион в труднорастворимых солях часто является сопряженным основанием слабой кислоты, которая может стать протонированной в растворе, поэтому растворимость простых оксидов и сульфидов, как сильных оснований, часто зависит от pH. Анион во многих труднорастворимых солях является сопряженным основанием слабой кислоты.При низком pH протонирование аниона может резко увеличить растворимость соли. Оксиды можно разделить на кислые оксиды или основные оксиды. Кислые оксиды реагируют с водой с образованием кислого раствора или растворяются в сильном основании; большинство кислых оксидов — это оксиды неметаллов или оксиды металлов в высоких степенях окисления. Основные оксиды реагируют с водой с образованием основного раствора или растворяются в сильной кислоте; самые основные оксиды — это оксиды металлических элементов. Оксиды или гидроксиды, растворимые как в кислотных, так и в основных растворах, называются амфотерными оксидами.Большинство элементов, оксиды которых проявляют амфотерное поведение, расположены вдоль диагональной линии, разделяющей металлы и неметаллы в периодической таблице. В растворах, содержащих смеси растворенных ионов металлов, pH можно использовать для контроля концентрации анионов, необходимой для селективного осаждения желаемого катиона.
Авторы и авторство
14.4 Гидролиз солей — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Предсказать, будет ли солевой раствор кислым, основным или нейтральным
- Расчет концентраций различных веществ в солевом растворе
- Описать кислотную ионизацию гидратированных ионов металлов
Соли кислотных ионов
Соли — это ионные соединения, состоящие из катионов и анионов, каждый из которых может подвергаться кислотной или основной ионизационной реакции с водой.Следовательно, водные солевые растворы могут быть кислыми, основными или нейтральными, в зависимости от относительной кислотно-щелочной силы ионов, составляющих соль. Например, растворение хлорида аммония в воде приводит к его диссоциации, как описано уравнением
Nh5Cl (т) ⇌Nh5 + (водн.) + Cl- (водн.) Nh5Cl (т) ⇌Nh5 + (водн.) + Cl- (водн.)Ион аммония представляет собой сопряженную кислоту основного аммиака, NH 3 ; реакция его кислотной ионизации (или кислотного гидролиза) представлена
Nh5 + (водн.) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / KbNh5 + (aq) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / KbПоскольку аммиак является слабым основанием, можно измерить K b и K a > 0 (ион аммония является слабой кислотой).
Хлорид-ион является сопряженным основанием соляной кислоты, поэтому реакция его ионизации основанием (или гидролиза основанием ) представлена как
Cl− (aq) + h3O (l) ⇌HCl (aq) + OH− (aq) Kb = Kw / KaCl− (aq) + h3O (l) ⇌HCl (aq) + OH− (aq) Kb = Kw / КаПоскольку HCl является сильной кислотой, K a неизмеримо велико и K b ≈ 0 (ионы хлора не подвергаются заметному гидролизу).
Таким образом, растворение хлорида аммония в воде дает раствор слабых кислотных катионов (Nh5 + Nh5 +) и инертных анионов (Cl — ), в результате чего получается кислый раствор.
Пример 14.15
Расчет pH кислого солевого раствора
Анилин — это амин, который используется для производства красителей. Он выделяется в виде хлорида анилиния, [C6H5Nh4] Cl, [C6H5Nh4] Cl, соли, полученной реакцией слабого основного анилина и соляной кислоты. Каков pH 0,233 M раствора хлорида анилина C6H5Nh4 + (водн.) + H3O (l) ⇌h4O + (водн.) + C6H5Nh3 (водн.) C6H5Nh4 + (водн.) + H3O (l) h4O + (водн.) + C6Hq5 )Раствор
K a для иона анилиния является производным от K b для его сопряженного основания, анилина (см. Приложение H): Ка = KwKb = 1.0 × 10–144,3 × 10–10 = 2,3 × 10–5Ka = KwKb = 1,0 × 10–144,3 × 10–10 = 2,3 × 10–5На основе предоставленной информации подготовлена таблица ICE для этой системы:
Подстановка этих членов равновесной концентрации в выражение K дает
Ka = [C6H5Nh3] [h4O +] / [C6H5Nh4 +] 2.3 × 10−5 = (x) (x) /0.233−x) Ka = [C6H5Nh3] [h4O +] / [C6H5Nh4 +] 2.3 × 10−5 = (x) (x) /0,233−x)Предполагая x << 0,233, уравнение упрощается и решается для x :
2.3 × 10−5 = x2 / 0.233x = 0,0023M2,3 × 10−5 = x2 / 0,233x = 0,0023MВ таблице ICE x определяется как молярность иона гидроксония, поэтому значение pH рассчитывается как
. pH = −log [h4O +] = — log (0,0023) = 2,64 pH = −log [h4O +] = — log (0,0023) = 2,64Проверьте свои знания
Какова концентрация ионов гидроксония в 0,100– M растворе нитрата аммония, NH 4 NO 3 , соли, состоящей из ионов Nh5 + Nh5 + и NO3 − .NO3−. Какая кислота сильнее C6H5Nh4 + C6H5Nh4 + или Nh5 +? Nh5 +?Ответ:
[H 3 O + ] = 7.5 × × 10 −6 M ; C6H5Nh4 + C6H5Nh4 + — более сильная кислота.
Соли основных ионов
В качестве другого примера рассмотрим растворение ацетата натрия в воде:
NaCh4CO2 (т) ⇋Na + (водн.) + Ch4CO2- (водн.) NaCh4CO2 (т.) ⇋Na + (водн.) + Ch4CO2- (водн.)Ион натрия не подвергается заметной кислотной или щелочной ионизации и не влияет на pH раствора. Это может показаться очевидным из формулы иона, которая указывает на отсутствие атомов водорода или кислорода, но некоторые растворенные ионы металлов действуют как слабые кислоты, о чем будет сказано далее в этом разделе.
Ацетат-ион, Ch4CO2-, Ch4CO2-, представляет собой сопряженное основание уксусной кислоты, CH 3 CO 2 H, и поэтому его реакция ионизации основанием (или гидролиза основанием ) представлена как
Ch4CO2− (водный раствор) + h3O (l) ⇌Ch4CO2H (водный раствор) + OH− (водный раствор) Kb = Kw / KaCh4CO2− (водный раствор) + h3O (l) ⇌Ch4CO2H (водный раствор) + OH− (водный раствор) Kb = Kw / КаПоскольку уксусная кислота является слабой кислотой, ее K a можно измерить, а K b > 0 (ацетат-ион является слабым основанием).
Растворение ацетата натрия в воде дает раствор инертных катионов (Na + ) и слабых основных анионов (Ch4CO2 -), (Ch4CO2-), приводя к базовому решению.
Пример 14.16
Равновесие в растворе соли слабой кислоты и сильного основания
Определите концентрацию уксусной кислоты в растворе с [Ch4CO2 -] = 0,050M [Ch4CO2 -] = 0,050M и [OH — ] = 2,5 × × 10 −6 M в состоянии равновесия. Реакция такая: Ch4CO2− (водн.) + H3O (l) ⇌Ch4CO2H (водн.) + OH− (водн.) Ch4CO2− (водн.) + H3O (l) ⇌Ch4CO2H (водн.) + OH− (водн.)Раствор
Приведенные равновесные концентрации и значение константы равновесия позволят рассчитать недостающую равновесную концентрацию.Рассматриваемый процесс представляет собой основную ионизацию ацетат-иона, для которой Kb (forCh4CO2 -) = KwKa (forCh4CO2H) = 1.0 × 10−141.8 × 10−5 = 5.6 × 10−10Kb (forCh4CO2 -) = KwKa (forCh4CO2H) = 1.0 × 10−141.8 × 10−5 = 5.6 × 10− 10Подстановка доступных значений в выражение K b дает
Kb = [Ch4CO2H] [OH -] [Ch4CO2 -] = 5,6 × 10-10 Kb = [Ch4CO2H] [OH -] [Ch4CO2 -] = 5,6 × 10-10 = [Ch4CO2H] (2,5 × 10–6) (0,050) = 5,6 × 10–10 = [Ch4CO2H] (2,5 × 10–6) (0,050) = 5,6 × 10–10Решение вышеуказанного уравнения для молярности уксусной кислоты дает [CH 3 CO 2 H] = 1.1 × × 10 −5 M .
Проверьте свои знания
Каков pH 0,083– M раствора NaCN?Соли кислотных и основных ионов
Некоторые соли состоят как из кислотных, так и из основных ионов, поэтому pH их растворов будет зависеть от относительной силы этих двух видов. Точно так же некоторые соли содержат единственный ион, который является амфипротонным, и поэтому относительная сила кислотного и основного характера этого иона будет определять его влияние на pH раствора.Для обоих типов солей сравнение значений K a и K b позволяет прогнозировать кислотно-основное состояние раствора, как показано в следующем примере упражнения.
Пример 14.17
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:(а) KBr
(б) NaHCO 3
(в) Na 2 HPO 4
(г) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на pH раствора, как показано здесь:(a) Катион K + инертен и не влияет на pH.Бромид-ион является сопряженным основанием сильной кислоты, поэтому его основная сила незначительна (нет заметной ионизации основания). Раствор нейтральный.
(b) Катион Na + инертен и не влияет на pH раствора; в то время как анион HCO3-HCO3- является амфипротонным. K a HCO3 − HCO3− составляет 4,7 × × 10 −11 , а его K b составляет 1,0 × 10−144,3 × 10−7 = 2,3 × 10−8,1,0 × 10. −144,3 × 10−7 = 2,3 × 10−8.
Начиная с K b >> K a , решение является базовым.
(c) Катион Na + инертен и не влияет на pH раствора, в то время как анион HPO42-HPO42- является амфипротонным. K a HPO42 − HPO42− составляет 4,2 × × 10 −13 ,
, а его K b составляет 1,0 × 10−146,2 × 10−8 = 1,6 × 10−7,1,0. × 10−146,2 × 10−8 = 1,6 × 10−7. Поскольку K b >> K a , решение является основным.
(d) Ион Nh5 + Nh5 + является кислым (см. Обсуждение выше), а ион F — является основным (сопряженное основание слабой кислоты HF).Сравнивая две константы ионизации: K a Nh5 + Nh5 + составляет 5,6 × × 10 −10 и K b F — составляет 1,6 × × 10 −11 , поэтому раствор кислый, так как K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:(а) К 2 CO 3
(б) CaCl 2
(в) KH 2 PO 4
(г) (NH 4 ) 2 CO 3
Ответ:
(а) базовый; (б) нейтральный; (в) кислая; (г) базовый
Ионизация гидратированных ионов металлов
В отличие от ионов металлов 1 и 2 групп предыдущих примеров (Na + , Ca 2+ и т. Д.), некоторые ионы металлов действуют как кислоты в водных растворах. Эти ионы не просто слабо сольватируются молекулами воды при растворении, вместо этого они ковалентно связаны с фиксированным числом молекул воды с образованием сложного иона (см. Главу о координационной химии). Например, растворение нитрата алюминия в воде обычно представлено как
Al (NO3) (s) ⇌Al3 + (водн.) + 3NO3- (водн.) Al (NO3) (s) ⇌Al3 + (водн.) + 3NO3- (водн.)Однако ион алюминия (III) на самом деле реагирует с шестью молекулами воды с образованием стабильного комплексного иона, и поэтому более явное представление процесса растворения составляет
Al (NO3) 3 (т) + 6h3O (ж) ⇌Al (h3O) 63+ (водн.) + 3NO3- (водн.) Al (NO3) 3 (т) + 6h3O (ж) ⇌Al (h3O) 63+ ( водн.) + 3NO3− (водн.)Как показано на Рисунке 14.13, Al (h3O) 63 + Al (h3O) 63+ ионы включают связи между центральным атомом Al и атомами O шести молекул воды. Следовательно, связи O – H связанных молекул воды более полярны, чем в несвязанных молекулах воды, что делает связанные молекулы более склонными к отдаче иона водорода:
Al (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 × 10−5Al (h3O) 63+ (водн.) + H3O (л) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 · 10−5Конъюгированное основание, полученное этим способом, содержит пять других связанных молекул воды, способных действовать как кислоты, и поэтому возможен последовательный или ступенчатый перенос протонов, как показано в нескольких уравнениях ниже:
Al (h3O) 63+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Al (h3O) 63+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 5 ( ОН) 2+ (водн.) Al (h3O) 5 (OH) 2+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 4 (OH) 2+ (водн.) Al (h3O) 5 (OH) 2+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 4 (OH) 2+ (водн.) Al (h3O) 4 (OH) 2+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.) Al (h3O) 4 (OH) 2+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.)Это пример полипротонной кислоты, о которой мы поговорим в следующем разделе этой главы.
Рис. 14.13 Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.
За исключением щелочных металлов (группа 1) и некоторых щелочноземельных металлов (группа 2), большинство ионов других металлов в некоторой степени подвергается кислотной ионизации при растворении в воде. Кислотная сила этих комплексных ионов обычно увеличивается с увеличением заряда и уменьшением размера ионов металла. Уравнения кислотной ионизации первого шага для нескольких других кислотных ионов металлов показаны ниже:
Fe (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (водн.) + Fe (h3O) 5 (OH) 2+ ( aq) pKa = 2.74Fe (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (aq) + Fe (h3O) 5 (OH) 2+ (aq) pKa = 2.74Cu (h3O) 62+ (водн.) + H3O (l) ⇌h4O + (водн.) + Cu (h3O) 5 (OH) + (водн.) PKa = ~ 6,3Cu (h3O) 62+ (водн.) + H3O (l) ⇌h4O + (водн.) + Cu (h3O) 5 (OH) + (aq) pKa = ~ 6.3Zn (h3O) 42+ (aq) + h3O (l) ⇌h4O + (aq) + Zn (h3O) 3 (OH) + (aq) pKa = 9.6Zn (h3O) 42+ ( aq) + h3O (l) ⇌h4O + (aq) + Zn (h3O) 3 (OH) + (aq) pKa = 9,6Пример 14.18
Гидролиз [Al (H
2 O) 6 ] 3+ Рассчитайте pH раствора хлорида алюминия 0,10– M , который полностью растворяется с образованием гидратированного иона алюминия [Al (h3O) 6] 3+ [Al (h3O) 6] 3+ в растворе.Решение
Уравнение реакции и K a :
Al (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 × 10−5Al (h3O) 63+ (водн.) + H3O (л) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 × 10-5
Таблица ICE с предоставленной информацией —Ka = [h4O +] [Al (h3O) 5 (OH) 2 +] [Al (h3O) 63+] Ka = [h4O +] [Al (h3O) 5 (OH) 2 +] [Al (h3O) 63+ ] = (х) (х) 0.10 − x = 1,4 × 10−5 = (x) (x) 0,10 − x = 1,4 × 10−5
Подставляя выражения для равновесных концентраций в уравнение для константы ионизации, получаем:x = 1,2 × 10−3Mx = 1,2 × 10−3M
Предполагая x << 0,10 и решая упрощенное уравнение, получаем:[h4O +] = 0 + x = 1,2 × 10−3M [h4O +] = 0 + x = 1,2 × 10−3MpH = −log [h4O +] = 2,92 (кислый раствор) pH = −log [h4O +] = 2,92 ( кислый раствор)
Таблица ICE определила x как равную концентрации иона гидроксония, поэтому рассчитанный pH равен
.Проверьте свои знания
Что такое [Al (h3O) 5 (OH) 2 +] [Al (h3O) 5 (OH) 2+] в 0.15- M раствор Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы довести [H 3 O + ] до 0,10 M ?Гидролиз амидов с использованием кислоты или основания — Master Organic Chemistry
Гидролиз амидов — превращение амидов в карбоновые кислоты
В этом посте мы обсуждаем примеры и механизм кислотного гидролиза амидов, а также некоторые примеры гидролиза амидов, которые являются необычно «легко».Мы также кратко коснемся гидролиза амидов в основных условиях.
Содержание
- Гидролиз амидов
- Почему гидролиз амидов так сложен по сравнению с галогенидами и сложными эфирами кислот?
- Гидролиз амида с использованием водной кислоты: механизм
- Что относительно основного гидролиза амидов
- Заключение: гидролиз амида
- Примечания: 3 амида, которые необычно легко разрушаются
- (расширенный) Ссылки и дополнительная литература
1 .Гидролиз амидовАмиды представляют собой производные карбоновой кислоты, в которых –ОН карбоновой кислоты заменен на –NH 2 , –NHR или –NR 2 амина. Поскольку реакция между карбоновой кислотой и амином с образованием амида также высвобождает воду, это пример «реакции конденсации». [ Мы обсуждаем номенклатуру и синтез амидов здесь ].
Когда две аминокислоты образуют амид, мы называем этот вид пептидом , и если вы не жили под камнем, вы бы знали, что белки собраны из аминокислот, связанных пептидными (амидными) связями. .Амиды — непростая функциональная группа для разрушения — и это тоже хорошо, поскольку жизнь на Земле так зависит от них.
Противоположной реакции конденсации является реакция гидролиза . Гидролиз амидов, как правило, непросто. Типичные условия гидролиза амида включают нагревание амида с водной кислотой в течение продолжительных периодов времени.
Циклические амиды называются «лактамами». Подобно тому, как расстегивание ремня приводит к получению простой полоски кожи, гидролиз циклического лактама приводит к образованию линейной аминокислоты.(Пример ниже представляет собой «дельта-аминокислоту», поскольку амин является заместителем на четвертом атоме углерода ниже карбонила — не путать с «аминокислотами» жизни, которые являются «альфа-аминокислотами»).
2. Почему гидролиз амидов так сложен по сравнению с галогенангидридами и сложными эфирами? Две причиныТак почему же амиды так трудно разрушить по сравнению, скажем, с хлорангидридом или даже сложным эфиром?
Одним из ключевых факторов является донорская способность неподеленной пары на азоте .Напомним, что неподеленные пары на азоте (амины) на меньше удерживаются прочно, чем неподеленные пары на (более электроотрицательном) кислороде и, следовательно, на больше доступны для донорства (т. Е. Более основные). Таким образом, резонансная форма с двойной связью азот-углерод более значима, чем соответствующая резонансная форма для сложных эфиров. [Эта тема может быть вам знакома: именно поэтому –NH 2 является «более активирующим» заместителем в ароматических кольцах, чем ОН].
Это имеет несколько интересных последствий.Во-первых, самым основным участком амида является , а не неподеленная пара азота, а вместо этого кислород.
Протонирование происходит сначала на кислороде!
Второе интересное следствие состоит в том, что из-за важности этой правой резонансной формы существует значительный характер «двойной связи» в связи углерод-азот. [В предыдущем посте о конъюгации и резонансе мы упоминали, что это проявляется как барьер для вращения в связи C-N около 15-20 ккал / моль]
3.Гидролиз амидов с использованием водной кислоты: механизмВсе это означает, что гидролиз амида далеко не так прост, как отщепление галогенангидрида. Механизм тоже не такой простой.
Так как же работает реакция?
Как мы уже отмечали, первая стадия — это обратимое протонирование амида на кислороде с образованием конъюгированной кислоты.
Протонирование карбонильного кислорода делает карбонильный углерод более электрофильным, поскольку пи-связь C-O ослабляется и резонансная форма с карбокатионом на углероде становится более значительной.
Следующим шагом является добавление нуклеофила (вода, которая является либо растворителем, либо сорастворителем), образуя новую связь C-O и разрывая пи-связь C-O.
Это приводит к появлению нового вещества с положительным зарядом кислорода. На следующем этапе протон перемещается к атому азота посредством депротонирования кислорода и протонирования азота. [ депротонирование — протонирование, или просто «перенос протона» ]
Получающиеся в результате положительно заряженные частицы азота теперь представляют собой значительно лучшую уходящую группу , поскольку уходящей группой будет HNR 2 (слабое основание ) вместо (-) NR 2 (очень прочная база).Следовательно, на следующем этапе происходит отщепление , образуя новую связь c-o pi и разрывая C-N.
Это приводит к положительно заряженному производному карбоновой кислоты, которое затем депротонируют с получением нейтральной карбоновой кислоты, завершая гидролиз амида.
Этот шестиступенчатый механизм (протонирование, добавление, депротонирование, протонирование, отщепление, депротонирование) может показаться смутно знакомым. Это точная последовательность этапов этерификации Фишера и различных других механизмов, обозначаемых аббревиатурой PADPED.[См. Создание музыки с помощью механизмов]
Все этапы процесса находятся в равновесии, пока не произойдет реакция элиминирования. После разрыва связи углерод-азот добавление крайне маловероятно, поскольку амин присутствует в виде сопряженной кислоты и не может действовать как нуклеофил.
Для среднего амида это практически все, что нужно для гидролиза амида. Очевидно, что для первичного амида уходящей группой будет NH 3 , а для вторичного амида — RNH 2 .
4. А как насчет основного гидролиза амидов?Итак, это кислотный гидролиз. А как насчет основного гидролиза?
Это можно сделать, но обычно это непросто. Если настаивать на грубой силе, это возможно. Гидролиз амидов основанием требует длительного нагревания.
Вся проблема в том, что для того, чтобы произошла реакция замещения (будь то S N 2 или ацильное замещение), вам нужна подходящая уходящая группа. Поскольку это такое сильное основание, депротонированный амин (ошибочно также называют «амидом», или иногда «металлическим амидным основанием») в значительной степени является противоположностью приличной уходящей группы.Таким образом, даже с сильным основанием, таким как гидроксид калия, и большим количеством тепла расщепление амида может быть затруднено. [Примечание]
5. Резюме: гидролиз амидов до карбоновых кислот кислотой или основаниемКислотный гидролиз амидов — одна из тех химических реакций «мясо и картофель», которые необходимо знать и понимать. Один из ключей к полному пониманию механизма — разбить реакцию на шесть этапов (PADPED) и сравнить ее с реакциями, которые разделяют этот основной механистический путь (например,грамм. Этерификация Фишера, гидролиз сложных эфиров и др.).
Убедитесь, что вы можете нарисовать продукт для гидролиза циклического амида (лактама), поскольку реакции циклических молекул (и их обратные, внутримолекулярные реакции) являются обычным кормом для экзаменов.
Эта реакция происходит позже в синтезе аминокислот по Штрекеру, который начинается с присоединения цианид-иона к имину с последующим гидролизом нитрила с образованием карбоновой кислоты.
Спасибо KG за помощь с цифрами в этом посте!
Примечания
Амиды, которые необычно легко разрушаются (1) — Ацилимидазол
Как мы уже говорили, амиды, как правило, плохо расщепляются.Однако стоит обратить внимание на некоторые исключения, которые помогут проиллюстрировать здесь ключевые моменты.
Одним из амидов, которые легко разрушаются, является ацилимидазол. Связь C-N по-прежнему остается, и по-прежнему остается неподеленная пара по азоту.
Так почему же так легко сломать?
Подумайте о формах резонанса. Что вы заметили в имидазоле в резонансной форме слева по сравнению с резонансной формой справа?
В резонансной форме слева имидазол является ароматическим.В резонансной форме справа, с частичным характером двойной связи C-N, эта ароматичность теряется.
Это не уникальное свойство N-ацилимидазола. Это также верно для N-ацилпиррола, N-ацилиндола и других соединений, у которых неподеленная пара «связана» в ароматическом кольце.
Амиды, которые необычно легко разрушать (2) — бета-лактамы
Как описано в The Enchanted Ring , химик из Массачусетского технологического института Джон Шихан и его исследовательская группа чертовски долго синтезировали пенициллин.Проблема заключалась в том, что как только они сформируют 4-членное амидное кольцо («бета-лактам») при обычных условиях, эта чертова штука развалится. В конце концов группа Шихана разработала DCC (а позже EDC) как очень мягкий метод образования амидных связей, и проблема была решена.
Бета-лактам необычайно легко разрушить по двум причинам. Первым и наиболее очевидным является тот факт, что резонансная форма с двойной связью углерод-азот находится в 4-членном кольце и в 4-членном кольце с двойной связью (например.грамм. циклобутен) увеличивает нагрузку на систему. Это сводит к минимуму важность резонансного фактора с двойной связью C = N. Вторая, более тонкая причина заключается в том, что sp3-гибридизированный углерод на кольцевом соединении (рядом с азотом) придает легкую складку азоту, так что перекрытие орбиталей еще более затруднено, чем в линейном амиде.
Поскольку перекрытие орбиталей плохо, связь углерод-азот не имеет частичного характера двойной связи, и ее легко разорвать.
Амиды, которые необычно легко разрушаются (3) — хинуклидин амид
Родственным примером является этот «плацдарм» амид хинуклидинон. Хотя на первый взгляд это может показаться не таким уж странным, когда вы строите модель, вы видите, что неподеленная пара азота направлена под странным углом, который предотвращает перекрытие с соседним карбонилом. Кристаллическая структура справа (из этого исследования профессора Брайана Штольца из Калифорнийского технологического института) делает отсутствие перекрытия орбиталей еще более очевидным.
Помните правило Бредта о нестабильности алкенов на плацдарме? То же самое и с амидными атомами азота на плацдарме.Чтобы «характер частичной двойной связи» присутствовал в этой резонансной форме, должно быть орбитальное перекрытие, и, как показала работа Бредта, для разумно малых размеров кольца это орбитальное перекрытие чрезвычайно мало.
Примечание . Некоторые исследования предполагают, что разрыв связи C-N не происходит до тех пор, пока вторая OH-группа не будет депротонирована.
(Advanced) Ссылки и дополнительная литература
- α-AMINODIETHYLACETIC ACID
Steiger, Robert E.
Орг. Synth. 1942 , 22 , 13
DOI: 10.15227 / orgsyn.022.0013
Для примера кислотного гидролиза амида эта процедура в органическом синтезе довольно типична. Первичный амид кипятят с обратным холодильником в концентрированной HCl в течение 2,5 часов, чтобы получить карбоновую кислоту.- Каталитическая эффективность гидролиза амида. Двухступенчатый механизм
Ричард Л. Шоуен, Х. Джаяраман и Ларри Кершнер
Журнал Американского химического общества 1966 88 (14), 3373-3375
DOI: 10.1021 / ja00966a034
Механистические исследования основного гидролиза амидов подтверждают двухступенчатый механизм присоединения-отщепления.- Синтез и структурный анализ тетрафторбората 2-хинуклидония
Коусуке Тани и Брайан М. Штольц
Nature 441 , страницы 731-734 (2006)
DOI: 10.1038 / nature04842
an чрезвычайно нестабильный «скрученный» амид Штольца и Тани с кристаллической структурой.Удаление отходов | Осмотрительная практика в лаборатории: обращение с химическими веществами и их утилизация
t -гидропероксид бутила и ди- t -бутилпероксид менее опасны, чем побочные пероксиды, образующиеся в растворителях.
Удаление пероксидов оксидом алюминия:
Колонки 2 x 33 см, заполненной 80 г основного активированного оксида алюминия с размером ячеек 80 меш, обычно достаточно для удаления всех пероксидов из 100–400 мл растворителя, растворимого в воде или нерастворимого в воде. После прохождения через колонку следует проверить растворитель на содержание перекиси. Пероксиды, образующиеся при окислении на воздухе, обычно разлагаются оксидом алюминия, а не просто абсорбируются им. Однако в целях безопасности лучше всего перемешать влажный оксид алюминия с разбавленным кислым раствором сульфата железа (II) перед тем, как его выбросить.
Удаление пероксидов с помощью молекулярных сит ® :
Нагрейте 100 мл растворителя с 5 г 4-8-меш, что указывает на активацию 4A Molecular Sieves®, в течение нескольких часов в атмосфере азота. Сита отделяются от растворителя и не требуют дополнительной обработки, поскольку пероксиды разрушаются во время взаимодействия с ситами.
Удаление пероксидов сульфатом железа:
Раствор из 6 г FeSO 4 · 7H 2 O, 6 мл концентрированной серной кислоты и 11 мл воды перемешивают с 1 л нерастворимого в воде растворителя до тех пор, пока растворитель не перестанет давать положительный результат теста на перекиси.Обычно требуется всего несколько минут.
Диацилпероксиды могут быть разрушены этим реагентом, а также водным раствором гидросульфита натрия, гидроксида натрия или аммиака. Однако диацилпероксиды с низкой растворимостью в воде, такие как дибензоилпероксид, реагируют очень медленно. Лучшим реагентом является раствор йодида натрия или йодида калия в ледяной уксусной кислоте.
Методика разрушения диацилпероксидов:
Для 0,01 моль диацилпероксида, 0.022 моль (избыток 10%) иодида натрия или калия растворяют в 70 мл ледяной уксусной кислоты и постепенно добавляют пероксид при перемешивании при комнатной температуре. Раствор быстро темнеет из-за образования йода. По прошествии минимум 30 минут раствор смывается в канализацию с большим избытком воды.
Большинство пероксидов диалкила (ROOR) плохо реагируют при комнатной температуре с сульфатом железа, йодидом, аммиаком или другими реагентами, упомянутыми выше. Однако эти пероксиды можно разрушить модификацией йодидной процедуры.
Методика разрушения пероксидов диалкила:
К вышеуказанному раствору уксусная кислота / йодид калия в качестве ускорителя добавляют один миллилитр 36% (мас. / Об.) Соляной кислоты, а затем 0,01 моль пероксида диалкила. Раствор нагревают до 90-100 ° C на паровой бане в течение 30 минут и выдерживают при этой температуре в течение 5 часов.
7.D.3 Неорганические химические вещества7.D.3.1 Гидриды металлов
Большинство гидридов металлов бурно реагируют с водой с выделением водорода, который может образовывать взрывоопасную смесь с воздухом. Некоторые из них, такие как алюмогидрид лития, гидрид калия и гидрид натрия, являются пирофорными. Большинство из них может быть разложено постепенным добавлением (в порядке уменьшения реакционной способности ) метилового спирта, этилового спирта, n -бутилового спирта или t -бутилового спирта к перемешиваемому, охлажденному льдом раствору или суспензии гидрида. в инертной жидкости, такой как диэтиловый эфир, тетрагидрофуран или толуол, в атмосфере азота в трехгорлой колбе.Хотя эти процедуры снижают опасность и должны быть частью любой экспериментальной процедуры, в которой используются реакционноспособные гидриды металлов, продукты такой дезактивации могут быть опасными отходами, которые должны обрабатываться как таковые при утилизации.
Гидриды, обычно используемые в лабораториях, — это алюмогидрид лития, гидрид калия, гидрид натрия, боргидрид натрия и гидрид кальция. Следующие ниже методы их утилизации демонстрируют, что реакционная способность гидридов металлов значительно варьируется.Большинство гидридов можно безопасно разложить одним из четырех методов, но свойства данного гидрида должны быть хорошо изучены, чтобы выбрать наиболее подходящий метод. (ВНИМАНИЕ: при большинстве описанных ниже методов образуется газообразный водород, который может представлять опасность взрыва. Реакцию следует проводить в вытяжном шкафу, за экраном и с соответствующими мерами безопасности, чтобы избежать воздействия искры или пламени на выходящий газ. . Любое перемешивающее устройство должно быть искробезопасным.)
Разложение алюмогидрида лития:
Литийалюминийгидрид (LiA1H 4 ) можно приобрести в твердом виде или в виде раствора в толуоле, диэтиловом эфире, тетрагидрофуране или других простых эфирах.Хотя дроп-
Глава 9 — Белки и ферменты — CHE 120 — Введение в органическую химию — Учебник
9.1 Белки
Цели обучения
- Опишите четыре уровня структуры белка.
- Определите типы привлекательных взаимодействий, которые удерживают белки в их наиболее стабильной трехмерной структуре.
- Объясните, что происходит, когда белки денатурируются.
- Определите, как белок может быть денатурирован.
Каждый из тысяч встречающихся в природе белков имеет свой собственный характерный аминокислотный состав и последовательность, что приводит к уникальной трехмерной форме. С 1950-х годов ученые определили аминокислотные последовательности и трехмерную конформацию множества белков и, таким образом, получили важные сведения о том, как каждый белок выполняет свою конкретную функцию в организме.
Белки представляют собой соединения с высокой молярной массой, состоящие в основном или полностью из цепочек аминокислот.Из-за их большой сложности белковые молекулы не могут быть классифицированы на основе определенного структурного сходства, поскольку углеводы и липиды классифицируются. Две основные структурные классификации белков основаны на гораздо более общих качествах: является ли белок (1) волокнообразным и нерастворимым или (2) глобулярным и растворимым. Некоторые белки, например те, из которых состоят волосы, кожа, мышцы и соединительная ткань, похожи на волокна. Эти волокнистые белки нерастворимы в воде и обычно выполняют структурные, соединительные и защитные функции.Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины — это мышечные белки, способные сокращаться и расширяться. Эластины находятся в связках и эластичной ткани стенок артерий.
Глобулярные белки , другой основной класс, растворимы в водной среде. В этих белках цепи сложены так, что молекула в целом имеет примерно сферическую форму.Знакомые примеры включают яичный альбумин из яичных белков и сывороточный альбумин в крови. Сывороточный альбумин играет важную роль в транспортировке жирных кислот и поддержании надлежащего баланса осмотического давления в организме. Гемоглобин и миоглобин, которые важны для связывания кислорода, также являются глобулярными белками.
Уровни структуры белка
Структура белков обычно описывается как имеющая четыре организационных уровня. Первой из них является первичная структура , которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемых пептидными связями, соединяющими каждую аминокислоту со следующей.Первичная структура инсулина, состоящая из 51 аминокислоты, показана на Рисунке 9.1 «Первичная структура человеческого инсулина».
Рисунок 9.1 Первичная структура человеческого инсулина
Человеческий инсулин, аминокислотная последовательность которого показана здесь, представляет собой гормон, необходимый для правильного метаболизма глюкозы.
Белковая молекула — это не случайный клубок полипептидных цепей. Вместо этого цепи расположены в уникальных, но специфических формах. Термин вторичная структура относится к фиксированному расположению полипептидного остова.На основе рентгеновских исследований Линус Полинг и Роберт Кори предположили, что определенные белки или их части скручиваются в спираль или спираль. Эта спираль стабилизируется за счет водородной связи внутри цепи между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты вверх по цепи (расположенным на следующем витке спирали) и известна как правосторонняя α- спираль. Данные рентгеновского излучения показывают, что эта спираль делает один оборот на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из спирального остова (рис.9.2 «Шариковая модель α-спирали»). Α-кератины, содержащиеся в волосах и шерсти, имеют исключительно α-спиральную форму. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, имеют небольшую спиральную структуру или не имеют ее. Другие, такие как гемоглобин и миоглобин, имеют спиралевидную форму в одних областях, но не в других.
Рисунок 9.2 Шарообразная модель α-Helix
Эта шарообразная модель показывает внутрицепочечную водородную связь между карбонильными атомами кислорода и амидными атомами водорода.Каждый виток спирали охватывает 3,6 аминокислот. Обратите внимание, что боковые цепи (представленные зелеными сферами) указывают на спираль.
Другой распространенный тип вторичной структуры, называемый конформацией β-складчатого листа , представляет собой пластинчатую структуру, в которой две или более протяженных полипептидных цепей (или отдельные области на одной цепи) выровнены бок о бок. Выровненные сегменты могут идти параллельно или антипараллельно, то есть N-концы могут быть обращены в одном и том же направлении на соседних цепях или в разных направлениях, и соединены водородными связями между цепями и (Рисунок 9.3 «Шариковая модель структуры β-складчатого листа в белках»). Β-складчатый лист особенно важен для структурных белков, таких как фиброин шелка. Это также наблюдается в частях многих ферментов, таких как карбоксипептидаза А и лизоцим.
Рисунок 9.3 Шариковая модель структуры β-складчатого листа в белках
Боковые цепи проходят над или под листом и чередуются вдоль цепи. Белковые цепи удерживаются вместе за счет межцепочечных водородных связей.
Третичная структура относится к уникальной трехмерной форме белка в целом, которая возникает в результате складывания и изгиба основной цепи белка. Третичная структура тесно связана с правильным биохимическим функционированием белка. Рисунок 9.4 «Ленточная модель трехмерной структуры инсулина» показывает изображение трехмерной структуры инсулина.
Рисунок 9.4 Ленточная модель трехмерной структуры инсулина
Спиральные области представляют участки полипептидной цепи, которые имеют α-спиральную структуру, а широкие стрелки представляют собой β-складчатые листовые структуры.
Четыре основных типа взаимодействий притяжения определяют форму и стабильность третичной структуры белков.
1. Ионная связь . Ионные связи возникают в результате электростатического притяжения между положительно и отрицательно заряженными боковыми цепями аминокислот. Например, взаимное притяжение между ионом карбоксилата аспарагиновой кислоты и ионом лизин-аммония помогает поддерживать конкретную складчатую область белка (часть (а) рисунка 9.5 «Взаимодействие третичной структуры белка»).
2. Водородная связь . Водородная связь образуется между сильно электроотрицательным атомом кислорода или атомом азота и атомом водорода, присоединенным к другому атому кислорода или атому азота, например, таким, которые обнаруживаются в боковых цепях полярных аминокислот. Водородные связи (а также ионное притяжение) чрезвычайно важны как для внутри-, так и для межмолекулярных взаимодействий белков (часть (b) рисунка 9.5 «Взаимодействие с третичной структурой белка»).
3. Дисульфидные связи .Две аминокислотные единицы цистеина могут сближаться, когда молекула белка складывается. Последующее окисление и связывание атомов серы в высокореакционных сульфгидрильных (SH) группах приводит к образованию цистина (часть (c) рисунка 9.5 «Взаимодействия третичной структуры белка»). Внутрицепочечные дисульфидные связи обнаруживаются во многих белках, включая инсулин (желтые столбцы на рис. 9.1 «Первичная структура человеческого инсулина»), и оказывают сильное стабилизирующее действие на третичную структуру.
4. Рассеивающие силы 924 12. Дисперсионные силы возникают, когда обычно неполярный атом становится на мгновение полярным из-за неравномерного распределения электронов, что приводит к мгновенному диполю, который вызывает сдвиг электронов в соседнем неполярном атоме. Дисперсионные силы слабые, но могут быть важны, когда другие типы взаимодействий отсутствуют или минимальны (часть (d) рисунка 9.5 «Взаимодействие с третичной структурой белка»). Так обстоит дело с фиброином, основным белком шелка, в котором большая часть аминокислот в белке имеет неполярные боковые цепи.Термин гидрофобное взаимодействие часто неправильно используется как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды участвуют в водородных связях с другими молекулами воды (или группами в белках, способными образовывать водородные связи). Поскольку неполярные группы не могут участвовать в водородных связях, белок сворачивается таким образом, что эти группы погружаются во внутреннюю часть структуры белка, сводя к минимуму их контакт с водой.
Рисунок 9.5 Взаимодействие третичной структуры белка
Четыре взаимодействия стабилизируют третичную структуру белка: (а) ионная связь, (б) водородная связь, (в) дисульфидные связи и (г) дисперсионные силы.
Если белок содержит более одной полипептидной цепи, каждая цепь называется субъединицей . Расположение множества субъединиц представляет четвертый уровень структуры, четвертичную структуру белка. Гемоглобин с четырьмя полипептидными цепями или субъединицами является наиболее часто цитируемым примером белка, имеющего четвертичную структуру (рис. 9.6 «Четвертичная структура гемоглобина»). Четвертичная структура белка продуцируется и стабилизируется теми же видами взаимодействий, которые производят и поддерживают третичную структуру.Схематическое изображение четырех уровней структуры белка показано на рисунке 9.7 «Уровни структуры в белках».
Рисунок 9.6 Четвертичная структура гемоглобина
Гемоглобин — это белок, который переносит кислород по всему телу.
Источник: Изображение из RCSB PDB (www.pdb.org) PDB ID 1I3D (RD Kidd, HM Baker, AJ Mathews, T. Brittain, EN Baker (2001) Олигомеризация и связывание лигандов в гомотетрамерном гемоглобине: два высоких разрешение кристаллических структур гемоглобина Барта (гамма (4)), маркера альфа-талассемии.Protein Sci. 1739–1749).
Рисунок 9.7 Уровни структуры в белках
Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может скручиваться в α-спираль, которая является одним из типов вторичной структуры . Этот спиральный сегмент включен в третичную структуру свернутой полипептидной цепи. Одиночная полипептидная цепь представляет собой субъединицу, которая составляет четвертичную структуру белка, такого как гемоглобин, который имеет четыре полипептидных цепи.
Денатурация белков
Высокоорганизованные структуры белков — настоящие шедевры химической архитектуры. Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это верно в отношении белков. Денатурация — это термин, используемый для любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурация приравнивается к осаждению или коагуляции белка; наше определение немного шире.) Широкий спектр реагентов и условий, таких как нагревание, органические соединения, изменения pH и ионы тяжелых металлов, могут вызвать денатурацию белка (Таблица 9.1 «Методы денатурации белка»).
Таблица 9.1 Методы денатурации белка
Метод Влияние на структуру белка Нагрев выше 50 ° C или ультрафиолетовое (УФ) излучение Тепло или УФ-излучение снабжает молекулы белков кинетической энергией, заставляя их атомы вибрировать быстрее и разрушая относительно слабые водородные связи и силы дисперсии. Использование органических соединений, таких как этиловый спирт Эти соединения способны участвовать в межмолекулярных водородных связях с молекулами белка, нарушая внутримолекулярные водородные связи внутри белка. Соли ионов тяжелых металлов, таких как ртуть, серебро и свинец Эти ионы образуют прочные связи с карбоксилат-анионами кислых аминокислот или SH-групп цистеина, разрывая ионные связи и дисульфидные связи. Алкалоидные реагенты, такие как дубильная кислота (используется при дублении кожи) Эти реагенты сочетаются с положительно заряженными аминогруппами в белках, разрушая ионные связи. Любой, кто жарил яйцо, заметил денатурацию. Прозрачный яичный белок становится непрозрачным, поскольку альбумин денатурирует и коагулирует. Никто еще не обратил вспять этот процесс. Однако при подходящих обстоятельствах и достаточном времени белок, который развернулся в достаточно мягких условиях, может повторно свернуться и снова проявить биологическую активность (рис.9.8 «Денатурация и ренатурация белка»). Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Кажется, что данная последовательность аминокислот естественным образом принимает свое трехмерное расположение при подходящих условиях.
Рисунок 9.8 Денатурация и ренатурация белка
Изображена денатурация (разворачивание) и ренатурация (рефолдинг) белка. Красные прямоугольники представляют собой стабилизирующие взаимодействия, такие как дисульфидные связи, водородные связи и / или ионные связи.
Первичные структуры белков довольно прочны. Как правило, для гидролиза пептидных связей необходимы довольно жесткие условия. Однако на вторичном и четвертичном уровнях белки весьма уязвимы для атак, хотя их уязвимость к денатурации различается. Изящно свернутые глобулярные белки денатурировать намного легче, чем жесткие волокнистые белки волос и кожи.
Упражнения по обзору концепции
Какая преобладающая сила притяжения стабилизирует образование вторичной структуры в белках?
Различают третичный и четвертичный уровни белковой структуры.
Кратко опишите четыре способа денатурирования белка.
ответов
Третичная структура относится к уникальной трехмерной форме одной полипептидной цепи, в то время как четвертичная структура описывает взаимодействие между несколькими полипептидными цепями для белков, которые имеют более одной полипептидной цепи.
(1) нагревать белок выше 50 ° C или подвергать его УФ-излучению; (2) добавить к раствору белка органические растворители, такие как этиловый спирт; (3) добавить соли ионов тяжелых металлов, таких как ртуть, серебро или свинец; и (4) добавить алкалоидные реагенты, такие как дубильная кислота
Ключевые выводы
- Белки можно разделить на две категории: волокнистые, которые обычно нерастворимы в воде, и глобулярные, которые лучше растворяются в воде.
- Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.
- Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионные связи, водородные связи, дисульфидные связи и дисперсионные силы.
- Широкий спектр реагентов и условий может вызвать разворачивание или денатурирование белка.
Упражнения
1. Классифицируйте каждый белок как волокнистый или глобулярный.
а. альбумин
г. миозин
г. фиброин
2.Классифицируйте каждый белок как волокнистый или глобулярный.
а. гемоглобин
г. кератин
г. миоглобин
3. Как называется преобладающая вторичная структура шелка?
4. Как называется преобладающая вторичная структура белка шерсти?
5. Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот.Для каждой пары определите наиболее сильный тип взаимодействия между этими аминокислотами.
а. аспарагиновая кислота и лизин
г. фенилаланин и аланин
г. серин и лизин
г. два цистеина
6. Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот. Для каждой пары определите наиболее сильный тип взаимодействия между этими аминокислотами.
а. валин и изолейцин
г.аспарагин и серин
г. глутаминовая кислота и аргинин
г.
