Конспект урока по Химии «Кислород» 9 класс
Тема урока: «Кислород»
Цель урока: использовать практико-ориентированный подход с целью создания оптимальных условий для мотивации познавательной деятельности обучающихся.
Задачи урока:
образовательная
Дать характеристику химическому элементу кислороду, исходя из его положения в периодической системе Д.И.Менделеева; рассмотреть состав и строение простого вещества кислорода, физические и химические свойства, способы получения и области применения; закрепить имеющиеся знания об аллотропных модификациях кислорода, методах сбора и доказательств наличия кислорода.
воспитательная
Содействовать формированию научного мировоззрения, познаваемости мира.
развивающая
Способствовать развитию умения выделять главное в изучаемом материале, развитию умения логически мыслить, анализируя, сравнивая, делая выводы; способствовать развитию самостоятельности школьников, а также развитию познавательного интереса и коммуникативных качеств.
Тип урока: по дидактической цели — изучение нового материала,
по способу организации — комбинированный.
Оборудование :
1) ЛСМ “Химический элемент”, периодическая система химических элементов Д.И.Менделеева, карточки, снимок поверхности Земли.
2) оборудование для эксперимента: стакан химический, раствор перекиси водорода, оксид марганца (IV), ложечка, лучина, спиртовка, спички.
Информационные истиочники:
Воскобойникова Н.П., Галыгина И.В., Галыгина Л.В. К вопросу о педагогических технологиях и системах обучения //Химия в школе. – 2002 — №2. — С. 16-20.
Габриелян О.С., Остроумов И.Г. Изучаем химию в 9 классе: дидактическое пособие к учебнику О.С.Габриеляна «Химия-9» для учащихся и учителей общеобразовательных учебных заведений – М.: «БЛИК и К0», 2003. — С. 140 – 143.
Габриелян О.
 С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002. — С. 151 – 158.
С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002. — С. 151 – 158.Лисицын О. Г. Роль зелёных насаждений в создании оптимальной городской среды [Электронный ресурс]: реферат О. Г. Лисицын – Электрон. дан. – Режим доступа: http://5ka.ru/97/32427/1.html– Заглавие с экрана.
Полезная химия: задачи и истории / Л.Ю. Аликберова, Н.С. Рук. – М.: Дрофа, 2005.
Я познаю мир: Детская энциклопедия: Химия / Авт.-сост. Л.А. Савина. – М.: ООО «Фирма «Издательство АСТ», 1999.
Ход урока
Вводное слово учителя
Сегодня мы с вами будем говорить о веществе, которое можно охарактеризовать так: вездесущий, всемогущий, невидимый. На первый взгляд может показаться, что его вообще не существует, однако это вещество есть, мало того, без него человечество попросту задохнулось бы.
Учащимся предлагается предположить, о каком веществе и химическом элементе пойдет речь и определиться с задачами урока.
Восстановление опорных знаний
Используя логико-смысловую модель (приложение 1), учащимся предлагается дать характеристику химическому элементу кислороду (фронтальная работа).
Формирование знаний, умений, навыков
Перед началом урока учитель разбивает учащихся на 7 групп, каждая из которых получает задание, которое должна выполнить в течение 10 минут. Два человека работают в течение этого времени по карточкам самостоятельно у доски. Выкладки, необходимые для ответа, учащиеся, работающие в группах, выносят на интерактивную доску.
Карточка 1
Составьте уравнения химических реакций, если известно, что по каждой из них выделяется кислород.
t
KMnO4 = K2MnO4 + MnO2 + …
t
KClO3 = …
эл. ток
ток
H2O = …
свет
H2O2 =…
Карточка 2
Составьте уравнения химических реакций:
Mg + O2 =
P + O2 =
S + O2 =
Na + O2 =
Cu + O2 =
Задание для 1 группы
Используя материал параграфа, расскажите о нахождении кислорода в природе.
Какова объемная и массовая доли кислорода в воздухе?
Изучите снимок участка поверхности Земли, сделанный со спутника (приложение 2).
Рассчитайте, сколько кислорода мог бы выделить сгоревший участок лесного массива в течение года, если известно, что за один теплый солнечный день 1 гектар леса выделяет 180-200 кг кислорода.
Задание для 2 группы
Расскажите о составе и строении простого вещества кислорода по плану:
2. Какие аллотропные модификации кислорода вам известны? Каковы их формулы и значение?
Задание для 3 группы
Используя материал учебника и детской энциклопедии «Я познаю мир», ответьте на приведенные вопросы.
Кислород получали многие химики, не зная, правда, что это за газ. За кем же закрепили приоритет его открытия?
Каким годом датируется открытие кислорода?
Кто из выдающихся химиков дал название элементу кислороду; что оно означает?
Составьте уравнения реакций, на основе которых он, как считается, впервые был получен.
Задание для 4 группы
Используя материал учебника и справочных пособий, дайте ответ на поставленные вопросы.
1. Охарактеризуйте физические свойства кислорода по плану:
Как доказать наличие кислорода в сосуде?
Как следует держать пробирку при сборе кислорода? Ответ поясните.
Почему кислород можно собирать как методом вытеснения воздуха, так и методом вытеснения воды?
Задание для 5 группы
Используя материал учебника, дайте ответ на поставленные вопросы.
Какие реакции называются реакциями горения?
К какому типу реакций (по тепловому эффекту) следует отнести реакции горения?
Чем реакция горения отличается от процесса окисления?
Составьте уравнения реакций горения:
CH4 + O2 = …
… + O2 = H2O + P2O5
Задание для 6 группы
Расскажите о круговороте кислорода в природе.

Откуда появляется кислород в атмосфере Земли?
Что вам известно о процессе фотосинтеза?
Почему концентрация кислорода не уменьшается из-за расходования в процессе дыхания и горения?
Растения суши и Мирового океана ежегодно выделяют 320 млрд. тонн газообразного кислорода с избытком восполняя расход этого газа в промышленности, энергетике и на транспорте. Рассчитайте, сколько молекул кислорода ежегодно выделяет зеленая растительность?
Задание для 7 группы
Используя материал учебника, подготовьте сообщение об областях применения кислорода.
Кислород, используемый на подводных лодках и космических кораблях для обеспечения жизни экипажа, получают по реакции пероксида калия (K2O2) с углекислым газом, накапливающимся в воздухе в результате дыхания.
 При этом помимо кислорода образуется карбонат калия. Составьте уравнения данной химической реакции.
При этом помимо кислорода образуется карбонат калия. Составьте уравнения данной химической реакции.
Учащиеся поочередно отчитываются о проделанной работе. После отчета учащихся 3 группы учителем обращается внимание на задание карточки 1, выполненное на доске, которое характеризует и другие способы получения кислорода. После отчета учащихся 4 группы учитель предлагает выполнить лабораторную работу по получению кислорода из пероксида водорода и доказать его наличие в сосуде. Затем рассматривается задание карточки 2, которая фактически характеризует химические свойства кислорода: взаимодействие с простыми веществами; заслушиваются ответы учащихся 5,6,7 групп.
Формирование способов умственных и практических действий с новыми знаниями
В конце урока учащимся можно предложить выполнить тест обучающего характера.
Вариант 1
1. Относительная молекулярная масса кислорода равна:
а) 16, б) 32, в) 48
2. Кислород обладает следующими свойствами:
Кислород обладает следующими свойствами:
а) легче воздуха,
б) плохо растворим в воде,
в) поддерживает дыхание,
г) не поддерживает горение.
3. Оксидами являются:
а) НgО,
б) НСl,
в) HNО3 ,
г) О2 ,
д) Аl2О3
4. При взаимодействии калия и кислорода образуется вещество состава:
а) КО2 , б) КО, в) К2О.
5. Кислород выделяется в результате процесса:
а) брожения фруктовых соков
б) гниения отмерших частей растений,
в) фотосинтеза,
г) дыхания человека и животных
Вариант 2
1. Название химическому элементу кислороду дал:
а) Дальтон, б) Лавуазье, в) Шееле .
2. Кислород обладает следующими свойствами:
а) тяжелее воздуха,
б) хорошо растворим в воде,
в) не поддерживает дыхание,
г) поддерживает горение.
3.Оксидами являются:
а) Н2О,
б) РН3 ,
в) Н2SО4 ,
г) Cl2О7 ,
д) О2
4. При взаимодействии магния и кислорода образуется вещество состава:
а) MgО2 , б) MgО, в) Mg2О.
5. Кислород в лаборатории можно собрать методом:
а) вытеснения воздуха,
б) методом вытеснения воды,
в) обоими перечисленными методами,
г) ни одним из этих методов.
Подведение итогов урока
Домашнее задание: §20, упр. 8 стр. 96
8 стр. 96
Опорные конспекты по химии (9 класс) – УчМет
МКОУ Тополинская СОШ
ОПРОНЫЕ КОНСПЕКТЫ
ПО ХИМИИ
8 КЛАСС
Составитель
Сумцова О.В.
Учитель информатики-химии
2011г.
Электролитическая диссоциация.
Процесс распада электролита на ионы при растворении его в воде или расплавлении называют электролитической диссоциацией.
Особенно осторожно необходимо растворять серную кислоту, так как из-за повышения температуры часть воды может превратиться в пар и под его давлением выбросить кислоту из сосуда. Чтобы этого избежать, серную кислоту тонкой струей наливают в воду (но не наоборот) при постоянном помешивании.
Растворение
– это физико-химический процесс.
Гидратация – это присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют гидратами.
Кристаллические вещества, в состав которых входит связанная вода, называют кристаллогидратами. Воду входящую в состав кристаллов, называют кристаллизационной водой.
Основные положения теории электролитической диссоциации были сформулированы в 1887 году шведским ученым С.Аррениусом. в настоящее время их можно сформулировать следующим образом:
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы. Ионы – это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам.
В растворе и расплаве электролита ионы движутся хаотично. При пропускании постоянного электрического тока через этот раствор или расплав положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные иона (анионы) – к аноду.

Диссоциация кислот, оснований и солей.
Кислотой называется вещество, которое при взаимодействии с водой (при растворении в воде) образует ионы оксония Н3О+ (или, упрощая, ионы водорода Н+)
СИЛЬНЫЕ: HNO3, H2SO4, HI, HBr, HCl, H3PO4
СЛАБЫЕ: H2SO3, CH3COOH, H2CO3, H2S
МАЛОДИССОЦИИРУЮЩИЕ ИЛИ ОЧЕНЬ СЛАБЫЕ: H2SiO3
Формулы кислот | Специфический реагент | Образующиеся соединения и внешние эффекты |
H2SO4 | Ион Ba2+(соли, щелочь) | BaSO4 белый осадок |
HCl | Ион Ag+(соли серебра) | AgCl белый творожистый осадок |
H2CO3 | Известковая вода Ca(OH)2 | CaCO3 , помутнение прозрачного раствора известковой воды |
HNO3 | Cu в присутствии H2SO4 | Выделение бурого газа NO2 |
Химические
свойства кислот обеспечиваются ионами
водорода, в некоторых реакциях участвуют
анионы кислотных остатков( такие реакции
специфичны для каждой кислоты и называются
качественными).
Основания – это сложные вещества, при диссоциации которых в водных растворах в качестве анионов в водных растворах в качестве анионов отщепляются гидроксид-ионы.
Соли – это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
Кислые соли – это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и водорода и анионы кислотных остатков.
Алгоритм составления
полных и сокращенных ионных уравнений реакций.
1. Напишите уравнение диссоциации электронов, вступающих в реакцию (обратите внимание на запись обозначения зарядов ионов).
2. Отметьте, при соединении каких ионов могут образовываться малодиссоциирующие соединения, и расставьте коэффициенты (если нужно).
3.
Напишите формулу малодиссоциирующего
вещества и обозначения ионов, не
участвующих в реакции, в правой части
уравнения.
4. Внимательно проверьте написанное! Сумма положительно заряженных ионов в левой и правой частях уравнения реакции должна равняться нулю.
5. Допишите знак равенства.
6. Напишите сокращенное ионное уравнение реакции, отражающее суть реакции ионного обмена (образование малодиссоциирующих веществ). Учтите, что вначале пишут катион, а потом анион.
Окислительно-восстановительные реакции
Реакции, которые протекают с изменением степеней окисления элементов, называют окислительно-восстановительными.
При составлением уравнений окислительно-восстановительных реакций пользуются следующим алгоритмом.
Пишем формулы реагирующих веществ, ставим стрелку, а за ней пишем формулы веществ, которые образуются при данной реакции.
Проставляем степень окисления над знаками элементов, у которых она меняется.
Выписываем химические знаки элементов, атомы или ионы которых меняют степень окисления.

Находим, сколько электронов отдают или принимают соответствующие атомы или ионы.
Находим наименьшее общее кратное чисел отданных и присоединенных электронов (их число должно быть одинаково)
Найденные коэффициенты ставим перед соответствующими формулами в правой части уравнения.
Соответственно найденным коэффициентам в правой части уравнения находим коэффициенты для формул всех остальных веществ.
Проверяем, соответствует ли число атомов всех элементов в левой части уравнения числу атомов в правой части уравнения.
С водой не реагируют соли, образованные сильным основанием и сильной кислотой, так как ионы таких солей не могут связываться с ионами Н+ и ОН—.
С
водой реагируют соли, образованные
или слабым основанием и сильной кислотой,
или сильным основанием и слабой кислотой.
Гидролиз соли – это взаимодействие ионов соли с водой с образованием малодиссоциирующих электролитов.
Соли, образованные слабой кислотой и слабым основанием, в водном растворе не существуют, потому что они или выпадают в осадок, или разлагаются водой.
Гидролиз соли – это обратимая реакция. Гидролиз усиливается при нагревании и сильном разбавлении раствора.
Кислород и сера.
Явление, когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией. Простые вещества, образованные одним и тем же химическим элементом, называют аллотопными видоизменениями этого элемента.
Химические свойства серы.
Окислительные свойства | Восстановительные свойства |
|
|
Сероводород.
Сероводород – бесцветный газ, тяжелее воздуха, с неприятным запахом тухлых яиц. Сероводород очень ядовит. Уже 0,1% объема сероводорода в воздухе вызывает тяжелые отравления. Однако в малых количествах сероводород полезен: при некоторых заболеваниях в медицине используют сероводородные ванны.
Сероводород
образуется при разложении без доступа
воздуха многих природных органических
веществ, содержится в вулканических
газах, в воде минеральных источников.
Все опыты с сероводородом нужно проводить в вытяжном шкафу!
Сероводород легко можно получить в лаборатории действием разбавленной серной кислоты на сульфид железа (II):
FeS +H
Эта реакция проводится в аппарате Киппа, который используют для получения водорода.
Сероводород горит на воздухе голубым пламенем, при этом образуется сернистый газ, или оксид серы (IV):
2H2S + 3O2 = 2H2O +2SO2
При недостатке кислорода образуются пары воды и сера:
2H2S + O2 = 2H2O +2S
Сероводород обладает свойствами восстановителя. Если в пробирку с небольшим количеством сероводородной воды прилить бромную воду, то раствор обесцвечивается. На поверхности раствора появляется сера:
H2S + Br2 = 2HBr +S
Сероводород
малорастворим в воде. При 20° в одном
объеме воды растворяется 2,4 объема
сероводорода. Водный раствор сероводорода
проявляет свойства слабой кислоты:
При 20° в одном
объеме воды растворяется 2,4 объема
сероводорода. Водный раствор сероводорода
проявляет свойства слабой кислоты:
H2S ↔HS— + H+
HS—↔ S2- + H+
Сероводородная кислота вступает со щелочами в реакцию нейтрализации:
H2S + NaOH = NaHS + H2O
избыток
H2S + 2NaOH = Na2S + 2H2O
избыток
Средние соли сероводородной кислоты называют сульфидами, а кислые – гидросульфидами. В воде растворимы сульфиды щелочных металлов и большинство гидросульфидов.
Сернистый газ. Сернистая кислота.
При
горении серы на воздухе образуется
сернистый газ, или оксид серы (IV)
SO2.
Это бесцветный газ с резким характерным
запахом, более чем в 2 раза тяжелее
воздуха, хорошо растворяется в воде,
ядовит.
SO2кислотный оксид.
H2O + SO2 ↔ H2SO3 реакция обратимая.
Сернистая кислота – неустойчивое соединение, легко распадается на оксид серы (IV) и воду. Эта кислота средней силы. Она образует два ряда солей: средние – сульфиты и кислые гидросульфиты.
Качественной реакцией на сульфиты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом.
Сернистый газ как кислотный оксид взаимодействует с щелочами и основными оксидами.
Серная кислота (разбавленная)
Химическая формула H2SO4
Структурная формула
О
│
HO – S – OH
│
О
Уравнение диссоциации
H2SO4 = 2H+ + SO42-сильный электролит
Правила техники безопасности при приготовлении раствора серной кислоты
Кислоту
нужно небольшими порциями вливать в
воду.
Химические свойства
Me (в ряду активности до Н2)
MeSO4 + H2↑
MeO
MeSO4 + H2O
MeOH
H2SO4 + MeSO4 + H2O
(разб.) MeR (в случае ↑ или ↓)
MeSO4 + HR
BaR (качественная реакция)
Белый осадок BaSO4↓ + HR
Производство серной кислоты:
FeS2 → SO2 → SO3 → H2SO4
Скорость
химических реакций. Химическое равновесие.
Химическое равновесие.
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени.
Условия, влияющие на скорость химических реакций.
Скорость химических реакций зависит от природы реагирующих веществ.
Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.
Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2-4 раза.
Скорость химических реакций зависит от присутствия некоторых веществ. (катализаторов, ингибиторов).
Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами.
Вещества,
которые замедляют скорость химических
реакций, называют ингибиторами.
Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном, — называю обратимыми реакциями.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Принцип Ле Шателье: при изменении внешних условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это внешнее воздействие.
При повышении температуры равновесие смещается в сторону эндотермического процесса.
При повышении давления равновесие смещается в сторону меньшего объема.
При увеличении концентрации одного из исходных веществ равновесие смещается в сторону образования новых веществ.
При увеличении концентрации продукта реакции равновесие смещается в сторону исходных вещества.
Катализаторы
не влияют на смещение химического
равновесия, они способствуют более
быстрому достижению равновесия.
Азот.
Молекула азота – N2, структурная формула N Ξ N, электронная формула :N: :N:
В молекуле азота одна σ-связь и две π-связи.
Азот находится в воздухе в свободном виде – 78% по объему.
Физические свойства. Азот – газ без цвета и запаха, немного легче воздуха. Растворимость его в воде незначительна. Азот в твердом состоянии имеет молекулярную кристаллическую решетку, поэтому у него низкие температуры плавления и кипения.
Химические свойства. При обычных условиях азот малоактивен
Аммиак.
Молекулярная формула – NH3
Физические свойства – бесцветный газ с характерным резким запахом, почти в два раза легче воздуха, очень хорошо растворим в воде. При повышении давления аммиак сжижается. Жидкий аммиак имеет большую теплоту испарения, поэтому его применяют в холодильных устройствах.
Химические
свойства.
При нагревании разлагается:
2NH3 ↔ N2 + 3H2
Горит в кислороде:
4NH3 + 3O2 → 2N2 + 6H2O
В присутствии катализатора (сплав платины и родия) окисляется кислородом воздуха
4NH3 + 5O2 → 4NO + 6H2O
Реагирует с водой
NH3 + H2O→ NH4+ + OH—
Реагирует с кислотами, образуя нормальные и кислые соли
NH3 + HCl→ NH4Cl
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Соли аммония.
Физические свойства. Все соли аммония – твердые кристаллические вещества, хорошо растворимы в воде.
Химические свойства.
Сильные электролиты, диссоциируют на ионы
NH4R → NH4+ + R
Реагируют с кислотами
NH4R + HR1 → NH4R1+ HR
Реагируют с другими солями
NH4R + MeR1 → NH4R1 + MeR
Подвергаются гидролизу
При комнатной температуре разлагаются
NH4R → NH3↑ + HR
Реагируют со щелочами
NH4R + MeOH → MeR + NH3↑ + H2O
Оксиды азота.
Признаки | N2O | NO | NO2 | N2O3 | N2O5 |
Агрегатное состояние | Газ | Жидкость | Твердое вещество | ||
Цвет | Бесцветный | Бурый | Темно синяя | Белое | |
Токсичность для организма | — | + | |||
Отношение к воде | Малорастворим | Химически взаимодействует | |||
Кислотно-основные свойства | Восстановительные | Окисли-тельно восстано-вительные | Окислительные | ||
Особые свойства | Разлагается | Окисляется кислородом, восстанав-ливается водородом | + Н и МеОН | Разлагается | |
Получение | Из NH4NO3 | Окислением
N2,
NH3,
из HNO3 (разб. | Из HNO3 (конц.) и, Cu окислением NO | Из NO2 и NO | Обезво-живани-ем HNO3, окис-лением NO2 |
Применение | Медицина | Замедление цепных реакций, получение NO2 | Производство HNO3 | Промышленного значения не имеет | |
Азотная кислота.
Физические
свойства. Чистая азотная кислота –
бесцветная дымящаяся жидкость с резким,
раздражающим запахом. Концентрированная
азотная кислота обычно окрашена в желтый
цвет.
Химические свойства.
Me
MeNO3 + (различные оксиды азота, азот, аммиак)
MeO
MeNO3 + H2O
MeOH
HNO3 + MeNO3 + H2O
(разб.) MeR (более слабых кислот)
MeNO3 + HR
Белок (качественная реакция)
Вещество ярко-желтого цвета.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Cu0 – 2e— → Cu+2 1
N+5 + e— → N+4 2
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu0 – 2e— → Cu+2 3
N+5 +3e— → N+4 2
Производство азотной кислоты: NH3 → NO→ NO2 → HNO3
Соли
азотной кислоты.
Соли азотной кислоты называют нитратами.
Нитраты образуются при взаимодействии: 1) металлов основных оксидов, оснований, аммиака и некоторых солей с азотной кислотой; 2) оксида азота (IV) со щелочами.
Физические свойства. Все нитраты – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства.
Me находится левее Mg MeNO2 + O2↑
MeNO3 t Me находится между Mg и Cu MeO + NO2↑ + O2↑
Me находится правее Cu Me + NO2↑ + O2↑
t
NH4NO3 → N2O↑ + 2H2O
Для
качественного определения нитрат ионов
в пробирку помещают исследуемое вещество,
добавляют медных стружек, приливают
концентрированную азотную кислоту и
нагревают. Выделение газообразного
оксида азота (IV) бурого
цвета свидетельствует о наличии
нитрат-ионов NO3—.
Выделение газообразного
оксида азота (IV) бурого
цвета свидетельствует о наличии
нитрат-ионов NO3—.
Фосфор.
В свободном состоянии фосфор образует несколько аллотропных видоизменений: красный, белый и черный фосфор. а – молекулы белого фосфора, б – кристаллическая решетка черного фосфора, в – кристаллическая решетка красного фосфора.
Из-за большой активности фосфор в природе встречается только в соединениях.
Фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Физические свойства.
Белый
фосфор. Кристаллическое вещество,
можно резать ножом (под водой). Бесцветный
с желтоватым оттенком. Имеет чесночный
запах. Плотность 1,8г/см3. В воде не
растворяется. Хорошо растворяется в
сероуглероде. Температура плавления.
44°С. Температура воспламенения 40°С. В
измельченном состоянии воспламеняется
при обычной температуре. В темноте
светится. Сильный яд.
В темноте
светится. Сильный яд.
Красный фосфор. Аморфное или кристаллическое вещество. Темно-красного цвета. Без запаха. Плотность 2,3г/см3. В воде и сероводороде не растворяется. При сильном нагревании превращается в пары белого фосфора. Температура воспламенения примерно 260°С. Не светится, не ядовит.
Химические свойства.
O2 → P2O5
Р + H2 → PH3
Me → MeP
Оксид фосфора (V).
Физические свойства. Оксид фосфора (V) = белый рыхлый порошок, чрезвычайно гигроскопичный. Поэтому его следует хранить в герметически закрытых сосудах.
Химические свойства. По химическим свойствам сходен с другими кислотными оксидами.
t
P2O5 + H2O → 2HPO3 P2O5 + H2O → 2H3PO4
Ортофосфорная
кислота и ее соли.
Физические свойства. Твердое кристаллическое вещество, бесцветное, хорошо растворимое в воде.
Химические свойства.
Водный раствор кислоты изменяет окраску индикатора. Диссоциация происходит ступенчато.
H3PO4 ↔ H+ + H2PO4— H2PO4 ↔ H+ + HPO4— HPO4 ↔ H+ + PO4—
Me
MeРO4 + Н2↑
MeO
MeРO4 + H2O
MeOH
H3PO4 + MeРO4 + H2O
MeR (более слабых кислот)
MeРO4 + HR
AgNO3 (качественная реакция)
Желтый
осадок.
При нагревании постепенно превращается в метафосфорную кислоту.
2H3PO4 → H4P2O7 (дифосфорная кислота) + H2O
H4P2O7 → 2HPO3 (метафосфорная кислота) + H2O
Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ.
При разложении АТФ выделяется большое количество энергии.
Ортофосфаты.
Ортофосфорная кислота образует три ряда солей.
MeРO4 – ортофосфаты
MeНРO4 – гидроортофосфаиы
Me Н2РO4 – дигидроортофосфаты
Вместо иона одновпалентного металла в состав ортофосфатов может входить ион аммония:
(NH4)3PO4 — ортофосфат аммония,
(NH4)2 HPO4 — гидроортофосфат аммония,
NH4H2PO4 — дигидроортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используются в качестве удобрений, ортофосфат и гидроортофосфат натрия – для осаждения из воды солей кальция.
Конспект урока по химии для 9 класса на тему: «Фосфор»
МБОУ Пролетарская СОШ №5
Учитель: Волошина Г.В.
Класс: 9
Тема урока: Фосфор
Цель урока: создать условия для проявления познавательной активности учеников и усвоения ими знаний по теме: «Фосфор».
Задачи:
Образовательные:
— рассмотреть строение атома фосфора согласно его положению в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации фосфора;
— изучить физические и химические свойства фосфора, нахождение в природе, его области применения;
— способствовать осмыслению учащимися роли фосфора на земле и в жизни человека.
Развивающие:
-продолжить развивать УУД, продолжить формировать умения записывать уравнения химических реакций, давать названия полученным веществам, составлять ОВР;
— способствовать формированию материалистического мировоззрения,
— развивать понятие о взаимосвязи между строением и свойствами веществ;
— умение выделять общие и существенные признаки и свойства;
— умение увидеть проблему и найти пути её решения;
— умение применять полученные знания на практике.
Воспитательные:
— продолжить формирование коммуникативной компетенции у учащихся;
— показать значимость химических знаний для повседневной жизни современного человека,
— уважительное отношение к историческим фактам.
Средства обучения:
Реактивы и оборудование – красный фосфор, пробирка, держатель, спиртовка, спички, стеклянная палочка, вата, колба с кислородом, железная ложечка, стакан с водой.
Мультимедийный проектор, компьютер, мультимедийная доска, презентация Flipchart .
Раздаточный материал: таблица “Физические свойства белого, красного и черного фосфора”, тест по теме: «Фосфор», задания для групп.
Ход урока
В классе парты расставлены для работы в группах. Всем учащимся на перемене предлагается распределиться на группы, согласно их интересам. Предлагаются 4 группы: историки, биологи, химики и журналисты.
Постановка целей и задач урока
Беседа:
— Ребята, что мы с вами изучали на предыдущих уроках? (Характеристику V группы главной подгруппы, азот и его соединения).
— Как вы думаете, какой элемент мы будем изучать с вами сегодня? Почему? (Фосфор, т.к. он тоже находится в 5 группе главной подгруппе).
— А что вы хотели бы про него узнать? (Строение атома, физические, химические свойства, нахождение в природе, применение, значение для человека, в каких продуктах находится).
— Вот вы сами сформулировали цели и задачи сегодняшнего урока.
Демонстрация слайда № 1
Мотивация учащихся
— Ребята, откройте учебник стр. 232.
Учитель зачитывает отрывок из романа А.Конан-Дойла “Собака Баскервилей”. (Из учебника «Химия 9 класс»)
Демонстрация слайда № 2
“…Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана. .. Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
.. Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
— Из какого произведения этот отрывок?
— Могло ли быть такое в действительности, прав ли был А. Конан-Дойл? Выясним сегодня на уроке.
Актуализация знаний
— Ребята, я предлагаю вам выполнить небольшой тест по данной теме. В нем есть некоторые сведения, которые вам уже знакомы из уроков биологии, истории, повседневной жизни.
Тест по теме: «Фосфор»
1. Из чего впервые получили фосфор?
а) из фосфоритов б) из слюны в) из мочи
2. От чего скончалась герцогиня Матильда?
а) наступила на спичку, загорелась и получила ожоги
б) не соблюдала правила по технике безопасности при поджигании спичек
в) съела спички и отравилась
3. Какое соединение фосфора пахнет тухлой рыбой?
Какое соединение фосфора пахнет тухлой рыбой?
а) РН3 б) Р2О5 в)Н3РО4
4. В организме человека массой 70 кг
а) содержится 2 кг фосфора
б) содержится 780 г фосфора
в) фосфор не содержится
5. Какие продукты питания содержат большое количество фосфора
а) рыба, фасоль, хлеб, молоко
б) апельсины, мандарины, лимоны
в) пастила, сухофрукты, орехи
6. Ежедневная потребность человеческого организма в фосфоре составляет
а) 5 г б) 2 г в) 1,2 г
— У вас возникли вопросы при выполнении теста? (Да).
— Я предлагает отложить тест на край стола и вернуться к нему в конце урока. Если вы будете внимательно слушать, то к концу урока найдете все ответы на интересующие вас вопросы?
Изучение нового материала
1. История открытия фосфора
Рассказ ученика (опережающее домашнее задание).
Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что первооткрывателем фосфора был арабский алхимик Альхильд Бехиль (XII век), перегонявший мочу с глиной, известью и углем.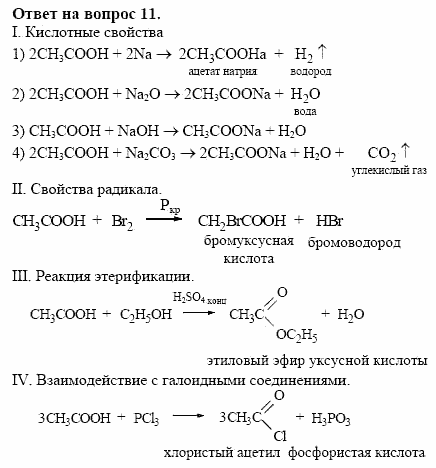 Но все же годом открытия фосфора считается 1669-й.
Но все же годом открытия фосфора считается 1669-й.
Демонстрация слайда № 3 № 4
Гамбургский отставной солдат, алхимик-любитель и разорившийся купец Хеннинг Бранд, хотел с помощью алхимии поправить свои дела и в поисках “философского камня”, который якобы способен превращать неблагородные металлы в золото проводил опыты с разными веществами. Бранд провел уже множество опытов с различными веществами, но ничего дельного у него не получалось. Однажды он решил провести химический эксперимент с мочой. Выпарил ее почти досуха и оставшийся светло-желтый осадок смешал с углем и песком, нагревая в реторте без доступа воздуха. В результате Бранд получил новое вещество, которое обладало удивительным свойством-светиться в темноте. Бранд назвал его фосфором, что в переводе с греческого означает “светоносец”. Способ получения фосфора он держал в секрете. Счастливый ученый не замедлил воспользоваться необычным свойством нового вещества и стал демонстрировать светящийся фосфор знатным особам за довольно высокое вознаграждение. Религиозно и мистически настроенные богатые люди того времени диву давались, смотря на различные манипуляции Бранда с этим «божественным» веществом. Он ловко использовал огромный интерес ученых и широкой публики к фосфору и стал продавать его по цене, превосходившей даже стоимость золота.
Религиозно и мистически настроенные богатые люди того времени диву давались, смотря на различные манипуляции Бранда с этим «божественным» веществом. Он ловко использовал огромный интерес ученых и широкой публики к фосфору и стал продавать его по цене, превосходившей даже стоимость золота.
В третий раз фосфор открыл Р.Бойль в 1680 году. Бойль опять таки самостоятельно получил фосфор из мочи. Через Бойля этот способ и получил всеобщую известность.
2. Фосфор как химический элемент.
Беседа:
— Каково положение фосфора в периодической системе химических элементов Д.И.Менделеева?
— Составьте схему строения атома фосфора, сделайте вывод о проявлении свойств.
— Определите возможные степени окисления фосфора в соединениях.
— Составьте формулу летучего водородного соединения и высшего оксида, расставьте степени окисления. Каков характер оксида?
(Один ученик у доски расписывает строение атома и отвечает на вопросы).
3. Аллотропные видоизменения фосфора.
— Необычное светящееся вещество, полученное Брандом, — белый фосфор. Кроме белого, есть еще красный фосфор и черный фосфор. Как называется явление существования нескольких простых веществ, образованных одним химическим элементом? (Аллотропия).
Демонстрация слайда №5
Молекула белого фосфора состоит из четырех атомов, построенных в форме тетраэдра. Имеет молекулярную кристаллическую решетку. Красный фосфор имеет атомную кристаллическую решетку с довольно сложным строением. Существует еще чёрный фосфор — полимерное вещество с металлическим блеском, похожее на графит, без запаха, жирное на ощупь. Не растворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник.
— Как вы думаете, можно ли из одного аллотропного видоизменения фосфора получить другое?
— Давайте попробуем осуществить это на практике. Для этого у вас на столе есть все необходимое. Соблюдайте правила по технике безопасности.
Лабораторный опыт.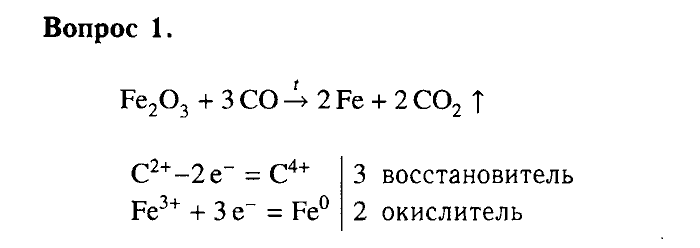 Получение белого фосфора из красного.
Получение белого фосфора из красного.
Красный фосфор (количество – с полгорошины) поместить в пробирку, вставить стеклянную палочку, закрыть тампоном, нагреть. Образуется белый дым оксида фосфора, затем – желтоватые капли белого фосфора. Извлечь стеклянную палочку, белый фосфор самовозгорается.
— Какова температура воспламенения белого фосфора? (44 градуса).
— Прав ли был А.Конан-Дойл в описании собаки Баскервилей? Почему? (Не прав. Этого не могло быть. Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическими веществами, в частности, шерстью. Поэтому собака Баскервилей не могла быть намазана белым фосфором).
— Каково физиологическое действие белого фосфора?
Доза фосфора в 0,05–0,15 г для человека смертельна. Профессиональным заболеванием рабочих первых спичечных фабрик был фосфорный некроз – поражение челюстей.
Белый фосфор не только является сильным ядом, при попадании на кожу вызывает долго не заживающие ожоги.
4. Физические свойства фосфора.
— Давайте более подробно познакомимся с физическими свойствами аллотропных видоизменений фосфора. Сравните физические свойства белого, красного, черного фосфора. (Самостоятельная работа учащихся с таблицей).
Таблица “Физические свойства белого, красного и черного фосфора”
Белый фосфор | Красный фосфор | Чёрный фосфор |
Твёрдое кристаллическое вещество, плотность 1,83г/см3. В чистом виде совершенно бесцветен и прозрачен; продажный продукт окрашен в желтоватый цвет и по внешнему виду очень похож на воск. На холоду хрупок, но при температуре свыше 150С становиться мягким и легко режется ножом. Плавится при t=44,10С, а при t=2750С начинает кипеть. Молекула фосфора в парах при температурах ниже 8000С состоит из 4-х атомов (Р4) и имеет молекулярную кристаллическую решетку. | Красный фосфор по свойствам резко отличается от белого, он очень медленно окисляется на воздухе, не светится в темноте, загорается только при 2600С, не растворяется в сероуглероде и не ядовит. Плотность фосфора красного равна 2,20 г/см3.. .Имеет атомную кристаллическую решетку. | Чёрный по виду очень похож на графит, жирен на ощупь, хорошо проводит электрический ток и значительно тяжелее других видоизменений фосфора. |
— Сходны или различны свойства белого и красного фосфора? (Различные).
— Чем объясняются различия в свойствах? (Строением кристаллической решетки).
Демонстрация слайда №6
5. Химические свойства фосфора
— Фосфор часто называют многоликим элементом. Не только из-за аллотропных видоизменений, но и благодаря химическим свойствам.
Давай посмотрим опыты, характеризующие химические свойства фосфора: Горение фосфора в кислороде.
Горение фосфора под водой.
Взаимодействие фосфора с хлором.
Взаимодействие фосфора с бертолетовой солью.
(Просмотр видеороликов). Демонстрация слайда №7 № 8
Я предлагаю вам написать уравнения химических реакций, которые мы с вами посмотрели, и разобрать их с точки зрения ОВР. Для этого выберите цвет понравившегося вам лепестка клевера, на обратной стороне которого будет ваше задание. (Учащиеся выбирают разноцветные листики клевера с заданиями).
(Учащиеся выбирают разноцветные листики клевера с заданиями).
Демонстрация слайда № 9, 10
4Р + 5О2 = 2Р2О5
3Mg + 2P = Mg3P2
5KClO3 + 6P = 3P2O5 + 5KCl
2P+ 5Cl2 = 2PCl5
На выполнение задания 5 минут. Учащиеся выполняют задания в группах, записывают их тетрадях, затем выходят к доске по одному человеку из команды и записывают ОВР своей реакции.
— В этой реакции фосфор выступает в роли окислителя или восстановителя?
— Какой вывод можно сделать о свойствах фосфора? (Этот элемент может проявлять как окислительные, так и восстановительные свойства).
— Распределите реакции на две колонки. Демонстрация слайда № 11 (Работа учащихся с интерактивной доской).
— Ребята, запишите схему и уравнения реакций с доски, а дома разберите их как ОВР.
— С фосфором и его соединениями связано немало легенд и суеверий. Сейчас я предлагаю вам в группах ознакомиться с материалами, которые у вас находятся на столе.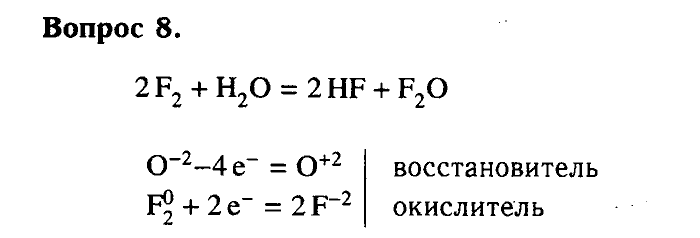
1группа Фосфор в организме человека (Биологи)
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Если бы фосфор исчез из костей, наше тело превратилось бы в бесформенные массы. Если бы фосфор исчез из мышц, мы утратили бы способность двигаться, из нервной ткани – мы перестали бы мыслить. Академик А.Е. Ферсман назвал фосфор “элементом жизни и мысли”.
Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5:1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.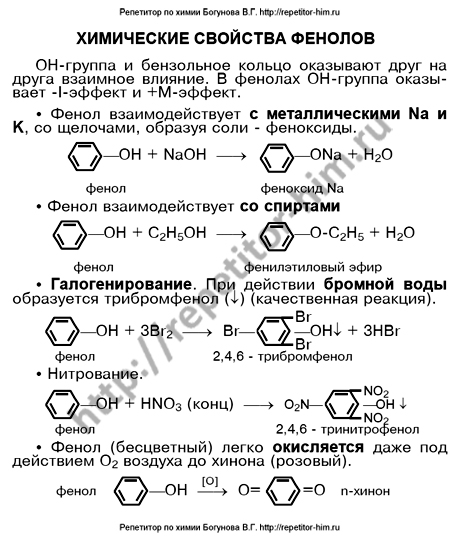
2 группа Необыкновенная история обыкновенной спички (Историки)
Первые спички содержали белый фосфор. Они были очень опасны и зажигались очень легко, а порой и неожиданно, что нередко приводило к пожарам. В 1867 г. от ожогов скончалась итальянская герцогиня Матильда, которая случайно наступила на спичку и ее платье было мгновенно охвачено пламенем.
Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками, как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену опасным спичкам пришли безопасные, содержащие красный фосфор, которые верно служат нам, и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла и клея. В состав спичечной головки входят окислители (KСlO3 бертолетовая соль) и восстановители (S сера). При трении спички о коробок происходит следующая реакция:
При трении спички о коробок происходит следующая реакция:
6P + 5KClO3 — 5KCl+ 3P2O5
3 группа “Светящийся монах” (Журналисты)
Вот что о работе с газообразным фосфором вспоминает академик С. И. Вольфкович: “Фосфор получался в электрической печи, установленной в Московском университете на Моховой улице. Так как эти опыты проводились тогда в нашей стране впервые, я не предпринял тех предосторожностей, которые необходимы при работе с газообразным фосфором – ядовитым, самовоспламеняющимся и светящимся голубоватым цветом элементом. В течение многих часов работы у электропечи часть выделяющегося газообразного фосфора настолько пропитала мою одежду и даже ботинки, что когда ночью я шел из университета по темным, не освещенным тогда улицам Москвы, моя одежда излучала голубоватое сияние, а из-под ботинок (при трении их о тротуар) высекались искры. За мной каждый раз собиралась толпа, среди которой, несмотря на мои объяснения, немало было лиц, видевших во мне “новоявленного” представителя потустороннего мира. Вскоре среди жителей района Моховой и по всей Москве из уст в уста стали передаваться фантастические рассказы о “светящемся монахе”…
Вскоре среди жителей района Моховой и по всей Москве из уст в уста стали передаваться фантастические рассказы о “светящемся монахе”…
4 группа “Огни на кладбищах” (Химики)
“На кладбище мы встретили массу вертящихся над могилами прозрачных огоньков. Иные были ростом с аршин. При первом дуновении ветерка огоньки заколыхались, быстро помчались вперед”. Фосфор как элемент входит в состав живых организмов, при гниении остатков животных, человека образуется РН3 – фосфин. Непрочное соединение, прямым соединением фосфора и водорода получить нельзя. На воздухе самовоспламеняется. Очень ядовитый бесцветный газ с запахом тухлой рыбы.
При разложение богатых фосфором соединений органического происхождения может выделяться фосфин. Одновременно с ним идёт образование другого продукта – дифосфина Р2Н4, представляющего собой жидкость. Пары дифосфина самовоспламеняются и поджигают газообразный фосфин. Этим объясняется появление так называемых, “блуждающих огней” в таких местах, как кладбище, болота.
Демонстрация слайда № 12 Видеоролик «Образование и возгорание фосфина».
6. Нахождение в природе, получение фосфора
Нахождение в природе и организме.
В свободном состоянии в природе не встречаются вследствие легкой окисляемости фосфора. Природные минералы – фосфорит Сa3(РО4)2, апатит –
Сa3(РО4)2•СaCI2 или Сa3(РО4)2•СaF2.Зубная эмаль, представляющая собой в соответствии со своими функциями самое твёрдое из веществ, тот же самый апатит.
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Демонстрация слайда № 13
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
7. Применение фосфора
Демонстрация слайда № 14
Главные его потребители – производство спичек, металлургия, химические производства. В недавнем прошлом на военных предприятиях его использовали для приготовления дымовых и зажигательных составов.
В недавнем прошлом на военных предприятиях его использовали для приготовления дымовых и зажигательных составов.
Большая часть фосфора, используемая промышленностью, идет на создание моющих средств и для умягчения воды.
Вода, обработанная соединениями фосфора, становится мягкой (т. е. не содержащей солей) и уменьшается образование накипи, так как фосфаты способствуют удалению накипи со стенок паровых машин. Большое количество фосфора идет на производство его органических соединений. Они используются для уничтожения насекомых-вредителей и для прополки сорняков. К сожалению, это же свойство фосфорных соединений используется и в военных целях. Фосфорорганические соединения входят в состав многих отравляющих веществ. Во Вьетнаме военщина США применяла их для уничтожения растительности, обрабатывая с самолетов целые провинции.
Военное применение находит и сам фосфор в виде простого вещества. Большое количество белого густого дыма, образующегося при горении.
С развитием полупроводниковой промышленности все чаще стали создаваться полупроводники на основе фосфидов.
Получили широкое распространение полупроводниковые материалы, с фосфидами индия, галлия, алюминия, бора. Входят фосфиды и в состав некоторых бронз. Металлургия использует соединения фосфора для создания защитных покрытий на металлах.
Очень часто пленка фосфатов используется как грунт для нанесения красок. Препарат мажеф известен ка средство защиты от коррозии. Состав его зашифрован в названии: фосфаты марганца и железа с небольшой добавкой фосфатов цинка и оксидов меди.
Удобрения, содержащие фосфор
Демонстрация слайда №15
Название удобрения | Химический состав |
Простые | |
Суперфосфат двойной | Са(Н2РО4)2 |
Суперфосфат простой | Са(Н2РО4)2 + 2СаSО4 |
Фосфоритная мука | Са3(РО4)2 |
Костяная мука | Са3(РО4)2 |
Преципитат | СаНРО4 х 2Н2О |
Шлак мартеновский печей | Сложный состав. |
Комплексные | |
Аммофос | (Nh5)2HPO4 + Nh5h3PO4 |
Аммофоска | (Nh5)2HPO4 + Nh5h3PO4 + KCl |
Нитроаммофос | Nh5h3PO4 + Nh5NO3 |
Войска США использовали зажигательные фосфорные бомбы во время военной операции вблизи иракского города Эль-Фаллуджа в 2004 году.
Демонстрация слайда №16
По словам представителя Пентагона, белый фосфор использовали как огневое средство против боевиков и для освещения поля боя. В то же время один из итальянских телеканалов сообщал, что среди жертв фосфорных бомб были женщины и дети.
Белый фосфор применяется в военном деле в качестве боевого зажигательного и дымообразующего вещества. При сжигании белого фосфора на воздухе получается фосфорный ангидрид, пары которого, притягивая из воздуха влагу, образуют непроницаемую пелену белого тумана из тончайших капелек раствора метафосфорной кислоты.
V Закрепление изученного
— Ребята давайте вернемся к вашему тесту. Есть ли теперь у вас вопросы? (нет). Нашли ли вы ответы на интересующие вас вопросы? (Да). Молодцы, значит вы очень внимательно слушали друг друга и хорошо работали сегодня. Сдайте свои работы.
VI Подведение итогов урока, комментирование и выставление отметок
VII Домашнее задание:
1. Параграф 32 упр 2,4
2 Индивидуальные задания. Подготовить сообщения:
1) История возникновения спичек;
2) Биологическая роль фосфора.
VIII Рефлексия
Вам было над чем подумать сегодня на уроке?
Узнали ли вы сегодня, что то новое?
Вы принимали активное участие в уроке?
Пригодится ли вам это в жизни?
Вам понравился урок?
Спасибо, ребята вам за урок. До свидания.
Конспекты уроков по химии 9 класс
Главная
— Конспекты
— Химия
— 9 класс
Подбор параметров
Класс
10 класс (124)
11 класс (76)
2 класс (1)
3 класс (1)
5 класс (3)
6 класс (3)
7 класс (18)
8 класс (338)
9 класс (269)
2 класс 3 класс 5 класс 6 класс 7 класс 8 класс 10 класс 11 класс
Государственное казенное общеобразовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п….
общеобразовательная школа-интернат основного общего образования. п….
docx Конспект урока
Химия
Открыть конспект →Урок химии «Силикатная промышленность» (9-й класс). Тип урока:. . изучение нового материала. Цели. :. . дать понятие о силикатной промышленности;…
docx Конспект урока
Химия
Открыть конспект →ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ГИМНАЗИЯ №363 ФРУНЗЕНСКОГО РАЙОНА САНКТ-ПЕТЕРБУРГА. Методическое объединение учителей естественно-научного…
docx Конспект урока
Химия
Открыть конспект → Государственное бюджетное общеобразовательное учреждение. Центр образования №80. Центрального района города Санкт-Петербурга. Методическое объединение…
Центр образования №80. Центрального района города Санкт-Петербурга. Методическое объединение…
docx Конспект урока
Химия
Открыть конспект →Тема: Современное состояние и охрана воздуха, 9 класс. (интегрированный урок по химии и биологии). Учитель химии и биологии высшей кв. категории…
docx Конспект урока
Химия
Открыть конспект →Методическая разработка. открытого урока по химии. на тему: «Значение воды в жизни человека». в 9 классе. Учитель: Попович Лидия…
docx Конспект урока
Химия
Открыть конспект → План-конспект урока. АЛЮМИНИЙ,. . ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ.
Евтушенко Елена Михайловна. .
…
АЛЮМИНИЙ,. . ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ.
Евтушенко Елена Михайловна. .
…
docx Конспект урока
Химия
Открыть конспект →9 класс химия ( Габриелян). Учебное занятие № 44. Дата:. Тема: Кремний – химический элемент или природный дар. …Силикаты. Эпиграф к уроку:….
docx Конспект урока
Химия
Открыть конспект →Предмет. : химия. . Класс. : 9. Учитель:. Косенкова Людмила Михайловна, МБОУ СОШ № 54 г. Липецка. Учебно-методический комплекс:. Габриелян О.С….
docx Конспект урока
Химия
Открыть конспект → Интегрированный урок химия- биология. . 9 класс. «Белки — органические полимеры». Мыслящий ум. . не чувствует себя счастливым,. . пока…
. 9 класс. «Белки — органические полимеры». Мыслящий ум. . не чувствует себя счастливым,. . пока…
docx Конспект урока
Химия
Открыть конспект →МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. «НОВО-ЯМСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА». Разработка…
docx Конспект урока
Химия
Открыть конспект →МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории…
docx Конспект урока
Химия
Открыть конспект → Учитель МБОУ СОШ № 51 г. Краснодар. СЛАВГОРОДСКАЯ И.В. Урок — сказка «Приключение Серной Кислоты». (9 класс). Цели урока: Закрепить и проверить…
Краснодар. СЛАВГОРОДСКАЯ И.В. Урок — сказка «Приключение Серной Кислоты». (9 класс). Цели урока: Закрепить и проверить…
docx Конспект урока
Химия
Открыть конспект →Конспект урока. Данные об учителе: Загребина Анастасия Павловна. учитель МБОУ Июльской СОШ, 1 категория, запрашиваемая 1 категория. Предмет. : химия….
docx Конспект урока
Химия
Открыть конспект →. Комитет по образованию. . администрации. муниципального образования г. Ноябрьск. Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная…
docx Конспект урока
Химия
Открыть конспект → УРОК ПО ТЕМЕ. «КОРРОЗИЯ МЕТАЛЛОВ». 9 класс. Разработку урока подготовил. . учитель химии. . МАОУ «СОШ №36» г. Перми. Сыропятова…
«КОРРОЗИЯ МЕТАЛЛОВ». 9 класс. Разработку урока подготовил. . учитель химии. . МАОУ «СОШ №36» г. Перми. Сыропятова…
docx Конспект урока
Химия
Открыть конспект →Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы…
docx Конспект урока
Химия
Открыть конспект →1001 идея интересного занятия с детьми. . ПЛАН-КОНСПЕКТ ОТКРЫТОГО УРОКА:. «ЖЕЛЕЗО; СТРОЕНИЕ, СВОЙСТВА». Богомолова Светлана Михайловна, Муниципальное…
docx Конспект урока
Химия
Открыть конспект → Муниципальное бюджетное общеобразовательное учреждение. . «СОШ № 68 с углублённым изучением русского языка и математики». . г. Оренбурга. …
. «СОШ № 68 с углублённым изучением русского языка и математики». . г. Оренбурга. …
docx Конспект урока
Химия
Открыть конспект →МКОУ ООШ с. Татаурово Нолинского района. . Кировской области. Урок химии в 9 классе. по теме. учитель…
docx Конспект урока
Химия
Открыть конспект →ПЛАН-КОНСПЕКТ УРОКА Железо. . ФИО (полностью). . . Петухова Юлия Валентиновна. . . . Место работы. . МБОУ СОШ с. Георгиевка…
docx Конспект урока
Химия
Открыть конспект → . ПЛАН-КОНСПЕКТ УРОКА. . Аммиак. (Тема урока).
.
ФИО (полностью). . . Панова Людмила Валентиновна. .
.
. Место работы….
ПЛАН-КОНСПЕКТ УРОКА. . Аммиак. (Тема урока).
.
ФИО (полностью). . . Панова Людмила Валентиновна. .
.
. Место работы….
docx Конспект урока
Химия
Открыть конспект →Паюхина М.В. – учитель химии МКОУ Еманжелинской СОШ, Челябинской области. . Аннотация к работе. Автор: Паюхина Мария Васильевна. . Предмет,…
docx Конспект урока
Химия
Открыть конспект →План-схема урока «Нитраты». . 9 класс. . Цель:. закрепить знания учащихся об общих свойствах солей, изучить особые свойства нитратов и их применение….
docx Конспект урока
Химия
Открыть конспект → Конспект урока на тему. . «Да здравствует мыло душистое…». (производство мыла). Учебные предметы: химия, информационные технологии, биология,…
. «Да здравствует мыло душистое…». (производство мыла). Учебные предметы: химия, информационные технологии, биология,…
docx Конспект урока
Химия
Открыть конспект →Обобщение по теме: «НЕМЕТАЛЛЫ». Учитель:. Свириденко Ю.А. Класс:. 9. . . Программа:. «Неорганическая химия — 9», авторы И.И.Новошинский,…
docx Конспект урока
Химия
Открыть конспект →Тема урока:. «Металлы в окружающей среде и здоровье человека». (урок-конференция). 9 класс. Цели урока:. 1. Сформировать у учащихся представления…
docx Конспект урока
Химия
Открыть конспект → Разработка урока химии, 9 класс по теме «Бериллий, магний, щелочноземельные металлы» к учебнику О. С.Габриелян, Химия 9 класс: учебник для общеобразовательных…
С.Габриелян, Химия 9 класс: учебник для общеобразовательных…
docx Конспект урока
Химия
Открыть конспект →. Аннотация. . к разработке интегрированного урока учителя биологии химии Мотайло Марины Валерьевны и учителя физики Скопиной Людмилы Александровны…
docx Конспект урока
Химия
Открыть конспект →. . Тема: «Соединения железа». Урок-исследование. Цель:. изучить состав , получение и свойства гидроксидов железа, научиться распознавать…
docx Конспект урока
Химия
Открыть конспект →1 2 3 4 5 … 9 След.
Описание каталога конспектов уроков по химии для 9 класса
Наш каталог конспектов уроков по химии для 9 класса вмещает в себя большой ассортимент учебных материалов на множество тем и отлично подходит для подготовки к уроку как для учителей, так и для учеников 9 класса. Кроме того, все конспекты Вы можете абсолютно бесплатно скачать.
Благодаря возможности просмотреть содержимое каждой работы онлайн, Вы можете легко выбрать действительно подходящий вариант, который поможет с подготовкой к уроку по Химии. Если найти подходящую работу не удается, то Вы можете воспользоваться удобным поиском по всей базе материалов.
Кроме того, все конспекты Вы можете абсолютно бесплатно скачать.
Благодаря возможности просмотреть содержимое каждой работы онлайн, Вы можете легко выбрать действительно подходящий вариант, который поможет с подготовкой к уроку по Химии. Если найти подходящую работу не удается, то Вы можете воспользоваться удобным поиском по всей базе материалов.
Конспект по химии 9 класс рудзитис параграф 9 – Конспекты уроков по химии — 9 класс
Химия 9 класс конспект
Конспект урока по химии 9 класс на тему » Соли аммония».УМК Рудзитис Г. Е.
Тема: «Соли аммония» Класс 9 УМК Рудзитис Г. Е., Фельдман Ф. Г.
Тип урока: Урок усвоения новых знаний
Деятельностная цель: формировать познавательные универсальные учебные действия при изучении темы «Соли аммония» , обучающиеся: сравнивают, анализируют, планируют и т. д.;
Предметно-дидактическая цель: расширение базы химических понятий, за счет включения в нее новых элементов: названия солей аммония, качественные реакции на ион аммония.
Планируемые результаты:
Предметный результат
Формирование систематизированных представлений о веществах, овладение понятийным аппаратом и символическим языком химии;
Осознание объективной значимости основ химической науки;
Приобретение опыта использования различных методов изучения веществ.
Метапредметный результат
Умение устанавливать причинно-следственные связи;
Умение создавать, применять и преобразовывать знаки и символы;
Работать индивидуально и в группе;
Владение устной и письменной речью, монологической контекстной речью;
Личностный результат
Формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию;
Формирование целостного мировоззрения;
Формирование ценности здорового и безопасного образа жизни;
Формирование основ экологической культуры.
Методы обучения:
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая
Средства обучения: таблица растворимости; набор с солями аммония. Учебник химия 9 класс Рудзитис Г. Е. классная доска, машрутный лист, лист самооценки работы.
Учебник химия 9 класс Рудзитис Г. Е. классная доска, машрутный лист, лист самооценки работы.
Деятельность учителя
Деятельность обучающихся
Формируемые УУД
1. Организационный этап 1 мин
Сообщает девиз урока «С малой удачи начинается успех»
Желает удачи в изучении новой темы.
Приветствуют учителя. Готовятся к уроку.
Регулятивные (оценка, саморегуляция)
Коммуникативные (определение способов взаимодействия)
2. Постановка цели и задач урока
Предлагает поиграть в игру «Исключения»
Из предложенного ряда веществ:
Исключите простые вещества
Аммиак нитрат натрия
Прочитайте формулы оставшихся веществ.
Что у них общего?
Как называется ион Nh5 + ?
Предположите тему, цель и план урока.
Отвечают на вопросы: Что у них общего? Как называется ион Nh5+ ?
Формулируют тему, цель занятия «Соли аммония».
Строят логические умозаключения.
Предлагают план работы, оценивают необходимые инструменты для достижения поставленной цели урока.
Личностные установление значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов
Регулятивные целеполагание постановка учебной задачи на основе соотнесения того, что уже известно и усвоено, и того, что ещё неизвестно.
Познавательные
Установление причинно-следственных связей.
Коммуникативные
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.
Классная доска, тетрадь, учебник
3. Актуализация знаний
1. Какую тему проходили на прошлом уроке? ( аммиак) Проверка домашнего задания.
Выполнение теста
Проверка (совместно с учителем)
Работа с листом заданий
2.Выберите формулы солей аммония и подберите к ним названия
Фосфат аммония, карбонат кальция, нитрат аммония, нитрат натрия, хлорид аммония.
Из чего состоят соли аммония? Как составить их названия?
Демонстрирует соли аммония. Предлагает охарактеризовать их физические свойства.
Как проверить растворимость солей аммония?
Разбиваемся на группы 2 группы теоретики и химики — исследователи.
1 ГРУППА химики – иследователи. изучают физические св-ва) ДавыдоваИ Калеева Д.
2 Группа ТЕОРЕТИКИ – изучают получение и применение солей аммония. Гайфутдинов З, Рахимов С Баймухамбетова Я, Буянов М Тихонова Т.
3 группа- химические св-ва общие и специфические. Максимов, Нуждин, СансызбаеваА, Аманжулов Р.
Работают с таблицами растворимости
После проведения работ РУКОВОДИТЕЛИ ГРУПП ОТЧИТАЮТСЯ и сообщают результаты
Индивидуально выполняют ТЕСТ, Критерии прописаны в листе самооценки.
Отвечают на вопросы о составе солей. Формулируют определение солей аммония.
Работа в группах, характеризуют физические свойства солей.
1 ГРУППА химики – иследователи. ( изучают физические св-ва)
( изучают физические св-ва)
Инструктаж по технике безопасности.
2 Группа ТЕОРЕТИКИ – изучают получение и применение солей аммония.
3 группа — химические св-ва общие и специфические.
Работают с таблицами растворимости
Сообщают результаты работы
Оценивают свою работу.
Владение монологической формой речи, понимание других, умение доносить свою позицию.
Познавательные
Осознанное и построение речевого высказывания в устной и письменной форме;
Контроль и оценка процесса и результатов деятельности
Анализ объектов с целью выделения признаков
Постановка и решение проблемы:
Регулятивные
Действие по плану, оценка результата.
Тетради, учебник, листы заданий, образцы солей
ФИЗМИНУТКА. ( дети встают и если учитель называет газообразные в-ва – подпрыгивают, если металлы – приседают, неметаллы — поворачиваются влево, вправо.)
Работа с листом заданий
Допишите уравнения реакций
Подготовка к итоговой аттестации. Работа с КИМАМИ стр 38 задание № 15.
Работа с КИМАМИ стр 38 задание № 15.
МаксимовД. Давыдова И. Аманжулов Р.
Сансызбаева А. Тихонова Т.
Корректировка састоятельной работы.
Каких знаний вам не хватило, чтобы безошибочно справиться с полученным заданием?
Строят логические умозаключения. В парах выполняют конспект, анализируют, делают вывод о получении солей аммония. Записывают в тетрадь.
Работают индивидуально, дописывая реакции в тетради. Калеева Д – работа у доски.
Самопроверка.
Отвечают на вопрос: Как доказать, что выделяется аммиак?
Регулятивные целеполагание на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно;
Установление учащимся значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов
Коммуникативные
Постановка вопросов инициативное сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Владение монологической и диалогической формами речи
Тетради, учебник, стр 50-51 листы заданий,
5. Первичная проверка понимания
Первичная проверка понимания
Создание проблемной ситуации
Задание: В деревне у бабушки Веры на пакетах с минеральными удобрениями написано: натриевая селитра, сернокислый аммоний, аммофос, двойной суперфосфат и молотый сильвинит.
Зачем бабушки нужны удобрения?
Как они выглядят? Среди удобрений определите соли аммония.
Как можно доказать, что это соли аммония?
Выдвигают гипотезу. Строят логические умозаключения. Ищут необходимую информацию
С помощью учителя записываю формулы и уравнения реакций.
Регулятивные
Постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно.
Коммуникативные
Сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Владение монологической и диалогической формами речи
Познавательные
— осознанное и произвольное построение речевого высказывания в устной форме;
— анализ объектов с целью выделения признаков
Установление причинно-следственных связей.
Постановка и решение проблемы:
Тетради, учебник, листы заданий, дополнительные источники информации
6. Первичное закрепление
Предлагаются новые задания.
Предложите способ очистки поваренной соли от содержащейся в ней примеси хлорида аммония (предполагаемый ответ – нагреть)
Выдвигают гипотезу. Строят логические умозаключения. Самостоятельно записывают реакции
Регулятивные
Постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно.
Коммуникативные
Сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Познавательные
Общеучебные действия:структурирование знаний;
Осознанное и произвольное построение речевого высказывания
— анализ объектов с целью выделения признаков
Установление причинно-следственных связей.
Постановка и решение проблемы:
7. Информация о домашнем задании, инструктаж по его выполнению
Приводит взаимосвязь профессий и знаний по химии, предлагая продолжить предложение: знание этой темы может помочь в профессии …(* агронома )
Коментарий домашнего задания.
Для сильных и тех кто сдаёт ОГЭ задача №1 –Это часть С
Работают в тетради. Пишут домашнее задание.
Установление учащимся значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов;
Постановка и решение проблемы формулирование проблемы.
§18 стр 50-51 таб 14 выучить. конспект. Общее для всех.
Для сильных решить задачу №1
8. Рефлексия (подведение итогов занятия)
Дает оценку работе класса, отмечает проблемные вопросы. Инициирует рефлексию детей.
Тема: «Соли аммония» Класс 9 УМК Рудзитис Г. Е., Фельдман Ф. Г.
Тип урока: Урок усвоения новых знаний
Деятельностная цель: формировать познавательные универсальные учебные действия при изучении темы «Соли аммония» , обучающиеся: сравнивают, анализируют, планируют и т. д.;
д.;
Предметно-дидактическая цель: расширение базы химических понятий, за счет включения в нее новых элементов: названия солей аммония, качественные реакции на ион аммония.
Планируемые результаты:
Предметный результат
Формирование систематизированных представлений о веществах, овладение понятийным аппаратом и символическим языком химии;
Осознание объективной значимости основ химической науки;
Приобретение опыта использования различных методов изучения веществ.
Метапредметный результат
Умение устанавливать причинно-следственные связи;
Умение создавать, применять и преобразовывать знаки и символы;
Работать индивидуально и в группе;
Владение устной и письменной речью, монологической контекстной речью;
Личностный результат
Формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию;
Формирование целостного мировоззрения;
Формирование ценности здорового и безопасного образа жизни;
Формирование основ экологической культуры.
Методы обучения:
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая
Средства обучения: таблица растворимости; набор с солями аммония. Учебник химия 9 класс Рудзитис Г. Е. классная доска, машрутный лист, лист самооценки работы.
Деятельность учителя
Деятельность обучающихся
Формируемые УУД
1. Организационный этап 1 мин
Сообщает девиз урока «С малой удачи начинается успех»
Желает удачи в изучении новой темы.
Приветствуют учителя. Готовятся к уроку.
Регулятивные (оценка, саморегуляция)
Коммуникативные (определение способов взаимодействия)
2. Постановка цели и задач урока
Предлагает поиграть в игру «Исключения»
Из предложенного ряда веществ:
Исключите простые вещества
Аммиак нитрат натрия
Прочитайте формулы оставшихся веществ.
Что у них общего?
Как называется ион Nh5 + ?
Предположите тему, цель и план урока.
Отвечают на вопросы: Что у них общего? Как называется ион Nh5+ ?
Формулируют тему, цель занятия «Соли аммония».
Строят логические умозаключения.
Предлагают план работы, оценивают необходимые инструменты для достижения поставленной цели урока.
Личностные установление значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов
Регулятивные целеполагание постановка учебной задачи на основе соотнесения того, что уже известно и усвоено, и того, что ещё неизвестно.
Познавательные
Установление причинно-следственных связей.
Коммуникативные
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации.
Классная доска, тетрадь, учебник
3. Актуализация знаний
1. Какую тему проходили на прошлом уроке? ( аммиак) Проверка домашнего задания.
Выполнение теста
Проверка (совместно с учителем)
Работа с листом заданий
2. Выберите формулы солей аммония и подберите к ним названия
Выберите формулы солей аммония и подберите к ним названия
Фосфат аммония, карбонат кальция, нитрат аммония, нитрат натрия, хлорид аммония.
Из чего состоят соли аммония? Как составить их названия?
Демонстрирует соли аммония. Предлагает охарактеризовать их физические свойства.
Как проверить растворимость солей аммония?
Разбиваемся на группы 2 группы теоретики и химики — исследователи.
1 ГРУППА химики – иследователи. изучают физические св-ва) ДавыдоваИ Калеева Д.
2 Группа ТЕОРЕТИКИ – изучают получение и применение солей аммония. Гайфутдинов З, Рахимов С Баймухамбетова Я, Буянов М Тихонова Т.
3 группа- химические св-ва общие и специфические. Максимов, Нуждин, СансызбаеваА, Аманжулов Р.
Работают с таблицами растворимости
После проведения работ РУКОВОДИТЕЛИ ГРУПП ОТЧИТАЮТСЯ и сообщают результаты
Индивидуально выполняют ТЕСТ, Критерии прописаны в листе самооценки.
Отвечают на вопросы о составе солей. Формулируют определение солей аммония.
Формулируют определение солей аммония.
Работа в группах, характеризуют физические свойства солей.
1 ГРУППА химики – иследователи.( изучают физические св-ва)
Инструктаж по технике безопасности.
2 Группа ТЕОРЕТИКИ – изучают получение и применение солей аммония.
3 группа — химические св-ва общие и специфические.
Работают с таблицами растворимости
Сообщают результаты работы
Оценивают свою работу.
Владение монологической формой речи, понимание других, умение доносить свою позицию.
Познавательные
Осознанное и построение речевого высказывания в устной и письменной форме;
Контроль и оценка процесса и результатов деятельности
Анализ объектов с целью выделения признаков
Постановка и решение проблемы:
Регулятивные
Действие по плану, оценка результата.
Тетради, учебник, листы заданий, образцы солей
ФИЗМИНУТКА. ( дети встают и если учитель называет газообразные в-ва – подпрыгивают, если металлы – приседают, неметаллы — поворачиваются влево, вправо. )
)
Работа с листом заданий
Допишите уравнения реакций
Подготовка к итоговой аттестации. Работа с КИМАМИ стр 38 задание № 15.
МаксимовД. Давыдова И. Аманжулов Р.
Сансызбаева А. Тихонова Т.
Корректировка састоятельной работы.
Каких знаний вам не хватило, чтобы безошибочно справиться с полученным заданием?
Строят логические умозаключения. В парах выполняют конспект, анализируют, делают вывод о получении солей аммония. Записывают в тетрадь.
Работают индивидуально, дописывая реакции в тетради. Калеева Д – работа у доски.
Самопроверка.
Отвечают на вопрос: Как доказать, что выделяется аммиак?
Регулятивные целеполагание на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно;
Установление учащимся значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов
Коммуникативные
Постановка вопросов инициативное сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Владение монологической и диалогической формами речи
Тетради, учебник, стр 50-51 листы заданий,
5. Первичная проверка понимания
Первичная проверка понимания
Создание проблемной ситуации
Задание: В деревне у бабушки Веры на пакетах с минеральными удобрениями написано: натриевая селитра, сернокислый аммоний, аммофос, двойной суперфосфат и молотый сильвинит.
Зачем бабушки нужны удобрения?
Как они выглядят? Среди удобрений определите соли аммония.
Как можно доказать, что это соли аммония?
Выдвигают гипотезу. Строят логические умозаключения. Ищут необходимую информацию
С помощью учителя записываю формулы и уравнения реакций.
Регулятивные
Постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно.
Коммуникативные
Сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Владение монологической и диалогической формами речи
Познавательные
— осознанное и произвольное построение речевого высказывания в устной форме;
— анализ объектов с целью выделения признаков
Установление причинно-следственных связей.
Постановка и решение проблемы:
Тетради, учебник, листы заданий, дополнительные источники информации
6. Первичное закрепление
Предлагаются новые задания.
Предложите способ очистки поваренной соли от содержащейся в ней примеси хлорида аммония (предполагаемый ответ – нагреть)
Выдвигают гипотезу. Строят логические умозаключения. Самостоятельно записывают реакции
Регулятивные
Постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё неизвестно.
Коммуникативные
Сотрудничество в поиске и сборе информации;
Умение с достаточной полнотой и точностью выражать свои мысли в соответствии с задачами и условиями коммуникации;
Познавательные
Общеучебные действия:структурирование знаний;
Осознанное и произвольное построение речевого высказывания
— анализ объектов с целью выделения признаков
Установление причинно-следственных связей.
Постановка и решение проблемы:
7. Информация о домашнем задании, инструктаж по его выполнению
Приводит взаимосвязь профессий и знаний по химии, предлагая продолжить предложение: знание этой темы может помочь в профессии …(* агронома )
Коментарий домашнего задания.
Для сильных и тех кто сдаёт ОГЭ задача №1 –Это часть С
Работают в тетради. Пишут домашнее задание.
Установление учащимся значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов;
Постановка и решение проблемы формулирование проблемы.
§18 стр 50-51 таб 14 выучить. конспект. Общее для всех.
Для сильных решить задачу №1
8. Рефлексия (подведение итогов занятия)
Дает оценку работе класса, отмечает проблемные вопросы. Инициирует рефлексию детей.
Приводит взаимосвязь профессий и знаний по химии, предлагая продолжить предложение знание этой темы может помочь в профессии агронома.
Schoolgreen. ru
ru
29.05.2017 3:19:33
2017-05-29 03:19:33
Источники:
Https://schoolgreen. ru/9-klass/konspekt-po-ximii-9-klass-rudzitis-paragraf-9-konspekty-urokov-po-ximii-9-klass. html
Конспект Химия 9 класс: все темы кратко — УчительPRO » /> » /> .keyword { color: red; }
Химия 9 класс конспект
Химия 9 класс: все темы кратко
Краткий курс «Химия 9 класс» сгруппирован в четыре блока, содержание каждого из которых рассматривается в отдельном параграфе — «Вещества», «Химические реакции», «Основы неорганической химии» и «Методы познания веществ и химических реакций». Материал каждого параграфа представляет собой схематическое обобщение уже изученного вами материала в виде схем, таблиц, уравнений.
Повторение курса химии в 9 классе позволит вам систематизировать знания о веществах и химических реакциях. Внимание! Данный курс не является материалом для изучения химии с нуля. Он ориентирован на повторение пройденного материала (экспресс-обзор). Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.
Данный курс не является материалом для подготовки к ОГЭ по химии. При подготовке к ОГЭ используйте другие материалы сайта.
Материал каждого параграфа представляет собой схематическое обобщение уже изученного вами материала в виде схем, таблиц, уравнений.
Uchitel. pro
17.05.2019 18:11:18
2019-05-17 18:11:18
Источники:
Https://uchitel. pro/%D1%85%D0%B8%D0%BC%D0%B8%D1%8F-9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%81%D0%B5-%D1%82%D0%B5%D0%BC%D1%8B-%D0%BA%D1%80%D0%B0%D1%82%D0%BA%D0%BE/
Фосфор. Химия. 9 класс. Конспект урока – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана) » /> » /> .keyword { color: red; }
Химия 9 класс конспект
Внимание! Администрация сайта rosuchebnik. ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
Автор материала: Еремина Ирина Александровна, МОУ СОШ № 7 города Ярославля
Химия, УМК О. С.Габриелян, 9 класс
С.Габриелян, 9 класс
Фосфор – элемент 5А — группы
Тип урока – изучение нового материала
- образовательные – изучить сведения о фосфоре, его свойства, значение, применение; воспитательные – забота о своем здоровье, умение работать в группе, укрепление метапредметных связей; развивающие – развитие познавательного интереса к предмету, самостоятельно находить информацию в различных источниках, сравнивать, делать вывод.
познакомить учащихся природными соединениями фосфора, рассмотреть физические и химические свойства фосфора, повторить и углубить знания об аллотропии, охарактеризовать практическое применение фосфора и его значение.
План урока:
нахождение в природе. получение. аллотропия. химические свойства. применение.
Фосфор – один из распространенных элементов в земной коре. В свободном виде в природе фосфор не встречается из-за высокой химической активности. В связанном виде он входит в состав примерно 200 минералов. Одним из главных фосфоросодержащих веществ является – ортофосфат кальция.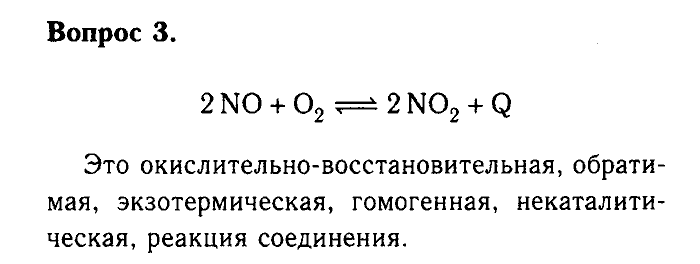 Основными источниками фосфора являются апатиты и фосфориты. Крупнейшие залежи апатитов в мире находятся вблизи города Киров на Кольском полуострове.
Основными источниками фосфора являются апатиты и фосфориты. Крупнейшие залежи апатитов в мире находятся вблизи города Киров на Кольском полуострове.
Кроме того фосфор входит в состав белковых веществ в виде различных соединений и содержится в мышцах, нервных клетках, мозговых клетках. Например, организм человека содержит приблизительно 1,5 кг фосфора, преимущественно в костной ткани.
Запись в тетрадь: нахождение фосфора в природе:
- минералы — фосфориты и апатиты, содержащие ортофосфат кальция; белковые вещества( мышцы, костные клетки, нервные клетки, мозговые клетки).
Теперь мы с вами должны выяснить как же получают фосфор в промышленности?
Фосфор получают главным образом из фосфоритов и апатитов, нагревая их в электрических печах без доступа воздуха при температуре 1500 градусов в присутствии оксида кремния (I V) – речной песок и угля ( С).
Ca3(PO4)2+ 5C + 3SiO2= 3CaSiO3 + 2P + 5CO
При этой реакции пары фосфора сгущают и улавливают в приемнике с водой.
Аллотропия.
Давайте вспомним что такое аллотропия?
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ.
А что такое аллотропные видоизменения?
Простые вещества, образованные одним и тем же химическим элементом, называют аллотропными видоизменениями этого элемента. Вспомните у каких ранее изученных элементов мы встречали аллотропные модификации?
Ответ — сера, кислород.
Кто может назвать видоизменения этих химических элементов?
Кислород – озон, сера – кристаллическая, ромбическая, пластическая.
У фосфора тоже есть аллотропные видоизменения.
| Белый | Красный | Черный |
| Р4- молекулярное строение, молекулы имеют форму трехгранной пирамиды. Активен, ядовит. На воздухе самовоспламеняется. Хранят под водой. | Порошок краснобурого цвета, не ядовит, устойчив, на воздухе не окисляется. Атомная кристаллическая решетка.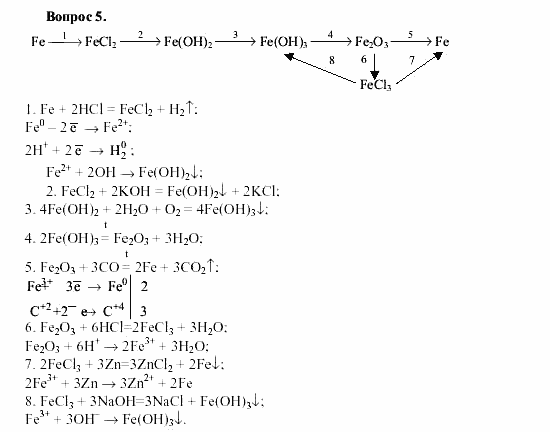 Получают нагреванием белого фосфора. Получают нагреванием белого фосфора. | Атомная кристаллическая решетка, устойчив к нагреванию является полупроводником. Внешне похож на графит, получают при длительном нагревании белого фосфора. |
При определенных условиях виды фосфора могут переходить один в другой, то есть друг в друга.
Химические свойства фосфора.
с кислородом 4Р + 5О2 = 2Р2О5 (дома записать ОВР). с водородом, образуется фосфин – ядовитый газ. 2Р + 3Н2 = 2Рh4 ( дома записать ОВР). с металлами ( например кальций) , образуя соли – фосфиды. 2 P + 3 Ca = Ca3P2 (дома записать ОВР).
Запись ОВР – дополнительные результаты обучения для сильных учеников.
Ребята расставьте степени окисления фосфора в записанных уравнениях.
Какой вывод Вы можете сделать о свойствах проявляемых фосфором в окислительно-восстановительных реакциях?
Учащиеся сами делают вывод : при взаимодействии с кислородом фосфор является восстановителем, а при взаимодействии с водородом и металлами – окислитель.
Применение фосфора.
Красный фосфор применяется для производства спичек. Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный применяется очень редко.
ИТОГ по уроку: (делают учащиеся) соответствует цели урока : познакомились с природными соединениями фосфора, физическими и химическими свойствами, повторили явление аллотропии, узнали практическое значение фосфора.
Дополнительное задание для желающих – подготовка сообщений об аллотропных модификациях фосфора с использованием различных источников информации.
Черный применяется очень редко.
Rosuchebnik. ru
30.11.2020 16:05:43
2020-11-30 16:05:43
Источники:
Https://rosuchebnik. ru/material/fosfor-himiya-9-klass-konspekt-uroka/
Конспект по химии 9 класс,Габриелян §16, Срочно. На завтр… -reshimne.ru
Новые вопросы
Ответы
Набери в ютубе вурдихан вурдиханов 9 класс, зайди на плейлист всех его видео за 9 класс, полистай и найдешь 16 параграф.
удачи!!!
Похожие вопросы
Масса азота, занимающего при н.у. объем 112л, равна: в граммах…
Определите молекулярную формулу предельной карбоновой кислоты если её серебряная соль содержит 64,67% серебра по массе?…
Определить вещество с найменшим степенью окисления Магану (Mn) a)MnO б)K2MnO4 в)Mn2O7 г)MnCl2…
1)WO₃+?→W+H₂O
2)SnCl₂+FeCl→SnCl₄+FeCl₂
3)Na+H₂O→NaOH+H₂↑…
Каких элементов больше металлов или неметаллов в 3-м периоде, и в 4-м периоде….
В 75 г воды растворили 5г бромида калия. Рассчитайте массовую долю вещества в полученном растворе…
Рассчитайте массовую долю вещества в полученном растворе…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
решу огэ толстую химию с объяснением.
 ОГЭ по химии
ОГЭ по химии Сборник содержит 30 практических вариантов экзаменационных работ по химии и предназначен для подготовки к основному государственному экзамену в 9 классе. 31-й вариант — контрольный.
Каждый вариант включает тестовые задания разных типов и уровня сложности, соответствующие 1 и 2 частям экзаменационной работы. В конце книги даны ответы для самостоятельной проверки всех заданий.
Предлагаемые варианты обучения помогут преподавателю организовать подготовку к итоговой аттестации, а студентам самостоятельно проверить свои знания и готовность к итоговому экзамену.
Примеры.
Метан характеризуется следующими утверждениями
1) молекула содержит два атома углерода
2) характерны реакции присоединения
3) не растворяется в воде
4) обесцвечивает бромную воду
5) вступает в реакции замещения с хлором
У химических элементов VIA группы периодической системы с увеличением относительной атомной массы:
1) усиливаются металлические свойства и повышается валентность в соединениях водорода
2) заряд ядра атома и радиус атома увеличиваются
3) количество электронных слоев в атоме и высшая валентность увеличиваются
4) усиливаются неметаллические свойства и количество электронных слоев в атом увеличивается
Соединения с ковалентной полярной и ковалентной неполярной связью соответственно:
1) хлор и хлористый водород
2) вода и азот
3) сероводород и метан
4) кислород и оксид серы (IV)
Содержание
ПРЕДИСЛОВИЕ
Опция 1
Опция 2
Опция 3
Опция 4
Опция 5
Опция 6
Опция 7
Опция 8
Вариант 9
Опция 10
Вариант 11
Опция 12
13
. Опция 15
Опция 15
Опция 16
Опция 17
Опция 18
Опция 19
Опция 20
Опция 21
Опция 22
Опция 23
Опция 24
Опция 25 7
0 Опция 360003 Опция 28
Опция 29
Опция 30
Опция 31 (управление)
Ответы.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу ОГЭ 2017, Химия, 30 вариантов обучения, Корощенко А.С., Купцова А.В. — fileskachat.com, быстрая и бесплатная загрузка.
- ОГЭ-2020, Химия, 10 вариантов обучения, Корощенко А.С., Купцова А.В., 2019
- ОГЭ-2019, Химия, 10 вариантов обучения экзаменационных работ для подготовки к ЕГЭ, Корощенко А.С., Купцова А.В., 2019
Тренировочный тест для подготовки к ОГЭ — 2017 по химии в 9 классе
Подготовила:
Трибунская Елена Жановна,
учитель химии МАОУ СОШ №7
Балаково Саратовская область
Задача:
1) повторить изученный материал
2) познакомить студентов со структурой экзаменационной работы
3) помочь студентам подготовиться к ОГЭ.
Рабочие инструкции
На выполнение работы дается 2 часа (120 минут). Работа состоит из 2 частей, включающих 22 задания. Часть 1 содержит 19 заданий с короткими ответами, часть 2 содержит 3 задания с длинными ответами.
Ответы на задания 1-15 записываются одной цифрой, что соответствует номеру правильного ответа.
Ответы на задания 16-19 записываются в виде последовательности чисел.
Для заданий 20-22 необходимо дать полный развернутый ответ, включая необходимые уравнения реакций и решение задачи.
При выполнении работ можно пользоваться Периодической таблицей химических элементов Д.И. Менделеева, таблица растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов и непрограммируемый калькулятор.
Бывшие в употреблении учебники и интернет-ресурсы :
Габриелян О.С. «Химия 9 класс». М., Дрофа. 2013 год.
О.С. Габриелян «Химия 8 класс». М., Дрофа. 2013 год.
ОТКРЫТЫЙ БАНК заданий по химии ОГЭ
Часть 1
1. Атому соответствуют три электронных слоя и один электрон во внешнем электронном слое:
Атому соответствуют три электронных слоя и один электрон во внешнем электронном слое:
1) хлор; 3) натрий;
2) литий; 4) водород.
Ответ:
2. В каком ряду усиливаются металлические свойства соответствующих простых веществ:
1) бериллий — магний — кальций;
2) фтор-бром-хлор;
3) сера — кислород — селен;
4) углерод-свинец-кремний.
Ответ:
3. Соединения с ковалентной полярной и ковалентной неполярной связью соответственно
1) RbClandCl 2 3) О 3 и Н 2 С
2) HBrandN 2 4) НХ 3 и Н 2 О
Ответ:
4 .Степень окисления +5 фосфор проявляет в соединении
1) P 2 О 3 3) На 3 Р
2) РН 3 4) Мг(Н2 ПО 4 ) 2
Ответ:
5. Вещества, формулы которых -BeO и BaO, равны соответственно:
1) основной оксид и кислый оксид
2) амфотерный оксид и основной оксид
3) кислый оксид и основной оксид
4) основной оксид и амфотерный оксид
Ответ:
6. Реакция, уравнение которой 2Rb+2
Н 2
О=2
RbOH+
Н 2
относится к реакциям:
Реакция, уравнение которой 2Rb+2
Н 2
О=2
RbOH+
Н 2
относится к реакциям:
1) замещения, экзотермические;
2) разложение экзотермическое;
3) присоединение эндотермическое;
4) обменный, эндотермический.
Ответ:
7 . ионы SO 3 2- образуются при диссоциации в водном растворе:
1) сульфид калия; 3) сульфат калия;
2) кислота серная; 4) сульфит калия.
Ответ:
8. Газ выделяется при взаимодействии:
1) цинка гидроксида и соляной кислоты; 3) гидроксид меди (II) и азотная кислота;
2) сульфид меди и кислота соляная 4) окись калия и кислота азотная.
Ответ:
9. Кальций взаимодействует с каждым из веществ, формулы которых указаны в группе:
1) То, О 2 , HCl; 3) О 2 , Н 2 О, Н 2 ;
2) Cu, O 2 , N 2; 4)Н 2 OToOH, S.
Ответ:
10 .Оксид бериллия реагирует с каждым из двух веществ:
1) NaandH 2 О 3) HClandO 2
2) Н 2 O и HNO 3 4) KOHandH 2 ТАК 4
Ответ:
11 . Раствор азотной кислоты реагирует с каждым из двух веществ:
Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Ag и RbOH;
2) № 2 O и CO 2 ;
3) NiO и HCl;
4) Ва(NO 3 ) 2 и NH 3 .
Ответ:
12. Среди веществ: хлорид натрия, сульфид натрия, сульфат натрия — в реакцию с нитратом меди (II) вступают(ют)
1) два вещества; 3) одно вещество;
2) три вещества; 4) нет вещества.
Ответ:
13. Верны ли следующие утверждения?
A. Вы можете отделить спирт от воды отстаиванием.
B. Водный раствор соли и мела можно разделить фильтрованием
1) верно только А; 3) оба суждения верны;
2) верно только В; 4) оба суждения неверны.
Ответ:
14. Аммиак – окислитель, в схеме реакции которого:
1) N 2 +Н 2 →NH 3 ; 3) НХ 3 +CuO→Cu+ N 2 +Н 2 О;
2) NH3 +О 2 →N 2 +Н 2 О; 4) НХ 3 +К→КНХ 2 +Н 2 .
Ответ:
15 . На какой диаграмме распределение массовых долей элементов соответствует качественному составу фосфата аммония?
1) 3)
2) 4)
Ответ:
Часть 2
16. Среди химических элементов Cl —
S- R
Среди химических элементов Cl —
S- R
1) уменьшаются заряды ядер атомов;
2) увеличиваются кислотные свойства их оксидов;
3) снижается низшая степень окисления;
4) радиус атомов уменьшается;
5) повышены неметаллические свойства.
Ответ:
17. Для углеводорода С 2 Н 6 характеристика:
1) реакция замещения;
2) реакция дегидрирования;
3) обесцвечивание бромной воды;
4) реакция изомеризации;
5) реакция с водой.
Ответ:
18. Соедините два вещества с помощью реагента, который можно использовать для различения этих веществ
Вещества: Реагент:
А)NaI и NaClO 3 1) Са( Ой) 2
B)HFandRb 2 ТАК 4 2) AgNO 3
В) СО 2 и CaC 2 3) фенолфталеин
4) Ba(NO 3 ) 2
Ответ:
19. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
НАИМЕНОВАНИЕ РЕАГЕНТОВ
ВЕЩЕСТВА:
A) оксид цинка 1)K 2 О, Na
B) углекислый газ 2)SO 2 , Н 2 О
В) серная кислота 3) Са( Ой) 2 , Н 2 О
4) HBr, Са( Ой) 2
Ответ:
Часть 2
20. Методом электронного баланса расположите коэффициенты в уравнении реакции, схема которой
H 2 О 2 + НХ 3 → № 2 + Н 2 O
Определите окислитель и восстановитель.
21. Углекислый газ пропускали через раствор гидроксида кальция. Образовалось 648 г гидрокарбоната кальция с массовой долей 1%. Рассчитать объем прореагировавшего газа
22. Данные вещества: Ve,NaNO 3 , КОН, Н 2 ТАК 4 , На 2 ТАК 4 , MgO. Используя воду и необходимые вещества только из этого списка, получают гидроксид бериллия в две стадии. Опишите признаки продолжающихся реакций. Для реакции ионного обмена напишите сокращенное уравнение ионной реакции.
Система оценки химических тестов
Правильное выполнение каждой задачи часть 1 базовый уровень сложности (1–15) оценивается в 1 балл.
Правильное выполнение каждой задачи часть 1 продвинутый уровень сложности (16–19) оценивается максимум в 2 балла. Задания 16 и 17 считаются правильно выполненными, если в каждом из них правильно выбрано два ответа. За неполный ответ — правильно назван один из двух ответов или названы три ответа, из них два правильных — дается 1 балл. Остальные ответы считаются неверными и оцениваются в 0 баллов.
Задачи 18 и 19считаются завершенными правильно, если правильно установлены три совпадения. Частично правильным является ответ, в котором установлено два совпадения из трех; стоит 1 балл. Остальные варианты считаются неправильным ответом и оцениваются в 0 баллов.
Часть 1
Часть 2
20. Методом электронных весов расставить коэффициенты в уравнении реакции, схема которого:
H 2 О 2 + НХ 3 → № 2 + Н 2 О
Укажите окислитель и восстановитель.
Элементы ответ
1. Составленный электронный баланс.
Составленный электронный баланс.
3 │2О -1 + 2Э → 2О -2
1 │2 Н-3 — 6ē →N 2 0
2. Коэффициенты расставлены в уравнении реакции:
3 Н 2 О 2 + 2 НХ 3 → № 2 + 6 Н 2 O
3. Указано, что восстановителем является N -3 , а окислитель O -1
Критерии оценки
Очки
Ответ содержит ошибку только в одном из элементов
В ответе две ошибки.
Максимальный балл
21. Углекислый газ пропускали через раствор гидроксида кальция. Образовалось 648 г гидрокарбоната кальция с массовой долей 1%. Рассчитать объем прореагировавшего газа
Элементы ответа
(Допускаются другие формулировки ответа, не искажающие его смысла)
1) Уравнение реакции 2CO 2 + Са( Ой) 2 знак равно Са( ХСО 3)2
2) Рассчитывали массу и количество вещества бикарбоната калия, полученного в результате реакции:
мкл.(Ca(
ХСО 3)2
знак равно
мр-ра (Ca(HCO3)2
)
*
ш (Са(НСО3)2
)= 648
*
0,01=6,48 г.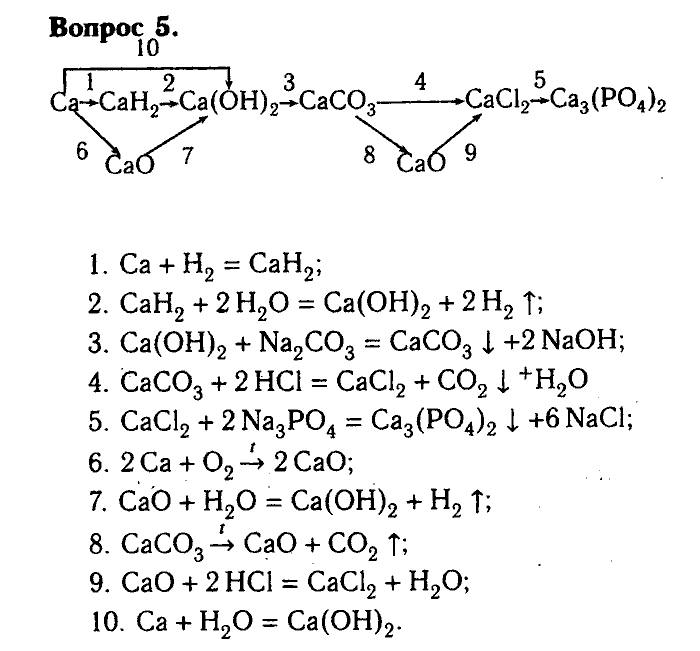
М(Ca(HCO3)2 )=164 г/моль
n(Ca(HCO3)2 )= 6,48 г/ 164 г/моль= 0,04 моль
3) Рассчитайте объем CO 2
н(СО 2 )=2 n(Ca(HCO3)2 )=2 * 0,04=0,08 моль
V(CO 2 )=n * V м = 0,08 * 22,4 = 1,8 л.
Критерии оценки
Очки
Ответ правильный и полный, включает все названные элементы
3
Правильно написаны 2 из названных выше элементов
2
Правильно написан 1 элемент из вышеперечисленного (1-й или 2-й)
1
Все элементы ответа написаны неверно
0
Максимальный балл
3
22. Даны вещества: Ve, NaNO 3 , КОН, Н 2 ТАК 4 , На 2 ТАК 4 , MgO. Используя воду и необходимые вещества только из этого списка, получают гидроксид бериллия в две стадии. Опишите признаки продолжающихся реакций. Для реакции ионного обмена напишите сокращенное уравнение ионной реакции.
Элементы ответа
(Допускаются другие формулировки ответа, не искажающие его смысла)
1) Составлена цепочка преобразований:
ве весо 4 Ве (О) 2
Составлены два уравнения реакции:
2) Ве+Н 2 ТАК 4 знак равно ВЕСО 4 +Н 2
3) ВЕСО 4 + 2КОН = Ве(ОН) 2 ↓+ К 2 ТАК 4
4) Описаны признаки реакций:
для первой реакции: цинк растворяется, выделяется бесцветный газ;
для второй реакции: выпадение белого осадка.
5) Составлено сокращенное ионное уравнение второй реакции:
Ve 2 + + 2 О — знак равно Ве(ОН) 2 ↓
Критерии оценки
Баллы
Ответ правильный и полный, включает все названные элементы
5
Четыре элемента ответа написаны правильно
4
Правильно написаны три элемента ответа
3
Правильно написаны два элемента ответа
2
Один элемент ответа написан правильно
1
Все элементы ответа написаны неверно
0
Максимальный балл
5
Пособие содержит 10 вариантов типовых тестовых заданий ЕГЭ 2017.
Цель пособия — формирование практических навыков учащихся при подготовке к ЕГЭ в 9 классепо химии в 2017 году.
Сборник содержит ответы на все варианты тестов и дает подробный разбор всех заданий одного из вариантов.
Пособие предназначено для учителей и методистов, использующих тесты для подготовки студентов к ЕГЭ 2017, а также может быть использовано студентами для самостоятельной работы и самоконтроля.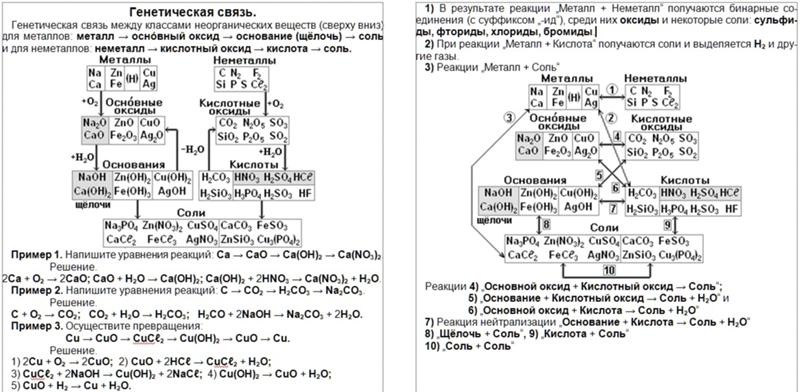 Приказом
Приказом
Министерства образования и науки Российской Федерации учебники издательства «Экзамен» допущены к использованию в образовательных организациях.
Примеры.
Если кусок мела прокалить, дать ему остыть, а затем поместить в пробирку с небольшим количеством воды, к которой добавить несколько капель фенолфталеина, то:
1) изменений не произойдет
2 ) окраска содержимого пробирки станет малиновой
3) образуется прозрачный бесцветный раствор
4) наблюдаются пузырьки газа
Верны ли следующие утверждения о правилах?
безопасная работа в химической лаборатории?
A. Кислород, полученный из перекиси водорода, не ощущается.
Б. Водород, полученный в результате взаимодействия цинка с соляной кислотой, при прокаливании не нуждается в проверке на чистоту.
1) верно только А
2) верно только Б
3) оба утверждения верны
4) оба суждения неверны (модель 1)
Система оценки химического экзамена
Часть 1
Часть 2
Опции экзамена Вариант 1
Часть 1
Часть 2
Опция 2
Часть 1
Часть 2
Опция 3
Часть 1
Часть 2
Опция 4
Часть 1
Часть 2
Вариант 5
Часть 1
Часть 2
Инструкция по выполнению работ (образец 2)
Инструкция по выполнению задания 23
Вариант 6
Часть 1
Часть 2
Вариант 7
Часть 1
Часть 2
Вариант 8
Часть 1
Часть 2
Вариант 9
Часть 1
Часть 2
Часть 10
Часть 1
Часть 2
Решение задач варианта 3 задания части 2.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу ОГЭ 2017, Химия, 9 класс, Типовые проверочные задания, Корощенко А.С. — fileskachat.com, быстрая и бесплатная загрузка.
- ОГЭ-2019, Химия, 10 вариантов учебных экзаменационных работ для подготовки к ЕГЭ, Корощенко А.С., Купцова А.В., 2019
- ОГЭ-2019, Химия, 9 класс, 32 варианта, Типовые тестовые задания, Молчанова Г.Н., Медведев Ю.Н., Корощенко А.С.
- ОГЭ 2019, Химия, 9 класс, 14 вариантов, Типовые тестовые задания, Молчанова Г.Н., Медведев Ю.Н., Корощенко А.С.
- ОГЭ (ГИА-9), Химия, Диагностическая рабочая тетрадь для подготовки к ЕГЭ, 9 класс, Корощенко А.С., Яшукова А.В., Иванова Р.Г., 2015
В этом разделе я систематизирую разбор заданий из ОГЭ по химии. Аналогично разделу вы найдете подробные разборы с инструкциями по решению типовых задач по химии в ОГЭ 9 класс. Перед разбором каждого блока типовых задач даю теоретическую базу, без которой решение данной задачи невозможно. Теории ровно столько, сколько достаточно знать для успешного выполнения задания с одной стороны. С другой стороны, я постарался изложить теоретический материал интересным и понятным языком. Уверен, что пройдя обучение по моим материалам, вы не только успешно сдадите ОГЭ по химии, но и полюбите этот предмет.
Теории ровно столько, сколько достаточно знать для успешного выполнения задания с одной стороны. С другой стороны, я постарался изложить теоретический материал интересным и понятным языком. Уверен, что пройдя обучение по моим материалам, вы не только успешно сдадите ОГЭ по химии, но и полюбите этот предмет.
ОГЭ по химии состоит из трех частей.
В первой части 15 заданий с одним ответом — это первый уровень и задания в нем простые, при наличии, конечно, базовых знаний по химии. Эти задания не требуют вычислений, кроме задания 15.
Вторая часть состоит из четырех вопросов — в первых двух — 16 и 17 надо выбрать два правильных ответа, а в 18 и 19 соотнести значения или утверждения из правого столбца с левым.
Третья часть — решение задач . В 20 нужно уравнять реакцию и определить коэффициенты, а в 21 решить задачу на расчет.
Четвертая часть — практичная , простая, но нужно быть внимательным и осторожным, как всегда при работе с химией.
Всего отдано работ 140 минут.
Ниже разобраны типовые варианты задач, сопровождаемые необходимой для решения теорией. Все задания тематические — перед каждым заданием есть тема для общего понимания.
М.: 2017. — 144 с.
Сборник содержит 30 типовых вариантов экзаменационных работ по химии и предназначен для подготовки к ЕГЭ в 9 классе. Каждый вариант составлен в полном соответствии с требованиями ЕГЭ по химии, включает задания разных типов и уровни сложности. В конце книги даны ответы для самостоятельной проверки всех заданий. Предлагаемые варианты обучения помогут преподавателю организовать подготовку к итоговой аттестации, а студентам самостоятельно проверить свои знания и готовность к итоговому экзамену.
Формат: pdf
Размер: 2.6 МБ
Смотреть, скачать: drive.google
СОДЕРЖАНИЕ
Предисловие 4
Опция 1 5
Опция 2 9
Опция 3 13
Опция 4 17
Опция 5 21
Опция 6 25
Опция 7 29
Опция 8 33
Опция 9 37
Опция 10 41
Опция 11 45
Опция 12 49
Опция 13 53
Опция 14 57
Опция 15 61
Опция 16 65
Опция 17 69
Опция 18 73
Опция 19 77
Опция 20 81
Опция 21 85
Опция 22 89
Опция 23 93
Опция 24 97
Опция 25 101
Вариант 26 105
Вариант 27 109
Вариант 28 113
Вариант. 29 117
29 117
Вариант 30 121
Вариант 31 (контрольный) 125
Ответы 129
Государственная итоговая аттестация выпускников 9 классов общеобразовательных организаций проводится, как известно, в форме тестирования.
В предлагаемом учебном пособии представлены контрольно-измерительные материалы (КИМ) в виде вариантов экзаменационных работ по химии. Тестовые задания контрольной работы проверяют усвоение обучающимися основного содержания программ по химии в соответствии с плановыми результатами, указанными в ФГОС общего образования. По этим результатам экзаменационная работа (ГИА) включает в себя задания, проверяющие знания и умения по следующим темам:
Периодический закон и Периодическая система химических элементов Д.И. Менделеев;
строение электронных оболочек атомов первых двадцати элементов Периодической таблицы Д.И. Менделеев;
строение вещества, виды химических связей;
основные классы неорганических веществ и их общие химические свойства;
химические реакции, их классификация, условия и признаки реакций;
метода познания веществ и химических реакций.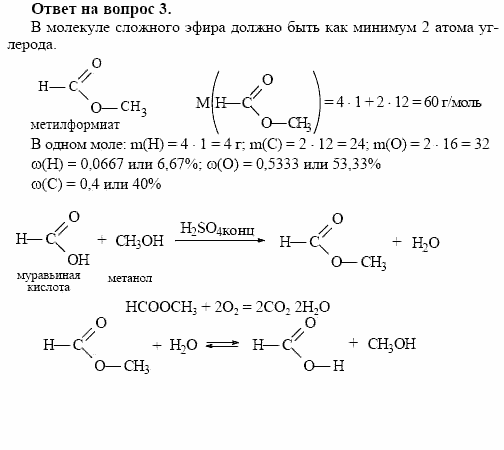
Распределение и идентификация источников тяжелых металлов в бассейне реки Вохчи, подвергшихся воздействию горнодобывающей деятельности (Армения)
На этой странице
АннотацияВведениеМатериалы и методыРезультаты и обсуждениеВыводыКонфликты интересовБлагодарностиСсылкиАвторские праваСтатьи по теме
реальный источник каждого из тяжелых металлов в окружающей среде для оценки уровня загрязнения тяжелыми металлами. Река Вохчи с двумя основными притоками (Гехи и Норашеник) впадает в два горнодобывающих района. Для выявления источников распространения и загрязнения тяжелыми металлами были отобраны пробы воды и донных отложений с восьми точек отбора проб. Результаты статистического анализа по массивам данных за период 2014–2016 гг. показали, что после воздействия дренажных вод и сточных вод горнорудных районов содержание тяжелых металлов в бассейне реки Вохчи резко возросло. Воды реки Вохчи были сильно загрязнены Mn, Co, Cu, Zn, Mo, Cd, Pb. Соотношение содержания металлов сильно изменилось из-за антропогенного воздействия, нарушившего геохимический баланс р. Вохчи. Качество воды только по содержанию тяжелых металлов в истоке реки Вохчи относится к «хорошему» химическому статусу, а в истоках рек Гехи и Норашеник – к «умеренному». Качество воды рек Вохчи и Норашеник резко ухудшается после влияния горнодобывающей деятельности, приобретая «плохой» химический статус. Исследование выявило источники загрязнения каждого металла.
Соотношение содержания металлов сильно изменилось из-за антропогенного воздействия, нарушившего геохимический баланс р. Вохчи. Качество воды только по содержанию тяжелых металлов в истоке реки Вохчи относится к «хорошему» химическому статусу, а в истоках рек Гехи и Норашеник – к «умеренному». Качество воды рек Вохчи и Норашеник резко ухудшается после влияния горнодобывающей деятельности, приобретая «плохой» химический статус. Исследование выявило источники загрязнения каждого металла.
1. Введение
Воздействие добычи полезных ископаемых на водные экосистемы становится все более серьезной проблемой. Добыча полезных ископаемых по своей природе потребляет, отвлекает и серьезно загрязняет водные ресурсы [1–3]. Горно-фрезерные работы вместе с измельчением, обогащением руд и захоронением хвостов являются очевидными источниками загрязнения в поверхностной среде, наряду со сбросом или переливом сточных вод, дождевым или талым стоком, стоком с носка отвалов и дренированием. сброс загрязненных подземных вод в ручьи и родники. Проблемы загрязнения воды, вызванные добычей полезных ископаемых, включают кислые шахтные стоки, загрязнение металлами и повышенный уровень наносов в ручьях [4, 5]. Образование кислых стоков и сброс вод с высокими концентрациями растворенных металлов из шахтных отходов представляют собой экологическую проблему международного масштаба [6–8]. Химическое выщелачивание металлов происходит, когда осадки от дождя или таяния снега проникают через руду или отходы и растворяют или десорбируют металлы из твердого материала. Как следствие, потоки переносят большое количество токсичных микроэлементов, таких как As, Cd, Pb, Zn, Cu, Sb и Se [9].].
Проблемы загрязнения воды, вызванные добычей полезных ископаемых, включают кислые шахтные стоки, загрязнение металлами и повышенный уровень наносов в ручьях [4, 5]. Образование кислых стоков и сброс вод с высокими концентрациями растворенных металлов из шахтных отходов представляют собой экологическую проблему международного масштаба [6–8]. Химическое выщелачивание металлов происходит, когда осадки от дождя или таяния снега проникают через руду или отходы и растворяют или десорбируют металлы из твердого материала. Как следствие, потоки переносят большое количество токсичных микроэлементов, таких как As, Cd, Pb, Zn, Cu, Sb и Se [9].].
Тяжелые металлы представляют собой важный класс загрязняющих веществ, которые могут причинить значительный вред окружающей среде при превышении определенных концентраций [10–12]. Эти элементы могут выщелачиваться в поверхностные или грунтовые воды, поглощаться растениями и могут полупостоянно связываться с компонентами почвы, такими как глина или органические вещества, которые впоследствии влияют на здоровье человека [13]. Попадая в водоем, тяжелые металлы могут нанести вред водным организмам, а за счет процессов химической адсорбции и физического осаждения тяжелые металлы могут накапливаться в донных отложениях водной среды [14]. Содержание тяжелых металлов в поверхностных отложениях, как правило, значительно выше, чем в водоеме, поэтому очень важно исследовать содержание тяжелых металлов в поверхностных отложениях [15, 16].
Попадая в водоем, тяжелые металлы могут нанести вред водным организмам, а за счет процессов химической адсорбции и физического осаждения тяжелые металлы могут накапливаться в донных отложениях водной среды [14]. Содержание тяжелых металлов в поверхностных отложениях, как правило, значительно выше, чем в водоеме, поэтому очень важно исследовать содержание тяжелых металлов в поверхностных отложениях [15, 16].
Тяжелые металлы определяются как металлические элементы, которые имеют относительно высокую плотность по сравнению с водой. При допущении, что тяжесть и токсичность взаимосвязаны, к тяжелым металлам также относятся металлоиды, такие как мышьяк, способные вызывать токсичность при низком уровне воздействия, и неметаллический селен [17].
В Республике Армения (РА) развита горнодобывающая промышленность. Из-за отсутствия надлежащего управления и планирования, а также слабого опыта эксплуатации и обращения с отходами эта отрасль промышленности является одним из основных источников загрязнения воды и окружающей среды в целом тяжелыми металлами (Pb, Cu, Ni , Cd, Mo, As и др. ). Все предыдущие исследования в бассейне реки Вохчи [18–21] выявили повышенные концентрации тяжелых металлов и микроэлементов, таких как As, Cu, Mo, Sb, Cu, Co, Ni и Zn, в поверхностных водах и отложениях. Проблемы загрязнения отмечены в почвах, расположенных вблизи детских садов и школ городов Капан и Каджаран [22, 23].
). Все предыдущие исследования в бассейне реки Вохчи [18–21] выявили повышенные концентрации тяжелых металлов и микроэлементов, таких как As, Cu, Mo, Sb, Cu, Co, Ni и Zn, в поверхностных водах и отложениях. Проблемы загрязнения отмечены в почвах, расположенных вблизи детских садов и школ городов Капан и Каджаран [22, 23].
Однако имеется недостаточная информация о концентрациях и распределении тяжелых металлов и микроэлементов в бассейне реки Вохчи. Таким образом, целью данного исследования было изучение распределения тяжелых металлов (Ti, Fe, Mn, V, Cr, Co, Ni, Cu, Zn, As, Se, Mo, Cd, Sb, Pb) в водах и донных отложениях. реки Вохчи и ее притоков, затронутых горнодобывающей деятельностью; выявить источник каждого из тяжелых металлов в окружающей среде и корреляцию между параметрами, оценить уровень загрязнения тяжелыми металлами; и оценить влияние временной изменчивости концентраций тяжелых металлов.
2. Материалы и методы
2.1. Область исследования
Река Вохчи – левый приток реки Аракс, расположенный на юго-востоке Армении. Истоками реки Вохчи являются горные родники и небольшие озера горы Капутджуг на высоте 3650 м над уровнем моря, расположенные в западно-южной части Армении. Общая длина реки составляет 82 км (в Армении 52 км), а площадь водосборного бассейна составляет 2337 км 2 (в Армении 1240,47 км 2 ). Крупнейшие притоки – Гехи и Норашеник. На своем пути ручей питается грунтовыми водами, дождями и талыми водами и имеет многолетний сток в течение всего года. Среднегодовой расход воды рек Вохчи, Норашеник и Гехи оценивается в 334,3, 69.7 и 135,3 млн м 3 или 10,6, 2,21 и 4,29 м 3 /с соответственно [24].
Истоками реки Вохчи являются горные родники и небольшие озера горы Капутджуг на высоте 3650 м над уровнем моря, расположенные в западно-южной части Армении. Общая длина реки составляет 82 км (в Армении 52 км), а площадь водосборного бассейна составляет 2337 км 2 (в Армении 1240,47 км 2 ). Крупнейшие притоки – Гехи и Норашеник. На своем пути ручей питается грунтовыми водами, дождями и талыми водами и имеет многолетний сток в течение всего года. Среднегодовой расход воды рек Вохчи, Норашеник и Гехи оценивается в 334,3, 69.7 и 135,3 млн м 3 или 10,6, 2,21 и 4,29 м 3 /с соответственно [24].
Река Вохчи протекает через два горнодобывающих района. Одним из них является Зангезурский медно-молибденовый комбинат (ЗММК), расположенный в верхнем течении реки Вохчи на территории города Каджаран, на юго-востоке Армении. ZCMC является крупнейшим открытым рудником в регионе, на котором добывается руда, богатая медью и молибденом, после чего производится два отдельных концентрата меди и молибдена. ZCMC ежегодно производит 21 млн тонн руды (и такое же количество отходов). Помимо основных элементов, в руде присутствует ряд ценных сопутствующих элементов, таких как Pb, Zn, Cd, As, Co и Ni. Шламовые хвосты, 33% которых составляют вода, транспортируются с завода ZCMC на хвостохранилище Арцваник по трубопроводу. Хвостохранилище Арцваника расположено в ущелье одноименной реки. После осаждения шламовых хвостов поверхностные воды хвостохранилища стекают в реку Норашеник. Кроме того, дренажные воды (поверхностные и грунтовые) с карьера также стекают в реку Вохчи на территории города Каджаран.
ZCMC ежегодно производит 21 млн тонн руды (и такое же количество отходов). Помимо основных элементов, в руде присутствует ряд ценных сопутствующих элементов, таких как Pb, Zn, Cd, As, Co и Ni. Шламовые хвосты, 33% которых составляют вода, транспортируются с завода ZCMC на хвостохранилище Арцваник по трубопроводу. Хвостохранилище Арцваника расположено в ущелье одноименной реки. После осаждения шламовых хвостов поверхностные воды хвостохранилища стекают в реку Норашеник. Кроме того, дренажные воды (поверхностные и грунтовые) с карьера также стекают в реку Вохчи на территории города Каджаран.
Второй горнорудный район (Капанский полиметалл) расположен в нижнем течении реки Вохчи, в 1,5 км к востоку от города Капан на юго-востоке Армении. Капанский полиметалл (КПМ) представляет собой полностью механизированный подземный рудник с текущей мощностью около 400 тыс. тонн в год, обычной флотационной обогатительной фабрикой мощностью 750 тыс. тонн в год и различными объектами инфраструктуры. На руднике производится золото-медно-серебряный и цинковый концентрат. Хвосты КПМ сбрасываются в хвостохранилище Гегануш, расположенное в ущелье той же реки. После осаждения шламовых хвостов в дамбе хвостохранилища жидкие хвосты стекают в реку Гегануш, а затем в реку Вохчи. Рядом с городом Капан находится заброшенный рудник Каварт (не принадлежащий КПМ), который считается возможным источником загрязнения металла. Воды Каварта, богатые тяжелыми металлами, по-разному смешиваются с поверхностными и подземными водами.
На руднике производится золото-медно-серебряный и цинковый концентрат. Хвосты КПМ сбрасываются в хвостохранилище Гегануш, расположенное в ущелье той же реки. После осаждения шламовых хвостов в дамбе хвостохранилища жидкие хвосты стекают в реку Гегануш, а затем в реку Вохчи. Рядом с городом Капан находится заброшенный рудник Каварт (не принадлежащий КПМ), который считается возможным источником загрязнения металла. Воды Каварта, богатые тяжелыми металлами, по-разному смешиваются с поверхностными и подземными водами.
2.2. Сбор и анализ проб
Пробы воды и донных отложений были отобраны на 8 пробоотборных участках бассейна реки Вохчи в период 2014–2016 гг. (см. рис. 1, табл. 1). Места отбора проб были выбраны таким образом, чтобы охватить весь ручей от истока до слияния с двумя районами добычи. Участки отбора проб были разделены на две группы: участки отбора проб 1, 5 и 7 расположены в истоках рек, испытывающих минимальное антропогенное воздействие и представляющих собой фоновое состояние речного бассейна; пробоотборные площадки 2, 4 и 6 несут влияние горнодобывающей деятельности и неочищенных сточных вод городов.
Пробы воды отбирались ежемесячно. Частота отбора проб в истоках рек Вохчи (WS-1), Гехи (WS-7) и Арцваник (WS-5) была меньше по сравнению с другими участками. Пробы осадков отбирали в летний период в июне и августе.
Сбор и обработка проб воды и донных отложений проводились в соответствии со стандартной методологией (ISO 5667-3, -6 и -12). Пробы воды отбирали в полипропиленовые пластиковые бутылки. Пробы воды во время отбора подкисляли азотной кислотой. Для консервации проб воды использовали бидистиллированную азотную кислоту. Пробы хранили при температуре 4°С и доставляли в лабораторию.
Образцы отложений были отобраны с использованием соответствующего пробоотборника. Образцы доставляли в лабораторию, сушили на воздухе в лаборатории при комнатной температуре до тех пор, пока не регистрировался стабильный вес, а затем просеивали через сито с размером ячеек 2 мм. Затем образцы высушенных отложений помещали в сосуд для разложения с 12 мл раствора HNO 3 /HF (3 : 1 об/об) и подвергали разложению в системе микроволнового разложения (Speedwave MWS-3, Berghof, GmbH).
Масс-спектрометр с индуктивно связанной плазмой (ICP-MS, PerkinElmer ELAN 9000, США) использовали для определения содержания Ti, Fe, Mn, V, Cr, Co, Ni, Cu, Zn, As, Se, Mo, Cd, Sb и Pb в пробах донных отложений и воды.
Стандартные кривые были получены с использованием отдельных растворов, содержащих известные концентрации каждого тяжелого металла (PerkinElmer, калибровочный стандарт атомной спектроскопии Pure Grade, США), разбавленных деионизированной водой. Для процедуры калибровки использовали одноэлементные и многоэлементные калибровочные стандартные растворы. Для приготовления стандартных растворов использовали деионизированную воду (18,2 МОм/см), очищенную на Thermo Scientific Barnstead Easypure II, и газообразный аргон чистотой 9Было использовано 9,998%.
Фоновые помехи от газов плазмы, вовлечения воздуха и растворителя были скорректированы путем вычитания холостых сигналов реагентов. Изобарические спектральные интерференции, возникающие из-за многоатомных ионов, включающих матричные элементы образца, устраненные путем выбора подходящего изотопа, были скорректированы или уменьшены путем применения уравнений коррекции интерференции. Для корректировки матричного эффекта и повышения точности использовался внутренний стандарт 115 In.
Для корректировки матричного эффекта и повышения точности использовался внутренний стандарт 115 In.
2.3. Анализ данных
Данные были проанализированы с использованием описательной статистики: сообщаются максимум, минимум, среднее значение, стандартное отклонение, коэффициент вариации, эксцесс и асимметрия. Для визуализации эксцесса и асимметрии использовался график «коробка с усами». Box-and-Whisker предоставляет мощный инструмент для анализа паттернов, который помогает оценить источники изменений, а также назначить параметры, связанные с этими источниками. Корреляционный анализ Пирсона использовался для определения наличия линейной связи между микроэлементами. На основании значения коэффициента корреляции «» корреляцию между двумя параметрами можно назвать положительной или отрицательной. Анализы проводились с использованием SPSS 19.0 (IBM, Нью-Йорк, США).
Оценка уровня загрязнения тяжелыми металлами реки Вохчи проводилась на основании национальных стандартов качества воды [25]. Согласно этим стандартам качество воды классифицируется на 5 классов: «отличное» (I класс), «хорошее» (II класс), «умеренное» (III класс), «плохое» (IV класс), «плохое» ( V класс). Система классификации качества воды основана на фоновых концентрациях тяжелых металлов для каждого участка управления водным бассейном, и первый класс системы соответствует фоновой концентрации. Схема классификации приведена в табл. 2.
Согласно этим стандартам качество воды классифицируется на 5 классов: «отличное» (I класс), «хорошее» (II класс), «умеренное» (III класс), «плохое» (IV класс), «плохое» ( V класс). Система классификации качества воды основана на фоновых концентрациях тяжелых металлов для каждого участка управления водным бассейном, и первый класс системы соответствует фоновой концентрации. Схема классификации приведена в табл. 2.
Поскольку в Армении не существует установленных национальных рекомендаций по качеству донных отложений, результаты по тяжелым металлам в донных отложениях сравнивались с Канадскими временными рекомендациями по качеству донных отложений (ISQG), предложенными Канадскими рекомендациями по качеству донных отложений для защиты водных организмов [26]. .
3. Результаты и обсуждение
3.1. Тяжелые металлы в водах реки Вохчи и ее притоков
Данные в таблице 3 представляют собой сводку описательной статистики тяжелых металлов в водах реки Вохчи и ее притоков. Высокий CV означает, что измеренные концентрации всех металлов различались между станциями (; ANOVA).
Высокий CV означает, что измеренные концентрации всех металлов различались между станциями (; ANOVA).
Пространственное распределение некоторых тяжелых металлов в водах рек Вохчи, Норашеник и Гехи было проанализировано в виде графиков типа «ящик с усами» (см. рис. 2).
Они отображают пакеты данных с пятью значениями, используемыми для описания набора данных. Длина прямоугольника представляет межквартильный диапазон, который содержит 50% значений, а толстая горизонтальная линия внутри прямоугольника указывает медиану. «Усы» — это линии, идущие от прямоугольника к самым высоким и самым низким значениям.
Модель пространственного распределения оказалась мощным инструментом для выявления очагов загрязнения и возможных источников тяжелых металлов. Сопоставление содержания тяжелых металлов в истоках рек и других объектах позволяет выделить геологическую и антропогенную природу загрязняющих веществ.
Наибольшее содержание Cu в водах р. Вохчи и ее притоков (медианное значение 71,3 μ г/л) (см. рис. 2) наблюдалось на СС-4, примерно в 30–60 раз выше по сравнению с фоновыми участками СС -1, WS-5 и WS-7 (см. карту, рис. 1). Концентрация Cu также на порядок выше по сравнению с WS-3. Это явление говорит о том, что воды реки Вохчи загрязнены Cu на территории города Капан, а источником загрязнения Cu являются сточные воды КПМ. Существует также вероятность диффузного загрязнения Cu из заброшенного рудника Каварт. Другим источником загрязнения Cu реки Вохчи, хотя и не таким большим, как сточные воды КПМ, является ЗХМК с его хвостохранилищем Арцваник, о чем свидетельствует увеличение концентрации Cu после города Каджаран и в устье Норашеник по сравнению с источником рек Вохчи (WS-1) и Норашеник (WS-5). Колебания концентрации Cu вокруг среднего значения также выше из-за неконтролируемого точечного и неточечного загрязнения.
рис. 2) наблюдалось на СС-4, примерно в 30–60 раз выше по сравнению с фоновыми участками СС -1, WS-5 и WS-7 (см. карту, рис. 1). Концентрация Cu также на порядок выше по сравнению с WS-3. Это явление говорит о том, что воды реки Вохчи загрязнены Cu на территории города Капан, а источником загрязнения Cu являются сточные воды КПМ. Существует также вероятность диффузного загрязнения Cu из заброшенного рудника Каварт. Другим источником загрязнения Cu реки Вохчи, хотя и не таким большим, как сточные воды КПМ, является ЗХМК с его хвостохранилищем Арцваник, о чем свидетельствует увеличение концентрации Cu после города Каджаран и в устье Норашеник по сравнению с источником рек Вохчи (WS-1) и Норашеник (WS-5). Колебания концентрации Cu вокруг среднего значения также выше из-за неконтролируемого точечного и неточечного загрязнения.
Модели пространственного распределения Co и Fe аналогичны Cu с наблюдаемыми самыми высокими значениями концентрации в WS-4 (см. Рисунок 2 и Таблицу 3).
Средние значения Zn и Mn были значительно выше () в WS-6 и WS-4 (см. рис. 2). Они были примерно на два порядка выше самых высоких концентраций Zn и Mn, измеренных на других участках, которые связаны с поступлением сточных вод как с Арцваникского хвостохранилища, так и с КПМ. Концентрации Zn и Mn в ПС-6 (устье р. Норашеник) после воздействия сточных вод Арцваникского хвостохранилища увеличиваются 99 и 55 раз соответственно. Диапазон изменения медианного значения также выше.
рис. 2). Они были примерно на два порядка выше самых высоких концентраций Zn и Mn, измеренных на других участках, которые связаны с поступлением сточных вод как с Арцваникского хвостохранилища, так и с КПМ. Концентрации Zn и Mn в ПС-6 (устье р. Норашеник) после воздействия сточных вод Арцваникского хвостохранилища увеличиваются 99 и 55 раз соответственно. Диапазон изменения медианного значения также выше.
В случае Sb, Mo, Se, As и Cd медианные значения были значительно выше в WS-6, 4,78, 340,1, 4,0, 4,0 и 1,93 мк г/л (), соответственно (см. рис. 2 и табл. 3). Увеличение концентрации между WS-6 и WS-5 составляет около 2-3 порядков. Это связано с притоком сточных вод Арцваникского хвостохранилища. Несмотря на наблюдаемые более высокие концентрации Sb и Mo в устье Норашеника (WS-6), воздействие на реку Вохчи не столь велико из-за различий в количестве воды в реках Норашеник и Вохчи (см. раздел 2.1). Данная закономерность свидетельствует о том, что сточные воды КПМ не загрязнены Sb и Mo. Повышение концентраций Sb, Cd и Mo наблюдается также на ПС-2 за счет точечного и неточечного загрязнения ЗКМК. Концентрация Cd увеличивается на ПС-4 из-за воздействия сточных вод КПМ.
Повышение концентраций Sb, Cd и Mo наблюдается также на ПС-2 за счет точечного и неточечного загрязнения ЗКМК. Концентрация Cd увеличивается на ПС-4 из-за воздействия сточных вод КПМ.
Характер пространственного распределения Pb имеет сходство с Cd (см. табл. 3). Изменение средней концентрации Pb в пределах участков отбора проб составляет более 80%, что указывает на большую разницу между концентрациями фонового и подверженного воздействию участков. Как видно из данных (таблица 3), содержание свинца в реке Вохчи увеличилось из-за воздействия сточных вод ЗКМК и КПМ.
Изменчивость средних концентраций Cr, Ni и Ti между точками отбора проб составляет 37%, 49% и 41% соответственно. Небольшое увеличение содержания Cr и Ti наблюдалось только на WS-2 (0,97 и 5,05 мк г/л) (рис. 2). Концентрация Ni незначительно возрастает на ПС-2 и ПС-6.
Характер пространственного распределения V отличается от других металлов. Под влиянием ZCMC наблюдалось небольшое увеличение концентрации V в WS-2, которое значительно ниже, чем концентрация, наблюдаемая в WS-5. Содержание нескольких тяжелых металлов, таких как Ti, Cr, Co, Ni, Sb и Pb, выше на ПС-5 по сравнению с двумя другими фоновыми участками (ПС-1 и ПС-7).
Содержание нескольких тяжелых металлов, таких как Ti, Cr, Co, Ni, Sb и Pb, выше на ПС-5 по сравнению с двумя другими фоновыми участками (ПС-1 и ПС-7).
В целом в реке Норашеник резко возросли концентрации Mn, Mo, Zn, Cd, Sb под влиянием сточных вод хвостохранилища Арцваник. В реке Гехи наблюдалось небольшое увеличение значений концентраций Mn, As, Sb и Pb.
Для исследования изменчивости концентраций в период отбора проб (2014–2016 гг.) использовали коэффициент вариации (КВ). Наиболее сезонно изменчивыми металлами являются Pb, Fe и Se (см. табл. 2). Значения VC для Pb превышали 80 % (86–136 %) на всех участках отбора проб, кроме ПС-4. На фоновых участках, за исключением WS-7, значения VC составляют менее 80% (кроме Se и Pb), что свидетельствует о меньшей изменчивости содержания тяжелых металлов на фоновых участках. В WS-7 переменными металлами (CV > 80%) являются Fe, Mn, Cr и Pb. Наиболее высокие значения в течение года наблюдались с марта по май и частично с октября по ноябрь. Содержание тяжелых металлов увеличивается весной из-за таяния снега и осадков в водосборе. Источником неточечного загрязнения тяжелыми металлами считаются сточные воды с горнорудной территории и шахтный дренаж.
Содержание тяжелых металлов увеличивается весной из-за таяния снега и осадков в водосборе. Источником неточечного загрязнения тяжелыми металлами считаются сточные воды с горнорудной территории и шахтный дренаж.
Чтобы различить источники загрязнения, тяжелые металлы также были проанализированы с помощью корреляции Пирсона. Корреляционный анализ был проведен для наблюдаемых 15 тяжелых металлов по данным за период 2014–2016 гг. (см. табл. 4). Учитывалась только сильная и положительная (> 0,7) корреляция между металлами. Среди металлов единственным некоррелированным металлом является Ni.
На площадке 2 увеличивается количество коррелируемых параметров и значения коэффициента корреляции. Сильная корреляция была обнаружена между 9металлы (Ti, V, Co, Cu, As, Mo, Cd, Pb, Fe). После добычи и переработки молибдена и меди изменился состав речной воды. Коррелирующие металлы связаны с составом местных минералов: молибдена, халькопирита, магнетита, пирита.
На участке 3 сильная корреляция наблюдалась для 5 пар. На участке 4 коэффициенты корреляции были снижены с 0,95 до 0,70 среди 13 пар. Высокая корреляция указывает на то, что эти элементы имеют одни и те же искусственные источники.
На участке 4 коэффициенты корреляции были снижены с 0,95 до 0,70 среди 13 пар. Высокая корреляция указывает на то, что эти элементы имеют одни и те же искусственные источники.
В истоке реки Норашеник (WS-5) сильная корреляция наблюдалась только между 3 металлами (Fe, Mn и Ti). Эти металлы являются основными компонентами нескольких распространенных минералов и горных пород. На участке 6 увеличивается количество коррелируемых параметров и значения коэффициента корреляции. Корреляция была обнаружена среди 8 пар, а коэффициенты корреляции были изменены с 0,76 до 0,7.
На участке 7 коэффициенты корреляции снижены с 0,87 до 0,70 среди 12 пар. Хотя ЗС-7 считается фоновым участком из коррелированных пар, очевидно, что антропогенное воздействие существует. Наиболее коррелированные пары наблюдались на WS-8. На участке 8 коэффициенты корреляции снижены с 0,9 до3 до 0,70. Это указывает на то, что эти пары металлов, вероятно, произошли из одних и тех же источников.
3.2. Пространственное распределение тяжелых металлов в донных отложениях
Результаты анализа тяжелых металлов в донных отложениях рек Вохчи, Гехи и Норашеник (см. табл. 5) показали увеличение концентрации тяжелых металлов в донных отложениях в нижнем течении р. Каджаран (СС-2). ), за исключением Ti, Mn и Fe, по сравнению с СС-1 (исток р. Вохчи), связанной с дренированием горнорудной территории ЗКМК. Наибольшие концентрации Cu, Zn, Mo и Pb наблюдались на ПС-2 и ПС-3. На СС-1 среднее содержание металлов следует порядку Fe > Ti > Mn > Cu > Zn > V > Mo > Pb > Ni > Cr > As > Co > Cd > Sb. На СС-2 среднее содержание металлов следует порядку Fe > Ti > Cu > Mn > Mo > Zn > V > Pb > Ni > Cr > As > Co > Sb > Cd. Несмотря на увеличение содержания металлов на СС-2, порядок значений средних концентраций металлов остается практически прежним.
табл. 5) показали увеличение концентрации тяжелых металлов в донных отложениях в нижнем течении р. Каджаран (СС-2). ), за исключением Ti, Mn и Fe, по сравнению с СС-1 (исток р. Вохчи), связанной с дренированием горнорудной территории ЗКМК. Наибольшие концентрации Cu, Zn, Mo и Pb наблюдались на ПС-2 и ПС-3. На СС-1 среднее содержание металлов следует порядку Fe > Ti > Mn > Cu > Zn > V > Mo > Pb > Ni > Cr > As > Co > Cd > Sb. На СС-2 среднее содержание металлов следует порядку Fe > Ti > Cu > Mn > Mo > Zn > V > Pb > Ni > Cr > As > Co > Sb > Cd. Несмотря на увеличение содержания металлов на СС-2, порядок значений средних концентраций металлов остается практически прежним.
На СУ-3 Fe, Ti, V, As и Sb накапливались в осадке, что привело к самой высокой концентрации этих металлов во всем речном бассейне.
Донные отложения реки Норашеник загрязнены тяжелыми металлами из-за поступающих сточных вод хвостохранилища Арцваник. Это видно из сравнения содержания тяжелых металлов в отложениях УС-5 (исток р. Норашеник) и УС-6 (устье р. Норашеник). Единственное отличие наблюдалось на СС-3, где содержание металлов необъяснимо велико. Пространственное распределение металлов в отложениях в целом аналогично распределению воды. Как показали результаты, значения концентраций Mo, Sb, Cd, Cu и Fe в донных отложениях устья р. Норашеник (СУ-6) резко возросли. Небольшой рост концентраций наблюдался в случае Ti, V, Co, Zn, As и Pb. В случае Cr и Ni, наоборот, концентрации уменьшались.
Норашеник) и УС-6 (устье р. Норашеник). Единственное отличие наблюдалось на СС-3, где содержание металлов необъяснимо велико. Пространственное распределение металлов в отложениях в целом аналогично распределению воды. Как показали результаты, значения концентраций Mo, Sb, Cd, Cu и Fe в донных отложениях устья р. Норашеник (СУ-6) резко возросли. Небольшой рост концентраций наблюдался в случае Ti, V, Co, Zn, As и Pb. В случае Cr и Ni, наоборот, концентрации уменьшались.
Характер распределения Mn показал, что концентрация в осадках выше только на ПС-1 и ниже на ПС-4. На остальных участках диапазон концентраций Mn не изменился, что свидетельствует о том, что распределение Mn в отложениях не связано напрямую с добычей полезных ископаемых.
Концентрации Cu и As в отложениях превышали ISQG на всех участках, кроме СУ-5. Концентрации Cd превышали ISQG в отложениях ПС-4 и ПС-6. Примечательно, что концентрация кадмия превышала соответствующий ISQG только в отложениях СС-3.
3.
 3. Взаимосвязь содержания тяжелых металлов в воде и донных отложениях
3. Взаимосвязь содержания тяжелых металлов в воде и донных отложенияхВоды и донные отложения, окружающие район добычи, несут основную тяжесть промышленных сбросов и нарушают природный баланс окружающей среды. Для выявления изменения природного химического состава тяжелых металлов в воде и донных отложениях в результате ведения горных работ оценивали соотношение тяжелых металлов в воде и донных отложениях и корреляцию между соотношением тяжелых металлов в воде и донных отложениях.
В верховьях р. Вохчи (WS-1) медиана отношения Cu/Zn в пробах воды фоновых участков варьировала от 0,8 до 1,6. Затем после ЗКМК отношение Cu/Zn составило 3,5, а после г. Капан снова 1, несмотря на резкий рост Cu и Zn. В пробах донных отложений верхней части р. Вохчи отношение Cu/Zn равнялось 3. После ЗКМК отношение увеличилось в той же степени и составило 6–9..
Соотношение Mo/Zn в воде точек отбора проб 1 и 5 составило 1,5 и 1,9 соответственно. Затем, после воздействия ЗКМК (ниже г. Каджаран) отношение Mo/Zn составило 21,5. Из-за неэффективной переработки большое количество Мо остается в перерабатываемых породах и попадает в воды.
Из-за неэффективной переработки большое количество Мо остается в перерабатываемых породах и попадает в воды.
Отношения Ti/V, Ti/Cr, V/Cr и Ti/Ni незначительно изменились после воздействия ZCMC в водах рек Вохчи и Норашеник.
Соотношение Fe/Al в воде точек отбора проб 1, 5 и 7 составило 2,5, 2,9и 2,7 соответственно. После воздействия горных работ природный состав изменился в пределах 1,2–1,9.
Отношение Mo/Ti увеличилось до 6,8 в верхней части (участок 1), которое увеличилось до 13 после г. Каджаран, а резкий рост наблюдался после г. Капан, около 28 в воде реки. Отношение Pb/Cd увеличилось с 1,3 до 1,7 после г. Каджаран, а затем наблюдалось медленное снижение до г. Капан, достигнув минимальных значений после ЗКМК, что свидетельствует о содержании в отходах предприятия большого количества токсичных металлов. За счет диффузии в реку попадают обильные отходы и хвосты тяжелых металлов, становясь источниками загрязнения. В процессе добычи нарушается пространственное распределение концентраций металлов.
3.4. Оценка загрязнения тяжелыми металлами бассейна реки Вохчи
Оценка содержания тяжелых металлов проводилась на основании средних значений концентраций за период 2014–2016 гг. (см. табл. 3). Средние значения тяжелых металлов сравниваются с национальными стандартами качества воды (см. Раздел 2.3) и производным классом качества. Результаты оценки представлены в табл. 6. По результатам (табл. 6) в верховьях р. Вохчи (ПС-1) качество воды соответствует «хорошему». Затем в реке, принимающей дренажные сточные воды ЗКМК, качество воды постепенно ухудшилось до «плохого» класса ниже Каджарана. «Плохое» качество воды на участке вниз по течению от Каджарана (участок 2) было связано с высокой концентрацией Mo. Затем, после смешения с рекой Гехи, качество воды реки Вохчи стало улучшаться и качество воды было классифицировано как «умеренное». (WS-3), связанный с повышенным содержанием Mo. После воздействия КПМ и перемешивания р. Норашеник качество воды р. Вохчи ухудшилось до «плохого» качества из-за повышенного содержания Mn и Co. Качество воды притока Гехи было классифицировано как «умеренное» по содержанию железа. Качество воды притока Норашеник было классифицировано как «плохое», связанное с Mn, Mo и Sb.
Качество воды притока Гехи было классифицировано как «умеренное» по содержанию железа. Качество воды притока Норашеник было классифицировано как «плохое», связанное с Mn, Mo и Sb.
4. Выводы
Наши результаты показали высокую степень загрязнения реки Вохчи горнодобывающей промышленностью. Основными источниками загрязнения тяжелыми металлами являются горнодобывающие районы ЗГМК и КПМ с их фильтратом рудоперерабатывающего центра, действующими хвостохранилищами, заброшенным рудником и другими предприятиями, расположенными в бассейне реки Вохчи. Качество воды после воздействия шахтных вод ухудшается из «хорошего» в «плохое» состояние.
Исследование выявило источники загрязнения каждого металла. ЗКМК своими сточными и рассеянными водами загрязняет реку Вохчи в основном Mo и Sb. Содержание остальных металлов незначительно (менее чем в 10 раз) увеличивается после воздействия ЗКМЦ. Сточные воды хвостохранилища Арцваник загрязнили реку Норашеник, а затем реку Вохчи, в основном Mn, Zn, Se, Mo, Cd, As и Sb. КПМ и богатый горнодобывающий район Каварт были в основном ответственны за повышенные концентрации меди, цинка и кобальта в реке Вохчи (ниже города Капан). Как ZCMC, так и KPM были ответственны за увеличение концентраций Fe, Mn, Zn, Pb и Cd в реке Вохчи (ниже города Капан). Концентрации Ti, V, Cr, Ni и As в р. Вохчи изменились незначительно. Высокие концентрации V в водах истока реки Норашеник обусловлены в основном природными источниками, что свидетельствует об особенностях геогидрохимии реки Норашеник.
КПМ и богатый горнодобывающий район Каварт были в основном ответственны за повышенные концентрации меди, цинка и кобальта в реке Вохчи (ниже города Капан). Как ZCMC, так и KPM были ответственны за увеличение концентраций Fe, Mn, Zn, Pb и Cd в реке Вохчи (ниже города Капан). Концентрации Ti, V, Cr, Ni и As в р. Вохчи изменились незначительно. Высокие концентрации V в водах истока реки Норашеник обусловлены в основном природными источниками, что свидетельствует об особенностях геогидрохимии реки Норашеник.
Пространственное распределение металлов в отложениях в целом аналогично распределению воды. Единственное отличие наблюдалось на СС-3, где содержание металлов необъяснимо велико. Значения концентраций Mo, Sb, Cd, Cu, Fe в отложениях устья р. Норашеник резко возросли. Небольшой рост концентраций наблюдался в случае Ti, V, Co, Zn, As и Pb. В случае Cr и Ni, наоборот, концентрации уменьшались.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают благодарность Центру экологического мониторинга и информации, государственной неправительственной организации при Министерстве охраны природы Республики Армения, за помощь в проведении исследования и доступ к базе данных мониторинга качества воды, а также НПО Civil Voice (Армения) за техническую помощь в отборе проб отложений.
Каталожные номера
П. Капуста и Л. Собчик, «Влияние загрязнения тяжелыми металлами в результате горнодобывающей и плавильной промышленности на сообщества энхитреид при различном землепользовании и почвенных условиях», Science of the Total Environment , vol. 536, стр. 517–526, 2015.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Лян, Ю. Ван, Х. Го, Л. Бо, С. Чжан, Ю. Бай, «Оценка загрязнения и идентификация источников тяжелых металлов в отложениях озера Чаншоу в рукав водохранилища «Три ущелья», Науки об окружающей среде и исследования загрязнения , vol.
 22, нет. 20, стр. 16067–16076, 2015.
22, нет. 20, стр. 16067–16076, 2015.Посмотреть по адресу:
Сайт издателя | Google Scholar
О. Срачек, Б. Кржибек, М. Михалевич и др., «Загрязнение поверхностных вод и отложений дренажной системы реки Кафуэ в районе Коппербелт, Замбия, связанное с добычей полезных ископаемых: пример высокой нейтрализации система пропускной способности», Journal of Geochemical Exploration , vol. 112, стр. 174–188, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J. J. Marcus, Mining Environmental Handbook: Effects of Mining on the Environment and American Environmental Controls on Mining , Imperial College Press, London, UK, 1997.
M. M. Islamic Ali, M. S. Alia, M. S. Alia и М. З. Рахманда, «Предварительная оценка содержания тяжелых металлов в воде и отложениях реки Карнапхули», , Бангладеш, Экологические нанотехнологии, управление мониторингом , том.
 5, стр. 27–35, 2016 г.
5, стр. 27–35, 2016 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Р. Абрахам и Т. Б. Сьюзан, «Загрязнение воды тяжелыми металлами и микроэлементами на медном руднике Килембе и хвостохранилищах в Западной Уганде; влияние на качество воды для бытовых нужд», Chemosphere , vol. 169, стр. 281–287, 2017.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Олиас, Х. М. Ньето, А. М. Сармьенто, Х. К. Серон и К. Р. Кановас, «Сезонные колебания качества воды в реке, затронутой кислыми шахтными стоками: река Одиэль (Юго-Западная Испания)», Наука об окружающей среде в целом , vol. 333, нет. 1–3, стр. 267–281, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Э. Динелли, Ф.
 Луккини, М. Фаббри и Г. Кортеччи, «Распределение металлов и экологические проблемы, связанные с окислением сульфидов в районе медного рудника Либиола (Лигурийские Апеннины, Италия)», Journal of Геохимическая разведка , вып. 74, нет. 1–3, стр. 141–152, 2001.
Луккини, М. Фаббри и Г. Кортеччи, «Распределение металлов и экологические проблемы, связанные с окислением сульфидов в районе медного рудника Либиола (Лигурийские Апеннины, Италия)», Journal of Геохимическая разведка , вып. 74, нет. 1–3, стр. 141–152, 2001.Посмотреть по адресу:
Сайт издателя | Академия Google
W. Tang, S. Duan, B. Shan et al., «Концентрации, диффузионные потоки и токсичность тяжелых металлов в поровой воде реки Фуян, бассейн Хайхэ», Ecotoxicology and Environmental Safety , vol. 127, стр. 80–86, 2016.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Sierra, O. Ruíz-Barzola, M. Menéndez, JR Demey и JL Vicente-Villardón, «Изучение геохимических взаимодействий в поверхностных речных отложениях в районе кустарной добычи с помощью Canonical (MANOVA) — Бисюжет», Журнал геохимических исследований , том.
 175, стр. 72–81, 2017.
175, стр. 72–81, 2017.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Kabata-Pendias and B. Szteke, A Микроэлементы в абиотической и биотической среде , Taylor & Francis Group, 2015.
Z. Zhang, L. Juying, and Z. Mamat , «Идентификация источников и оценка загрязнения тяжелыми металлами в поверхностных отложениях реки Бортала, Северо-Западный Китай», Экотоксикология и экологическая безопасность , том. 126, стр. 94–101, 2016.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Гомес-Альварес, Д. Меса-Фигероа, А. И. Вильяльба-Атондо, Х. Л. Валенсуэла-Гарсия, Х. Рамирес-Эрнандес и Х. Альмендарис-Тапия, «Оценка потенциального загрязнения от хвостохранилищ в река Сан-Педро (1993-2005 гг.), граница Мексики и США», Экологическая геология , том.
 57, нет. 7, стр. 1469–1479, 2009.
57, нет. 7, стр. 1469–1479, 2009.Посмотреть по адресу:
Сайт издателя | Академия Google
C. Gao, Q. Lin, K. Bao et al., «Исторические изменения и недавний экологический риск тяжелых металлов в отложениях водно-болотных угодий вдоль реки Усули, Северо-Восточный Китай», Environmental Earth Sciences , vol. 72, нет. 11, стр. 4345–4355, 2014.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Сундарай С. К., Наяк Б. Б., Лин С. и Бхатта Д. «Геохимическое определение и оценка риска тяжелых металлов в отложениях речных устьев — тематическое исследование: бассейн Маханади, Индия», Журнал опасных материалов , том. 186, нет. 2–3, стр. 1837–1846, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J.
 Wang, R. Liu, P. Zhang, W. Yu, Z. Shen, and C. Feng, «Пространственные вариации, экологическая оценка и идентификация источников тяжелых металлов в отложениях устья реки Янцзы». », Бюллетень о загрязнении морской среды , том. 87, нет. 1, стр. 364–373, 2014.
Wang, R. Liu, P. Zhang, W. Yu, Z. Shen, and C. Feng, «Пространственные вариации, экологическая оценка и идентификация источников тяжелых металлов в отложениях устья реки Янцзы». », Бюллетень о загрязнении морской среды , том. 87, нет. 1, стр. 364–373, 2014.Посмотреть по адресу:
Сайт издателя | Академия Google
P.B. Tchounwou, C.G. Yedjou, A.K. Patlolla и D.J. Sutton, «Токсичность тяжелых металлов и окружающая среда», в Molecular, Clinical and Environmental Toxicology , vol. 101, стр. 133–164, Springer, Базель, Швейцария, 2012 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Вардумян Л., Вардумян Э., Пирумян Г., Минасян С. «Оценка качества воды бассейна южных рек в Республике Армения с использованием метода главных компонент», Известия Инженерной академии Армении , том.
 8, нет. 1, pp. с тяжелыми металлами и алюминием», Известия ЕГУ, Химия и биология , вып. 3, нет. 226, стр. 50–53, 2011.
8, нет. 1, pp. с тяжелыми металлами и алюминием», Известия ЕГУ, Химия и биология , вып. 3, нет. 226, стр. 50–53, 2011.Посмотреть по адресу:
Google Scholar
Куркджян Р., «Загрязнение металлами в Республике Армения», Journal of Environmental Management , vol. 25, нет. 5, стр. 477–483, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Беляева О.В. Влияние горнодобывающих предприятий г. Капана на прилегающие агроэкосистемы // Электронный журнал естественных наук. . Вып. 2, нет. 19, стр. 26–30, 2012 г. (китайский).
Посмотреть по адресу:
Google Scholar
«Американский центр ООН по ответственной добыче полезных ископаемых», 2017 г., http://crm.aua.am/files/2016/12/Schools-and-Kindergartens-in-Kapan_Final-Report-Eng-Dec-2-2016 .
 pdf.
pdf.Посмотреть по адресу:
Google Scholar
«Центр ответственной добычи полезных ископаемых AUA», 2017 г., http://crm.aua.am/files/2016/12/Schools-and-Kindergartens-in-Kajaran_Artsvanik_Final-Report -Eng-Dec-2-2016.pdf.
Посмотреть по адресу:
Google Scholar
План управления южным речным бассейном (ПУБР) Ресурсный документ. USAID, Программа «Чистая энергия и вода», 2015 г.
«Постановление Правительства РА» «Об определении нормативов качества воды для каждой зоны управления водным бассейном с учетом особенностей территории» 75-Н, 2011.
CCME, «Канадские рекомендации по качеству донных отложений для защиты водных организмов: сводные таблицы. Обновленные канадские рекомендации по качеству окружающей среды. Ресурсный документ», Тех. Представитель Совета министров окружающей среды Канады, 1999, http://www.
 ccme.ca/en/resources/canadian_environmental_quality_guidelines.
ccme.ca/en/resources/canadian_environmental_quality_guidelines.Посмотреть по адресу:
Google Scholar
Copyright
Copyright © 2018 А. В. Габриелян и др. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
ИСПОЛЬЗОВАНИЕ ИГРОВОЙ ТЕХНОЛОГИИ ПРИ ИЗУЧЕНИИ ХИМИИ
Выпуск
Том. 7 № 6 (2019): ноябрь
Авторы сохраняют за собой авторские права без каких-либо ограничений на свои опубликованные материалы в этом журнале. HSSR является зеленым журналом SHERPA ROMEO.
Лицензия на публикацию
Это статья с открытым доступом, распространяемая на условиях
https://doi. org/10.18510/hssr.2019.76142
org/10.18510/hssr.2019.76142
Farid Dgamaletdinovich Yambyshev
Kazan Federal University, Russia
Dilyara Lenarovna Derbisheva
Kazan Federal University, Russia
Adelina Vladimorovna Halaman
Казанский федеральный университет, Россия
Автор, ответственный(ые) за переписку: Ямбышев Фарид Джамалетдинович
Гуманитарные и социальные науки Обзоры ,
Том. 7 № 6 (2019): ноябрь
- Аннотация
- Укажите
- Каталожные номера
- Информация об авторах
Реферат
Цели: В статье рассмотрено влияние игрового метода обучения на формирование интереса у старшеклассников к углубленному изучению предмета химии. Игровые технологии в обучении используются давно, но их значение в инактивации познавательной деятельности учащихся не теряет актуальности. С помощью дидактической игры можно с успехом реализовать все ведущие функции обучения: воспитательную, воспитывающую и развивающую.
Игровые технологии в обучении используются давно, но их значение в инактивации познавательной деятельности учащихся не теряет актуальности. С помощью дидактической игры можно с успехом реализовать все ведущие функции обучения: воспитательную, воспитывающую и развивающую.
Методика : Авторы описывают сценарий урока-игры по химии на тему «Углеводороды» для учащихся 10-х классов, делают анализ результатов выполнения заданий на всех этапах игры и дают критерии оценок .
Результаты : По итогам анкетирования, проведенного среди школьников, сделан вывод, что благодаря игровому методу на уроке удалось повысить интерес к предмету, уровень усвоения материала, осуществлять активную ориентацию на приобретение знаний и мотивацию успеха. Во время игры в классе царит творческая атмосфера, благодаря чему такие уроки способствуют максимальной реализации способностей каждого ученика и развивают навыки группового взаимодействия. Дидактические игры можно использовать на всех этапах процесса обучения: при изучении нового предмета, закреплении полученных знаний, при контроле результатов.
Значение/применение : Внедрение новых методов в исследование может помочь аудитории добиться процветания. Теория игр может быть практически неэффективным изучением химии.
Новизна/Оригинальность : Исследование влияния дидактических игр на формирование познавательной активности учащихся проводилось в форме квеста с темой, посвященной 190-летию со дня рождения А.М. Бутлеров.
Ключевые слова
Образовательные технологии
Ямбышев Дгамалетдинович Ф., Дербишева Ленаровна Д., Халаман Владимировна А. (2019). ИСПОЛЬЗОВАНИЕ ИГРОВОЙ ТЕХНОЛОГИИ В ИЗУЧЕНИИ ХИМИИ. Обзоры гуманитарных и социальных наук , 7 (6), 954-961. https://doi.org/10.18510/hssr.2019.76142
Скачать цитату
Сноска/Zotero/Mendeley (RIS)
БибТекс
Ссылки
Подробнее
Ссылки
Афонина, Дж. В., и Ханова, Т. Г. (2017). Использование игровых презентаций как средства активизации судебных испытаний предметных интересов дошкольников. Перспективы науки и образования. Международный научный электронный журнал, 6(30), 52-57.
(2017). Использование игровых презентаций как средства активизации судебных испытаний предметных интересов дошкольников. Перспективы науки и образования. Международный научный электронный журнал, 6(30), 52-57.
Белинская Т.В. (2003). О развитии познавательного интереса на уроках-конкурсах. Химия в школе, 3, 43.
Быков Г., Бутлеров А. М. (1978). Основоположник теории строения органических соединений. М.: Просвещение, 94 с.
Габриелян О.С. (2009). Химия. 10 класс. Профильный уровень: учебник для общеобразовательных учреждений — 10 изд., стереотип. М, 318 с.
Лыкова И. А. (2009). Дидактические игры и занятия. М.: Тот: Сфера, 140 с.
Михайленко Т. М. (2011, октябрь). Игровые технологии как вид педагогических технологий. В педагогике: традиции и инновации. материалы Междунар. науч. конф.= Педагогика: традиции и новации. материалы междунар. научная конф.(Челябинск (т.1, с.140-146).
Мурашева А. А., Столяров В. М., Ломакин Г. В., Лепехин П. А., Тарбаев В. А. (2018). Оценка использования сельхозугодий, обремененных электросетевыми объектами: факторы ущерба и подходы к решению. Опсьон, 34 (85-2), 677-705.
А. (2018). Оценка использования сельхозугодий, обремененных электросетевыми объектами: факторы ущерба и подходы к решению. Опсьон, 34 (85-2), 677-705.
Новошинский И. и Новошинский Н. (2015). Химия. 10(11) класс. Глубокий уровень. Текущий и тотальный контроль. — М.: Русское слово, 224 с. ISBN 978-5-00092-003-9
Остроумов И. Г. и Габриелян О. С. (2013). Химия. 10 класс. Учебник. Базовый уровень ФГОС. — М.: Мнемозина, 240 с. ISBN: 978-5-346-02471-2
Трайнев В.А. (2005). Образовательные деловые игры. М.: Гуманитар. Произв. Центр ВЛАДОС.
Трайнев В. А. (2006). Системы и методы стратегии повышения качества педагогического образования: обобщение и практика — М.: Дашков и Ко, 295 с.
Ушинский К.Д. (2014). Три элемента школы. Историко-педагогический журнал, 01, 49-62.
Болетсис, К., и МакКаллум, С. (2013 г., сентябрь). Тайна стола: совместная игра с дополненной реальностью для изучения химии. В Международной конференции по разработке и приложениям серьезных игр (стр. 86–9).5). Шпрингер, Берлин, Гейдельберг. https://doi.org/10.1007/978-3-642-40790-1_9
DOI: https://doi.org/10.1007/978-3-642-40790-1_9
86–9).5). Шпрингер, Берлин, Гейдельберг. https://doi.org/10.1007/978-3-642-40790-1_9
DOI: https://doi.org/10.1007/978-3-642-40790-1_9
Ахметов Н.К. и Азимбаева Г.Т. (2018). Применение обучающих игр в обучении химии. https://doi.org/10.31489/2018Ch5/81-86 DOI: https://doi.org/10.31489/2018Ch5/81-86
Хьюз, Лос-Анджелес (1991). Концептуальная основа для изучения детских игр. Игра и культура, 4 (3), 284–301.
Фоли, Л., и Мэддисон, Р. (2010). Использование активных видеоигр для повышения физической активности у детей: (виртуальная) реальность? Педиатрическая гимнастика, 22(1), 7-20. https://doi.org/10.1123/pes.22.1.7 DOI: https://doi.org/10.1123/pes.22.1.7
Фальво, Д. (2008). Анимации и симуляторы для преподавания и изучения молекулярной химии. Международный журнал технологий преподавания и обучения, 4(1), 68-77.
Динева С. и Дучева З. (2011). Позитивность веб-сайта по общей и неорганической химии в смешанном обучении. В 6-й Международной конференции по виртуальному обучению ICVL 2011 (стр. 211-217).
211-217).
Мерчант З., Гетц Э. Т., Кини-Кенникатт В., Сифуэнтес Л., Квок О. М. и Дэвис Т. Дж. (2013). Изучение технологии трехмерной виртуальной реальности для улучшения пространственных способностей и химии. Журнал компьютерного обучения, 29(6), 579-590. https://doi.org/10.1111/jcal.12018 DOI: https://doi.org/10.1111/jcal.12018
Рахман, С., и Шахин, А. (2011). Использование виртуальной реальности в двигательной реабилитации неврологических расстройств: систематический обзор. Ближний Восток J Sci Res, 7 (1), 63-70.
Биографии авторов недоступны.
Опосредованный экстрактом Origanum vulgare L. синтез наночастиц серебра, их характеристика и антибактериальная активность
- Список журналов
- АМБ Экспресс
- т.10; 2020
- PMC7474311
АМБ Экспресс. 2020; 10: 162.
2020; 10: 162.
Опубликовано в Интернете 5 сентября 2020 г. doi: 10.1186/s13568-020-01100-9
, 1, 2 , 1 , 1 , 2 , 2 и 1
ЗАМЕЧА поэтому обычно используются для получения наночастиц серебра (Ag). Опосредованный растительными экстрактами синтез НЧ Ag представляет собой экологичный, экологически безопасный и экономичный метод, который предлагает новую и потенциальную альтернативу химически синтезированным НЧ, снижая использование опасных и токсичных химических веществ и защищая окружающую среду. 9Экстракты 1211 Origanum vulgare L. оценивали на общее содержание флавоноидов и фенолов. Активность по удалению свободных радикалов определяли с использованием анализа 2,2-дифенил-1-пикрилгидразила. НЧ Ag были получены с использованием спиртовых экстрактов листьев O. vulgare L.. Генерацию НЧ Ag проводили как на свету, так и в темноте. Биосинтезированные НЧ Ag были охарактеризованы с использованием микроскопических и спектроскопических методов. Антибактериальную активность НЧ Ag определяли соответствующими методами. Результаты показали, что для восстановления Ag 9 требуется энергия фотонов.0775 + до Ag 0 . Согласно отчетам сканирующей электронной микроскопии, биологически сформированные НЧ Ag имели размер от 1 до 50 нм и проявляли нестабильность, вызывающую агрегацию. Они показали, что экстракты O. vulgare L. были богаты флавоноидами и фенолами и проявляли сильную антиоксидантную активность. НЧ Ag проявляли хорошую антибактериальную активность сразу после получения. Грамположительные штаммы показали более высокую чувствительность к НЧ Ag по сравнению с грамотрицательными красителями. НЧ Ag могут служить эффективным антибактериальным средством против устойчивых к антибиотикам штаммов. Резистентный к канамицину штамм был более чувствителен к НЧ Ag, чем штамм, устойчивый к ампициллину. Таким образом, НЧ Ag, синтезированные экстрактом душицы, могут быть рекомендованы в качестве альтернативных эффективных антибактериальных средств, однако их активность зависит от вида и штамма бактерий.
Биосинтезированные НЧ Ag были охарактеризованы с использованием микроскопических и спектроскопических методов. Антибактериальную активность НЧ Ag определяли соответствующими методами. Результаты показали, что для восстановления Ag 9 требуется энергия фотонов.0775 + до Ag 0 . Согласно отчетам сканирующей электронной микроскопии, биологически сформированные НЧ Ag имели размер от 1 до 50 нм и проявляли нестабильность, вызывающую агрегацию. Они показали, что экстракты O. vulgare L. были богаты флавоноидами и фенолами и проявляли сильную антиоксидантную активность. НЧ Ag проявляли хорошую антибактериальную активность сразу после получения. Грамположительные штаммы показали более высокую чувствительность к НЧ Ag по сравнению с грамотрицательными красителями. НЧ Ag могут служить эффективным антибактериальным средством против устойчивых к антибиотикам штаммов. Резистентный к канамицину штамм был более чувствителен к НЧ Ag, чем штамм, устойчивый к ампициллину. Таким образом, НЧ Ag, синтезированные экстрактом душицы, могут быть рекомендованы в качестве альтернативных эффективных антибактериальных средств, однако их активность зависит от вида и штамма бактерий.
Ключевые слова: Origanum vulgare L., Экстракт листьев и содержание фенола, Антиоксидантная активность, Опосредованный растительным экстрактом синтез наночастиц серебра, Антибактериальная активность Экстракты листьев L. при освещении.
Значительное ингибирование роста грамположительных, грамотрицательных бактерий и устойчивых к антибиотикам штаммов с помощью НЧ Ag.
Возникновение устойчивости к доступным в настоящее время антибиотикам является огромной проблемой, с которой столкнулось человечество. По оценкам Европейского центра профилактики и контроля заболеваний, ежегодно в Европе от лекарственно-устойчивых бактериальных инфекций умирает 25 000 человек. Самая последняя ситуация с пандемией Covid-19, от которой на сегодняшний день пострадало более двадцати миллионов человек по всему миру, является последним примером, который подчеркивает необходимость разработки лекарства от этих видов. Таким образом, появление резистентности спровоцировало необходимость разработки альтернативных агентов против патогенных бактериальных штаммов (Trchounian et al. 2018; Kraemer et al. 2019).).
2018; Kraemer et al. 2019).).
Серебро (Ag) — уникальный многоцелевой элемент, который обычно использовался для изготовления монет и украшений. Доказательства антибактериальных свойств серебра также относятся к глубокой древности, о чем свидетельствуют различные исторические рассказы, хорошо известные широкой публике (Александр, 2009). В последние годы использование наночастиц Ag в медицинских целях привлекло большое внимание исследователей из-за их исключительной антимикробной активности, особенно в отношении широкого спектра патогенных микроорганизмов (Srirangam and Rao 2017; Trchounian et al. 2018).
Как правило, Ag + является печально известным токсичным ионом, который вызывает окислительный стресс и повреждения различных клеточных компонентов, включая ДНК, белки и клеточную мембрану. Элементарные НЧ Ag, напротив, служат интересной лекарственной формой, характеризующейся более медленной скоростью растворения, что обеспечивает непрерывную внутриклеточную поставку Ag + , приводящую к гибели целевых микроорганизмов (Mcshan et al.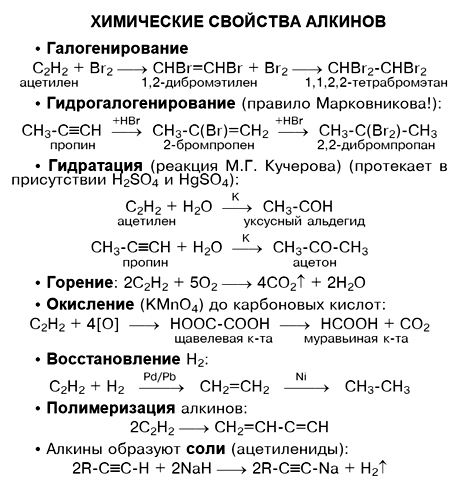 2014), хотя некоторые авторы приходят к выводу, что механизмы действия Ag + и НЧ Ag могут не совпадать (Anna et al. 2018).
2014), хотя некоторые авторы приходят к выводу, что механизмы действия Ag + и НЧ Ag могут не совпадать (Anna et al. 2018).
Существует несколько методов получения НЧ Ag, включая физическое измельчение, влажно-химические реакции и биологические методы. Физические методы обычно генерируют очень стабильные и маленькие НЧ Ag в высоких концентрациях. Однако физические методы, как правило, связаны с многочисленными недостатками. Наиболее многообещающий недостаток включает необратимый вред окружающей среде, поскольку такие методы обычно потребляют значительное количество энергии (Dhand et al. 2015). Точно так же химические методы также создают серьезную нагрузку на окружающую среду. Реагенты, часто используемые в химических методах, такие как восстановители (боргидрид натрия и гидразин), стабилизаторы (например, тиолы, кислоты, спирты) и растворители, по своей природе опасны и вредны для окружающей среды (Kondeti et al. 2017). Биологические методы, напротив, достаточно просты, быстры, недороги, энергоэффективны и не угрожают окружающей среде (Tarannum and Gautam 2019). ). НЧ Ag синтезируются биологически с использованием различных микроорганизмов (дрожжей, грибов и бактерий) и экстрактов тканей растений (листьев, корней, плодов, стеблей, цветков и т. д.). Среди биологических методов более оправданным представляется получение НЧ Ag на основе растительных экстрактов. В дополнение к другим преимуществам синтеза НЧ Ag, опосредованного растительными экстрактами, вторичные метаболиты, присутствующие в растительных экстрактах в качестве покрывающих агентов с антиоксидантной активностью, могут уменьшить побочные эффекты НЧ Ag, что делает их более подходящими для медицинских применений (Shaik et al. ., 2018; Могровян А и др., 2019.; Агаджанян и др., 2020). Экстракты растений содержат различные природные фитохимические вещества, такие как водорастворимые флавоноиды и полифенольные соединения, которые служат антиоксидантами. Эти фитомолекулы сильно восстанавливаются по своей природе и легко адсорбируются на поверхности НЧ, тем самым повышая их стабильность (Salari et al.
). НЧ Ag синтезируются биологически с использованием различных микроорганизмов (дрожжей, грибов и бактерий) и экстрактов тканей растений (листьев, корней, плодов, стеблей, цветков и т. д.). Среди биологических методов более оправданным представляется получение НЧ Ag на основе растительных экстрактов. В дополнение к другим преимуществам синтеза НЧ Ag, опосредованного растительными экстрактами, вторичные метаболиты, присутствующие в растительных экстрактах в качестве покрывающих агентов с антиоксидантной активностью, могут уменьшить побочные эффекты НЧ Ag, что делает их более подходящими для медицинских применений (Shaik et al. ., 2018; Могровян А и др., 2019.; Агаджанян и др., 2020). Экстракты растений содержат различные природные фитохимические вещества, такие как водорастворимые флавоноиды и полифенольные соединения, которые служат антиоксидантами. Эти фитомолекулы сильно восстанавливаются по своей природе и легко адсорбируются на поверхности НЧ, тем самым повышая их стабильность (Salari et al. 2019). Кроме того, антиоксиданты растительного происхождения предотвращают окисление атомов Ag (Ag 0 ) на поверхности НЧ, образуя защитное покрытие вокруг частиц и тем самым избегая прямого взаимодействия с молекулярным кислородом. Если эти компоненты покрытия не прочно прилипают к поверхности НЧ и вытесняются молекулами растворителя, это отрицательно влияет на физическую и химическую стабильность НЧ, что приводит к агрегации или окислению (Mcshan et al., 2014; Agajanyan et al. 2020). O. vulgare L., относящийся к семейству Lamiaceae , как основной источник природных вторичных метаболитов с окислительно-восстановительными свойствами, может быть эффективно использован для синтеза НЧ Ag (MoghrovyanA et al. 2019).
2019). Кроме того, антиоксиданты растительного происхождения предотвращают окисление атомов Ag (Ag 0 ) на поверхности НЧ, образуя защитное покрытие вокруг частиц и тем самым избегая прямого взаимодействия с молекулярным кислородом. Если эти компоненты покрытия не прочно прилипают к поверхности НЧ и вытесняются молекулами растворителя, это отрицательно влияет на физическую и химическую стабильность НЧ, что приводит к агрегации или окислению (Mcshan et al., 2014; Agajanyan et al. 2020). O. vulgare L., относящийся к семейству Lamiaceae , как основной источник природных вторичных метаболитов с окислительно-восстановительными свойствами, может быть эффективно использован для синтеза НЧ Ag (MoghrovyanA et al. 2019).
В настоящем исследовании кулинарная трава O. vulgare L. была собрана в четырех различных областях Армении , т.е. Котайк, Лори, Тавуш, Гегаркуник, и ее этанольный экстракт был использован для зеленого синтеза НЧ Ag. Спиртовой экстракт O. vulgare L. богат полифенолами, которые способствуют его восстановительному потенциалу. Биосинтезированные НЧ Ag были охарактеризованы и количественно определены с помощью нескольких методов, таких как спектрофотометрия в УФ-видимой области, динамическое рассеяние света (DLS) и лазерная дифракция (LD), сканирующая электронная микроскопия (SEM) в сочетании с энергодисперсионным рентгеновским анализом (EDX). Оптическая эмиссионная спектрометрия с индуктивно связанной плазмой (ICP-OES). Более того, потенциальные антибактериальные свойства НЧ Ag оценивались в отношении различных грамположительных ( Staphylococcus aureus, Bacillus subtilis ), штаммы грамотрицательных бактерий ( Escherichia coli , Salmonella typhimurium ), ампициллин-резистентные E. coli и канамицин-резистентные E. coli . Также была изучена кинетика роста E. coli при воздействии растительного экстракта и НЧ Ag.
vulgare L. богат полифенолами, которые способствуют его восстановительному потенциалу. Биосинтезированные НЧ Ag были охарактеризованы и количественно определены с помощью нескольких методов, таких как спектрофотометрия в УФ-видимой области, динамическое рассеяние света (DLS) и лазерная дифракция (LD), сканирующая электронная микроскопия (SEM) в сочетании с энергодисперсионным рентгеновским анализом (EDX). Оптическая эмиссионная спектрометрия с индуктивно связанной плазмой (ICP-OES). Более того, потенциальные антибактериальные свойства НЧ Ag оценивались в отношении различных грамположительных ( Staphylococcus aureus, Bacillus subtilis ), штаммы грамотрицательных бактерий ( Escherichia coli , Salmonella typhimurium ), ампициллин-резистентные E. coli и канамицин-резистентные E. coli . Также была изучена кинетика роста E. coli при воздействии растительного экстракта и НЧ Ag.
Растительное сырье и приготовление экстрактов
O. vulgare
vulgare Растительное сырье ( O. vulgare L.) собирали в четырех областях Армении; Котайк (ОВ 1), Лори (ОВ 2), Тавуш (ОВ 3), Гегаркуник (ОВ 4) во время цветения в июле 2016 г. Идентификацию образцов растений проводили на кафедре фармакогнозии ЕГМУ, г. Ереван ( Армения). Образцы растений были депонированы и доступны в Гербарии Института ботаники Национальной академии наук Армении, Ереван, Армения (номер образца ваучера: ERE1
). Собранные листья промывали, сушили в тени при комнатной температуре и затем измельчали до получения порошка, который до использования хранили в сухом и темном месте при комнатной температуре.
1 г порошка листьев O. vulgare взвешивали, суспендировали в 10–15 мл 40% этанола и перемешивали в течение ночи при ~ 10 °C. Затем экстракт центрифугировали в течение 5 мин при 5000 об/мин и выделяли супернатант. Осадок экстрагировали четыре раза по той же методике, а объединенные супернатантные фракции выпаривали при комнатной температуре с получением сухих экстрактов, которые затем хранили при 4°С до дальнейшего использования.
Определение общего содержания флавоноидов
Общее содержание флавоноидов в растительных экстрактах O. vulgare определяли с помощью колориметрического анализа AlCl 3 (Ghasemi et al. 2009). Экстракт растворяли в 80% этаноле для получения конечной концентрации 1 мг мл -1 . 0,5 мл этого раствора экстракта смешивали с 0,1 мл AlCl 3 (10%), 0,1 мл ацетата натрия (1 М) и 2,8 мл дистиллированной воды. Образец инкубировали в течение 15 минут и измеряли оптическую плотность образцов при 415 нм против холостого раствора, состоящего из дистиллированной воды, с использованием УФ-видимого спектрофотометра (Genesys 10S, Thermo Scientific, США). Общее содержание флавоноидов определяли с использованием калибровочной кривой кверцетина (Q) в качестве эталонного флавоноида (0–1000 мкг мл -1 ), и результаты выражали в эквивалентах Q (QE) на г сухого веса экстракта.
Определение общего содержания фенолов
Общее содержание фенолов в растительных экстрактах измеряли с использованием реактива Фолина-Чокальтеу (FC) в соответствии с методом, описанным Genwali et al. (2013). Экстракт растения растворяли в дистиллированной воде для получения конечной концентрации 1 мг мл -1 . 0,5 мл раствора растительных экстрактов смешивали с 0,1 мл реагента ФК и инкубировали 7 мин при комнатной температуре с последующим добавлением 1 мл Na 2 CO 3 раствор (7%) и 0,9 мл дистиллированной воды. Смесь тщательно встряхивали и выдерживали в темноте при комнатной температуре в течение 1 ч. Поглощение образцов измеряли при 765 нм с помощью спектрофотометра UV-Vis (Genesys 10S, Thermo Scientific, США). В качестве холостого опыта использовали дистиллированную воду. Общее содержание фенолов определяли с использованием калибровочной кривой галловой кислоты (GA) (0–250 мкг мл -1 ). Общее содержание фенолов выражали в эквивалентах GA (GAE) на г сухого веса экстракта.
(2013). Экстракт растения растворяли в дистиллированной воде для получения конечной концентрации 1 мг мл -1 . 0,5 мл раствора растительных экстрактов смешивали с 0,1 мл реагента ФК и инкубировали 7 мин при комнатной температуре с последующим добавлением 1 мл Na 2 CO 3 раствор (7%) и 0,9 мл дистиллированной воды. Смесь тщательно встряхивали и выдерживали в темноте при комнатной температуре в течение 1 ч. Поглощение образцов измеряли при 765 нм с помощью спектрофотометра UV-Vis (Genesys 10S, Thermo Scientific, США). В качестве холостого опыта использовали дистиллированную воду. Общее содержание фенолов определяли с использованием калибровочной кривой галловой кислоты (GA) (0–250 мкг мл -1 ). Общее содержание фенолов выражали в эквивалентах GA (GAE) на г сухого веса экстракта.
Анализ поглощения свободных радикалов 2,2-дифенил-1-пикрилгидразилом. (Сюй и др., 2011). Различные концентрации растительных экстрактов (в диапазоне от 31,25 до 500 мкг мл
-1 ) были приготовлены методом разбавления. 0,0,1 мМ DPPH был приготовлен в 96% этаноле. К 1 мл раствора DPPH добавляли 200 мкл водных экстрактов растений разной концентрации. Смесь энергично встряхивали и оставляли в темноте при комнатной температуре на 30 мин. Поглощение измеряли при длине волны 517 нм относительно холостого образца (96% этанола) с использованием спектрофотометра UV-Vis (Genesys 10S, Thermo Scientific, США). Катехин использовали в качестве положительного контроля при тех же условиях анализа. Активность по удалению радикалов рассчитывали по следующему уравнению:
0,0,1 мМ DPPH был приготовлен в 96% этаноле. К 1 мл раствора DPPH добавляли 200 мкл водных экстрактов растений разной концентрации. Смесь энергично встряхивали и оставляли в темноте при комнатной температуре на 30 мин. Поглощение измеряли при длине волны 517 нм относительно холостого образца (96% этанола) с использованием спектрофотометра UV-Vis (Genesys 10S, Thermo Scientific, США). Катехин использовали в качестве положительного контроля при тех же условиях анализа. Активность по удалению радикалов рассчитывали по следующему уравнению:Активность по удалению радикалов\%=Abc-AbsAbc×100
, где Abc и Abs представляли поглощение контроля (только раствор DPPH) и поглощение образца в присутствии экстракта или стандарта соответственно. Результаты выражали как IC 50 значений (мкг/л -1 ), которые представляли концентрацию образца, необходимую для ингибирования 50% свободных радикалов DPPH.
Синтез НЧ Ag с использованием экстрактов
O. vulgare Исходный раствор экстракта O. vulgare готовили путем растворения 5 мг растительного экстракта в 10 мл воды Milli-Q (18,2 МОм·см при 25 °C). ). НЧ Ag синтезировали путем смешивания растворов AgNO 3 (10 мМ) и растительного экстракта (0,5 мг мл -1 ) в соотношении 1:9.соотношение для достижения конечной концентрации 1 мМ для AgNO 3 (Rautela et al. 2019). Аналогичным образом готовили контрольный образец, исключая растительный экстракт. Образцы встряхивали на шейкере с постоянным вращением (150 об/мин) в темных (без света) и светлых (нормальное комнатное освещение) условиях при температуре 23 ± 2 °C в течение 18 ч. В темных условиях пробирки были обернуты алюминиевой фольгой для защиты от света (Srikar et al. 2016).
vulgare готовили путем растворения 5 мг растительного экстракта в 10 мл воды Milli-Q (18,2 МОм·см при 25 °C). ). НЧ Ag синтезировали путем смешивания растворов AgNO 3 (10 мМ) и растительного экстракта (0,5 мг мл -1 ) в соотношении 1:9.соотношение для достижения конечной концентрации 1 мМ для AgNO 3 (Rautela et al. 2019). Аналогичным образом готовили контрольный образец, исключая растительный экстракт. Образцы встряхивали на шейкере с постоянным вращением (150 об/мин) в темных (без света) и светлых (нормальное комнатное освещение) условиях при температуре 23 ± 2 °C в течение 18 ч. В темных условиях пробирки были обернуты алюминиевой фольгой для защиты от света (Srikar et al. 2016).
Характеристика биосинтезированных НЧ Ag
Оптические свойства НЧ Ag были охарактеризованы с использованием спектрофотометра UV-Vis (Lambda 35, Perkin Elmer) с шириной щели 1 нм и скоростью сканирования 480 нм мин. –1 . Анализ проводили с использованием кварцевых кювет с длиной оптического пути 10 мм. Поглощение образцов измеряли в диапазоне длин волн (λ) 350–700 нм. Прибор был оснащен программным комплексом UV WinLab.
Поглощение образцов измеряли в диапазоне длин волн (λ) 350–700 нм. Прибор был оснащен программным комплексом UV WinLab.
Физическую стабильность образцов оценивали путем измерения дзета-потенциала (ξ-потенциала) и динамического рассеяния света (ДРС). Измерения ξ-потенциала и DLS образцов проводили с использованием Zeta-sizer Nano ZS (Malvern Instruments, Великобритания), который анализировал электрофоретическую подвижность образцов в электрическом поле. Размер биосинтезированных НЧ Ag визуализировали с помощью SEM (колонка ZEISS-SUPRA 40/gemini), оснащенного детектором дифракции обратного рассеяния электронов (EBSD) и детектором энергодисперсионной рентгеновской спектроскопии (EDS) — анализ SEM-EDX. Общее содержание Ag определяли методом оптической эмиссионной спектроскопии с индуктивно-связанной плазмой (ICP-OES) (Horiba Jobin-Yvon Ultima 2)).
Антибактериальная активность биосинтезированных НЧ Ag
Антибактериальную активность биосинтезированных НЧ Ag оценивали в отношении множества микроорганизмов, включая штаммы грамположительных бактерий ( S. aureus MDC 5233 (Центр депозитария микробов, MDC (Национальная коллекция микробных культур) , WDCM 803, НАН Армении, Ереван, Армения; лабораторный контрольный штамм), B. subtilis WT-A17 (выделен из загрязненных металлами почв г. Каджаран, Армения), штаммы грамотрицательных бактерий (E. coli ВКПМ-М17 (Всероссийская коллекция промышленных микроорганизмов Института генетики и селекции промышленных микроорганизмов, Москва, Россия; лабораторно-контрольный штамм)), S. typhimurium MDC 1754 (лабораторно-контрольный штамм)) , ампициллинорезистентные штаммы E. coli DH5α-pUC18 и канамицинрезистентные E. coli pARG-25 (поставляется НПЦ «Армбиотехнология» НАН Армении, г. Ереван, Армения) методом дисковой диффузии метод с использованием дисков диаметром 6 мм (Lawhavinit et al., 2010). Агар Мюллера-Хинтона использовали для роста бактерий. Диски, погруженные в растительные экстракты (0,5 мг мл -1 ), а растворы НЧ Ag помещали отдельно на чашки Петри, содержащие мясопептонный агар, загрязненный бактериями.
aureus MDC 5233 (Центр депозитария микробов, MDC (Национальная коллекция микробных культур) , WDCM 803, НАН Армении, Ереван, Армения; лабораторный контрольный штамм), B. subtilis WT-A17 (выделен из загрязненных металлами почв г. Каджаран, Армения), штаммы грамотрицательных бактерий (E. coli ВКПМ-М17 (Всероссийская коллекция промышленных микроорганизмов Института генетики и селекции промышленных микроорганизмов, Москва, Россия; лабораторно-контрольный штамм)), S. typhimurium MDC 1754 (лабораторно-контрольный штамм)) , ампициллинорезистентные штаммы E. coli DH5α-pUC18 и канамицинрезистентные E. coli pARG-25 (поставляется НПЦ «Армбиотехнология» НАН Армении, г. Ереван, Армения) методом дисковой диффузии метод с использованием дисков диаметром 6 мм (Lawhavinit et al., 2010). Агар Мюллера-Хинтона использовали для роста бактерий. Диски, погруженные в растительные экстракты (0,5 мг мл -1 ), а растворы НЧ Ag помещали отдельно на чашки Петри, содержащие мясопептонный агар, загрязненный бактериями. Дистиллированную воду использовали в качестве отрицательного контроля, в то время как ампициллин (20 мкг мл -1 ) использовали в качестве стандартного положительного контроля для всех случаев, за исключением устойчивых к ампициллину E. coli DH5α-pUC18, для которых использовали канамицин (20 мкг мл — 1 ). Затем планшеты инкубировали в течение 18 ч при 37 °C, и регистрировали диаметры зон ингибирования роста бактерий в миллиметрах (мм). Антибактериальную активность биосинтезированных НЧ Ag сравнивали с коллоидным Ag, коммерчески доступным под торговой маркой «Сильвертон» (Лаборатория «Тонус-Лес», Армения), полученным электрохимическим способом (Согомонян и др., 2019).). Антибактериальную активность НЧ Ag также регистрировали с точки зрения минимальной ингибирующей концентрации (МИК) методом двукратного серийного разведения (110–6,875 мкг мл -1 ). Значения MIC были получены после 18 ч инкубации при 37 °C. Величину МИК принимали за наименьшую концентрацию НЧ, подавляющую рост тест-бактерии (концентрацию, образующую наименьшую зону ингибирования вокруг диска).
Дистиллированную воду использовали в качестве отрицательного контроля, в то время как ампициллин (20 мкг мл -1 ) использовали в качестве стандартного положительного контроля для всех случаев, за исключением устойчивых к ампициллину E. coli DH5α-pUC18, для которых использовали канамицин (20 мкг мл — 1 ). Затем планшеты инкубировали в течение 18 ч при 37 °C, и регистрировали диаметры зон ингибирования роста бактерий в миллиметрах (мм). Антибактериальную активность биосинтезированных НЧ Ag сравнивали с коллоидным Ag, коммерчески доступным под торговой маркой «Сильвертон» (Лаборатория «Тонус-Лес», Армения), полученным электрохимическим способом (Согомонян и др., 2019).). Антибактериальную активность НЧ Ag также регистрировали с точки зрения минимальной ингибирующей концентрации (МИК) методом двукратного серийного разведения (110–6,875 мкг мл -1 ). Значения MIC были получены после 18 ч инкубации при 37 °C. Величину МИК принимали за наименьшую концентрацию НЧ, подавляющую рост тест-бактерии (концентрацию, образующую наименьшую зону ингибирования вокруг диска).
Кинетика роста
E. coli ВКПМ-М17 под влиянием биосинтезированных НЧ AgАнализ кинетики роста был использован для понимания картины роста бактерий под влиянием биосинтезированных НЧ Ag. Кинетику роста E. coli ВКПМ-М17 также отслеживали в присутствии растительного экстракта ОВ-3. Свежие колонии E. coli выделяли из чашек с мясопептонным агаром и переносили в бульон LB (pH 7,5) с последующей инкубацией в течение 18 ч при 37 °C. Антибактериальную активность НЧ Ag оценивали по МИК. Антибактериальный эффект экстракта (OV3) контролировали при концентрации, использованной для получения НЧ Ag , т.е. 0,5 мг мл -1 . Кривые роста бактерий определяли путем измерения мутности образцов, содержащих бактерии, при 565 ± 15 нм каждые 30 минут с использованием денситометра (DEN-1B, BIOSAN, Латвия) (Szermer-Olearnik and Zwolińska 2014).
Константа скорости роста (μ 1 ) и среднее время генерации (g 1 ) для E. coli ВКПМ-М17 были рассчитаны во время логарифмической фазы роста (t 0 = 0, t = 1,5 ч) используя следующие формулы:
coli ВКПМ-М17 были рассчитаны во время логарифмической фазы роста (t 0 = 0, t = 1,5 ч) используя следующие формулы:
μ=[log10N-log10N0×2,303]/t-t0
g=log10Nt-log10N0/log102или g=0,693/μ
, где N — количество клеток (Maclean et al. 2009).
Обработка данных
Экспериментальные измерения были выражены как среднее значение трех анализов, рассчитанных с помощью ± SD с использованием Microsoft Office 365. Диаметры НЧ измеряли с использованием программного обеспечения ImageJ. Анализ распределения данных проводили с помощью теста Стьюдента t . Значения P менее 0,05 считались статистически значимыми.
Общий флавоноидно-фенольный состав экстрактов
O. vulgare Флавоноиды и другие фенольные соединения обычно связаны с окислительно-восстановительными и антиоксидантными свойствами. Общее содержание флавоноидов в различных экстрактах O. vulgare определяли по калибровочной кривой. Q (y = 2,3083x + 0,0369, R 2 = 0,9947). Приемлемое количество флавоноидов было обнаружено во всех образцах. Наибольшее количество флавоноидов наблюдалось в образце, взятом из Тавушской области (690,65 ± 1,09 мг (QE) г -1 ), за которым следует образец, собранный в Гегаркуникской области (53,54 ± 0,75 мг (QE) г -1 ). Несколько сниженное количество флавоноидов наблюдалось в пробе, взятой из Лорийской области (41,63 ± 1,14 мг (КЭ) г -1 ), а наименьшее количество было обнаружено в пробе, взятой из Котайкской области (30,22 ± 0,25 мг (КО) г -1 ). Аналогично, общее содержание фенолов в различных экстрактах O. vulgare рассчитывали по калибровочной кривой ГА (y = 0,0063x + 0,0718, R 2 = 0,9789). Приемлемое количество полифенолов наблюдалось во всех образцах. Наибольшее содержание полифенолов наблюдалось в образце, взятом из Тавушской области (202,68 ± 1,27 мг (ГАЭ) г -1 ), за которым следует образец, собранный в Лорийской области (185,27± 2,05 мг (ГАЭ) г -1 ).
Приемлемое количество флавоноидов было обнаружено во всех образцах. Наибольшее количество флавоноидов наблюдалось в образце, взятом из Тавушской области (690,65 ± 1,09 мг (QE) г -1 ), за которым следует образец, собранный в Гегаркуникской области (53,54 ± 0,75 мг (QE) г -1 ). Несколько сниженное количество флавоноидов наблюдалось в пробе, взятой из Лорийской области (41,63 ± 1,14 мг (КЭ) г -1 ), а наименьшее количество было обнаружено в пробе, взятой из Котайкской области (30,22 ± 0,25 мг (КО) г -1 ). Аналогично, общее содержание фенолов в различных экстрактах O. vulgare рассчитывали по калибровочной кривой ГА (y = 0,0063x + 0,0718, R 2 = 0,9789). Приемлемое количество полифенолов наблюдалось во всех образцах. Наибольшее содержание полифенолов наблюдалось в образце, взятом из Тавушской области (202,68 ± 1,27 мг (ГАЭ) г -1 ), за которым следует образец, собранный в Лорийской области (185,27± 2,05 мг (ГАЭ) г -1 ). . Несколько меньшее содержание полифенолов наблюдалось в пробе, взятой из Котайкской области (165,01 ± 1,07 мг (ГАЭ) г -1 ), а наименьшее количество было обнаружено в пробе, взятой из Гегаркуникской области (150,19 мг).± 0,69 мг (GAE) г -1 ). Общие результаты показывают, что образец, собранный в Тавушской области, содержит самое высокое содержание полифенолов и флавоноидов (таблица ).
. Несколько меньшее содержание полифенолов наблюдалось в пробе, взятой из Котайкской области (165,01 ± 1,07 мг (ГАЭ) г -1 ), а наименьшее количество было обнаружено в пробе, взятой из Гегаркуникской области (150,19 мг).± 0,69 мг (GAE) г -1 ). Общие результаты показывают, что образец, собранный в Тавушской области, содержит самое высокое содержание полифенолов и флавоноидов (таблица ).
Таблица 1
Общее содержание флавоноидного и фенольного содержимого O. vulgare Экстракты
| Область сбора | Имя O. vulgare | 9 | . −1 | Содержание фенолов общее, мг (ГАЭ) (г сухой массы) −1 |
|---|---|---|---|---|
| Kotayk | OV 1 | 30. 22 ± 0.25 22 ± 0.25 | 165.01 ± 1.07 | |
| Lori | OV 2 | 41.63 ± 1.14 | 185.26 ± 2.05 | |
| Tavush | OV 3 | 69.64 ± 1.09 | 202.67 ± 1.27 | |
| Gegharkunik | OV 4 | 53.53 ± 0.75 | 150.19 ± 0.69 |
Open in a separate window
Антиоксидантная активность экстрактов
O. vulgare Поскольку полифенолы и флавоноиды обычно связаны с активностью по удалению радикалов, четыре различных экстракта O.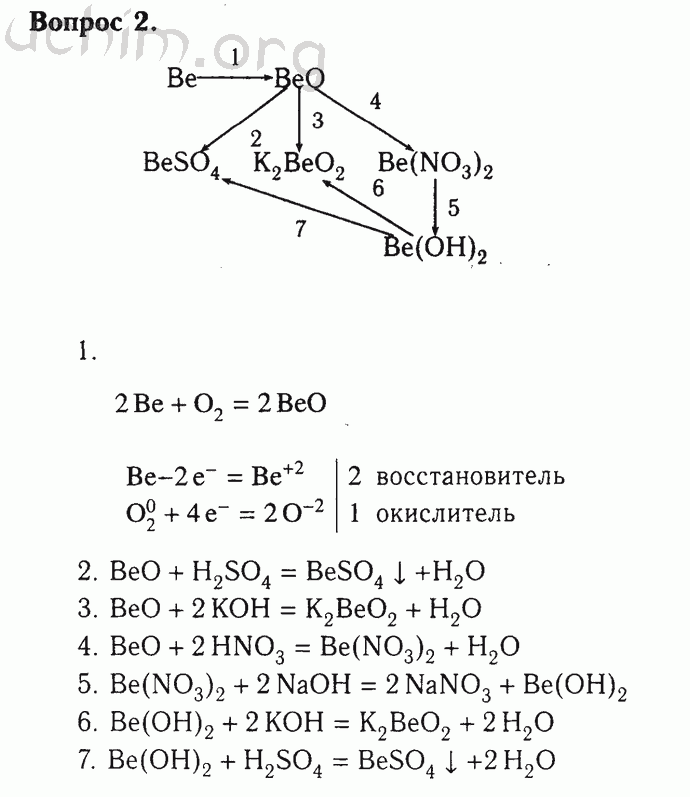 vulgare были оценены на активность по удалению свободных радикалов DPPH, и результаты были выражено в виде значений IC 50 (мкг мл -1 ). Все образцы демонстрировали достаточную активность по удалению радикалов. Наибольшая активность наблюдалась для OV3 (40,22 ± 0,91 мкг мл -1 ), затем OV 2 (49,99 ± 1,24 мкг мл -1 ). Относительно более низкая активность по удалению радикалов наблюдалась для OV 1 (64,73 ± 1,01 мкг мл -1 ), а наименьшая активность наблюдалась для OV 4 (75,99 ± 13 мкг мл -1 ) (рис. ). Более низкие значения поглощения реакционной смеси указывали на более высокую активность свободных радикалов. Антиоксидантную активность растительных экстрактов сравнивали с антиоксидантной активностью катехина (12,62 мкг мл -1 ) в качестве положительного контроля. Результаты подтверждаются несколькими другими многочисленными исследованиями, которые подтверждают представление о том, что экстракты с высоким содержанием фенолов проявляют сильную антиоксидантную активность (Tungmunnithum et al.
vulgare были оценены на активность по удалению свободных радикалов DPPH, и результаты были выражено в виде значений IC 50 (мкг мл -1 ). Все образцы демонстрировали достаточную активность по удалению радикалов. Наибольшая активность наблюдалась для OV3 (40,22 ± 0,91 мкг мл -1 ), затем OV 2 (49,99 ± 1,24 мкг мл -1 ). Относительно более низкая активность по удалению радикалов наблюдалась для OV 1 (64,73 ± 1,01 мкг мл -1 ), а наименьшая активность наблюдалась для OV 4 (75,99 ± 13 мкг мл -1 ) (рис. ). Более низкие значения поглощения реакционной смеси указывали на более высокую активность свободных радикалов. Антиоксидантную активность растительных экстрактов сравнивали с антиоксидантной активностью катехина (12,62 мкг мл -1 ) в качестве положительного контроля. Результаты подтверждаются несколькими другими многочисленными исследованиями, которые подтверждают представление о том, что экстракты с высоким содержанием фенолов проявляют сильную антиоксидантную активность (Tungmunnithum et al. 2018). Самая высокая активность наблюдалась для OV3 (40,22 ± 0,91 мкг мл -1 ), что может быть связано с максимальным количеством флавоноидов и полифенолов.
2018). Самая высокая активность наблюдалась для OV3 (40,22 ± 0,91 мкг мл -1 ), что может быть связано с максимальным количеством флавоноидов и полифенолов.
Открыто в отдельном окне
Активность экстрактов O. vulgare (OV 1, OV 2, OV 3 и OV 4) и катехина в отношении свободных радикалов. Результаты выражены в виде значений IC 50 , указывающих концентрации, необходимые для поглощения 50% свободных радикалов
Генерация и характеристика НЧ Ag
Четыре группы НЧ Ag ( , т.е. НЧ Ag 1, НЧ Ag 2, НЧ Ag 3 и НЧ Ag 4) были получены с использованием экстрактов OV 1, OV 2, OV 3 и OV 4 соответственно. Образование НЧ Ag было подтверждено с помощью анализа, основанного на УФ-видимой спектроскопии. В присутствии растительных экстрактов цвет реакционной смеси менялся со светло-желтого на коричневый через 18 ч инкубации. В предыдущей литературе о НЧ Ag описывается, что НЧ образуются, когда цвет раствора меняется со светло-желтого на коричневый, а темно-коричневый или черный цвет указывает на возможное окисление НЧ Ag (Yong et al. 2013). Стабильность и срок годности всех наносуспензий исследовали после хранения образцов более двух недель после изготовления. Однако результаты показали, что образцы были не очень стабильными, о чем свидетельствует изменение цвета образцов (рис. ). Никаких изменений в цвете не наблюдалось в отсутствие растительного экстракта в аналогичных условиях, что подтверждает представление о том, что растительные экстракты являются ключевыми игроками для образования НЧ.
2013). Стабильность и срок годности всех наносуспензий исследовали после хранения образцов более двух недель после изготовления. Однако результаты показали, что образцы были не очень стабильными, о чем свидетельствует изменение цвета образцов (рис. ). Никаких изменений в цвете не наблюдалось в отсутствие растительного экстракта в аналогичных условиях, что подтверждает представление о том, что растительные экстракты являются ключевыми игроками для образования НЧ.
Открыть в отдельном окне
Наносуспензии были проанализированы на стабильность и изменение цвета с течением времени, и результаты подтверждают нестабильность образцов
Образцы были разведены в 2,5 раза для спектрофотометрического анализа в УФ-видимой области и результаты показали пики поглощения около 440–460 нм, которые характерны для НЧ Ag в образцах (рис. ). Результаты согласуются с литературными данными (Санкар и др., 2010; Санкар и др., 2014; Мудли и др., 2018; Бехраван и др., 2019).; Пиртаригат и др. 2019).
2019).
Открыть в отдельном окне
УФ-видимый спектрофотометрический анализ НЧ Ag 1 ( a ), НЧ Ag 2 ( b ), НЧ Ag 3 ( c ) и НЧ Ag 4 ( d ) . См. текст
В темноте цвет реакционной смеси НЧ Ag не изменился, что подтверждает значение световой энергии для образования НЧ Ag (изображения не показаны). Значение световой энергии для образования НЧ также описано Rahman et al. (2019). Поскольку НЧ Ag не были получены в темных условиях, описанные выше данные относятся только к образцам, подвергнутым воздействию света. Поскольку НЧ Ag относятся к категории плазмонных частиц, они обладают необычными оптическими свойствами. Электроны, присутствующие в зоне проводимости на поверхности Ag NP, подвергаются коллективным колебаниям при освещении на определенных длинах волн, явление, известное как поверхностный плазмонный резонанс (SPR). ППР придает НЧ Ag высокие поглощающие и рассеивающие свойства (Al-sharqi et al. 2019). Поэтому пик поглощения таких частиц может смещаться в зависимости от размера, формы и среды, окружающей частицы (Lee and Jun 2019). Предыдущие исследования показали, что полоса SPR смещается в сторону большей длины волны с увеличением размера наночастиц, что известно как красное смещение (Loiseau et al. 2019).
Поэтому пик поглощения таких частиц может смещаться в зависимости от размера, формы и среды, окружающей частицы (Lee and Jun 2019). Предыдущие исследования показали, что полоса SPR смещается в сторону большей длины волны с увеличением размера наночастиц, что известно как красное смещение (Loiseau et al. 2019).
Динамическое рассеяние света и исследования дзета-потенциала
DLS — это метод измерения среднего размера наночастиц в образце. Принцип работы ДЛС основан на методе дифракции лазерного луча. Падающий на образец свет в основном рассеивается частицами, показатель преломления которых значительно отличается от показателя преломления растворителя. Интенсивность рассеянного света определяется детектором DLS (Karmakar 2019). Результаты DLS-анализа показали Z-средний размер частиц 58,81 ± 0,65 днм, 30,27 ± 0,17 днм, 30,20 ± 045 днм и 44,11 ± 0,56 днм для НЧ Ag 1, НЧ Ag 2, НЧ Ag. 3 и НЧ Ag 4 соответственно (рис. ). Индекс полидисперсности (PDI) также является важным показателем качества в отношении распределения размеров. Значения PDI для образцов варьировались от 0,291 до 0,536, что указывало на то, что образцы являются в некоторой степени полидисперсными по своей природе, а диаметры частиц значительно различаются (Danaei et al., 2018).
Значения PDI для образцов варьировались от 0,291 до 0,536, что указывало на то, что образцы являются в некоторой степени полидисперсными по своей природе, а диаметры частиц значительно различаются (Danaei et al., 2018).
Открыть в отдельном окне. . См. текст
Еще одним важным параметром для понимания поверхностного заряда и тенденции к агрегации НЧ является ξ-потенциал. Общепринято, что НЧ со значениями ξ-потенциала ± 0–10 мВ, ± 10–20 мВ, ± 20–30 мВ и ± 30 мВ нестабильны, относительно стабильны, умеренно стабильны и высокостабильны соответственно (Bhattacharjee , 2016). Аргументы относительно зависимости стабильности НЧ от ξ-потенциала в литературе несколько различаются (Kumar and Dixit 2019). Значения ξ-потенциала -16,90 ± 1,13 мВ, -21,30 ± 0,40 мВ, -22,50 ± 0,55 мВ и -26,70 ± 0,23 мВ были зарегистрированы для НЧ Ag 1, НЧ Ag 2, НЧ Ag 3 и НЧ Ag 4 соответственно. . НЧ с такими значениями ξ-потенциала по-прежнему склонны к агломерации, что может привести к дальнейшей агрегации.
Анализ SEM-EDX
SEM был выполнен для определения распределения размера частиц Ag NP. СЭМ-изображения подтвердили, что НЧ Ag были получены небольших размеров в диапазоне от 1 до 50 нм, как показано на рис. В случае НЧ Ag 2, НЧ Ag 3 и НЧ Ag 4 преобладали размеры 1–25 нм, в то время как в случае НЧ Ag 1 преобладал размер 30–50 нм.
Открыть в отдельном окне. . См. текст
EDX был использован для подтверждения элементного состава реакционной смеси (Menon et al. 2017). Анализ EDX представил спектральный сигнал в области серебра, подтверждающий наличие НЧ Ag. Также наблюдались спектральные сигналы углерода, кислорода, хлора и серы, что может быть связано с присутствием фитохимических составляющих растительных экстрактов, адсорбированных на поверхности или вблизи поверхности НЧ металлов.
Анализ с помощью оптической эмиссионной спектроскопии с индуктивно связанной плазмой
Общее содержание Ag определяли с использованием оптической эмиссионной спектрометрии с индуктивно связанной плазмой (ICP OES). Важно отметить, что этот метод не позволяет различать ионы Ag и НЧ Ag и обеспечивает кумулятивное содержание обеих форм (Campos et al. 2017). Тем не менее, анализ предоставляет подробную информацию о качестве образцов. По результатам ИСП-ОЭС НЧ Ag получены в хорошем количестве. Наибольшее количество было достигнуто для НЧ Ag 3 (110,1 ± 0,2 мг л -1 ), за которыми следуют НЧ Ag 2 (107,3 ± 1,5 мг L -1 ). Несколько меньшее количество было достигнуто для Ag NPs 4 (106,7 ± 1,1 мг L -1 ), а наименьшее количество наблюдалось для Ag NPs 1 (103,9 ± 0,8 мг L -1 ). Небольшие различия в полученных количествах представляют особый интерес, поскольку количество AgNO 3 , первоначально использованное для всех образцов, было одинаковым. Эти различия в количествах можно объяснить, учитывая принцип работы ИСП-ОЭС, в котором могут быть обнаружены только мелкие частицы, а крупные частицы могут быть потеряны. По данным ИСП-ОЭС наименьшая концентрация Ag была достигнута в случае НЧ Ag 1, что указывает на то, что данный образец содержал агрегированные частицы или оксиды Ag, а самое высокое содержание Ag среди всех образцов было достигнуто для НЧ Ag 3, что подтверждает хорошее качество этого образца.
Важно отметить, что этот метод не позволяет различать ионы Ag и НЧ Ag и обеспечивает кумулятивное содержание обеих форм (Campos et al. 2017). Тем не менее, анализ предоставляет подробную информацию о качестве образцов. По результатам ИСП-ОЭС НЧ Ag получены в хорошем количестве. Наибольшее количество было достигнуто для НЧ Ag 3 (110,1 ± 0,2 мг л -1 ), за которыми следуют НЧ Ag 2 (107,3 ± 1,5 мг L -1 ). Несколько меньшее количество было достигнуто для Ag NPs 4 (106,7 ± 1,1 мг L -1 ), а наименьшее количество наблюдалось для Ag NPs 1 (103,9 ± 0,8 мг L -1 ). Небольшие различия в полученных количествах представляют особый интерес, поскольку количество AgNO 3 , первоначально использованное для всех образцов, было одинаковым. Эти различия в количествах можно объяснить, учитывая принцип работы ИСП-ОЭС, в котором могут быть обнаружены только мелкие частицы, а крупные частицы могут быть потеряны. По данным ИСП-ОЭС наименьшая концентрация Ag была достигнута в случае НЧ Ag 1, что указывает на то, что данный образец содержал агрегированные частицы или оксиды Ag, а самое высокое содержание Ag среди всех образцов было достигнуто для НЧ Ag 3, что подтверждает хорошее качество этого образца.
Антибактериальная активность Ag NPs
На основании отличных результатов характеристики, Ag NPs 3 был выбран по антибактериальной активности вместе с соответствующим экстрактом (OV3). Антибактериальную активность оценивали в отношении нескольких бактериальных штаммов с точки зрения зоны ингибирования, а антибактериальную активность НЧ Ag 3 сравнивали с активностью химически синтезированных коллоидных НЧ Ag (P > 0,05) (в качестве эталонного образца) и стандартов (p < 0,05). ), как показано на рис. Экстракт растения сам по себе не проявлял заметной антибактериальной активности (данные не представлены). Антибактериальная активность биологически синтезированных НЧ Ag 3 в ряде случаев была сравнима с химически полученными коллоидными НЧ Ag при той же концентрации.
Открыть в отдельном окне
Антибактериальная активность НЧ Ag 3, коллоидных НЧ Ag и стандартов в отношении тест-бактерий. См. текст
Для исследования стабильности активности НЧ Ag были представлены значения МИК, которые составили 13,75, 9,16, 18,35, 18,35, 18,35 и 11 мкг/мл. MDC 5233, B. subtilis WT-A17, E. coli ВКПМ-M17, S. typhimurium MDC 1754, E. coli DH5α-pUC18 и E. coli pARG-25 соответственно. Эксперимент был повторен с тем же образцом (НЧ Ag 3) через 1 неделю, и наблюдалось значительное снижение антибактериальной активности НЧ Ag 3, в то время как коллоидные НЧ Ag сохраняли активность. Это снижение активности может быть связано с возможной агрегацией НЧ.
MDC 5233, B. subtilis WT-A17, E. coli ВКПМ-M17, S. typhimurium MDC 1754, E. coli DH5α-pUC18 и E. coli pARG-25 соответственно. Эксперимент был повторен с тем же образцом (НЧ Ag 3) через 1 неделю, и наблюдалось значительное снижение антибактериальной активности НЧ Ag 3, в то время как коллоидные НЧ Ag сохраняли активность. Это снижение активности может быть связано с возможной агрегацией НЧ.
В случае грамположительных штаммов бактерий активность коллоидных и биосинтезированных НЧ Ag была практически одинаковой, но в случае грамотрицательных штаммов мы имели некоторое разнообразие в воздействии— E. coli ВКПМ-М17 была более чувствительна к биосинтезированным НЧ по сравнению с коллоидными (рис. ) (p < 0,01). НЧ Ag 3 ингибировали рост штаммов E. coli даже сильнее, чем стандарт (рис. ) (p < 0,05).
Анализ кинетики роста был использован для понимания картины роста бактерий под влиянием биосинтезированных НЧ Ag и родственного экстракта. Значительное ингибирование роста E. coli ВКПМ-М17 наблюдалось для обоих образцов , т.е. экстракт , и НЧ Ag 3, как показано на рис. .
Значительное ингибирование роста E. coli ВКПМ-М17 наблюдалось для обоих образцов , т.е. экстракт , и НЧ Ag 3, как показано на рис. .
Открыть в отдельном окне
Кривая роста E. coli ВКПМ-М17 в сравнении с кривыми роста бактерий под влиянием ОВ 3 и НЧ Ag 3
Значения μ 2 и g 2 были рассчитаны также для E. coli ВКПМ-М17, обработанных экстрактом OV 3 (t 0 = 0 и t = 1 ч). Значения расчетных констант скорости роста НЧ Ag 3 и экстракта OV3 составили 0,529.ч -1 и 0,456 ч -1 соответственно. Среднее время генерации 1,31 ч и 1,52 ч было рассчитано для штамма E. coli ВКПМ-М17, обработанного НЧ Ag 3 и экстрактом OV 3 соответственно.
НЧ Ag, синтезированные с использованием экстракта листьев душицы, имеют небольшие размеры, полидисперсность, разное содержание Ag и склонность к агрегации. Среди растений из разных регионов, используемых для синтеза НЧ, выявлены НЧ Ag 3 (см. Материалы и методы и Результаты) с наиболее высокой антибактериальной активностью.
Материалы и методы и Результаты) с наиболее высокой антибактериальной активностью.
Географическое происхождение и климатические условия произрастания растений существенно влияют на количественный и качественный состав фитохимических веществ, присутствующих в растениях, в результате чего использованные в данном исследовании экстракты листьев O. vulgare проявляли различную антиоксидантную и восстановительную активность, что привело к синтез НЧ различной степени стабильности. Таким образом, химический состав растительных экстрактов очень важен, и, изменяя его, можно синтезировать более стабильные частицы. Мы предлагаем дальнейшие исследования с использованием отдельных фитомолекул вместо растительных экстрактов, содержащих смесь разных фитомолекул. Это может помочь лучше понять, какие фитомолекулы более благоприятны для зеленого синтеза НЧ Ag.
Антибактериальное действие НЧ Ag на грамположительные и грамотрицательные штаммы бактерий проявляется по-разному, поскольку структура и заряд клеточной стенки этих бактерий различны. Грамотрицательные бактерии более восприимчивы к НЧ Ag, чем грамположительные бактерии, как описано также разными авторами (Мнацаканян и Трчунян, 2018; Агаджанян и др., 2020).
Грамотрицательные бактерии более восприимчивы к НЧ Ag, чем грамположительные бактерии, как описано также разными авторами (Мнацаканян и Трчунян, 2018; Агаджанян и др., 2020).
Для объяснения антибактериального действия следует отметить, что в первую очередь НЧ Ag повреждают клеточную мембрану (Трчунян и др., 2018; Габриелян, Трчунян, 2019).). Кроме того, НЧ Ag изменяют проницаемость клеточной мембраны и нарушают работу бактериальной дыхательной цепи или протонной F O F 1 -АТФазы, что является одной из причин гибели клеток (Trchounian et al. 2018; Габриелян и Трчунян, 2019). Кроме того, НЧ Ag индуцируют образование активных форм кислорода (АФК) (например, супероксида, гидроксильных радикалов, синглетного кислорода) и ингибируют экспрессию антиоксидантных ферментов (т. е. супероксиддисмутазы и гидропероксидазы), в результате чего бактериальная клетка подвергается окислительному стрессу и погибает (Qing et al. 2018). НЧ Ag проявляют генотоксический эффект, вызывая различные повреждения последовательностей ДНК. В присутствии НЧ Ag ДНК теряет способность к репликации. Это также может привести к нарушению работы системы восстановления (Morones et al., 2005).
В присутствии НЧ Ag ДНК теряет способность к репликации. Это также может привести к нарушению работы системы восстановления (Morones et al., 2005).
Большое значение имеют также формы НЧ с точки зрения воздействия на клеточную мембрану бактерий. В связи с этим было бы полезно отметить, что так называемые зеленые НЧ Ag округлой формы более активны по сравнению с другими формами (Trchounian et al., 2018). НЧ Ag, полученные восстановлением веществ растительного происхождения, выделенных из листьев O. vulgare , также имеют округлую форму. Подобные результаты были также описаны Агаджаняном и соавт. (2020), которые использовали в качестве восстановителей экстракты, полученные из Полынь однолетняя . Но в отличие от НЧ, полученных с использованием экстрактов Artemisia , антибактериальная активность НЧ, полученных восстановлением AgNO 3 экстрактами листьев O. vulgare , обладает в 7–9 раз большей активностью.
В целом, биосинтез НЧ Ag с использованием растительных экстрактов представляет собой простой, недорогой и безопасный метод, который широко используется несколькими исследователями во всем мире (Kumar and Yadav 2009). Некоторые литературные данные свидетельствуют о синергическом эффекте биологически синтезированных НЧ Ag и некоторых веществ растительного происхождения в отношении различных бактериальных штаммов, в том числе бактерий с множественной лекарственной устойчивостью, снижая их значения МИК и сокращая время действия по сравнению с био-НЧ Ag, используемых отдельно (Scandorieiro et al. др. 2016). Биологически синтезированные НЧ Ag проявляли хорошую антибактериальную активность в отношении нерезистентных к антибиотикам, а также устойчивых к антибиотикам бактериальных пятен, хотя такие частицы не могут быть использованы в течение длительного времени из-за нестабильности и склонности к агрегации. Несмотря на это, улучшая стабильность НЧ Ag, эти наночастицы могут использоваться в различных биомедицинских и биотехнологических приложениях (Nakamura et al. 2019).).
Некоторые литературные данные свидетельствуют о синергическом эффекте биологически синтезированных НЧ Ag и некоторых веществ растительного происхождения в отношении различных бактериальных штаммов, в том числе бактерий с множественной лекарственной устойчивостью, снижая их значения МИК и сокращая время действия по сравнению с био-НЧ Ag, используемых отдельно (Scandorieiro et al. др. 2016). Биологически синтезированные НЧ Ag проявляли хорошую антибактериальную активность в отношении нерезистентных к антибиотикам, а также устойчивых к антибиотикам бактериальных пятен, хотя такие частицы не могут быть использованы в течение длительного времени из-за нестабильности и склонности к агрегации. Несмотря на это, улучшая стабильность НЧ Ag, эти наночастицы могут использоваться в различных биомедицинских и биотехнологических приложениях (Nakamura et al. 2019).).
Выражаем благодарность доктору Арменуи Могровян, кафедра фармакогнозии, Ереванский государственный медицинский университет, Армения, за предоставленные растительные экстракты.
SH выполнял экспериментальную часть под непосредственным руководством NS. MJN помогал в проведении экспериментов, предоставлял аванс. AT руководил исследованием, предоставлял авансы и критические комментарии. Все остальные авторы внесли свой вклад в пересмотр, критически прокомментировали и отредактировали рукопись. Все авторы прочитали и одобрили рукопись.
Исследование выполнено при базовой поддержке Комитета науки Министерства образования, науки, культуры и спорта Армении, Ереванскому государственному университету, а также программе ЕС Erasmus + Exchange от Саарландского университета, Германия, для SH.
Все данные, полученные или проанализированные в ходе этого исследования, включены в эту опубликованную статью.
Неприменимо.
Неприменимо.
Авторы заявляют об отсутствии конфликта интересов.
Примечание издателя
Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
- Агаджанян А., Габриелян Л., Шуберт Р., Трчунян А. Биовосстановление ионов серебра в наночастицах с использованием экстракта Artemisia annua L: характеристика и применение в качестве антибактериальных средств. АМБ Экспресс. 2020;10:66. doi: 10.1186/s13568-020-01002-w. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Александр JW. История медицинского применения серебра. Сур Инфекция. 2009 г.;10(3):289–292. doi: 10.1089/sur.2008.9941. [PubMed] [CrossRef] [Google Scholar]
- Аль-Шарки А., Апун К., Винсент М., Канакараджу Д., Билунг Л.М. Повышение антибактериальной эффективности наночастиц серебра в отношении грамположительных и грамотрицательных бактерий с помощью синего лазерного излучения. Int J Фотоэнергия. 2019;2019:1–12. doi: 10.1155/2019/2528490. [CrossRef] [Google Scholar]
- Анна К., Сперуда М., Кши Э. Сходства и различия между ионами серебра и серебром в наноформах в качестве антибактериальных агентов. Int J Mol Sci.
 2018;19(2):444. doi: 10.3390/ijms144. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2018;19(2):444. doi: 10.3390/ijms144. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Behravan M, Hossein A, Naghizadeh A, Ziaee M, Mahdavi R, Mirzapour A. Простой зеленый синтез наночастиц серебра с использованием Berberis vulgaris листьев и корней Экстракт и его антибактериальная активность. Int J Биол Макромоль. 2019; 124:148–154. doi: 10.1016/j.ijbiomac.2018.11.101. [PubMed] [CrossRef] [Google Scholar]
- Bhattacharjee S. DLS и дзета-потенциал — что они собой представляют и чем они не являются? J Управление выпуском. 2016; 235:337–351. doi: 10.1016/j.jconrel.2016.06.017. [PubMed] [CrossRef] [Академия Google]
- Кампос В., ДеАльба-Монтеро И., Руис Ф., Хирон С., Гарсия-Гарсия Э., Лоредо-Товиас М. Простой и быстрый метод включения наночастиц серебра в полиметилметакрилатные (ПММА) субстраты. Superficies и Vacío. 2017;30(4):51–55. [Google Scholar]
- Данаи М., Дехганкхолд М., Атаеи Даварани SFH, Джаванмард Р., Дохани А., Хорасани С.
 , Мозафари М.Р. Влияние размера частиц и индекса полидисперсности на клиническое применение систем липидных наноносителей. Фармацевтика. 2018;10(2):1–17. дои: 10.3390/фармацевтика10020057. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Мозафари М.Р. Влияние размера частиц и индекса полидисперсности на клиническое применение систем липидных наноносителей. Фармацевтика. 2018;10(2):1–17. дои: 10.3390/фармацевтика10020057. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Dhand C, Dwivedi N, Loh XJ, Ying ANJ, Varma NK, Beuerman RW, Lakshminarayanan R, Ramakrishna S. Методы и стратегии синтеза различных наночастиц и их приложения: всесторонний обзор. RSC Adv. 2015;5(127):105003–105037. doi: 10.1039/C5RA19388E. [CrossRef] [Google Scholar]
- Габриелян Л., Трчунян А. Антибактериальная активность наночастиц переходных металлов и мембранные механизмы действия. World J MicrobBiotechnol. 2019;35(10):162. doi: 10.1007/s11274-019-2742-6. [PubMed] [CrossRef] [Google Scholar]
- Genwali GR, Acharya PP, Rajbhandari M. Выделение галловой кислоты и оценка общего содержания фенолов в некоторых лекарственных растениях и их антиоксидантной активности. Непал J Sci Technol. 2013;14(1):95–102. doi: 10.
 3126/njst.v14i1.8928. [CrossRef] [Google Scholar]
3126/njst.v14i1.8928. [CrossRef] [Google Scholar] - Ghasemi K, Sciences SA, GhasemiY Ebrahimzadeh MA. Антиоксидантная активность, содержание фенолов и флавоноидов в кожуре и тканях 13 видов цитрусовых. Пак Дж Фарм Наук. 2009 г.;22(3):277–281. [PubMed] [Google Scholar]
- Кармакар С. (2019) Распределение частиц по размерам и дзета-потенциал на основе динамического светорассеяния: методы определения стабильности и поверхностного распределения заряженных коллоидных частиц. Материалы последних тенденций: Physics Chem 1-е изд., Studium Press Pvt Ltd., Индия, стр. 117-159
- Kondeti VSSK, Gangal U, Yatom S, Bruggeman PJ. Восстановление Ag + и синтез наночастиц серебра на границе плазма-жидкость с помощью высокочастотной плазменной струи атмосферного давления: механизмы и влияние поверхностно-активного вещества. J Vac Sci Technol A. 2017; 35 (6): 1–19. doi: 10.1116/1.4995374. [CrossRef] [Google Scholar]
- Кремер С.А., Рамачандран А., Перрон Г.Г. Антибиотическое загрязнение окружающей среды: от микробной экологии к государственной политике.
 Микроорганизмы. 2019;7(6):1–24. doi: 10.3390/микроорганизмы7060180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Микроорганизмы. 2019;7(6):1–24. doi: 10.3390/микроорганизмы7060180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Kumar A, Dixit CK. Методы характеристики наночастиц. Нукл кислоты Adv Nanomed Del Therap. 2019 г.: 10.1016/B978-0-08-100557-6.00003-1. [Перекрестная ссылка] [Академия Google]
- Кумар В., Ядав С.К. Растительно-опосредованный синтез наночастиц серебра и золота и их применение. J ХимТехнолБиотехнолог. 2009; 84: 151–157. doi: 10.1002/jctb.2023. [CrossRef] [Google Scholar]
- Lawhavinit O, Kongkathip N, Kongkathip B 2010 Антимикробная активность куркуминоидов из Curcuma longa L. в отношении патогенных бактерий креветок и кур. Kasetsart J (Nat. Sci.) 44(3):364–371
- Lee SH, Jun BH. Наночастицы серебра: синтез и применение в наномедицине. Int J Mol Sci. 2019;20(4):865. doi: 10.3390/ijms20040865. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Loiseau A, Asila V, Boitel-aullen G, Lam M (2019) Плазмонные наночастицы на основе серебра для биосенсоров и их использование в биосенсорах (Базель)9 (2):78.
 10.3390/bios
10.3390/bios78 [бесплатная статья PMC] [PubMed]
- Maclean AM, White CE, Fowler JE, Finan TM. Идентификация транспортной системы гидроксипролина у эндосимбионта бобовых Sinorhizobium meliloti . Взаимодействие мол растений и микробов. 2009 г.;22(9):1116–1127. doi: 10.1094/MPMI-22-9-1116. [PubMed] [CrossRef] [Google Scholar]
- Mcshan D, Ray PC, Yu H. Механизм молекулярной токсичности наносеребра. J Анал с едой и наркотиками. 2014;22(1):116–127. doi: 10.1016/j.jfda.2014.01.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Menon S, Agarwal H, Kumar SR, Kumar SV. Зеленый синтез наночастиц серебра с использованием экстрактов листьев лекарственного растения Acalypha indica и его применение в качестве антиоксиданта и противомикробного агента против патогенов пищевого происхождения. Int J App Фарм. 2017;9(5): 42–50. doi: 10.22159/ijap.2017v9i5.19464. [CrossRef] [Google Scholar]
- Мнацаканян Н, Трчунян А. Нанокомпозитный фильтр из пористого минерального туфа с абсорбированными наночастицами серебра и его применение для обеззараживания воды.
 J Подача воды 2018;67:127–136. doi: 10.2166/aqua.2018.161. [CrossRef] [Google Scholar]
J Подача воды 2018;67:127–136. doi: 10.2166/aqua.2018.161. [CrossRef] [Google Scholar] - Могровян А. Саакян Н., Бабаян А., Чичоян Н., Петросян М., Трчунян А. Эфирное масло и этаноловый экстракт орегано ( Origanum vulgare L) от ArmenianFlora как природный источник терпенов, флавоноидов и другие фитохимические вещества с антирадикальной, антиоксидантной, металлохелатирующей, ингибирующей тирозиназу и антибактериальной активностью. Curr Pharmaceut Design. 2019;25(16):1809–1816. doi: 10.2174/13816128256661
095612. [PubMed] [CrossRef] [Google Scholar] - Moodley JS, Babu S, Krishna N, Pillay K. Зеленый синтез наночастиц серебра из экстрактов листьев Moringa oleifera и его антимикробный потенциал. Adv Nat Sci Nanosci Nanotechnol. 2018;9(1):1–9. doi: 10.1088/2043-6254/aaabb2. [CrossRef] [Google Scholar]
- Моронес Дж. Р., Элечигуэрра Дж. Л., Камачо А., Холт К., Коури Дж. Б., Рамирес Дж. Т., Якаман М. Дж. Бактерицидный эффект наночастиц серебра.
 Нанотехнологии. 2005; 16: 2346–2353. дои: 10.1088/0957-4484/16/10/059. [PubMed] [CrossRef] [Google Scholar]
Нанотехнологии. 2005; 16: 2346–2353. дои: 10.1088/0957-4484/16/10/059. [PubMed] [CrossRef] [Google Scholar] - Накамура С., Сато М., Сато Ю., Андо Н., Такаяма Т., Фудзита М., Исихара М. Синтез и применение наночастиц серебра (НЧ Ag) для профилактики инфекций в здравоохранении Рабочие. Int J Mol Sci. 2019;20:3620. doi: 10.3390/ijms20153620. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
- Pirtarighat S, Ghannadnia M, Baghshahi S. Зеленый синтез наночастиц серебра с использованием растительного экстракта Salvia spinosa, выращенного in vitro, и оценка их антибактериальной активности. J Nanostructure Chem. 2019;9(1):1–9. doi: 10.1007/s40097-018-0291-4. [CrossRef] [Google Scholar]
- Qing Y, Cheng L, Li R, Liu G, Zhang Y, Tang X, Wang J, Liu H, Qin Y. Потенциальный антибактериальный механизм наночастиц серебра и оптимизация ортопедических имплантатов с помощью передовых технологии модификации. Int L Nanomed. 2018;13:3311–3327. doi: 10.2147/IJN.S165125. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Рахман А.
 , Кумар С., Бафана А., Лин Дж., Дахуман С.А., Дже К. Механистический взгляд на индуцированный светом синтез наночастиц серебра с использованием внеклеточных полимеров вещества Chlamydomonas reinhardtii . Молекулы. 2019;24:3506. doi: 10,3390/молекулы24193506. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Кумар С., Бафана А., Лин Дж., Дахуман С.А., Дже К. Механистический взгляд на индуцированный светом синтез наночастиц серебра с использованием внеклеточных полимеров вещества Chlamydomonas reinhardtii . Молекулы. 2019;24:3506. doi: 10,3390/молекулы24193506. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Rautela A, Rani J, Das MD. Зеленый синтез наночастиц серебра из экстракта семян Tectona grandis: характеристика и механизм антимикробного действия на различные микроорганизмы. J. Anal Sci Technol. 2019;10(1):5. doi: 10.1186/s40543-018-0163-z. [CrossRef] [Google Scholar]
- Салари С., Эсмаилзаде С., Самзаде-кермани А. В — vitro оценка антиоксидантного и антибактериального потенциала зеленых синтезированных наночастиц серебра с использованием экстракта плодов Prosopis farcta . Иран Дж Фарм Рез. 2019;18(1):430–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Санкар Р., Кумбхакар П., Митра А.К. Зеленый синтез наночастиц серебра и его оптические свойства.
 Дайджест J Nanomater Biostruct. 2010;5(2):491–496. [Google Scholar]
Дайджест J Nanomater Biostruct. 2010;5(2):491–496. [Google Scholar] - Санкар Р., Картик А., Прабу А., Картик С., Шивашангари К.С., Равикумар В. Origanum vulgare опосредует биосинтез наночастиц серебра для его антибактериальной и противораковой активности. Colloids Surf, B. 2014; 108:80–84. doi: 10.1016/j.colsurfb.2013.02.033. [PubMed] [CrossRef] [Академия Google]
- Scandorieiro S, Camargo LC, Lancheros CAC, Yamada-Ogatta SF, Nakamura CV, Oliveira AG, Andrade CGTJ, Duran N, Nakazato G, Kobayashi RKT. Синергический и аддитивный эффект эфирного масла орегано и биологических наночастиц серебра в отношении штаммов бактерий с множественной лекарственной устойчивостью. Фронт микробиол. 2016;7:760. doi: 10.3389/fmicb.2016.00760. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Shaik MR, Khan M, Kuniyil M, Al-Warthan A, Alkhathlan HZ, Siddiqui MRH, Shaik JP, Ahhamed A, Mahmood A, Khan M, Adil СФ. Зеленый синтез наночастиц серебра с использованием растительного экстракта с использованием 9Экстракт 1211 Origanum vulgare L и их микробицидная активность.
 Устойчивость. 2018;10(4):913. doi: 10.3390/su10040913. [CrossRef] [Google Scholar]
Устойчивость. 2018;10(4):913. doi: 10.3390/su10040913. [CrossRef] [Google Scholar] - Согомонян Д.Р., Мнацаканян Н.С., Трчунян А.Х. К механизму антибактериального действия коллоидного серебра: изменение активности мембраноассоциированной протонной АТФазы у Escherichia coli и Enterococcus faecalis . Биолог J Армения. 2019;3(71):73–78. [Google Scholar]
- Шрикар С.К., Гири Д.Д., Пал Д.Б., Мишра П.К., Упадхьяй С.Н. Светоиндуцированный зеленый синтез наночастиц серебра с использованием водного экстракта Prunus amygdalus . Зеленая сустейн хим. 2016;6:26–33. doi: 10.4236/gsc.2016.61003. [CrossRef] [Google Scholar]
- Srirangam GM, Rao KP. Синтез и характеристика наночастиц серебра из экстракта листьев Malachra Capitata (L) Rasayan J Chem. 2017;10(1):46–53. doi: 10.7324/rjc.2017.1011548. [CrossRef] [Google Scholar]
- Шермер-олеарник Б., Зволинска К. Сравнение микробиологических и физико-химических методов подсчета микроорганизмов.
 Postepy Hig Med Dosw. 2014;68:1392–1396. doi: 10.5604/17322693.1130086. [PubMed] [CrossRef] [Google Scholar]
Postepy Hig Med Dosw. 2014;68:1392–1396. doi: 10.5604/17322693.1130086. [PubMed] [CrossRef] [Google Scholar] - Tarannum N, Gautam YK. Легкий зеленый синтез и применение наночастиц серебра: современный обзор. RSC Adv. 2019;9(60):34926–34948. doi: 10.1039/c9ra04164h. [CrossRef] [Google Scholar]
- Трчунян А., Габриелян Л., Мнацаканян Н. (2018) Наночастицы различных переходных металлов и их применение в качестве антимикробных агентов. В Saylor Y, IrbyV, Editors. Наночастицы металлов: свойства, синтез и применение, Hauppauge NY, USA: Nova Science Publ, 161-211
- Tungmunnithum D, Thongboonyou A, Pholboon A. Флавоноиды и другие фенольные соединения из лекарственных растений для фармацевтических и медицинских аспектов: обзор. Лекарства. 2018;5(3):93. doi: 10.3390/лекарства5030093. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Xu Y, Zhao H, Zhang M, Li C, Lin X, Sheng J. Изменения антиоксидантных свойств и способности поглощать NO во время ферментации чая.
 Int J Mol Sci. 2011;12(7):4574–459.0. doi: 10.3390/ijms12074574. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Int J Mol Sci. 2011;12(7):4574–459.0. doi: 10.3390/ijms12074574. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] - Yong NL, Ahmad A, Mohammad AW. Синтез и характеристика наночастиц оксида серебра новым методом. Int J Sci Eng Res. 2013;4(5):155–158. [Google Scholar]
Статьи из AMB Express предоставлены здесь с разрешения Springer-Verlag
Решение по химии 9. Какая помощь по химии нужна школьнику
Учебник по химии для 9 класса Габриелян — это сборник решений и ответов, набор готовых домашних заданий на основе учебника, составленного для 9 класса авторитетным русским педагогом и ученым — О.С. Габриелян. Он призван помочь школьникам в изучении химии — практическом закреплении теоретических знаний.
Решебник по химии, 9 класс Габриелян — белый учебник 2014-2017
Химия сложный предмет. Именно поэтому, по статистике, 60-65% школьников допускают ошибки при решении домашних задач. Как решить эту проблему? Совсем не обязательно искать дорогого репетитора – школьник в состоянии самостоятельно разобраться в уравнениях реакций и определить массу сложного раствора, если использует ГДЗ по химии за 9Габриелян-й класс.
Как решить эту проблему? Совсем не обязательно искать дорогого репетитора – школьник в состоянии самостоятельно разобраться в уравнениях реакций и определить массу сложного раствора, если использует ГДЗ по химии за 9Габриелян-й класс.
Наш сайт представляет собой продвинутую систему для использования онлайн-ответов на ребусы и примеры по химии для 9 класса. Школьники или их родители могут зайти на сайт с помощью планшета или телефона и найти нужный ответ по номеру.
Преимуществами нашего сайта перед другими ресурсами Рунета являются:
- регулярное обновление базы решебников;
- предлагает несколько решений для каждой задачи.
Обратившись к решениям нашего сайта, девятиклассники смогут понять схему решения задач по химии и составления уравнений реакций. эти знания помогут им в выполнении тестов и сдаче экзаменов. Родители на основе готовых ответов смогут проверить правильность выполнения детьми домашних заданий.
ГДЗ по химии 9 класс Габриелян О.
 С. — ответы на вопросы по учебнику
С. — ответы на вопросы по учебникуВ настоящее время в общеобразовательных школах России используется учебник для 9 класса О.С. Габриелян, изданный в 2014 г. во 2-м издании издательством «Дрофа».
Учебник состоит из 42 параграфов, в которых освещены основные вопросы неорганической химии:
- закономерности таблицы химических элементов Менделеева Д.И. и его структура;
- виды металлов, их физические и химические свойства;
- неметаллы, их свойства и направления использования.
Учебник Габриеляна О.С. также содержит вопросы, примеры и задания для повторения по химии для 8-9 классов. Тестовые задания к разделам позволяют проверить и закрепить теоретические знания.
Такая сложная структура позволяет школьникам успешно выполнять домашние задания, решать контрольные, сдавать экзамены и даже использовать знания, полученные при поступлении в вузы.
Изображения обложек учебников размещаются на страницах данного сайта исключительно в качестве иллюстративного материала (ст. 1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
1274 п. 1 части четвертой Гражданского кодекса Российской Федерации)
- Химия 9 кл. Задачник Кузнецова, Левкин Вентана-Граф
- Химия 9 кл. ФГОС Рудзитис, Фельдман Образование
- Контрольно-проверочная работа по химии 9 кл. ФГОС Габриелян, Краснова Дрофа
- Контрольно-измерительные материалы (КМ ) за 9 класс химии. ФГОС Стрельникова Вако
Рабочие тетради
- Габриелян, Сладков Дрофа
- Тетрадь для оценки качества знаний по химии, 9 класс. ФГОС Габриелян, Купцова Дрофа
- Рабочая тетрадь по химии, 9 класс. ФГОС Габрусева Просвещение
- Тетрадь по химии за 9 класс. ФГОС Гара Просвещение
- Тетрадь-экзаменатор по химии, 9 класс. 9. ФГОС Боровских. К учебнику Рудзитиса Экзамен
- Рабочая тетрадь по химии, 9 класс. ФГОС Микитюк. К учебнику Габриеляна Экзамен
Тесты
ГДЗ — три буквы, которые решат задачи в школе
- Химия – довольно специфический предмет и с каждым учебным годом разобраться в нем становится не так просто, как раньше.
 Разобраться с некоторыми темами за несколько школьных уроков не всегда получается, нанять репетитора иногда не представляется возможным в финансовом плане, поэтому решебники произвели настоящий фурор.
Разобраться с некоторыми темами за несколько школьных уроков не всегда получается, нанять репетитора иногда не представляется возможным в финансовом плане, поэтому решебники произвели настоящий фурор. - Если вы обычный школьник и химия для вас не самый понятный предмет — ГДЗ ваше спасение. Если вы отличник, но хотите узнать дополнительные алгоритмы решения, подробно разобрать сложную задачу или хотите проверить себя — этот решатель для вас. Если вы родитель и совсем забыли, что такое валентность и химические формулы, но проверяете домашнюю работу, которая нужна вашему ученику, — этот решебник идеальный помощник. Если вы учитель химии, который хочет строго контролировать учебный процесс и, не решая задачи самостоятельно, быстро узнать ответ — эта книга — подсказка поможет и вам.
- Сейчас купить раствор по химии можно практически в каждом книжном магазине, но стоит ли отдавать свои деньги навсегда, если нужен только один учебный год… Гораздо проще скачать электронную версию ГДЗ в интернете или посмотреть ответы онлайн.
 В одном небольшом файле будет вся программа по химии для 9 класса. Благодаря ГДЗ химия станет более доступной, а изучение более приятным.
В одном небольшом файле будет вся программа по химии для 9 класса. Благодаря ГДЗ химия станет более доступной, а изучение более приятным. - Многие девятиклассники выбирают химию как дисциплину, которую планируют сдавать на ОГЭ. Прежде всего, это те выпускники, которые планируют поступать в медицинские и сельскохозяйственные вузы, где этот предмет является ведущим и базовым. Грамотное отношение к напряженной работе, ответственность, скрупулезность помогут девятиклассникам эффективно подготовиться. В помощь — качественный набор учебников и решения к ним. Достаточно регулярно выделять определенное количество времени на подготовку, и результат не заставит себя долго ждать.
- Через ГДЗ можно не только подготовиться к ВПР, диагностические и итоговые анализы. Сборники позволят вам самостоятельно работать на предметных олимпиадах по дисциплине. Для девятиклассников победа в нем может означать возможность поступления в вузы по окончании одиннадцатого класса без внутренних экзаменов или с другими привилегиями.
 За победителями в 9 классе преимущество сохраняется на следующие два года. Комплект необходимой для подготовки учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам – школьным учителям, тьюторам, руководителям кружков и курсов.
За победителями в 9 классе преимущество сохраняется на следующие два года. Комплект необходимой для подготовки учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам – школьным учителям, тьюторам, руководителям кружков и курсов. - Наиболее сложными для изучения и понимания учащимися являются такие разделы дисциплины химия в 9 классе, как:
— химические элементы и их характеристика;
— периодическая система Д. И. Менделеева и периодический закон;
— реакции и их катализаторы;
— понятия и свойства металлов и неметаллов с точки зрения химии;
— неорганические вещества и их основные свойства. - Ряд учебных пособий предлагают подготовку к итоговой аттестации в течение последней четверти учебного года. Вы можете сформировать свою собственную методику преподавания и обучения, ориентируясь на свои задачи и цели. В такой комплект помимо стандартного учебного пособия по теории необходимо включить:
— рабочая тетрадь по химии;
— тетрадь для практических и лабораторных опытов;
— проверка и контроль работа;
— тесты, задачи и упражнения по химии.
- Для обучающихся самостоятельно и находящихся на семейной форме обучения могут быть включены в комплект рабочие программы и планы уроков по химии для 9 класса, методические разработки учителей и экспертов, тетради и сборники для оценки качества знаний.
Готовое домашнее задание (ГДЗ) к учебнику Рудзитис Г.Е. «Химия. 9 класс» — книга, включающая решенные примеры и задачи. Не окажут ли готовые ответы медвежью услугу девятикласснику? Многие учителя говорят, что такое пособие – спасательный круг для школьников с плохой успеваемостью по химии. А все, кто интересуется химией, желает продолжить обучение, смогут проверить свои ответы и решения.
Какая помощь по химии нужна школьнику?
Не все предметы школьники усваивают без проблем. Некоторые люди, начиная с 8-го класса, имеют отношение к химии как к очень сложной и непонятной науке. Проблемы начинаются, когда нужно запомнить химические знаки, валентность, уметь определять коэффициенты в уравнениях и производить расчеты. Трудности могут быть временными и ученику нужно лишь более уверенно усвоить непонятный ему материал.
Трудности могут быть временными и ученику нужно лишь более уверенно усвоить непонятный ему материал.
С помощью ГДЗ ребенок начнет понимать суть вопросов и заданий, предлагаемых в учебнике Рудзитиса. В книге решений, помимо уравнений реакций и ответов на задачи, даются аргументированные пояснения и алгоритмы действий. Эти шаблоны помогут вашему девятикласснику лучше успевать в классе и дома.
Как пользоваться ГДЗ?
Решебник подходит для закрепления и самопроверки изученных на уроках тем. Первая глава, которую изучают по учебнику Рудзитиса — «Электролитическая диссоциация» — является одним из самых сложных разделов химии. Также автор включил несколько тем из органической химии, основы химического производства. Благодаря ГДЗ девятиклассник сможет проверить выполнение наиболее сложных заданий учителя на уроке, домашнего задания. Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Пособие дает возможность родителям школьников увидеть, каковы успехи ребенка в освоении химии. Книга позволяет контролировать учебную работу и помогает в освоении сложного курса. Руководство можно использовать онлайн на нашем веб-сайте. Для каждого переиздания учебника Рудзитиса предлагается свой вариант ГДЗ.
Книга позволяет контролировать учебную работу и помогает в освоении сложного курса. Руководство можно использовать онлайн на нашем веб-сайте. Для каждого переиздания учебника Рудзитиса предлагается свой вариант ГДЗ.
Axis vi и ходили на уроки химии до введения важных тем более подробно — растворы, химия реакций, органические соединения, углеводы, спирты, кислоты. Окрим имеет право на те задачи, которые вы пока будете посещать в лаборатории, а по результатам — писать роботы. Защита знания кожи верна от химии образа хималихского знания. А вонь лепится в процессе вивчення вивчення и повторения уроков. Чтобы вам было проще посетить домашний кабинет из ГДЗ для девятого класса по химии. Это твой специальный консультант по випадкам, если инструктор не проинструктирован, а папа будет брать уроки.
Учитесь подсказки к заданиям по химии
Если вам легко начать, например, взаимосвязь между словами и взаимодействиями, если вы хотите что-то изменить, то посмотрите готовые домашние задания по химии за 9 класс. Все, что было не до конца ума, пропущено на уроке, объяснять решебнику. Тем более, что это настолько просто и доступно, что вы легко можете лишить своего домашнего робота 12 баллов. Не забудьте поделиться секретами высоких оценок с девятиклассниками. Также для некоторых из них жизнеспособным станет девятый класс, а оценки по всем предметам будут гарнимыми.
Все, что было не до конца ума, пропущено на уроке, объяснять решебнику. Тем более, что это настолько просто и доступно, что вы легко можете лишить своего домашнего робота 12 баллов. Не забудьте поделиться секретами высоких оценок с девятиклассниками. Также для некоторых из них жизнеспособным станет девятый класс, а оценки по всем предметам будут гарнимыми.
Читать химию онлайн — лучшее решение для школьников
Как домашнее задание по химии стало для вас на заданиях, следите за ситуацией. Покажитесь на ГДЗ по химии за 9 класс с удовольствием, ведь это еще так просто! Со своего компьютера по номеру телефона зайдите на сайт GDZ4YOU, видна на коже. Мстит им безкоштовно, без повторных наслоений. Опросите хотя бы одну децильку авторов для разных авторов, тогда на сайте вы сможете узнать, какая именно нужная пицца. Независимо от этого, вы знаете, портал доступен. Дина умова — подключение к интернету.
Будь вундеркиндом
Кожаный предмет, как є в школьном раздатчике девятиклассников, можно читать с учеником 9 класса. Включая географию, которая богата разнообразием и универсально наглядна. Это предмет, который позволяет многое узнать обо всем мире – суше, океанах. С ней можно научиться за урок просыпаться от пивничей к пивденю, повувати на зеленые стержни земли. Для дополнительной помощи контурных карт школы должны быть нарисованы, чтобы нарисовать и понять развитие смысла. А завдяки атлас и карты вони могут расповисти богато цыкавого о коже континента.
Включая географию, которая богата разнообразием и универсально наглядна. Это предмет, который позволяет многое узнать обо всем мире – суше, океанах. С ней можно научиться за урок просыпаться от пивничей к пивденю, повувати на зеленые стержни земли. Для дополнительной помощи контурных карт школы должны быть нарисованы, чтобы нарисовать и понять развитие смысла. А завдяки атлас и карты вони могут расповисти богато цыкавого о коже континента.
Антимикробные свойства пробиотического штамма Bacillus Subtilis 534
2 Академик В.И. Шумакова Федеральный исследовательский центр трансплантологии и искусственных органов, Россия
3 Институт биоорганической химии имени Шемякина и Овчинникова РАН, Россия
Фон
Эффективность антибактериальной терапии постоянно снижается из-за увеличения распространения резистентных возбудителей. Одним из альтернативных методов лечения инфекций является использование пробиотиков – живых микроорганизмов, способствующих нормализации микробиоты человека. Целью данного исследования является определение антибиотических свойств штамма 534 как предполагаемой основы его пробиотической активности.
Целью данного исследования является определение антибиотических свойств штамма 534 как предполагаемой основы его пробиотической активности.
Методы
Объектом нашего исследования является транзиентный пробиотик штамм Bacillus subtilis 534, являющийся основой препарата Споробактерин. Штамм 534 культивировали в погруженных условиях и полученную культуральную жидкость (КЖ) исследовали на антимикробную активность методом диффузии в агаризованную среду. В качестве тест-объектов использовали коллекционные штаммы бактерий и грибов, а также клинические изоляты с различной устойчивостью к антибиотикам. Для предварительной химической характеристики ХЛ пропускали через колонку с сорбентом Amberlite XAD-2. Антимикробные компоненты десорбировали смесью н-бутанол-ацетон-вода (1:1:1), полученные элюаты упаривали в вакууме досуха и растворяли в водном этаноле. Последующую очистку антимикробных компонентов проводили на колонке с силикагелем Kieselgel 60 (Merck) при ступенчатом элюировании хлороформ-метанольными растворителями в различных соотношениях. Для определения активных фракций использовали тест-штаммы 9Использовали 1211 Staphylococcus aureus INA 00761 (метициллин-резистентный S. aureus — MRSA) и Saccharomyces cerevisiae RIA 259.
Для определения активных фракций использовали тест-штаммы 9Использовали 1211 Staphylococcus aureus INA 00761 (метициллин-резистентный S. aureus — MRSA) и Saccharomyces cerevisiae RIA 259.
Результаты
При глубинном культивировании штамм 534 продуцирует антимикробные вещества, подавляющие рост грамположительных бактерий и грибов. ХЛ штамма 534 ингибирует рост не только тест-штаммов, но и клинических изолятов с различной антимикробной устойчивостью следующих грамположительных бактерий и грибов: Staphylococcus aureus, S. epidermidis, S. capitis sbsp. urealyticus, Сandidaalbicans, С. glabrata, C. lusitaniae, Cryptococcus neoformans, Prototheca sp., Trichosporon sp. Хотя в КЛ не было обнаружено активности в отношении грамотрицательных бактерий, такая активность была обнаружена после концентрации КЛ примерно в 800 раз, включая активность в отношении некоторых клинических изолятов полирезистентных бактерий Klebsiella pneumonia и Acinetobacter baumannii видов.
Заключение
Спектр антимикробной активности КЖ свидетельствует о способности пробиотического штамма B. subtilis 534 продуцировать антимикробные вещества, активные в отношении широкого круга бактерий и грибов, в том числе резистентных к современным медицинским антибиотикам. Мы рассматриваем этот штамм как продуцент антибиотиков, преодолевающих лекарственную устойчивость патогенных микроорганизмов, и планируем его дальнейшее химическое исследование.
Устойчивость к антибиотикам, Патогенные микроорганизмы, Антимикробная активность, Bacillus subtilis 534, Пробиотик споробактерин
Применение антибиотиков в медицине началось во время Второй мировой войны, но на протяжении последних десятилетий эффективность антибактериальной терапии постоянно снижается из-за развития резистентности патогенных микроорганизмов [1-3]. Сложившаяся ситуация требует разработки и внедрения в медицинскую практику новых антибиотиков, а также других противомикробных препаратов. К последним относятся пробиотики – препараты, основу которых составляют живые микроорганизмы, способствующие нормализации микробиоты человека. Термин «пробиотик» также применяется непосредственно к пробиотическим микроорганизмам. Действие пробиотиков носит многофакторный характер, и одним из действующих начал является образование антибиотических веществ, способствующих восстановлению баланса микробиоты. Ценным свойством многих пробиотиков является отсутствие токсичности [4].
К последним относятся пробиотики – препараты, основу которых составляют живые микроорганизмы, способствующие нормализации микробиоты человека. Термин «пробиотик» также применяется непосредственно к пробиотическим микроорганизмам. Действие пробиотиков носит многофакторный характер, и одним из действующих начал является образование антибиотических веществ, способствующих восстановлению баланса микробиоты. Ценным свойством многих пробиотиков является отсутствие токсичности [4].
К пробиотическим микроорганизмам относятся такие обитатели кишечника, как стрептококки, лактобактерии и бифидобактерии, а также транзиторные микроорганизмы, т.е. временно присутствующие в организме человека. В частности, сенная палочка ( Bacillus subtilis ), широко распространенная в природе и попадающая в организм человека с водой и пищей, дает основание некоторым исследователям рассматривать эту бактерию как обитателя нормальной кишечной микробиоты [5-7]. Первым описанным бациллярным пробиотиком был штамм B. subtilis , выделенный из раны в 1945 г. [8]. Результатом последующих исследований стало выделение из бацилл многих антибиотиков различного строения, активных как в отношении грамположительных, так и грамотрицательных микроорганизмов, а также грибов [9-13]. В медицинской практике разных стран применяют биопрепараты на основе бактерий рода Bacillus . В Западной Европе применяют пробиотик Бактисубтил (фирма Marion Merrell, Франция) и его аналог Флонивин БС (фирма Галеника, Словения). В основе этих препаратов 9Штамм 1211 B. cereus IP 5832 из коллекции Института Пастера (Франция). Известен также биологический препарат Цереобиоген (Син Цзянь, Китай), действующим веществом которого является штамм B. cereus DM-423. Вьетнамский препарат Биосубтил в качестве действующего вещества содержит штамм B. subtilis . В России зарегистрировано три препарата на основе бацилл: Биоспорин, Споробактерин, Бактиспорин. Биоспорин — единственный комплексный препарат, основу которого составляют два штамма — 9.
subtilis , выделенный из раны в 1945 г. [8]. Результатом последующих исследований стало выделение из бацилл многих антибиотиков различного строения, активных как в отношении грамположительных, так и грамотрицательных микроорганизмов, а также грибов [9-13]. В медицинской практике разных стран применяют биопрепараты на основе бактерий рода Bacillus . В Западной Европе применяют пробиотик Бактисубтил (фирма Marion Merrell, Франция) и его аналог Флонивин БС (фирма Галеника, Словения). В основе этих препаратов 9Штамм 1211 B. cereus IP 5832 из коллекции Института Пастера (Франция). Известен также биологический препарат Цереобиоген (Син Цзянь, Китай), действующим веществом которого является штамм B. cereus DM-423. Вьетнамский препарат Биосубтил в качестве действующего вещества содержит штамм B. subtilis . В России зарегистрировано три препарата на основе бацилл: Биоспорин, Споробактерин, Бактиспорин. Биоспорин — единственный комплексный препарат, основу которого составляют два штамма — 9. 1211 B. subtilis 2335 и B. licheniformis 2336. Споробактерин и бактиспорин основаны на штаммах B. subtilis — 534 и 3H соответственно.
1211 B. subtilis 2335 и B. licheniformis 2336. Споробактерин и бактиспорин основаны на штаммах B. subtilis — 534 и 3H соответственно.
Препарат Споробактерин представляет собой суспензию спор пробиотика штамма B. subtilis 534 в 7% водном растворе натрия хлорида. В России пробиотик споробактерин применяется в течение последних тридцати лет, в частности, для профилактики и лечения послеоперационных бактериальных и грибковых инфекций в высокотехнологичной хирургии, в том числе в трансплантологии [14-16]. К настоящему времени опубликованы результаты многолетних клинико-лабораторных исследований, согласно которым использование Споробактерина в технологии раннего послеоперационного ведения больных кардиохирургического и трансплантационного профилей открывает возможности для оптимизации клинического состояния больных. , а также значительно сокращает продолжительность курсов антибактериальной терапии [17-20]. Целью данного исследования было определение способности штамма 534 продуцировать антимикробные вещества в условиях in vitro условия культивирования для последующего рассмотрения данного штамма в качестве продуцента медицинских антибиотиков. В качестве тест-организмов использовали коллекционные тест-штаммы и клинические изоляты с различной антибиотикорезистентностью.
В качестве тест-организмов использовали коллекционные тест-штаммы и клинические изоляты с различной антибиотикорезистентностью.
Объект исследования
Bacillus subtilis 534 является основой пробиотика споробактерина. Штамм депонирован в Микробиологической коллекции Института новых антибиотиков им. Гаузе под номером ИНА 01122 (Россия). Последовательность штамма 534 депонирована в базе данных GenBank под номером KU05169.6 [21].
Условия выращивания
Глубинное культивирование штамма B. subtilis 534 проводили на модифицированной среде №2 Gause следующего состава (%): глюкоза — 1, пептон — 0,5, триптон — 0,3, NaCl — 0,5, вода водопроводная; рН 7,2-7,4. Споры штамма 534 в количестве 10 6 /мл инъецировали в колбы Эрленмейера вместимостью 750 мл со 150 мл среды, после чего колбы помещали на роторный шейкер со скоростью вращения 220 об/мин и инкубировали при 28 ℃. Антимикробную активность культуральной жидкости (КЖ) определяли на 2, 4 и 7 сутки культивирования. Было проведено 12 культиваций с не менее чем тремя параллельными опытами.
Было проведено 12 культиваций с не менее чем тремя параллельными опытами.
Для поверхностного культивирования всех тест-микроорганизмов использовали универсальный для бактерий и грибов агаризованный вариант модифицированной среды №2 Гаузе с добавлением 2% агара. Штаммы грибов Aspergillus niger ИНА 00760, Saccharomyces cerevisiae РИА 259 и штаммы бактерий Comamonas terrigena ВКПМ В-7571 и Leuconostoc mesenteroides ВКПМ В-4187, в том числе клинические штаммы ℃ пробиотический штамм B. subtilis 534, при 37 ℃. Продолжительность культивирования всех тест-штаммов составила 20 часов.
Выделение и очистка противомикробных компонентов
Через колонку, заполненную 80 мл сорбента Амберлит ХАД-2, пропускали 0,8 л культуральной жидкости штамма Bacillus subtilis 534. Антимикробные компоненты десорбировали смесью «н-бутанол-ацетон-вода» (1:1:1) при нейтральном рН. Полученные элюаты упаривали в вакууме досуха при 37°С и сухой остаток растворяли в 60% водном этаноле. Дальнейшую очистку антимикробных компонентов проводили на колонке с силикагелем Kieselgel 60 (Merck) с использованием ступенчатой элюции хлороформ-метанольными растворителями (9:1, 8:2, 7:3, 6:4 и 5:5). Фракции из колонки тестировали на биологическую активность в отношении тест-штаммов Staphylococcus aureus INA 00761 (MRSA) и Sac. cerevisiae RIA 259. Активные фракции упаривали досуха, растворяли в 1 мл метанола (800-кратная концентрация) и анализировали методом тонкослойной хроматографии (ТСХ) на силикагелевых пластинах в системе растворителей этилацетат-метанол (1: 4) с последующей биоавтографией. Из трех выбранных активных компонентов антимикробными свойствами обладает компонент №1 с R 9.0797 f = 0,7 изучено более детально.
Дальнейшую очистку антимикробных компонентов проводили на колонке с силикагелем Kieselgel 60 (Merck) с использованием ступенчатой элюции хлороформ-метанольными растворителями (9:1, 8:2, 7:3, 6:4 и 5:5). Фракции из колонки тестировали на биологическую активность в отношении тест-штаммов Staphylococcus aureus INA 00761 (MRSA) и Sac. cerevisiae RIA 259. Активные фракции упаривали досуха, растворяли в 1 мл метанола (800-кратная концентрация) и анализировали методом тонкослойной хроматографии (ТСХ) на силикагелевых пластинах в системе растворителей этилацетат-метанол (1: 4) с последующей биоавтографией. Из трех выбранных активных компонентов антимикробными свойствами обладает компонент №1 с R 9.0797 f = 0,7 изучено более детально.
Тест-организмы и определение противомикробной активности
В качестве тестов для определения антимикробной активности использовали международные коллекционные штаммы грамположительных и грамотрицательных бактерий, грибов (табл. 1), а также клинические изоляты патогенных микроорганизмов с различной антибиотикорезистентностью (табл. 2, табл. 3, табл. 4 и Таблица 5). Видовую идентификацию клинических изолятов патогенных микроорганизмов, а также их чувствительность/резистентность к антибиотикам проводили на автоматизированном бактериологическом анализаторе для идентификации микроорганизмов Siemens MicroScan Walk Away — 9Система 6 плюс. Антимикробную активность культуральной жидкости (КЖ) B. subtilis 534 и экстракта ее активного компонента определяли агаро-диффузионным методом. По 100 мкл КЖ вносили в лунки диаметром 9 мм на агаризованной среде, контаминированной тест-организмом. Выбранный антимикробный компонент наносили на диски диаметром 6 мм и помещали на поверхность агаризованной среды.
1), а также клинические изоляты патогенных микроорганизмов с различной антибиотикорезистентностью (табл. 2, табл. 3, табл. 4 и Таблица 5). Видовую идентификацию клинических изолятов патогенных микроорганизмов, а также их чувствительность/резистентность к антибиотикам проводили на автоматизированном бактериологическом анализаторе для идентификации микроорганизмов Siemens MicroScan Walk Away — 9Система 6 плюс. Антимикробную активность культуральной жидкости (КЖ) B. subtilis 534 и экстракта ее активного компонента определяли агаро-диффузионным методом. По 100 мкл КЖ вносили в лунки диаметром 9 мм на агаризованной среде, контаминированной тест-организмом. Выбранный антимикробный компонент наносили на диски диаметром 6 мм и помещали на поверхность агаризованной среды.
Таблица 1: Антимикробный спектр в отношении коллекционных штаммов и самый высокий установленный уровень антимикробной активности в Bacillus subtilis 534 Культуральная жидкость (КЛ). Просмотр таблицы 1
Просмотр таблицы 1
Таблица 2: Противомикробная активность культуральной жидкости (CL) Bacillus subtilis 534 в отношении клинических изолятов Staphylococcus spp. Просмотр таблицы 2
Таблица 3. Активность компонента № 1 антибактериального комплекса B. subtilis 534 в отношении клинических изолятов A. baumannii. Просмотр таблицы 3
Таблица 4. Противомикробная активность компонента №1 антибактериального комплекса B. subtilis 534 в отношении клинических изолятов K. pneumoniae . Просмотр таблицы 4
Таблица 5. Зоны задержки роста клинических изолятов патогенных грибов под действием культуральной жидкости (КЖ) штамма B. subtilis 534 (диаметр в мм). Посмотреть таблицу 5
Показано, что штамм 534 продуцирует и выделяет в КЖ антимикробные компоненты с разным антимикробным спектром, максимальная активность которых достигается в разное время (рис. 1). Из рисунка 1 следует, что в состав КЛ входит не менее четырех различных соединений или групп соединений, различающихся антимикробной активностью:
1). Из рисунка 1 следует, что в состав КЛ входит не менее четырех различных соединений или групп соединений, различающихся антимикробной активностью:
Рисунок 1: Динамика антимикробной активности штамма B. subtilis 534 при глубинном культивировании. Посмотреть рисунок 1
— антибактериальная активность только в отношении штамма B. subtilis ATCC 6633 и только на вторые сутки культивирования; такая активность может быть обусловлена бактериоцином;
— противогрибковая активность, пик которой приходится на вторые сутки и постепенно снижается к седьмым суткам;
— Антибактериальная активность в отношении M. luteus NCTC 8340 и S. aureus FDA 209P (метициллин-чувствительные S. aureus -MSSA), которая проявляется на третьи сутки культивирования и усиливается на седьмые сутки;
— Антибактериальная активность в отношении B. pumilus NCTC 8241 и S. aureus INA 00761 (MRSA).
Максимально возможные уровни антимикробной активности в вышеописанных условиях культивирования приведены в табл. 1. Из рис. 1 и табл. 1 следует, что штамм 534 ингибирует рост грамположительных бактерий и грибов. Важно отметить, что CL активен в отношении резистентных к метициллину и оксациллину Staphylococcus aureus (MRSA) и тест-штамм Leuconostoc mesenteroides ВКПМ В-4177 с высоким уровнем естественной устойчивости к ванкомицину.
На следующем этапе была протестирована антимикробная активность культуральной жидкости штамма 534 в отношении 15 клинических изолятов рода Staphylococcus (табл. 2). Для двух клинических изолятов S. capitis sbsp. urealyticus 1133 и S. epidermidis 2624 проявляла выраженную противомикробную активность. Важно отметить, что штамм 2624 устойчив к 15 медицинским антибиотикам из 20, поэтому в качестве эффективных препаратов можно использовать только 5 антибиотиков: даптомицин, линезолид, рифампин, синерцид и ванкомицин. В дальнейшем при химическом исследовании культуральной жидкости штамма 534 проводили микробиологический контроль с выделением активных компонентов с помощью тест-штамма MRSA INA 00761 (рис. 2).
В дальнейшем при химическом исследовании культуральной жидкости штамма 534 проводили микробиологический контроль с выделением активных компонентов с помощью тест-штамма MRSA INA 00761 (рис. 2).
Рисунок 2: Чувствительность к антибиотикам двух штаммов S. aureus : FDA 209P (MSSA, слева) и INA 00761 (MRSA, справа). С левой стороны чашек расположены диски с 1 мкг оксациллина (OX, вверху) и 5 мкг ванкомицина (VA, внизу). С правой стороны диск с 5 мкл компонента №1 из КЛ штамма 534. Посмотреть рисунок 2
Культуральная жидкость B. subtilis 534 не проявляла активности в отношении коллекционных штаммов грамотрицательных бактерий (табл. 1). Однако при выделении и, соответственно, повышении концентрации компонента №1, который по предварительным оценкам состоял из полипептидных соединений, такая активность наблюдалась в отношении ряда клинических изолятов грамотрицательных бактерий (табл. 3 и табл. 4). Хотя уровень активности компонента №1 по отношению к A. baumannii и K. pneumoniae является низким, необходимы дальнейшие биотехнологические и химические исследования, поскольку полирезистентные бактерии чувствительны к компоненту № 1. Например, A. baumannii клинические изоляты 1630, 2050, 2455, 2617, 3122, 3166, 3208 и 4354, а также K. pneumonia 1878 чувствительны к компоненту №1, но устойчивы ко всем испытанным современным медицинским антибиотикам. Анализ компонента №1 показал, что он состоит не менее чем из двадцати веществ, из которых количественно преобладают пять. Три из пяти компонентов подтвердили антибиотическую активность. По предварительным данным можно предположить, что действующие вещества имеют пептидную природу.
baumannii и K. pneumoniae является низким, необходимы дальнейшие биотехнологические и химические исследования, поскольку полирезистентные бактерии чувствительны к компоненту № 1. Например, A. baumannii клинические изоляты 1630, 2050, 2455, 2617, 3122, 3166, 3208 и 4354, а также K. pneumonia 1878 чувствительны к компоненту №1, но устойчивы ко всем испытанным современным медицинским антибиотикам. Анализ компонента №1 показал, что он состоит не менее чем из двадцати веществ, из которых количественно преобладают пять. Три из пяти компонентов подтвердили антибиотическую активность. По предварительным данным можно предположить, что действующие вещества имеют пептидную природу.
Препарат Споробактерин представляет собой взвесь спор B. subtilis 534 в 7% водном растворе натрия хлорида, предназначен для приема внутрь. Ранее нами было показано, что споробактерин сам по себе не обладает антибиотическими свойствами in vitro [21]. Наоборот, в условиях глубинного культивирования штамма 534 в питательной среде проявляется широкий спектр антимикробной активности. С другой стороны, известно, что пребывание B. subtilis в кишечнике теплокровных животных сохраняется от 10 до 30 дней, причем бактерии присутствуют как в виде вегетативных клеток, так и спор. Процесс прорастания и спороношения спор повторяется несколько раз перед выведением из организма с фекалиями [22,23].
С другой стороны, известно, что пребывание B. subtilis в кишечнике теплокровных животных сохраняется от 10 до 30 дней, причем бактерии присутствуют как в виде вегетативных клеток, так и спор. Процесс прорастания и спороношения спор повторяется несколько раз перед выведением из организма с фекалиями [22,23].
На основании этих данных мы предположили, что в кишечнике и в питательной среде в колбах процессы развития B. subtilis сходны и возможен бактериальный биосинтез антимикробных веществ в пищеварительном тракте. Способность штамма 534 секретировать антибактериальные и противогрибковые вещества может быть основным объяснением эффективности споробактерина в предупреждении развития и лечении бактериальных и грибковых инфекций наряду с такими свойствами, как повышение иммунитета, стимуляция роста нормальной кишечной микрофлоры и секреции. пищеварительных ферментов. Особенно ценно, что пробиотический штамм 534 способен продуцировать вещества, преодолевающие антибиотикорезистентность клинических изолятов ряда грамположительных бактерий и грибов. Что касается грамотрицательных бактерий, то также возможно проявление антимикробной активности in vitro , хотя и с низкой интенсивностью. Поскольку B. subtilis 534 способен продуцировать вещества, активные в отношении клинических изолятов с разным спектром устойчивости к современным антибиотикам, можно предположить, что эти вещества имеют разные молекулярные мишени в клетках (или на поверхности клеток) патогенных микроорганизмов. . В настоящее время мы рассматриваем штамм B. subtilis 534 в качестве продуцента антибиотиков и работаем над идентификацией продуцируемых противомикробных соединений.
Что касается грамотрицательных бактерий, то также возможно проявление антимикробной активности in vitro , хотя и с низкой интенсивностью. Поскольку B. subtilis 534 способен продуцировать вещества, активные в отношении клинических изолятов с разным спектром устойчивости к современным антибиотикам, можно предположить, что эти вещества имеют разные молекулярные мишени в клетках (или на поверхности клеток) патогенных микроорганизмов. . В настоящее время мы рассматриваем штамм B. subtilis 534 в качестве продуцента антибиотиков и работаем над идентификацией продуцируемых противомикробных соединений.
Можно ли обнаружить новые антибиотики в B. subtilis ? Среди бацилл вид B. subtilis занимает первое место по количеству описанных антибиотиков различной химической природы, среди которых поликетидные антибиотики [24], фосфолипиды [25], полиены [25-28], макролактины [29]. ] и различные пептиды, различающиеся по химической природе, механизму биосинтеза и антимикробным спектрам. Некоторые антибиотики B. subtilis используются в качестве современных лекарственных средств. Пептидный антибиотик бацитрацин, один из первых антибиотиков, описанных в 1945, образованный штаммом B. subtilis , выделенным из раны человека, до сих пор используется в медицине [8]. В настоящее время известен ряд близких антибиотиков, образующих бацитрациновый комплекс [30]. В связи с низкой токсичностью в 2010 г. бацитрацин был одобрен в США для лечения стафилококковых инфекций у новорожденных [9]. Комбинация бацитрацина с неомицином эффективна в отношении большинства клинических изолятов резистентного стафилококка (MRSA), что очень важно для современной антимикробной терапии [31]. Среди Пептиды B. subtilis , относительно крупные пептидные антибиотики — бактериоцины, имеющие молекулярную массу в десятки тысяч Дальтон, характеризующиеся узким спектром антибиотической активности и действующие на другие штаммы B. subtilis , т.е. действующие как внутривидовые регуляторный фактор [8,32,33].
Некоторые антибиотики B. subtilis используются в качестве современных лекарственных средств. Пептидный антибиотик бацитрацин, один из первых антибиотиков, описанных в 1945, образованный штаммом B. subtilis , выделенным из раны человека, до сих пор используется в медицине [8]. В настоящее время известен ряд близких антибиотиков, образующих бацитрациновый комплекс [30]. В связи с низкой токсичностью в 2010 г. бацитрацин был одобрен в США для лечения стафилококковых инфекций у новорожденных [9]. Комбинация бацитрацина с неомицином эффективна в отношении большинства клинических изолятов резистентного стафилококка (MRSA), что очень важно для современной антимикробной терапии [31]. Среди Пептиды B. subtilis , относительно крупные пептидные антибиотики — бактериоцины, имеющие молекулярную массу в десятки тысяч Дальтон, характеризующиеся узким спектром антибиотической активности и действующие на другие штаммы B. subtilis , т.е. действующие как внутривидовые регуляторный фактор [8,32,33]. Среди бактериоцинов в самостоятельную группу выделяют антибиотики с относительно небольшой молекулярной массой 5-10 килодальтон, называемые микроцинами [30]. Среди пептидных антибиотиков B. subtilis , существует также группа соединений лантибиотиков, к которым относится редкая тиоэфирная аминокислота лантионин и ее производные, за счет которых в молекуле антибиотика образуются внутренние тиоэфирные связи. Лантибиотики B. subtilis , например, субтилин и эрицин, в отличие от бактериоцинов, обладают широким антимикробным спектром действия. Субтилин, состоящий из 32 аминокислот и имеющий пентациклическую структуру, подобен по строению консерванту низину, широко применяемому в пищевой промышленности и образованному Lactococcus lactis [9]. Из ферментированных соевых бобов, традиционной корейской пищи, штамма B. subtilis выделен антибиотик SC-8, проявляющий узкий спектр антимикробной активности в отношении бактерий группы Bacillus cereus и способствующий сохранению пищевых продуктов [31].
Среди бактериоцинов в самостоятельную группу выделяют антибиотики с относительно небольшой молекулярной массой 5-10 килодальтон, называемые микроцинами [30]. Среди пептидных антибиотиков B. subtilis , существует также группа соединений лантибиотиков, к которым относится редкая тиоэфирная аминокислота лантионин и ее производные, за счет которых в молекуле антибиотика образуются внутренние тиоэфирные связи. Лантибиотики B. subtilis , например, субтилин и эрицин, в отличие от бактериоцинов, обладают широким антимикробным спектром действия. Субтилин, состоящий из 32 аминокислот и имеющий пентациклическую структуру, подобен по строению консерванту низину, широко применяемому в пищевой промышленности и образованному Lactococcus lactis [9]. Из ферментированных соевых бобов, традиционной корейской пищи, штамма B. subtilis выделен антибиотик SC-8, проявляющий узкий спектр антимикробной активности в отношении бактерий группы Bacillus cereus и способствующий сохранению пищевых продуктов [31]. В B. subtilis также была описана большая группа липопептидных антибиотиков широкого спектра действия. Это олигопептиды, синтезированные на мультиферментных комплексах, к которым затем добавляют жирные кислоты. Цепи аминокислот и бациллярные липопептиды жирных кислот делятся на три семейства. Представители семейства итуринов представляют собой гептапептиды с липофильной β-аминокислотой. Обладают выраженной эффективностью в отношении мицелиальных и дрожжевых фитопатогенных грибов [34,35]. Декапептиды с липофильной β-гидроксикислотой относятся к семейству феницинов и характеризуются наличием орнитина. Они характеризуются эффективностью в отношении мицелиальных грибов [36,37]. К третьему семейству относятся сурфактины — гептапептиды с β-оксижирной кислотой, менее эффективные в отношении грибов, но проявляющие среди этих липопептидов наиболее выраженные гидрофобные свойства, позволяющие образовывать устойчивые биопленки на поверхности растений и препятствующие их колонизации другими микроорганизмы.
В B. subtilis также была описана большая группа липопептидных антибиотиков широкого спектра действия. Это олигопептиды, синтезированные на мультиферментных комплексах, к которым затем добавляют жирные кислоты. Цепи аминокислот и бациллярные липопептиды жирных кислот делятся на три семейства. Представители семейства итуринов представляют собой гептапептиды с липофильной β-аминокислотой. Обладают выраженной эффективностью в отношении мицелиальных и дрожжевых фитопатогенных грибов [34,35]. Декапептиды с липофильной β-гидроксикислотой относятся к семейству феницинов и характеризуются наличием орнитина. Они характеризуются эффективностью в отношении мицелиальных грибов [36,37]. К третьему семейству относятся сурфактины — гептапептиды с β-оксижирной кислотой, менее эффективные в отношении грибов, но проявляющие среди этих липопептидов наиболее выраженные гидрофобные свойства, позволяющие образовывать устойчивые биопленки на поверхности растений и препятствующие их колонизации другими микроорганизмы. В этом случае B. subtilis антибиотики играют важную роль в экосистемах, способствуя формированию биопленок и заселению территории [32,38,39]. К олигопептидам с наименьшей молекулярной массой, содержащим всего две-три аминокислоты, относятся ризоктицины, которые были выделены в виде противогрибковых фосфоноолигопептидов из КЖ коллекционного штамма B. subtilis ATCC 6633. Эти пептиды содержат небелковую аминокислоту (Z)-2-амино-5-фосфоно-3-пентеновая кислота [34].
В этом случае B. subtilis антибиотики играют важную роль в экосистемах, способствуя формированию биопленок и заселению территории [32,38,39]. К олигопептидам с наименьшей молекулярной массой, содержащим всего две-три аминокислоты, относятся ризоктицины, которые были выделены в виде противогрибковых фосфоноолигопептидов из КЖ коллекционного штамма B. subtilis ATCC 6633. Эти пептиды содержат небелковую аминокислоту (Z)-2-амино-5-фосфоно-3-пентеновая кислота [34].
Поскольку B. subtilis является видом-космополитом и встречается на самых разнообразных субстратах, для него характерна широкая приспособляемость к различным условиям среды, что, в частности, находит отражение в большом разнообразии производимых антибиотиков, и следует ожидать дальнейшее описание новых антибиотиков B. subtilis .
Штамм B. subtilis 534 относится к пробиотикам и давно и успешно применяется в медицине, являясь основой препарата Споробактерин. Применение споробактерина не токсично и не обременительно для больных, но может быть эффективным. Поскольку установлено, что штамм 534 проявляет антимикробную активность в условиях глубинного культивирования, мы рассматриваем его как потенциального продуцента антимикробных веществ, преодолевающих множественную лекарственную устойчивость патогенных микроорганизмов. Целесообразно продолжить дальнейшие химические исследования и клинические испытания антимикробных веществ с перспективой их использования в качестве медицинских антибиотиков.
Поскольку установлено, что штамм 534 проявляет антимикробную активность в условиях глубинного культивирования, мы рассматриваем его как потенциального продуцента антимикробных веществ, преодолевающих множественную лекарственную устойчивость патогенных микроорганизмов. Целесообразно продолжить дальнейшие химические исследования и клинические испытания антимикробных веществ с перспективой их использования в качестве медицинских антибиотиков.
Авторы благодарят всех рецензентов за улучшение качества рукописи. Также хотим поблагодарить Светлану Долгорукову за техническую помощь.
Все авторы заявляют об отсутствии конфликта интересов.
Исследования проводились в рамках государственного задания в Институте новых антибиотиков им. Гаузе. Работа выполнена при частичной поддержке РФФИ, грант 17-00-00393\18.
- Батлер М.С., Бласкович М.А., Купер (2013) М.А. Антибиотики в клинической разработке в 2013 г. J Antibiot (Токио) 66: 571-591.
- Батлер М.С., Бласкович М.
 А., Купер М.А. (2017) Антибиотики в клинической разработке в конце 2015 г. J Antibiot (Токио) 70: 3-24.
А., Купер М.А. (2017) Антибиотики в клинической разработке в конце 2015 г. J Antibiot (Токио) 70: 3-24. - О’Нил Дж. (2016) Обзор устойчивости к противомикробным препаратам. Глобальная борьба с лекарственно-устойчивыми инфекциями: итоговый отчет и рекомендации.
- Duc LH, Hong HA, Barbosa TM, Henriques AO, Cutting SM (2004) Характеристика пробиотиков бацилл, доступных для использования человеком. Appl Environ Microbiol 70: 2161-2171.
- Похиленко В.Д., Перелыгин В.В. (2007) Пробиотики на основе спорообразующих бактерий и их безопасность. Химическая и биологическая безопасность 2-3: 20-41.
- Скрыпник И.Н., Маслова А.С. (2009) Современные спорообразующие пробиотики в клинической практике. Современная гастроэнтерология (Украина) 3: 81-90.
- Савустьяненко А.В. (2016) Механизмы действия пробиотиков на основе Bacillus subtilis. Актуальная инфектология 2: 35-44.
- Джонсон Б., Анкер Х., Мелени Ф. (1945) Бацитрацин: новый антибиотик, производимый членом группы B subtilis.
 Наука 102: 376-377.
Наука 102: 376-377. - Фикерс П. (2012) Антибиотические соединения из Bacillus: почему они такие удивительные? Am J Biochem and Biotech 8: 40-46.
- Stein T (2005) Антибиотики Bacillus subtilis: структуры, синтезы и специфические функции. Молекулярный микробиол 56: 845-857.
- Baruzzi F, Quintieri L, Morea M, Caputo L (2011) Противомикробные соединения, продуцируемые bacillus spp. и применения в пищевых продуктах. В: Вилас AM (ред.). Наука против микробных патогенов: информирование о текущих исследованиях и технологических достижениях. Formatex, Бадахос, Испания, 1102-1111 гг.
- Коттер П.Д., Росс Р.П., Хилл С. (2013) Бактериоцины – жизнеспособная альтернатива антибиотикам? Nat Rev Microbiol 11: 95-105.
- Sumi CD, Yang BW, Yeo IC, Hahm YT (2015)Противомикробные пептиды рода Bacillus: новая эра для антибиотиков. Can J Microbiol 61: 93-103.
- Никитенко В.И., Полякова BC, Никитенко М.В. (2001) Препарат споробактерин. Новые данные о механизме действия этого и других препаратов живых бактерий.
 Научный вестник Тюменской медицинской академии 2: 70-72.
Научный вестник Тюменской медицинской академии 2: 70-72. - Никитенко В.И., Никитенко И.К. (1988) Штамм бактерий Bacillus subtilis использован для получения препарата для профилактики и лечения воспалительных процессов и аллергических заболеваний. Патент SU 1723116 А1. СССР.
- Никитенко М.В., Никитенко В.И. (2001) Препарат споробактерин жидкий. Патент RU2217154C2.
- Габриелян Н.И., Суськова В.С., Суськов С.И., Вологодская Н.Л. (2012) Изучение влияния пробиотика споробактерина на функциональное состояние гранулоцитарно-макрофагальных клеток доноров крови in vitro. Вестник экспериментальной биологии и медицины. 153: 653-655.
- Казаков Е.Н., Габриелян Н.И., Сенченко О.Р., Петраков К.В., Арефьева Л.И., и соавт. (2013) К вопросу о профилактике инфекционных осложнений после операций на сердце в условиях искусственного кровообращения. Русский медицинский журнал 2: 13-16.
- Арефьева Л.И., Горская Е.М., Савостьянова О.А., Сенченко О.Р., Габриелян Н.И.
 (2013) Инфекционные осложнения бактериальной природы в сердечно-сосудистой хирургии. Русский медицинский журнал. 3: 36-42.
(2013) Инфекционные осложнения бактериальной природы в сердечно-сосудистой хирургии. Русский медицинский журнал. 3: 36-42. - Габриелян Н.И., Арефьева Л.И., Горская Е.М., Корнилов М.Н., Мойсюк Ю.Г., и соавт. (2013) Использование биопрепаратов в абдоминальной хирургии и трансплантации печени. Российский журнал трансплантологии и искусственных органов 2: 48-155.
- Габриелян Н.И., Горская Е.М., Крупенио Т.В., Зенкова В.А., Ефименко Т.А., и соавт. (2016) Оценка антимикробной активности бациллярного пробиотика Bacillus subtilis (штамм 534). Эпидемиология и инфекционные болезни. Текущие выпуски 1: 41-47.
- Осипова И.Г., Сорокулова И.Б., Васильева Е.А., Буданова Е.В. (2005) Доклинические испытания новых споровых пробиотиков. Вестн Росс Акад Мед Наук 12: 36-40.
- Leser TD, Knarreborg A, Worm J (2008)Прорастание и рост спор Bacillus subtilis и Bacillus licheniformis в желудочно-кишечном тракте свиней. J Appl Microbiol 104: 1025-1033.
- Бостиан М., Макнитт К.
 , Асалос А., Берди Дж. (1977) Идентификация антибиотиков: компьютеризированная система базы данных. Дж. Антибиот 30: 633-634.
, Асалос А., Берди Дж. (1977) Идентификация антибиотиков: компьютеризированная система базы данных. Дж. Антибиот 30: 633-634. - Егоров Е.С., Баранова И.Н. (1999) Бактериоцины: образование, свойства и применение. Антибиот Химиотер 6: 33-40.
- Rea MC, Ross RP, Cotter PD, Hill C (2011)Классификация бактериоцинов грамположительных бактерий. В: Драйдер Д., Ребуффат С., Прокариотические антимикробные пептиды: от генов к приложениям. Спрингер, Нью-Йорк, 29 лет-53.
- Abriouel H, Franz CMAP, Ben Omar N, Galvez A (2011) Разнообразие и применение бактериоцинов Bacillus. FEMS Microbiol Rev 35: 201-232.
- Северинов К., Семенова Е., Казаков Т. (2011) Микроцины класса I: их структура, активность и механизмы устойчивости. В: Драйдер Д., Ребуффат С., Прокариотические антимикробные пептиды: от генов к приложениям. Спрингер, Нью-Йорк, 289–308.
- Росс Р.П., Морган С., Хилл С. (2002) Сохранение и ферментация: прошлое, настоящее и будущее. Int J Food Microbiol 79: 3-16.

- Ikai Y, Oka H, Hayakawa J, Harada K-I, Suzuki M (1992) Структурная характеристика компонентов бацитрацина с помощью жидкостной хроматографии/масс-спектрометрии (ЖХ/МС) с бомбардировкой быстрыми атомами фритты (FAB). J Антибиот 45: 1325-1334.
- Судзуки М., Ямада К., Нагао М., Аоки Э., Мацумото М. и др. (2011) Противомикробные мази и метициллин-резистентный золотистый стафилококк USA300. Эмердж Инфекция Дис 17: 1917-1920.
- Raaijmakers JM, De Bruijn I, Nybroe O, Ongena M (2010)Естественные функции липопептидов из Bacillus и Pseudomonas: больше, чем поверхностно-активные вещества и антибиотики. FEMS Microbiol Rev 34: 1037-1062.
- Fredenhagen A, Angst C, Peter HH (1995) Расщепление ризоктицинов до (Z)-L-2-амино-5-фосфоно-3-пентеновой кислоты: пересмотр абсолютной конфигурации плюмбемицинов A и B. J Antibiot 48: 1043 -1045.
- Thimon L, Peypoux F, Wallach J, Michel G (1995) Влияние липопептидного антибиотика итурина А на морфологию и ультраструктуру мембраны дрожжевой клетки.
 FEMS Microbiol Lett 128: 101-106.
FEMS Microbiol Lett 128: 101-106. - Цуге К., Акияма Т., Шода М. (2001)Клонирование, секвенирование и характеристика оперона итурина А. Дж. Бактериол 183: 6265-6273.
- Стеллер С., Волленбройх Д., Линдерс Ф., Штейн Т., Конрад Б. и др. (1999) Структурно-функциональная организация мультиферментной системы фенгицинсинтетазы из Bacillus subtilis b213 и A1/3. Химическая биология 6: 31-41.
- Vanittanakom N, Loeffer W, Koch U, Jung G (1986) Фенгицин — новый противогрибковый липопептидный антибиотик, продуцируемый Bacillus subtilis F-29-3. J Antibiot (Токио) 39: 888-901.
- Magnet-Dana R, Thimon L, Peypoux F, Ptak M (1992) Взаимодействия сурфактина/итурина А могут объяснить синергический эффект сурфактина на биологические свойства итурина А. Biochimie 74: 1047-1051.
- Bais HP, Fall R, Vivanco JM (2004)Биоконтроль Bacillus subtilis против заражения корней Arabidopsis Pseudomonas syringae облегчается за счет образования биопленки и продукции сурфактина. Завод Физиол 134: 307-319.


 С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002. — С. 151 – 158.
С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002. — С. 151 – 158.
 При этом помимо кислорода образуется карбонат калия. Составьте уравнения данной химической реакции.
При этом помимо кислорода образуется карбонат калия. Составьте уравнения данной химической реакции.


 ) и Cu
) и Cu На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название “фосфор”, которое в переводе на русский язык значит “светоносный”. Уже при слабом нагревании, для чего достаточно простого трения, фосфор загорается и сгорает, выделяя большое количество тепла. Фосфор может и сам собой воспламениться на воздухе вследствие выделения тепла при окислении. Чтобы защитить белый фосфор от окисления, его сохраняют под водой. В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде. Белый фосфор – сильный яд, даже в малых дозах действующий смертельно.
На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название “фосфор”, которое в переводе на русский язык значит “светоносный”. Уже при слабом нагревании, для чего достаточно простого трения, фосфор загорается и сгорает, выделяя большое количество тепла. Фосфор может и сам собой воспламениться на воздухе вследствие выделения тепла при окислении. Чтобы защитить белый фосфор от окисления, его сохраняют под водой. В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде. Белый фосфор – сильный яд, даже в малых дозах действующий смертельно.  Плотность чёрного фосфора равна 2,70 г/см3,температура воспламенения 4900С. Имеет атомную кристаллическую решетку.
Плотность чёрного фосфора равна 2,70 г/см3,температура воспламенения 4900С. Имеет атомную кристаллическую решетку. Содержит P,Ca, Si, C, Fe и др. элементы
Содержит P,Ca, Si, C, Fe и др. элементы 22, нет. 20, стр. 16067–16076, 2015.
22, нет. 20, стр. 16067–16076, 2015. 5, стр. 27–35, 2016 г.
5, стр. 27–35, 2016 г. Луккини, М. Фаббри и Г. Кортеччи, «Распределение металлов и экологические проблемы, связанные с окислением сульфидов в районе медного рудника Либиола (Лигурийские Апеннины, Италия)», Journal of Геохимическая разведка , вып. 74, нет. 1–3, стр. 141–152, 2001.
Луккини, М. Фаббри и Г. Кортеччи, «Распределение металлов и экологические проблемы, связанные с окислением сульфидов в районе медного рудника Либиола (Лигурийские Апеннины, Италия)», Journal of Геохимическая разведка , вып. 74, нет. 1–3, стр. 141–152, 2001. 175, стр. 72–81, 2017.
175, стр. 72–81, 2017. 57, нет. 7, стр. 1469–1479, 2009.
57, нет. 7, стр. 1469–1479, 2009. Wang, R. Liu, P. Zhang, W. Yu, Z. Shen, and C. Feng, «Пространственные вариации, экологическая оценка и идентификация источников тяжелых металлов в отложениях устья реки Янцзы». », Бюллетень о загрязнении морской среды , том. 87, нет. 1, стр. 364–373, 2014.
Wang, R. Liu, P. Zhang, W. Yu, Z. Shen, and C. Feng, «Пространственные вариации, экологическая оценка и идентификация источников тяжелых металлов в отложениях устья реки Янцзы». », Бюллетень о загрязнении морской среды , том. 87, нет. 1, стр. 364–373, 2014.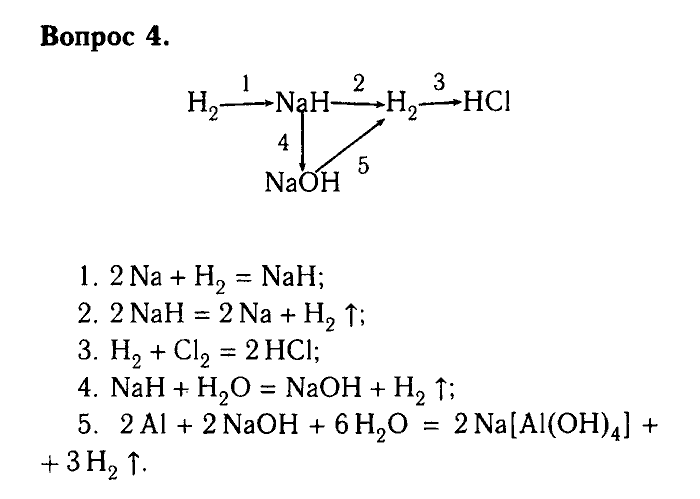 8, нет. 1, pp. с тяжелыми металлами и алюминием», Известия ЕГУ, Химия и биология , вып. 3, нет. 226, стр. 50–53, 2011.
8, нет. 1, pp. с тяжелыми металлами и алюминием», Известия ЕГУ, Химия и биология , вып. 3, нет. 226, стр. 50–53, 2011. pdf.
pdf.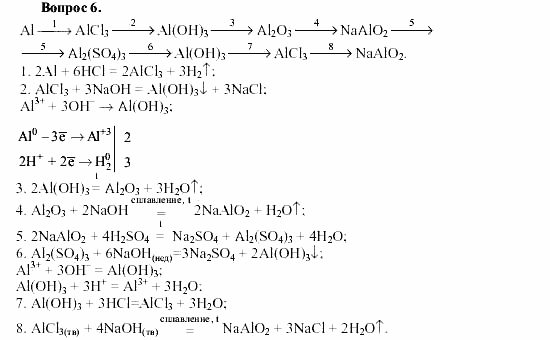 ccme.ca/en/resources/canadian_environmental_quality_guidelines.
ccme.ca/en/resources/canadian_environmental_quality_guidelines. 2018;19(2):444. doi: 10.3390/ijms144. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2018;19(2):444. doi: 10.3390/ijms144. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] , Мозафари М.Р. Влияние размера частиц и индекса полидисперсности на клиническое применение систем липидных наноносителей. Фармацевтика. 2018;10(2):1–17. дои: 10.3390/фармацевтика10020057. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Мозафари М.Р. Влияние размера частиц и индекса полидисперсности на клиническое применение систем липидных наноносителей. Фармацевтика. 2018;10(2):1–17. дои: 10.3390/фармацевтика10020057. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3126/njst.v14i1.8928. [CrossRef] [Google Scholar]
3126/njst.v14i1.8928. [CrossRef] [Google Scholar] Микроорганизмы. 2019;7(6):1–24. doi: 10.3390/микроорганизмы7060180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Микроорганизмы. 2019;7(6):1–24. doi: 10.3390/микроорганизмы7060180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10.3390/bios
10.3390/bios J Подача воды 2018;67:127–136. doi: 10.2166/aqua.2018.161. [CrossRef] [Google Scholar]
J Подача воды 2018;67:127–136. doi: 10.2166/aqua.2018.161. [CrossRef] [Google Scholar] Нанотехнологии. 2005; 16: 2346–2353. дои: 10.1088/0957-4484/16/10/059. [PubMed] [CrossRef] [Google Scholar]
Нанотехнологии. 2005; 16: 2346–2353. дои: 10.1088/0957-4484/16/10/059. [PubMed] [CrossRef] [Google Scholar] , Кумар С., Бафана А., Лин Дж., Дахуман С.А., Дже К. Механистический взгляд на индуцированный светом синтез наночастиц серебра с использованием внеклеточных полимеров вещества Chlamydomonas reinhardtii . Молекулы. 2019;24:3506. doi: 10,3390/молекулы24193506. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Кумар С., Бафана А., Лин Дж., Дахуман С.А., Дже К. Механистический взгляд на индуцированный светом синтез наночастиц серебра с использованием внеклеточных полимеров вещества Chlamydomonas reinhardtii . Молекулы. 2019;24:3506. doi: 10,3390/молекулы24193506. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Дайджест J Nanomater Biostruct. 2010;5(2):491–496. [Google Scholar]
Дайджест J Nanomater Biostruct. 2010;5(2):491–496. [Google Scholar] Устойчивость. 2018;10(4):913. doi: 10.3390/su10040913. [CrossRef] [Google Scholar]
Устойчивость. 2018;10(4):913. doi: 10.3390/su10040913. [CrossRef] [Google Scholar] Postepy Hig Med Dosw. 2014;68:1392–1396. doi: 10.5604/17322693.1130086. [PubMed] [CrossRef] [Google Scholar]
Postepy Hig Med Dosw. 2014;68:1392–1396. doi: 10.5604/17322693.1130086. [PubMed] [CrossRef] [Google Scholar]