Водород. Химия. 9 класс. Конспект урока
УМК «Химия. 9 класс» О. С. Габриеляна.
Цели урока: способствовать достижению обучающимися образовательных результатов.
Предметных: особенности положения водорода в периодической системе, строение молекулы, физические, химические свойства, способы получения и области применения.
Метапредметных: регулятивных-умение управлять и организовывать свою деятельность; коммуникативных – формирование навыков сотрудничества; познавательных-осуществлять поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы и справочным материалом, выполнение логических операций анализа, обобщения, установления причинно-следственные связи.
Личностных: мотивация к получению нового знания.
Тип урока: создания нового знания.
Ход урока
I. Орг. момент
Проверка готовности учащихся к работе.
II. Мотивационный этап
В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснут солнца, не станет воды… Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты — в ядре и вокруг него, и оттуда «мигрирует» наружу. Этот газ — начало всех начал. Его название — «водород».
Сегодня мы посвятим наш урок этому удивительному веществу — водороду.
Давайте вместе составим план изучения этого вещества.
(В процессе совместного обсуждения составляется план исследования темы «Водород»)
III. Этап создания нового знания
1. Положение водорода в Периодической системе
В 8 классе, знакомясь со структурой Периодической системы, мы сравнивали Периодическую систему с многоэтажным домом, в которой есть удивительный жилец, занимающий сразу 2 квартиры – это водород.
Задание: Используя текст учебника найдите аргументы за то, что водород должен находиться в первом периоде и аргументы за 7 период. (стр. 98 учебника)
(В процессе совместного обсуждения заполняется таблица № 1)
Таблица № 1 Положение водорода в Периодической системе
|
|
I группа главная подгруппа |
VII группа главная подгруппа |
|
Строение атома |
1е на внешнем уровне |
Не хватает 1 е на внешнем уровне |
|
Окислительно-восстановительные свойства |
Отдает 1 е- восстановительные свойства |
Принимает 1 е- окислительные свойства |
|
Степень окисления |
+1 |
-1 |
Совместное формулирование вывода: Водород занимает в периодической системе двойственное положение, в связи с особенностями строения атома.
2. Простое вещество – водород
а) Задание: используя текст учебника, знания о типах химической связи запишите молекулярную, структурную и электронную формулу водорода, укажите тип химической связи.
б) Физические свойства водорода:
Демонстрация опыта по получению и собиранию водорода, доказательство его наличия.
Обсуждение: почему водород можно собирать способом вытеснения воды и способом вытеснения воздуха? Где можно использовать водород?
в) Химические свойства водорода.
В начале урока мы предположили, что водород должен проявлять окислительные и восстановительные свойства. При взаимодействии с какими веществами водород будет проявлять окислительные свойства? Восстановительные свойства?
Учащиеся записывают уравнения реакции в свете ОВР, доказывая окислительные и восстановительные свойства водорода.
1) Н2 – восстановитель
а) Н2 + НеМе → ННеМе
б) Н2 + МеО → Ме + Н2О
2) Н2 – окислитель
Ме + Н2 → МеН (гидрид)
г) Получение водорода
Совместное обсуждение лабораторных и промышленных способов получения водорода, запись уравнений реакций.
д) Применение водорода
Проанализируйте физические и химические свойства водорода, предположите области его применения. Заполнение таблицы № 2
|
Свойство Н2 |
Область применения |
|
Легкий газ |
Воздушные шары, аэростаты во время ВОВ |
|
Выделение большого количества теплоты при взаимодействии с О2 |
Водородное топливо |
|
Взаимодействие с оксидами металлов |
Получение чистых металлов |
|
Взаимодействие с неметаллами |
Получение NH3, HCl |
IV.
 Этап первичного контроля знаний
Этап первичного контроля знанийВыполнение и самопроверка теста (приложение).
V. Этап подведения итогов урока и рефлексии
В начале урока мы составили план исследования темы «Водород». Все ли пункты этого плана мы выполнили? В результате в ваших тетрадях получился краткий конспект по теме «Водород».
Водород
Бесцветный, легкий.
В реакции вступает, восстанавливает, сгорает.
В смеси с кислородом взрывоопасен.
Осторожно!!!
VI. Домашнее задание
Параграф 17 учебника, Творческое задание «Составить портрет водорода».
Опорные конспекты по химии (9 класс) – УчМет
МКОУ Тополинская СОШ
ОПРОНЫЕ КОНСПЕКТЫ
ПО ХИМИИ
8 КЛАСС
Составитель
Сумцова
О. В.
В.
Учитель информатики-химии
2011г.
Электролитическая диссоциация.
Процесс распада электролита на ионы при растворении его в воде или расплавлении называют электролитической диссоциацией.
Особенно осторожно необходимо растворять серную кислоту, так как из-за повышения температуры часть воды может превратиться в пар и под его давлением выбросить кислоту из сосуда. Чтобы этого избежать, серную кислоту тонкой струей наливают в воду (но не наоборот) при постоянном помешивании.
Растворение – это физико-химический процесс.
Гидратация – это присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют гидратами.
Кристаллические
вещества, в состав которых входит
связанная вода, называют кристаллогидратами.
Воду входящую в состав кристаллов,
называют кристаллизационной водой.
Основные положения теории электролитической диссоциации были сформулированы в 1887 году шведским ученым С.Аррениусом. в настоящее время их можно сформулировать следующим образом:
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы. Ионы – это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам.
В растворе и расплаве электролита ионы движутся хаотично. При пропускании постоянного электрического тока через этот раствор или расплав положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные иона (анионы) – к аноду.
Диссоциация кислот, оснований и солей.
Кислотой называется вещество, которое при взаимодействии с водой (при растворении в воде) образует ионы оксония Н3О+ (или, упрощая, ионы водорода Н +)
СИЛЬНЫЕ: HNO3, H2SO4, HI, HBr, HCl, H3PO4
СЛАБЫЕ: H2SO3, CH3COOH, H2CO3, H2S
МАЛОДИССОЦИИРУЮЩИЕ ИЛИ ОЧЕНЬ СЛАБЫЕ: H2SiO3
Формулы кислот | Специфический реагент | Образующиеся соединения и внешние эффекты |
H2SO4 | Ион Ba2+(соли, щелочь) | BaSO4 белый осадок |
HCl | Ион Ag+(соли серебра) | AgCl белый творожистый осадок |
H2CO3 | Известковая вода Ca(OH)2 | CaCO3 , помутнение прозрачного раствора известковой воды |
HNO3 | Cu в присутствии H2SO4 | Выделение бурого газа NO2 |
Химические
свойства кислот обеспечиваются ионами
водорода, в некоторых реакциях участвуют
анионы кислотных остатков( такие реакции
специфичны для каждой кислоты и называются
качественными).
Основания – это сложные вещества, при диссоциации которых в водных растворах в качестве анионов в водных растворах в качестве анионов отщепляются гидроксид-ионы.
Соли – это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
Кислые соли – это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и водорода и анионы кислотных остатков.
Алгоритм составления
полных и сокращенных ионных уравнений реакций.
1. Напишите уравнение диссоциации электронов, вступающих в реакцию (обратите внимание на запись обозначения зарядов ионов).
2. Отметьте, при соединении каких ионов могут образовываться малодиссоциирующие соединения, и расставьте коэффициенты (если нужно).
3.
Напишите формулу малодиссоциирующего
вещества и обозначения ионов, не
участвующих в реакции, в правой части
уравнения.
4. Внимательно проверьте написанное! Сумма положительно заряженных ионов в левой и правой частях уравнения реакции должна равняться нулю.
5. Допишите знак равенства.
6. Напишите сокращенное ионное уравнение реакции, отражающее суть реакции ионного обмена (образование малодиссоциирующих веществ). Учтите, что вначале пишут катион, а потом анион.
Окислительно-восстановительные реакции
Реакции, которые протекают с изменением степеней окисления элементов, называют окислительно-восстановительными.
При составлением уравнений окислительно-восстановительных реакций пользуются следующим алгоритмом.
Пишем формулы реагирующих веществ, ставим стрелку, а за ней пишем формулы веществ, которые образуются при данной реакции.
Проставляем степень окисления над знаками элементов, у которых она меняется.
Выписываем химические знаки элементов, атомы или ионы которых меняют степень окисления.

Находим, сколько электронов отдают или принимают соответствующие атомы или ионы.
Находим наименьшее общее кратное чисел отданных и присоединенных электронов (их число должно быть одинаково)
Найденные коэффициенты ставим перед соответствующими формулами в правой части уравнения.
Соответственно найденным коэффициентам в правой части уравнения находим коэффициенты для формул всех остальных веществ.
Проверяем, соответствует ли число атомов всех элементов в левой части уравнения числу атомов в правой части уравнения.
С водой не реагируют соли, образованные сильным основанием и сильной кислотой, так как ионы таких солей не могут связываться с ионами Н+ и ОН—.
С
водой реагируют соли, образованные
или слабым основанием и сильной кислотой,
или сильным основанием и слабой кислотой. Это объясняется тем, что в составе таких
солей имеются ионы, которые могут
связываться с ионами Н+ и ОН—.
Это объясняется тем, что в составе таких
солей имеются ионы, которые могут
связываться с ионами Н+ и ОН—.
Гидролиз соли – это взаимодействие ионов соли с водой с образованием малодиссоциирующих электролитов.
Соли, образованные слабой кислотой и слабым основанием, в водном растворе не существуют, потому что они или выпадают в осадок, или разлагаются водой.
Гидролиз соли – это обратимая реакция. Гидролиз усиливается при нагревании и сильном разбавлении раствора.
Кислород и сера.
Явление, когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией. Простые вещества, образованные одним и тем же химическим элементом, называют аллотопными видоизменениями этого элемента.
Химические свойства серы.
Окислительные свойства | Восстановительные свойства |
|
|
Сероводород.
Сероводород – бесцветный газ, тяжелее воздуха, с неприятным запахом тухлых яиц. Сероводород очень ядовит. Уже 0,1% объема сероводорода в воздухе вызывает тяжелые отравления. Однако в малых количествах сероводород полезен: при некоторых заболеваниях в медицине используют сероводородные ванны.
Сероводород
образуется при разложении без доступа
воздуха многих природных органических
веществ, содержится в вулканических
газах, в воде минеральных источников.
Все опыты с сероводородом нужно проводить в вытяжном шкафу!
Сероводород легко можно получить в лаборатории действием разбавленной серной кислоты на сульфид железа (II):
FeS +H2SO4 = FeSO4 + H2S↑
Эта реакция проводится в аппарате Киппа, который используют для получения водорода.
Сероводород горит на воздухе голубым пламенем, при этом образуется сернистый газ, или оксид серы (IV):
2H2S + 3O2 = 2H2O +2SO2
При недостатке кислорода образуются пары воды и сера:
2H2S + O2 = 2H2O +2S
Сероводород обладает свойствами восстановителя. Если в пробирку с небольшим количеством сероводородной воды прилить бромную воду, то раствор обесцвечивается. На поверхности раствора появляется сера:
H2S + Br2 = 2HBr +S
Сероводород
малорастворим в воде. При 20° в одном
объеме воды растворяется 2,4 объема
сероводорода. Водный раствор сероводорода
проявляет свойства слабой кислоты:
При 20° в одном
объеме воды растворяется 2,4 объема
сероводорода. Водный раствор сероводорода
проявляет свойства слабой кислоты:
H2S ↔HS— + H+
HS—↔ S2- + H+
Сероводородная кислота вступает со щелочами в реакцию нейтрализации:
H2S + NaOH = NaHS + H2O
избыток
H2S + 2NaOH = Na2S + 2H2O
избыток
Средние соли сероводородной кислоты называют сульфидами, а кислые – гидросульфидами. В воде растворимы сульфиды щелочных металлов и большинство гидросульфидов.
Сернистый газ. Сернистая кислота.
При
горении серы на воздухе образуется
сернистый газ, или оксид серы (IV)
SO2.
Это бесцветный газ с резким характерным
запахом, более чем в 2 раза тяжелее
воздуха, хорошо растворяется в воде,
ядовит.
SO2кислотный оксид.
H2O + SO2 ↔ H2SO3 реакция обратимая.
Сернистая кислота – неустойчивое соединение, легко распадается на оксид серы (IV) и воду. Эта кислота средней силы. Она образует два ряда солей: средние – сульфиты и кислые гидросульфиты.
Качественной реакцией на сульфиты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом.
Сернистый газ как кислотный оксид взаимодействует с щелочами и основными оксидами.
Серная кислота (разбавленная)
Химическая формула H2SO4
Структурная формула
О
│
HO – S – OH
│
О
Уравнение диссоциации
H2SO4 = 2H+ + SO42- сильный электролит
Правила техники безопасности при приготовлении раствора серной кислоты
Кислоту
нужно небольшими порциями вливать в
воду.
Химические свойства
Me (в ряду активности до Н2)
MeSO4 + H2↑
MeO
MeSO4 + H2O
MeOH
H2SO4 + MeSO4 + H2O
(разб.) MeR (в случае ↑ или ↓)
MeSO4 + HR
BaR (качественная реакция)
Белый осадок BaSO4↓ + HR
Производство серной кислоты:
FeS2 → SO2 → SO3 → H2SO4
Скорость
химических реакций. Химическое равновесие.
Химическое равновесие.
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени.
Условия, влияющие на скорость химических реакций.
Скорость химических реакций зависит от природы реагирующих веществ.
Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.
Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2-4 раза.
Скорость химических реакций зависит от присутствия некоторых веществ. (катализаторов, ингибиторов).
Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами.
Вещества,
которые замедляют скорость химических
реакций, называют ингибиторами.
Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном, — называю обратимыми реакциями.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
Принцип Ле Шателье: при изменении внешних условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это внешнее воздействие.
При повышении температуры равновесие смещается в сторону эндотермического процесса.
При повышении давления равновесие смещается в сторону меньшего объема.
При увеличении концентрации одного из исходных веществ равновесие смещается в сторону образования новых веществ.
При увеличении концентрации продукта реакции равновесие смещается в сторону исходных вещества.
Катализаторы
не влияют на смещение химического
равновесия, они способствуют более
быстрому достижению равновесия.
Азот.
Молекула азота – N2, структурная формула N Ξ N, электронная формула :N: :N:
В молекуле азота одна σ-связь и две π-связи.
Азот находится в воздухе в свободном виде – 78% по объему.
Физические свойства. Азот – газ без цвета и запаха, немного легче воздуха. Растворимость его в воде незначительна. Азот в твердом состоянии имеет молекулярную кристаллическую решетку, поэтому у него низкие температуры плавления и кипения.
Химические свойства. При обычных условиях азот малоактивен
Аммиак.
Молекулярная формула – NH3
Физические свойства – бесцветный газ с характерным резким запахом, почти в два раза легче воздуха, очень хорошо растворим в воде. При повышении давления аммиак сжижается. Жидкий аммиак имеет большую теплоту испарения, поэтому его применяют в холодильных устройствах.
Химические
свойства.
При нагревании разлагается:
2NH3 ↔ N2 + 3H2
Горит в кислороде:
4NH3 + 3O2 → 2N2 + 6H2O
В присутствии катализатора (сплав платины и родия) окисляется кислородом воздуха
4NH3 + 5O2 → 4NO + 6H2O
Реагирует с водой
NH3 + H2O→ NH4+ + OH—
Реагирует с кислотами, образуя нормальные и кислые соли
NH3 + HCl → NH4Cl
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Соли аммония.
Физические свойства. Все соли аммония – твердые кристаллические вещества, хорошо растворимы в воде.
Химические свойства.
Сильные электролиты, диссоциируют на ионы
NH4R → NH4+ + R
Реагируют с кислотами
NH4R + HR1 → NH4R1+ HR
Реагируют с другими солями
NH4R + MeR1 → NH4R1 + MeR
Подвергаются гидролизу
При комнатной температуре разлагаются
NH4R → NH3↑ + HR
Реагируют со щелочами
NH4R + MeOH → MeR + NH3↑ + H2O
Оксиды азота.
Признаки | N2O | NO | NO2 | N2O3 | N2O5 |
Агрегатное состояние | Газ | Жидкость | Твердое вещество | ||
Цвет | Бесцветный | Бурый | Темно синяя | Белое | |
Токсичность для организма | — | + | |||
Отношение к воде | Малорастворим | Химически взаимодействует | |||
Кислотно-основные свойства | Восстановительные | Окисли-тельно восстано-вительные | Окислительные | ||
Особые свойства | Разлагается | Окисляется кислородом, восстанав-ливается водородом | + Н и МеОН | Разлагается | |
Получение | Из NH4NO3 | Окислением
N2,
NH3,
из HNO3 (разб. | Из HNO3 (конц.) и, Cu окислением NO | Из NO2 и NO | Обезво-живани-ем HNO3, окис-лением NO2 |
Применение | Медицина | Замедление цепных реакций, получение NO2 | Производство HNO3 | Промышленного значения не имеет | |
Азотная кислота.
Физические
свойства. Чистая азотная кислота –
бесцветная дымящаяся жидкость с резким,
раздражающим запахом. Концентрированная
азотная кислота обычно окрашена в желтый
цвет.
Химические свойства.
Me
MeNO3 + (различные оксиды азота, азот, аммиак)
MeO
MeNO3 + H2O
MeOH
HNO3 + MeNO3 + H2O
(разб.) MeR (более слабых кислот)
MeNO3 + HR
Белок (качественная реакция)
Вещество ярко-желтого цвета.
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Cu0 – 2e— → Cu+2 1
N+5 + e— → N+4 2
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu0 – 2e— → Cu+2 3
N+5 +3e— → N+4 2
Производство азотной кислоты: NH3 → NO→ NO2 → HNO3
Соли
азотной кислоты.
Соли азотной кислоты называют нитратами.
Нитраты образуются при взаимодействии: 1) металлов основных оксидов, оснований, аммиака и некоторых солей с азотной кислотой; 2) оксида азота (IV) со щелочами.
Физические свойства. Все нитраты – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства.
Me находится левее Mg MeNO2 + O2↑
MeNO3 t Me находится между Mg и Cu MeO + NO2↑ + O2↑
Me находится правее Cu Me + NO2↑ + O2↑
t
NH4NO3 → N2O↑ + 2H2O
Для
качественного определения нитрат ионов
в пробирку помещают исследуемое вещество,
добавляют медных стружек, приливают
концентрированную азотную кислоту и
нагревают.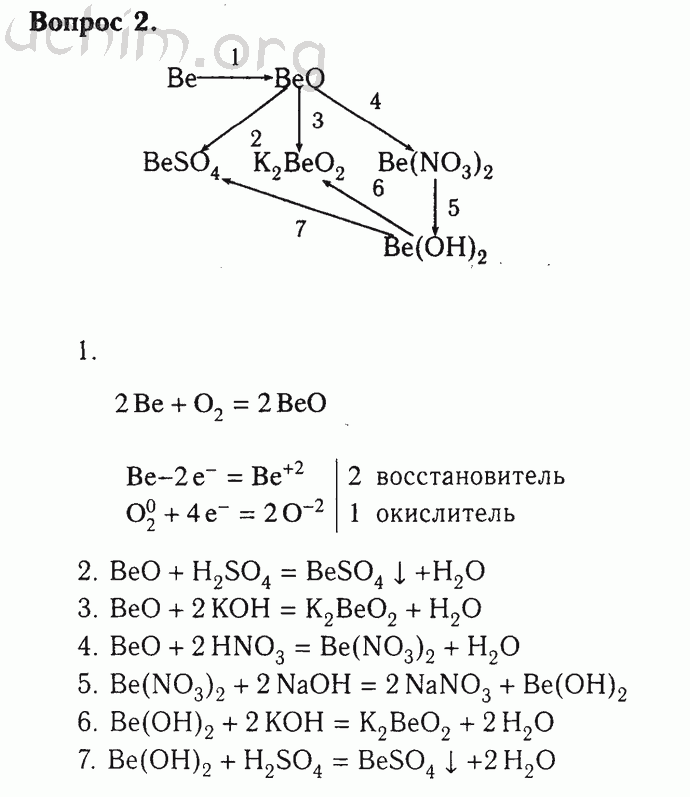 Выделение газообразного
оксида азота (IV) бурого
цвета свидетельствует о наличии
нитрат-ионов NO3—.
Выделение газообразного
оксида азота (IV) бурого
цвета свидетельствует о наличии
нитрат-ионов NO3—.
Фосфор.
В свободном состоянии фосфор образует несколько аллотропных видоизменений: красный, белый и черный фосфор. а – молекулы белого фосфора, б – кристаллическая решетка черного фосфора, в – кристаллическая решетка красного фосфора.
Из-за большой активности фосфор в природе встречается только в соединениях.
Фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Физические свойства.
Белый
фосфор. Кристаллическое вещество,
можно резать ножом (под водой). Бесцветный
с желтоватым оттенком. Имеет чесночный
запах. Плотность 1,8г/см3. В воде не
растворяется. Хорошо растворяется в
сероуглероде. Температура плавления.
44°С. Температура воспламенения 40°С. В
измельченном состоянии воспламеняется
при обычной температуре. В темноте
светится. Сильный яд.
В
измельченном состоянии воспламеняется
при обычной температуре. В темноте
светится. Сильный яд.
Красный фосфор. Аморфное или кристаллическое вещество. Темно-красного цвета. Без запаха. Плотность 2,3г/см3. В воде и сероводороде не растворяется. При сильном нагревании превращается в пары белого фосфора. Температура воспламенения примерно 260°С. Не светится, не ядовит.
Химические свойства.
O2 → P2O5
Р + H2 → PH3
Me → MeP
Оксид фосфора (V).
Физические свойства. Оксид фосфора (V) = белый рыхлый порошок, чрезвычайно гигроскопичный. Поэтому его следует хранить в герметически закрытых сосудах.
Химические
свойства. По химическим свойствам
сходен с другими кислотными оксидами.
t
P2O5 + H2O → 2HPO3 P2O5 + H2O → 2H3PO4
Ортофосфорная кислота и ее соли.
Физические свойства. Твердое кристаллическое вещество, бесцветное, хорошо растворимое в воде.
Химические свойства.
Водный раствор кислоты изменяет окраску индикатора. Диссоциация происходит ступенчато.
H3PO4 ↔ H+ + H2PO4— H2PO4 ↔ H+ + HPO4— HPO4 ↔ H+ + PO4—
Me
MeРO4 + Н2↑
MeO
MeРO4 + H2O
MeOH
H3PO4 + MeРO4 + H2O
MeR (более слабых кислот)
MeРO4 + HR
AgNO3 (качественная реакция)
Желтый
осадок.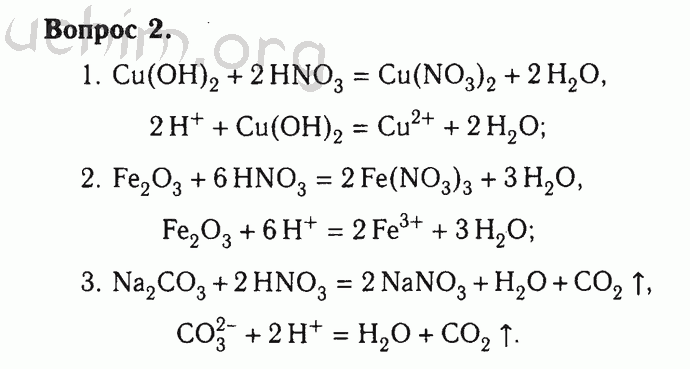
При нагревании постепенно превращается в метафосфорную кислоту.
2H3PO4 → H4P2O7 (дифосфорная кислота) + H2O
H4P2O7 → 2HPO3 (метафосфорная кислота) + H2O
Ортофосфорная кислота играет большую роль в жизнедеятельности животных и растений. Ее остатки входят в состав аденозинтрифосфорной кислоты АТФ.
При разложении АТФ выделяется большое количество энергии.
Ортофосфаты.
Ортофосфорная кислота образует три ряда солей.
MeРO4 – ортофосфаты
MeНРO4 – гидроортофосфаиы
Me Н2РO4 – дигидроортофосфаты
Вместо иона одновпалентного металла в состав ортофосфатов может входить ион аммония:
(NH4)3PO4 — ортофосфат аммония,
(NH4)2 HPO4 — гидроортофосфат аммония,
NH4H2PO4 — дигидроортофосфат аммония.
Ортофосфаты и гидроортофосфаты кальция и аммония широко используются в качестве удобрений, ортофосфат и гидроортофосфат натрия – для осаждения из воды солей кальция.
Конспект урока по Химии «Кислород» 9 класс
Тема урока: «Кислород»
Цель урока: использовать практико-ориентированный подход с целью создания оптимальных условий для мотивации познавательной деятельности обучающихся.
Задачи урока:
образовательная
Дать характеристику химическому элементу кислороду, исходя из его положения в периодической системе Д.И.Менделеева; рассмотреть состав и строение простого вещества кислорода, физические и химические свойства, способы получения и области применения; закрепить имеющиеся знания об аллотропных модификациях кислорода, методах сбора и доказательств наличия кислорода.
воспитательная
Содействовать формированию научного мировоззрения, познаваемости мира.
развивающая
Способствовать развитию умения выделять главное в изучаемом материале, развитию умения логически мыслить, анализируя, сравнивая, делая выводы; способствовать развитию самостоятельности школьников, а также развитию познавательного интереса и коммуникативных качеств.
Тип урока: по дидактической цели — изучение нового материала,
по способу организации — комбинированный.
Оборудование :
1) ЛСМ “Химический элемент”, периодическая система химических элементов Д.И.Менделеева, карточки, снимок поверхности Земли.
2) оборудование для эксперимента: стакан химический, раствор перекиси водорода, оксид марганца (IV), ложечка, лучина, спиртовка, спички.
Информационные истиочники:
Воскобойникова Н.П., Галыгина И.В., Галыгина Л.В. К вопросу о педагогических технологиях и системах обучения //Химия в школе.
 – 2002 — №2. — С. 16-20.
– 2002 — №2. — С. 16-20.Габриелян О.С., Остроумов И.Г. Изучаем химию в 9 классе: дидактическое пособие к учебнику О.С.Габриеляна «Химия-9» для учащихся и учителей общеобразовательных учебных заведений – М.: «БЛИК и К0», 2003. — С. 140 – 143.
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002. — С. 151 – 158.
Лисицын О. Г. Роль зелёных насаждений в создании оптимальной городской среды [Электронный ресурс]: реферат О. Г. Лисицын – Электрон. дан. – Режим доступа: http://5ka.ru/97/32427/1.html– Заглавие с экрана.
Полезная химия: задачи и истории / Л.Ю. Аликберова, Н.С. Рук. – М.: Дрофа, 2005.
Я познаю мир: Детская энциклопедия: Химия / Авт.-сост. Л.А. Савина. – М.: ООО «Фирма «Издательство АСТ», 1999.
Ход урока
Вводное слово учителя
Сегодня мы с вами будем говорить о веществе, которое можно охарактеризовать так: вездесущий, всемогущий, невидимый. На первый взгляд может показаться, что его вообще не существует, однако это вещество есть, мало того, без него человечество попросту задохнулось бы.
На первый взгляд может показаться, что его вообще не существует, однако это вещество есть, мало того, без него человечество попросту задохнулось бы.
Учащимся предлагается предположить, о каком веществе и химическом элементе пойдет речь и определиться с задачами урока.
Восстановление опорных знаний
Используя логико-смысловую модель (приложение 1), учащимся предлагается дать характеристику химическому элементу кислороду (фронтальная работа).
Формирование знаний, умений, навыков
Перед началом урока учитель разбивает учащихся на 7 групп, каждая из которых получает задание, которое должна выполнить в течение 10 минут. Два человека работают в течение этого времени по карточкам самостоятельно у доски. Выкладки, необходимые для ответа, учащиеся, работающие в группах, выносят на интерактивную доску.
Карточка 1
Составьте уравнения химических реакций, если известно, что по каждой из них выделяется кислород.
t
KMnO4 = K2MnO4 + MnO2 + …
t
KClO3 = …
эл.ток
H2O = …
свет
H2O2 =…
Карточка 2
Составьте уравнения химических реакций:
Mg + O2 =
P + O2 =
S + O2 =
Na + O2 =
Cu + O2 =
Задание для 1 группы
Используя материал параграфа, расскажите о нахождении кислорода в природе.
Какова объемная и массовая доли кислорода в воздухе?
Изучите снимок участка поверхности Земли, сделанный со спутника (приложение 2).

Рассчитайте, сколько кислорода мог бы выделить сгоревший участок лесного массива в течение года, если известно, что за один теплый солнечный день 1 гектар леса выделяет 180-200 кг кислорода.
Задание для 2 группы
Расскажите о составе и строении простого вещества кислорода по плану:
формула вещества,
вид химической связи,
тип кристаллической решетки
2. Какие аллотропные модификации кислорода вам известны? Каковы их формулы и значение?
Задание для 3 группы
Используя материал учебника и детской энциклопедии «Я познаю мир», ответьте на приведенные вопросы.
Кислород получали многие химики, не зная, правда, что это за газ. За кем же закрепили приоритет его открытия?
Каким годом датируется открытие кислорода?
Кто из выдающихся химиков дал название элементу кислороду; что оно означает?
Составьте уравнения реакций, на основе которых он, как считается, впервые был получен.

Задание для 4 группы
Используя материал учебника и справочных пособий, дайте ответ на поставленные вопросы.
1. Охарактеризуйте физические свойства кислорода по плану:
цвет,
вкус,
запах,
легче или тяжелее воздуха,
t кипения,
особые свойства.
Как доказать наличие кислорода в сосуде?
Как следует держать пробирку при сборе кислорода? Ответ поясните.
Почему кислород можно собирать как методом вытеснения воздуха, так и методом вытеснения воды?
Задание для 5 группы
Используя материал учебника, дайте ответ на поставленные вопросы.
Какие реакции называются реакциями горения?
К какому типу реакций (по тепловому эффекту) следует отнести реакции горения?
Чем реакция горения отличается от процесса окисления?
Составьте уравнения реакций горения:
CH4 + O2 = …
… + O2 = H2O + P2O5
Задание для 6 группы
Расскажите о круговороте кислорода в природе.
Откуда появляется кислород в атмосфере Земли?
Что вам известно о процессе фотосинтеза?
Почему концентрация кислорода не уменьшается из-за расходования в процессе дыхания и горения?
Растения суши и Мирового океана ежегодно выделяют 320 млрд.
 тонн газообразного кислорода с избытком восполняя расход этого газа в промышленности, энергетике и на транспорте. Рассчитайте, сколько молекул кислорода ежегодно выделяет зеленая растительность?
тонн газообразного кислорода с избытком восполняя расход этого газа в промышленности, энергетике и на транспорте. Рассчитайте, сколько молекул кислорода ежегодно выделяет зеленая растительность?
Задание для 7 группы
Используя материал учебника, подготовьте сообщение об областях применения кислорода.
Кислород, используемый на подводных лодках и космических кораблях для обеспечения жизни экипажа, получают по реакции пероксида калия (K2O2) с углекислым газом, накапливающимся в воздухе в результате дыхания. При этом помимо кислорода образуется карбонат калия. Составьте уравнения данной химической реакции.
Учащиеся поочередно отчитываются о проделанной работе. После отчета учащихся 3 группы учителем обращается внимание на задание карточки 1, выполненное на доске, которое характеризует и другие способы получения кислорода. После отчета учащихся 4 группы учитель предлагает выполнить лабораторную работу по получению кислорода из пероксида водорода и доказать его наличие в сосуде. Затем рассматривается задание карточки 2, которая фактически характеризует химические свойства кислорода: взаимодействие с простыми веществами; заслушиваются ответы учащихся 5,6,7 групп.
Затем рассматривается задание карточки 2, которая фактически характеризует химические свойства кислорода: взаимодействие с простыми веществами; заслушиваются ответы учащихся 5,6,7 групп.
Формирование способов умственных и практических действий с новыми знаниями
В конце урока учащимся можно предложить выполнить тест обучающего характера.
Вариант 1
1. Относительная молекулярная масса кислорода равна:
а) 16, б) 32, в) 48
2. Кислород обладает следующими свойствами:
а) легче воздуха,
б) плохо растворим в воде,
в) поддерживает дыхание,
г) не поддерживает горение.
3. Оксидами являются:
а) НgО,
б) НСl,
в) HNО3 ,
г) О2 ,
д) Аl2О3
4. При взаимодействии калия и кислорода образуется вещество состава:
При взаимодействии калия и кислорода образуется вещество состава:
а) КО2 , б) КО, в) К2О.
5. Кислород выделяется в результате процесса:
а) брожения фруктовых соков
б) гниения отмерших частей растений,
в) фотосинтеза,
г) дыхания человека и животных
Вариант 2
1. Название химическому элементу кислороду дал:
а) Дальтон, б) Лавуазье, в) Шееле .
2. Кислород обладает следующими свойствами:
а) тяжелее воздуха,
б) хорошо растворим в воде,
в) не поддерживает дыхание,
г) поддерживает горение.
3.Оксидами являются:
а) Н2О,
б) РН3 ,
в) Н2SО4 ,
г) Cl2О7 ,
д) О2
4. При взаимодействии магния и кислорода образуется вещество состава:
При взаимодействии магния и кислорода образуется вещество состава:
а) MgО2 , б) MgО, в) Mg2О.
5. Кислород в лаборатории можно собрать методом:
а) вытеснения воздуха,
б) методом вытеснения воды,
в) обоими перечисленными методами,
г) ни одним из этих методов.
Подведение итогов урока
Домашнее задание: §20, упр. 8 стр. 96
Конспект урока по химии 9 класс по теме «Кремний и его соединения».
Российская Федерация
Краснодарский край г. Сочи, Лазаревский район
Управление по образованию и науке администрации города Сочи
Муниципальное общеобразовательное бюджетное учреждение
гимназия № 76 имени Кононцевой Г. В г. Сочи
В г. Сочи
354207 г. Сочи, Л-207, ул. Гайдара, 11, тел. 252-29-91, факс (862) 252-29-92
Методическая разработка урока по химии в 9 классе по теме:
«Кремний и его соединения».
Разработала учитель химии: Егиазарова В.В
Цели урока:
Образовательная: сформировать и систематизировать знания о местоположении кремния в периодической системе, свойствах, получении и применении кремния и его соединений.
Развивающая: развитие умения выделять главное и формулировать вывод, умений проводить лабораторный эксперимент
Воспитательная: воспитывать культуру взаимоотношений при работе в группах (парах).
Тип урока: Урок изучения и первичного закрепления новых знаний
Используемые учебники и учебные пособия:
1. Габриелян О. С. Химия. 9 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян.- 18- е изд., стереотип. – М.: Дрофа, 2011.
С. Химия. 9 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян.- 18- е изд., стереотип. – М.: Дрофа, 2011.
2. Горковенко М.Ю. Поурочные разработки по химии: 9 класс. — М.: ВАКО, 2010.
3. Интернет-ресурсы.
Используемое оборудование: Видеопроектор, презентация, рабочий-лист, коллекция минералов (каолин, песчаник, полевой шпат).
Химические реактивы: растворы Na2SiO3, HCl, штатив с пробирками, универсальный индикатор.
Ход урока
I. Вводная часть. Орг. момент.
Вступительное слово учителя.
1 задание: “Что объединяет эти изображения?” (слайд 1)
Правильный ответ – основу составляет кремний. Кристаллический кремний полупроводник, на спутниках, крышах домов, устанавливают солнечные батареи, которые преобразуют солнечную энергию в электрическую. В калькуляторе тоже есть солнечная батарейка, которая работает от освещения.
2 задание: сформулировать тему урока – учащиеся делают это самостоятельно. (Кремний.)
(Кремний.)
Запись темы урока в рабочую тетрадь. Сообщение целей урока. (Слайд 2)
Как Вы думаете ребята это важная тема? Ответим на этот вопрос, прочитав текст рабочего листа.
3 задание: прочитать вслух текст из рабочего листа (актуальность), сделать вывод
(слайд 4)
II. Основная часть. Изучение нового материала.
Распространенность кремния в природе: (слайд 5, 6)
В состав каких соединений он входит?
Работа в группах: рассмотрите образцы минералов (полевой шпат, песчаник, каолин). Сравните эти минералы по цвету, твердости, блеску и т.д.
(ребята рассматривают выданные образцы минералов)
Много ли этого элемента в природе?
Ответ:
Кремний – это один из распространенных в земле элементов (27,6% массы). Главная часть находится в соединениях кремния с кислородом и др. металлами – силикатных породах. Соединения, в состав которых входит оксид алюминия, называются алюмосиликатами. Таковы белая глина, слюда, полевой шпат. Значительная часть кремния представлена оксидом кремния (IV) – кремнезема. Окрашивание оксида кремния (IV) различными примесями образует драгоценные и полудрагоценные камни, например, изумруд, топаз, аквамарин и др.(Слайд 7)
Значительная часть кремния представлена оксидом кремния (IV) – кремнезема. Окрашивание оксида кремния (IV) различными примесями образует драгоценные и полудрагоценные камни, например, изумруд, топаз, аквамарин и др.(Слайд 7)
Вообще в чистом виде кремний в природе не встречается.
Попробуем по рисунку охарактеризовать простое вещество – кристаллический кремний (Слайд 8).
тёмно-серого цвета
полупроводник
твёрдый (твердость по шкале Мооса – 7)
температура плавления 1415 °С
имеет металлический блеск.
Запись физ. Свойств кремния в рабочую тетрадь.
Поговорим о получении кремния. Кремний получают как в промышленности, так и лаборатории.
— в промышленности
В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом (углём):
SiO2+2C = Si+2CO
— в лаборатории
В качестве восстановителей используют магний или алюминий:
SiO2+2Mg = Si+2MgO
3SiO2+4Al = 3Si+2Al2O3
Вы помните о том, что ПСХЭ – это универсальная подсказка, которой нужно уметь пользоваться. Попробуем охарактеризовать элемент кремний, строение его атома, предположить степени окисления по ПСХЭ. Для оформления конспекта воспользуемся вопросами из листа фронтальной работы. (Один ученик работает у доски – отвечает на вопросы, составляет схему строения атома, предполагает степени окисления). (Слайд 9) Приложение 1.
Попробуем охарактеризовать элемент кремний, строение его атома, предположить степени окисления по ПСХЭ. Для оформления конспекта воспользуемся вопросами из листа фронтальной работы. (Один ученик работает у доски – отвечает на вопросы, составляет схему строения атома, предполагает степени окисления). (Слайд 9) Приложение 1.
Ответ:
1) Положение кремния в ПСХЭ.
1. Химический знак – Si
2. Порядковый номер – 14
3. Атомная масса – 28,086
4. Кремний находится в IV группе, гл. подгруппе, 3 период.
2) Рассмотрим строение атома:
1. Число протонов, электронов, нейтронов:
14р+; 14e; 14 n0.
2. Электронная формула:
1s2 2s2 2p6 3s2 3p2
3) Семейство — р-элемент
4) Важнейшие степени окисления: -4; 0; +4.
5) Характер элемента — неметалл
Наконец мы добрались до химических свойств. Химические свойства кремния мы рассмотрим по следующей схеме:
(Слайд 10)
(Рассматривают хим. свойства, записывают уравнения хим. реакций. Один уч-ся у доски, остальные в тетради, учитель помогает).
Проявляет восстановительные свойства:
1. Реагирует с простыми веществами – неметаллами
а) с галогенами:
Si +2F2 = SiF4
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
б) с кислородом (при t°)
Si + O2 = SiO2
в) с углеродом
Si + С = SiС (карбид кремния – карборунд)
Проявляет окислительные свойства:
а) с металлами:
Si+2Mg = Mg2Si
2. Взаимодействует со сложными веществами – со щелочами видео-эксперимент:
Si+2NaOH+H2O = Na2SiO3+2H2
Соединения кремния.
Рассказ учителя:
Одно из названных сегодня веществ – это оксид кремния SiO2. Это кислотный оксид, а для таких оксидов характерно взаимодействие с водой, основным оксидом и щелочью, но
а) SiO2 + H2O не взаимодействует
б) SiO2 + Na2O = Na2SiO3
в) SiO2+2NaOH = Na2SiO3+H2О
Составление уравнений реакций учениками на доске и в тетради.
Рассказ учителя:
Если у кремния есть кислотный оксид, то есть и соответствующая оксиду кислота.
Лабораторный опыт: “Получение кремниевой кислоты” — работа в группах, составление уравнения хим. реакции.
Na2SiO3+2HCl = H2SiO3+2NaCl (Слайд 11)
Что можно сказать о её растворимости в воде? (Она не растворима).
Применение кремния и его соединений. (Слайд 12).
Выступления ребят с подготовленными заранее сообщениями о применения кремния.
(3 доклада)
III. Заключительная часть.
Первичное обобщение приобретённых знаний и рефлексия:
Итак, сегодня на уроке мы познакомились с кремнием, узнали о строении его атома, свойствах и получении. Рассмотрели соединения кремния — оксид, кислота, бинарные соединения.
Назовите высшую и низшую степени окисления кремния.
Какова формула и характер оксида?
Какова формула гидроксида кремния (кремниевой кислоты), её особенность?
Оценивание работы на уроке учащихся, выставление отметок в дневник и журнал.
IV. Домашнее задание: параграф 31, составить задачу по любому уравнению из темы и решить её.
Конспект урока по химии для 9 класса на тему: «Фосфор»
МБОУ Пролетарская СОШ №5
Учитель: Волошина Г.В.
Класс: 9
Тема урока: Фосфор
Цель урока: создать условия для проявления познавательной активности учеников и усвоения ими знаний по теме: «Фосфор».
Задачи:
Образовательные:
— рассмотреть строение атома фосфора согласно его положению в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации фосфора;
— изучить физические и химические свойства фосфора, нахождение в природе, его области применения;
— способствовать осмыслению учащимися роли фосфора на земле и в жизни человека.
Развивающие:
-продолжить развивать УУД, продолжить формировать умения записывать уравнения химических реакций, давать названия полученным веществам, составлять ОВР;
— способствовать формированию материалистического мировоззрения,
— развивать понятие о взаимосвязи между строением и свойствами веществ;
— умение выделять общие и существенные признаки и свойства;
— умение увидеть проблему и найти пути её решения;
— умение применять полученные знания на практике.
Воспитательные:
— продолжить формирование коммуникативной компетенции у учащихся;
— показать значимость химических знаний для повседневной жизни современного человека,
— уважительное отношение к историческим фактам.
Средства обучения:
Реактивы и оборудование – красный фосфор, пробирка, держатель, спиртовка, спички, стеклянная палочка, вата, колба с кислородом, железная ложечка, стакан с водой.
Мультимедийный проектор, компьютер, мультимедийная доска, презентация Flipchart .
Раздаточный материал: таблица “Физические свойства белого, красного и черного фосфора”, тест по теме: «Фосфор», задания для групп.
Ход урока
В классе парты расставлены для работы в группах. Всем учащимся на перемене предлагается распределиться на группы, согласно их интересам. Предлагаются 4 группы: историки, биологи, химики и журналисты.
Постановка целей и задач урока
Беседа:
— Ребята, что мы с вами изучали на предыдущих уроках? (Характеристику V группы главной подгруппы, азот и его соединения).
— Как вы думаете, какой элемент мы будем изучать с вами сегодня? Почему? (Фосфор, т.к. он тоже находится в 5 группе главной подгруппе).
— А что вы хотели бы про него узнать? (Строение атома, физические, химические свойства, нахождение в природе, применение, значение для человека, в каких продуктах находится).
— Вот вы сами сформулировали цели и задачи сегодняшнего урока.
Демонстрация слайда № 1
Мотивация учащихся
— Ребята, откройте учебник стр. 232.
Учитель зачитывает отрывок из романа А.Конан-Дойла “Собака Баскервилей”. (Из учебника «Химия 9 класс»)
Демонстрация слайда № 2
“…Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
— Из какого произведения этот отрывок?
— Могло ли быть такое в действительности, прав ли был А. Конан-Дойл? Выясним сегодня на уроке.
Актуализация знаний
— Ребята, я предлагаю вам выполнить небольшой тест по данной теме. В нем есть некоторые сведения, которые вам уже знакомы из уроков биологии, истории, повседневной жизни.
Тест по теме: «Фосфор»
1. Из чего впервые получили фосфор?
а) из фосфоритов б) из слюны в) из мочи
2. От чего скончалась герцогиня Матильда?
а) наступила на спичку, загорелась и получила ожоги
б) не соблюдала правила по технике безопасности при поджигании спичек
в) съела спички и отравилась
3. Какое соединение фосфора пахнет тухлой рыбой?
а) РН3 б) Р2О5 в)Н3РО4
4. В организме человека массой 70 кг
а) содержится 2 кг фосфора
б) содержится 780 г фосфора
в) фосфор не содержится
5. Какие продукты питания содержат большое количество фосфора
а) рыба, фасоль, хлеб, молоко
б) апельсины, мандарины, лимоны
в) пастила, сухофрукты, орехи
6. Ежедневная потребность человеческого организма в фосфоре составляет
а) 5 г б) 2 г в) 1,2 г
— У вас возникли вопросы при выполнении теста? (Да).
— Я предлагает отложить тест на край стола и вернуться к нему в конце урока. Если вы будете внимательно слушать, то к концу урока найдете все ответы на интересующие вас вопросы?
Изучение нового материала
1. История открытия фосфора
Рассказ ученика (опережающее домашнее задание).
Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что первооткрывателем фосфора был арабский алхимик Альхильд Бехиль (XII век), перегонявший мочу с глиной, известью и углем. Но все же годом открытия фосфора считается 1669-й.
Демонстрация слайда № 3 № 4
Гамбургский отставной солдат, алхимик-любитель и разорившийся купец Хеннинг Бранд, хотел с помощью алхимии поправить свои дела и в поисках “философского камня”, который якобы способен превращать неблагородные металлы в золото проводил опыты с разными веществами. Бранд провел уже множество опытов с различными веществами, но ничего дельного у него не получалось. Однажды он решил провести химический эксперимент с мочой. Выпарил ее почти досуха и оставшийся светло-желтый осадок смешал с углем и песком, нагревая в реторте без доступа воздуха. В результате Бранд получил новое вещество, которое обладало удивительным свойством-светиться в темноте. Бранд назвал его фосфором, что в переводе с греческого означает “светоносец”. Способ получения фосфора он держал в секрете. Счастливый ученый не замедлил воспользоваться необычным свойством нового вещества и стал демонстрировать светящийся фосфор знатным особам за довольно высокое вознаграждение. Религиозно и мистически настроенные богатые люди того времени диву давались, смотря на различные манипуляции Бранда с этим «божественным» веществом. Он ловко использовал огромный интерес ученых и широкой публики к фосфору и стал продавать его по цене, превосходившей даже стоимость золота.
В третий раз фосфор открыл Р.Бойль в 1680 году. Бойль опять таки самостоятельно получил фосфор из мочи. Через Бойля этот способ и получил всеобщую известность.
2. Фосфор как химический элемент.
Беседа:
— Каково положение фосфора в периодической системе химических элементов Д.И.Менделеева?
— Составьте схему строения атома фосфора, сделайте вывод о проявлении свойств.
— Определите возможные степени окисления фосфора в соединениях.
— Составьте формулу летучего водородного соединения и высшего оксида, расставьте степени окисления. Каков характер оксида?
(Один ученик у доски расписывает строение атома и отвечает на вопросы).
3. Аллотропные видоизменения фосфора.
— Необычное светящееся вещество, полученное Брандом, — белый фосфор. Кроме белого, есть еще красный фосфор и черный фосфор. Как называется явление существования нескольких простых веществ, образованных одним химическим элементом? (Аллотропия).
Демонстрация слайда №5
Молекула белого фосфора состоит из четырех атомов, построенных в форме тетраэдра. Имеет молекулярную кристаллическую решетку. Красный фосфор имеет атомную кристаллическую решетку с довольно сложным строением. Существует еще чёрный фосфор — полимерное вещество с металлическим блеском, похожее на графит, без запаха, жирное на ощупь. Не растворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник.
— Как вы думаете, можно ли из одного аллотропного видоизменения фосфора получить другое?
— Давайте попробуем осуществить это на практике. Для этого у вас на столе есть все необходимое. Соблюдайте правила по технике безопасности.
Лабораторный опыт. Получение белого фосфора из красного.
Красный фосфор (количество – с полгорошины) поместить в пробирку, вставить стеклянную палочку, закрыть тампоном, нагреть. Образуется белый дым оксида фосфора, затем – желтоватые капли белого фосфора. Извлечь стеклянную палочку, белый фосфор самовозгорается.
— Какова температура воспламенения белого фосфора? (44 градуса).
— Прав ли был А.Конан-Дойл в описании собаки Баскервилей? Почему? (Не прав. Этого не могло быть. Белый фосфор самовозгорается на воздухе. Кроме того, процесс окисления катализируется органическими веществами, в частности, шерстью. Поэтому собака Баскервилей не могла быть намазана белым фосфором).
— Каково физиологическое действие белого фосфора?
Доза фосфора в 0,05–0,15 г для человека смертельна. Профессиональным заболеванием рабочих первых спичечных фабрик был фосфорный некроз – поражение челюстей.
Белый фосфор не только является сильным ядом, при попадании на кожу вызывает долго не заживающие ожоги.
4. Физические свойства фосфора.
— Давайте более подробно познакомимся с физическими свойствами аллотропных видоизменений фосфора. Сравните физические свойства белого, красного, черного фосфора. (Самостоятельная работа учащихся с таблицей).
Таблица “Физические свойства белого, красного и черного фосфора”
Белый фосфор | Красный фосфор | Чёрный фосфор |
Твёрдое кристаллическое вещество, плотность 1,83г/см3. В чистом виде совершенно бесцветен и прозрачен; продажный продукт окрашен в желтоватый цвет и по внешнему виду очень похож на воск. На холоду хрупок, но при температуре свыше 150С становиться мягким и легко режется ножом. Плавится при t=44,10С, а при t=2750С начинает кипеть. Молекула фосфора в парах при температурах ниже 8000С состоит из 4-х атомов (Р4) и имеет молекулярную кристаллическую решетку. На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название “фосфор”, которое в переводе на русский язык значит “светоносный”. Уже при слабом нагревании, для чего достаточно простого трения, фосфор загорается и сгорает, выделяя большое количество тепла. Фосфор может и сам собой воспламениться на воздухе вследствие выделения тепла при окислении. Чтобы защитить белый фосфор от окисления, его сохраняют под водой. В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде. Белый фосфор – сильный яд, даже в малых дозах действующий смертельно. | Красный фосфор по свойствам резко отличается от белого, он очень медленно окисляется на воздухе, не светится в темноте, загорается только при 2600С, не растворяется в сероуглероде и не ядовит. Плотность фосфора красного равна 2,20 г/см3.. .Имеет атомную кристаллическую решетку. | Чёрный по виду очень похож на графит, жирен на ощупь, хорошо проводит электрический ток и значительно тяжелее других видоизменений фосфора. Плотность чёрного фосфора равна 2,70 г/см3,температура воспламенения 4900С. Имеет атомную кристаллическую решетку. |
— Сходны или различны свойства белого и красного фосфора? (Различные).
— Чем объясняются различия в свойствах? (Строением кристаллической решетки).
Демонстрация слайда №6
5. Химические свойства фосфора
— Фосфор часто называют многоликим элементом. Не только из-за аллотропных видоизменений, но и благодаря химическим свойствам.
Давай посмотрим опыты, характеризующие химические свойства фосфора: Горение фосфора в кислороде.
Горение фосфора под водой.
Взаимодействие фосфора с хлором.
Взаимодействие фосфора с бертолетовой солью.
(Просмотр видеороликов). Демонстрация слайда №7 № 8
Я предлагаю вам написать уравнения химических реакций, которые мы с вами посмотрели, и разобрать их с точки зрения ОВР. Для этого выберите цвет понравившегося вам лепестка клевера, на обратной стороне которого будет ваше задание. (Учащиеся выбирают разноцветные листики клевера с заданиями).
Демонстрация слайда № 9, 10
4Р + 5О2 = 2Р2О5
3Mg + 2P = Mg3P2
5KClO3 + 6P = 3P2O5 + 5KCl
2P+ 5Cl2 = 2PCl5
На выполнение задания 5 минут. Учащиеся выполняют задания в группах, записывают их тетрадях, затем выходят к доске по одному человеку из команды и записывают ОВР своей реакции.
— В этой реакции фосфор выступает в роли окислителя или восстановителя?
— Какой вывод можно сделать о свойствах фосфора? (Этот элемент может проявлять как окислительные, так и восстановительные свойства).
— Распределите реакции на две колонки. Демонстрация слайда № 11 (Работа учащихся с интерактивной доской).
— Ребята, запишите схему и уравнения реакций с доски, а дома разберите их как ОВР.
— С фосфором и его соединениями связано немало легенд и суеверий. Сейчас я предлагаю вам в группах ознакомиться с материалами, которые у вас находятся на столе.
1группа Фосфор в организме человека (Биологи)
В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Если бы фосфор исчез из костей, наше тело превратилось бы в бесформенные массы. Если бы фосфор исчез из мышц, мы утратили бы способность двигаться, из нервной ткани – мы перестали бы мыслить. Академик А.Е. Ферсман назвал фосфор “элементом жизни и мысли”.
Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра.
Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5:1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
2 группа Необыкновенная история обыкновенной спички (Историки)
Первые спички содержали белый фосфор. Они были очень опасны и зажигались очень легко, а порой и неожиданно, что нередко приводило к пожарам. В 1867 г. от ожогов скончалась итальянская герцогиня Матильда, которая случайно наступила на спичку и ее платье было мгновенно охвачено пламенем.
Кроме того, белый фосфор очень ядовит. Описаны случаи отравления фосфорными спичками, как из-за неосторожного обращения, так и с целью самоубийства: для этого достаточно было съесть несколько спичечных головок. Вот почему на смену опасным спичкам пришли безопасные, содержащие красный фосфор, которые верно служат нам, и по сей день. Промышленное производство безопасных спичек началось в Швеции в 60-х гг. XIX века.
Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла и клея. В состав спичечной головки входят окислители (KСlO3 бертолетовая соль) и восстановители (S сера). При трении спички о коробок происходит следующая реакция:
6P + 5KClO3 — 5KCl+ 3P2O5
3 группа “Светящийся монах” (Журналисты)
Вот что о работе с газообразным фосфором вспоминает академик С. И. Вольфкович: “Фосфор получался в электрической печи, установленной в Московском университете на Моховой улице. Так как эти опыты проводились тогда в нашей стране впервые, я не предпринял тех предосторожностей, которые необходимы при работе с газообразным фосфором – ядовитым, самовоспламеняющимся и светящимся голубоватым цветом элементом. В течение многих часов работы у электропечи часть выделяющегося газообразного фосфора настолько пропитала мою одежду и даже ботинки, что когда ночью я шел из университета по темным, не освещенным тогда улицам Москвы, моя одежда излучала голубоватое сияние, а из-под ботинок (при трении их о тротуар) высекались искры. За мной каждый раз собиралась толпа, среди которой, несмотря на мои объяснения, немало было лиц, видевших во мне “новоявленного” представителя потустороннего мира. Вскоре среди жителей района Моховой и по всей Москве из уст в уста стали передаваться фантастические рассказы о “светящемся монахе”…
4 группа “Огни на кладбищах” (Химики)
“На кладбище мы встретили массу вертящихся над могилами прозрачных огоньков. Иные были ростом с аршин. При первом дуновении ветерка огоньки заколыхались, быстро помчались вперед”. Фосфор как элемент входит в состав живых организмов, при гниении остатков животных, человека образуется РН3 – фосфин. Непрочное соединение, прямым соединением фосфора и водорода получить нельзя. На воздухе самовоспламеняется. Очень ядовитый бесцветный газ с запахом тухлой рыбы.
При разложение богатых фосфором соединений органического происхождения может выделяться фосфин. Одновременно с ним идёт образование другого продукта – дифосфина Р2Н4, представляющего собой жидкость. Пары дифосфина самовоспламеняются и поджигают газообразный фосфин. Этим объясняется появление так называемых, “блуждающих огней” в таких местах, как кладбище, болота.
Демонстрация слайда № 12 Видеоролик «Образование и возгорание фосфина».
6. Нахождение в природе, получение фосфора
Нахождение в природе и организме.
В свободном состоянии в природе не встречаются вследствие легкой окисляемости фосфора. Природные минералы – фосфорит Сa3(РО4)2, апатит –
Сa3(РО4)2•СaCI2 или Сa3(РО4)2•СaF2.Зубная эмаль, представляющая собой в соответствии со своими функциями самое твёрдое из веществ, тот же самый апатит.
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
Демонстрация слайда № 13
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
7. Применение фосфора
Демонстрация слайда № 14
Главные его потребители – производство спичек, металлургия, химические производства. В недавнем прошлом на военных предприятиях его использовали для приготовления дымовых и зажигательных составов.Большая часть фосфора, используемая промышленностью, идет на создание моющих средств и для умягчения воды.
Вода, обработанная соединениями фосфора, становится мягкой (т. е. не содержащей солей) и уменьшается образование накипи, так как фосфаты способствуют удалению накипи со стенок паровых машин. Большое количество фосфора идет на производство его органических соединений. Они используются для уничтожения насекомых-вредителей и для прополки сорняков. К сожалению, это же свойство фосфорных соединений используется и в военных целях. Фосфорорганические соединения входят в состав многих отравляющих веществ. Во Вьетнаме военщина США применяла их для уничтожения растительности, обрабатывая с самолетов целые провинции.
Военное применение находит и сам фосфор в виде простого вещества. Большое количество белого густого дыма, образующегося при горении.
С развитием полупроводниковой промышленности все чаще стали создаваться полупроводники на основе фосфидов.
Получили широкое распространение полупроводниковые материалы, с фосфидами индия, галлия, алюминия, бора. Входят фосфиды и в состав некоторых бронз. Металлургия использует соединения фосфора для создания защитных покрытий на металлах.
Очень часто пленка фосфатов используется как грунт для нанесения красок. Препарат мажеф известен ка средство защиты от коррозии. Состав его зашифрован в названии: фосфаты марганца и железа с небольшой добавкой фосфатов цинка и оксидов меди.
Удобрения, содержащие фосфор
Демонстрация слайда №15
Название удобрения | Химический состав |
Простые | |
Суперфосфат двойной | Са(Н2РО4)2 |
Суперфосфат простой | Са(Н2РО4)2 + 2СаSО4 |
Фосфоритная мука | Са3(РО4)2 |
Костяная мука | Са3(РО4)2 |
Преципитат | СаНРО4 х 2Н2О |
Шлак мартеновский печей | Сложный состав. Содержит P,Ca, Si, C, Fe и др. элементы |
Комплексные | |
Аммофос | (Nh5)2HPO4 + Nh5h3PO4 |
Аммофоска | (Nh5)2HPO4 + Nh5h3PO4 + KCl |
Нитроаммофос | Nh5h3PO4 + Nh5NO3 |
Войска США использовали зажигательные фосфорные бомбы во время военной операции вблизи иракского города Эль-Фаллуджа в 2004 году.
Демонстрация слайда №16
По словам представителя Пентагона, белый фосфор использовали как огневое средство против боевиков и для освещения поля боя. В то же время один из итальянских телеканалов сообщал, что среди жертв фосфорных бомб были женщины и дети.
Белый фосфор применяется в военном деле в качестве боевого зажигательного и дымообразующего вещества. При сжигании белого фосфора на воздухе получается фосфорный ангидрид, пары которого, притягивая из воздуха влагу, образуют непроницаемую пелену белого тумана из тончайших капелек раствора метафосфорной кислоты.
V Закрепление изученного
— Ребята давайте вернемся к вашему тесту. Есть ли теперь у вас вопросы? (нет). Нашли ли вы ответы на интересующие вас вопросы? (Да). Молодцы, значит вы очень внимательно слушали друг друга и хорошо работали сегодня. Сдайте свои работы.
VI Подведение итогов урока, комментирование и выставление отметок
VII Домашнее задание:
1. Параграф 32 упр 2,4
2 Индивидуальные задания. Подготовить сообщения:
1) История возникновения спичек;
2) Биологическая роль фосфора.
VIII Рефлексия
Вам было над чем подумать сегодня на уроке?
Узнали ли вы сегодня, что то новое?
Вы принимали активное участие в уроке?
Пригодится ли вам это в жизни?
Вам понравился урок?
Спасибо, ребята вам за урок. До свидания.
План-конспект урока к учебнику Рудзитиса Г.Е. Неорганическая химия. 9 класс.
Устно отвечают на вопросы учителя:
Тема урока «Железо — элемент побочной подгруппы Периодической системы» Автор: учитель химии Зайцева Н.С. Цель: Создать условия для изучения свойств элементов побочных подгрупп Периодической системы химических
ПодробнееХимия 8-9 Нормативнометодические
Химия 8-9 Нормативнометодические материалы Реализуемый УМК Цели и задачи изучения Срок реализации Место в учебном плане Результатаы Базисный учебный план общеобразовательных учреждений РФ, утвержденный
ПодробнееСОЛИ АММОНИЯ ХОД УРОКА
Девиз урока: Практика есть дерево жизни. СОЛИ АММОНИЯ Цели. Систематизировать знания учащихся о солях; познакомить их с солями сложного катиона; изучить свойства, присущие солям аммония; научить распознавать
ПодробнееРабочая программа курса химии 8-9 класс
\ Рабочая программа курса химии 8-9 класс Пояснительная записка Программа разна на основе следующих нормативных документов: Федеральный компонент Государственного Образовательного Стандарта (ФК ГОС 2004
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
ПодробнееТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ( 8 класс )
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ( 8 класс ) п/п Тема урока Тип урока Элементы содержания Требования к уровню подготовки обучающихся (результат) Измерители Эксперимент Домашнее задание 1 2 3 4 5 6 7 ТЕМА 1. ВВЕДЕНИЕ.
ПодробнееПОЯСНИТЕЛЬНАЯ ЗАПИСКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Данная рабочая программа по химии в 11 классе составлена на основе федерального компонента образовательного стандарта и программы курса химии для 8-11 классов общеобразовательных
ПодробнееУчебно-тематическое планирование
Учебно-тематическое планирование по химии Класс 8 Учитель Саликова Фарида Дамировна Количество часов всего 70 часов, в неделю 2 часа. Плановых контрольных уроков-4, практических работ-6. Планирование составлено
ПодробнееАннотация к рабочей программе по химии.
Аннотация к рабочей программе по химии. Программа разработана на основе Федерального компонента государственного стандарта общего образования по химии (Часть I. Основное общее образование) для основной
ПодробнееПояснительная записка
Пояснительная записка Настоящая программа раскрывает содержание обучения химии учащихся в 8-9 классах общеобразовательных учреждений. В системе естественно-научного образования химия как учебный предмет
ПодробнееБилеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
ПодробнееПоурочное планирование по химии, 8 класс,
Поурочное планирование по химии, 8 класс, (2часа в неделю, всего 68 часов), УМК О. С. Габриеляна п/п Кол-во часов Тема урока Элементы содержания Требования к уровню подготовки выпускников Средства обучения
ПодробнееОтветы на билеты по химии за 11 класс
Ответы на билеты по химии за 11 класс >>> Ответы на билеты по химии за 11 класс Ответы на билеты по химии за 11 класс Простые и сложные эфиры. Алкены ряда этена этиленаих общая формула. Периодический закон
ПодробнееПояснительная записка:
Пояснительная записка: Рабочая программа по химии 8 класса составлена на основе: «Программы курса химии для 8 11класса для общеобразовательных учреждений» — М.: «Дрофа» 2007 и учебника О.С. Габриелян «Химия.
ПодробнееВиды контроля, измерители
УЧЕБНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ХИМИЯ 8 КЛАСС Количество часов: всего — 70, в неделю — 2 часа. Плановых контрольных ов — 6, практических работ — 5 Планирование составлено на основе программы О.С. Габриеляна
ПодробнееАннотация к программе химия 8 класс
Аннотация к программе химия 8 класс Рабочая программа составлена на основе Федерального Государственного стандарта, Примерной программы основного общего образования по химии, а также программы курса химии
ПодробнееРабочая программа по химии 8 класс
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 3 г.о. Подольск мкр. Климовск УТВЕРЖДАЮ Директор МБОУ СОШ 3 С.Г. Пелипака 2016 Рабочая программа по химии 8 класс
Подробнееавтор/авторский коллектив учебника
Аннотация к рабочей программе по химии 8 9 класс Рабочая программа разработана на основе Примерных программ основного общего образования по химии (базовый уровень), соответствующих федеральному компоненту
ПодробнееРабота учителя на уроке:
Учитель Орехова Л.Н., МАОУ гимназия 1 Типы химической связи 8 класс Презентация прилагается Оборудование и ресурсы: Компьютер, проектор, плакаты, модель кристаллической решётки, вещества: соли, основания.
ПодробнееКонспект урока по химии на тему «Сплавы» для 9 класса
Урок по химии на тему «Сплавы»
9 класс
Автор Ким Наталья Викторовна
учитель химии высшей
квалификационной категории
МБОУ «СОШ №6» г. Нягани ХМАО-Югры
Цель урока: изучение многообразия сплавов; их свойств и областей применения сплавов.
Оборудование: коллекция «Металлы и сплавы», выставка открыток с изображением изделий из сплавов, периодическая таблица Д.И.Менделеева.
Ход урока.
I. Орг. момент.
II. Повторение.
Игра «Мозговой штурм» — на 5 минут класс разбивается на группы по 4 человека (две рядом расположенные парты). Каждая группа получает листок с заданием – загадкой на свойства металлов или определение самого металла. Через 5 минут группа зачитывает свой ответ к заданию. Можно разным группам приготовить похожие задания, тогда возможно обсуждение между группами.
Образцы заданий.
1. Как известно, после Бородинского сражения (26.08.1812 года) главнокомандующий русской армией генерал – фельдмаршал М.И.Кутузов (1745-1813 г.) принял очень нелегкое решение сжечь Москву: «Мы оставим Москву, но спасем армию, а значит, и всю Россию». Москва горела шесть дней. Погибло три четверти построек. Пожар уничтожил и монетный двор. Впоследствии, при разборке пожарища были обнаружены медяки, покрытые черным налетом.
Объясните причину образования черного налета на медных монетах? Можно ли его смыть? Если да, то как?
2. Хранение скоропортящихся продуктов сегодня не является проблемой благодаря холодильникам. Наши предки решали эту проблему, не имея сложной бытовой техники. Например, для того, чтобы сохранить куриные яйца дольше свежими, их обрабатывали раствором гашеной извести. Одну часть гашеной извести растворяли в 20 частях воды. Свежее яйцо окунали в полученный раствор. Когда яйцо высыхало, обработку повторяли.
Объясните процессы, происходящие с яйцом при длительном хранении на воздухе? Объясните, что происходит с яйцом после данной обработки?
3. Несколько лет назад из Летнего сада в С-Петербурге были убраны все подлинные статуи, являющиеся бесценными произведениями искусства, их заменили копиями.
Чем объяснить такое решение городских властей?
Какие компоненты воздуха приводят к разрушению мраморных статуй?
III. Содержание урока.
Сплавы — это материалы с характерными свойствами, состоящие из двух и более компонентов, из которых, по крайней мере, один — металл.
В большинстве случаев сплавы обладают более полезными свойствами, чем составляющие их чистые металлы. Получены десятки тысяч сплавов. В чистом виде металлы используют редко.
1. Свойства сплавов.
У бронзы, например, прочность выше, чем у составляющих ее меди и олова. Сталь и чугун прочнее технически чистого железа. Помимо большей прочности многие сплавы обладают большей коррозионной стойкостью и твердостью, лучшими литейными свойствами, чем чистые металлы. Так, чистая медь очень плохо поддается литью, из нее трудно получить отливки, и в то же время оловянная бронза имеет прекрасные литейные свойства: из нее отливают художественные изделия, требующие тонкой проработки деталей. Чугун-сплав железа с углеродом — также великолепный литейный материал.
Помимо более высоких механических качеств сплавам присущи свойства, которых нет у чистых металлов. Примерами могут служить получаемая на основе железа нержавеющая сталь-материал с высокой коррозионной стойкостью даже в агрессивных средах и с высокой жаропрочностью, магнитные материалы, сплавы с высоким электрическим сопротивлением, с малым коэффициентом термического расширения.
2. Классификация сплавов.
В металлургии железо и его сплавы выделяют в одну группу под названием черные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или черных) сплавов содержит углерод. Их разделяют на чугуны и стали.
Сплавы чёрной металлургии.
Чугун-сплав на основе железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу. Чугун значительно тверже железа, обычно он очень хрупкий, не куется, а при ударе разбивается. Этот сплав применяется для изготовления различных массивных деталей методом литья, так называемый литейный чугун и для переработки в сталь — передельный чугун.
В зависимости от состояния углерода в сплаве различают серый и белый чугун.
Сталь-сплав на основе железа, содержащий менее 2% углерода. По химическому составу стали делят на два основных вида: углеродистая и легированная стали.
Углеродистая сталь представляет собой сплав железа главным образом с углеродом, но, в отличие от чугуна, содержание в ней углерода, а также других веществ гораздо меньше. В зависимости от количества углерода стали подразделяют на мягкие (0,3%С), средней твердости и твердые (до 2%С). Из мягкой и средней твердости стали делают детали машин, трубы, гвозди, скрепки и т. д., а из твердой — различные инструменты.
Легированная сталь — это тоже сплав железа с углеродом, только в него введены еще специальные, легирующие добавки: хром, никель, вольфрам, молибден и др.
Легирующие добавки придают сплаву особые качества. Так, хромоникелевые стали очень пластичные, прочные, жаростойкие, кислотоупорные, устойчивые против коррозии. Они применяются в строительстве, а также для изготовления нержавеющих предметов домашнего обихода (ножей, вилок, ложек), всевозможных медицинских и других инструментов. Хромомолибденовые и хромованадиевые стали очень твердые, прочные и жаростойкие. Они используются для изготовления трубопроводов, компрессоров, моторов и многих других деталей машин современной техники.
Стали — это основа современного машиностроения, оборонной промышленности, ракетостроения и других отраслей промышленности. В развитии современной металлургии стали большое значение имели работы Д. К. Чернова и П. П. Аносова
Сплавы цветной металлургии.
Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель.
На сплавы идет более 30% меди. Латуни — сплавы меди с цинком ( меди от 60 до 90% и цинка от 40 до 10%) — прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлозно-бумажной промышленности.
Бронза — сплав на основе меди с добавкой (до 20%) олова. Бронза хорошо отливается, поэтому используется в машиностроении, где из нее изготавливают подшипники, поршневые кольца, клапаны, арматуру и т. д. Используется также для художественного литья.
Алюминиевые бронзы. Дюралюминий — сплав на основе алюминия, содержащий медь, магний. Марганец и никель. Имеет хорошие механические свойства, применяется в самолетостроении машиностроении. Содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
Свинцовые бронзы, содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
Кремниевые бронзы, содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
Бериллиевые бронзы, содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
Кадмиевые бронзы — сплавы меди с небольшим количества кадмия (до 1%) — используют при производстве троллейных проводов, для изготовления арматуры водопроводных и газовых линий и в машиностроении.
Припои — сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва. Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31%Cu; остальное — цинк). Из цветных сплавов отметим бронзу, латунь, мельхиор, дюралюминий.
IV. Домашнее задание.
§7упр.1-3,сообщения о производстве и применении сплавов .
V. Закрепление
1. На какие две группы делятся металлы?
2. Сравните состав и свойства чугуна и стали. В чем сходство и различие?
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7A
класс 7Б
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 8A
класс 8Б
Grade 8 (комбинированные A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 9А
Марка 9Б
Оценка 9 (вместе A и B)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 4A
класс 4Б
Класс 4 (комбинированные A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 6А
класс 6Б
Класс 6 (вместе A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснялось:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими организациями, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без бренда)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Сиявуле. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Основные темы по химии
Общая химия — это изучение материи, энергии и взаимодействия между ними.Основные темы химии включают кислоты и основания, атомную структуру, периодическую таблицу, химические связи и химические реакции.
Кислоты, основания и pH
Анчали Фанмаха / Getty Images
Кислоты, основания и pH — это понятия, применимые к водным растворам (растворам в воде). pH относится к концентрации ионов водорода или способности частиц отдавать / принимать протоны или электроны. Кислоты и основания отражают относительную доступность ионов водорода или доноров или акцепторов протонов / электронов.Кислотно-основные реакции чрезвычайно важны в живых клетках и промышленных процессах.
Атомная структура
изображений героев / Getty Images
Атомы состоят из протонов, нейтронов и электронов. Протоны и нейтроны образуют ядро каждого атома, а электроны движутся вокруг этого ядра. Изучение атомной структуры включает понимание состава атомов, изотопов и ионов.
Электрохимия
Драган Смилькович / Getty Images
Электрохимия в первую очередь занимается окислительно-восстановительными реакциями или окислительно-восстановительными реакциями.Эти реакции производят ионы, и их можно использовать для производства электродов и батарей. Электрохимия используется, чтобы предсказать, произойдет ли реакция и в каком направлении будут течь электроны.
Единицы и измерения
barbol88 / Getty Images
Химия — это наука, основанная на экспериментах, которые часто включают в себя измерения и вычисления на основе этих измерений. Важно знать единицы измерения и различные способы преобразования между различными единицами.
Термохимия
мгаллар / Getty Images
Термохимия — это область общей химии, относящаяся к термодинамике. Иногда это называют физической химией. Термохимия включает понятия энтропии, энтальпии, свободной энергии Гиббса, условий стандартного состояния и энергетических диаграмм. Он также включает изучение температуры, калориметрии, эндотермических и экзотермических реакций.
Химическая связь
SDI Productions / Getty Images
Атомы и молекулы соединяются посредством ионной и ковалентной связи.Связанные темы включают электроотрицательность, степень окисления и структуру электронных точек Льюиса.
Периодическая таблица
СТИВ ХОРРЕЛЛ / SPL / Getty Images
Таблица Менделеева — это систематический способ организации химических элементов. Элементы проявляют периодические свойства, которые можно использовать для прогнозирования их характеристик, включая вероятность того, что они будут образовывать соединения и участвовать в химических реакциях.
Уравнения и стехиометрия
Witthaya Prasongsin / Getty Images
Важно научиться уравновешивать химические уравнения и как различные факторы влияют на скорость и выход химических реакций.
Растворы и смеси
AzmanL / Getty Images
Важной частью общей химии является изучение различных типов растворов и смесей и способов расчета концентраций. В эту категорию входят такие темы, как коллоиды, суспензии и разведения.
Гдз по химии 9 клеток рабочая тетрадь. Рабочая тетрадь как эффективное средство подготовки
- Тетрадь рабочих заданий по обучению химии за 9 класс раскрывает основную цель контроля.Использование этого формата для проверки понимания предыдущей темы — Учителя используют этот формат при собеседовании с девятиклассниками.
- Студенты считают, что онлайн-версия поможет быстрее написать требуемый предмет. Оксиды, азот уже не такие страшные абзацы с непонятными формулами. Достаточно прочитать несколько прошлых уроков и посторонние решения, чтобы в этом разобраться. Предлагаемый подход к обучению увеличивает шансы учащихся догнать школьную программу.
- По химии в 9 классе Габрусев готовых ответов без обязательной загрузки всех страниц, вы можете найти данные материалы.
- Не спешите списывать растворы на химическую реакцию, не ознакомившись со всем порядком действий. Именно такой детальный подход к проблемам дает элементарную концепцию, исследуя однотипные вопросы. Мы советуем вам изучить свойства металлов и аналогичную информацию, это основные основы, которые позволят вам решать уравнения с любыми тестовыми неожиданными проверками.
- Химические положения, записанные как концепции каждой таблицы, представляют собой хорошо подчеркнутые комплексные знания.Обдумайте все суждения, полистайте учебник изучаемой темы, знание правил убережет вас от внезапных ситуаций у доски.
- Подготовка к CDF и итоговым тестам по химии для тех, кто выбрал этот предмет для сдачи ОГЭ, как правило, сопровождается серьезной подготовкой. Для получения высокого результата необязательно обращаться за помощью к репетиторам, посещать довольно дорогие кружки и подготовительные курсы.Вы можете эффективно и продуктивно подготовиться, используя доступные высококачественные учебные пособия и ответы на них. Для реализации этих задач, помимо литературы и ГДЗ , вам потребуются:
— целеустремленность и желание работать самостоятельно, умение ставить цели и добиваться желаемого;
— продуманный план работы. Он должен учитывать базовый уровень подготовки девятиклассника, его способности, интерес к дисциплине, уровень преподавания химии в школе, количество времени, которое можно регулярно проводить на работе;
— график подготовки, в котором необходимо определить этапы, даты, когда будет осуществляться промежуточный контроль достигнутых результатов.Если они окажутся неудовлетворительными, необходимо будет пересмотреть план и схему обучения. То же самое нужно сделать, если цели изменились (например, девятиклассник решил участвовать в олимпиадах, других олимпиадах по химии) или если выполнить поставленные задания очень легко. - Выбор литературы — один из самых ответственных этапов. Если вас устраивает качество школьного обучения, вы можете обратиться к учителю-предметнику за помощью в выборе литературы. Или самостоятельно дополнить школьный базовый учебник мастер-классами из тех же учебных материалов.Например, для комплекса Рудзитиса и Фельдмана специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Н.И. Габрусева. Книга содержит хорошо организованный практический материал по темам, изучаемым в курсе химии для девятого класса:
— электролитическая диссоциация;
— металлургия;
— общие свойства металлов;
— важнейшие органические вещества и другие.
Тетрадью могут пользоваться и одиннадцатиклассники при подготовке к итоговому экзамену по химии — ЕГЭ.Практикум считается универсальным — его можно комплектовать как рекомендованными учебными материалами, так и использовать для практических занятий по химии, укомплектовывать базовым учебником и задачами, практическими сборниками других авторов.
Рабочая тетрадь по химии для девятиклассников — универсальная версия
2-е изд., Стерт. — М .: 201 4. — 2 24 с.
Предлагаемая тетрадь является частью учебного комплекса к учебнику О.С. Габриеляна «Химия. 9 класс ». Учебник соответствует Федеральному государственному образовательному стандарту основного общего образования.Также блокнот можно использовать с учебником, соответствующим Федеральному компоненту государственного образовательного стандарта. Учебные материалы помимо тетради включают электронное приложение к учебнику, методическое пособие и рабочую программу. Специальными знаками отмечаются задания, направленные на формирование метапредметных умений (планирование деятельности, выделение различных знаков, сравнение, классификация, установление причинно-следственных связей, преобразование информации и др.) И личностных качеств учащихся.
Формат: pdf
Размер: 2 Мб
Watch, скачать: drive.google
Содержание
ОБОБЩЕНИЕ ИНФОРМАЦИИ О СТРУКТУРЕ ВЕЩЕСТВА И ХИМИЧЕСКОЙ РЕАКЦИИ
Характеристики химического элемента-металла на основе его положения в Периодической таблице Д.И. Менделеева 5
Характеристики неметаллического элемента на основе его положения в Периодической таблице Д.И. Менделеев 12
Амфотерные оксиды и гидроксиды 17
Периодический закон и Периодическая таблица химических элементов Д.И. Менделеева в свете теории строения атома 24
Обобщение сведений о химической реакции 30
Скорость химической реакции 33
Катализ и катализаторы 37
МЕТАЛЛЫ
Положение металлов в периодической таблице Д. И. Менделеева. Строение атомов и кристаллов. Физические свойства 41
Общие химические свойства металлов 47
Получение металлов 52
Коррозия металлов 56
Щелочные металлы 60
Соединения щелочных металлов 64
Бериллий, магний и щелочноземельные металлы 70
Соединения щелочноземельных металлов 76
Алюминий 81
Алюминиевые соединения 86
Железо 91
Соединения железа 96
НЕМЕТАЛЛЫ
Общие характеристики неметаллов 101
Водород 106
Галогены 112
Галогенные соединения 117
Кислород 122
Сера 127
Бинарные соединения серы 131
Серная кислота 136
Соли серной кислоты 141
Азот 144
Аммиак 149
Соли аммония 154
Оксиды азота 158
Соли азотной кислоты 163
Фосфор 167
Соединения фосфора 170
Углерод 175
Оксиды углерода 179
Угольная кислота и ее соли 184
Кремний 184
Силикатная промышленность 184
Силикат 187 904 ОКОНЧАТЕЛЬНЫЙ КОНТРОЛЬ ЗНАНИЙ
Заключительный тест 197
Подготовка к GIA 202
ПРИЛОЖЕНИЯ
1.Классификация неорганических веществ 209
2. Химические свойства основных классов неорганических веществ 210
3. Растворимость гидроксидов и солей в воде (при комнатной температуре) 212
4. Диапазон электрохимических напряжений 213
5. Ряд электроотрицательностей 213
6 Классификация химических реакций 214
7. Классификация оснований 215
8. Классификация кислот 215
9. Правила определения степеней окисления 216
10. Расстановка коэффициентов в уравнениях ОВР методом электронного баланса 217
11.Плотность, твердость, теплопроводность, температуры плавления и кипения некоторых веществ 217
Учебное пособие «Рабочая тетрадь. «9 класс» предназначен для работы как в классе, так и дома. Пособие включает раздел для повторения основных тем химии, которые вы изучали в 8 классе. Каждый абзац учебника для 9 класса соответствует разделу рабочей тетради, состоящему из двух части
Первая часть представляет собой четкое, краткое и очень содержательное изложение учебного материала, с которым вы познакомитесь на уроке.Авторы надеются, что вы создадите этот синопсис в сотрудничестве с нами и вашим учителем. Правильно составленный и усвоенный план поможет в достижении желаемого результата.
Вторая часть записного материала к абзацу также «работает» на результат. Выполнение заданий позволит вам не только усвоить учебный материал, но и применить его в самостоятельной и контрольной работе, а также на экзаменах в форме Государственного экзамена и ЕГЭ.Поэтому многие задания предлагаются в формате этих государственных тестов.
- В 9 классе уже понимают, кем ученикам суждено стать в будущем. Отличные оценки по химии — не только законченные работы в тетради, списание которых не приносит знаний; но личная концепция химической реакции, изучение скорости процесса и получаемых продуктов.
- Анализируя упражнения, изложенные в тетради для 9 класса, на наличие ГДЗ О.С.Габриелян, С.А.Сладков Книги по химии — не всегда простой способ обмануть ответы.
Это отличный самоконтроль заданий, разбор вариантов проверки плана тестирования, расположенный после изученной темы. - Особое внимание, студент должен уделить достаточно времени отведенным вопросам, подготовленным к итоговой аттестации. Имея представление о заполнении таблиц, относящихся к школьным материалам, ГДЗ к рабочей тетради Габриелян, Сладкова, позволяют делать самоконтроль по темам фосфора, аммиака и др., Из 40 нарисованных для школьников.
- Есть ли шанс получить знания, когда наличие готовых ответов дает возможность быстро накрутить?
Такой вариант возможен, если:
Вы счастливый обладатель фотографической памяти,
Вы понимаете весь изучаемый курс, хотя нет времени на выполнение заданий. - Если ученик осознает свои пробелы в знаниях, он сам, используя эти решения, сможет разобрать учебный материал.
- Для того, чтобы качественно подготовиться к выпускному тесту по химии в девятом классе, одного базового учебника и школьных уроков по нему будет недостаточно.Материал по этой науке, преподаваемый в 9 классе, достаточно обширен и сложен. И чтобы его освоить, нужно внимательно и глубоко разбираться во всех особенностях курса. Оптимальным решением для повышения эффективности вашей работы является подбор и использование практических руководств и решений по ним. Выбор можно доверить специалисту — учителю-предметнику, репетитору, заведующему кружком, курсами, либо вы можете сделать это сами.
- Занятия по GDZ с мастерской помогут:
— понять логику поиска верного решения даже для самых сложных задач;
— оцените и запомните порядок правильной записи результата.Часто неправильно написанный ответ становится причиной досадной потери баллов по CDF, диагностическим, итоговым тестам;
— самостоятельно работать с информацией — находите нужную информацию, анализируйте, составляйте и записывайте выводы. - Найти компетентные и качественные мастерские непросто. Среди таких источников специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную О.С. Габриелян. Сборник является неотъемлемой частью EMC, в которую помимо него входят учебник, электронные приложения, методическое пособие и рабочая программа.



 ) и Cu
) и Cu – 2002 — №2. — С. 16-20.
– 2002 — №2. — С. 16-20.
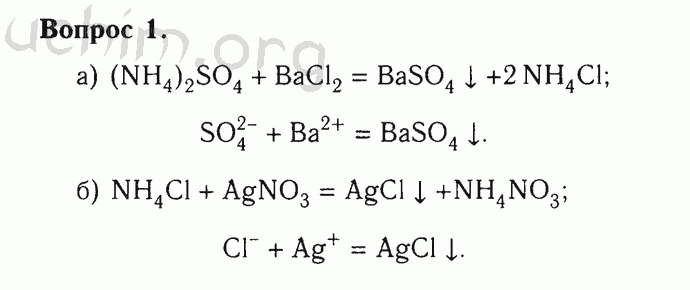
 тонн газообразного кислорода с избытком восполняя расход этого газа в промышленности, энергетике и на транспорте. Рассчитайте, сколько молекул кислорода ежегодно выделяет зеленая растительность?
тонн газообразного кислорода с избытком восполняя расход этого газа в промышленности, энергетике и на транспорте. Рассчитайте, сколько молекул кислорода ежегодно выделяет зеленая растительность?