Решебник ⏩ ГДЗ Химия 9 класс ⚡ Н. Н. Буринская, Л. П. Величко 2009
Авторы: Н. Н. Буринская, Л. П. Величко
Год: 2009
Рейтинг: 5.0
Оцените книгуСвязанный учебник
Аналоги другого года издания
Самые популярные книги
Сделать самостоятельно домашнее задание по химии в 9 классе под силу не каждому школьнику. А если еще родители не могут помочь, так как уже давно забыли школьную программу, то ситуация вообще трудная. В таком случае самый простой выход — ГДЗ по химии, 9 класс, Буринская и Величко. Этот сборник поможет не только решить домашнее задание, но и повысить уровень своих знаний по предмету.
Решебник по химии, 9 класс, Буринская Н. Н. и Величко Л. П.
Авторы этого пособия по химии — Нина Николаевна Буринская и Людмила Петровна Величко. Обе они – профессора, доктора педагогических наук. Помимо всестороннего развития их отличает недюжинная одаренность. Ведь их высказывания и идеи заслуживают огромного уважения.
Н.Н. Буринская главной целью современной школы видит ее переориентацию на развитие одаренности и способностей детей. Также огромный потенциал она находит в существенном повышении престижа культуры и интеллекта учащихся, формировании высоконравственной позиции личности-гражданина с высоким национальным сознанием. В то же время с коллегой, Л.П. Величко, она пытается переосмыслить новое философское отношение к химическому образованию, сущность которого заключается в вооружении учеников современными знаниями по химии, ориентировании их на аспект украиноведения, общечеловеческую мораль и ценности.
Благодаря педагогическому, научному и методическому уровню, опыту, достижениям Буринской Нины Николаевны и Величко Людмилы Петровны, их оптимизму, человечности, работоспособности и энтузиазму в преодолении бесконечных препятствий, была создана плодотворная почва для роста бесчисленной армии педагогов, учителей химии, методистов и научных сотрудников, которые следуют по их стопам.
Решебник по химии, 9 класс, Буринская, Величко – лучшее пособие для самообразования и научных изысканий
Вокруг Буринской Н. Н. всегда образуется творческая атмосфера истиной человечности. Внимательность к собеседнику, стремление к восприятию новых научных взглядов и их поддержке, умение объединять усилия всех единомышленников с целью решения конкретной научной идеи или проблемы – вот отличительные черты этого педагога.
Н. всегда образуется творческая атмосфера истиной человечности. Внимательность к собеседнику, стремление к восприятию новых научных взглядов и их поддержке, умение объединять усилия всех единомышленников с целью решения конкретной научной идеи или проблемы – вот отличительные черты этого педагога.
А Величко Л.П. свойственно крайне остро чувствовать краеугольные камни настоящего, злободневные проблемы, а также пути их решения. Ей удается вовлечь в это общее дело всех, кто готов наравне с ней воплощать возникшие задумки в практику.
Буринской Нине Николаевне и Величко Людмиле Петровне дано умение радоваться чужим успехам, гордиться удачами сотрудников, дарить им бесконечный позитив и щедрость своей души. Они умело вдохновляют людей на работу и творческий поиск. Именно за счет этого в научную школу этих двух женщин-ученых стремится попасть многочисленная армия современных молодых химиков. Они хорошо известны в Украине и за границей.
ГДЗ химия, 9 класс, Буринская, Величко – вдохновение для школьников
Благодаря душевной теплоте и доброте Буринской Нины Николаевны, оптимизму и целенаправленности Величко Людмилы Петровны школьники обретают:
веру в себя
энтузиазм
смелость.

Они вдохновляют школьников на познание этой науки, на то, чтобы они побороли в себе навязчивый соблазн просто скачать решебник из интернета и списывать домашние задания. Ведь добавив в характер толику стойкости, терпения, твердости решений, ученики откроют неожиданно для себя огромный неизведанный интереснейший мир, полный приятных мгновений в процессе освоения химии в 9 классе. И тогда не нужны будут подсказки интернета, уроки репетиторов, контроль со стороны родителей. Четкая цель, живой интерес, вера в себя – и даже химия покорится перед такой жаждой познания.
ГДЗ (відповіді) Хімія 9 клас Буринська Н.М., 2017 §9 Розчинність речовин » Допомога учням
Інші завдання дивись тут…
Сторінка 31
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Чому в гарячому чаї грудочка цукру розчиняється швидше, ніж у холодному? Розчинність твердих речовин залежить від температури: з підвищенням температури вона зазвичай зростає.
2. Чому акваріум не можна заповнювати свіжою кип’яченою водою, а треба щоб вода відстоялася впродовж кількох днів? Під час кип’ятіння води виділяються бульбашки повітря, що були розчинені у ній, тому частина молекул кисню виходить за межі посудини і в розчині їх залишається менше. Відстояна вода впродовж кількох днів поповниться розчиненим киснем.
3. Укажіть, що не впливає на розчинність карбон (ІV) оксиду у воді:
|
А швидкість пропускання газу Б температура |
В тиск Г хімічна взаємодія газу з водою |
4. Поясніть, як можна перетворити:
а) ненасичений розчин у насичений; Можна або додати розчинену речовину, або випарити розчинник, або охолодити розчин.
б) насичений розчин у ненасичений. Можна додати розчинник або підігріти розчин.
Сторінка 32
Додаткові завдання
Вправа 5.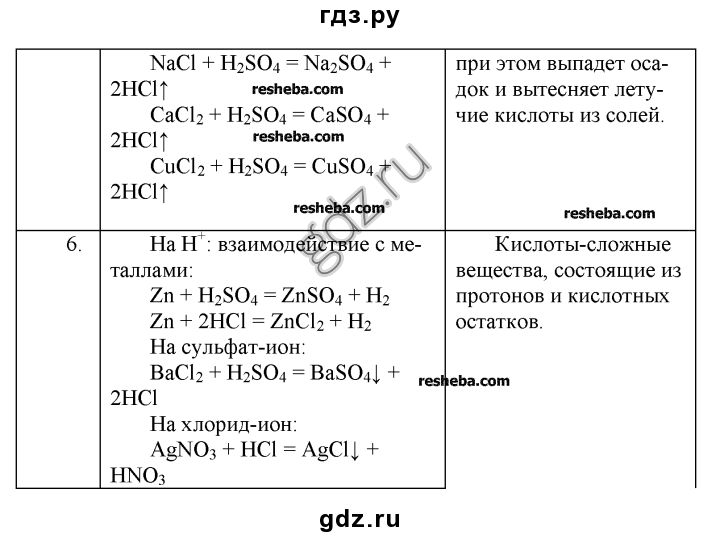 У 100 г води розчинили 90 г мідного купоросу. Яка масова частка безводної солі в добутому розчині?
У 100 г води розчинили 90 г мідного купоросу. Яка масова частка безводної солі в добутому розчині?
Відомо: m(CuSO4•5H2O)=90 г, m(H2O)=100 г. Знайти: w(CuSO4)-?
Розв’язування.
І спосіб
1. Обчислюємо молярну масу кристалогідрату.
M(CuSO4•5H2O)=Mr(CuSO4)+5•Mr(H2O)=160+5•18=250 г/моль, де
Mr(CuSO4)=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
2. Обчислюємо масу безводної солі у кристалогідраті. Для цього складаємо пропорцію і розв’язуємо її.
У 250 г CuSO4•5H2O міститься 160 г CuSO4, тоді
у 90 г CuSO4•5H2O буде міститися х г CuSO
250 г / 90 г = 160 г / х г, звідси
х г • 250 г = 90 г • 160 г
х = 90 г • 160 г / 250 г
х = 57,6 г
3. Обчислюємо масу розчину.
Обчислюємо масу розчину.
m(розчину)=m(Н2О)+m(CuSO4•5H2O)=100 г + 90 г=190 г
4. Знаходимо масову частку речовини (солі) за формулою
w(речовини)=m(речовини)/m(розчину)
w(CuSO4)=m(CuSO4)/m(розчину)=57,6 г : 190 г=0,303, або,
помноживши це значення на 100%, одержимо 30,3%
ІI спосіб
Обчислюємо кількість речoвини кристалогідрату за формулою n=m/M, де M=Mrг/моль
M(CuSO4•5H2O)=Mr(CuSO4)+5•Mr(H2O)=160+5•18=250 г/моль, де
Mr(CuSO4)=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160,
Mr(H2O)=2•A r(H)+Ar(O)=2•1+16=18.
n(CuSO4•5H2O)=m(CuSO4•5H2O)/M(CuSO4•5H2O)=90 г:219 г/моль=0,36 моль.
2. У кристалогідраті CuSO4•5H2O кількістю речовини 1 моль міститься 1 моль солі CuSO4 та 5 моль кристалізаційної води Н2О:
n(CuSO4)=n(CuSO4•5H2O) і n(Н2О)=5•n(CuSO4•5H2O)
Отже, n(CuSO4)=n(CuSO4•5H2O)=0,36 моль
3. З формули n=m/M знаходимо масу безводної солі m=n•M;
З формули n=m/M знаходимо масу безводної солі m=n•M;
m(CuSO4)=n(CuSO4)•M(CuSO4)=0,36 моль•160 г/моль=57,6 г.
4. Знаходимо масу розчину.
m(розчину)=m(Н2О)+m(CuSO4•5H2O)=100 г+90 г=190 г
5. Знаходимо масову частку речовини (солі) за формулою
w(речовини)=m(речовини)/m(розчину)
w(CuSO4)=m(CuSO4)/m(розчину)=57,6 г : 190 г = 0,303, або,
помноживши це значення на 100%, одержимо 30,3%
ІІI спосіб
1. Обчислюємо молярну масу кристалогідрату.
M(CuSO4•5H2O)=Mr(CuSO4)+5•Mr(H2O)=160+5•18=250 г/моль, де
Mr(CuSO4)=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
2. Знаходимо масову частку CuSO4 в кристалогідраті за формулою:
w(CuSO4)=М(CuSO4)/М(CuSO4•6H2O)=160/250=0,64
3. З формули w(CuSO4)=m(CuSO4)/m(CuSO4•5H2O) отримуємо формулу для обчислення маси CuSO4:
З формули w(CuSO4)=m(CuSO4)/m(CuSO4•5H2O) отримуємо формулу для обчислення маси CuSO4:
m(CuSO4)=m(CuSO4•5H 2O)•w(CuSO4)=90 г•0,64=57,6 г
4. Знаходимо масу розчину.
m(розчину)=m(Н2О)+m(CuSO4•5H2O)=100 г + 90 г =190 г
5. Знаходимо масову частку речовини (солі) за формулою
w(речовини)=m(речовини)/m(розчину)
w(CuSO4)=m(CuSO4)/m(розчину)=57,6 г / 190 г = 0,303, або,
помноживши це значення на 100%, одержимо 30,3%
Відповідь: масова частка солі в розчині 30,3% або 0,303.
Вправа 6. До 250 г 5 %-го водного розчину натрій гідроксиду добавили 31 г натрій оксиду. Яка масова частка натрій гідроксиду в добутому розчині?
Відомо: m0(розчину)=250 г, w0(NaOH)=5% або 0,05, m(Na2O)=31 г.
Знайти: w(NaOH)-?
Розв’язування:
1.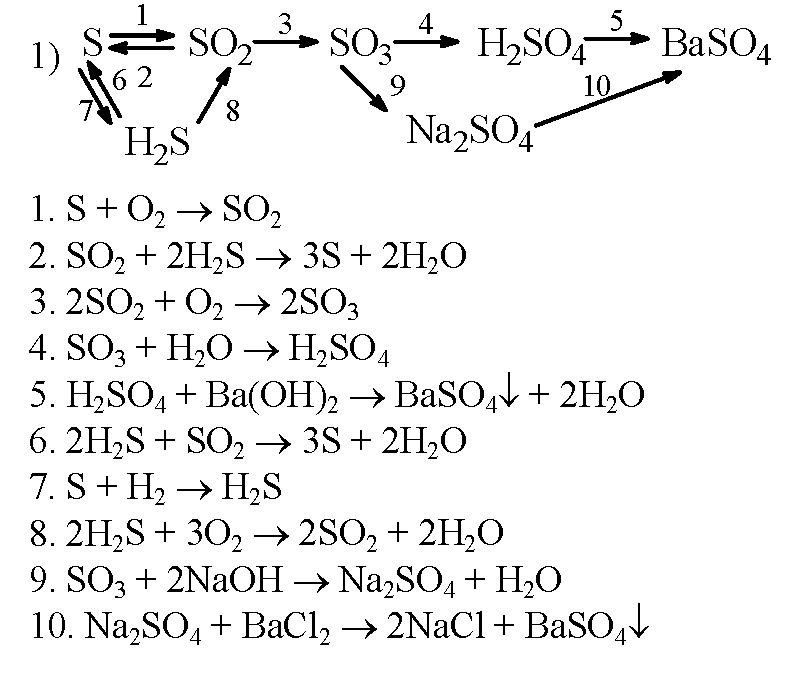 Знаходимо масу розчиненої речовини (NaOH) в початковому розчині за формулою: m(речовини)=w(речовини)•m(розчину)
Знаходимо масу розчиненої речовини (NaOH) в початковому розчині за формулою: m(речовини)=w(речовини)•m(розчину)
m0(NaOH)=w0(NaOH)•m0(розчину)=0,05•250=12,5 г.
2. Знайдемо масу натрій гідроксиду, що утвориться у розчині, після добавляння у розчин натрій оксиду.
Запишемо рівняння реакції:
31 г х г
Na2O + H2O = 2NaOH
62 г 80 г
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 1 моль натрій оксиду Na2O з утворенням 2 моль NaOH. Обчислюємо молярні маси (M=Mr г/моль) речовин й, відповідно, масу 1 моль Na2O і 2 моль NaOH.
Mr(Na2O)=2•Ar(Na)+Ar(O)=2•23+16=62, M(Na2O)=62 г/моль.
Маса 1 моль=62 г
Mr(NaOH)=Ar(Na)+Ar(O)+Ar(H)=23+16+1=40, M(NaOH)=40 г/моль.
Маса 1 моль=40 г, а маса 2 моль=80 г.
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
Складаємо пропорцію і розв’язуємо її.
31 г / 62 г = х г / 80 г, звідси
х г • 62 г = 80 г • 31 г
х=80 г • 31 г / 62 г
х=m1(NaOH)=40 г
3. Обчислимо масу гідроксиду, що був у початковому розчимі і утворився.
m(NaOH)=m0(NaOH)+m1(NaOH)=12,5 г + 40 г = 52,5 г.
4. Обчислимо масу води, що прореагувала (за законом збереження маси речовин: маса речовин, що вступила у реакцію, дорівнює масі речовин, що утворились після реакції.
m1(Н2О)=m(NaOH)-m(Na2O)=40 г — 31 г = 9 г
5. Знаходимо масу розчину.
m(розчину)=m0(розчину)-m1(Н2О)=250 г — 9 г = 241 г.
6. Знаходимо масову частку речовини (NaOH) за формулою
w(речовини)=m(речовини)/m(розчину)
w(NaOH)=m(NaOH)/m(розчину)=52,5 г / 241 г = 0,218, або,
помноживши це значення на 100%, одержимо 21,8%
Вправа 7. У воді масою 190 г розчинили залізний купорос FeSО4•7H2O масою 10 г. Яка масова частка безводного ферум (ІІ) сульфату в добутому розчині?
Яка масова частка безводного ферум (ІІ) сульфату в добутому розчині?
Відомо: m(FeSO4•7H2O)=10 г, m(H2O)=190 г. Знайти: w(FeSO4)-?
Розв’язування.
І спосіб
1. Обчислюємо молярну масу кристалогідрату.
M(FeSO4•7H2O)=Mr(FeSO4)+7•Mr(H2O)=152+7•18=278 г/моль, де
Mr(FeSO4)=Ar(Fe)+Ar(S)+4•Ar(O)=56+32+4•16=152,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
2. Обчислюємо масу безводної солі у кристалогідраті. Для цього складаємо пропорцію і розв’язуємо її.
У 278 г FeSO4•7H2O міститься 152 г FeSO4, тоді
у 10 г FeSO4•7H2O буде міститися х г FeSO4.
278 г / 10 г = 152 г / х г, звідси
х г • 278 г = 10 г • 152 г
х = 10 г • 152 г / 278 г
х = m(FeSO4)=5,5 г
3. Обчислюємо масу розчину.
m(розчину)=m(Н2О)+m(FeSO4•7H2O)=190 г + 10 г=200 г
4. Знаходимо масову частку речовини (солі) за формулою
w(речовини)=m(речовини)/m(розчину)
w(FeSO4)=m(FeSO4)/m(розчину)=5,5 г : 200 г=0,0275, або,
помноживши це значення на 100%, одержимо 2,75%
ІI спосіб
Обчислюємо кількість речoвини кристалогідрату за формулою n=m/M, де M=Mrг/моль
M(FeSO4•7H2O)=Mr(FeSO4)+7•Mr(H2O)=152+7•18=278 г/моль, де
Mr(FeSO4)=Ar(Fe)+Ar(S)+4•Ar(O)=56+32+4•16=152,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
n(FeSO4•7H2O)=m(FeSO4•7H2O)/M(FeSO4•7H2O)=10 г:278 г/моль=0,036 моль.
2. У кристалогідраті FeSO4•7H2O кількістю речовини 1 моль міститься 1 моль солі FeSO4 та 7 моль кристалізаційної води Н2О:
n(FeSO4)=n(FeSO4•7H2O) і n(Н2О)=7•n(FeSO4•7H2O)
Отже, n(FeSO4)=n(FeSO4•7H2O)=0,036 моль
3. З формули n=m/M знаходимо масу безводної солі m=n•M;
З формули n=m/M знаходимо масу безводної солі m=n•M;
m(FeSO4)=n(feSO4)•M(FeSO4)=0,036 моль•152 г/моль=5,5 г.
4. Знаходимо масу розчину.
m(розчину)=m(Н2О)+m(FeSO4•7H2O)=190 г+10 г=200 г
5. Знаходимо масову частку речовини (солі) за формулою
w(речовини)=m(речовини)/m(розчину)
w(FeSO4)=m(FeSO4)/m(розчину)=5,5 г : 200 г = 0,0275, або,
помноживши це значення на 100%, одержимо 2,75%
ІІI спосіб
1. Обчислюємо молярну масу кристалогідрату.
M(FeSO4•7H2O)=Mr(FeSO4)+7•Mr(H2O)=152+7•18=278 г/моль, де
Mr(FeSO4)=Ar(Fe)+Ar(S)+4•Ar(O)=56+32+4•16=152,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
2. Знаходимо масову частку FeSO4 в кристалогідраті за формулою:
w(FeSO4)=М(FeSO4)/М(FeSO4•7H2O)=152/278=0,55
3.

