Электролитическая диссоциация кислот, оснований и солей в водных растворах
Химия. 9 класс. Григорович
Этот учебник можно скачать в PDF формате на сайте тут.
Электролитическая диссоциация кислот
При растворении в воде кислоты, соли и основания диссоциируют на положительно и отрицательно заряженные ионы (катионы и анионы). Определим характерные общие признаки диссоциации электролитов каждого класса соединений.
Кислоты, как вы помните, состоят из Гидрогена и кислотного остатка, соединенных ковалентной полярной связью. В предыдущем параграфе на примере растворения гидроген хлорида мы рассмотрели, как под действием молекул воды полярная связь превращается в ионную, и кислота распадается на катионы Гидрогена и хлорид-ионы.
Таким образом, с точки зрения теории электролитической диссоциации Аррениуса,
• Кислоты — это электролиты, при диссоциации которых образуются катионы Гидрогена и анионы кислотного остатка.
Подобно хлоридной кислоте протекает диссоциация и других кислот, например нитратной:
HNO
При диссоциации молекулы сульфатной кислоты число катионов Гидрогена вдвое превышает число анионов кислотного остатка — сульфат-ионов. Заряд аниона равен -2 (в формулах ионов записывают «2-»):
Заряд аниона равен -2 (в формулах ионов записывают «2-»):
H2SO4 → 2H+ + SO2-4
Названия анионов, образующихся при диссоциации кислот, совпадают с названиями кислотных остатков. Они приведены в таблице растворимости на форзаце.
Легко заметить, что при диссоциации различных кислот образуются различные анионы, но катионы только одного типа — катионы Гидрогена H+. Значит, именно катионы Гидрогена определяют характерные свойства кислот — кислый вкус, изменение окраски индикаторов, реакции с активными металлами, основными оксидами, основаниями и солями.
Многоосновные кислоты диссоциируют ступенчато, отщепляя ионы Гидрогена последовательно, друг за другом. Например, в растворе сульфатной кислоты протекают следующие процессы:
H2SO4 → H+ + HSO—4 — первая стадия
HSO—4⇄H+ + SO2-4 — вторая стадия
Как видно из приведенных уравнений диссоциации многоосновной кислоты, анионы, образующиеся при ступенчатой диссоциации на первой стадии, содержат ионы Гидрогена. Это отражено в названии анионов: HSO—4 — гидрогенсульфат-ион.
Это отражено в названии анионов: HSO—4 — гидрогенсульфат-ион.
Электролитическая диссоциация ортофосфатной кислоты проходит в три стадии:
первая стадия: H3PO4 ⇄ H+ + H2PO—4 (дигидрогенортофосфат-ион)
вторая стадия: H2PO—4 ⇄ H+ + HPO2-4 (гидрогенортофосфат-ион)
Суммарное уравнение диссоциации ортофосфатной кислоты имеет вид:
H3PO4 ⇄3H+ + PO3-4
Таким образом, каждой многоосновной кислоте соответствует несколько анионов, и все они одновременно присутствуют в растворе.
Обратите внимание, что в некоторых уравнениях диссоциации стоят двунаправленные стрелки. Что они означают, вы узнаете в следующем параграфе.
Электролитическая диссоциация оснований
Основания состоят из катионов металлического элемента и гидроксид-анионов. При диссоциации оснований эти ионы переходят в раствор. Число гидроксид-ионов, образующихся при диссоциации, равно заряду иона металлического элемента. Таким образом, с точки зрения теории электролитической диссоциации
• Основания — это электролиты, которые диссоциируют на катионы металлического элемента и гидроксид-анионы.
Рассмотрим уравнения диссоциации оснований на примере диссоциации натрий и барий гидроксидов:
NaOH → Na+ + OH—
Ba(OH)2 →Ba2+ + 2OH—
При диссоциации оснований образуются анионы одного типа — гидроксид-ионы, определяющие все характерные свойства растворов щелочей: способность менять окраску индикаторов, реагировать с кислотами, кислотными оксидами и солями.
Электролитическая диссоциация солей
Соли образованы катионами металлического элемента и анионами кислотного остатка.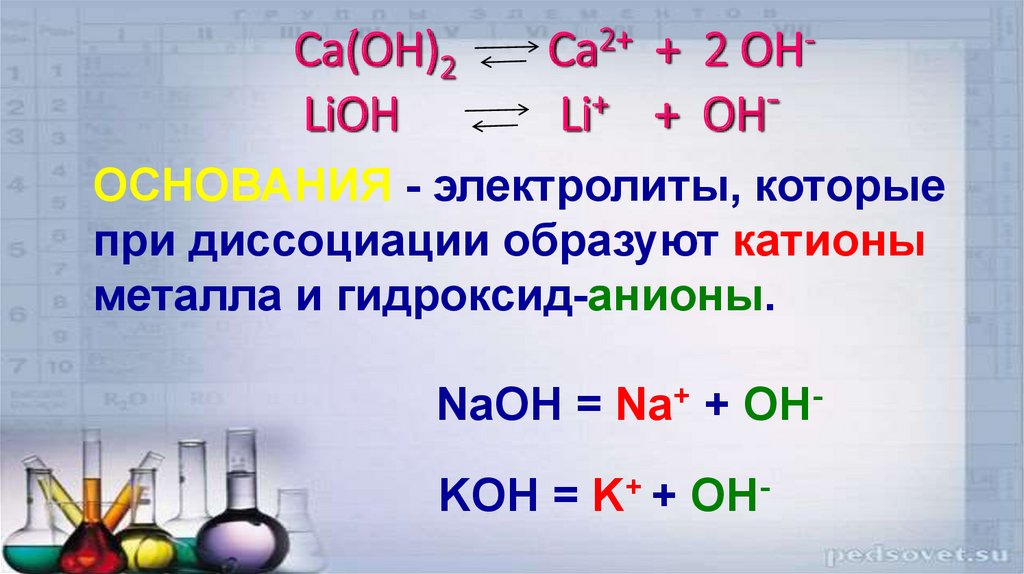 При растворении солей в воде эти ионы переходят в раствор. Таким образом,
При растворении солей в воде эти ионы переходят в раствор. Таким образом,
• Соли — это электролиты, которые диссоциируют на катионы металлического элемента и анионы кислотного остатка.
Рассмотрим диссоциацию солей на примере диссоциации калий нитрата:
KNO3 → K+ + NO—3
Аналогично диссоциируют и другие соли, например нитрат кальция и калий ортофосфат:
Ca(NO3)2 → Ca2+ + 2NO—3
K3PO4 → 3K+ + PO3-4
В уравнениях диссоциации солей заряд катиона по абсолютной величине равен степени окисления металлического элемента, а заряд аниона — сумме степеней окисления элементов в кислотном остатке. Например, купрум(II) сульфат распадается на ионы Cu2+ и SO2-4:
CuSO4 → Cu2+ + SO2-4
а феррум(III) нитрат — на ионы Fe3+ и NO—3:
Fe(NO3)3 →Fe 3+ + 3NO—3
Заряд катионов металлических элементов в большинстве случаев можно определить по Периодической системе. Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Группа IA | Группа IIA | Группа IIIA |
Li+, Na+, K+ | Mg2+, Ca2+, Ba2+ | Al3+, Sc3+, Ga3+ |
Металлические элементы побочных подгрупп обычно образуют несколько ионов, например Fe2+
Заряды кислотных остатков проще определять по числу ионов Гидрогена в составе молекулы кислоты, как вы это делали в 8 классе. Заряды некоторых кислотных остатков приведены в таблице растворимости на форзаце.
Обратите внимание, что в уравнениях диссоциации кислот, оснований и солей суммарный заряд катионов и анионов должен быть равен нулю, поскольку любое вещество является электронейтральным.
Ступенчатая диссоциация обусловливает возможность существования кислых и основных солей. Кислые соли содержат ионы Гидрогена, как кислоты. Именно поэтому такие соли называют кислыми. А в основных солях содержатся гидроксид-ионы, как в основаниях.
На первой стадии диссоциации сульфатной кислоты образуется гидрогенсульфат-ион HSO—4, благодаря чему существуют кислые соли: NaHSO 4 (натрий гидрогенсульфат), Al(HSO4)3(алюминий гидрогенсульфат) и др. Для ортофосфатной кислоты также характерны кислые соли K2HPO4 (калий гидрогенортофосфат) или KH2PO4 (калий дигидрогенортофосфат).
В растворах кислые соли диссоциируют в две стадии:
KH2PO4 → К+ + H2PO—4, H2PO—4⇄H+ + HPO2-4
Кислые соли характерны только для многоосновных кислот, поскольку они диссоциируют ступенчато. Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF
Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF
Некоторые нерастворимые гидроксиды образуют катионы, в которых имеется гидроксид-ион. Например, алюминий содержится в составе катиона AlOH2+, благодаря чему существует соль состава AlOHCl2 (алюминий гидроксохлорид). Такую соль называют основной.
Ключевая идея
Контрольные вопросы
- 100. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
- 101. В чем особенность диссоциации многоосновных кислот по сравнению с одноосновными? Объясните на примере сульфатной кислоты.
Задания для усвоения материала
102. В результате диссоциации молекулы кислоты образовался ион с зарядом 3-. Сколько ионов Гидрогена при этом образовалось?
Сколько ионов Гидрогена при этом образовалось?
103. Составьте уравнения электролитической диссоциации кислот: карбонатной, бромидной, нитритной. Назовите образующиеся анионы.
104. Какие из приведенных кислот будут диссоциировать ступенчато: HCl, H2CO3, HNO3, H2S, H2SO3? Ответ подтвердите уравнениями реакций.
105. Составьте уравнения диссоциации солей: магний нитрата, алюминий хлорида, барий бромида, натрий карбоната, натрий ортофосфата.
106. Приведите по одному примеру солей, при диссоциации которых количеством вещества 1 моль образуется: а) 2 моль ионов; б) 3 моль ионов; в) 4 моль ионов; г) 5 моль ионов. Запишите уравнения диссоциации.
107. Запишите заряды ионов в веществах: a) Na2S, Na2SO4, Na3PO4, AlPO4; б) NaHSO4, Mg(HSO4)2, CaHPO4, Ba(OH)2. Назовите эти вещества.
108.
109. Составьте формулу вещества, при диссоциации которого образуются ионы Кальция и гидроксид-ионы.
110. Из перечня веществ выпишите отдельно электролиты и неэлектролиты: HCl, Ca, Cr2(SO4)3, Fe2O3, Mg(OH)2, CO2, Sr(OH)2, Sr(NO3)2, P2O5, H2O. Составьте уравнения диссоциации электролитов.
111. При диссоциации некоего нитрата образовался 1 моль катионов с зарядом 2+. Какое количество вещества нитрат-ионов при этом образовалось?
112. Составьте формулы и запишите уравнения диссоциации феррум(ІІ) сульфата и феррум(III) сульфата. Чем отличаются эти соли?
113. Приведите по одному примеру уравнений диссоциации солей в соответствии со схемами (буквой М обозначен металлический элемент, а Х — кислотный остаток): а) МХ → М2+ + Х2-; б) МХ3→М3+ + 3Х—; в) М3Х → 3М+ + Х3-; г) М2Х3→2М3+ + 3Х2-.
114. В растворе присутствуют ионы K+, Mg2+, NO—3, SO2-4. Какие вещества растворили? Приведите два варианта ответа.
115*. Составьте уравнения диссоциации тех электролитов, которые образуют хлорид-ионы: CrCl3, KClO3, BaCl2, Ca(ClO)2, HClO4, MgOHCl.
ГДЗ к учебнику можно найти тут.
Попередня
СторінкаНаступна
СторінкаЗміст
Электролитическая диссоциация кислот, щелочей и солей в водных растворах.
Урок химии, 9 класс
Диссоциация кислот, оснований и солей
Учитель химии
Чернышова Анна Сергеевна.
Цель урока
- Объяснять понятия «кислоты», «основания», «соли» с точки зрения теории электролитической диссоциации;
- Уметь объяснять, чем обусловлены общие свойства растворов кислот и растворов солей;
- Уметь составлять уравнения электролитической диссоциации кислот, оснований и солей;
- Уметь решать задачи на вычисление количества ионов.

Растворимость кислот, оснований и солей
Диссоциируют только растворимые кислоты, основания и соли
Диссоциация кислот
- Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков ;
HCl = H + + Cl ˉ
- Процесс диссоциации изображают упрощенно:
HNO 3 = H + + NO 3 ˉ
- Многоосновные кислоты диссоциируют ступенчато:
H 2 SO 4 H + + HSO 4 ˉ
HSO 4 ˉ H + + SO 4 2ˉ
- Кислоты – это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются ионы водорода ;
- Именно ионы водорода H + придают кислотам характерные для них свойства.

Диссоциация оснований
- Все растворимые основания в водных растворах диссоциируют на отрицательно заряженные гидроксид-ионы и положительно заряженные ионы металлов.
NaOH = Na + + OHˉ
Ca(OH) 2 = Ca 2+ + 2OHˉ
- Основания — это сложные вещества , при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы.
- Присутствием в растворах гидроксид-иона OHˉ объясняются характерные общие свойства оснований.
Диссоциация солей
- Все растворимые соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков .
KNO 3 = K + + NO 3 ˉ
CaCl 2 = Ca 2+ + 2Clˉ
Al 2 (SO 4 ) 3 = 2Al 3+ + 3SO 4 2 ˉ
- C оли — это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионов кислотных остатков.

Свойства кислот, оснований и солей с точки зрения ТЭД
Электролиты
Характерные общие ионы
Кислоты
Характерные свойства
H +
Основания
ОНˉ
Действуют на индикаторы и реагируют с ионами ОНˉ
с образованием воды:
H + + ОНˉ = H 2 O
Соли
Действуют на индикаторы и реагируют с ионами H +
с образованием воды:
ОНˉ + H + = H 2 O
Общих ионов нет
Отсутствуют общие свойства, обусловленные наличием общих ионов
Первичное закрепление знаний
Напишите схемы ступенчатой диссоциации следующих веществ:
а) H 3 PO 4
б) MgOHCl
в) Ca(OH) 2
г) NaHCO 3
Первичное закрепление знаний
Напишите схемы ступенчатой диссоциации следующих веществ:
а) H 3 PO 4 H + +H 2 PO 4 ˉ
H 2 PO 4 ˉ H + + HPO 4 2 ˉ
HPO 4 2 ˉ H + + PO 4 3 ˉ
б) MgOHCl MgOH + + Clˉ
MgOH + Mg 2+ + OHˉ
в) Ca(OH) 2 С aOH + + OHˉ
С aOH + С a 2+ + OH ˉ
г) NaHCO 3 Na + + HCO 3 ˉ
HCO 3 ˉ H + + CO 3 2ˉ
Закрепление знаний — зад. №7 ОГЭ
№7 ОГЭ
Напишите уравнения диссоциации солей. Наибольшее число анионов образуется при полной диссоциации 1 моль:
1) нитрата кальция
2) сульфата алюминия
3) фосфата натрия
4) хлорида бария
Решение:
1) Ca(NO 3 ) 2 = Ca 2+ + 2NO 3 ˉ
2) Al 2 (SO 4 ) 3 = 2Al 3+ + 3SO 4 2ˉ
3) Na 3 PO 4 = 3Na + + PO 4 3 ˉ
4) BaCl 2 = Ba 2+ + 2Clˉ
Закрепление знаний — №7 ОГЭ
При полной электролитической диссоциации какого из указанных веществ число образующихся катионов и анионов получается поровну?
1) нитрата алюминия
2) фосфорная кислота
3) гидроксид бария
4) хлорид калия
Решение:
1) Al(NO 3 ) 3 = Al 3+ + 3NO 3 ˉ
2) H 3 PO 4 = 3H + + PO 4 3 ˉ
3) Ba(OH) 2 = Ba 2+ + 2OHˉ
4) KCl = K + + Clˉ
Рефлексия
- Какая была тема урока?
- Какую цель мы преследовали?
- Достигли ли мы поставленной цели?
- Что вы узнали сегодня нового?
- Что для вас было сложным и трудным для понимания?
- Какую оценку поставите вы себе за урок?
- Проработать § 7, упр.
 2
2
Ионизация кислот и оснований
Ионизацию соединения можно объяснить как процесс, при котором нейтральная молекула расщепляется на заряженные ионы при воздействии раствора.
Согласно теории Аррениуса, кислоты представляют собой соединения, которые диссоциируют в водной среде с образованием ионов водорода, H + (водн.). С другой стороны, основания представляют собой соединения, которые содержат гидроксильные ионы OH – (водн.) в водном растворе или среде.
Давайте посмотрим на разницу между ионизацией и диссоциацией.
Основное различие между диссоциацией и ионизацией состоит в том, что диссоциация — это процесс отделения заряженных частиц, уже существующих в соединении, с другой стороны, ионизация — это образование новых заряженных частиц, которых не было в предыдущем соединении .
Теория Аррениуса
Теория Аррениуса играет важную роль в объяснении ионизации кислот и оснований, поскольку ионизация в основном происходит в водной среде. Основываясь на степени ионизации кислот и оснований, мы можем определить силу как кислот, так и оснований. Также степень ионизации различна для разных соединений кислотных и основных. Некоторые кислоты, такие как соляная кислота (HCl), хлорная кислота (HClO 4 ), полностью диссоциируют на составляющие их ионы в водной среде.
Основываясь на степени ионизации кислот и оснований, мы можем определить силу как кислот, так и оснований. Также степень ионизации различна для разных соединений кислотных и основных. Некоторые кислоты, такие как соляная кислота (HCl), хлорная кислота (HClO 4 ), полностью диссоциируют на составляющие их ионы в водной среде.
Все эти кислоты относятся к сильным кислотам. При ионизации кислот образуются ионы водорода, поэтому эти соединения действуют как доноры протонов. Точно так же некоторые основания, такие как гидроксид натрия (NaOH), гидроксид лития (LiOH), также полностью диссоциируют на свои ионы в водном растворе или среде. Эти основания называются сильными основаниями. При ионизации этих оснований образуются ионы гидроксила (OH — ).
Следовательно, степень ионизации кислот и оснований зависит от степени диссоциации соединений на составляющие их ионы. Сильные кислоты и основания имеют более высокую степень ионизации по сравнению с ионизацией слабых кислот и оснований. Кроме того, сильная кислота подразумевает хороший донор протонов, тогда как сильное основание подразумевает хороший акцептор протонов — например, диссоциация слабой кислоты ГК.
Кроме того, сильная кислота подразумевает хороший донор протонов, тогда как сильное основание подразумевает хороший акцептор протонов — например, диссоциация слабой кислоты ГК.
HA(водн.) + H 2 O(л) ⇌ H 3 O + (водн.) + A — (aq)
Объяснение
Давайте кратко рассмотрим объяснение теории Аррениуса.
Эта реакция показывает, что равновесие диссоциации кислоты носит динамический характер, при котором перенос протонов может происходить как в прямом, так и в обратном направлении. Если HA имеет более высокую склонность отдавать протон по сравнению с H 3 O + , HA действует как сильная кислота по сравнению с ионом H 3 O + . Поскольку более сильная кислота отдает протон более сильному основанию, равновесие смещается в сторону образования более слабой кислоты и основания.
Как правило, сильные кислоты имеют более слабые сопряженные основания, тогда как сильные основания имеют более слабые сопряженные кислоты. Это связано с высокой степенью ионизации сильных кислот и оснований.
Это связано с высокой степенью ионизации сильных кислот и оснований.
Ионизация соединения
Основания представляют собой соединения, которые поставляют гидроксильные ионы и ОН — , присутствующие в водной среде. Степень ионизации как кислот, так и оснований помогает определить его силу. В зависимости от кислотных и основных соединений степень ионизации может различаться.
Ионизация кислот и оснований
Процесс распада нейтральной молекулы на заряженные ионы при контакте с раствором известен как ионизация соединений. Согласно теории Аррениуса, кислота представляет собой соединение, которое диссоциирует в водной среде с образованием иона водорода H + в водной среде.
Ионизация кислот
Степень ионизации относится к силе кислоты или основания. Говорят, что сильная кислота ионизируется в воде полностью, тогда как слабая кислота ионизируется только частично. Поскольку существуют различные степени ионизации кислоты, также существуют различные уровни слабости, для которых существует простой количественный способ выражения. 9{-}]}{HA}\]
Поскольку существуют различные степени ионизации кислоты, также существуют различные уровни слабости, для которых существует простой количественный способ выражения. 9{-}]}{HA}\]
Константа равновесия для ионизации кислоты описывает ее константу кислотной ионизации (Ka). Однако чем сильнее кислота, тем больше константа ионизации кислоты (Ka). Это означает, что сильная кислота является донором лучшего протона. Из-за концентрации продукта в числителе константы ионизации (Ka) чем сильнее кислота, тем выше кислотность Ka.
(Изображение будет загружено в ближайшее время)
Степень ионизации зависит от силы кислоты или основания. Считается, что сильные кислоты полностью ионизированы в воде, а слабые — лишь частично. Так как степень ионизации кислоты разная, то и степень слабости тоже разная, и имеется простая количественная формула. 9{-}]}{HA}\]
Константа равновесия для кислотной ионизации – это константа кислотной ионизации. Определите (Ка). Однако чем сильнее кислота, тем выше константа ионизации кислоты (Ka). Это означает, что сильные кислоты являются лучшими донорами протонов. В зависимости от концентрации продукта в молекуле Ка действует следующее: Чем сильнее кислота, тем больше константа ионизации кислоты (Ка).
Определите (Ка). Однако чем сильнее кислота, тем выше константа ионизации кислоты (Ka). Это означает, что сильные кислоты являются лучшими донорами протонов. В зависимости от концентрации продукта в молекуле Ка действует следующее: Чем сильнее кислота, тем больше константа ионизации кислоты (Ка).
Некоторые основания, такие как гидроксид натрия или гидроксид лития, полностью диссоциируют на свои ионы в водном растворе, что называется сильными основаниями. Таким образом, ионизация этих оснований дает ионы соляной кислоты, так как (OH 9{+}]}{A}\]
Константа ионизации основания, то есть Kb, называется константой равновесия для ионизации основания. Таким образом, мы можем сказать, что сильное основание подразумевает хороший акцептор протонов, тогда как сильная кислота подразумевает хороший донор протонов. Диссоциацию слабых кислот или слабых оснований в воде можно представить следующим образом.
CH 3 COOH + H 2 O CH 3 COO — + H 3 O +
8 NH 31{+}]}{A}\]
Константа ионизации оснований, т. е. Kb – это ионизация оснований. Следовательно, можно сказать, что сильное основание означает хороший акцептор протонов, а сильная кислота означает хороший донор протонов. Диссоциация слабых кислот или оснований в воде следующим образом:
е. Kb – это ионизация оснований. Следовательно, можно сказать, что сильное основание означает хороший акцептор протонов, а сильная кислота означает хороший донор протонов. Диссоциация слабых кислот или оснований в воде следующим образом:
CH 3 COOH + H 2 O⇌CH 3 COO ~ + H 3 O +
NH 3 O +
NH 3 O +
NH 3 o +
NH 3 o + H 2 O⇌NH 4 + (водн.) + OH ~ (водн.)
Основания представляют собой соединения, образующие гидроксильные ионы, в то время как ОН – содержится в водной среде. Степень ионизации кислоты и основания определяет их силу. Из-за разницы между кислотными и основными соединениями степень ионизации может различаться.
Степень ионизации
Степень ионизации также называется выходом ионизации, который относится к доле нейтральных частиц, например, в водных или газообразных растворах, которые ионизируются по отношению к заряженным частицам. Для электролитов это можно понимать как способность кислоты или основания ионизировать себя. Низкую степень ионизации иногда называют частично или слабо ионизированными, а высокую степень ионизации — полностью ионизированными. Но полностью ионизированная степень может также означать, что у иона не осталось электронов.
Для электролитов это можно понимать как способность кислоты или основания ионизировать себя. Низкую степень ионизации иногда называют частично или слабо ионизированными, а высокую степень ионизации — полностью ионизированными. Но полностью ионизированная степень может также означать, что у иона не осталось электронов.
Концепция ионизации кислот и оснований Аррениуса
Согласно теории Аррениуса, кислота представляет собой соединение, которое диссоциирует в водной среде с образованием ионов водорода. С другой стороны, основание представляет собой соединение, которое образует гидроксильные ионы в водной среде. Теория Аррениуса очень важна для объяснения ионизации кислот и оснований. Это связано с тем, что ионизация обычно происходит в водной среде. Силу кислоты и основания можно определить по степени ионизации кислоты и основания.
Степень ионизации зависит от кислотных и основных соединений. Некоторые кислоты, например хлорная и соляная, в водной среде полностью диссоциируют на ионы. Эти основания называются сильными основаниями. Ионизация этих оснований дает гидроксильные ионы. Поэтому степень кислотно-основной ионизации зависит от степени диссоциации соединения на ионы. Сильные кислоты и сильные основания имеют более высокую степень ионизации, чем слабые кислоты и слабые основания.
Эти основания называются сильными основаниями. Ионизация этих оснований дает гидроксильные ионы. Поэтому степень кислотно-основной ионизации зависит от степени диссоциации соединения на ионы. Сильные кислоты и сильные основания имеют более высокую степень ионизации, чем слабые кислоты и слабые основания.
кислоты и основания — Студенты | Британика Кидс
Введение
© Miloszbudzynski/Dreamstime.comКислоты и основания представляют собой две группы химических соединений с противоположными свойствами, которые часто встречаются в лаборатории и в повседневной жизни. Кислоты, основания и продукты их реакций необходимы для многих жизненных процессов и бесценны для промышленности и сельского хозяйства.
Кислоты обычно имеют кислый или терпкий вкус. Основы обычно имеют горький вкус и могут быть скользкими на ощупь. Однако сильные кислоты и сильные основания представляют собой опасные химические вещества, которые ядовиты и могут вызывать химические ожоги; к ним никогда нельзя пробовать или прикасаться.
В сочетании с другими веществами, такими как вода, кислоты и основания диссоциируют или распадаются с образованием ионов, частиц, несущих электрический заряд. Атом водорода состоит из одного протона (положительный заряд) и одного электрона (отрицательный заряд). Положительные и отрицательные заряды в атоме уравновешивают друг друга, так что атом водорода нейтрален — у него нет суммарного заряда. Если атом водорода теряет свой электрон, он становится ионом с положительным зарядом. Поскольку ион водорода теперь состоит только из одного протона, члены ион водорода и протон иногда используются взаимозаменяемо в кислотно-щелочной химии.
Кислоты и основания обладают многими свойствами, которые помогают их идентифицировать. Однако наиболее конкретно они определяются их соответствующей способностью терять или приобретать ион водорода.
Кислоты
Кислота – это вещество, которое может терять или «отдавать» ион водорода при соединении с другим веществом, например с водой. Когда соединение хлористого водорода (HCl) растворяется в воде, соединение диссоциирует или разделяется, высвобождая ионы водорода (H + ) и ионы хлорида (Cl − ):
Когда соединение хлористого водорода (HCl) растворяется в воде, соединение диссоциирует или разделяется, высвобождая ионы водорода (H + ) и ионы хлорида (Cl − ):
Раствор ионов водорода и ионов хлора в воде называется соляной кислотой. Это кислота, потому что она содержит свободные ионы водорода, которые могут реагировать или соединяться с отрицательно заряженными ионами.
Кислоты могут быть сильными или слабыми, в зависимости от того, сколько ионов водорода они выделяют в растворе. Чем больше выделяется ионов водорода, тем сильнее кислота. Сильная кислота, такая как хлористый водород, при растворении в воде полностью диссоциирует — раствор будет содержать только ионы водорода и ионы хлора; молекул хлороводорода не останется. Напротив, слабая кислота в растворе не диссоциирует полностью. Когда лимонная кислота растворяется в воде, только небольшой процент молекул кислоты диссоциирует с образованием ионов водорода и цитрат-ионов — большая часть молекул лимонной кислоты остается в растворе неизменной. Следовательно, лимонная кислота является слабой кислотой.
Следовательно, лимонная кислота является слабой кислотой.
Самыми сильными кислотами являются минеральные или неорганические кислоты. К ним относятся серная кислота, азотная кислота и соляная кислота. Сильные кислоты важны в промышленности и производстве, где они используются для производства таких продуктов, как удобрения, красители, лекарства и некоторые типы батарей. Слабые органические кислоты содержатся во многих продуктах, которые мы едим и пьем, таких как цитрусовые (лимонная кислота), молоко и йогурт (молочная кислота), яблоки (яблочная кислота), уксус (уксусная кислота), мясо и другие продукты, богатые белком. (аминокислоты) и даже газировку (карбоновая кислота). Большое значение для жизни имеют сотни слабых кислот, обнаруженных в живых существах, включая молочную кислоту, аминокислоты, жирные кислоты и нуклеиновые кислоты, такие как ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота). Соляная кислота — редкий пример сильной кислоты, присутствующей в организме: она вырабатывается в желудке, чтобы помочь переваривать пищу. Слизистая оболочка желудка покрыта слоем слизи, которая защищает его от ожога кислотой.
Слизистая оболочка желудка покрыта слоем слизи, которая защищает его от ожога кислотой.
Основания
Основание — это вещество, которое может приобретать или «принимать» ион водорода при соединении с другим веществом, например с водой. При растворении соединения гидроксида натрия (NaOH) в воде соединение диссоциирует с образованием ионов натрия (Na + ) и ионов гидроксида (OH – ):
Раствор ионов натрия и гидроксид-ионов в воде носит то же название, что и растворенное соединение — гидроксид натрия. Это основание, потому что оно содержит свободные ионы гидроксида, которые могут принимать ионы водорода в химических реакциях. Основной раствор также называют щелочным раствором.
Основания могут быть сильными или слабыми, в зависимости от того, сколько ионов гидроксида они выделяют в растворе. Чем больше высвобождается ионов гидроксида, тем прочнее основание. Сильные основания, такие как гидроксид натрия, полностью диссоциируют в растворе, тогда как при растворении в воде диссоциирует только часть молекул слабого основания. Когда аммиак добавляется в воду, только небольшой процент молекул аммиака диссоциирует с образованием ионов гидроксида и ионов аммония. Большая часть молекул аммиака остается в растворе нетронутой; поэтому аммиак считается слабым основанием.
Когда аммиак добавляется в воду, только небольшой процент молекул аммиака диссоциирует с образованием ионов гидроксида и ионов аммония. Большая часть молекул аммиака остается в растворе нетронутой; поэтому аммиак считается слабым основанием.
Наиболее сильными основаниями являются гидроксиды и оксиды некоторых металлов и земных металлов, в том числе гидроксид кальция, гидроксид калия, оксид стронция и гидроксид натрия. Последний является основным компонентом мыла и чистящих средств, в том числе сильно едких продуктов, таких как щелочь, сливные пробки и чистящие средства для духовок. Более слабые основания включают аммиак, магнезиальное молоко и карбонаты, такие как пищевая сода (бикарбонат натрия) и известняк (карбонат кальция). Морская вода, зубная паста, яичный белок и кровь также слабощелочные.
Химические реакции
Реакции кислот с металлами
Одной из характеристик кислот является их реакционная способность с металлами. Когда кислота соединяется с металлом, в результате реакции образуется соль и газообразный водород:
(Обратите внимание, что используемый здесь термин соль не означает конкретно поваренную соль, используемую в пищевых продуктах). а скорее описывает класс веществ, образующихся в результате химической реакции.)
а скорее описывает класс веществ, образующихся в результате химической реакции.)
Типичная реакция между кислотой и металлом происходит, когда металлический цинк (Zn) помещают в раствор серной кислоты (H 2 SO 4 ). Реакция образует соленую сульфат цинка (ZNSO 4 ) и газовый водород (H 2 ):
Поскольку кислоты отдают ионы водорода, а основания принимают ионы водорода, неудивительно, что соединение кислоты с основанием приводит к химической реакции. Свободные ионы водорода (H + ), выделяющиеся из кислоты, соединяются со свободными ионами гидроксида из основания (OH − ) с образованием воды (H 2 O) и соли:
Соль образуется из отрицательного иона кислоты и положительного иона основания, поэтому соль нейтральна. Поскольку вода также нейтральна, реакция называется нейтрализацией. Примером нейтрализации является сочетание соляной кислоты (HCl) и гидроксида натрия (NaOH) с образованием воды и хлорида натрия (NaCl):
Поскольку вода также нейтральна, реакция называется нейтрализацией. Примером нейтрализации является сочетание соляной кислоты (HCl) и гидроксида натрия (NaOH) с образованием воды и хлорида натрия (NaCl):
Реакции нейтрализации, в которых участвуют карбонатные основания, производят газообразный диоксид углерода (CO 2 ) в дополнение к соли и воде:
Реакции нейтрализации имеют множество практических применений, некоторые из которых может быть довольно знакомым. Фермеры и садоводы добавляют основные вещества, такие как известь (оксид кальция), чтобы нейтрализовать кислую почву, тогда как слишком щелочную (основную) почву можно нейтрализовать кислотными удобрениями, такими как сульфат аммония. Антацидные препараты, такие как магнезиальное молоко, являются слабыми основаниями, помогающими нейтрализовать избыточную выработку желудочной кислоты. Углекислый газ, образующийся при добавлении пищевой соды в тесто для выпечки, которое содержит кислоту, такую как винный камень (тартрат калия) или квасцы (сульфат натрия и алюминия), помогает тесту подняться.
Углекислый газ, образующийся при добавлении пищевой соды в тесто для выпечки, которое содержит кислоту, такую как винный камень (тартрат калия) или квасцы (сульфат натрия и алюминия), помогает тесту подняться.
Впечатляющее, но относительно безопасное образование пузырьков, возникающее в результате сочетания уксуса и пищевой соды, то есть разбавленной уксусной кислоты (CH 3 COOH) и бикарбоната натрия (NaHCO 3 ), часто используется в домашних условиях в качестве естественной альтернативы к едким очистителям канализации при попытке открыть забитую раковину или ванну:
Индикаторы
Кислоты и основания могут вызывать изменение цвета многих органических веществ. Например, если в чай добавить лимонный сок, чай станет светлее. Это происходит потому, что кислота в лимонном соке меняет цвет вещества в чае с темно-коричневого на светло-коричневый. Реакцию можно обратить вспять, добавив в чай основное вещество, такое как пищевая сода. Это дополнение восстанавливает первоначальный цвет. Вещество, которое меняет цвет при добавлении к нему кислоты или основания, называется индикатором.
Например, если в чай добавить лимонный сок, чай станет светлее. Это происходит потому, что кислота в лимонном соке меняет цвет вещества в чае с темно-коричневого на светло-коричневый. Реакцию можно обратить вспять, добавив в чай основное вещество, такое как пищевая сода. Это дополнение восстанавливает первоначальный цвет. Вещество, которое меняет цвет при добавлении к нему кислоты или основания, называется индикатором.
Лакмусовая бумажка – это обычный индикатор, используемый в лаборатории. В растворе кислоты он становится красным, а в щелочном — синим. Нейтральный раствор окрашивает лакмусовую бумагу в цвет, средний между красным и синим. Другим широко используемым индикатором является фенолфталеин, жидкость, бесцветная в кислотах, но окрашивающаяся в темно-красный цвет при добавлении к щелочному раствору.
pH
Шкала pH измеряет, насколько кислым или щелочным является вещество. Шкала варьируется от 0 до 14 и основана на концентрации ионов водорода в растворе.




 2
2