Цепочки превращений по химии 9 класс – Практическая работа № 1(2). Осуществление цепочки химических превращений
Цепочка по химии
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Практическая работа по химии №1 «Осуществление цепочки химических превращений» (9 класс)
Практическая работа №1. 9 класс
Осуществление цепочки химических превращений
Цель: Осуществить цепочку химических превращений; изучить способы получения и свойства гидроксидов металла (меди)
1. Повторите правила техники безопасности
Повторите правила техники безопасности
2. Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
Инструкция к выполнению первой цепочки переходов.
Опыт.1) Для осуществления цепочки превращений выданы пробирки №1, №2. В пробирку №1 прилейте 1-2 мл раствора CuSO4 . Для осуществления 1-ого опыта приливайте к этому раствору 1 мл необходимого реактива.
2) Второй и третий переход проводите в этой же пробирке (№1). Составьте молекулярные и ионные уравнения реакций.
Для отчёта оформите таблицу
Выводы, запись уравнений реакций
1.Повторите правила техники безопасности
2. Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
Опыт. Инструкция к выполнению цепочки переходов.
1) Для осуществления цепочки переходов выданы пробирки №1, №2;
А) в пробирку прилейте 1-2 мл раствора хлорида цинка. Получите гидроксид цинка, для этого добавьте несколько капель необходимого реактива. Полученный гидроксид разлейте в две пробирки.
Полученный гидроксид разлейте в две пробирки.
Б) в пр.№1 получите ZnCl2, в пр.№2 получите Na2Zn(OH)4. Что наблюдаете?
Составьте молекулярные и ионные уравнения реакций. Для отчёта оформите таблицу:
Выводы, запись уравнений реакций
Методическая разработка «Алгоритм решения превращений по химии»
Методические рекомендации решения «цепочек» превращения по химии.
В заданиях ля школьников по химии на любом этапе обучения и для любой параллели всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Для того, чтобы успешно решать цепочки химических превращений из одного вещества в другое, необходимо изучить свойства веществ, их взаимодействия и особенности каждого класса соединений. Среди качественных задач решение цепочек веществ встречаются чаще всего.
Алгоритм решения «цепочки»:
1.Внимательно прочитайте условие задачи. Если необходимо, можете сделать это не один раз.
Напишите уравнения, с помощью которых можно получить следующие превращения:
Al → → Al2O3 → Al(OH)3 → K[AL(OH)4] → AlCl3 → Al(NO3)3 → AlPO4.
Для каждого превращения составьте уравнения реакций. Если переход в одну стадия невозможен, составьте два и более уравнений реакций.
2.Выпишите цепочку отдельно, из условия задачи. Вы можете пронумеровать количество реакций и ли веществ для удобства. Помните, что каждое следующее вещество является исходным для последующего. Определите к какому классу веществ относиться каждый член цепочки. Под первым номером стоит металл алюминий. исходным продуктом реакции должна стать соль. По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
3.Проверьте себя еще раз. Пробегитесь взглядом по уравнениям реакций, проверьте везде ли стоят нужные коэффициенты. Не забудьте правильно оформить уравнения реакций.
Решение
1.Al + 6HNO3(конц.) => Al(NO3)3 + 3NO2 + 3h4O
2.4Al(NO3)3 => 2AL2O3 + 12NO2 + 3O2
3.Al2O3 + 3h4SO4 => Al2(SO4)3 + 3h4O
Al2(SO4)3 + 6NaOH => 2Al(OH)3 + 3Na2SO4
4.Al(OH)3 +KOH => K[Al(OH)4]
5.K[Al(OH)4] + 4HCl => KCl + AlCl3 + 4h4O
6.AlCl3 + 3AgNO3 => Al(NO3)3 + 3AgCl
7.Al(NO3)3 + K3PO4 => AlPO4 + 3KNO3
Решите «цепочки» самостоятельно:
Cu CuO Cu(OH)2 CuO
Практическая работа №1 «Осуществление цепочки химических превращений» 9 класс по УМК Габриеляна
Практическая работа №1 «Осуществление цепочки химических превращений» 1вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Составить уравнения реакций обмена в молекулярном и ионном виде.
Практическую работу оформить в виде таблицы
Уравнения химических реакций
Практическая работа №1 «Осуществление цепочки химических превращений» 2 вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Составить уравнения реакций обмена в молекулярном и ионном виде.
Практическую работу оформить в виде таблицы
Уравнения химических реакций
Практическая работа №1 «Осуществление цепочки химических превращений» 3 вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Составить уравнения реакций обмена в молекулярном и ионном виде.
Практическую работу оформить в виде таблицы
Уравнения химических реакций
Решение качественных задач-2.
 Цепочки превращений. Видеоурок. Химия 10 Класс
Цепочки превращений. Видеоурок. Химия 10 КлассДанный текст представляет собой неотредактированную версию стенограммы, которая в дальнейшем будет отредактирована.
Химия. 10 класс
Урок 70. Решение качественных задач-2. Цепочки превращений
Загорский Вячеслав Викторович, д. п.н., проф. Специализированного учебно-научного центра МГУ (школа им. А. Н. Колмогорова при МГУ),
Многократный лауреат грантов «Учитель Москвы»
24.03. 2011 г.
При участии: Менделеевой Екатерины Александровны, к. х.н., доц. СУНЦ МГУ
Морозовой Натальи Игоревны, к. х.н., ст. преп. СУНЦ МГУ
Решение качественных задач по химии — цепочка превращений
Здравствуйте! Тема сегодняшнего урока – «Решение качественных задач. Цепочки превращений». Некоторые задачи на цепочки превращений фактически являются качественными задачами, в которых нужно проанализировать органические соединения, зашифрованные буквами алфавита.
Вспомним такую задачу из прошлого урока: «Вещество А представляет собой легко кипящую жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди. Вещество С, которое используется для сохранения биологических препаратов. Приведите возможные формулы веществ А, В, С».
А теперь решим задачу, которая представляет собой подобную цепочку в чистом виде. Требуется установить структурные формулы и названия веществ от А до Е. В этой цепочке есть определенное начало, что облегчает наши действия. Начальная формула дана однозначно. Фактически такая задача сводится к написанию последовательных уравнений реакции. Сами уравнения нам пока не ясны, но зато указаны условия. Исходное вещество должно прореагировать с бромом на свету. Это типичная реакция радикального замещения. Замещение у вторичных атомов протекает быстрее, чем у первичных. Поэтому при среднем атоме углерода замещается атом водорода существенно быстрее, чем при крайних, и основным продуктом превращений будет вещество А — 2 бром пропан. Затем 2 бром пропан реагирует со спиртовым раствором щелочи. Если раствор щелочи не водный, а именно спиртовой, то происходит отщепление – элиминирование бромоводорода, при этом образуется вещество В, а именно – пропен.
Поэтому при среднем атоме углерода замещается атом водорода существенно быстрее, чем при крайних, и основным продуктом превращений будет вещество А — 2 бром пропан. Затем 2 бром пропан реагирует со спиртовым раствором щелочи. Если раствор щелочи не водный, а именно спиртовой, то происходит отщепление – элиминирование бромоводорода, при этом образуется вещество В, а именно – пропен.
Пропен присоединяет молекулу хлора, в общем-то, в любых условиях. И получается вещество С — 1, 2 дихлорпропан. Затем снова спиртовой раствор щелочи. Реакция идет так же, как и с 2 бром пропаном. Отщепляется молекула галоген водорода. Но здесь два атома галогена, поэтому отщепятся два галоген водорода, а именно два хлороводорода. В результате получится не двойная, а тройная связь. И тогда вещество Д – пропин.
И, наконец, пропин присоединяет воду в кислой среде в присутствии соли ртути. Подобное присоединение идет по правилам Морковникова, т. е. водород уходит на край молекулы, а гидроксильная группа идет в центр. В результате получается непредельный спирт или енол. Но такие спирты неустойчивы, и он тут же перегруппировывается в кетон. Простейший кетон, который называется ацетон. Таким образом, задача решена.
В результате получается непредельный спирт или енол. Но такие спирты неустойчивы, и он тут же перегруппировывается в кетон. Простейший кетон, который называется ацетон. Таким образом, задача решена.
Следующая разновидность цепочек содержит вещества с относительно простыми молекулярными формулами, и нужно подобрать условия, при которых одно вещество будет превращаться в другое.
Рассмотрим такую цепочку. Как превратить этиловый спирт в этилен?
Чтобы получить непредельный углеводород из спирта, нужно забрать у спирта воду. Такая реакция называется дегидратацией. Обычно ее проводят, нагревая этиловый спирт с концентрированной серной кислотой. Затем этилен или этен надо превратить в дихлорэтан. Для того чтобы присоединить хлор, достаточно просто взаимодействия даже в темноте. Затем из 1, 2 дихлорэтана, который получается в этих условиях, нужно получить ацетилен или этин. Нельзя просто отщепить молекулу хлора. Тогда получится этен или этилен. Поэтому нужно отщепить две молекулы хлороводорода. Чтобы произвести такое отщепление или элиминирование, нужно подействовать спиртовым раствором щелочи. И, наконец, последний шаг: из этина или ацетилена нужно получить бензол. Для того чтобы произошла такая реакция, она называется тримеризация, необходим катализатор, имеющий типичную для бензола гексагональную или шестиугольную структуру. В качестве катализатора чаще всего используют активированный уголь или оксид хрома. Данная задача решена.
Чтобы произвести такое отщепление или элиминирование, нужно подействовать спиртовым раствором щелочи. И, наконец, последний шаг: из этина или ацетилена нужно получить бензол. Для того чтобы произошла такая реакция, она называется тримеризация, необходим катализатор, имеющий типичную для бензола гексагональную или шестиугольную структуру. В качестве катализатора чаще всего используют активированный уголь или оксид хрома. Данная задача решена.
Мы подобрали все условия реакции.
Еще одна разновидность задач на цепочки – это задачи, в которых в цепочке находятся уже относительно сложные молекулярные формулы. В таком случае расшифровка цепочки является уже не очень простой задачей.
Рассмотрим это на конкретном примере. Данная цепочка превращений сложна еще и тем, что требует определенного внимания. Она двойная. Мы видим, что стрелки расходятся от центра цепочки к ее краям. Сразу видно, что число атомов водорода в формулах всех перечисленных веществ относительно мало, т. е. такое соотношение углерода и водорода характерно для аренов или производных бензола. В формулах большинства веществ в данной цепочке находятся 7 атомов углерода. Скорее всего, они как-то генетически связаны с формулой, имеющей одно бензольное кольцо и один метильный радикал.
В формулах большинства веществ в данной цепочке находятся 7 атомов углерода. Скорее всего, они как-то генетически связаны с формулой, имеющей одно бензольное кольцо и один метильный радикал.
Состав вещества, отвечающего такой формуле С7Н8. Исходное вещество находится в середине цепочки. По сравнению с предложенной нами, так называемой базовой формулой, соответствующей талуолу, в нем не хватает 3-х атомов водорода. Зато есть азот и кислород. Предположим, что 3 атома водорода были замещены другими группами.
Какие это могут быть группы? Исходя из видимого нами состава, можно предположить, что одна из групп – это нитрогруппа. Но тогда остается 2 атома кислорода. Атомы кислорода не могут быть сами по себе заместителями в ароматическом ядре. Они не входят и в состав спиртовых групп, потому что для этого не хватит водорода в исходной формуле. Тогда логично предположить, что атомы кислорода замещают атомы водорода не в бензольном ядре, а в метильном радикале.
Если мы заменим метильную группу карбоксильной группой, т. е. кислотной, мы как раз получим ту формулу, которая соответствует находящейся в условии задачи. В исходной формуле находятся и нитрогруппа, и карбоксильная группа. Исходное вещество – нитробензольная кислота. Однако мы пока не можем судить о взаимном расположении этих заместителей. Надо выбрать направление цепочки. Здесь скорее помогает интуитивная оценка имеющейся у нас ситуации. Предположим, мы пойдем влево. У соседнего вещества на 2 атома кислорода меньше, но больше на 3 атома водорода и появился атом хлора. Если число атомов кислорода уменьшилось и возникли атомы водорода, по-видимому, произошло восстановление. При восстановлении нитрогруппа превращается в аминогруппу, тогда не очень понятно, откуда взялся атом хлора. Однако если восстановление протекало в кислой среде, то вместо амина образуется аммониевая соль. Тогда соответствующий анион – хлорид.
е. кислотной, мы как раз получим ту формулу, которая соответствует находящейся в условии задачи. В исходной формуле находятся и нитрогруппа, и карбоксильная группа. Исходное вещество – нитробензольная кислота. Однако мы пока не можем судить о взаимном расположении этих заместителей. Надо выбрать направление цепочки. Здесь скорее помогает интуитивная оценка имеющейся у нас ситуации. Предположим, мы пойдем влево. У соседнего вещества на 2 атома кислорода меньше, но больше на 3 атома водорода и появился атом хлора. Если число атомов кислорода уменьшилось и возникли атомы водорода, по-видимому, произошло восстановление. При восстановлении нитрогруппа превращается в аминогруппу, тогда не очень понятно, откуда взялся атом хлора. Однако если восстановление протекало в кислой среде, то вместо амина образуется аммониевая соль. Тогда соответствующий анион – хлорид.
Итак, условия реакции восстановления – взаимодействие с активным металлом в солянокислой среде. Металлом может быть, например, цинк. Теперь пойдем еще на 1 шаг влево по данной цепочке.
Теперь пойдем еще на 1 шаг влево по данной цепочке.
При таком переходе у нас как бы пропал атом хлора, но появился атом калия и уменьшилось число атомов водорода. Эта комбинация из изменений намекает нам на то, что кислая среда сменилась на основную или щелочную. И тогда хлорид в аминогруппе заменяется солью калия, которая будет, разумеется, не по аминогруппе, а по карбоксильной группе кислоты. Такая реакция протекает при взаимодействии предшествовавшего вещества – соли аммония с концентрированным раствором щелочи.
Теперь двинемся по той же цепочке вправо. Условия реакция здесь довольно однозначные – нужно нитрование. Однако условия нитрования потребуются весьма жесткие, потому что уже есть две функциональные группы, которые не способствуют подобным реакциям. Поэтому придется довольно сильно нагревать вещество с нитрующей смесью. И карбоксильная группа, и нитрогруппа ориентируют новые заместители в метоположение. А поскольку, согласно цепочке, в результате реакции образовалось только одно вещество, то ориентация этих двух исходных заместителей является согласованной. Такая ситуация возможна только в одном случае: и карбоксильная группа, и нитрогруппа по отношению друг другу находятся в метоположении. А продуктом реакции является 3, 5 динитробензольная кислота. Это вещество превращается далее, например, за счет взаимодействия по карбоксильной группе. Возможно образование сложного эфира со спиртом, содержащим 2 атома углерода. И тогда последний продукт – это этиловый эфир 3, 5 динитробензольной кислоты. Реакция идет в кислой среде. Итак, цепочка превращений расшифрована.
Такая ситуация возможна только в одном случае: и карбоксильная группа, и нитрогруппа по отношению друг другу находятся в метоположении. А продуктом реакции является 3, 5 динитробензольная кислота. Это вещество превращается далее, например, за счет взаимодействия по карбоксильной группе. Возможно образование сложного эфира со спиртом, содержащим 2 атома углерода. И тогда последний продукт – это этиловый эфир 3, 5 динитробензольной кислоты. Реакция идет в кислой среде. Итак, цепочка превращений расшифрована.
На этом наш урок закончен. До свидания.
Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс
Данная инструктивная карточка предназначена для учащихся при проведении практической работы №1 по УМК О. С. Габриеляна. Может быть использованна при проведении похожих практических работ в УМК других авторов.
Просмотр содержимого документа
«Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс»
Практическая работа №1
«Осуществление цепочки химических превращений металлов».
CuSO4 –Cu(OH)2 – CuO – CuSO4
Цель работы: научиться осуществлять цепочки химических превращений, исходя из предложенных веществ; закрепить практические навыки проведения химических опытов; повторить технику безопасности при проведении практических опытов по химии.
Реактивы и оборудование: сульфат меди CuSO4, щелочь NaOH, серная кислота Н2 SO4; спиртовка, штатив с набором пробирок, спички, спиртовка, держатель для пробирок
ИНТСТУКТАЖ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
В пробирку с CuSO4 добавить NaOH. Что наблюдаете?
Составьте уравнение реакции в молекулярном и ионном виде. Укажите тип химической реакции
Опыт №2. Получение CuO
Пробирку с Cu(OH)2 нагреть. Что наблюдаете?
Составьте уравнение реакции.
В пробирку с полученным осадком добавьте кислоту и при необходимости немного нагрейте. Что наблюдаете?
Составьте уравнение реакции в молекулярном и ионном виде.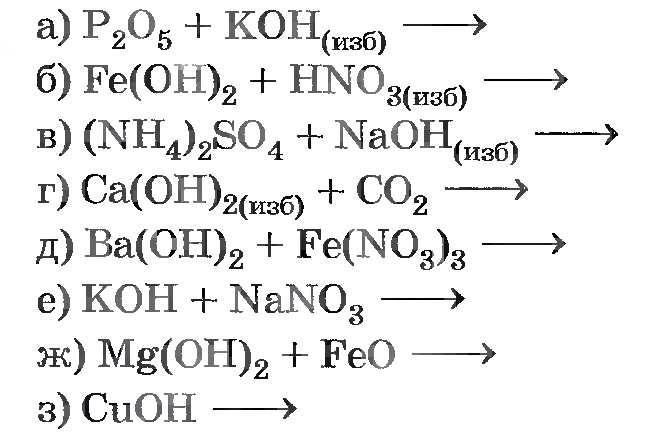 Укажите тип химической реакции
Укажите тип химической реакции
Просмотр содержимого документа «Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс»
Методические рекомендации решения цепочек превращения по химии.
Xn—96-5cd3cgu2f. xn--p1ai
23.07.2018 16:49:51
2018-07-23 16:49:51
Источники:
Https://xn—96-5cd3cgu2f. xn--p1ai/9-klass/cepochki-prevrashhenij-po-ximii-9-klass-prakticheskaya-rabota-12-osushhestvlenie-cepochki-ximicheskix-prevrashhenij. html
Как делать цепочки по химии: Как решить цепочку по химии — Школа №96 г. Екатеринбурга » /> » /> .keyword { color: red; }
Цепочка по химии
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой Превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается Щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
(Такая реакция возможна, если в итоге получается Щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – h4PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Органические цепочки из ЕГЭ с решениями (50 цепочек).
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) Уравнение спиртового брожения глюкозы под действием дрожжей:
2) Этиловый спирт сернокислым раствором перманганата калия может быть окислен до уксусной кислоты:
3) Уравнение нейтрализации уксусной кислоты гидроксидом натрия:
4) Взаимодействие солей карбоновых кислот со щелочами при сплавлении приводит к образованию углеводорода с меньшим числом атомов углерода
5) Алканы вступают в реакцию нитрования с разбавленной азотной кислотой при сильном нагревании:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) При нагревании одноатомных спиртов с концентрированной серной кислотой выше 140 о С протекает внутримолекулярная дегидратация с образованием алкена:
2) Алкены вступают в реакцию соединения с бромом. При этом атомы брома присоединяются по месту двойной связи, сами двойная связь превращается в одинарную:
3) Вицинальные дигалогенпроизоводные углеводородов при нагревании с некоторыми металлами, например, цинком или магнием, образуют алкены:
4) Гидратация несимметричных алкенов протекает в соответствии с правилом Марковникова:
5) Вторичные спирты в ЕГЭ окисляем до соответствующих кетонов (углеродный скелет не рвем):
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
1) При бромировании бутана на свету образуется преимущественно 2-бромбутан:
2) При действии на галогенпроизводные алканов спиртового раствора щелочи при нагревании образуется алкен. Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
Реакция протекает для 2-бромбутана в соответствии с правилом Зайцева:
3) Бутен-2, реагируя с бромом, образует 2,3-дибромбутан:
4) 2,3-дибромбутан при реакции с избытком спиртового раствора щелочи образует бутин-2:
5) Гидратация алкинов с числом углеродных атомов в молекуле больше 2-х приводит к образованию кетонов:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
V1) Реакция алкенов с нейтральным холодным раствором перманганата калия приводит к образованию соответствующих вицинальных диолов:
2) Взаимодействие этиленгликоля с избытком бромоводорода приводит к образованию 1,2-дибромэтана:
3) Дегидрогалогенирование вицинальных дигалогеналканов действием спиртового раствора щелочи приводит к образованию соответствующих алкинов:
4) В результате гидратации ацетилена в присутствии солей ртути образуется ацетальдегид:
5) Совместное нагревание ацетальдегида с гидроксидом меди (II) приводит к его окислению до уксусной кислоты. Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Гидроксид меди (II) при этом восстанавливается до оксида меди (I) (кирпично-красный осадок):
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.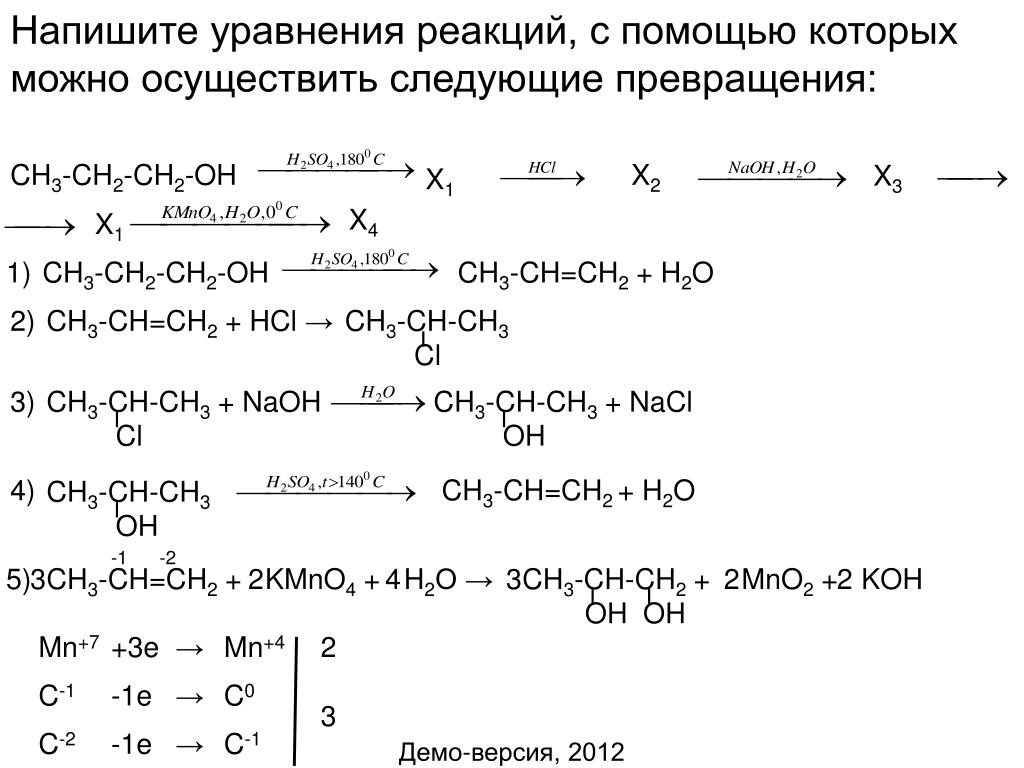
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.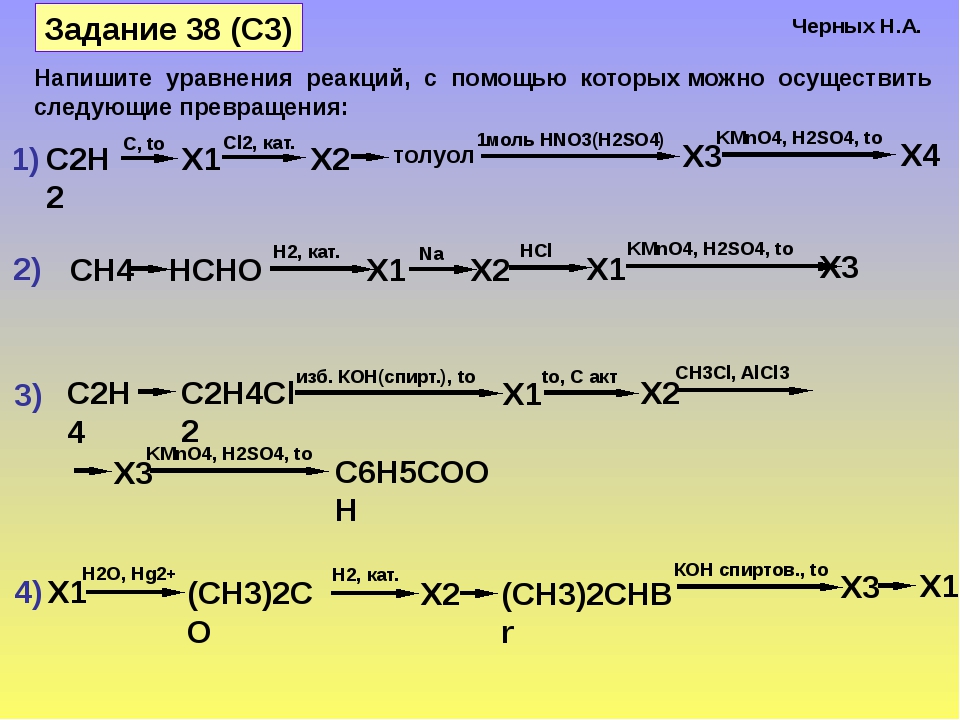
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные формулы органических веществ. Решение Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превраще
Органические цепочки для подготовки к ЕГЭ по химии 2017 года.

Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) Получить ацетилен из 1,2-дибромэтана можно, подействовав на него спиртовым раствором щелочи при нагревании. При этом от одной молекулы дибромэтана отщепляются две молекулы бромоводорода, которые нейтрализуются щелочью:
2) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция М. Г. Кучерова):
3) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
4) Гидрокарбонаты аналогично карбонатам вступают в реакцию обмена с растворами кислот:
5) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию разложения, в результате которой образуется карбонат металла и кетон:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) Под действием катализаторов гидрирования/дегидрирования (платина, никель, палладий) алканы с длиной углеродной цепи более 6-ти атомов при нагревании могут вступать в реакцию дегидроциклизации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При хлорировании этилбензола на свету замещение происходит не в ароматическом ядре, а в боковой цепи. При этом замещение атомов водорода происходит преимущественно у вторичного, а не первичного углеродного атома:
4) Моногалогенпроизводные углеводородов при действии водных растворов щелочей вступают в реакцию замещения. При этом образуются спирты соответствующего строения:
5) 1-фенилэтанол при действии таких окислителей, как перманганат калия или дихромат калия в присутствии серной кислоты может окислиться до кетона, либо до бензойной кислоты и углекислого газа. Любой вариант из двух записанных ниже реакций засчитывался на экзамене:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Пояснение:
1) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь. При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
* Напомним, что для того чтобы замещение атома водорода атомом галогена происходило в ароматическом ядре, а не боковой цепи, галогенирование следует проводить в присутствии соответствующего галогенида алюминия или трехвалентного железа.
1) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Если бы раствор щелочи был водным, то вместо указанной реакции произошло бы замещение атома галогена в галогенпроизводном на гидроксильную группу.
3) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
4) Бензойная кислота реагирует с раствором гидрокарбоната (как и карбоната) натрия, поскольку является более сильной, чем образующаяся нестойкая угольная:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При гидрировании бутадиена-1,3 и изопрена протекает преимущественно так называемое 1,4-присоединение:
2) Действие на алкены подкисленного раствора перманганата или дихромата относят к так называемому жесткому окислению.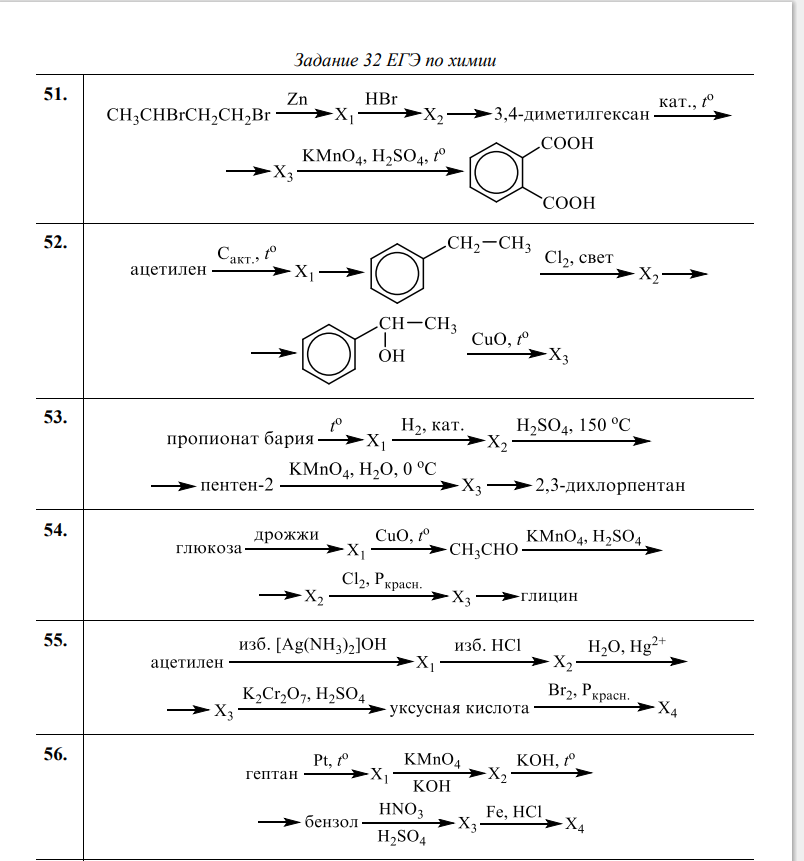 При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Действием на галогенпроизводные карбоновых кислот избытка аммиака получают соответствующие аминокислоты:
5) Аминокислоты реагируют с щелочами с образованием солей:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Сложные эфиры могут вступать в реакции гидролиза. При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
* Следует отметить, что сложные эфиры могут также состоять из остатков карбоновых кислот и фенолов. При щелочном гидролизе таких эфиров образуются две соли — соль карбоновой кислоты и фенолят активного металла.
При щелочном гидролизе таких эфиров образуются две соли — соль карбоновой кислоты и фенолят активного металла.
2) Соли, состоящие из остатков карбоновых кислот и катионов щелочноземельных металлов, при нагревании вступают в реакцию декарбоксилирования — образуются соответствующие карбонат двухвалентного металла и кетон:
3) Кетоны легко гидрируются в присутствии катализаторов (Pt, Pd, Ni) до соответствующих вторичных спиртов:
4) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
5) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий):
2) Спирты реагируют с галогеноводородными кислотами, образуя соответствующие галогенпроизводные:
3) Бензол и его гомологи можно алкилировать хлор — или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси). В нашем случае, поскольку алкильные заместители (метил, этил и т. д.) являются заместителями первого рода, последующий заместитель направляется в орто — и пара-положения по отношению к исходному. Т. е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
5) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление нитросоединений до солей аминов:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600 о С протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлор — или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь:
4) При щелочном гидролизе геминальных дигалогенпроизводных образуются альдегиды или кетоны:
5) Альдегиды под действием таких окислителей, как гидроксид меди (II), перекись водорода, а также подкисленные растворы перманганатов и дихроматов превращаются в соответствующие карбоновые кислоты:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Спирты при нагревании с концентрированной серной кислотой могут вступать в реакцию внутримолекулярной дегидратации, приводящей к образованию алкенов:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Действие на 1,3-дибромпропан цинковой пыли приводит к образованию циклопропана:
2) В циклоалканах с малым размером цикла (3 и 4 углеродных атома) в связи с малыми значениями валентных углов С-С-С имеется сильное напряжение внутри молекулы. Такие соединения легко вступают в реакцию присоединения с водородом, галогенами и галогеноводородами подобно алкенам:
* В отличие от алкенов циклоалканы не реагируют с водой и водным раствором перманганата калия.
3) Действие на моногалогеналканы спиртового раствора щелочи
4) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
5) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя из них более слабую угольную кислоту:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра.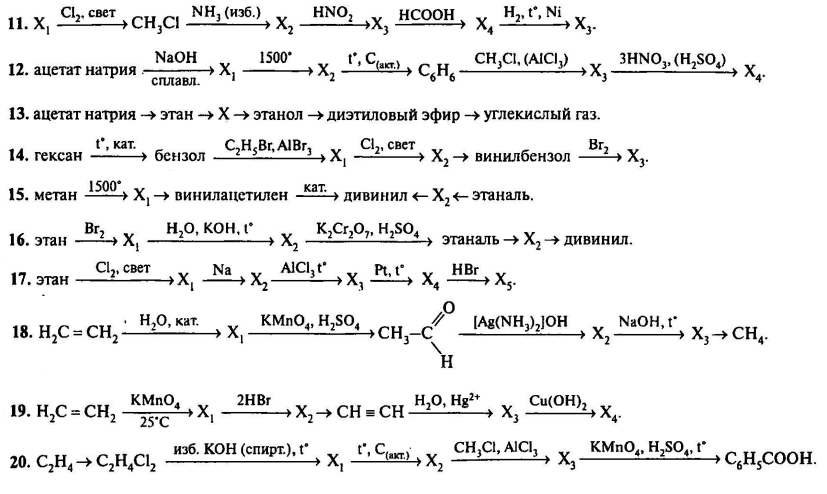 В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии воды на карбид кальция протекает реакция обмена, одним из продуктов которой является ацетилен:
2) Ацетилен в присутствии солей ртути вступает в реакцию гидратации:
3) Альдегиды легко окисляются до карбоновых кислот или их солей. В карбоновые кислоты альдегиды могут быть превращены действием таких реагентов, как Cu(OH)2, h3O2, подкисленные растворы K2Cr2O7 или KMnO4:
4) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
5) При сплавлении твердых соли карбоновой кислоты и щелочи протекает реакция декарбоксилирования:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600 о С протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на бензол и его гомологи брома или хлора в присутствии галогенидов алюминия или железа (III) галогенированию подвергается ароматическое ядро. В нашем случае, поскольку алкильные заместители (метил, этил и т. д.) являются заместителями первого рода, последующий заместитель направляется в орто — и пара-положения по отношению к исходному. Т. е. образуется смесь орто— и пара-бромтолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
4) При смешении п-бромтолуола с бромметаном и натрием протекает реакция Вюрца-Фиттига:
5) Гомологи бензола, представляющие собой метилзамещенный бензол, при действии подкисленного раствора перманганата калия окисляются до карбоновой кислоты. При этом
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Нагревание метана до 1200-1500 o C приводит к образованию ацетилена и водорода:
2) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600 о С протекает реакция тримеризации:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на толуол раствора перманганата калия в кислой среде образуется бензойная кислота, а в нейтральной или щелочной — соль бензойной кислоты:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии хлора или брома на алканы при ультрафиолетовом облучении протекает реакция замещения с образованием галогеналкана и соответствующего галогеноводорода. В зависимости от от пропорции галоген/алкан замещаться на галоген может один или более атомов водорода:
2) При действии натрия на моногалогеналканы протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана. При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
2) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на изопропилбензол (кумол) хлора или брома в реакцию замещения вступает боковая цепь ароматического углеводорода. При этом, как и в случае алканов, замещению подвергается атом водорода при наиболее замещенном атоме углерода, в нашем случае — третичном:
5) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При нагревании алканов в присутствии таких катализаторов, как платина, никель, палладий или оксид хрома (III) можно осуществлять реакцию дегидрирования:
2) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
3) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
4) При действии на пропин катализаторов при нагревании протекает реакция, аналогичная тримеризации ацетилена.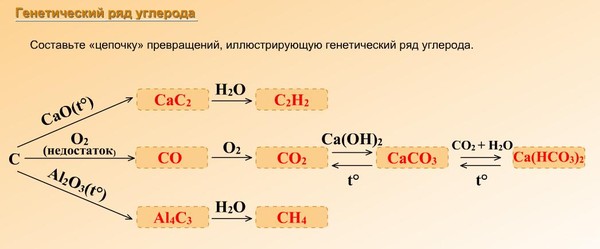 При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
5) При действии на метилзамещенные бензолы перманганата или дихромата калия в кислой среде все метильные радикалы превращаются в карбоксильные группы:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция Кучерова):
* Гомологи ацетилена в этих же условиях вместо альдегида образуют кетон.
2) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
3) Органические кислоты подобно неорганическим реагируют с основными оксидами, образуя соль и воду:
4) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию декарбоксилирования, в результате которой образуется карбонат металла и кетон:
5) Кетоны способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование вторичного спирта:
Результатом такой реакции является образование вторичного спирта:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование первичного спирта:
2) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
3) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
4) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
5) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии на альдегиды нейтрального либо щелочного раствора перманганата калия они окисляются, образуя соли карбоновых кислот соответствующего строения:
2) При проведении электролиза растворов солей карбоновых кислот происходит образование углеводорода, углекислого газа, водорода и щелочи:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
2) Первичные спирты действием перманганата или дихромата калия в кислой среде могут быть окислены до альдегидов либо до карбоновых кислот:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя более слабую угольную кислоту, которая будучи нестойкой разлагается на углекислый газ и воду
5) Действием галогенпроизводных на соли, образованные щелочными металлами и карбоновыми кислотами, могут быть получены сложные эфиры:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) Этилбензол при действии подкисленного раствора дихромата или перманганата калия окисляется с образованием бензойной кислоты и углекислого газа:
2) Карбоновые кислоты реагируют с щелочами с образованием соответствующих солей и воды:
3) При сплавлении соли карбоновой кислоты с твердой щелочью протекает реакция декарбоксилирования, продуктами которой является углеводород и карбонат металла:
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси):
5) При действии на нитропроизводные кислот-неокислителей совместно с металлами, расположенными до водорода в ряду активности, происходит восстановление первых до солей аминов:
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Урок 12: Превращения между веществами
План урока:
Почему связь между классами веществ считается генетической
Родственные связи между металлами и неметаллами
Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.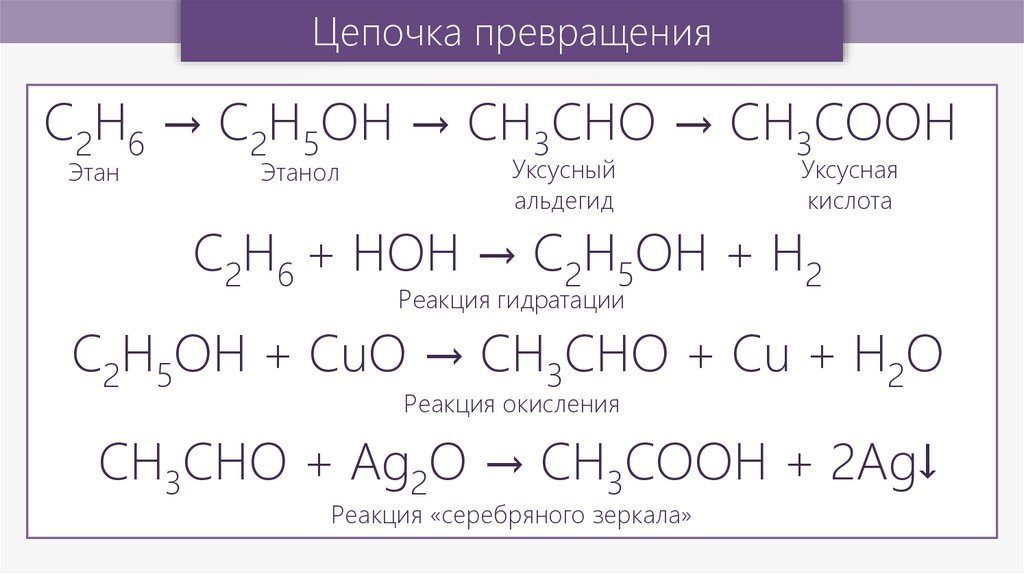
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.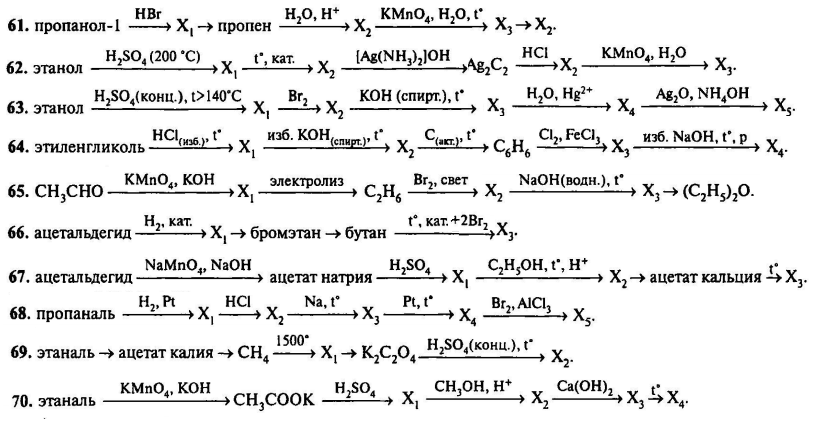
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей, сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + h4O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4. Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2. Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h4. Величину активности можно узнать из таблицы ряда электрохимических напряжений. Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями.
Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + h4O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4. Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2. Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + h4. Величину активности можно узнать из таблицы ряда электрохимических напряжений. Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + h4O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + h4O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
Написания формул элементов, вступающих в реакцию с левой стороны. Указания справа формулы образующихся веществ. Уравнивания числа атомов с добавлением коэффициентов.
Указания справа формулы образующихся веществ. Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + h4SO 4 → Na 2SO4 + h4O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + h4SO 4 → Na2 SO4 +2h4O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + h4O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + h4O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5h4O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле Nh5 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+.

Уравнение можно сократить на 16H + и 8h4O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2h4O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков.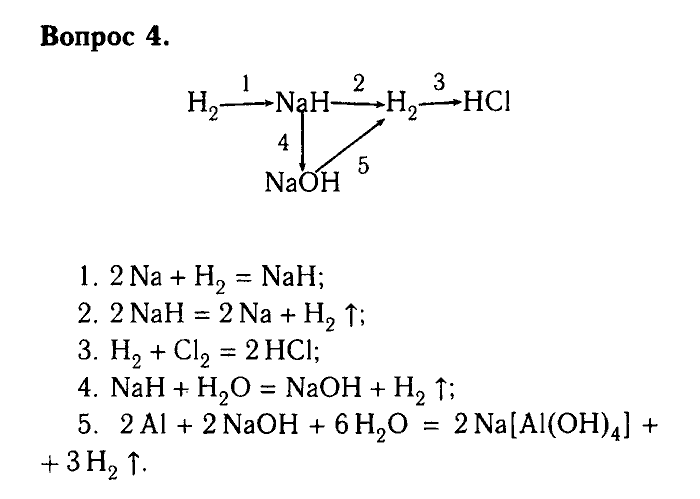 Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда Запись сделана верно, Но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Алгоритм решения «цепочек превращений».
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой Превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг.
2Сa + O2 2Ca+2O-2
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается Щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + h4O → Ca 2+(OH)2-
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – h5PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2- + 2h5+PO43- → Ca32+(PO4)23- + 6h4O
Как найти и пронумеровать самую длинную цепь в разветвленном алкане
Образование Наука Химия Как найти и пронумеровать самую длинную цепь в разветвленном алкане
Алканы не ограничиваются пребыванием в одной линии — у них могут быть структуры, которые разветвляются. Называя разветвленный алкан, ваш первый шаг — найти и пронумеровать самую длинную цепь.
После того, как вы пронумеровали родительскую цепь, если вы хотите назвать разветвленный алкан, вам необходимо определить имена всех заместителей, которые выступают из родительской цепи, а затем расположить заместители в алфавитном порядке перед родительской цепью.
На этом рисунке показан пример разветвленного алкана. Как видите, алкан с формулой C 4 H 10 может иметь две возможные химические структуры или Изомеров — один алкан с прямой цепью (бутан) и один алкан с разветвленной цепью (изобутан).
Найдите самую длинную цепь в разветвленном алкане
Первый и потенциально самый сложный шаг в присвоении названия разветвленному алкану — найти самую длинную цепочку атомов углерода в молекуле.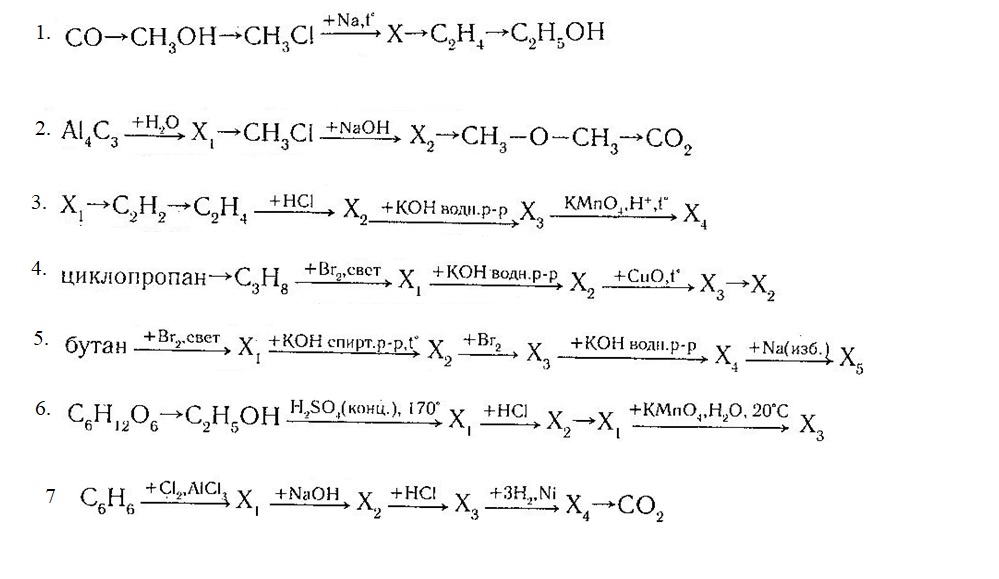 Эта задача может быть сложной, потому что, как читатель английского языка, вы привыкли читать слева направо. Однако часто самая длинная цепочка атомов углерода — это не цепь, которая следует просто слева направо, а цепочка, которая огибает молекулу в разных направлениях. Профессора-органики любят делать родительскую цепь такой, которая изгибается вокруг молекулы и не обязательно течет слева направо, поэтому вы должны быть настороже, чтобы убедиться, что вы заметили самую длинную углеродную цепь.
Эта задача может быть сложной, потому что, как читатель английского языка, вы привыкли читать слева направо. Однако часто самая длинная цепочка атомов углерода — это не цепь, которая следует просто слева направо, а цепочка, которая огибает молекулу в разных направлениях. Профессора-органики любят делать родительскую цепь такой, которая изгибается вокруг молекулы и не обязательно течет слева направо, поэтому вы должны быть настороже, чтобы убедиться, что вы заметили самую длинную углеродную цепь.
Неправильный и правильный способы подсчета родительской цепочки.
Самая длинная углеродная цепь показанной здесь молекулы состоит из семи атомов углерода, поэтому исходное название этого алкана — гептан.
Номер самой длинной цепи в разветвленном алкане
Пронумеруйте родительскую цепь, начиная с конца, который первым достигает заместителя. Цепочку всегда можно пронумеровать двумя способами. Для молекулы в этом примере нумерация может начинаться сверху и идти вниз, или она может начинаться снизу и идти вверх. Правильный способ пронумеровать родительскую цепь — начинать с конца, который раньше достигает первого заместителя. Заместитель является органическим обозначением фрагмента, отходящего от родительской цепи.
Правильный способ пронумеровать родительскую цепь — начинать с конца, который раньше достигает первого заместителя. Заместитель является органическим обозначением фрагмента, отходящего от родительской цепи.
Правильный и неправильный способы нумерации атомов углерода в родительской цепи.
Как вы можете видеть здесь, если вы пронумеруете сверху вниз, первый заместитель будет у атома углерода номер три; если вы пронумеруете снизу вверх, первый заместитель будет на четвертом атоме углерода. Таким образом, правильная нумерация в этом случае начинается сверху и идет вниз.
Об авторе книги
Артур Винтер окончил Фростбургский государственный университет, где получил степень бакалавра химии. Он получил докторскую степень в Университете Мэриленда в 2007 году. В настоящее время он является профессором химии в Университете штата Айова.
Как назвать разветвленные алканы в химии
Образование Наука Химия Как назвать разветвленные алканы в химии
Джон Т.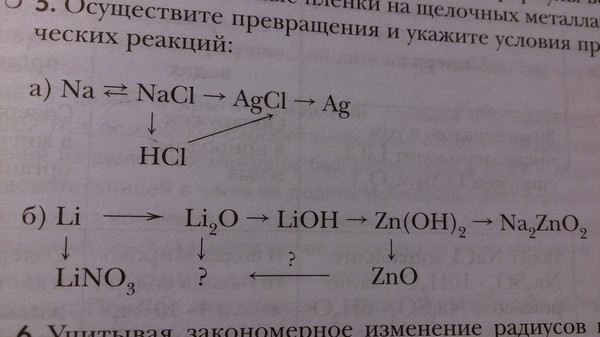 Мур, Крис Хрен, Питер Дж. Микулецки
Мур, Крис Хрен, Питер Дж. Микулецки
Органическая химия получает плохую репутацию. На самом деле, это не такая уж грубая тема, если вы потратите время. К сожалению, не все Алканов и (простые органические соединения) являются алканами с прямой цепью. Это было бы слишком просто. Многие алканы представляют собой так называемые разветвленные алканы . Разветвленные алканы отличаются от алканов с непрерывной цепью тем, что углеродные цепи замещают несколько атомов водорода вдоль цепи. Атомы или другие группы (например, углеродные цепи), замещающие водород в алкане, называются Заместителями.
Присвоение имен разветвленным алканам немного сложнее, чем наименование алканов с непрерывной цепью, но вам нужно всего лишь выполнить простой набор шагов, чтобы получить правильное (и часто длинное) имя:
Подсчитайте самую длинную непрерывную цепочку атомов углерода.
Хитрые учителя химии часто рисуют разветвленные алканы с самой длинной цепью, извивающейся через несколько ветвей, вместо того, чтобы явно выстраиваться в ряд.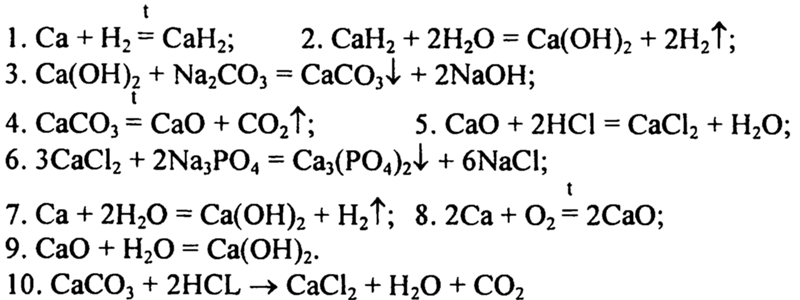 Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой. В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.
Рассмотрим две углеродные структуры ниже. На самом деле это одна и та же структура, нарисованная по-разному! Ой. В любом случае самая длинная непрерывная цепь в этой структуре состоит из восьми атомов углерода.
Одна углеродная структура, нарисованная двумя разными способами.
Пронумеруйте атомы углерода в цепочке, начиная с конца, ближайшего к ответвлению.
Чтобы убедиться, что вы выполнили этот шаг правильно, вы можете проверить свою работу, пронумеровав углеродную цепочку с противоположного конца. Правильная последовательность нумерации — это та, в которой заместители отходят от атомов углерода с наименьшим номером. Например, как показано и пронумеровано выше, у алкана есть группы заместителей, ответвляющиеся от третьего, четвертого и пятого атомов углерода. Если бы углеродная цепь была пронумерована в обратном порядке, это были бы четвертый, пятый и шестой атомы углерода в цепи. Поскольку первый набор цифр ниже, цепочка нумеруется правильно. Самая длинная цепь разветвленного алкана называется родительской цепью.
Подсчитайте количество атомов углерода в каждой ветви.
Эти группы называются алкильными группами и называются добавлением суффикса -yl к соответствующему префиксу алкана. Три наиболее распространенных алкильных группы — это метильная (одна углеродная), этильная (два углерода) и пропильная (три углерода) группы. На рисунке 1 показаны две метильные группы, одна этильная группа и нет пропильных групп.
Будьте осторожны, когда имеете дело с алкильными группами, состоящими не из нескольких атомов углерода. Сложный рисунок может привести к неправильной нумерации родительской цепочки!
Прикрепите номер атома углерода, от которого разветвляется каждый заместитель, перед названием алкильной группы.
Например, если группа из двух атомов углерода присоединена к третьему атому углерода в цепи, как на рисунке 1, группа называется 3-этил.
Проверить наличие повторяющихся алкильных групп.
Если несколько групп с одинаковым количеством атомов углерода ответвляются от родительской цепочки, не повторяйте имя. Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы Ди-, три-, тетра-, и так далее. Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».
Вместо этого включите несколько чисел, разделенных запятыми, перед названием алкильной группы. Кроме того, укажите количество экземпляров алкильной группы, используя префиксы Ди-, три-, тетра-, и так далее. Например, если одноуглеродные группы (другими словами, метильные группы) ответвляются от четвертого и пятого атомов углерода родительской цепи, две метильные группы появляются вместе как «4,5-диметил».
Поместите названия групп заместителей перед названием родительской цепи в алфавитном порядке.
, такие как Ди-, три-, и Тетра- , не фигурируют в алфавитном порядке, поэтому собственное название органической молекулы на рисунке 1 — 3-этил-4,5-диметилоктан.
Обратите внимание, что дефисы используются для соединения всех элементов именования, кроме последнего соединения с родительской цепочкой (то есть Диметилоктан будет неправильным).
Об авторе книги
Джон Т. Мур, EdD, более 40 лет преподавал химию в Государственном университете Стивена Ф. Остина в Накогдочес, Техас. Кристофер Р. Хрен — выпускник Мичиганского государственного университета, преподает химию в средней школе. Питер Дж. Микулецки, доктор философии, преподает химию и биологию в Учебном центре Fusion и Академии Fusion.
Остина в Накогдочес, Техас. Кристофер Р. Хрен — выпускник Мичиганского государственного университета, преподает химию в средней школе. Питер Дж. Микулецки, доктор философии, преподает химию и биологию в Учебном центре Fusion и Академии Fusion.
Как решать вопросы синтеза органической химии Учебник по органической химии
Органическая химия может охватывать множество концепций и тем, но это Все о реакциях и механизмах.
Поначалу это не так уж и страшно, подумайте о простом кислотно-основном депротонировании, реакции алкена здесь, другой там. Прежде чем вы это осознаете, вы тонете в десятках и десятках реакций!
Вас просят «запомнить» каждого из них, а до Знать , что будет делать каждый реагент и реагент.
И как только вы все это разберетесь, не забудьте про дюжину или около того исключений из правил.
И когда у вас есть все ЭТО, давайте объединим их все вместе: когда вам дадут молекулу A и попросите придумать все 20 шагов для получения продукта Z!
Хорошо, возможно, я немного преувеличиваю… но на самом деле совсем чуть-чуть!
В среднем вопрос по синтезу 1 или 2 экзамена по органической химии будет варьироваться от двух до пяти шагов с промежуточными продуктами.
Как правильно все выучить?
И что еще более важно, как вы просеиваете сотни точек данных в своей голове, чтобы произвести точные шаги, необходимые для достижения желаемого результата?
В детстве я гордился тем, что называл себя ботаником. Возможно, с небольшим количеством ОКР.
Я всегда искал тенденции и находил закономерности там, где их не было. Возможно, поэтому мне так нравится Orgo.
A) Ищите закономерности, как мы объясним ниже.
B) когда вы застряли, помните, что, вероятно, есть несколько способов добраться до желаемого продукта.
Для правильного синтеза требуется сочетание прямого и обратного мышления!
Мы рассмотрим обратное мышление в руководстве по ретросинтезу.
В этом руководстве мы сосредоточимся на более коротком и простом синтезе.
Начнем с поиска закономерностей.
Следующие вопросы помогут вам понять, на что следует обращать пристальное внимание.
Обратите внимание на следующее:
Какая Функциональная группа присутствует в реагенте? Какая функциональная группа присутствует в продукте? Какие реакции Конвертируют из одного в другое, что я знаю? Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Например:
Если вы начинаете с четырехуглеродного алкена, а в продукте запрашивается четырехуглеродный спирт, спросите себя:
«Что у меня в реагенте?»
Реактивная пи-связь!
« Что содержится в продукте?»
Спирт.
«Какая из известных мне реакций может помочь мне превратиться из алкена в спирт?»
Ну, если вдуматься, их много. Пойдем по порядку от наиболее очевидного к менее очевидному:
- Гидратация, катализируемая кислотой Оксимеркурация-демеркурация Гидроборирование-окисление
Это прямые очевидные реакции с потенциально разными результатами.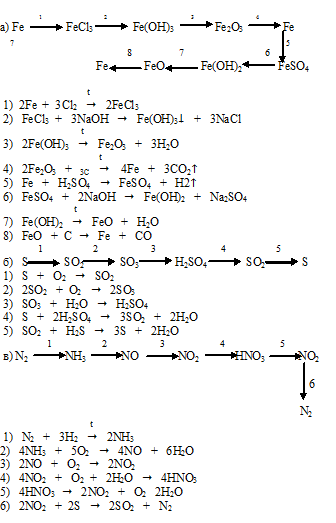 Мы воспользуемся 3-метил-1-бутеном, чтобы подчеркнуть эту разницу.
Мы воспользуемся 3-метил-1-бутеном, чтобы подчеркнуть эту разницу.
Но что, если бы вам не давали алкен или вы не думали об этих алкеновых реакциях?
А как насчет помещения уходящей группы галогена на алкен посредством гидрогалогенирования?
Или радикальное галогенирование, если исходить из алкана?
Затем можно провести реакцию SN2, используя NaOH в полярном протонном растворителе.
Что, если бы это было не так просто?
Что, если вас попросят начать с алкина?
Мы не можем перейти от алкина к спирту напрямую, так как енольный продукт немедленно таутомеризуется в кетон или альдегид.
Здесь мы представляем множество вариантов:
-> Если вы восстанавливаете алкин до алкена, вы можете использовать одно из следующего, как уже обсуждалось выше:
-> Если вы перейдете от алкина к карбонилу (кетону или альдегиду), вы можете продолжить восстановление:
Вы понимаете, к чему мы идем?
A) Определите шаблоны
B) Спросите себя: «Что я знаю?» чтобы распознать эти образцы
C) Оттуда
Давайте начнем с простого примера концепции, а затем применим ту же логику к чему-то более сложному.
Допустим, вас попросили синтезировать 2-бутанон из пропина. Просмотрите свои вопросы:
Какая Функциональная группа присутствует в реагенте?
Реактивный терминал алкин Какая функциональная группа присутствует в продукте?
Кетон на угле # 2 Какие реакции
Гидратация алкинов, катализируемая кислотой, дает кетон в соответствии с правилом Марковникова.
ОДНАКО , в этом примере мы начинаем с цепи из 3 атомов углерода, но заканчиваем цепочкой из 4 атомов углерода.
4. Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Да! Терминальные алкины легко подвергаются удлинению цепи через SN2.
Мы начнем с кислотно-основной реакции, чтобы депротонировать концевой алкин с образованием хорошего нуклеофила.
Нам нужно удлинить цепочку всего на один углерод. Давайте дадим этой метильной группе хорошую уходящую группу, чтобы облегчить быструю реакцию SN2 — моим «незаменимым» является бром, но вы также можете использовать хлор или йод.
Теперь, когда у нас есть углеродная цепь желаемой длины, приступим к гидратации, катализируемой кислотой.
Но подождите, продукт — енол, а не кетон!!
Следующий шаг произойдет автоматически. Поэтому, хотя вам не нужно показывать реагент, просто нарисуйте «KET» над стрелкой реакции для таутомеризации кето енола.
Следующий экзаменационный вопрос / запрос страшнее, чем синтез сам по себе:
«Предложите разумный механизм для выполнения следующего синтеза».
Здесь вам предоставляется один реагент, один продукт и ОДИН или ДВА набора реагентов.
Другими словами, вам даны все шаги, но вас попросят показать, как разные молекулы работают вместе.
Хотя вопрос совсем другой, концепт Тот же .
Немного изменим начальные вопросы:
Какая Функциональная группа присутствует в реагенте? Какая функциональная группа присутствует в продукте? ГДЕ РЕАКТИВНОСТЬ НА ЗАПУСКНОЙ МОЛЕКУЛЕ? Например, где мне запустить механизм? Какие реакции Конвертируют из одного в другое, что я знаю? Знаю ли я о реакции, в результате которой образуется промежуточное соединение с указанным выше продуктом?
Студент недавно показал мне этот экзаменационный вопрос, за который ни один студент в его классе не получил полного кредита.
Позвольте мне предварить это, сказав ДА, это сложный вопрос.
НО, если вы обдумаете это логически, вы поймете, что если вы изучите отдельные шаги и узнаете их, вы сможете следовать за ними.
На самом деле, я призываю вас попробовать и посмотреть, как далеко вы продвинетесь, прежде чем читать дальше.
Предложите разумный механизм для следующей реакции. Показать всех промежуточных звеньев и официальных сборов. Это реакция SN1 SN2 E1 E2?Как вы думаете? Ты понял?
Вот видео с пошаговым решением:
Независимо от того, насколько хорошо вы подготовились, тот или иной хитрый шаг все равно застает вас врасплох.
А когда застрешь?
Скорее всего, существует несколько способов получения вашего продукта!
Когда я проходил свою первую еженедельную викторину по органической химии 2, я непреднамеренно установил тенденцию к получению лучших баллов в классе, но это была случайность. Я не знал, что у нас еженедельные викторины…
Нас попросили обрисовать пошаговую процедуру разделения двух похожих молекул с разными функциональными группами.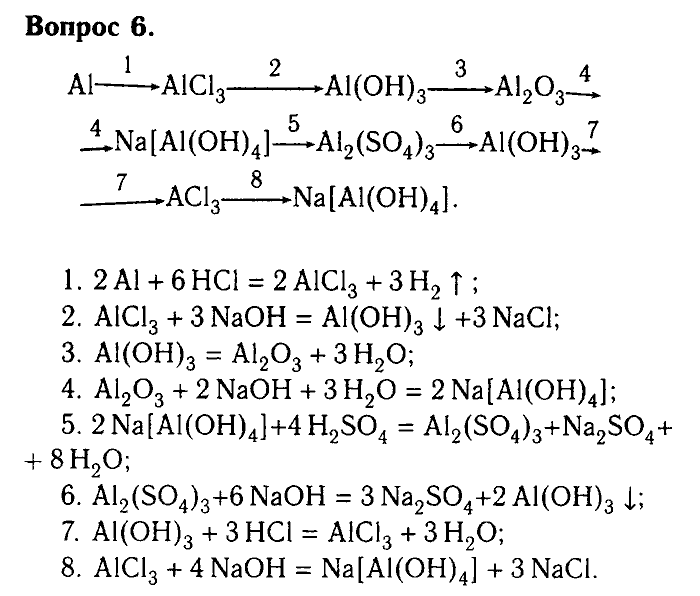 Процесс включал серию реакций для подготовки одной молекулы к экстракции.
Процесс включал серию реакций для подготовки одной молекулы к экстракции.
Я пробовал!
Я вспомнил, что шагов было около шести, но уверенно ответил только на четыре. Я уже бомбил, потом одолел Орго 1 и больше не хотел этого делать!
Что бы я ни делал, я не мог придумать другие шаги. Вместо этого я вычеркнул свои четыре с половиной шага и написал подробную пошаговую процедуру проведения фракционной перегонки.
Мой TA очень неохотно дал мне полную оценку забавным предупреждением.
Никто и близко не подошел.
Я прошу вас перехитрить вопрос?
Просто поймите, что чем больше реакций вы узнаете, тем больше у вас
Вариантов для создания единой функциональной группы.Если вы застряли на определенном пути или не можете полностью описать шаги,
Спросите себя: «Есть ли другой способ создать такую же функциональную группу?»
Вспомните многие реакции образования спирта, которые мы обсуждали выше. Если вы забыли один вариант, просто используйте другой.
Вот несколько интересных моделей и альтернатив, которые стоит рассмотреть.
-> Переходные реакции удлинения цепи
- Используйте алкины в Orgo 1 Используйте гриньяр или конденсат в Orgo 2
-> Добавление карбоновых кислот или карбонилов
-> «Перемещение» реактивности, чтобы вы могли начать / реагировать в другой части молекулы по сравнению с текущим положением активной группы.
Активные группы включают уходящие группы, пи-связи, уязвимые нуклеофильные центры и многое другое.
Вот некоторые из моих любимых трюков «перемещение реактивного местоположения»:
Это лишь НЕКОТОРЫЕ уловки, которые вы можете использовать.
Увеличение частичного кредита на экзамене
Получение бонусных баллов на экзаменах — это одно, но вот самое лучшее:
Средний вопрос синтеза оценивается в 10-30 баллов.
И средний профессор БУДЕТ давать частичную оценку.
Итак, если вы можете запомнить только четыре из пяти шагов, НЕ оставляйте поле пустым, чтобы получить ноль баллов!
Вместо этого напишите четыре шага и добавьте как можно больше релевантной информации.
Тогда ОЧЕНЬ УВЕРЕННО подделайте пятый шаг.
Не пишите «
Magic! »(да, я видел это на студенческом экзамене).Придумайте что-то, что кажется просто «небрежной» ошибкой. Ваш профессор будет впечатлен вашей работой и, надеюсь, даст вам 80% за вопрос.
Это касается и реагентов!
Если вы помните только шаги, но не помните, какие реагенты приведут вас к нужному результату, начните с рисования молекул:
У этого есть два преимущества:
Это помогает вам думать, не отвлекаясь, поэтому вы можете четко видеть, как молекула и функциональные группы изменяются / развиваются от шага к шагу. Теперь, когда у вас есть четкое представление о том, что вы делаете, вы можете вернуться к своим действиям и заполнить необходимые реагенты!
Конечно, если у вас с этим возникают проблемы с реагентами, вот видео о «запоминании» реагентов органической химии.
И если вы не можете их вспомнить, лучше ИЗОБРЕЙТЕ ЧТО-нибудь, а не оставляйте поле пустым. Попробуйте использовать реагент, содержащий группы, которые вы добавляете.

Например, если вы забудете, что алкин будет реагировать с HgSO4 в h4SO4 с образованием кетона,
, но вы ЗНАЕТЕ, что вы пытаетесь направить кислород в молекулу, добавить что-нибудь еще с кислородом. Например: O3 или KMnO4.
Они правы?
Не совсем!
Оба они расщепляют алкин.
НО, я видел достаточно студентов, которые использовали это как законную ошибку, и ваш профессор может подумать так же и, надеюсь, частично вам поверит.
Опять же, я не прошу вас изобретать на экзамене.
Но, угадав Логически в многоэтапной задаче, в которой вы уже заработали достаточно очков, поможет вам приблизиться к полному баллу.
Я успешно сдала это на экзаменах по орго и вышла на первое место в классе, несмотря на то, что пропустила полбалла то тут, то там по нескольким вопросам. Члены моего учебного зала и клиенты-репетиторы делают то же самое, чтобы выжать несколько дополнительных очков и вывести их на вершину.
Итог, убедитесь, что вы усвоили и ПОНИМАЕТЕ все необходимые реакции!
Но даже лучшие из нас забывают некоторые вещи под давлением.
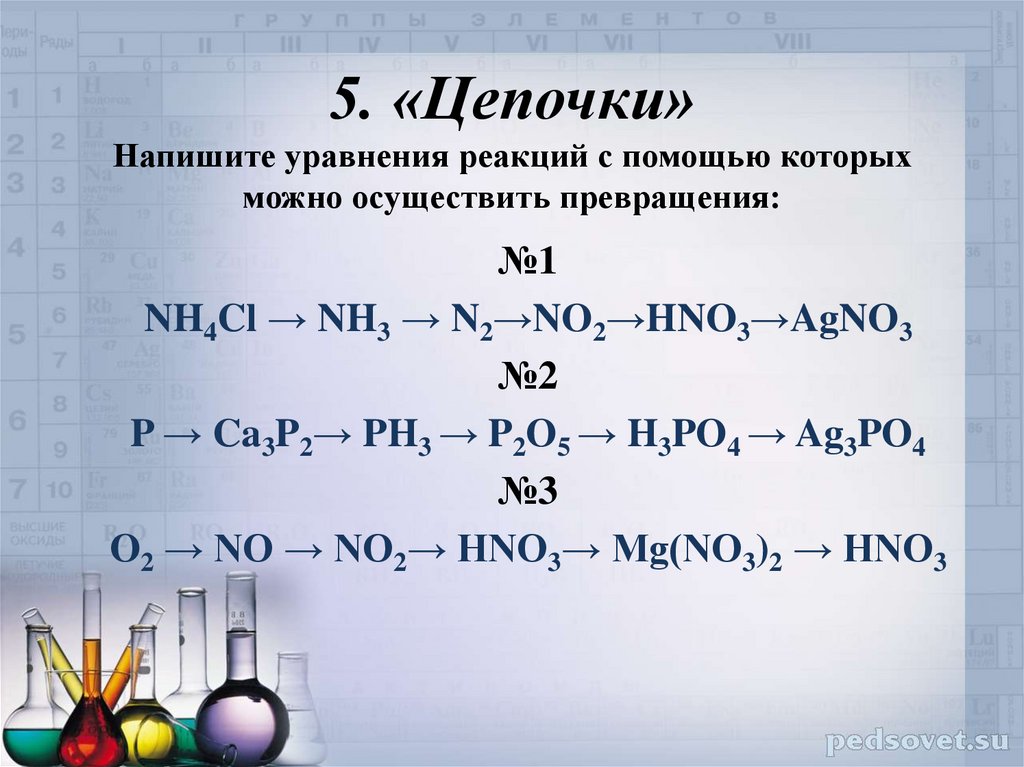
Вот когда вы можете воспользоваться приведенными выше советами, чтобы помочь вам максимально постараться, и у вас будет преимущество перед большинством профессоров. Мы надеемся, что они дадут вам возможность выразить сомнение, когда ответы будут сомнительными или не совсем то, что они искали.
Готовы начать думать задом наперед? Именно здесь вступает в игру более сложная тема ретросинтетического анализа или просто ретросинтеза.
Я хотел бы услышать от вас
Чувствуете ли вы себя лучше в синтезе и знании, что делать, когда вы застряли? Дайте мне знать в комментариях под
Учебное пособие по химии первичных алканаминов с прямой цепью ИЮПАК
Ключевые понятия
- Алканамины — это органические молекулы, содержащие только атомы углерода (C), водорода (H) и азота (N). Алканамины относятся к группе органических соединений, известных как амины. Амины — производные аммиака, NH 3 , в которых углеродные цепи заменяют атомы водорода. Первичные алканамины возникают, когда только один из атомов водорода в аммиаке заменен углеродной цепью.
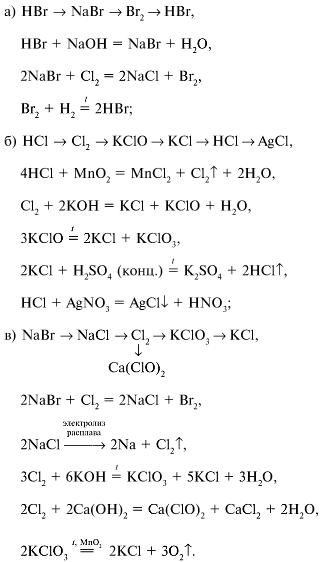
(i) префикс или основа
(название исходного углеводорода (алкановой цепи) без окончания «е», алкан ) (3)
(число, указывающее местонахождение функциональной группы NH 2 , — n — )
(последняя часть названия, амин )
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Структура и связь в первичных алканаминах с прямой цепью
Первичные алканамины — это амины и соединения, содержащие ТОЛЬКО атомы углерода, водорода и азота.
Первичные алканамины содержат функциональную группу NH 2 , известную как функциональная группа амина (или амино).
- Углерод принадлежит к 14 группе периодической таблицы.
Каждый атом углерода в первичной молекуле алканамина имеет 4 валентных электрона.
Каждый атом азота в первичной молекуле алканамина имеет 5 валентных электронов.
Обратите внимание, что на атом азота теперь приходится всего 7 валентных электронов.
Это означает, что неспаренный электрон может образовать пару с электроном другого атома, такого как углерод, для образования ковалентной связи.
R, R ‘и R «могут быть атомами водорода (H) или атомами углерода (C).
Этапы присвоения ИЮПАК наименования первичных алканаминов с прямой цепью
- Систематическое название IUPAC алкана — n-амина состоит из трех частей:
(i) префикс или основа (первая часть названия, название исходного алкана без окончания «е»): alkan
(ii) инфикс (число, указывающее расположение функциональной группы NH 2 ): — n —
(iii) суффикс (последняя часть названия, указывающая на присутствие функциональной группы NH 2 ): амин
Шаг 1: Определите самую длинную углеродную цепь, содержащую функциональную группу NH 2 (амино или амино).
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(Название исходного алкана без окончания «е»)
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Шаг 6: Напишите название первичного алканамина в виде префикса — infix — суффикс
Рабочий пример присвоения ИЮПАК названия первичного алканамина с прямой цепью: 1 атом углерода в цепи
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
Шаг 1: Определите самую длинную углеродную цепь, содержащую NH 2 (аминную или амино) функциональную группу.
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
Только 1 атом углерода в цепи, родительский углеводород — метан.
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
В алкановой цепи присутствует только 1 атом углерода, поэтому инфикс не требуется.
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Шаг 6: Напишите название первичного алканамина в виде префикса — infix — суффикс
Рабочий пример присвоения ИЮПАК названия первичных алканаминов с прямой цепью: цепь с двумя атомами углерода
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
| H | | H | | ||||
| H- | C | — | C | — | NH 2 |
| | H | | H |
Шаг 1: Определите самую длинную углеродную цепь, содержащую NH 2 (аминную или амино) функциональную группу.
| H | | H | | ||||
| H- | C | — | C | — | NH 2 |
| | H | | H |
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
2 атома углерода в цепи, поэтому исходным алканом является этан
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
| H | | H | | ||||
| H- | C 2 | — | C 1 | — | NH 2 |
| H | | H |
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
Присутствуют только 2 атома углерода, поэтому инфикс не требуется.
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Шаг 6: Напишите название первичного алканамина в виде префикса — infix — суффикс
Рабочий пример присвоения ИЮПАК названия первичных алканаминов с прямой цепью: цепь с 3 атомами углерода
Назовите показанный ниже первичный алканамин с прямой цепью, используя правила номенклатуры ИЮПАК:
| H | | H | | H | | |||||
| H- | C | — | C | — | C | — | NH 2 |
| H | | H | | H |
Шаг 1: Определите самую длинную углеродную цепь, содержащую NH 2 (аминную или амино) функциональную группу.
| H | | H | | H | | |||||
| H- | C | — | C | — | C | — | NH 2 |
| H | | H | | H |
Шаг 2: Определите префикс для названия первичного алканамина на основе количества атомов углерода в цепи.
(название исходного алкана без окончания «е»)
3 атома углерода в цепи, поэтому исходным алканом является пропан
Шаг 3: Пронумеруйте каждый атом углерода вдоль самой длинной углеродной цепи так, чтобы атом углерода, связанный с функциональной группой NH 2 (амино или амино), имел наименьшее возможное число.
| H | | H | | H | | |||||||||
| H- | C 3 | — | C 2 | — | C 1 | — | Nh4 | — | NH H | | H | | H |
Шаг 4: Определите инфикс для названия первичного алканамина, основываясь на расположении функциональной группы NH 2 (амино или амино).
Обратите внимание, что инфикс может не требоваться, если самая длинная углеродная цепь содержит только один или два атома углерода.
В цепи 3 атома углерода, поэтому требуется инфикс.
NH 2 Группа связана с углеродом 1
Шаг 5: Определите суффикс для названия первичного алканамина. Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Все первичные алканамины, содержащие одну функциональную группу NH 2 (амино или амино), оканчиваются на «амин».
Шаг 6: Напишите название первичного алканамина в виде префикса — infix — суффикс
Этапы построения структуры (4) первичных алканаминов с прямой цепью
Шаг 1: Разбейте систематическое название алкан-н-амина по ИЮПАК на три части:
| Алкан | -н- | Амин |
| Префикс | Инфикс | Суффикс |
Обратите внимание, что инфикс может отсутствовать, если родительская алкановая цепь содержит только 1 или 2 атома углерода.
Шаг 2: Определите количество атомов углерода в самой длинной углеродной цепи алкана, используя префикс.
Шаг 3: Нарисуйте цепочку атомов углерода необходимой длины, используя пунктирную линию, чтобы обозначить одну ковалентную связь между каждой парой атомов углерода.
Шаг 4: Нарисуйте пунктир вокруг каждого атома углерода в цепи так, чтобы каждый атом углерода образовывал 4 связи.
Шаг 5: Пронумеруйте атомы углерода в цепочке слева направо.
Шаг 6: Определите местоположение функциональной группы NH 2 (амин или амино) с помощью инфикса.
Мы знаем, что существует функциональная группа NH 2 , поскольку название молекулы имеет суффикс, амин (5) .
Шаг 7: Нарисуйте группу NH 2 в конце тире на угле с тем же номером, что и инфикс.
Шаг 8: Завершите структуру, поместив атом водорода (H) в конец всех пустых штрихов.
Рабочий пример построения структуры первичного алканамина с прямой цепью
Изобразите структуру первичного алканамина пропан-2-амина с прямой цепью (2-пропанамин).
Шаг 1: Разбейте систематическое название алкан-н-амина по ИЮПАК на три части:
| Алкан | -н- | Амин |
| Префикс | Инфикс | Суффикс |
| Пропан | -2- | Амин |
Шаг 2: Определите количество атомов углерода в самой длинной углеродной цепи алкана, используя префикс.
— пропан, следовательно, в цепочке 3 атома углерода.
Шаг 3: Нарисуйте цепочку атомов углерода необходимой длины, используя пунктирную линию, чтобы обозначить одну ковалентную связь между каждой парой атомов углерода.
Шаг 4: Нарисуйте пунктир вокруг каждого атома углерода в цепи так, чтобы каждый атом углерода образовывал 4 связи.
| | | | | | | ||||
| – | С | – | С | – | С | – |
| | | | | | |
Шаг 5: Пронумеруйте атомы углерода в цепочке слева направо.
| | | | | | | ||||
| – | С 1 | – | С 2 | – | С 3 | – |
| | | | | | |
Шаг 6: Определите местоположение функциональной группы NH 2 (амин или амино) с помощью инфикса.
Мы знаем, что существует функциональная группа NH 2 , поскольку название молекулы имеет суффикс, амин (5) .
Infix — это -2-, поэтому группа NH 2 связана с углеродным номером 2 в цепи.
Шаг 7: Нарисуйте группу NH 2 в конце тире на угле с тем же номером, что и инфикс.
| | | NH 2 | | | | ||||
| – | С 1 | – | С 2 | – | С 3 | – |
| | | | | | |
Шаг 8: Завершите структуру, поместив атом водорода (H) в конец всех пустых штрихов.
Шаги для написания молекулярной формулы первичных алканаминов с прямой цепью
Молекулярная формула сообщает нам количество атомов каждого элемента, присутствующего в молекуле соединения.
Для первичного алканамина с прямой цепью присутствуют только три элемента: углерод (C), водород (H) и азот (N).
При написании молекулярной формулы алканамина число атомов углерода записывается перед числом атомов водорода, которое записывается перед числом атомов кислорода, то есть C пишется перед H, который записывается перед N (6) :
Шаг 1: Изобразите структуру молекулы алкан-н-амина.
Шаг 2: Напишите скелетную молекулярную формулу, используя символы углерода (C), водорода (H) и азота (N).
Шаг 3: Подсчитайте количество атомов углерода в молекуле алканамина.
Шаг 4: Запишите количество атомов углерода в молекулярной формуле скелета в виде нижнего индекса справа от символа углерода (C).
Шаг 5: Подсчитайте количество атомов водорода в молекуле алканамина.
Шаг 6: Запишите количество атомов водорода в молекулярной формуле скелета в виде нижнего индекса справа от символа водорода (H).
Шаг 7: Подсчитайте количество атомов азота в молекуле алканамина.
Шаг 8: Запишите количество атомов азота в молекулярной формуле скелета в виде нижнего индекса справа от символа азота (N).
Примечание: если присутствует только одна аминогруппа (или амино, NH 2 ), количество атомов азота равно 1, и индекс 1 НЕ входит в молекулярную формулу.
Шаг 9: Убедитесь, что ваша завершенная молекулярная формула имеет смысл (для первичного алканамина с прямой цепью C n H 2n + 3 N)
Рабочий пример написания молекулярной формулы первичного алканамина с прямой цепью
Напишите молекулярную формулу бутан-2-амина (2-бутанамина).
Шаг 1: Изобразите структуру молекулы алкан-н-амина.
| H | H | |||||||
| \ | / | |||||||
| H | N | H | H | |||||
| | | | | | | | | |||||
| H- | С | – | С | – | С | – | С | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 2: Напишите скелетную молекулярную формулу, используя символы углерода (C), водорода (H) и азота (N).
Шаг 3: Подсчитайте количество атомов углерода в молекуле алканамина.
| H | H | |||||||
| \ | / | |||||||
| H | N | H | H | |||||
| | | | | | | | | |||||
| H- | С 1 | – | С 2 | – | С 3 | – | С 4 | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 4: Запишите количество атомов углерода в молекулярной формуле скелета в виде нижнего индекса справа от символа углерода (C).
Шаг 5: Подсчитайте количество атомов водорода в молекуле алканамина.
| H 1 | H 2 | |||||||
| \ | / | |||||||
| H 11 | N | H 3 | H 4 | |||||
| | | | | | | | | |||||
| 10 H- | С | – | С | – | С | – | С | -H 5 |
| | | | | | | | | |||||
| H 9 | H 8 | H 7 | H 6 |
Шаг 6: Запишите количество атомов водорода в молекулярной формуле скелета в виде нижнего индекса справа от символа водорода (H).
Шаг 7: Подсчитайте количество атомов азота в молекуле алканамина:
| H | H | |||||||
| \ | / | |||||||
| H | N 1 | H | H | |||||
| | | | | | | | | |||||
| H- | С | – | С | – | С | – | С | -H |
| | | | | | | | | |||||
| H | H | H | H |
Шаг 8: Запишите количество атомов азота в молекулярной формуле скелета в виде нижнего индекса справа от символа азота (N).
Примечание: если присутствует только одна аминогруппа (или амино, NH 2 ), количество атомов азота равно 1, и индекс 1 НЕ включается в молекулярную формулу.
В этой молекуле присутствует только 1 атом азота, поэтому индекс 1 в молекулярной формуле не требуется.
Молекулярная формула бутан-2-амина: C 4 H 11 N
Шаг 9: Убедитесь, что ваша завершенная молекулярная формула имеет смысл (C n H 2n + 3 N для первичных алканаминов)
N = количество атомов углерода = 4
Количество атомов водорода = 2 × n + 3 = 2 × 4 + 3 = 11
Количество атомов азота = 1
Таблица Суммэя: Молекулярная формула, структура и названия некоторых первичных алканаминов с прямой цепью по ИЮПАК
(1) Функциональная группа NH 2 в первичных аминах называется аминогруппой или аминогруппой.
Если функциональная группа NH 2 является единственной присутствующей функциональной группой или, если группа NH 2 является функциональной группой с наивысшим приоритетом, тогда молекула обозначается суффиксом амина.
Обратите внимание, что когда другая функциональная группа имеет приоритет над функциональной группой NH 2 , группа NH 2 тогда называется аминогруппой и становится префиксом.
(2) IUPAC — это аббревиатура Международного союза теоретической и прикладной химии.
Предпочтительное систематическое имя ИЮПАК является замещающим именем и помещает инфикс для локанта непосредственно перед той частью имени, к которой оно относится, за исключением случаев, когда предпочтительное имя ИЮПАК является традиционным сокращенным именем, и в этом случае инфикс помещается впереди имени.
Для простых первичных алканаминов, которые мы обсуждаем, допустима любая номенклатура, поскольку название в каждом случае однозначно.
Также часто встречаются амины, названные с использованием системы именования функциональных классов IUPAC, но это не предпочтительная номенклатура. В номенклатуре функциональных классов суффиксу «амин» предшествует название алкильной цепи, так что название имеет форму алкиламин.
Систематическое название ИЮПАК происходит от набора общих «правил», разработанных для обеспечения того, чтобы каждой органической молекуле можно было дать однозначное имя.
Правила наименования органических соединений все еще разрабатываются. Самый последний документ для направления — «Предпочтительные наименования в номенклатуре органических соединений» (проект от 7 октября 2004 г.).
(3) Мы рассматриваем алканамины с прямой цепью, а не диамины.
При названии диамина, например, сохраняется буква «е» исходного алкана, например этан-1,2-диамин НЕ этан-1,2-диамин.
(4) «Структура» здесь будет относиться к валентной структуре, которую можно использовать для представления двумерной структурной формулы.
После того, как вы нарисовали валентную структуру или двухмерную структурную формулу, вы можете использовать ее для рисования
Сжатая (полу) структурная формула
Или скелетная структура
(5) Мы знаем, что это первичный алканамин, потому что в названии нет локанта « N », следовательно, функциональная группа амина — NH 2 , а не NH или N.
(6) Молекулярная формула первичного алканамина с прямой цепью: C n H 2n + 3 N, в то время как часто используемый C n H 2n + 1 NH 2 , строго говоря, не молекулярная формула, но сжатая структурная формула.
Как сделать цепной шлем в Майнкрафт
В этом руководстве Minecraft объясняется, как создать цепной шлем, со скриншотами и пошаговыми инструкциями.
В Майнкрафте цепной шлем — это предмет брони, который нельзя сделать с помощью верстака или печи. Вместо этого вам нужно найти и собрать этот предмет в игре.
Давайте посмотрим, как добавить цепной шлем в свой инвентарь.
Поддерживаемые платформы
Цепной шлем доступен в следующих версиях Майнкрафт:
* Версия, в которой он был добавлен или удален, если применимо.
ПРИМЕЧАНИЕ. Pocket Edition (PE), Xbox One, PS4, Nintendo Switch и Windows 10 Edition теперь называются Bedrock Edition. Мы продолжим показывать их индивидуально для истории версий.
Где найти цепной шлем в творческом режиме
Определения
- Платформа — это применяемая платформа.
 Версия (и) — это номера версий Minecraft, где элемент можно найти в указанном месте меню ( мы протестировали и подтвердили этот номер версии ). Расположение меню «Креатив» — это расположение элемента в меню «Креатив».
Версия (и) — это номера версий Minecraft, где элемент можно найти в указанном месте меню ( мы протестировали и подтвердили этот номер версии ). Расположение меню «Креатив» — это расположение элемента в меню «Креатив».Как получить цепной шлем в режиме выживания
Вы можете добавить цепной шлем в свой инвентарь в режиме выживания, убив зомби, на котором он надет.
Если у вас возникли проблемы с поиском зомби в цепном шлеме, вы можете вызвать его с помощью нашего генератора призыва мобов.
Как только вы найдете зомби, вам нужно атаковать его. Когда вы атакуете зомби, он становится розовым, поскольку получает урон.
Продолжайте преследовать и атаковать зомби. После того, как вы убили зомби, с него может упасть броня, которую он носит.
Убедитесь, что вы подняли цепной шлем, прежде чем он исчезнет.
Цепной шлем — редкий предмет брони и должен храниться в вашем инвентаре.
Идентификатор и название предмета
Minecraft Java Edition (ПК / Mac)
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Java Edition (ПК / Mac) | 1.8 — 1,12 |
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | Java Edition (ПК / Mac) | 1,13 — 1,17 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Карманное издание (PE)
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Карманное издание (PE) | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Xbox One
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Xbox One | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт PS4
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | PS4 | 1.14.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Nintendo Switch
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Nintendo Switch | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Windows 10 Edition
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Windows 10 Edition | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Education Edition
В Minecraft цепной шлем имеет следующие Имя, ID и DataValue:
| Кольчужный шлем ( minecraft: кольчуга_ шлем ) | 302 | 0 | Education Edition | 1. 0 — 1.14.31 0 — 1.14.31 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Определения
- Описание — так называется элемент, а ( Minecraft ID Name) — строковое значение, которое используется в игровых командах. Minecraft ID — это внутренний номер предмета. Minecraft DataValue (или значение ущерба) определяет вариант блока, если для идентификатора Minecraft ID существует более одного типа. Платформа — это подходящая платформа. Версия (и) — это номера версий Minecraft, для которых действительны идентификатор и имя Minecraft.
Подать команду на цепной шлем
Дать команду в Minecraft Java Edition (ПК / Mac)
В Minecraft Java Edition (ПК / Mac) 1.13, 1.14, 1.15, 1.16, 1.16.4 и 1.17, команда / give для цепного шлема:
В Minecraft Java Edition (ПК / Mac) 1.8, 1.9, 1.10, 1.11 и 1.12 команда / give для цепного шлема:
Дайте команду в Minecraft Pocket Edition (PE)
В Minecraft Pocket Edition (PE) 0. 16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для кольчужного шлема:
16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для кольчужного шлема:
Дайте команду в Minecraft Xbox One
В Minecraft Xbox One 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100 / give command для цепного шлема:
Отдать команду в Minecraft PS4
В Minecraft PS4 1.14.0, 1.16.0 и 1.16.100 команда / give для Chain Helmet:
Отдать команду в Minecraft Nintendo Switch
В Minecraft Nintendo Switch 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепного шлема — :
Дайте команду в Minecraft Windows 10 Edition
В Minecraft Windows 10 Edition 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12. 0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепного шлема:
Дайте команду в Minecraft Education Edition
В Minecraft Education Edition 0. 14.2, 1.0, 1.0.18, 1.0.21, 1.4.0, 1.7.0, 1.9.0, 1.12.0, 1.12.60 и 1.14.31, команда / give для кольчужного шлема:
14.2, 1.0, 1.0.18, 1.0.21, 1.4.0, 1.7.0, 1.9.0, 1.12.0, 1.12.60 и 1.14.31, команда / give для кольчужного шлема:
Прочность
Прочность показывает, сколько прослужит предмет. Для инструментов, оружия и транспорта долговечность — это количество полезных действий до того, как предмет будет уничтожен. Для предметов брони долговечность — это количество ударов (которые могут быть заблокированы броней) до того, как предмет будет уничтожен. Таким образом, чем выше показатель прочности, тем дольше прослужит предмет.
В следующей таблице показана долговечность каждого шлема / кепки в Minecraft:
Чары для кольчужного шлема
В Майнкрафт цепной шлем можно зачаровать следующими чарами:
Определения
- Чары — так называется чары. Описание — это описание того, что делают чары.
См. Полный интерактивный список Minecraft Enchantments с возможностью поиска.
Что делать с цепным шлемом
Вот некоторые действия, которые вы можете делать с цепными шлемами в Minecraft:
Другая броня
В Майнкрафте можно сделать другую броню, например:
Как сделать цепные сапоги в Майнкрафт
В этом руководстве Minecraft объясняется, как создать цепные ботинки, со скриншотами и пошаговыми инструкциями.
В Minecraft цепные сапоги — это броня, которую нельзя изготовить с помощью верстака или печи. Вместо этого вам нужно найти и собрать этот предмет в игре.
Давайте посмотрим, как добавить цепные ботинки в свой инвентарь.
Поддерживаемые платформы
Chain boots доступны в следующих версиях Minecraft:
* Версия, в которой он был добавлен или удален, если применимо.
ПРИМЕЧАНИЕ. Pocket Edition (PE), Xbox One, PS4, Nintendo Switch и Windows 10 Edition теперь называются Bedrock Edition. Мы продолжим показывать их индивидуально для истории версий.
Где найти цепные сапоги в творческом режиме
Определения
- Платформа — это применяемая платформа. Версия (и) — это номера версий Minecraft, где элемент можно найти в указанном месте меню ( мы протестировали и подтвердили этот номер версии ). Расположение меню «Креатив» — это расположение элемента в меню «Креатив».
Как получить цепные ботинки в режиме выживания
Вы можете добавить цепные ботинки в свой инвентарь в режиме выживания, убив зомби, который носит их.
Если у вас возникли проблемы с поиском зомби в цепных ботинках, вы можете призвать его с помощью нашего генератора призыва мобов.
Как только вы найдете зомби, вам нужно атаковать его. Когда вы атакуете зомби, он становится розовым, поскольку получает урон.
Продолжайте преследовать и атаковать зомби. После того, как вы убили зомби, с него может упасть броня, которую он носит.
Убедитесь, что вы подняли цепочку, прежде чем она исчезнет.
Кольчужные сапоги — редкий предмет брони, и их следует держать в инвентаре.
Идентификатор и название предмета
Minecraft Java Edition (ПК / Mac)
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Java Edition (ПК / Mac) | 1.8 — 1,12 |
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | Java Edition (ПК / Mac) | 1,13 — 1,17 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Карманное издание (PE)
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Карманное издание (PE) | 0.16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Xbox One
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Xbox One | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт PS4
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | PS4 | 1.14.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Nintendo Switch
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Nintendo Switch | 1.6.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Майнкрафт Windows 10 Edition
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Windows 10 Edition | 0. 16.0 — 1.16.100 16.0 — 1.16.100 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Minecraft Education Edition
В Minecraft у цепных ботинок есть следующие Имя, ID и DataValue:
| Сапоги с цепочкой ( minecraft: кольчуга_ сапоги ) | 305 | 0 | Education Edition | 1.0 — 1.14.31 |
Ознакомьтесь с полным интерактивным списком идентификаторов Minecraft с возможностью поиска.
Определения
- Описание — так называется элемент, а ( Minecraft ID Name) — строковое значение, которое используется в игровых командах. Minecraft ID — это внутренний номер предмета. Minecraft DataValue (или значение ущерба) определяет вариант блока, если для идентификатора Minecraft ID существует более одного типа.
 Платформа — это подходящая платформа. Версия (и) — это номера версий Minecraft, для которых действительны идентификатор и имя Minecraft.
Платформа — это подходящая платформа. Версия (и) — это номера версий Minecraft, для которых действительны идентификатор и имя Minecraft.Подать команду на кольчужные сапоги
Дать команду в Minecraft Java Edition (ПК / Mac)
В Minecraft Java Edition (ПК / Mac) 1.13, 1.14, 1.15, 1.16, 1.16.4 и 1.17, команда / give для Chain Boots:
В Minecraft Java Edition (ПК / Mac) 1.8, 1.9, 1.10, 1.11 и 1.12 команда / give для Chain Boots:
Дайте команду в Minecraft Pocket Edition (PE)
В Minecraft Pocket Edition (PE) 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для цепных ботинок:
Дайте команду в Minecraft Xbox One
В Minecraft Xbox One 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100 / give command for Chain Boots:
Отдать команду в Minecraft PS4
В Minecraft PS4 1.14.0, 1.16. 0 и 1.16.100 команда / give для Chain Boots:
0 и 1.16.100 команда / give для Chain Boots:
Отдать команду в Minecraft Nintendo Switch
В Minecraft Nintendo Switch 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12.0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для Chain Boots: :
Дайте команду в Minecraft Windows 10 Edition
В Minecraft Windows 10 Edition 0.16.0, 1.0, 1.1, 1.2, 1.4.0, 1.5.0, 1.6.0, 1.7.0, 1.8.0, 1.9.0, 1.10.0, 1.11.0, 1.12. 0, 1.13.0, 1.14.0, 1.16.0 и 1.16.100, команда / give для Chain Boots:
Дайте команду в Minecraft Education Edition
В Minecraft Education Edition 0.14.2, 1.0, 1.0.18, 1.0.21, 1.4.0, 1.7.0, 1.9.0, 1.12.0, 1.12.60 и 1.14.31, команда / give для Chain Boots:
Прочность
Прочность показывает, сколько прослужит предмет. Для инструментов, оружия и транспорта долговечность — это количество полезных действий до того, как предмет будет уничтожен. Для предметов брони долговечность — это количество ударов (которые могут быть заблокированы броней) до того, как предмет будет уничтожен. Таким образом, чем выше показатель прочности, тем дольше прослужит предмет.
Таким образом, чем выше показатель прочности, тем дольше прослужит предмет.
В следующей таблице показана долговечность каждой пары ботинок в Minecraft:
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой Превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается Щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – h4PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Значит, для этой реакции подойдет фосфорная кислота – h4PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
1) Сложные эфиры могут вступать в реакции гидролиза. При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
Предложите разумный механизм для следующей реакции. Показать всех промежуточных звеньев и официальных сборов. Это реакция SN1 SN2 E1 E2?
6 Молекулярная формула первичного алканамина с прямой цепью C n H 2n 3 N, в то время как часто используемый C n H 2n 1 NH 2 , строго говоря, не молекулярная формула, но сжатая структурная формула.
Xn—96-5cd3cgu2f. xn--p1ai
17.08.2018 21:30:51
2017-12-24 22:56:36
Источники:
Https://xn—96-5cd3cgu2f. xn--p1ai/raznoe-2/kak-delat-czepochki-po-himii-kak-reshit-czepochku-po-himii. html
Уравнения реакций цепочки превращений (кальций — углерод — хлор) » /> » /> . keyword { color: red; }
keyword { color: red; }
Цепочка по химии
Этот цифровой объект представляет собой интерактивное задание на тему «Органическая химия», в котором нужно дать развернутый ответ на поставленный вопрос.
Размер ресурса: 170.4 кб, время скачивания: 128 Кбит/с — 11 cек., 256 Кбит/с — 6 cек., 2 Мбит/с — 1 cек.
Поддержка ресурса
- Тематическая подборка ЦОР по предметам Педагогическая мастерская Мастер-классы показать все
- Произведения искусства из собрания Государственной Третьяковской галереи Произведения искусства из собрания Государственного Русского музея показать все
Все ресурсы Коллекции предназначены только для некоммерческого использования в системе образования Российской Федерации. Свидетельство о регистрации средства массовой информации Эл ФС 77 — 47492 от 25.11.2011
При использовании материалов сайта ссылка на Единую коллекцию ЦОР обязательна.
Свидетельство о регистрации средства массовой информации Эл ФС 77 — 47492 от 25.
School-collection. edu. ru
20.11.2020 13:24:13
2020-11-20 13:24:13
Источники:
Http://school-collection. edu. ru/catalog/res/f76bf3de-8298-4730-27bb-12b55c399d26/?fullView=1
Практическая работа «Осуществление цепочки химических превращений»
Урок химии в 9 классе. «____»________________ 20____ г.
Практическая работа «Осуществление цепочки химических превращений»
Цель. Систематизировать знания учащихся о соединениях металлов.
Задачи.
Образовательные. На основании знаний о металлах и их кислородных соединений совершенствовать умения осуществлять цепочки превращений.
Развивающие. Развивать умения решать экспериментальные задачи, умения проводить лабораторные опыты, записывать уравнения химических реакций в молекулярном и ионном виде.
Воспитательные. Воспитание аккуратности при выполнении практических работ по ТБ; бережное отношение к реактивам.
Ход урока.
Орг. момент.
Выполнение практической работы. Работа выполняется в парах. Учащиеся выполняют задание 1, задание 2 (1 — по выбору учащихся)
Работа выполняется в парах. Учащиеся выполняют задание 1, задание 2 (1 — по выбору учащихся)
Инструкция к выполнению
Практическая работа № 1.
«Осуществление цепочки химических превращений»
Цель. _____________________________________________________________________________.
Оборудование и реактивы: гидроксид натрия, сульфат кальция, карбонат натрия, соляная кислота, нитрат серебра, сульфат цинка, сульфат меди(),пробирки, штатив для пробирок, стеклянная палочка, воронка, фильтровальная бумага, спиртовка, пробиркодержатель, спички.
ТБ: 1) аккуратно работать с реактивами и приборами;
2) не смешивать реактивы без согласования с заданием;
3) Использовать минимальные количества реактивов.
Ход работы.
Задание 1. Проверьте свою готовность к работе – выберите верные утверждения о правилах ТБ при работе в химической лаборатории.
А) пробирки с растворами солей нельзя нагревать в пламени спиртовки;
Б) вещества в лаборатории нельзя пробовать на вкус;
В) при попадании кислоты на кожу данный участок кожи необходимо промыть водой или раствором соды;
Г) работы с растворами солей проводят только в вытяжном шкафу;
Д) чтобы погасить пламя спиртовки, следует накрыть его колпачком.
Вариант 1.
Задание 2. Опытным путем проведите цепочку превращений: CaSO4 →CaCO3 → CaCl2 →AgCl
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
Вариант 2.
Задание 2. Опытным путем проведите цепочку превращений: CuSO4→ Cu(OH)2→ CuO →Cu
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
Вариант 3.
Задание 2. Опытным путем проведите цепочку превращений: ZnSO4 → Zn(OH)2 →ZnCl2
Na [Zn(OH)4]
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
СБОРНИК ическая химия. Цепочки химических превращенийматериал для подготовки к егэ (гиа) по химии (10, 11 класс) — Справочник
Цепочки превращений по углеводородам для подготовки к егэ
По теме: методические разработки, презентации и конспекты
Тестовое задание по химии по теме:»Строение и классификация органических соединений.
 Химические реакции в органической химии.»
Химические реакции в органической химии.»Тесты применяются для проверки знаний по теме Строение и классификация органических соединений. Химические реакции в органической химии.
Презентация «Химические превращения органических веществ»
Данная презентация успешно применяется мною на заключительном уроке по Углеводородам.
Презентация к уроку по химии «Предмет органической химии. Органические вещества. Теория химического строения органических веществ»
P Цели урока:Образовательные: P Сформировать представление о составе и строении органических соединений, их отличительных признаках. сформ.
Презентация «Предмет органической химии. Теория химического строения органических веществ» химия 9 класс
Презентация к уроку химии 9 класса «Предмет органической химии. Теория химического строения органических веществ» составлена к учебнику О. С.Габриеляна. Презентация содержит эпиграф, проверку эмоционал.
Типы химических реакций в органической химии.
 Взаимное влияние атомов в молекулах органических соединений (индуктивный и мезамерный эффекты). Механизмы реакций в органической химии. Задания и упражнения по теме.
Взаимное влияние атомов в молекулах органических соединений (индуктивный и мезамерный эффекты). Механизмы реакций в органической химии. Задания и упражнения по теме.Типы химических реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (индуктивный и мезамерный эффекты). Механизмы реакций в органической химии. Задания и упражнен.
Применение заданий на цепочки химических превращений для определения уровня обученности учащихся по химии
В статье на примере «цепочки превращения» железа и его соединений предлагается проверка уровня обученности выпускника средней школы. Предложенная схема превращений может быть также использ.
СБОРНИК ЕГЭ-21.Органическая химия. Цепочки химических превращений
В сборнике представлены цепочки химических превращений (упражнение 32 ЕГЭ-22).
Тестовое задание по химии по теме:»Строение и классификация органических соединений. Химические реакции в органической химии.»
Тесты применяются для проверки знаний по теме Строение и классификация органических соединений. Химические реакции в органической химии.
Химические реакции в органической химии.
Презентация «Химические превращения органических веществ»
Данная презентация успешно применяется мною на заключительном уроке по Углеводородам.
Презентация к уроку по химии «Предмет органической химии. Органические вещества. Теория химического строения органических веществ»
P Цели урока:Образовательные: P Сформировать представление о составе и строении органических соединений, их отличительных признаках. сформ.
Презентация «Предмет органической химии. Теория химического строения органических веществ» химия 9 класс
Презентация к уроку химии 9 класса «Предмет органической химии. Теория химического строения органических веществ» составлена к учебнику О. С.Габриеляна. Презентация содержит эпиграф, проверку эмоционал.
Типы химических реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (индуктивный и мезамерный эффекты). Механизмы реакций в органической химии.
 Задания и упражнения по теме.
Задания и упражнения по теме.Типы химических реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (индуктивный и мезамерный эффекты). Механизмы реакций в органической химии. Задания и упражнен.
Применение заданий на цепочки химических превращений для определения уровня обученности учащихся по химии
В статье на примере «цепочки превращения» железа и его соединений предлагается проверка уровня обученности выпускника средней школы. Предложенная схема превращений может быть также использ.
СБОРНИК ЕГЭ-21.Органическая химия. Цепочки химических превращений
В сборнике представлены цепочки химических превращений (упражнение 32 ЕГЭ-22).
Цепочки химических превращений.
Nsportal. ru
27.08.2017 15:12:16
2017-08-27 15:12:16
Источники:
Http://nsportal. ru/shkola/khimiya/library/2021/11/01/sbornik-ege-20-organicheskaya-himiya-tsepochki-himicheskih
Помогите! Напишите цепочку превращений между основными классами углеводородов. В цепочке — Школьные » /> » /> .keyword { color: red; }
В цепочке — Школьные » /> » /> .keyword { color: red; }
Цепочки превращений по углеводородам для подготовки к егэ
1. Можно взять бензоат натрия и получить бензол по р-ции Дюма,2. далее полученный бензол хлорировать под действием железа при нагревании ; 3. далее по реакции Вюрца-Фиттига получить толуол и 4. далее каталитическое окисление кислородом и получить бензойную кислоту, 5. далее пустить во взаимодействие с этиловым спиртом и получить сложный эфир : этиловый эфир бензойной кислоты. Реакции в файле. карбоциклические, ароматические соединения, арены ; производные аренов ;гомологи, ароматические карбоновые кислоты, сложные эфиры.
В цепочке должно быть 5 превращений.
Znanija. com
30.01.2018 8:09:36
2018-01-30 08:09:36
Источники:
Http://znanija. com/task/14555703
Цепочки превращений » /> » /> .keyword { color: red; }
Цепочки превращений по углеводородам для подготовки к егэ
В школьных учебниках, задачниках и на вступительных экзаменах в вузы часто встречаются цепочки химических превращений. Есть они и в блоке С (самый трудный блок!) контрольно-измерительных материалов единого государственного экзамена (ЕГЭ) по химии. Они позволяют проверить усвоение учащимися способов получения и свойств веществ, а также общее знание химии.
Есть они и в блоке С (самый трудный блок!) контрольно-измерительных материалов единого государственного экзамена (ЕГЭ) по химии. Они позволяют проверить усвоение учащимися способов получения и свойств веществ, а также общее знание химии.
Задания подобных видов Вы встретите в контрольных задачах.
Пример 11. Назовите промежуточные продукты в следующей схеме превращений:
Этиловый спирт X Y Z
Бутадиен-1,3.
Напишите уравнения всех реакций.
Решение. В данной цепи превращений, включающей 4 реакции, из этилового спирта С2Н5ОН должен быть получен бутадиен-1,3 СН2=СН–СН=СН2.
1. При нагревании спиртов с концентрированной серной кислотой h3SO4 (водоотнимающее средство) происходит их дегидратация с образованием алкена. Отщепление воды от этилового спирта приводит к образованию этилена:
СН3–СН2–ОН СН2=СН2 + Н2О
Таким образом, вещество Х, образующееся при дегидратации этилового спирта и способное прореагировать с НBr, является этиленом СН2=СН2.
2. Этилен – представитель алкенов. Являясь ненасыщенным соединением, он способен вступать в реакции присоединения. В результате гидробромирования этилена образуется бромэтан СН3–СН2–Br (вещество Y):
3. При нагревании бромэтана в присутствии металлического натрия (реакция Вюрца) образуется бутан (вещество Z):
4. Дегидрирование бутана в присутствии катализатора – один из способов получения бутадиена-1,3 СН2=СН–СН=СН2.
Ответ: X – этилен СН2=СН2; Y – бромэтан СН3–СН2–Br;
Литература
1. Кан Р., Дермер О. Введение в химическую номенклатуру: Пер. с англ. / Под ред. В. М. Потапова и Р. А. Лидина. – М.: Химия, 1983.
2. Потапов В. М., Татаринчик С. Н. Органическая химия: Учебник. – М.: Химия, 1989.
3. Жиряков В. Г. Органическая химия. – М.: Химия, 1978.
4. Органическая химия: Учебник / С. Э. Зурабян, Ю. А. Колесник, А. А. Кост и др. / Под ред. Н. А. Тюкавкиной. – М.: Медицина, 1989.
5. Ардашникова Е. И. , Казеннова Н. Б., Тамм М. Е. Курс органической химии для старшеклассников и поступающих в вузы. – М.: Аквариум, 1998.
, Казеннова Н. Б., Тамм М. Е. Курс органической химии для старшеклассников и поступающих в вузы. – М.: Аквариум, 1998.
6. Лисин А. Ф., Ахметов М. А. Органическая химия: Учебное пособие для старших классов средних школ. – Ульяновск: «Симбирская книга», 1995.
2. Оганесян Э. Т. Руководство по химии поступающим в вузы: Справ. пособие. – М.: Высшая школа, 1991.
3. Хомченко Г. П. Химия для поступающих в вузы: Учебное пособие. – М.: Высшая школа, 1994.
4. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: В 2-х т. – М.: Экзамен: Издательский дом «ОНИКС 21 век», 2001.
5. Химия. Пособие для поступающих в вузы: Как ответить на наиболее трудные вопросы? / Сост. Т. Я. Ашихмина, Е. В. Береснева, М. А. Зайцев, А. С. Ярмоленко, В. П. Исупов, И. В. Горева. – Киров: ВятГГУ, 2003.
6. Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в ВУЗы. – М.: «Издательство Новая Волна», 1998.
СН3–СН2–ОН СН2=СН2 + Н2О
бутадиен-1,3.
Аквариум, 1998.
Studfile. net
16.08.2019 6:04:01
2019-08-16 06:04:01
Источники:
Http://studfile. net/preview/3538752/page:9/
Университетские субботы | Томский политехнический университет
В этом году для учащихся будут проведены занятия
по физике, химии, математике.
Занятия для учеников 9-х и 11-х классов будут проходить в очном и дистанционном форматах.
Для участия необходимо пройти регистрацию
по ссылкам:РЕГИСТРАЦИЯ НА ФИЗИКУ
РЕГИСТРАЦИЯ НА ХИМИЮ
РЕГИСТРАЦИЯ НА МАТЕМАТИКУ
Ссылка на онлайн-трансляцию будет отправлена на электронную почту зарегистрировавшихся участников за день до мероприятия.
Расписание занятий на 2022 год:
*возможны изменения в расписании и формате проведения мероприятий
| Предмет, тема | Дата, время | 9 класс | 11 класс | Место проведения | |
ФИЗИКА |
https://youtu. https://youtu.be/oVmsYQCD_mc (11 кл.) | 29.01.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна | Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) |
https://youtu.be/YToZpJkc6-0 (9 кл.) https://youtu.be/UPELFjk1K-Q (11 кл.) | 05.02.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна | Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) | |
https://youtu. (9 кл.) https://youtu.be/NA5ofTzkCiQ (11 кл.)
| 12.02.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна | Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) | |
(9 кл.) https://youtu.be/cyBbhkp26Pw (11 кл.) | 19.02.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна
| Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) | |
https://youtu. (9 кл.) https://youtu.be/TbKs00ab4c8 (11 кл.) | 26.02.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна | Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) | |
(9 кл.) https://youtu.be/FWkT41QUa4g (11 кл.) | 05.03.2022 16:30-18:00 | Никитина Лариса Николаевна Пак Виктория Вячеславовна | Постникова Екатерина Ивановна Лисичко Елена Владимировна | 215 ауд. 3корпус (9кл.)/ 210 ауд. 3корпус (11кл.) | |
ХИМИЯ |
https://youtu.be/cdlS3pFyO_g (11 кл.) | 29.01.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин
| 9 класс 211 ауд. 2 корпус/ 11 класс 204 ауд. Главный корпус |
https://youtu.be/L4hmLHPg4ds (11 кл.) | 05.02.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин | 9 класс 211 ауд. 2 корпус/ 11 класс 204 ауд. Главный корпус | |
https://youtu.be/zIMY0nfmLa0 (11 кл. | 12.02.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин | 9 класс 211 ауд. 2 корпус/ 11 класс 204 ауд. Главный корпус | |
https://youtu.be/oMex3DwSJPA (11 кл.) | 19.02.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин | 9 класс 211 ауд. 2 корпус/ 11 класс 204 ауд. Главный корпус | |
https://youtu.be/DNG1sb5lA_Q (11 кл.) | 26.02.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин | 9 класс 211 ауд. 11 класс 204 ауд. Главный корпус | |
https://youtu.be/Bdz7HDH9BCo (11 кл.) | 05.03.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Осипова | Чумерин | 9 класс 211 ауд. 2 корпус/ 11 класс 204 ауд. Главный корпус | |
МАТЕМАТИКА |
| 12.03.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. 11 класс 204 ауд. Главный корпус |
| 19.03.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. Главный корпус/ 11 класс 204 ауд. Главный корпус | |
| 26.03.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. Главный корпус/ 11 класс 204 ауд. Главный корпус | |
| 02.04.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. Главный корпус/ 11 класс 204 ауд. Главный корпус | |
| 09.04.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. Главный корпус/ 11 класс 204 ауд. Главный корпус | |
| 16.04.2022 9 класс 16:30-18:00 11 класс 15:00-16:30 | Глазырина Елена Дмитриевна | Чумерин Денис Сергеевич | 9 класс 234 ауд. Главный корпус/ 11 класс 204 ауд. Главный корпус | |
Химия: уроки, тесты, задания.
- Предметы
-
-
Предмет химии
-
Физические тела и вещества
-
Чистые вещества и их смеси
-
Разделение смесей.
 Методы очистки веществ
Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Отличия простых и сложных веществ
-
Валентность.
 Степень окисления. Составление формул по валентностям и степеням окисления
Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ в химических реакциях
-
Уравнения химических реакций
-
-
-
Классификация веществ
-
Оксиды: классификация, свойства, получение
-
Основания: классификация, свойства, получение
-
Кислоты: состав, свойства, получение
-
Амфотерные гидроксиды
-
Соли: состав и свойства
-
Взаимосвязь между классами неорганических веществ
-
-
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
-
-
-
Электроотрицательность
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
-
-
-
Степени окисления элементов
-
Окислители и восстановители, окисление и восстановление
-
-
-
Состав растворов
-
Растворение.
 Растворимость
Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов.
 Индикаторы
Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
-
Обнаружение ионов
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
-
-
-
Методы научного познания.
 Химический эксперимент
Химический эксперимент
-
Методы получения, собирания и распознавания газов
-
-
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
-
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции.
 Катализаторы
Катализаторы
-
-
-
Неметаллы
-
Свойства водорода
-
Свойства кислорода
-
Вода
-
Галогены.
 Хлор и его соединения
Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор. Соединения фосфора
-
Углерод.
 Соединения углерода
Соединения углерода
-
Кремний. Соединения кремния
-
-
-
Металлы
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
-
-
-
Состав и строение органических веществ
-
Углеводороды.
 Полимеры
Полимеры
-
Одноатомные и многоатомные спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы: классификация и свойства
-
Белки
-
-
-
Природные источники углеводородов
-
Химия и пища.
 Химия и здоровье
Химия и здоровье
-
-
-
Предмет органической химии. Теория химического строения органических веществ А. М. Бутлерова
-
Состояние электронов в атоме; s-, p-орбитали. Электронная конфигурация атома
-
Химическая связь в органических соединениях
-
Классификация органических веществ
-
Изомерия.
 Изомеры
Изомеры
-
-
-
Алканы: метан и его гомологи
-
Алканы: изомерия, номенклатура
-
Алканы: физические и химические свойства, получение и применение
-
Алкены: этилен и его гомологи
-
Алкены: структурная и пространственная изомерия; номенклатура
-
Алкены: физические и химические свойства
-
Алкены: получение и применение
-
Алкадиены
-
Алкины: ацетилен и его гомологи
-
Алкины: свойства, получение, применение
-
Арены: бензол и его гомологи
-
Арены: свойства, получение и применение
-
Углеводороды в природе
-
Переработка нефти и охрана окружающей среды
-
Предельные, непредельные и ароматические углеводороды
-
-
-
Насыщенные одноатомные спирты.
 Метанол. Этанол
Метанол. Этанол
-
Свойства, получение и применение насыщенных одноатомных спиртов
-
Многоатомные спирты. Этиленгликоль, глицерин
-
Ароматические спирты. Фенол
-
Углеводороды, спирты и фенолы
-
-
-
Альдегиды и кетоны
-
Метаналь и этаналь: свойства, получение, применение
-
Карбоновые кислоты.
 Карбоксильная группа
Карбоксильная группа
-
Свойства, получение и применение насыщенных одноосновных карбоновых кислот
-
Углеводороды, спирты, альдегиды, карбоновые кислоты
-
-
-
Строение и свойства сложных эфиров
-
Жиры
-
Мыла.
 СМС
СМС
-
-
-
Классификация углеводов
-
Глюкоза и фруктоза
-
Сахароза
-
Крахмал.
 Целлюлоза
Целлюлоза
-
-
-
Амины — производные аммиака. Насыщенные амины
-
Ароматические амины. Анилин
-
Аминокислоты — амфотерные соединения
-
Строение, свойства и значение белков
-
Азотсодержащие гетероциклы
-
Нуклеиновые кислоты (ДНК, РНК)
-
-
-
Основные понятия ВМС.
 Реакции полимеризации и поликонденсации
Реакции полимеризации и поликонденсации
-
Классификация и практическое использование полимеров
-
Классификация и практическое использование волокон
-
-
-
Вывод молекулярной формулы по плотности и массовой доле химического элемента
-
Вывод молекулярной формулы по продуктам сгорания
-
-
-
Основные понятия химии
-
Основные законы химии
-
Современная модель строения атома
-
Состояние и распределение электронов в атоме; d-орбитали
-
Валентные возможности атомов
-
Закономерности изменения свойств элементов и их соединений по периодам и А-группам
-
Характеристика химического элемента по его положению в периодической системе и строению атома
-
-
-
Электронная природа и типы химической связи.
 Электроотрицательность
Электроотрицательность
-
Ковалентная связь. Неполярная ковалентная связь
-
Ковалентная полярная связь. Механизмы образования ковалентной связи
-
Ионная связь. Металлическая связь
-
Межмолекулярное взаимодействие.
 Водородная связь
Водородная связь
-
Типы кристаллических решёток
-
Зависимость физических свойств веществ от типа кристаллической решётки
-
Ответы на контрольную работу по теме «Органические вещества»(Габриелян) решебник
Первый уровень
Вариант 1
ЗАДАНИЕ 1
Даны формулы веществ:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества А и Ж.
Напишите структурные формулы веществ Б и 3.
А спирты. Метанол
Б алканы. СН3-СН2-СН3
В алкены
Г углеводы
Д аминокислоты
Е арены
Ж альдегиды. Этаналь
З карбоновые кислоты
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН3—СН2—СН3 → СН2=СН—СН3 → СО2.
Назовите все вещества в цепочке.
СН3-СН2-СН3 → СН2=СН-СН3 + Н2 (пропан – пропен)
2СН2=СН-СН3 + 9О2→ 6СО2 + 6Н2О (пропен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу уксусной кислоты. Опишите применение этого вещества в быту и промышленности.
СН3СООН
Применение в промышленности. Растворитель при производстве лаков, красок; реагент для получения сложных эфиров. Используется для переведения целлюлозы в раствор (получение ацетата целлюлозы) , для растворения некоторых полимеров (например, хитозана) ; в орг. синтезе. В пищевой промышленности – добавка Е260 – консервант. Можно использовать для получения уксусного ангидрида, который используется в орг синтезе. Также для приготовления буферных растворов (уксусный буфер) или просто для подкисления среды.
Также для приготовления буферных растворов (уксусный буфер) или просто для подкисления среды.
Применение в быту. Столовый уксус – 9%, уксусная эссенция – 80%. В малых количествах приправа к блюдам. Также для дезинфекции, удаления накипи с чайника; как очищающее средство, для создания запаха.
Вариант 2
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества Б и Е.
Напишите структурные формулы веществ Б и Ж.
А алкины
Н-С≡С-Н
Б алканы, метан
В спирты
Г альдегиды
Д сл.эфиры
Е алкены, этилен
Ж алканы
З карбоновые кислоты
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: СН3—СН2—ОН → СН2=СН2 → С02.
Назовите все вещества в цепочке.
1.
2. С2Н4 + 3О2 = 2СО2 + 2Н2О (этилен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этилового спирта. Опишите применение этого вещества в быту и промышленности.
С2H5OH
Применение:
Топливо; сырьё для получения многих химических веществ, растворитель, компонент антифризов и стеклоомывателей; в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой; в медицине – антисептик, растворитель, консервант, противоядие и др. В быту: наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Применяется для фиксирования и консервирования биологических препаратов.
Вариант 3
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества Г и Е.
Напишите структурные формулы веществ А и Д.
А алканы
Б алкины
В многоатомные спирты
Г карбоновые кислоты, уксусная кислота
Д алкены
Е спирты, этанол
Ж полиолефины
З алканы
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н4 —> С2Н6 —> С2Н5Сl.
Назовите все вещества в цепочке.
С2Н4 + Н2 → С2Н6 (этилен – этан)
Ch4Ch4+Cl2→Ch4Ch3Cl +HCl (этан – хлорэтан)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу пропана. Опишите применение этого вещества в быту и промышленности.
C3H8
Топливо
При выполнении газопламенных работ на заводах и предприятиях:
в заготовительном производстве;
для резки металлолома;
для сварки неответственных металлоконструкций.
При кровельных работах.
При дорожных работах для разогрева битума и асфальта.
В качестве топлива для переносных электрогенераторов.
Для обогрева производственных помещений в строительстве.
Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
Для газовых плит, водогрейных колонок в пищевой промышленности.
В быту:
при приготовлении пищи в домашних и походных условиях;
для подогрева воды;
для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
В химической промышленности используется для получения пропилена, сырья для производства полипропилена.
Является исходным сырьём для производства растворителей.
В пищевой промышленности пропан зарегистрирован в качестве пищевой добавки E944.
Хладагент.
Вариант 4
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества А и Г.
Напишите структурные формулы веществ А и Г.
А алканы, пентан
Б многоатомные спирты
В алкены
Г спирты, метанол
Д альдегиды
Е сложные эфиры
Ж карбоновые кислоты
З алкены
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н5ОН → СН2=СН2 → хлорэтан.
Назовите все вещества в цепочке.
C2h5+HCl→C2H5Cl (этилен – хлорэтан)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу ацетилена. Опишите применение этого вещества в быту и промышленности.
Опишите применение этого вещества в быту и промышленности.
Структурная формула ацетилена H–C≡C–H
Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и 1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
Второй уровень
Вариант 1
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ А и 3.
А спирты, метанол
Б алканы, пропан
В алкены, пропен
Г углеводы, сахароза
Д аминокислоты, глицин
Е арены, бензол
Ж альдегиды, этаналь
З карбоновые кислоты, уксусная кислота
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
Назовите все вещества в цепочке.
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этилена. Опишите применение этого вещества в быту и промышленности.
C2Н4
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена Этилен – исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел. Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Вариант 2
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ В и Д.
А алкины, ацетилен
Б алканы, метан
В спирты, этанол
Г альдегиды, метаналь
Ж сл.эфиры, метилэтаноат
Е алкены, этилен
Ж углеводы, глюкозы
З карбоновые кислоты, муравьиная (метановая)
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
Ch4CHO+h3 (температура, Ni) -> Ch4Ch3OH (этанол)
5C2H5OH + 4KMnO4 + 6h3SO4 → 5Ch4COOH (уксусная кислота) + 2K2SO4 + 4MnSO4 + 11h3O
Ch4COOH + NaOH → Ch4COONa (ацетат натрия)+ h3O
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этиленгликоля. Опишите применение этого вещества в быту и промышленности.
HO—CH₂—CH₂—OH
Этиленгликоль – для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время) В производстве целлофана, полиуретанов и ряда других полимеров. Как растворитель красящих веществ;
Как растворитель красящих веществ;
В органическом синтезе. Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля. Этиленгликоль также применяется: при производстве конденсаторов, при производстве 1,4-диоксана, как теплоноситель в системах чиллер-фанкойл, в качестве компонента крема для обуви (1—2 %), в составе для мытья стёкол вместе с изопропиловым спиртом.
Вариант 3
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ Е и 3.
А алканы, этан
Б алкины, ацетилен
В многоатомные спирты, этиленгликоль
Г карбоновые кислоты, уксусная кислота
Д алкены, этилен
Е спирты, этанол
Ж полиолефины, полиэтилен
З алканы
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН≡СН→ СН2=СН2→ С2Н5ОН→ СО2.
Укажите условия протекания реакций. Назовите все вещества в цепочке.
Назовите все вещества в цепочке.
СН≡СН + Н2 (платина, темп.) →СН2=СН2 (ацетилен – этилен)
Ch3=Ch3 + h3O t,h4PO4→ Ch4-Ch3-OH (этанол – этиловый спирт)
C2H5OH+3O2(горение) =3h3O+2CO2 (этанол – вода и углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу сахарозы. Опишите применение этого вещества в быту и промышленности.
С12Н22О11
Сахароза находит многочисленное применение и в первую очередь как пищевой продукт — сахар. Она также служит в качестве исходного вещества в различных ферментационных процессах получения этилового спирта, глицерина, лимонной кислоты. Применяется также для изготовления лекарств.
Вариант 4
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ Д и 3.
А алканы, пентан
Б многоатомные спирты, глицерин
В алкены, бутен-1
Г спирты, метанол
Д альдегиды, этаналь
Е сл. эфиры, этилэтаноат (этилацетат)
эфиры, этилэтаноат (этилацетат)
Ж высшие карбоновые кислоты, стеариновая кислота
З алканы, пропен
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н5ОН→ Ch4COH→ СН3СООН→ Ch4COONa.
Укажите условия протекания реакций. Назовите все вещества в цепочке.
Ch4-CHО + KMnO4 + h3SO4 = Ch4-COOH + MnSO4+ K2SO4 + h3O (ацетальдегид – уксусная кислота)
Ch4COOH + NaOH → Ch4COONa (ацетат натрия)+ h3O
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу муравьиного альдегида. Опишите применение этого вещества в быту и промышленности.
СН2О метаналь, применяется в качестве дубителя в кожевенном производстве и дубления желатина при производстве кинофотоплёнки. Из-за сильного дубящего эффекта формальдегид является также сильным антисептиком, это свойство формалина используется в медицине (формидрон и подобные препараты) и для консервации биологических материалов (создание анатомических и других препаратов). Водный раствор формальдегида (метандиол), стабилизированный карбамидом, — КФК — является одним из важнейших источников формальдегида и карбамида в производстве карбамидоформальдегидных, меламинокарбамидоформальдегидных смол и для обработки карбамида против слеживаемости; применяется в деревообрабатывающей и мебельной промышленности для производства фанеры, ДСП и т. д.
Водный раствор формальдегида (метандиол), стабилизированный карбамидом, — КФК — является одним из важнейших источников формальдегида и карбамида в производстве карбамидоформальдегидных, меламинокарбамидоформальдегидных смол и для обработки карбамида против слеживаемости; применяется в деревообрабатывающей и мебельной промышленности для производства фанеры, ДСП и т. д.
Основная часть формальдегида идёт на изготовление полимеров-реактопластов (фенолформальдегидные, карбамидформальдегидные и меламинформальдегидные смолы), он широко используется также в промышленном органическом синтезе (пентаэритрит, триметилолпропан и т. д.). В пищевой промышленности зарегистрирован под кодом E240. Допускается применение формальдегида в качестве консерванта в количестве до 0,1 % в составе косметических средств, предназначенных для гигиены полости рта, и до 0,2 % в прочих косметических препаратах.
Третий уровень
Вариант 1
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ Б и Ж.
А спирты, метанол
Б алканы, пропан. Гомологи:
В аминокислоты, глицин (аминоуксусная кислота)
Г арены, бензол
Д алкены, пропен
Е дисахариды, сахароза
Ж альдегиды, этаналь
З карбоновые кислоты, уксусная кислота
Гомологи:
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН4→ С02→ С6Н1206 → СН3—СН2—ОН→ СН2=СН2.
Назовите все вещества в цепочке. Укажите условия проведения реакций.
Ch5+2O2(горение)=CO2+2h3O (метан – углекислый газ)
6CO2 + 6h3O hν, хлорофилл → C6h22O6 + 6O2 (углекислый газ и вода – глюкоза и кислород)
C6h22O6 дрожжи → 2C2H5OH + 2CO2↑(глюкоза – этанол)
Ch4Ch3OH ⇄ Ch3=Ch3 + h3O (При сильном нагревании этанола с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия – дегидратация, обр.этилена).
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу глицерина. Опишите применение этого вещества в быту и промышленности.
Опишите применение этого вещества в быту и промышленности.
HOCh3-СH(OH)-Ch3OH
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Вариант 2
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ А и Г.
А алкины, ацетилен
Гомологи:
Пропин
Бутин-1
Б алканы, метан
В спирты, этанол
Г альдегиды, метаналь
Гомологи:
Этаналь
Пропаналь
Д сл.эфиры, метилэтаноат(метилацетат)
Е алкены, этилен
Ж углеводы, глюкоза
З карбоновые кислоты, муравьиная (метановая) кислота.
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку следующих превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
Ch4-CHО + KMnO4 + h3SO4 = Ch4-COOH + MnSO4+ K2SO4 + h3O (ацетальдегид – уксусная кислота)
Ch4-COOH + Cl2 (Уф-облучение) = HCl + Ch3Cl-COOH
Ch3Cl-COOH + Nh4 (газ) = HCl + Ch3(Nh3)-COOH (глицин, или аминоуксусная кислота)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу глюкозы. Опишите применение этого вещества в быту и промышленности.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6h22O6 + 6O2 → 6h3O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Вариант 3
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ Е и 3.
А алканы, этан
Б алкины, ацетилен
В многатомные спирты, этиленгликоль
Г карбоновые кислоты, уксусная кислота
Д алкены, этилен
Е спирты, этанол
Гомологи:
Метанол
Пропанол
Ж полиолефины, полиэтилен
З алканы, бутан.
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку следующих превращений:
С6Н12О6 → С2Н5ОН→ С2Н4→ С2Н2 → СО2.
Назовите все вещества в цепочке. Укажите условия протекания реакций.
C6h22O6 дрожжи → 2C2H5OH + 2CO2↑(глюкоза – этанол и углекислый газ)
Ch4Ch3OH ⇄ Ch3=Ch3 + h3O (При сильном нагревании этанола с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия – дегидратация, обр. этилена)
этилена)
C2h5 -> (t, Ni) -> C2h3 + h3 (этилен – ацетилен)
2СН ≡ СН + 5О2 горение→ 4СО2 + 2Н2О (ацетилен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу крахмала. Опишите применение этого вещества в быту и промышленности.
В пищевой промышленности крахмал используется для получения глюкозы, патоки, этанола, в текстильной — для обработки тканей, в бумажной — в качестве наполнителя. Кроме того, крахмал входит в состав большинства колбас, майонеза, кетчупа и пр. В мире наибольшее применение крахмал нашёл в целлюлозно-бумажной промышленности, насчитывая миллионы метрических тонн ежегодно. Модифицированный крахмал является основным компонентом клея для обоев. Применяется в фармацевтической промышленности в качестве наполнителя таблетированных форм лекарственных препаратов, некоторых лекарственных капсул, декстраны (декстрины) используются для приготовления ряда инфузионных растворов для внутривенных вливаний (гемодез, полиглюкин, реополиглюкин и т. д.).
д.).
Крахмал используется для накрахмаливания предметов одежды: воротников, халатов и т. д. Крахмальный клейстер применяется для приклеивания обоев, изготовления папье-маше. Иногда крахмал используется в качестве присыпок.
Вариант 4
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ А и Г.
А алканы, пентан
Гомологи:
Б многоатомные спирты, глицерин
В алкены, бутен-1
Г спирты, метанол
Гомологи:
Д альдегиды, этаналь
Е сл.эфиры, этилацетат
Ж карбоновые кислоты, стеариновая кислота
З алкены, пропен
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СаС2→ С2Н2→ С2Н4→ С2Н5ОН → С02.
Назовите все вещества в цепочке. Укажите условия протекания реакций.
CaC2 + 2h3O → Ca(OH)2 + C2h3 (карбид кальция – ацетилен)
СН≡СН + Н2 (платина, темпер. )→СН2=СН2 (ацетилен – этилен)
)→СН2=СН2 (ацетилен – этилен)
Ch3=Ch3 + h3O (h3SO4)→ C2H5OH (этилен – этанол)
C2H5OH + 3O2→2CO2+3 h3O горение этанола
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу уксусной кислоты. Опишите применение этого вещества в быту и в промышленности.
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-9 % – уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности – окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей.Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги. Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Клод-Луи Бертолле Вильгельм Оствальд Анри-Луи Ле Шателье Сэр Дерек Х. Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции окислительно-восстановительная реакция ионообменная реакция фотохимическая реакция
Просмотреть весь связанный контент →
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.
 Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения. - Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разрушены, а атомы или части молекул снова собираются в продукты путем образования новых связей. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочные реакции
Узнать о кислотно-щелочных реакциях.
окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.Сводка
Прочтите краткий обзор этой темы
химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, выплавка железа, изготовление стекла и керамики, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции возникла примерно 250 лет назад. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ), Лавуазье определил 33 «элемента» — субстанции, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Подписаться сейчас
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций. Сегодня экспериментальная химия дает бесчисленное множество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия о химических реакциях
Создавая новое вещество из других веществ, химики говорят, что либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются, образуя сульфид железа (FeS). Fe(s) + S(s) → FeS(s) Знак плюс указывает на то, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Вещественное состояние реагентов и продуктов обозначается символами (s) для твердых тел, (l) для жидкостей и (g) для газов.
4.1 Энергия и обмен веществ – концепции биологии – 1-е канадское издание
Перейти к содержанию
Глава 4. Введение в то, как клетки получают энергию
Введение в то, как клетки получают энергию
Цели обучения
К концу этого раздела вы сможете:
- Объяснять, что такое метаболические пути
- Назовите первый и второй законы термодинамики
- Объясните разницу между кинетической и потенциальной энергией
- Опишите эндергонические и экзергонические реакции
- Обсудите, как ферменты функционируют как молекулярные катализаторы
Посмотрите видео о гетеротрофах.
Ученые используют термин биоэнергетика для описания концепции потока энергии (рис. 4.2) через живые системы, такие как клетки. Клеточные процессы , такие как построение и разрушение сложных молекул , происходят посредством ступенчатых химических реакций . Некоторые из этих химических реакций протекают самопроизвольно и высвобождают энергию, тогда как для протекания других требуется энергия. Точно так же, как живые существа должны постоянно потреблять пищу, чтобы пополнять свои запасы энергии, клетки должны постоянно производить больше энергии, чтобы пополнить ту, которая используется многими постоянно происходящими энергетическими реакциями. Вместе, все химические реакции , происходящие внутри клеток, включая те, которые потребляют или вырабатывают энергию, называются клеточным метаболизмом .
Вместе, все химические реакции , происходящие внутри клеток, включая те, которые потребляют или вырабатывают энергию, называются клеточным метаболизмом .
Рассмотрим метаболизм сахара. Это классический пример одного из многих клеточных процессов, использующих и производящих энергию. Живые существа потребляют сахара в качестве основного источника энергии, потому что молекулы сахара имеют большое количество энергии, хранящейся в их связях. По большей части фотосинтезирующие организмы, такие как растения, производят эти сахара. Во время фотосинтеза растения используют энергию (первоначально солнечного света) для преобразования углекислого газа (CO 2 ) на молекулы сахара (например, глюкоза: C 6 H 12 O 6 ). Они потребляют углекислый газ и производят кислород в качестве побочного продукта. Эта реакция резюмируется как:
Они потребляют углекислый газ и производят кислород в качестве побочного продукта. Эта реакция резюмируется как:
6CO 2 + 6H 2 O + энергия ——-> C 6 H 12 O 6 + 6O 2
Поскольку этот процесс включает в себя синтез молекулы, запасающей энергию, для его продолжения требуется затрата энергии. При световых реакциях фотосинтеза энергия обеспечивается молекулой под названием аденозинтрифосфат (АТФ) , которая является основной энергетической валютой всех клеток. Точно так же, как доллар используется в качестве валюты для покупки товаров, клетки используют молекулы АТФ в качестве энергетической валюты для выполнения непосредственной работы. Напротив, молекулы-аккумуляторы энергии, такие как глюкоза, потребляются только для того, чтобы расщепляться для использования своей энергии. Реакция, которая собирает энергию молекулы сахара в клетках, нуждающихся в кислороде для выживания, может быть обобщена как реакция, обратная фотосинтезу. В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как:
В этой реакции потребляется кислород, а в качестве побочного продукта выделяется углекислый газ. Реакция резюмируется как:
C 6 H 12 O 6 + 6O 2 ——> 6CO 2 + 6H 2 O + энергия
Обе эти реакции включают много стадий.
Процессы создания и расщепления молекул сахара иллюстрируют два примера метаболических путей. Метаболический путь представляет собой серию химических реакций, в которых исходная молекула шаг за шагом модифицируется через ряд метаболических промежуточных продуктов, в конечном итоге давая конечный продукт. В примере метаболизма сахара первый метаболический путь синтезирует сахар из более мелких молекул, а другой путь расщепляет сахар на более мелкие молекулы. Эти два противоположных процесса — первый, требующий энергии, и второй, производящий энергию, — называются анаболические пути (строительные полимеры) и катаболические пути (расщепление полимеров на их мономеры) соответственно. Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Следовательно, метаболизм состоит из синтеза (анаболизма) и деградации (катаболизма) (рис. 4.3).
Важно знать, что химические реакции метаболических путей не происходят сами по себе. Каждый этап реакции облегчается или катализируется белком, называемым ферментом. Ферменты важны для катализа всех типов биологических реакций — те, которые требуют энергии, а также те, которые высвобождают энергию.
Рис. 4.3. Катаболические пути — это те, которые вырабатывают энергию за счет расщепления более крупных молекул. Анаболические пути — это те, которые требуют энергии для синтеза более крупных молекул. Оба типа путей необходимы для поддержания энергетического баланса клетки. Термодинамика относится к изучению энергии и передачи энергии с участием физической материи. Материя, относящаяся к конкретному случаю передачи энергии, называется системой, а все, что находится вне этой материи, — окружающей средой. Например, при нагревании кастрюли с водой на плите система включает плиту, кастрюлю и воду. Энергия передается внутри системы (между плитой, кастрюлей и водой). Существует два типа систем: открытые и закрытые. В открытой системе возможен обмен энергией с окружающей средой. Система плиты открыта, потому что тепло может отдаваться воздуху. Замкнутая система не может обмениваться энергией с окружающей средой.
Энергия передается внутри системы (между плитой, кастрюлей и водой). Существует два типа систем: открытые и закрытые. В открытой системе возможен обмен энергией с окружающей средой. Система плиты открыта, потому что тепло может отдаваться воздуху. Замкнутая система не может обмениваться энергией с окружающей средой.
Биологические организмы являются открытыми системами. Между ними и их окружением происходит обмен энергией, поскольку они используют энергию солнца для фотосинтеза или потребляют молекулы, хранящие энергию, и выделяют энергию в окружающую среду, выполняя работу и выделяя тепло. Как и все вещи в физическом мире, энергия подчиняется физическим законам. Законы термодинамики управляют передачей энергии во всех системах во Вселенной и между ними.
В целом энергия определяется как способность выполнять работу или создавать какие-либо изменения. Энергия существует в разных формах. Например, электрическая энергия, световая энергия и тепловая энергия — это разные виды энергии. Чтобы понять, как энергия поступает в биологические системы и выходит из них, важно понимать два физических закона, управляющих энергией.
Чтобы понять, как энергия поступает в биологические системы и выходит из них, важно понимать два физических закона, управляющих энергией.
Первый закон термодинамики гласит, что общее количество энергии во Вселенной постоянно и сохраняется. Другими словами, во Вселенной всегда было и всегда будет одинаковое количество энергии. Энергия существует во многих различных формах . Согласно первому закону термодинамики, энергия может передаваться с места на место или преобразовываться в различные формы , но не может быть создана или уничтожена . Передачи и преобразования энергии происходят вокруг нас все время. Лампочки преобразуют электрическую энергию в световую и тепловую энергию. Газовые плиты преобразуют химическую энергию природного газа в тепловую энергию. Растения осуществляют одно из самых биологически полезных преобразований энергии на Земле: преобразование энергии солнечного света в химическую энергию, хранящуюся в органических молекулах (рис. 4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.
4.2). Некоторые примеры преобразования энергии показаны на рис. 4.4.
Задача всех живых организмов состоит в том, чтобы получать энергию из своего окружения в формах, которые они могут передавать или преобразовывать в полезную энергию для выполнения работы. Живые клетки эволюционировали, чтобы справиться с этой задачей. Химическая энергия, хранящаяся в органических молекулах, таких как сахара и жиры, передается и трансформируется посредством ряда клеточных химических реакций в энергию внутри молекул АТФ. Энергия молекул АТФ легко доступна для выполнения работы. Примеры типов работы, которую должны выполнять клетки, включают построение сложных молекул, транспортировку материалов, обеспечение движения ресничек или жгутиков и сокращение мышечных волокон для создания движения.
На рис. 4.4 показаны некоторые примеры передачи и преобразования энергии из одной системы в другую и из одной формы в другую. Пища, которую мы потребляем, обеспечивает наши клетки энергией, необходимой для выполнения функций организма, точно так же, как световая энергия дает растениям средства для создания необходимой им химической энергии.
 (кредит «мороженое»: модификация работы Д. Шэрон Прюитт; кредит «дети»: модификация работы Макса из Провиденса; кредит «лист»: модификация работы Кори Занкера)
(кредит «мороженое»: модификация работы Д. Шэрон Прюитт; кредит «дети»: модификация работы Макса из Провиденса; кредит «лист»: модификация работы Кори Занкера) Основные задачи живой клетки по получению, преобразованию и использованию энергии для выполнения работы могут показаться простыми. Однако второй закон термодинамики объясняет, почему эти задачи сложнее, чем кажутся. Все передачи и преобразования энергии никогда не бывают полностью эффективными . При каждой передаче энергии некоторое количество энергии теряется в непригодной для использования форме. В большинстве случаев такой формой является тепловая энергия. Термодинамически тепловая энергия определяется как энергия, передаваемая от одной системы к другой, которая не является работой. Например, когда включается лампочка, часть энергии, преобразуемой из электрической энергии в световую, теряется в виде тепловой энергии. Точно так же часть энергии теряется в виде тепловой энергии во время клеточных метаболических реакций.
Важным понятием в физических системах является порядок и беспорядок. Чем больше энергии теряет система в своем окружении, тем менее упорядоченной и более случайной является система. Ученые называют мерой случайности или беспорядка в системе энтропию . Высокая энтропия означает высокий беспорядок и низкую энергию. Молекулы и химические реакции также имеют разную энтропию. Например, энтропия увеличивается по мере того, как молекулы с высокой концентрацией в одном месте диффундируют и распространяются. Второй закон термодинамики гласит, что энергия всегда будет теряться в виде тепла при передаче или превращении энергии.
Живые существа высоко упорядочены, и им требуется постоянное потребление энергии для поддержания состояния низкой энтропии.
Когда объект находится в движении, с ним связана энергия. Подумайте о разрушающем шаре. Даже медленно движущийся шар-разрушитель может нанести большой ущерб другим объектам. Энергия, связанная с движущимися объектами, называется кинетической энергией (рис. 4.5). Мчащаяся пуля, идущий человек и быстрое движение молекул в воздухе (выделяющее тепло) — все они обладают кинетической энергией.
4.5). Мчащаяся пуля, идущий человек и быстрое движение молекул в воздухе (выделяющее тепло) — все они обладают кинетической энергией.
А что, если тот самый неподвижный шар-вредитель поднять краном на два этажа над землей? Если подвешенный разрушающий шар неподвижен, связана ли с ним энергия? Ответ положительный. Энергия, необходимая для подъема шара-разрушителя, не исчезла, а теперь запасена в шаре-разрушителе благодаря его положению и действующей на него силе тяжести. Этот вид энергии называется потенциальной энергией (рис. 4.5). Если мяч упадет, потенциальная энергия будет преобразована в кинетическую энергию до тех пор, пока вся потенциальная энергия не будет исчерпана, когда мяч покоится на земле. Разрушительные шары также качаются, как маятник; во время качелей происходит постоянное изменение потенциальной энергии (наибольшей в верхней части качелей) на кинетическую энергию (наибольшей в нижней части качелей). Другие примеры потенциальной энергии включают энергию воды, удерживаемой за плотиной, или энергию человека, собирающегося прыгнуть с парашютом из самолета.
Потенциальная энергия связана не только с расположением материи, но и со структурой материи. Даже пружина на земле обладает потенциальной энергией, если ее сжать; то же самое делает и натянутая резинка. На молекулярном уровне связи, удерживающие атомы молекул вместе, существуют в определенной структуре, обладающей потенциальной энергией. Помните, что анаболические клеточные пути требуют энергии для синтеза сложных молекул из более простых, а катаболические пути высвобождают энергию при расщеплении сложных молекул. Тот факт, что энергия может высвобождаться при разрыве определенных химических связей, подразумевает, что эти связи обладают потенциальной энергией. На самом деле существует потенциальная энергия, хранящаяся в связях всех пищевых молекул, которые мы едим, и которая в конечном итоге используется для использования. Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи.
Это потому, что эти связи могут высвобождать энергию при разрыве. Тип потенциальной энергии, которая существует внутри химических связей и высвобождается, когда эти связи разрываются, называется химической энергией. Химическая энергия отвечает за обеспечение живых клеток энергией из пищи. Высвобождение энергии происходит при разрыве молекулярных связей внутри молекул пищи.
Посмотрите видео о килокалориях.
Концепция в действии
Посетите сайт и выберите «Маятник» в меню «Работа и энергия», чтобы увидеть изменение кинетической и потенциальной энергии маятника в движении.
Узнав, что химические реакции высвобождают энергию, когда разрушаются энергосберегающие связи, возникает следующий важный вопрос: как определяется и выражается энергия, связанная с этими химическими реакциями? Как можно сравнить энергию, выделяющуюся в одной реакции, с энергией другой реакции? Измерение свободной энергии используется для количественной оценки этих передач энергии. Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.
Вспомним, что согласно второму закону термодинамики все передачи энергии связаны с потерей некоторого количества энергии в непригодной для использования форме, такой как тепло. Свободная энергия конкретно относится к энергии, связанной с химической реакцией, которая доступна после учета потерь. Другими словами, свободная энергия — это полезная энергия, или энергия, доступная для выполнения работы.
Если в ходе химической реакции выделяется энергия, то изменение свободной энергии, обозначаемое как ∆G (дельта G), будет отрицательным числом. Отрицательное изменение свободной энергии также означает, что продукты реакции имеют меньшую свободную энергию, чем реагенты, потому что они выделяют некоторую свободную энергию во время реакции. Реакции, которые вызывают отрицательное изменение свободной энергии и, следовательно, высвобождение свободной энергии, называются экзергоническими реакциями. Подумайте: ex ergonic означает, что энергия равна ex , используя систему. Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.
Эти реакции также называют самопроизвольными реакциями, и их продукты имеют меньший запас энергии, чем реагенты. Необходимо провести важное различие между термином «самопроизвольно» и идеей химической реакции, протекающей немедленно. Вопреки повседневному использованию этого термина спонтанная реакция не возникает внезапно или быстро. Ржавление железа является примером спонтанной реакции, которая происходит медленно, мало-помалу, с течением времени.
Если химическая реакция поглощает энергию, а не высвобождает энергию в балансе, то ∆G для этой реакции будет положительным значением. В этом случае продукты имеют больше свободной энергии, чем реагенты. Таким образом, продукты этих реакций можно рассматривать как запасающие энергию молекулы. Эти химические реакции называются эндергоническими реакциями и являются неспонтанными . Эндергоническая реакция не будет происходить сама по себе без добавления свободной энергии.
На рис. 4.
 6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)
6 показаны некоторые примеры эндергонических процессов (тех, которые требуют энергии) и экзергонических процессов (тех, которые высвобождают энергию). (кредит a: модификация работы Натали Мейнор; кредит b: модификация работы USDA; кредит c: модификация работы Кори Занкера; кредит d: модификация работы Гарри Мальша)Посмотрите на каждый из показанных процессов и решите если он эндергонический или экзергонический.
Существует еще одна важная концепция, которую следует учитывать в отношении эндергонических и экзергонических реакций. Экзергонические реакции требуют небольшого количества энергии для запуска, прежде чем они смогут продолжить свои этапы высвобождения энергии. Эти реакции имеют чистое высвобождение энергии, но все же требуют некоторого подвода энергии в начале. Это небольшое количество энергии, необходимое для протекания всех химических реакций, называется энергией активации.
Концепция в действии
Посмотрите анимацию перехода от свободной энергии к переходному состоянию реакции.
Вещество, которое способствует протеканию химической реакции, называется катализатором, а молекулы, катализирующие биохимические реакции, называются ферментами. Большинство ферментов являются белками и выполняют важнейшую задачу снижения энергии активации химических реакций внутри клетки. Большинство критических для живой клетки реакций протекают слишком медленно при нормальных температурах, чтобы быть полезными для клетки. Без ферментов до ускорить эти реакции , жизнь не может продолжаться. Ферменты делают это, связываясь с молекулами реагентов и удерживая их таким образом, чтобы облегчить процессы разрыва и образования химических связей. Важно помнить, что ферменты не изменяются, является ли реакция экзергонической (спонтанной) или эндергонической. Это потому, что они не изменяют свободную энергию реагентов или продуктов. Они лишь уменьшают энергию активации, необходимую для протекания реакции (рис. 4.7). Кроме того, сам фермент не изменяется в ходе реакции, которую он катализирует. После катализа одной реакции фермент может участвовать в других реакциях.
После катализа одной реакции фермент может участвовать в других реакциях.
Химические реагенты, с которыми связывается фермент, называются субстратами фермента. В зависимости от конкретной химической реакции может быть один или несколько субстратов. В некоторых реакциях один реагент-субстрат распадается на несколько продуктов. В других случаях два субстрата могут объединяться, образуя одну большую молекулу. Два реагента также могут вступить в реакцию и оба измениться, но они покинут реакцию как два продукта. Место внутри фермента, где связывается субстрат, называется ферментным 9-узлом.0073 активный сайт . Активный сайт — это место, где происходит «действие». Поскольку ферменты представляют собой белки, в активном центре имеется уникальная комбинация боковых цепей аминокислот. Каждая боковая цепь характеризуется различными свойствами. Они могут быть большими или маленькими, слабокислыми или основными, гидрофильными или гидрофобными, положительно или отрицательно заряженными или нейтральными. Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).
Уникальная комбинация боковых цепей создает очень специфическую химическую среду в активном центре. Эта конкретная среда подходит для связывания с одним конкретным химическим субстратом (или субстратами).
Активные сайты подвержены влиянию местной среды. Повышение температуры окружающей среды обычно увеличивает скорость реакции, катализируемой ферментами или иным образом. Однако температуры за пределами оптимального диапазона снижают скорость, с которой фермент катализирует реакцию. Горячие температуры в конечном итоге вызовут денатурацию ферментов, необратимое изменение трехмерной формы и, следовательно, функции фермента. Ферменты также лучше всего подходят для работы в пределах определенного диапазона pH и концентрации соли, и, как и в случае с температурой, экстремальный pH и концентрация соли могут вызвать денатурацию ферментов.
В течение многих лет ученые считали, что связывание фермента с субстратом происходит простым способом «замок и ключ». Эта модель утверждала, что фермент и субстрат идеально сочетаются друг с другом за один мгновенный шаг. Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом.
Однако текущие исследования поддерживают модель, называемую индуцированной подгонкой (рис. 4.8). Модель индуцированного соответствия расширяет модель «замок и ключ», описывая более динамичное связывание между ферментом и субстратом. Когда фермент и субстрат объединяются, их взаимодействие вызывает небольшой сдвиг в структуре фермента, который формирует идеальную схему связывания между ферментом и субстратом.
Концепция в действии
Просмотрите анимацию индуцированной посадки.
Когда фермент связывается со своим субстратом, образуется фермент-субстратный комплекс. Этот комплекс снижает энергию активации реакции и способствует ее быстрому протеканию одним из многих возможных путей. На базовом уровне ферменты способствуют химическим реакциям, в которых участвует более одного субстрата, объединяя субстраты в оптимальной для реакции ориентации. Другой способ, с помощью которого ферменты способствуют реакции своих субстратов, заключается в создании оптимальной среды в активном центре для протекания реакции. Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.
Химические свойства, возникающие из-за особого расположения аминокислотных групп R в активном центре, создают идеальную среду для реакции специфических субстратов фермента.
Комплекс фермент-субстрат также может снижать энергию активации, нарушая структуру связи, чтобы ее было легче разорвать. Наконец, ферменты также могут снижать энергию активации, участвуя в самой химической реакции. В этих случаях важно помнить, что фермент всегда возвращается в исходное состояние по завершении реакции. Одним из отличительных свойств ферментов является то, что они в конечном счете остаются неизменными в реакциях, которые они катализируют. После того, как фермент катализирует реакцию, он высвобождает свой продукт (продукты) и может катализировать новую реакцию.
Рисунок 4.8. Модель индуцированного соответствия представляет собой корректировку модели «замок и ключ» и объясняет, как ферменты и субстраты претерпевают динамические модификации во время переходного состояния, чтобы увеличить сродство субстрата к активному центру.
Казалось бы идеальным сценарий, при котором все ферменты организма существовали бы в изобилии и функционировали оптимально во всех клеточных условиях, во всех клетках, во все времена. Однако различные механизмы гарантируют, что этого не произойдет. Клеточные потребности и условия постоянно варьируются от клетки к клетке и меняются внутри отдельных клеток с течением времени. Необходимые ферменты клеток желудка отличаются от ферментов клеток хранения жира, клеток кожи, клеток крови и нервных клеток. Кроме того, клетки органов пищеварения работают гораздо усерднее, перерабатывая и расщепляя питательные вещества в течение времени, которое следует за приемом пищи, по сравнению со многими часами после приема пищи. Поскольку эти клеточные потребности и условия различаются, должны различаться количество и функциональность различных ферментов.
Поскольку скорость биохимических реакций контролируется энергией активации, а ферменты снижают и определяют энергию активации химических реакций, относительное количество и функционирование различных ферментов в клетке в конечном итоге определяют, какие реакции будут протекать и с какой скоростью. Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.
Это определение строго контролируется в клетках. В определенных клеточных средах активность ферментов частично контролируется такими факторами окружающей среды, как pH, температура, концентрация соли и, в некоторых случаях, кофакторами или коферментами.
Ферменты также можно регулировать таким образом, чтобы стимулировать или снижать активность ферментов. Существует много видов молекул, которые ингибируют или стимулируют функцию фермента, и различные механизмы, с помощью которых они это делают. В некоторых случаях ингибирования фермента молекула ингибитора достаточно подобна субстрату, поэтому она может связываться с активным центром и просто блокировать связывание субстрата. Когда это происходит, фермент ингибируется путем конкурентного ингибирования , потому что молекула ингибитора конкурирует с субстратом за связывание с активным центром.
С другой стороны, при неконкурентном ингибировании молекула ингибитора связывается с ферментом в месте, отличном от активного центра, называемого аллостерическим сайтом , но все же умудряется блокировать связывание субстрата с активным центром. Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).).
Некоторые молекулы-ингибиторы связываются с ферментами в местах, где их связывание вызывает конформационные изменения, снижающие сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением (рис. 4.9). Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, а это означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с участком фермента, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Существуют аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационные изменения, повышающие сродство активного(ых) центра(ов) фермента к его субстрату(ам) (рис. 4.9).).
 Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.
Напротив, при аллостерической активации молекула активатора изменяет форму активного центра, чтобы обеспечить лучшее прилегание к субстрату.Через призму коренных народов
Растения не могут убегать или прятаться от своих хищников и разработали множество стратегий, чтобы отпугнуть тех, кто их съест. Подумайте о шипах, раздражителях и вторичных метаболитах: это соединения, которые напрямую не помогают растению расти, но созданы специально для защиты от хищников. Вторичные метаболиты — наиболее распространенный способ, с помощью которого растения отпугивают хищников. Некоторыми примерами вторичных метаболитов являются атропин, никотин, ТГК и кофеин. Люди обнаружили, что эти соединения вторичного метаболита являются богатым источником материалов для лекарств. Подсчитано, что 90% лекарств в современной фармации имеют свои «корни» в этих вторичных метаболитах.
Лечение травами первых людей открыло миру эти вторичные метаболиты. Например, коренные народы издавна использовали кору ивы и ольхи для приготовления чая, тонизирующего средства или припарки для уменьшения воспаления. Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Вы узнаете больше о воспалительной реакции иммунной системы в главе 11.
Рис. 4.10. Кора тихоокеанской ивы содержит соединение салицин.
Кора ивы и ольхи содержит соединение салицин. У большинства из нас это соединение есть в аптечке в виде салициловой кислоты или аспирина. Доказано, что аспирин уменьшает боль и воспаление, а в наших клетках салицин превращается в салициловую кислоту.
Так как же это работает? Салицин или аспирин действуют как ингибиторы ферментов. В воспалительной реакции два фермента, ЦОГ1 и ЦОГ2, играют ключевую роль в этом процессе. Салицин или аспирин специфически модифицируют аминокислоту (серин) в активном центре этих двух родственных ферментов. Эта модификация активных центров не позволяет нормальному субстрату связываться, поэтому воспалительный процесс прерывается. Как вы прочитали в этой главе, это делает его конкурентоспособным ингибитором ферментов.
Разработчик фармацевтических препаратов
Рисунок 4.11 Задумывались ли вы когда-нибудь, как разрабатываются фармацевтические препараты? (кредит: Дебора Остин) Ферменты являются ключевыми компонентами метаболических путей. Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).
Понимание того, как работают ферменты и как их можно регулировать, является ключевым принципом разработки многих фармацевтических препаратов, представленных сегодня на рынке. Биологи, работающие в этой области, совместно с другими учеными разрабатывают лекарства (рис. 4.11).
Возьмем, к примеру, статины. Статины — это название, данное одному классу препаратов, которые могут снижать уровень холестерина. Эти соединения являются ингибиторами фермента ГМГ-КоА-редуктазы, фермента, который синтезирует холестерин из липидов в организме. Ингибируя этот фермент, можно снизить уровень холестерина, синтезируемого в организме. Точно так же ацетаминофен, широко продаваемый под торговой маркой Тайленол, является ингибитором фермента циклооксигеназы. Хотя он используется для облегчения лихорадки и воспаления (боли), его механизм действия до сих пор полностью не изучен.
Как обнаруживаются наркотики? Одной из самых больших проблем при открытии лекарств является определение мишени для лекарства. Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов в пробирке до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин.
Лекарственная мишень — это молекула, которая буквально является мишенью лекарства. В случае статинов мишенью является ГМГ-КоА-редуктаза. Мишени для наркотиков идентифицируются путем кропотливых исследований в лаборатории. Одной идентификации цели недостаточно; ученым также необходимо знать, как мишень действует внутри клетки и какие реакции идут наперекосяк в случае болезни. Как только цель и путь определены, начинается фактический процесс разработки лекарства. На этом этапе химики и биологи работают вместе, чтобы разработать и синтезировать молекулы, которые могут блокировать или активировать определенную реакцию. Однако это только начало: если и когда прототип лекарства успешно выполняет свою функцию, он подвергается многочисленным испытаниям, от экспериментов в пробирке до клинических испытаний, прежде чем он сможет получить одобрение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США. магазин.
Многие ферменты не работают оптимально или вообще не работают, если они не связаны с другими специфическими небелковыми вспомогательными молекулами. Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Они могут связываться либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи. Связывание с этими молекулами способствует оптимальной форме и функционированию соответствующих ферментов. Двумя примерами этих типов вспомогательных молекул являются кофакторы и коферменты. Кофакторы представляют собой неорганические ионы, такие как ионы железа и магния. Коэнзимы — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода. Подобно ферментам, эти молекулы участвуют в реакциях, сами не изменяясь, и в конечном итоге перерабатываются и используются повторно. Витамины являются источником коферментов. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин С является прямым коферментом для множества ферментов, которые принимают участие в построении важной соединительной ткани, коллагена. Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые могут поступать с пищей организма или, в некоторых случаях, вырабатываться организмом.
Ингибирование обратной связи в метаболических путях
Молекулы могут регулировать функцию ферментов разными способами. Однако остается главный вопрос: что это за молекулы и откуда они берутся? Как вы узнали, некоторые из них являются кофакторами и коферментами. Какие другие молекулы в клетке обеспечивают ферментативную регуляцию, такую как аллостерическая модуляция, конкурентное и неконкурентное ингибирование? Возможно, наиболее релевантными источниками регуляторных молекул в отношении ферментативного клеточного метаболизма являются продукты самих клеточных метаболических реакций. Наиболее эффективным и элегантным способом клетки научились использовать продукты своих собственных реакций для ингибирования активности ферментов по принципу обратной связи. Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше.
Ингибирование с обратной связью предполагает использование продукта реакции для регуляции собственного дальнейшего производства (рис. 4.12). Клетка реагирует на обилие продуктов замедлением производства во время анаболических или катаболических реакций. Такие продукты реакции могут ингибировать ферменты, катализирующие их продукцию, посредством механизмов, описанных выше.
Производство как аминокислот, так и нуклеотидов контролируется ингибированием по принципу обратной связи. Кроме того, АТФ является аллостерическим регулятором некоторых ферментов, участвующих в катаболическом расщеплении сахара — процессе, который создает АТФ. Таким образом, когда АТФ в изобилии, клетка может предотвратить производство АТФ. С другой стороны, АДФ служит положительным аллостерическим регулятором (аллостерическим активатором) для некоторых из тех же ферментов, которые ингибируются АТФ. Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.
Таким образом, когда относительные уровни АДФ высоки по сравнению с АТФ, клетка начинает производить больше АТФ за счет катаболизма сахара.
Клетки выполняют функции жизни посредством различных химических реакций. Метаболизм клетки относится к комбинации химических реакций, происходящих в ней. Катаболические реакции расщепляют сложные химические вещества на более простые и связаны с выделением энергии. Анаболические процессы строят сложные молекулы из более простых и требуют энергии.
При изучении энергии термин «система» относится к материи и окружающей среде, участвующим в передаче энергии. Энтропия есть мера беспорядка системы. Физические законы, описывающие передачу энергии, — это законы термодинамики. Первый закон гласит, что общее количество энергии во Вселенной постоянно. Второй закон термодинамики гласит, что каждая передача энергии связана с некоторой потерей энергии в непригодной для использования форме, такой как тепловая энергия. Энергия бывает разных форм: кинетической, потенциальной и свободной. Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.
Изменение свободной энергии реакции может быть отрицательным (высвобождение энергии, экзергоническое) или положительным (потребление энергии, эндергоническое). Для протекания всех реакций требуется первоначальный ввод энергии, называемой энергией активации.
Ферменты — это химические катализаторы, ускоряющие химические реакции за счет снижения энергии их активации. Ферменты имеют активный центр с уникальной химической средой, которая подходит для определенных химических реагентов для этого фермента, называемых субстратами. Считается, что ферменты и субстраты связываются в соответствии с моделью индуцированного соответствия. Действие фермента регулируется для сохранения ресурсов и оптимального реагирования на окружающую среду.
Глоссарий
энергия активации: количество начальной энергии, необходимой для протекания реакции
активный центр: специфический участок фермента, где связывается субстрат изменение в активном центре, предотвращающее связывание с субстратом
анаболический: описывает путь, который требует затрат чистой энергии для синтеза сложных молекул из более простых
биоэнергетика: концепция потока энергии через живые системы
катаболический: описывает путь, по которому сложные молекулы расщепляются на более простые с образованием энергии в качестве дополнительного продукта реакции
конкурентное ингибирование: общий механизм регуляции активности фермента, при котором молекула, отличная от субстрата фермента, способна связываться с активным центром и предотвращать связывание самого субстрата, тем самым подавляя общую скорость реакции фермента
эндергонический: описывает химическую реакцию, в результате которой образуются продукты, запасающие больше химической потенциальной энергии, чем реагенты.
фермент: молекула, катализирующая биохимическую реакцию. с меньшей химической потенциальной энергией, чем у реагентов, плюс высвобождение свободной энергии
ингибирование по принципу обратной связи: механизм регуляции активности фермента, при котором продукт реакции или конечный продукт ряда последовательных реакций ингибирует фермент на некоторое время. более ранний шаг в серии реакций
тепловая энергия: энергия, передаваемая из одной системы в другую, которая не является работой
кинетическая энергия: вид энергии, связанный с движущимися объектами , включая те, которые используют энергию, и те, которые выделяют энергию
неконкурентное ингибирование: общий механизм регуляции активности фермента, при котором регуляторная молекула связывается с сайтом, отличным от активного центра, и предотвращает связывание активным центром субстрата; таким образом, молекула ингибитора не конкурирует с субстратом за активный центр; аллостерическое торможение является формой неконкурентного торможения
потенциальная энергия: тип энергии, относящийся к способности выполнять работу
субстрат: молекула, на которую действует фермент
License
Concepts of Biology — 1st Canadian Edition Чарльза Молнара и Джейн Гейр распространяется по лицензии Creative Commons Attribution 4. 0 International License, если не указано иное.
0 International License, если не указано иное.
Поделиться этой книгой
Поделиться в Твиттере
Олигоацетилацетоны как формуемые углеродные цепи и их преобразование в олигоимины для создания металлоорганических структур все еще трудная задача в органической химии. По мере увеличения степени свободы большая потеря энтропии препятствует фиксации конформации и ориентации. Здесь мы сообщаем об олиго(3,3-диметилпентан-2,4-дионе) как о гибких и формуемых углеродных цепях со многими карбонильными группами для химической модификации. Поликарбонилированные цепи различной длины синтезируют путем терминально-селективного силилирования и реакций окислительного сочетания с использованием оксида серебра (I). Мы используем реакции 1,3-дикетонов и 1,4-дикетонов, чтобы уменьшить длину цепи и вызвать благоприятные конформации. Когда цепи обрабатывают гидразином, все карбонильные группы превращаются в иминные группы, что приводит к образованию мультидентатных лигандов. Наконец, двумерная листовая структура и цилиндрическая сборка создаются, соответственно, путем объединения и скручивания углеродных цепей с помощью координации металлов.

Введение
Древние керамические сосуды изготавливались путем намотки веревок из глины 1 , и аналогичный метод можно использовать для создания больших трехмерных структур из гибких нитей. Гибкие углеродные цепи также могут играть решающую роль в синтезе различных органических структур в молекулярной науке, поскольку они могут принимать различные конформации, не вызывая больших энергий деформации. 2 Конструктивно гибкие каркасы, созданные из гибких компонентов, привлекли внимание, поскольку они могут изменять структуру и свойства в ответ на размещение гостей и другие воздействия 3,4,5 . При построении структур высокого порядка с гибкими компонентами цепи основные трудности связаны с большими потерями энтропии, вызванными фиксацией конформаций и ориентаций. Таким образом, гибкие углеродные цепи, такие как алкильные группы, были встроены в большие органические наноструктуры и агрегаты, часто просто как петли, линкеры, агенты агрегации и солюбилизирующие группы 6,7,8 . Учитывая недавние разработки в области синтетических реакций с использованием катализируемой переходными металлами функционализации алифатических соединений 9 , создание различных конформаций и построение двух- и трехмерных ансамблей с гибкими углеродными цепями (рис. 1а) становятся все более важными для синтеза нового класса структурно-гибких органических архитектур различного размера и формы. Это побудило нас спроектировать и синтезировать гибкие, но формируемые углеродные цепи.
Учитывая недавние разработки в области синтетических реакций с использованием катализируемой переходными металлами функционализации алифатических соединений 9 , создание различных конформаций и построение двух- и трехмерных ансамблей с гибкими углеродными цепями (рис. 1а) становятся все более важными для синтеза нового класса структурно-гибких органических архитектур различного размера и формы. Это побудило нас спроектировать и синтезировать гибкие, но формируемые углеродные цепи.
Создание крупных органических структур с использованием гибких поликетоновых цепей. a Стратегия построения различных органических сборок более высокого порядка. После того, как конформации углеродных цепей индуцируются реакциями и взаимодействиями, связанными с кетонами, цепи собираются с помощью координации металлов и других межмолекулярных взаимодействий. b Дизайн гибкой и изолируемой поликетоновой цепи, состоящей из последовательности чередующихся 1,3-дикетонов и 1,4-дикетонов. c Последовательность поликетоновых цепей природного типа. Они легко подвергаются внутримолекулярной циклизации посредством енолизации
c Последовательность поликетоновых цепей природного типа. Они легко подвергаются внутримолекулярной циклизации посредством енолизации
Мы сосредоточились на алифатических поликетонах как на гибких каркасах. Карбонильная группа является одной из наиболее хорошо изученных функциональных групп в органической химии, и известны различные превращения и взаимодействия, происходящие от неподеленной пары атома кислорода и электрофильного атома углерода. Биологические системы также используют поликетоновые цепи в качестве общего предшественника для производства широкого спектра вторичных метаболитов, известных как поликетиды 9.0444 10 . Природные поликетоны, состоящие из повторяющихся 1,3-дикетонов, легко вступают в реакции внутримолекулярной циклизации путем енолизации с образованием стабильных шестичленных колец, которые после дегидратации часто ароматизируются (рис. 1в) 11, 12 . Эти характеристики препятствуют синтезу и выделению длинных поликетоновых цепей без помощи ферментов, за исключением олигомеров и полимеров с повторяющимися звеньями 1,4-дикетона 13, 14 .
Здесь мы создаем новую последовательность поликетонов, состоящую из чередующихся 1,3-дикетонов и 1,4-дикетонов. Эти поликетоны могут быть синтезированы олигомеризацией производного ацетилацетона, 3,3-диметилпентан-2,4-диона ( 1 ) (рис. 1б). Несмотря на плотное расположение карбонильных групп в цепи, ни одна из них не находится в шестом положении ни от одного из α-углеродов, которые при енолизации становятся нуклеофильными. Расположение карбонильных групп позволяет синтезировать и выделять поликетоновые цепи различной длины, вплоть до тетраконтана (С40) с 16 карбонильными группами, в виде стабильных алл- кето форм. Субъединицы 1,3-дикетона и 1,4-дикетона могут подвергаться различным типам реакций, что позволяет модулировать длину и конформацию цепи. Мы также достигаем построения листообразных и цилиндрических сборок гибких и формуемых углеродных цепей с помощью координации ионов металлов после преобразования карбонильных групп в иминные группы.
Результаты.
 2). При обработке ацетилацетона 1 хлортриметилсиланом (1,2 экв.) в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) 15 был получен триметилсилиловый эфир енола 2 в 9выход 3%. Превосходная селективность в отношении моносилилированного продукта наблюдалась только для DBU, и одновременное бис-силилирование происходило, когда в качестве основания использовались другие амины, такие как триэтиламин. Чистый триметилсилиловый эфир енола 2 можно получить в масштабе 150 г путем вакуумной перегонки. Поэтому мы оптимизировали условия окислительного сочетания, используя соединение 2 . Рис. 2
2). При обработке ацетилацетона 1 хлортриметилсиланом (1,2 экв.) в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ) 15 был получен триметилсилиловый эфир енола 2 в 9выход 3%. Превосходная селективность в отношении моносилилированного продукта наблюдалась только для DBU, и одновременное бис-силилирование происходило, когда в качестве основания использовались другие амины, такие как триэтиламин. Чистый триметилсилиловый эфир енола 2 можно получить в масштабе 150 г путем вакуумной перегонки. Поэтому мы оптимизировали условия окислительного сочетания, используя соединение 2 . Рис. 2 Схема синтеза поликетоновых цепей на основе ацетилацетона 1 . Триметилсилиловые эфиры енолов образуются на концевых кетонах мономера и олигомеров ацетилацетона. Силиловые эфиры енолов затем гомосоединяют с использованием оксида серебра (I) 9.0003
Изображение полного размера
Для окислительного сочетания эфира силиленола 2 мы исследовали подходящие окислители для предотвращения побочных реакций незащищенных карбонильных групп в субстрате и продуктах. Было обнаружено, что среди окислителей для синтеза 1,4-дикетонов с енолятными синтонами оксид серебра(I) 16 опосредует реакцию гомосочетания с образованием димера 3 без образования основных побочных продуктов, отличных от десилилированного продукта 1 . Реакции с другими окислителями 17,18,19 , такие как трифлат меди(II), нитрат аммония-церия(IV) и гипервалентный йод, давали сложные смеси, включающие небольшое количество димера 3 (выход <10%), предположительно из-за реакций на карбонильные группы. Апротонные полярные реакционные среды подходили для реакции сочетания, опосредованной оксидом серебра(I), и димер 3 был получен с выходом 70% в смеси диметилсульфоксид/диметилсульфон. Стоит отметить, что десилилирование субстрата 2 была основной реакцией в неполярных и протонных растворителях из-за замедления реакции сочетания и ускорения десилилирования соответственно.
Было обнаружено, что среди окислителей для синтеза 1,4-дикетонов с енолятными синтонами оксид серебра(I) 16 опосредует реакцию гомосочетания с образованием димера 3 без образования основных побочных продуктов, отличных от десилилированного продукта 1 . Реакции с другими окислителями 17,18,19 , такие как трифлат меди(II), нитрат аммония-церия(IV) и гипервалентный йод, давали сложные смеси, включающие небольшое количество димера 3 (выход <10%), предположительно из-за реакций на карбонильные группы. Апротонные полярные реакционные среды подходили для реакции сочетания, опосредованной оксидом серебра(I), и димер 3 был получен с выходом 70% в смеси диметилсульфоксид/диметилсульфон. Стоит отметить, что десилилирование субстрата 2 была основной реакцией в неполярных и протонных растворителях из-за замедления реакции сочетания и ускорения десилилирования соответственно.
Силилирование димера ацетилацетона 3 происходит селективно по концевым карбонильным группам в мягких условиях. При обработке димера 3 хлортриметилсиланом, триэтиламином и йодидом натрия в ацетонитриле при 0 °C 20 силиловые эфиры концевых енолов 4 и 5 были получены с выходами 42 и 26% соответственно, наряду с выделением непрореагировавшего 3 (16%). Для силилирования олигомеров ацетилацетона условия с использованием ДБУ не подходили, так как получались сложные смеси, предположительно за счет внутримолекулярных альдольных реакций. Силиловый эфир енола 4 также подвергся реакции гомосочетания, опосредованной оксидом серебра (I), с получением тетрамера 6 с выходом 47%. Аналогичное терминально-селективное силилирование тетрамера 6 имело место с получением моносилилированного продукта 7 с выходом 26% вместе с 41% биссилилированного продукта. Хотя соотношение концевых/внутренних карбонильных групп составляло 1:3, образование енолсилиловых эфиров внутренних карбонильных групп не было обнаружено с помощью 1 Н спектроскопии ядерного магнитного резонанса (ЯМР).
При обработке димера 3 хлортриметилсиланом, триэтиламином и йодидом натрия в ацетонитриле при 0 °C 20 силиловые эфиры концевых енолов 4 и 5 были получены с выходами 42 и 26% соответственно, наряду с выделением непрореагировавшего 3 (16%). Для силилирования олигомеров ацетилацетона условия с использованием ДБУ не подходили, так как получались сложные смеси, предположительно за счет внутримолекулярных альдольных реакций. Силиловый эфир енола 4 также подвергся реакции гомосочетания, опосредованной оксидом серебра (I), с получением тетрамера 6 с выходом 47%. Аналогичное терминально-селективное силилирование тетрамера 6 имело место с получением моносилилированного продукта 7 с выходом 26% вместе с 41% биссилилированного продукта. Хотя соотношение концевых/внутренних карбонильных групп составляло 1:3, образование енолсилиловых эфиров внутренних карбонильных групп не было обнаружено с помощью 1 Н спектроскопии ядерного магнитного резонанса (ЯМР). Реакция сочетания с использованием оксида серебра (I) и соединения 7 дала октамер ацетилацетона 8 , несущий 16 карбонильных групп на тетраконтановой (С40) основной цепи, в виде бесцветного твердого вещества с выходом 17% после высокоэффективной жидкостной хроматографии (ВЭЖХ). ) разделение.
Реакция сочетания с использованием оксида серебра (I) и соединения 7 дала октамер ацетилацетона 8 , несущий 16 карбонильных групп на тетраконтановой (С40) основной цепи, в виде бесцветного твердого вещества с выходом 17% после высокоэффективной жидкостной хроматографии (ВЭЖХ). ) разделение.
Олигоацетилацетоновые цепи 3 – 8 были получены в виде одиночных таутомеров, что позволило полностью охарактеризовать их чистые формы. Времяпролетный масс-спектр электрораспыления с высоким разрешением (ESI-TOF) показал ионный пик на м / z = 1033,5496, который приписывается [ 8 + Na] + (рассчитано для C 56 H 82 O 16 Na m/z 1033.5495). Спектр ЯМР 1 Н октамера 8 в CDCl 3 показал сигнал концевого ацетильного протона при 2,15 м.д. в виде синглета, но в олефиновой области при 4.0–7.0 м.д. сигнала не наблюдалось. Это ясно показывает, что енолизация эффективно подавляется двумя метильными заместителями в субъединицах 1,3-дикетона даже для октамера 8 , который все еще имеет 16 карбонильных групп и 34 протона α-CH. Другие поликетоновые цепи 3 и 6 также были обнаружены в виде всех кето форм на основании их спектров ЯМР. Эти поликетоновые цепи термически стабильны по крайней мере до 120 °С и не подвергаются внутримолекулярной альдольной циклизации в растворе в нейтральных условиях. При нагревании в твердом состоянии соединения 3 , 6 и 8 плавились при 78, 94 и 119 °C соответственно без какого-либо разложения. Следует подчеркнуть, что двух основных проблем при работе с длинными поликетоновыми цепями, а именно енолизации и внутримолекулярной циклизации, можно избежать, используя олигоацетилацетоновую последовательность.
Другие поликетоновые цепи 3 и 6 также были обнаружены в виде всех кето форм на основании их спектров ЯМР. Эти поликетоновые цепи термически стабильны по крайней мере до 120 °С и не подвергаются внутримолекулярной альдольной циклизации в растворе в нейтральных условиях. При нагревании в твердом состоянии соединения 3 , 6 и 8 плавились при 78, 94 и 119 °C соответственно без какого-либо разложения. Следует подчеркнуть, что двух основных проблем при работе с длинными поликетоновыми цепями, а именно енолизации и внутримолекулярной циклизации, можно избежать, используя олигоацетилацетоновую последовательность.
Изменения длины и конформации цепей
Рентгеноструктурный анализ монокристалла показал, что цепи на основе ацетилацетона принимают уникальные конформации, обусловленные взаимодействиями по карбонильным группам в твердом состоянии. В частности, конформации основных углеродных цепей сильно различаются в зависимости от торсионных углов субъединиц 1,4-дикетона. Центральное этиленовое звено димера 3 принимает гош-конформацию с углом закручивания 68,8 °, что делает основную цепь декана (C10) скрученной (рис. 3b). Аналогичная тенденция наблюдается в кристаллической структуре тетрамера 6 , в котором две концевые субъединицы 1,4-дикетона принимают конформации гош (рис. 3в). Только центральное этиленовое звено принимает стерически предпочтительную антиперипланарную конформацию, поэтому основная цепь икозана (C 20 ) соединения 6 имеет S-образную форму. Помимо взаимодействий водородных связей в кристаллической упаковке, диполь-дипольные и 9Известно, что взаимодействия 0478 n –π* 21, 22 определяют конформацию структуры 1,4-дикетона. Эти слабые, но благоприятные взаимодействия в дикетоновых единицах полезны для создания сложных конформаций гибких цепей.
Центральное этиленовое звено димера 3 принимает гош-конформацию с углом закручивания 68,8 °, что делает основную цепь декана (C10) скрученной (рис. 3b). Аналогичная тенденция наблюдается в кристаллической структуре тетрамера 6 , в котором две концевые субъединицы 1,4-дикетона принимают конформации гош (рис. 3в). Только центральное этиленовое звено принимает стерически предпочтительную антиперипланарную конформацию, поэтому основная цепь икозана (C 20 ) соединения 6 имеет S-образную форму. Помимо взаимодействий водородных связей в кристаллической упаковке, диполь-дипольные и 9Известно, что взаимодействия 0478 n –π* 21, 22 определяют конформацию структуры 1,4-дикетона. Эти слабые, но благоприятные взаимодействия в дикетоновых единицах полезны для создания сложных конформаций гибких цепей.
Модуляция длины цепи и благоприятные конформации гибких углеродных цепей. a Синтетические схемы хемоселективного превращения 1,3- и 1,4-дикетоновых субъединиц. b Рентгеновская кристаллическая структура димера 3 . c Рентгеновская кристаллическая структура тетрамера 6 . d Рентгеноструктурный анализ 2,5-фуриленовой мостиковой цепи 9. e Рентгеноструктурный анализ соединения 10 . f Рентгеновская кристаллическая структура димера изопиразола 11 . г Рентгеновская кристаллическая структура октаиминовой цепи 12 . Все тепловые эллипсоиды построены с вероятностью 50%
b Рентгеновская кристаллическая структура димера 3 . c Рентгеновская кристаллическая структура тетрамера 6 . d Рентгеноструктурный анализ 2,5-фуриленовой мостиковой цепи 9. e Рентгеноструктурный анализ соединения 10 . f Рентгеновская кристаллическая структура димера изопиразола 11 . г Рентгеновская кристаллическая структура октаиминовой цепи 12 . Все тепловые эллипсоиды построены с вероятностью 50%
Чередование 1,3-дикетонов и 1,4-дикетонов удобно для регулирования длин и конформаций гибких поликетоновых цепей с помощью хемоселективных реакций ( Рис. 3а). При толуольном растворе тетракетона 3 кипятили с обратным холодильником в присутствии p -толуолсульфокислоты ( p -TsOH), сигналы этиленовых протонов 3 исчезали и появлялся новый ароматический пик при 6,14 м.д. в спектре ЯМР 1 Н. Рентгеноструктурный анализ монокристаллов подтвердил образование плоского 2,5-фуриленового мостика, соединяющего две диметилметиленовые субъединицы на расстоянии 4,87 Å (рис. 3г). Расстояние на ~1 Å короче, чем в 1,4-дикетоне 3 (5,81 Å), что приводит к уменьшению длины цепи. Две концевые ацетильные группы расположены параллельно, а углеродная цепь декана (С10) принимает U-образную форму.
3г). Расстояние на ~1 Å короче, чем в 1,4-дикетоне 3 (5,81 Å), что приводит к уменьшению длины цепи. Две концевые ацетильные группы расположены параллельно, а углеродная цепь декана (С10) принимает U-образную форму.
Катализируемый кислотой синтез фурана типа Паала-Кнорра 23 также применим к тетрамеру 6 . В тех же условиях все звенья 1,4-дикетона были превращены в фурановые кольца с получением соединения 10 с выходом 76%. Рентгеноструктурный анализ монокристаллов показал, что соединение 10 имеет S-образную конформацию, как и соответствующий октакетон 6 , но 10 явно меньше, чем 6 (рис. 3e). Длина цепи была укорочена на ок . 20% за счет образования трех фурановых колец в цепи (дополнительная таблица 1). Стоит также отметить, что аналогичные реакции типа Паала-Кнорра с поли(1,4-дикетонами) часто оставляют изолированные кетоны между двумя образующимися ароматическими кольцами 24 . Система чередования 1,3- и 1,4-дикетонов способствует полному превращению субъединиц 1,4-дикетонов в ароматические кольца посредством синтеза Паала-Кнорра 25 с высокими выходами, сохраняя нетронутыми только концевые ацетильные группы.
При обработке гидразином 26 , 1,3-дикетоновые звенья поликетоновых цепей 3 и 6 были преобразованы в изопиразольные кольца с получением полииминовых цепей 11 и 12 с выходами 89 и 80% соответственно. Учитывая, что в реакции с тетрамером 6 образуется восемь иминных связей, каждая реакция по карбонильной группе протекает с выходом более 97%. Рентгеновские кристаллические структуры 11 и 12 показывают, что все стерические конформации этиленовых мостиков антиперипланарны, что делает углеродные цепи прямыми, что часто наблюдается в наиболее стабильных конформациях незамещенных алканов (рис. 3е, ж). Все изопиразольные кольца в 11 и 12 расположены примерно в одной плоскости. Расстояние между двумя концевыми атомами углерода в 12 увеличилось до 2,3 нм по сравнению с 1,0 нм в S-образном октакетоне 6 . Октаимин 12 был гигроскопичным и кристаллизовался с семью молекулами воды на молекулу цепи. Молекулы воды образуют кластеры, которые связаны водородными связями с атомами азота в соединении 12 (дополнительный рисунок 5). В результате углеродные цепи 12 связаны друг с другом в кристалле несколькими водородными связями. Эти множественные взаимодействия на атомах азота перспективны не только для индуцирования конформаций, но и для создания сборок гибких углеродных цепей с использованием водородных связей и координационных связей.
Молекулы воды образуют кластеры, которые связаны водородными связями с атомами азота в соединении 12 (дополнительный рисунок 5). В результате углеродные цепи 12 связаны друг с другом в кристалле несколькими водородными связями. Эти множественные взаимодействия на атомах азота перспективны не только для индуцирования конформаций, но и для создания сборок гибких углеродных цепей с использованием водородных связей и координационных связей.
Сборки гибких углеродных цепей
После того, как мы добились регулировки длины и индукции различных конформаций гибких углеродных цепей, мы исследовали методы сборки больших органических структур с использованием комплексообразования металлов 27 . Когда цепь тетраимина 11 смешивали с гексагидратом тетрафторбората цинка (II) в метаноле, образовывались бесцветные кристаллы. Элементный анализ показал соотношение лиганда 11 к металлу 2:1. Кристаллы были почти нерастворимы в обычных органических растворителях, таких как хлороформ и диэтиловый эфир. Рентгеноструктурный анализ монокристалла показал двумерный координационный полимер, в котором каждый ион цинка (II) имеет тетраэдрическую геометрию и связывается с четырьмя лигандами 11 у концевых иминных атомов азота. Поскольку внутренние иминные атомы азота остаются некоординированными, лиганд 11 принимает почти ту же линейную конформацию, что и его чистый кристалл (рис. 4а и 3е).
Рентгеноструктурный анализ монокристалла показал двумерный координационный полимер, в котором каждый ион цинка (II) имеет тетраэдрическую геометрию и связывается с четырьмя лигандами 11 у концевых иминных атомов азота. Поскольку внутренние иминные атомы азота остаются некоординированными, лиганд 11 принимает почти ту же линейную конформацию, что и его чистый кристалл (рис. 4а и 3е).
Двумерная сборка тетраиминовой цепи 11 . a Диаграмма ОРТЕП координационного полимера [Zn( 11 ) 2 (BF 4 ) 2 ] n вокруг центра цинка(II) с тепловыми эллипсоидами на уровне вероятности 50%. Атомы Zn, N и C окрашены в пурпурный, голубой и серый цвета соответственно. b Структурная формула координационного полимера [Zn( 11 ) 2 (BF 4 ) 2 ] n . c двумерная пластинчатая структура координационной сети, рассматриваемая вдоль оси b . Последовательность ближайших углеродных цепей к 11 выделен зеленым цветом. d Ориентация ближайших углеродных цепей 11 выделено в c , если смотреть в направлении (1 0 –1). Противоионы и молекулы растворителя опущены для ясности
c двумерная пластинчатая структура координационной сети, рассматриваемая вдоль оси b . Последовательность ближайших углеродных цепей к 11 выделен зеленым цветом. d Ориентация ближайших углеродных цепей 11 выделено в c , если смотреть в направлении (1 0 –1). Противоионы и молекулы растворителя опущены для ясности
Увеличенное изображение
В структуре кристаллической упаковки двумерные сетки уложены вдоль оси b , образуя бесконечные одномерные каналы, в которых противоионы и молекулы растворителя наблюдались (рис. 4c и дополнительная рис. 8). При удалении молекул растворителя под вакуумом кристалличность терялась, что отражало гибкость компонентов каркаса. Две из четырех молекул лиганда 11 вокруг цинкового центра расположены близко друг к другу с концевым расстоянием С•••С 3,98 и 4,01 Å. Если мы сосредоточимся на ближайших цепях, основные цепи декана (C10) лиганда 11 выровнены в одном направлении, чтобы принять волнообразную ориентацию (рис. 4d). Эта предварительная организация может обеспечить образование двумерной листовой ковалентной углеродной сети за счет образования концевых связей С-С между ближайшими концевыми атомами углерода. Эти результаты ясно показывают возможность построения сложных углеродных каркасов путем сборки гибких углеродных цепей, индуцированных конформацией.
4d). Эта предварительная организация может обеспечить образование двумерной листовой ковалентной углеродной сети за счет образования концевых связей С-С между ближайшими концевыми атомами углерода. Эти результаты ясно показывают возможность построения сложных углеродных каркасов путем сборки гибких углеродных цепей, индуцированных конформацией.
Чтобы собрать большую дискретную архитектуру путем скручивания цепей на основе поли(ацетилацетона), мы исследовали координационную сборку октаиминной цепи 12 с кластером оксида металла 28 . Обработка гексагидратом нитрата никеля(II) в хлороформе/этаноле вызывает уширение пиков в спектре ЯМР 1 Н соединения 12 из-за координации парамагнитных ионов никеля(II). После того, как раствору дали постоять при комнатной температуре в течение 1 дня, пурпурные кристаллы, имеющие формулу [Ni 4 ( 12 ) 2 (OH) 2 (NO 3 ) 6 •4H 2 O•(растворители)], с выходом 55%. В масс-спектре ESI-TOF обнаружены катионные пики, относящиеся к тетраядерному комплексу никеля [Ni 4 ( 12 ) 2 (OH) 2 (NO 3 ) 4 0 5 900 44 + 90 4 900 44 ] 2 90 m / z = 748,1988 (рассчитано для [C 56 H 86 N 16 Ni 4 O 2 ] 2+ m/z 748.1995) в результате диссоциации гидратированных молекул воды и нитрат-ионов. Кристаллическая структура показывает, что пара кристаллографически эквивалентных лигандов 12 обвилась вокруг тетраядерного кластера никеля с гидроксомостиком (рис. 5 и дополнительная рис. 10). Четыре иона никеля(II) координируются двумя мостиковыми гидроксолигандами, четырьмя аквалигандами и двумя иминными лигандами 12 с образованием гексакатионного комплекса. Каждый лиганд 12 служит бидентатным лигандом для трех из четырех ионов никеля в октаэдрической координационной геометрии. Концевые иминные атомы азота лиганда 12 не координируются с ионом никеля, но действуют как акцепторы водородных связей для гидратированных молекул воды на ионе никеля.
В масс-спектре ESI-TOF обнаружены катионные пики, относящиеся к тетраядерному комплексу никеля [Ni 4 ( 12 ) 2 (OH) 2 (NO 3 ) 4 0 5 900 44 + 90 4 900 44 ] 2 90 m / z = 748,1988 (рассчитано для [C 56 H 86 N 16 Ni 4 O 2 ] 2+ m/z 748.1995) в результате диссоциации гидратированных молекул воды и нитрат-ионов. Кристаллическая структура показывает, что пара кристаллографически эквивалентных лигандов 12 обвилась вокруг тетраядерного кластера никеля с гидроксомостиком (рис. 5 и дополнительная рис. 10). Четыре иона никеля(II) координируются двумя мостиковыми гидроксолигандами, четырьмя аквалигандами и двумя иминными лигандами 12 с образованием гексакатионного комплекса. Каждый лиганд 12 служит бидентатным лигандом для трех из четырех ионов никеля в октаэдрической координационной геометрии. Концевые иминные атомы азота лиганда 12 не координируются с ионом никеля, но действуют как акцепторы водородных связей для гидратированных молекул воды на ионе никеля. Торсионные углы этиленовых мостиков в икозановой (С 20 ) основной цепи лиганда 12 варьируют от 54,9 до 90,0°. Таким образом, углеродная цепь лиганда 12 значительно изогнута и принимает подковообразную форму. Два подковообразных лиганда тесно обвиты вокруг никелевого кластера, а икозан (C 20 ) главные цепи были расположены в виде цилиндрического узла (рис. 5б). Следует подчеркнуть, что гибкость углеродной цепи и множество мест взаимодействия на ней сделали возможной цилиндрическую сборку спиральных углеродных цепей, как в случае гончарных изделий, сделанных из глиняных веревок.
Торсионные углы этиленовых мостиков в икозановой (С 20 ) основной цепи лиганда 12 варьируют от 54,9 до 90,0°. Таким образом, углеродная цепь лиганда 12 значительно изогнута и принимает подковообразную форму. Два подковообразных лиганда тесно обвиты вокруг никелевого кластера, а икозан (C 20 ) главные цепи были расположены в виде цилиндрического узла (рис. 5б). Следует подчеркнуть, что гибкость углеродной цепи и множество мест взаимодействия на ней сделали возможной цилиндрическую сборку спиральных углеродных цепей, как в случае гончарных изделий, сделанных из глиняных веревок.
Цилиндрическая сборка спиральной октаиминовой цепи 12 . a Структурная формула комплекса никеля [Ni 4 ( 12 ) 2 (OH) 2 (НО 3 ) 6 •4(H 2 O)]. b Конформация лиганда скрученной углеродной цепи 12 в комплексе никеля. Основная углеродная цепь икозана (C 20 ) верхнего лиганда выделена оранжевым цветом. Молекулы растворителя и противоионы для ясности опущены.
Основная углеродная цепь икозана (C 20 ) верхнего лиганда выделена оранжевым цветом. Молекулы растворителя и противоионы для ясности опущены.
Увеличенное изображение
Обсуждение
Мы добились синтеза, модуляции длины цепи, индукции конформации и формирования ансамблей гибких углеродных цепей на основе олиго(ацетилацетонов). Чередующееся повторение 1,3-дикетоновых и 1,4-дикетоновых субъединиц является ключом к подавлению внутримолекулярной циклизации и к эффективной функционализации цепей для индукции различных конформаций. Терминально-селективное силилирование и последующая реакция гомосочетания с использованием оксида серебра (I) обеспечили надежный метод получения длинных поликетоновых цепей вплоть до тетраконтана (C 40 ), содержащие 16 кетонов. Хотя многие карбонильные группы соседствуют друг с другом, положения 1,3-дикетона и 1,4-дикетона независимо превращаются в фурановые и изопиразольные кольца с высокими выходами, что приводит к образованию более коротких цепей и мультидентатных полииминовых лигандов соответственно. Поликетоновые и полииминовые цепи сочетают структурную гибкость и множественные сайты взаимодействия, поэтому они могут быть подходящими каркасными компонентами для различных типов сложных углеродных архитектур. В то время как создание дополнительных огромных и сложных структур и исследование их свойств являются следующими проблемами, наш подход с использованием формируемых углеродных цепей предоставил новый путь для создания структурно гибких сборок. Кроме того, учитывая, что многие карбонильные или иминные группы и α-углероды встроены в основные углеродные цепи, наши результаты обещают фиксацию индуцированных конформаций путем образования ковалентных связей C-C.
Поликетоновые и полииминовые цепи сочетают структурную гибкость и множественные сайты взаимодействия, поэтому они могут быть подходящими каркасными компонентами для различных типов сложных углеродных архитектур. В то время как создание дополнительных огромных и сложных структур и исследование их свойств являются следующими проблемами, наш подход с использованием формируемых углеродных цепей предоставил новый путь для создания структурно гибких сборок. Кроме того, учитывая, что многие карбонильные или иминные группы и α-углероды встроены в основные углеродные цепи, наши результаты обещают фиксацию индуцированных конформаций путем образования ковалентных связей C-C.
Методы
Экспериментальные данные и методики
Для экспериментальной методики хроматограмма ВЭЖХ, 1 H и 13 C ЯМР, масс-спектры высокого разрешения ESI-TOF, данные инфракрасной спектроскопии и элементного анализа, подробные кристаллографические данные, и данные о длине цепи, см. дополнительные методы, дополнительные рис. 1–10 и дополнительную таблицу 1.
дополнительные методы, дополнительные рис. 1–10 и дополнительную таблицу 1.
Доступность данных
Рентгенокристаллографические координаты структур соединений 3 , 6 , , 10 , 11 , 12 , [ZN ( 11 ) 2 (BF 4 )
) . 88
) . 88
) 2 . ·H 2 O] n и [Ni 4 ( 12 ) 2 (OH) 2 (№ 3 ) 6 · (H 2 O) 4 ] Доступны как добавленные данные 1–8. , соответственно. Эти данные также были депонированы в Кембриджском центре кристаллографических данных (CCDC) под номерами депонирования CCDC15879.59, CCDC1587960, CCDC1587961, CCDC1587962, CCDC1587963, CCDC1587964, CCDC1587965 и CCDC1587966 соответственно. Эти данные можно бесплатно получить в CCDC через http://www.ccdc.cam.ac. uk/data_request/cif. Все остальные данные можно получить у авторов по обоснованному запросу.
uk/data_request/cif. Все остальные данные можно получить у авторов по обоснованному запросу.
Ссылки
Бландино, Б. Спиральная керамика: традиционные и современные способы (Krause Publications, Айова, Висконсин; США, 2004).
Добсон, С. М. Сворачивание и неправильное сворачивание белков. Природа 426 , 884–890 (2003).
КАС Статья Google ученый
Schneemann, A. et al. Гибкие металлоорганические каркасы. Хим. соц. 43 , 6062–6096 (2014).
КАС Статья Google ученый
Лин, З.-Дж., Лю, Дж., Хун, М. и Цао, Р. Металлоорганические каркасы на основе гибких лигандов (FL-MOF): структуры и приложения. Хим. соц. 43 , 5867–5895 (2014).
КАС Статья Google ученый
«>Лу, Ф. и Наканиши, Т. Разработка алкил-π в государственном контроле для создания универсальных оптоэлектронных мягких материалов. Науч. Технол. Доп. Матер. 16 , 1–20 (2015).
Артикул Google ученый
Лей, Т., Ван, Дж.-Ю. и Пей, Дж. Роль гибких цепей в органических полупроводниковых материалах. Хим. Матер. 26 , 594–603 (2014).
КАС Статья Google ученый
Бабу С.С., Правин В.К. и Аджайагош А. Функциональные π-гелатросы и их приложения. Хим. Ред. 114 , 1973–2129 (2014).

КАС Статья Google ученый
Жирар, С. А., Кнаубер, Т. и Ли, К.-Дж. Кросс-дегидрирующее связывание связей C sp3 –H: универсальная стратегия образования связи C – C. Анжю. хим. Междунар. Эд. 53 , 74–100 (2014).
КАС Статья Google ученый
Hertweck, C. Биосинтетическая логика разнообразия поликетидов. Анжю. хим. Междунар. Эд. 48 , 4688–4716 (2009).
КАС Статья Google ученый
Виттек, П.Дж. и Харрис, Т.М. Синтез β-гекса, β-гепта и β-октакетонов. Дж. Ам. хим. соц. 95 , 6865–6867 (1973).
КАС Статья Google ученый
Гилбрет С.Г., Харрис С.М. и Харрис Т.М. Биомиметический синтез прететрамидов.
 1. Синтез прететрамида путем тандемного удлинения поликетидной цепи. Дж. Ам. хим. соц. 110 , 6172–6179 (1988).
1. Синтез прететрамида путем тандемного удлинения поликетидной цепи. Дж. Ам. хим. соц. 110 , 6172–6179 (1988).КАС Статья Google ученый
Олдер, Р. В., Хайланд, Н. П., Джеффри, Дж. К., Риис-Йоханнессен, Т. и Райли, Д. Дж. Поли(1,1-бис(диалкиламино)пропан-1,3-диил)с; конформационно контролируемые олигомеры, несущие электроактивные группы. Орг. биомол. хим. 7 , 2704–2715 (2009).
КАС Статья Google ученый
Дрент, Э. и Будзелаар, П. Х. М. Переменная сополимеризация алкенов и монооксида углерода, катализируемая палладием. Хим. Rev. 96 , 663–681 (1996).
КАС Статья Google ученый
Танигути Ю., Инанага Дж. и Ямагути М. Использование 1,8-диазабицикло[5.4.0]ундец-7-ена в получении простых эфиров триметилсилиленола и триметилсилилацетиленов.
 Бык. хим. соц. Jpn 54 , 3229–3230 (1981).
Бык. хим. соц. Jpn 54 , 3229–3230 (1981).КАС Статья Google ученый
Ито, Ю., Коноике, Т. и Саэгуса, Т. Синтез 1,4-дикетонов реакцией силиленолового эфира с оксидом серебра. Региоспецифическое образование интермедиатов енолята серебра(I). Дж. Ам. хим. соц. 97 , 649–651 (1975).
КАС Статья Google ученый
Кобаяши Ю., Тагучи Т., Морикава Т., Токуно Э. и Секигучи С. Исследования органических соединений фтора. XXXI. Окислительное сочетание енолятов кетона и эфиров триметилсилиленола с помощью Cu(OTf) 2 . Хим. фарм. Бык. 28 , 262–267 (1980).
КАС Статья Google ученый
Клифт, М. Д., Тейлор, С. Н. и Томсон, Р. Дж. Окислительное образование углерод-углеродных связей с помощью эфиров силил-бис-енола: контролируемое перекрестное связывание для синтеза четвертичных центров.
 Орг. лат. 9 , 4667–4669 (2007).
Орг. лат. 9 , 4667–4669 (2007).КАС Статья Google ученый
Жданкин В.В. и др. Образование углерод-углеродных связей в реакциях аддукта PhIO•HBF 4 /силиленолового эфира с алкенами или силиленоловыми эфирами. J. Org. хим. 54 , 2605–2608 (1989).
КАС Статья Google ученый
Казо, П., Дюбуден, Ф., Мулин, Ф., Бабо, О. и Дуног, Дж. Новый практический синтез простых эфиров силиленола. Часть. I. Из простых альдегидов и кетонов. Тетраэдр 43 , 2075–2088 (1987).
КАС Статья Google ученый
Камер К. Дж., Чоудхари А. и Рейнс Р. Т. Тесные взаимодействия с карбонильными группами: диполь-диполь или n→π*? J. Org. хим. 78 , 2099–2103 (2012).
Артикул Google ученый
«>Амарнат В. и Амарнат К. Промежуточные соединения в синтезе фуранов Паалом-Кнорром. J. Org. хим. 60 , 301–307 (1995).
КАС Статья Google ученый
Zhang, Y., Broekhuis, A.A. & Picchioni, F. Термически самовосстанавливающиеся полимерные материалы: следующий шаг к переработке термореактивных полимеров? Макромолекулы 42 , 1906–1912 (2009).
КАС Статья Google ученый
Cafeo, G., Kohnke, F.H., La Torre, G.L., White, A.J.P. & Williams, D.J. структуры. Анжю. хим. Междунар. Эд. 39 , 1496–1498 (2000).
КАС Статья Google ученый
«>Фурукава Х., Кордова К.Е., О’Киф М. и Яги О.М. Химия и применение металлоорганических каркасов. Наука 341 , 1230444–1230456 (2013).
Артикул Google ученый
Кинг, П., Клерак, Р., Вернсдорфер, В., Ансон, К.Э. и Пауэлл, А.К. Синтез и магнетизм тетраядерных дефектов с кислородными мостиками кластеров дикубана Co(II) и Ni(II). Далтон Транс . 33 , 2670-2676 (2004).
Артикул Google ученый
Beves, J. E. et al. Стратегии и тактики металлонаправленного синтеза ротаксанов, узлов, катенанов и звеньев более высокого порядка. Анжю. хим. Междунар. Эд. 50 , 9260–9327 (2011).
КАС Статья Google ученый
Ньюберри, Р. В. и Рейнс, Р. Т. n→π * взаимодействие. Согл. хим. Рез. 50 , 1838–1846 (2017).
КАС Статья Google ученый
Cafeo, G. et al. От каликсфуранов к гетероциклофанам, содержащим изопиразольные звенья. Тетраэдр 60 , 1895–1902 (2004).
КАС Статья Google ученый
Ссылки на скачивание
Благодарности
Эта работа была поддержана Грантом помощи молодым ученым (A) (№ 17H04872), Грантом помощи для начала исследовательской деятельности (№ 16H06592) для научных исследований в инновационных областях (координационная асимметрия) (№ 17H05347) от MEXT, JST-PRESTO и Asahi Glass Foundation. Мы благодарим г-на Рёту Котани, д-ра Такаюки Танаку и профессора Атсухиро Осука за предоставление данных рентгеновской дифракции для соединения 10 .
Мы благодарим г-на Рёту Котани, д-ра Такаюки Танаку и профессора Атсухиро Осука за предоставление данных рентгеновской дифракции для соединения 10 .
Информация об авторе
Авторы и организации
Отделение прикладной химии инженерного факультета Университета Хоккайдо, Кита 13 Ниси 8 Кита-ку, Саппоро, 060-8628, Япония
Мицухару Уэсака, Юки Сайто, Шота Ёсиока и Ясухидэ Инокума
Факультет прикладной химии, Школа инженерии, Токийский университет, Бункё-ку, Токио, 113-8656, Япония
00002 Фуджита и Юя ДомотоЯпонское агентство науки и техники PRESTO, Кавагути, Япония
Ясухидэ Инокума
Авторы
- Мицухару Уэсака
Посмотреть публикации автора
PubMed Google Академия
- Юки Сайто
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Shota Yoshioka
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yuya Domoto
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Макото Фудзита
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yasuhide Inokuma
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Взносы
Ю. И. разработал проект, проанализировал экспериментальные данные и написал статью. М.У., Ю.С., С.Ю. провел эксперименты и проанализировал данные. Ю.Д. и М.Ф. поддержал синтез и рентгеноструктурный анализ соединений 3 и 6 .
И. разработал проект, проанализировал экспериментальные данные и написал статью. М.У., Ю.С., С.Ю. провел эксперименты и проанализировал данные. Ю.Д. и М.Ф. поддержал синтез и рентгеноструктурный анализ соединений 3 и 6 .
Автор, ответственный за переписку
Ясухидэ Инокума.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительный электронный материал
Дополнительная информация (PDF 2985 КБ)
Описание дополнительных данных
Дополнительные данные 1 (CIF 220 KB)
Приместительные данные 2 (CIF 225 KB)
Приместительные данные 2 (CIF 225 KB)
Приместительные данные 2 (CIF 225 KB)
70.
 CIF 384 KB)
CIF 384 KB)Дополнительные данные 4 (CIF 538 KB)
Дополнительные данные 5 (CIF 214 KB)
Дополнительные данные 6 (CIF 1005 KB)
.0070 Дополнительные данные 7 (CIF 611 kb)
Дополнительные данные 8 (CIF 622 kb)
Права и разрешения
Открытый доступ Эта статья предоставляется по лицензии Creative Commons, использование которой разрешено, 4.0 Attribution совместное использование, адаптация, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Границы улавливания и использования CO2 (CCU) на пути к углеродной нейтральности
- Линюнь Чжан
- Песня Яньфан
- Вэй Вэй
Достижения в области атмосферных наук (2022)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Полимеры
1. Введение
До начала 1920-х годов химики сомневались в существовании молекул с молекулярной массой более нескольких тысяч. Это ограниченное представление было оспорено Германом Штаудингером, немецким химиком, имевшим опыт изучения природных соединений, таких как каучук и целлюлоза. В отличие от преобладающей рационализации этих веществ как агрегатов малых молекул, Штаудингер предположил, что они состоят из макромолекул 9.0456 состоит из 10 000 или более атомов. Он сформулировал полимерную структуру для каучука на основе повторяющегося изопренового звена (называемого мономером). За свой вклад в химию Штаудингер получил Нобелевскую премию 1953 года. Термины полимер и мономер произошли от греческих корней поли (много), моно (один) и мерос (часть).
За признанием того, что полимерные макромолекулы составляют многие важные природные материалы, последовало создание синтетических аналогов, обладающих разнообразными свойствами. Действительно, применение этих материалов в качестве волокон, гибких пленок, клеев, стойких красок и прочных, но легких твердых материалов изменило современное общество. Некоторые важные примеры этих веществ обсуждаются в следующих разделах.
Действительно, применение этих материалов в качестве волокон, гибких пленок, клеев, стойких красок и прочных, но легких твердых материалов изменило современное общество. Некоторые важные примеры этих веществ обсуждаются в следующих разделах.
2. Написание формул для полимерных макромолекул
Повторяющаяся структурная единица большинства простых полимеров не только отражает мономер(ы), из которых построены полимеры, но также обеспечивает краткие средства для рисования структур, представляющих эти макромолекулы. Для полиэтилена, возможно, самого простого полимера, это демонстрируется следующим уравнением. Здесь этилен (этен) является мономером, а соответствующий линейный полимер называется полиэтиленом высокой плотности (ПЭВП). ПЭВП состоит из макромолекул, в которых n находится в диапазоне от 10 000 до 100 000 (молекулярная масса 2*10 5 до 3 *10 6 ).
Если Y и Z представляют собой моли мономера и полимера соответственно, Z приблизительно равно 10 -5 Y. Этот полимер называется полиэтиленом, а не полиметиленом, (-CH 2 -) n , потому что этилен является стабильным соединением. (метилен не является), и он также служит синтетическим предшественником полимера. Две открытые связи, остающиеся на концах длинной цепи углеродов (окрашены пурпурным цветом), обычно не указываются, потому что атомы или группы, находящиеся там, зависят от химического процесса, используемого для полимеризации. Методы синтеза, использованные для получения этого и других полимеров, будут описаны далее в этой главе.
Этот полимер называется полиэтиленом, а не полиметиленом, (-CH 2 -) n , потому что этилен является стабильным соединением. (метилен не является), и он также служит синтетическим предшественником полимера. Две открытые связи, остающиеся на концах длинной цепи углеродов (окрашены пурпурным цветом), обычно не указываются, потому что атомы или группы, находящиеся там, зависят от химического процесса, используемого для полимеризации. Методы синтеза, использованные для получения этого и других полимеров, будут описаны далее в этой главе.
В отличие от более простых чистых соединений, большинство полимеров не состоят из идентичных молекул. Молекулы ПЭВП, например, состоят из длинных углеродных цепей, но их длина может варьироваться в пределах тысяч мономерных звеньев. Из-за этого молекулярные массы полимеров обычно приводятся как средние значения. Обычны два экспериментально определенных значения: M n , среднечисловая молекулярная масса, рассчитанная из распределения мольных долей молекул разного размера в образце, и M n 0458 M w , средневесовая молекулярная масса, рассчитывается из распределения массовых долей молекул разного размера. Они определены ниже. Поскольку более крупные молекулы в образце весят больше, чем более мелкие молекулы, среднее значение M w обязательно смещено в сторону более высоких значений и всегда больше, чем M n . По мере сужения массовой дисперсии молекул в образце М w приближается к M n , и в маловероятном случае, когда все молекулы полимера имеют одинаковую массу (чистый монодисперсный образец), соотношение М w / M n становится единицей.
Они определены ниже. Поскольку более крупные молекулы в образце весят больше, чем более мелкие молекулы, среднее значение M w обязательно смещено в сторону более высоких значений и всегда больше, чем M n . По мере сужения массовой дисперсии молекул в образце М w приближается к M n , и в маловероятном случае, когда все молекулы полимера имеют одинаковую массу (чистый монодисперсный образец), соотношение М w / M n становится единицей.
Влияние различных массовых распределений на M n и M w можно изучить с помощью простого калькулятора массы. |
|---|
Известно множество полимерных материалов, имеющих цепочечную структуру, аналогичную полиэтилену. Полимеры, образованные прямым соединением мономерных звеньев без потери или прибавления материала, называются 9. 0458 полимеры присоединения или полимеры с ростом цепи . Список некоторых важных аддитивных полимеров и их предшественников мономеров представлен в следующей таблице.
0458 полимеры присоединения или полимеры с ростом цепи . Список некоторых важных аддитивных полимеров и их предшественников мономеров представлен в следующей таблице.
Name(s) | Formula | Monomer | Properties | Uses | ||||
|---|---|---|---|---|---|---|---|---|
| Polyethylene low density (LDPE) | –(CH 2 -CH 2 ) n – | ethylene CH 2 =CH 2 | soft, waxy solid | film wrap, plastic bags | ||||
| Polyethylene high density (HDPE) | –(CH 2 -CH 2 ) n – | ethylene CH 2 =CH 2 | rigid, translucent solid | электрическая изоляция bottles, toys | ||||
| Polypropylene (PP) different grades | –[CH 2 -CH(CH 3 )] n – | propylene CH 2 =CHCH 3 | atactic : soft, elastic solid isotactic : hard, strong solid | similar to LDPE carpet, upholstery | ||||
| Poly(vinyl chloride) (PVC) | –(CH 2 -CHCL) N — | Винилхлорид CH 2 = CHCL | Строительный твердый твердый (CH 2 -CCl 2 ) n – | vinylidene chloride CH 2 =CCl 2 | dense, high-melting solid | seat covers, films | ||
| Polystyrene (PS) | –[CH 2 -CH(C 6 H 5 )] n – | styrene CH 2 =CHC 6 H 5 | hard, rigid, clear solid soluble in organic solvents | toys, cabinets packaging (foamed) | ||||
| Polyacrylonitrile (PAN, Orlon, Acrilan) | –(CH 2 -CHCN) n – | акрилонитрил CH 2 =CHCN | high-melting solid soluble in organic solvents | rugs, blankets clothing | ||||
| Polytetrafluoroethylene (PTFE, Teflon) | –(CF 2 -CF 2 ) n – | тетрафторэтилен CF 2 =CF 2 | прочный, гладкий твердый | антипригарные поверхности электрическая изоляция | ||||
| поли(метилметакрилат ) (PMMA, Lucite, Plexiglas) | -[CH 2 -C (Ch 3 ) CO 2 CH 3 ] N — | Метили -мехкрилат CH — | . 3 ) CO 2 CH 3 3 ) CO 2 CH 3 | Hard, прозрачное твердое вещество | СВЕДЕНИЯ. CHOCOCH 3 ) n – | винилацетат CH 2 =CHOCOCH 3 | soft, sticky solid | latex paints, adhesives |
| cis-Polyisoprene natural rubber | –[CH 2 -CH=C(CH 3 ) -CH 2 ] N — | ISOPREN CH 2 = CH-C (CH 3 ) = CH 2 | SOFT, STICK SOLID | . | ||||
| Полихлоропрен (CIS + TRANS) (неопрен) | -[CH 2 -CH = CCL-CH 2 ] N — | Хлореопрен Ch 2 = CH-CCL = CH 2 2 = CH-CCL = CH 2 9130 9130 9130 9130 9130 9150 9150 2 9150 9150 9150 9150 9150 9150 9150 9150 9150 9150 9150 9150 9150 2 . | прочный, резиноподобный твердый | синтетический каучук маслостойкий |
3.
 Свойства макромолекул
Свойства макромолекулПоучительно сравнение свойств полиэтилена (как LDPE, так и HDPE) с природными полимерами каучуком и целлюлозой. Как отмечалось выше, синтетические макромолекулы ПЭВП имеют массы от 10 5 до 10 6 а.е.м. (молекулы LDPE более чем в сто раз меньше). Молекулы каучука и целлюлозы имеют одинаковые диапазоны массы, но меньше мономерных звеньев из-за большего размера мономера. Физические свойства этих трех полимерных веществ отличаются друг от друга и, конечно же, от их мономеров.
ПЭВП представляет собой жесткое полупрозрачное твердое вещество, которое размягчается при нагревании выше 100º C, и из него можно формовать различные формы, включая пленки. Он не так легко растягивается и деформируется, как ПВД. ПЭВП нерастворим в воде и большинстве органических растворителей, хотя при погружении в последние может произойти некоторое набухание. HDPE является отличным электрическим изолятором.
LDPE представляет собой мягкое полупрозрачное твердое вещество, которое плохо деформируется при температуре выше 75º C. Пленки, изготовленные из LDPE, легко растягиваются и обычно используются для обертывания. LDPE нерастворим в воде, но размягчается и набухает при воздействии углеводородных растворителей. И LDPE, и HDPE становятся хрупкими при очень низких температурах (ниже -80ºC). Этилен, обычный мономер для этих полимеров, представляет собой газ с низкой температурой кипения (-104ºC).
Пленки, изготовленные из LDPE, легко растягиваются и обычно используются для обертывания. LDPE нерастворим в воде, но размягчается и набухает при воздействии углеводородных растворителей. И LDPE, и HDPE становятся хрупкими при очень низких температурах (ниже -80ºC). Этилен, обычный мономер для этих полимеров, представляет собой газ с низкой температурой кипения (-104ºC).
Натуральный (латексный) каучук представляет собой непрозрачное, мягкое, легко деформируемое твердое вещество, которое становится липким при нагревании (выше 60°С) и становится хрупким при охлаждении ниже -50°С. Набухает более чем в два раза по сравнению с неполярными органическими растворители, такие как толуол, со временем растворяются, но непроницаемы для воды. С 5 H 8 мономер изопрен представляет собой летучую жидкость (точка кипения 34ºC).
Чистая целлюлоза в виде хлопка представляет собой мягкое гибкое волокно, практически не изменяющееся при изменении температуры в диапазоне от -70 до 80°C. Хлопок легко впитывает воду, но на него не влияет погружение в толуол или большинство других органических растворителей. . Целлюлозные волокна могут изгибаться и скручиваться, но не сильно растягиваются, прежде чем порвутся. Мономер целлюлозы C 6 H 12 O 6 альдогексоза D-глюкоза. Глюкоза представляет собой водорастворимое твердое вещество, плавящееся при температуре ниже 150ºC.
Хлопок легко впитывает воду, но на него не влияет погружение в толуол или большинство других органических растворителей. . Целлюлозные волокна могут изгибаться и скручиваться, но не сильно растягиваются, прежде чем порвутся. Мономер целлюлозы C 6 H 12 O 6 альдогексоза D-глюкоза. Глюкоза представляет собой водорастворимое твердое вещество, плавящееся при температуре ниже 150ºC.
Чтобы объяснить отмеченные здесь различия, нам необходимо рассмотреть природу совокупной макромолекулярной структуры или морфологию каждого вещества. Поскольку полимерные молекулы очень большие, они обычно упаковываются неравномерно, с упорядоченными или кристаллоподобными областями, смешанными с неупорядоченными или аморфными областями. В некоторых случаях все твердое тело может быть аморфным, полностью состоящим из спиральных и запутанных макромолекулярных цепей. Кристалличность возникает, когда линейные полимерные цепи структурно ориентированы в однородной трехмерной матрице. На диаграмме справа кристаллические домены окрашены в синий цвет.
На диаграмме справа кристаллические домены окрашены в синий цвет.
Повышенная кристалличность связана с увеличением жесткости, прочности на разрыв и непрозрачности (из-за светорассеяния). Аморфные полимеры обычно менее жесткие, более слабые и легче деформируются. Часто они прозрачные.
На степень кристалличности влияют три фактора:
i) Длина цепи
ii) Разветвление цепи
iii) 9
Важность первых двух факторов хорошо иллюстрируется различиями между LDPE и HDPE. Как отмечалось ранее, ПЭВП состоит из очень длинных неразветвленных углеводородных цепей. Они легко объединяются в кристаллические домены, которые чередуются с аморфными сегментами, и полученный материал, хотя и относительно прочный и жесткий, сохраняет некоторую гибкость. Напротив, ПЭНП состоит из меньших по размеру и более разветвленных цепей, которым нелегко принять кристаллическую структуру. Таким образом, этот материал мягче, слабее, менее плотный и легче деформируется, чем HDPE. Как правило, механические свойства, такие как пластичность, прочность на растяжение и твердость, повышаются и в конечном итоге выравниваются с увеличением длины цепи.
Как правило, механические свойства, такие как пластичность, прочность на растяжение и твердость, повышаются и в конечном итоге выравниваются с увеличением длины цепи.
Природа целлюлозы подтверждает приведенный выше анализ и демонстрирует важность третьего фактора (iii). Начнем с того, что цепи целлюлозы легко принимают стабильную палочковидную конформацию. Эти молекулы выстраиваются бок о бок в волокна, которые стабилизируются межцепочечной водородной связью между тремя гидроксильными группами на каждом мономерном звене. Следовательно, кристалличность высока, и молекулы целлюлозы не перемещаются и не скользят друг относительно друга. Высокая концентрация гидроксильных групп также объясняет легкое поглощение воды, характерное для хлопка.
Натуральный каучук представляет собой полностью аморфный полимер. К сожалению, потенциально полезные свойства необработанного латексного каучука ограничены температурной зависимостью; однако эти свойства могут быть изменены путем химического изменения. Цис-двойные связи в углеводородной цепи образуют плоские сегменты, которые делают цепь более жесткой, но не выпрямляют ее. Если эти жесткие сегменты полностью удалить гидрированием (катализатор H 2 и Pt), цепи теряют все ограничения, и продукт представляет собой легкоплавкое парафиноподобное полутвердое вещество, имеющее небольшую ценность. Если вместо этого цепочки молекул каучука слегка сшиты атомами серы, процесс, называемый вулканизации , которая была открыта Чарльзом Гудиером в 1839 году, желаемые эластомерные свойства каучука существенно улучшаются. При степени сшивания от 2 до 3% получается полезная мягкая резина, которая больше не страдает от проблем с липкостью и хрупкостью при нагревании и охлаждении. При степени сшивки от 25 до 35% образуется жесткий твердый каучуковый продукт. На следующем рисунке показан сшитый участок аморфного каучука. Щелкнув по диаграмме, она изменится на отображение соответствующего растянутого участка. Цепи с более высоким порядком в растянутой конформации энтропийно нестабильны и возвращаются в исходное свернутое состояние, когда им позволяют расслабиться (щелчок второй раз).
Цис-двойные связи в углеводородной цепи образуют плоские сегменты, которые делают цепь более жесткой, но не выпрямляют ее. Если эти жесткие сегменты полностью удалить гидрированием (катализатор H 2 и Pt), цепи теряют все ограничения, и продукт представляет собой легкоплавкое парафиноподобное полутвердое вещество, имеющее небольшую ценность. Если вместо этого цепочки молекул каучука слегка сшиты атомами серы, процесс, называемый вулканизации , которая была открыта Чарльзом Гудиером в 1839 году, желаемые эластомерные свойства каучука существенно улучшаются. При степени сшивания от 2 до 3% получается полезная мягкая резина, которая больше не страдает от проблем с липкостью и хрупкостью при нагревании и охлаждении. При степени сшивки от 25 до 35% образуется жесткий твердый каучуковый продукт. На следующем рисунке показан сшитый участок аморфного каучука. Щелкнув по диаграмме, она изменится на отображение соответствующего растянутого участка. Цепи с более высоким порядком в растянутой конформации энтропийно нестабильны и возвращаются в исходное свернутое состояние, когда им позволяют расслабиться (щелчок второй раз).
При нагревании или охлаждении большинство полимеров претерпевают тепловые переходы, которые позволяют понять их морфологию. Они определяются как переход расплава , T m и переход в стеклообразное состояние , T g .
T m – температура, при которой кристаллические домены теряют свою структуру или плавятся. По мере увеличения кристалличности увеличивается и T m . |
T г часто зависит от истории образца, особенно от предшествующей термообработки, механических манипуляций и отжига. Иногда ее интерпретируют как температуру, выше которой значительные части полимерных цепей способны скользить относительно друг друга в ответ на приложенную силу. Введение относительно больших и жестких заместителей (например, бензольных колец) будет препятствовать этому движению цепи, увеличивая, таким образом, T г (обратите внимание на полистирол ниже). Введение низкомолекулярных соединений, называемых пластификаторами, в полимерную матрицу увеличивает расстояние между цепями, что позволяет цепям двигаться при более низких температурах. с последующим уменьшением Т г . Дегазация пластификаторов, используемых для модификации пластиковых деталей салона автомобилей, приводит к привычному для нас «запаху новой машины».
Введение относительно больших и жестких заместителей (например, бензольных колец) будет препятствовать этому движению цепи, увеличивая, таким образом, T г (обратите внимание на полистирол ниже). Введение низкомолекулярных соединений, называемых пластификаторами, в полимерную матрицу увеличивает расстояние между цепями, что позволяет цепям двигаться при более низких температурах. с последующим уменьшением Т г . Дегазация пластификаторов, используемых для модификации пластиковых деталей салона автомобилей, приводит к привычному для нас «запаху новой машины».
T m и T g для некоторых распространенных аддитивных полимеров приведены ниже. Обратите внимание, что целлюлоза не имеет ни T м ни Т г .
Polymer | LDPE | HDPE | PP | PVC | PS | PAN | PTFE | PMMA | Резина |
|---|---|---|---|---|---|---|---|---|---|
T m (ºC) | 110 | 130 | 175 | 180 | 175 | >200 | 330 | 180 | 30 |
T g (ºC) | _ 110 | _ 100 | _ 10 | 80 | 90 | 95 | _ 110 | 105 | _ 70 |
Каучук входит в важную группу полимеров под названием 9. 0458 эластомеры . Эластомеры представляют собой аморфные полимеры, обладающие способностью растягиваться, а затем возвращаться в исходную форму при температурах выше Т г . Это свойство важно для таких применений, как прокладки и уплотнительные кольца, поэтому разработка синтетических эластомеров, способных работать в суровых или сложных условиях, остается практической целью. При температурах ниже T g эластомеры становятся жесткими стекловидными телами и теряют всякую эластичность. Трагическим примером этого стала катастрофа космического корабля «Челленджер». Жаростойкие и химически стойкие уплотнительные кольца, используемые для герметизации секций твердотопливных ракет-носителей, имели, к сожалению, высокую Т г около 0 ºC. Неожиданно низкие температуры в утро запуска были ниже этого T g , что позволило горячим ракетным газам выйти из уплотнений.
0458 эластомеры . Эластомеры представляют собой аморфные полимеры, обладающие способностью растягиваться, а затем возвращаться в исходную форму при температурах выше Т г . Это свойство важно для таких применений, как прокладки и уплотнительные кольца, поэтому разработка синтетических эластомеров, способных работать в суровых или сложных условиях, остается практической целью. При температурах ниже T g эластомеры становятся жесткими стекловидными телами и теряют всякую эластичность. Трагическим примером этого стала катастрофа космического корабля «Челленджер». Жаростойкие и химически стойкие уплотнительные кольца, используемые для герметизации секций твердотопливных ракет-носителей, имели, к сожалению, высокую Т г около 0 ºC. Неожиданно низкие температуры в утро запуска были ниже этого T g , что позволило горячим ракетным газам выйти из уплотнений.
4. Регио- и стереоизомеризация в макромолекулах
Симметричные мономеры, такие как этилен и тетрафторэтилен, могут соединяться друг с другом только одним способом. С другой стороны, монозамещенные мономеры могут соединяться вместе двумя организованными способами, описанными на следующей диаграмме, или третьим случайным образом. Большинство мономеров этого типа, включая пропилен, винилхлорид, стирол, акрилонитрил и сложные эфиры акриловой кислоты, предпочитают соединяться «голова к хвосту» с некоторой случайностью, возникающей время от времени. Причины такой региоселективности будут обсуждаться в разделе синтетических методов.
С другой стороны, монозамещенные мономеры могут соединяться вместе двумя организованными способами, описанными на следующей диаграмме, или третьим случайным образом. Большинство мономеров этого типа, включая пропилен, винилхлорид, стирол, акрилонитрил и сложные эфиры акриловой кислоты, предпочитают соединяться «голова к хвосту» с некоторой случайностью, возникающей время от времени. Причины такой региоселективности будут обсуждаться в разделе синтетических методов.
Если полимерная цепь вычерчена зигзагообразно, как показано выше, каждая из замещающих групп (Z) обязательно будет расположена выше или ниже плоскости, определяемой углеродной цепью. Следовательно, мы можем идентифицировать три конфигурационных изомера таких полимеров. Если все заместители лежат на одной стороне цепи, конфигурация называется изотактической . Если заместители регулярно чередуются с одной стороны на другую, такая конфигурация называется 9.0458 синдиотактический . Наконец, случайное расположение групп заместителей упоминается как атактическое . Примеры таких конфигураций показаны здесь.
Наконец, случайное расположение групп заместителей упоминается как атактическое . Примеры таких конфигураций показаны здесь.
Многие распространенные и полезные полимеры, такие как полистирол, полиакрилонитрил и поли(винилхлорид), являются атактическими при обычном получении. Были разработаны специальные катализаторы, которые осуществляют стереорегулярную полимеризацию полипропилена и некоторых других мономеров, а улучшенные свойства, связанные с повышенной кристалличностью этих продуктов, сделали эту область важной областью исследований. Следующие значения Т 9Сообщалось о 0079 г .
Polymer | T g atactic | T g isotactic | T g syndiotactic |
|---|---|---|---|
PP | –20 ºC | 0 ºC | –8 ºC |
ПММА | 100 ºC | 131526 120 ºC |
Свойства данного полимера будут значительно различаться в зависимости от его тактичности. Таким образом, атактический полипропилен непригоден в качестве твердого конструкционного материала и используется в основном как компонент клеев или как мягкая матрица для композиционных материалов. Напротив, изотактический полипропилен представляет собой твердое вещество с высокой температурой плавления (около 170 ºC), из которого можно формовать или подвергать механической обработке структурные компоненты.
Таким образом, атактический полипропилен непригоден в качестве твердого конструкционного материала и используется в основном как компонент клеев или как мягкая матрица для композиционных материалов. Напротив, изотактический полипропилен представляет собой твердое вещество с высокой температурой плавления (около 170 ºC), из которого можно формовать или подвергать механической обработке структурные компоненты.
Синтез аддитивных полимеров
Все мономеры, из которых состоят аддитивные полимеры, представляют собой алкены или функционально замещенные алкены. Наиболее распространенными и термодинамически предпочтительными химическими превращениями алкенов являются реакции присоединения. Известно, что многие из этих реакций присоединения протекают ступенчато с участием реакционноспособных промежуточных соединений, и именно этому механизму следует большинство полимеризаций. Общая схема, иллюстрирующая эту сборку линейных макромолекул, которая поддерживает название полимеры для роста цепи представлены здесь. Поскольку пи-связь в мономере превращается в сигма-связь в полимере, реакция полимеризации обычно экзотермична на 8-20 ккал/моль. Действительно, сообщалось о случаях взрывной неконтролируемой полимеризации.
Поскольку пи-связь в мономере превращается в сигма-связь в полимере, реакция полимеризации обычно экзотермична на 8-20 ккал/моль. Действительно, сообщалось о случаях взрывной неконтролируемой полимеризации.
Полезно различать четыре процедуры полимеризации, соответствующие этому общему описанию.
Радикальная полимеризация Инициатором является радикал, а местом распространения реакционной способности (*) является углеродный радикал.
Катионная полимеризация Инициатором является кислота, а центром распространения реакционной способности (*) является карбокатион.
Анионная полимеризация Инициатором является нуклеофил, а местом распространения реакционной способности (*) является карбанион.
Координационная каталитическая полимеризация Инициатором является комплекс переходного металла, а местом распространения реакционной способности (*) является конечный каталитический комплекс.
1.
 Радикальная полимеризация с ростом цепи
Радикальная полимеризация с ростом цепиПрактически все описанные выше мономеры подвержены радикальной полимеризации. Поскольку это может быть инициировано следами кислорода или других незначительных примесей, чистые образцы этих соединений часто «стабилизируют» небольшими количествами ингибиторов радикалов, чтобы избежать нежелательной реакции. Когда желательна радикальная полимеризация, ее нужно начинать с использования радикального инициатора , такого как пероксид или определенные азосоединения. Формулы некоторых распространенных инициаторов и уравнения, показывающие образование радикальных частиц из этих инициаторов, представлены ниже.
Используя небольшие количества инициаторов, можно полимеризовать широкий спектр мономеров. Одним из примеров такой радикальной полимеризации является превращение стирола в полистирол, показанное на следующей диаграмме. Первые два уравнения иллюстрируют процесс инициирования , а последние два уравнения являются примерами распространения цепи . Каждое мономерное звено добавляется к растущей цепи таким образом, что образуется наиболее стабильный радикал. Поскольку углеродные радикалы стабилизируются заместителями многих видов, предпочтение региоселективности «голова к хвосту» в большинстве аддитивных полимеризаций понятно. Поскольку радикалы устойчивы ко многим функциональным группам и растворителям (включая воду), радикальные полимеризации широко используются в химической промышленности.
Каждое мономерное звено добавляется к растущей цепи таким образом, что образуется наиболее стабильный радикал. Поскольку углеродные радикалы стабилизируются заместителями многих видов, предпочтение региоселективности «голова к хвосту» в большинстве аддитивных полимеризаций понятно. Поскольку радикалы устойчивы ко многим функциональным группам и растворителям (включая воду), радикальные полимеризации широко используются в химической промышленности.
Посмотреть анимированную модель радикальной полимеризации винилхлорида с ростом цепи
В принципе, можно ожидать, что однажды начавшись, радикальная полимеризация будет продолжаться беспрепятственно, производя несколько чрезвычайно длинноцепочечных полимеров. На практике образуется большее количество цепей среднего размера, что указывает на то, что должны иметь место реакции обрыва цепи. Наиболее распространенными процессами прерывания являются Радикальная комбинация и Диспропорционирование 9. 0456 . Эти реакции иллюстрируются следующими уравнениями. Растущие полимерные цепи окрашены в синий и красный цвет, а атом водорода, перенесенный в результате диспропорционирования, окрашен в зеленый цвет. Обратите внимание, что в обоих типах терминации два реакционноспособных радикальных сайта удаляются путем одновременного превращения в стабильный продукт (продукты). Поскольку концентрация радикалов в реакции полимеризации мала по сравнению с другими реагентами (например, мономерами, растворителями и обрывами цепей), скорость, с которой происходят эти радикально-радикальные реакции обрыва, очень мала, и большинство растущих цепей достигают умеренной длины перед обрывом. .
0456 . Эти реакции иллюстрируются следующими уравнениями. Растущие полимерные цепи окрашены в синий и красный цвет, а атом водорода, перенесенный в результате диспропорционирования, окрашен в зеленый цвет. Обратите внимание, что в обоих типах терминации два реакционноспособных радикальных сайта удаляются путем одновременного превращения в стабильный продукт (продукты). Поскольку концентрация радикалов в реакции полимеризации мала по сравнению с другими реагентами (например, мономерами, растворителями и обрывами цепей), скорость, с которой происходят эти радикально-радикальные реакции обрыва, очень мала, и большинство растущих цепей достигают умеренной длины перед обрывом. .
Относительная важность этих обрывов варьируется в зависимости от природы мономера, подвергающегося полимеризации. Комбинация акрилонитрила и стирола является основным процессом. Однако метилметакрилат и винилацетат обрываются в основном диспропорционированием.
Другая реакция, которая отклоняет радикальную полимеризацию с ростом цепи от образования линейных макромолекул, называется передачей цепи . Как следует из названия, эта реакция перемещает углеродный радикал из одного места в другое за счет межмолекулярного или внутримолекулярного переноса атома водорода (окрашен зеленым). Эти возможности демонстрируются следующими уравнениями
Как следует из названия, эта реакция перемещает углеродный радикал из одного места в другое за счет межмолекулярного или внутримолекулярного переноса атома водорода (окрашен зеленым). Эти возможности демонстрируются следующими уравнениями
Реакции передачи цепи особенно распространены при радикальной полимеризации этилена под высоким давлением, которая является методом, используемым для производства LDPE (полиэтилена низкой плотности). 1º-радикал в конце растущей цепи превращается в более стабильный 2º-радикал за счет переноса атома водорода. Дальнейшая полимеризация в новом месте радикала приводит к образованию радикала боковой цепи, что, в свою очередь, может привести к образованию других боковых цепей в результате реакций переноса цепи. В результате морфология ПЭНП представляет собой аморфную сеть сильно разветвленных макромолекул.
2. Катионная полимеризация с ростом цепи
Полимеризация изобутилена (2-метилпропена) следами сильных кислот является примером катионной полимеризации. Полиизобутиленовый продукт представляет собой мягкое каучукоподобное твердое вещество, T г = _ 70ºC, которое используется для изготовления камер. Этот процесс подобен радикальной полимеризации, что демонстрируют следующие уравнения. Рост цепи прекращается, когда концевой карбокатион соединяется с нуклеофилом или теряет протон, давая концевой алкен (как показано здесь).
Полиизобутиленовый продукт представляет собой мягкое каучукоподобное твердое вещество, T г = _ 70ºC, которое используется для изготовления камер. Этот процесс подобен радикальной полимеризации, что демонстрируют следующие уравнения. Рост цепи прекращается, когда концевой карбокатион соединяется с нуклеофилом или теряет протон, давая концевой алкен (как показано здесь).
Мономеры, содержащие стабилизирующие катион группы, такие как алкильные, фенильные или виниловые, могут быть полимеризованы с помощью катионных процессов. Обычно их инициируют при низкой температуре в растворе хлористого метилена. Инициирующими реагентами служат сильные кислоты, такие как HClO 4 или кислоты Льюиса, содержащие следы воды (как показано выше). При низких температурах реакции передачи цепи в таких полимеризациях происходят редко, поэтому получаемые полимеры являются чисто линейными (неразветвленными).
3. Анионная полимеризация с ростом цепи
Обработка холодного раствора стирола в ТГФ 0,001 эквивалента н-бутиллития вызывает немедленную полимеризацию. Это пример анионной полимеризации, ход которой описывается следующими уравнениями. Рост цепи может быть остановлен водой или углекислым газом, и передача цепи происходит редко. Только мономеры, имеющие заместители, стабилизирующие анион, такие как фенил, циано или карбонил, являются хорошими субстратами для этого метода полимеризации. Многие из полученных полимеров в значительной степени изотактичны по конфигурации и имеют высокую степень кристалличности.
Это пример анионной полимеризации, ход которой описывается следующими уравнениями. Рост цепи может быть остановлен водой или углекислым газом, и передача цепи происходит редко. Только мономеры, имеющие заместители, стабилизирующие анион, такие как фенил, циано или карбонил, являются хорошими субстратами для этого метода полимеризации. Многие из полученных полимеров в значительной степени изотактичны по конфигурации и имеют высокую степень кристалличности.
Вещества, которые использовались для инициирования анионной полимеризации, включают щелочные металлы, амиды щелочных металлов, алкиллитий и различные источники электронов. Практическое применение анионной полимеризации происходит при использовании суперклея. Этот материал представляет собой метил-2-цианоакрилат, CH 2 =C(CN)CO 2 CH 3 . При воздействии воды, аминов или других нуклеофилов происходит быстрая полимеризация этого мономера.
4. Каталитическая полимеризация Циглера-Натта
Эффективная и стереоспецифическая процедура каталитической полимеризации была разработана Карлом Зиглером (Германия) и Джулио Натта (Италия) в 1950-х годах. Их результаты позволили впервые синтезировать неразветвленный полиэтилен высокой молекулярной массы (ПЭВП), лабораторный синтез натурального каучука из изопрена и контроль конфигурации полимеров из концевых алкенов, таких как пропен (например, чистые изотактические и синдиотактические полимеры). В случае этилена быстрая полимеризация происходила при атмосферном давлении и температуре от умеренной до низкой, что давало более прочный (более кристаллический) продукт (ПЭВП), чем продукт радикальной полимеризации (ПЭНП). За это важное открытие эти химики получили 1963 Нобелевская премия по химии.
Их результаты позволили впервые синтезировать неразветвленный полиэтилен высокой молекулярной массы (ПЭВП), лабораторный синтез натурального каучука из изопрена и контроль конфигурации полимеров из концевых алкенов, таких как пропен (например, чистые изотактические и синдиотактические полимеры). В случае этилена быстрая полимеризация происходила при атмосферном давлении и температуре от умеренной до низкой, что давало более прочный (более кристаллический) продукт (ПЭВП), чем продукт радикальной полимеризации (ПЭНП). За это важное открытие эти химики получили 1963 Нобелевская премия по химии.
Катализаторы Циглера-Натта получают реакцией некоторых галогенидов переходных металлов с металлоорганическими реагентами, такими как алкилалюминий, литий и цинк. Катализатор, образованный реакцией триэтилалюминия с тетрахлоридом титана, широко изучался, но другие металлы (например, V и Zr) также доказали свою эффективность. На следующей диаграмме представлен один из механизмов этой полезной реакции. Были предложены другие, с изменениями, чтобы приспособиться к гетерогенности или гомогенности катализатора. Полимеризация пропилена под действием титанового катализатора дает изотактический продукт; тогда как катализатор на основе ванадия дает синдиотактический продукт.
Были предложены другие, с изменениями, чтобы приспособиться к гетерогенности или гомогенности катализатора. Полимеризация пропилена под действием титанового катализатора дает изотактический продукт; тогда как катализатор на основе ванадия дает синдиотактический продукт.
Сополимеры
Синтез макромолекул, состоящих из более чем одного мономерного повторяющегося звена, изучался как средство управления свойствами получаемого материала. В этом отношении полезно различать несколько способов включения различных мономерных звеньев в полимерную молекулу. Следующие примеры относятся к двухкомпонентной системе, в которой один мономер обозначен A , а другой Б .
Статистические сополимеры | Также называются статистическими сополимерами. Здесь мономерные звенья распределены в полимерной цепи хаотично, а иногда и неравномерно: ~ ABBAAABAABBBABAABA ~. |
|---|---|
Чередующиеся сополимеры | Здесь мономерные звенья распределены регулярно чередующимся образом, с почти эквимолярными количествами каждого в цепи:0456 ~. |
Блок-сополимеры | Вместо смешанного распределения мономерных звеньев длинная последовательность или блок одного мономера присоединяются к блоку второго мономера: . |
Привитые сополимеры | Как следует из названия, боковые цепи данного мономера присоединены к основной цепи второго мономера:0456 ~. |
1. Добавочная сополимеризация
Большинство прямых сополимеризаций эквимолярных смесей различных мономеров дают статистические сополимеры или, если один мономер намного более реакционноспособен, почти гомополимер этого мономера. Сополимеризация стирола с метилметакрилатом, например, протекает по-разному в зависимости от механизма. Радикальная полимеризация дает статистический сополимер. Однако продуктом катионной полимеризации в основном является полистирол, а анионная полимеризация способствует образованию поли(метилметакрилата). В тех случаях, когда относительные реакционные способности различны, состав сополимера иногда можно контролировать, непрерывно вводя в реакцию смещенную смесь мономеров.
Радикальная полимеризация дает статистический сополимер. Однако продуктом катионной полимеризации в основном является полистирол, а анионная полимеризация способствует образованию поли(метилметакрилата). В тех случаях, когда относительные реакционные способности различны, состав сополимера иногда можно контролировать, непрерывно вводя в реакцию смещенную смесь мономеров.
Образование чередующихся сополимеров предпочтительно, когда мономеры имеют разные полярные заместители (например, один электроноакцепторный и другой электронодонорный), и оба имеют одинаковую реакционную способность по отношению к радикалам. Например, стирол и акрилонитрил сополимеризуются в значительной степени чередующимся образом.
Мономер A | Мономер B | Сополимер | Применение | |||
|---|---|---|---|---|---|---|
| H 2 C=CHCl | H 2 C=CCl 2 | Saran | films & fibers | |||
| H 2 C=CHC 6 H 5 | H 2 C = C-CH = CH 2 | SBR Стирол Бутадиен резина | Шины | |||
| H 2 C = CHCN | ||||||
| H 2 C = CHCN | ||||||
H 2 C = CHCN 6 H . 2 2 | Нитрилкаучук | Клеи Шланги | ||||
| H 2 C = C (CH 3 ) 2 | H 2 C = CH = CH 2 | 680 C = CH = CH 2 | 616. F 2 C = CF (CF 3 ) | H 2 C = CHF | VITON | БАСКЕТЫ |
A-ARPOLYMER ACRYENITRE-ARMEENER, ARPOLY-ARPELY-ARPERENER, ARPHERENE-ARMEENER, ARPELYRE-ITRIYRE-ARMENIERENITRE-ITRYERENITRE-ITRIYR, ARPERENIER. ударные емкости, трубы и прокладки.
2. Блок-сополимеризация
Было разработано несколько различных методов получения блок-сополимеров, многие из которых используют реакции конденсации (следующий раздел). На этом этапе наше обсуждение будет ограничено применением анионной полимеризации. При анионной полимеризации стирола, описанной выше, реакционноспособный центр остается на конце цепи до тех пор, пока он не будет погашен. Негашеный полимер был назван живым полимером , и если добавить дополнительный стирол или другой подходящий мономер, образуется блок-полимер. Это показано для метилметакрилата на следующей диаграмме.
Негашеный полимер был назван живым полимером , и если добавить дополнительный стирол или другой подходящий мономер, образуется блок-полимер. Это показано для метилметакрилата на следующей диаграмме.
Конденсационные полимеры
Большое количество важных и полезных полимерных материалов не образуется в результате процессов роста цепи с участием реакционноспособных частиц, таких как радикалы, а вместо этого происходит в результате обычных превращений функциональных групп полифункциональных реагентов. Эти полимеризации часто (но не всегда) происходят с потерей небольшого побочного продукта, такого как вода, и обычно (но не всегда) объединяют два разных компонента в чередующуюся структуру. Полиэстер Dacron и полиамид Nylon 66, показанные здесь, являются двумя примерами синтетических конденсационных полимеров, также известных как 9.0458 ступенчатые полимеры . В отличие от полимеров с цепным ростом, большинство из которых растет за счет образования связи углерод-углерод, полимеры со ступенчатым ростом обычно растут за счет образования связи углерод-гетероатом (CO и CN в дакроне и нейлоне соответственно). Хотя полимеры этого типа можно рассматривать как чередующиеся сополимеры, повторяющееся мономерное звено обычно определяется как комбинированный фрагмент.
Хотя полимеры этого типа можно рассматривать как чередующиеся сополимеры, повторяющееся мономерное звено обычно определяется как комбинированный фрагмент.
Примерами встречающихся в природе конденсационных полимеров являются целлюлоза, полипептидные цепи белков и поли(β-гидроксимасляная кислота), сложный полиэфир, синтезируемый в больших количествах некоторыми почвенными и водными бактериями. Формулы для них будут отображаться ниже, если щелкнуть по диаграмме.
1. Характеристики конденсационных полимеров
Конденсационные полимеры образуются медленнее, чем аддитивные полимеры, часто требуют нагревания и обычно имеют более низкую молекулярную массу. Концевые функциональные группы в цепи остаются активными, так что группы более коротких цепей объединяются в более длинные цепи на поздних стадиях полимеризации. Присутствие полярных функциональных групп в цепях часто увеличивает притяжение цепей друг к другу, особенно если они связаны с водородными связями, и, таким образом, кристалличность и прочность на растяжение. Следующие примеры конденсационных полимеров являются иллюстративными.
Следующие примеры конденсационных полимеров являются иллюстративными.
Обратите внимание, что для коммерческого синтеза компоненты карбоновой кислоты могут фактически использоваться в форме производных, таких как простые эфиры. Кроме того, реакции полимеризации нейлона 6 и спандекса не протекают за счет удаления воды или других малых молекул. Тем не менее, очевидно, что полимер образуется в результате ступенчатого процесса роста.
Formula | Тип | Компоненты | T G ºC | T M ºC |
|---|---|---|---|---|
| ~ [CO (CH 2 ) 4 CO-AOCH 2 7080) 4 CO-OH 2 707080808080808080808080808080808080808080808080808080808080808080808. 4 8080) | polyester | HO 2 C-(CH 2 ) 4 -CO 2 H HO-CH 2 CH 2 -OH | 50 | |
| полиэстер дакрон Mylar | para HO 2 C-C 6 H 4 -CO 2 H HO-CH 2 CH 2 -OH | 70 | 265 | |
| polyester | meta HO 2 C-C 6 H 4 -CO 2 H HO-CH 2 CH 2 -OH | 50 | 240 | |
| поликарбонат LEXAN | (HO -C 6 H 4 -) 2 C (Ch 3 ) 2 (Bisphenol A) X 2 80237 (Bisphenol A) X 2 8080237 (Bisphenol A) X 2 80808080808080808080808080808080.  C = C = . 3 or Cl) | 150 | 267 | |
| ~[CO(CH 2 ) 4 CO-NH(CH 2 ) 6 NH] n ~ | polyamide Нейлон 66 | HO 2 C-(CH 2 ) 4 -CO 2 H H 2 N-(CH 2 ) 6 -NH 2 | 45 | 265 |
| ~[CO(CH 2 ) 5 NH ] n ~ | polyamide Nylon 6 Perlon | 53 | 223 | |
| polyamide Kevlar | para HO 2 C-C 6 H 4 — СО 2 H para H 2 N-C 6 H 4 -NH 2 | — | 500 | |
| polyamide Nomex | meta HO 2 C-C 6 H 4 -CO 2 H meta H 2 N-C 6 H 4 -NH 2 | 273 | 390 | |
| polyurethane Спандекс | HOCH 2 CH 2 OH | 52 | — |
Разница в T g и T m между первым полиэфиром (полностью алифатическим) и двумя найлоновыми полиамидами (5-я и 6-я позиции) показывает влияние внутрицепочечной водородной связи на кристалличность. Замена гибких алкилиденовых звеньев жесткими бензольными кольцами также делает полимерную цепь более жесткой, что приводит к повышению кристалличности, как это продемонстрировано для сложных полиэфиров (опыты 1, 2 и 3) и полиамидов (опыты 5, 6, 7 и 8). Высокий Т 9Значения 0079 g и T m для аморфного полимера Lexan согласуются с его блестящей прозрачностью и стеклоподобной жесткостью. Кевлар и номекс — чрезвычайно прочные и стойкие материалы, которые находят применение в пуленепробиваемых жилетах и огнеупорной одежде.
Замена гибких алкилиденовых звеньев жесткими бензольными кольцами также делает полимерную цепь более жесткой, что приводит к повышению кристалличности, как это продемонстрировано для сложных полиэфиров (опыты 1, 2 и 3) и полиамидов (опыты 5, 6, 7 и 8). Высокий Т 9Значения 0079 g и T m для аморфного полимера Lexan согласуются с его блестящей прозрачностью и стеклоподобной жесткостью. Кевлар и номекс — чрезвычайно прочные и стойкие материалы, которые находят применение в пуленепробиваемых жилетах и огнеупорной одежде.
Многие полимеры, как аддитивные, так и конденсационные, используются в качестве волокон. Основными методами формования синтетических полимеров в волокна являются расплавы или вязкие растворы. Сложные полиэфиры, полиамиды и полиолефины обычно получают формованием из расплавов при условии, что Т м не слишком высоко. Полиакрилаты подвержены термическому разложению, поэтому их получают из растворов в летучем растворителе. Холодное волочение является важной физической обработкой, улучшающей прочность и внешний вид этих полимерных волокон. При температурах выше T g более толстое волокно может быть принудительно растянуто во много раз по сравнению с его длиной; и при этом полимерные цепи распутываются и имеют тенденцию выстраиваться параллельно. Эта процедура холодного волочения организует произвольно ориентированные кристаллические домены, а также выравнивает аморфные домены, чтобы они стали более кристаллическими. В этих случаях физически ориентированная морфология стабилизируется и сохраняется в конечном продукте. Это контрастирует с эластомерными полимерами, для которых растянутая или выровненная морфология нестабильна по сравнению с морфологией аморфного случайного клубка.
Холодное волочение является важной физической обработкой, улучшающей прочность и внешний вид этих полимерных волокон. При температурах выше T g более толстое волокно может быть принудительно растянуто во много раз по сравнению с его длиной; и при этом полимерные цепи распутываются и имеют тенденцию выстраиваться параллельно. Эта процедура холодного волочения организует произвольно ориентированные кристаллические домены, а также выравнивает аморфные домены, чтобы они стали более кристаллическими. В этих случаях физически ориентированная морфология стабилизируется и сохраняется в конечном продукте. Это контрастирует с эластомерными полимерами, для которых растянутая или выровненная морфология нестабильна по сравнению с морфологией аморфного случайного клубка.
Щелкнув по следующей диаграмме, карикатура этих изменений переключится с одной крайности на другую. Эту обработку холодным волочением можно также использовать для обработки полимерных пленок (например, Mylar и Saran), а также волокон.
Ступенчатая полимеризация также используется для получения класса клеев и аморфных твердых веществ, называемых эпоксидными смолами. Здесь ковалентная связь происходит в результате реакции S N 2 между нуклеофилом, обычно амином, и концевым эпоксидом. В следующем примере тот же промежуточный продукт бисфенола А, который используется в качестве мономера для лексана, служит бифункциональным каркасом, к которому присоединены эпоксидные кольца. Бисфенол А получают катализируемой кислотой конденсацией ацетона с фенолом.
2. Термореактивные и термопластичные полимеры
Большинство полимеров, описанных выше, классифицируются как термопласты . Это отражает тот факт, что выше Т и они могут формоваться или прессоваться в формы, формоваться или отливаться из расплава или растворяться в подходящих растворителях для последующего формования. Из-за их высокой температуры плавления и плохой растворимости в большинстве растворителей кевлар и номекс оказались проблемой, но в конечном итоге эта проблема была решена.
Другая группа полимеров, характеризующаяся высокой степенью сшивания, сопротивляется деформации и растворению после достижения их окончательной морфологии. Такие полимеры обычно готовят в формах, которые позволяют получить желаемый объект. Поскольку эти полимеры после образования не могут быть изменены при нагревании, их называют реактопластов . Частичные формулы для четырех из них будут показаны ниже, нажав соответствующую кнопку. Первоначальная экспозиция представляет собой бакелит, один из первых полностью синтетических пластиков, который начал использоваться в коммерческих целях (около 1910 г.).
Природный смолистый полимер, называемый лигнином, имеет сшитую структуру, похожую на бакелит. Лигнин представляет собой аморфную матрицу, в которой ориентированы целлюлозные волокна древесины. Древесина — природный композитный материал, природный эквивалент композитов из стекловолокна и углеродного волокна. Частичная структура лигнина показана здесь
Эпоха пластмасс
Исторически многие эпохи характеризовались материалами, которые были тогда важны для человеческого общества (например, каменный век, бронзовый век и железный век). ХХ век получил несколько ярлыков такого рода, в том числе ядерный век и нефтяной век ; тем не менее, лучшее название, вероятно, пластический век . В течение этого периода никакие технологические достижения, кроме подачи электроэнергии в каждый дом, не повлияли на нашу жизнь больше, чем широкое использование синтетических пластмасс в нашей одежде, посуде, строительных материалах, автомобилях, упаковке и игрушках, и это лишь некоторые из них. . Разработка материалов, которые мы сейчас называем пластмассами, началась с вискозы в 189 г.1, продолжая выпуск бакелита в 1907 г., полиэтилена в 1933 г., нейлона и тефлона в 1938 г., полипропилена в 1954 г., кевлара в 1965 г., и так далее.
ХХ век получил несколько ярлыков такого рода, в том числе ядерный век и нефтяной век ; тем не менее, лучшее название, вероятно, пластический век . В течение этого периода никакие технологические достижения, кроме подачи электроэнергии в каждый дом, не повлияли на нашу жизнь больше, чем широкое использование синтетических пластмасс в нашей одежде, посуде, строительных материалах, автомобилях, упаковке и игрушках, и это лишь некоторые из них. . Разработка материалов, которые мы сейчас называем пластмассами, началась с вискозы в 189 г.1, продолжая выпуск бакелита в 1907 г., полиэтилена в 1933 г., нейлона и тефлона в 1938 г., полипропилена в 1954 г., кевлара в 1965 г., и так далее.
Многие типы полимеров, которые мы смешиваем вместе как пластмассы, как правило, недороги, легки, прочны, долговечны и, при желании, гибки. Пластмассы могут обрабатываться экструзией, литьем под давлением, вакуумным формованием и прессованием, образуя волокна, тонкие листы или объекты определенной формы. Они могут быть окрашены по желанию и армированы стеклянными или углеродными волокнами, а некоторые из них могут быть расширены до пены низкой плотности. Многие современные клеи предполагают образование пластичного связующего вещества. Пластмассы заменили все большее количество природных материалов. При производстве клавиш пианино и бильярдных шаров пластик заменил слоновую кость, помогая слону выжить. Примечательно, что предприятие по производству синтетического волокна занимает гораздо меньшую площадь земли, чем потребовалось бы для производства такого же количества натуральных волокон, таких как хлопок, шерсть или шелк. При всех этих преимуществах неудивительно, что многое из того, что вы видите вокруг себя, сделано из пластика. Действительно, низкая стоимость, малый вес, прочность и конструктивная адаптируемость пластиков для решения различных задач привели к значительному росту их производства и использования из года в год, который, вероятно, продолжится. Действительно, многие пластмассы используются в одноразовых продуктах, предназначенных только для одноразового использования.
Они могут быть окрашены по желанию и армированы стеклянными или углеродными волокнами, а некоторые из них могут быть расширены до пены низкой плотности. Многие современные клеи предполагают образование пластичного связующего вещества. Пластмассы заменили все большее количество природных материалов. При производстве клавиш пианино и бильярдных шаров пластик заменил слоновую кость, помогая слону выжить. Примечательно, что предприятие по производству синтетического волокна занимает гораздо меньшую площадь земли, чем потребовалось бы для производства такого же количества натуральных волокон, таких как хлопок, шерсть или шелк. При всех этих преимуществах неудивительно, что многое из того, что вы видите вокруг себя, сделано из пластика. Действительно, низкая стоимость, малый вес, прочность и конструктивная адаптируемость пластиков для решения различных задач привели к значительному росту их производства и использования из года в год, который, вероятно, продолжится. Действительно, многие пластмассы используются в одноразовых продуктах, предназначенных только для одноразового использования.
Закон о непредвиденных последствиях
Успешные решения технологических проектов часто достигаются путем сосредоточения внимания на ограниченном наборе переменных, которые напрямую связаны с желаемым результатом. Однако у природы часто есть способ вознаградить такой успех, выявив неожиданные проблемы, возникшие «вне коробки» определенного проекта. В случае с пластмассами их благоприятная долговечность и относительная низкая стоимость привели к серьезному загрязнению окружающей среды, поскольку использованные предметы и обертки небрежно выбрасываются и заменяются в бесконечном цикле. Мы видим это каждый день на улицах и полях наших кварталов, но проблема гораздо серьезнее. Чарльз Мур, американский океанограф, в 1997-й обнаружил огромное скопление мусора, оцениваемое почти в 100 миллионов тонн, плавающее в Тихом океане между Сан-Франциско и Гавайями. Названное «Большим тихоокеанским мусорным пятном», это месиво из мусора состоит в основном (80%) из кусочков пластика, которые перевешивают планктон в соотношении 6:1, в районе, вдвое превышающем размер Техаса. Хотя часть этих обломков происходит от судов в море, не менее 80% приходится на наземный мусор. Представленная здесь информация и иллюстрация слева взяты из статьи Сьюзан Кейси в
БестЛайф
Хотя часть этих обломков происходит от судов в море, не менее 80% приходится на наземный мусор. Представленная здесь информация и иллюстрация слева взяты из статьи Сьюзан Кейси в
БестЛайф
Циркуляция течений по часовой стрелке, движимая глобальной системой ветра и ограниченная окружающими континентами, образует вихрь или круговорот, сравнимый с большим водоворотом. Каждый крупный океанический бассейн имеет большой круговорот в субтропическом регионе с центром около 30º северной и южной широты. Североатлантический субтропический круговорот известен как Саргассово море. Более крупный субтропический круговорот в северной части Тихого океана, называемый депрессией, представляет собой зону конвергенции, где пластик и другие отходы смешиваются вместе. Подобные области есть в южной части Тихого океана, в Северной и Южной Атлантике и в Индийском океане.
Помимо отвратительного эстетического вида, мусорное пятно представляет собой серьезную проблему для окружающей среды и здоровья. Никто не знает, сколько времени потребуется для того, чтобы некоторые из этих пластиков разложились или вернулись к составляющим их молекулам. Устойчивые объекты, такие как кольца из шести упаковок и выброшенные сети, ловят морских животных. Морские птицы принимают мелкие пластиковые отходы за пищу; и часто обнаруживаются непереваренными в кишечнике мертвых птиц. Гранулы пластика размером с чечевицу, в изобилии встречающиеся там, где производятся и распространяются пластмассы, разносятся ветром по всей биосфере. Они достаточно легкие, чтобы развеваться, как пыль, и смываться в гавани, ливневые стоки и ручьи. Сбежавшие гранулы и другой пластиковый мусор мигрируют в океан по круговороту в основном с суши. В таких отдаленных местах, как Раротонга на островах Кука, они обычно встречаются в смеси с пляжным песком. Оказавшись в океане, гранулы могут поглощать в миллион раз больше любых органических загрязнителей, обнаруженных в окружающих водах. Пустышки в море легко принимают за рыбью икру существа, которые очень хотели бы такой закуской.
Никто не знает, сколько времени потребуется для того, чтобы некоторые из этих пластиков разложились или вернулись к составляющим их молекулам. Устойчивые объекты, такие как кольца из шести упаковок и выброшенные сети, ловят морских животных. Морские птицы принимают мелкие пластиковые отходы за пищу; и часто обнаруживаются непереваренными в кишечнике мертвых птиц. Гранулы пластика размером с чечевицу, в изобилии встречающиеся там, где производятся и распространяются пластмассы, разносятся ветром по всей биосфере. Они достаточно легкие, чтобы развеваться, как пыль, и смываться в гавани, ливневые стоки и ручьи. Сбежавшие гранулы и другой пластиковый мусор мигрируют в океан по круговороту в основном с суши. В таких отдаленных местах, как Раротонга на островах Кука, они обычно встречаются в смеси с пляжным песком. Оказавшись в океане, гранулы могут поглощать в миллион раз больше любых органических загрязнителей, обнаруженных в окружающих водах. Пустышки в море легко принимают за рыбью икру существа, которые очень хотели бы такой закуской. Оказавшись внутри тела большеглазого тунца или королевского лосося, они становятся частью нашей пищевой цепи.
Оказавшись внутри тела большеглазого тунца или королевского лосося, они становятся частью нашей пищевой цепи.
Переработка и утилизация
Большинство пластиков рассыпаются на все более мелкие фрагменты под воздействием солнечного света и непогоды. За исключением небольшого количества, которое было сожжено — а это очень небольшое количество — каждый кусочек когда-либо произведенного пластика все еще существует, если только молекулярная структура материала не предназначена для биоразложения. К сожалению, очистка участка мусора не является реалистичным вариантом, и если мы не изменим наши привычки утилизации и переработки, он, несомненно, станет больше. Одним из разумных решений было бы требование к производителям по возможности использовать натуральные биоразлагаемые упаковочные материалы, а потребителям — добросовестно утилизировать свои пластиковые отходы. Таким образом, вместо того, чтобы выбрасывать весь пластиковый мусор на свалку, часть его может давать энергию путем прямого сжигания, а часть перерабатываться для повторного использования в качестве заменителя первичного пластика. Последнее особенно привлекательно, поскольку большая часть пластмасс производится из нефти, сокращающегося ресурса с неустойчивой ценой.
Последнее особенно привлекательно, поскольку большая часть пластмасс производится из нефти, сокращающегося ресурса с неустойчивой ценой.
Энергетический потенциал пластиковых отходов относительно значителен и составляет от 10,2 до 30,7 МДж/кг, что позволяет предположить их применение в качестве источника энергии и стабилизатора температуры на муниципальных мусоросжигательных заводах, теплоэлектростанциях и цементных печах. Использование пластиковых отходов в качестве источника топлива могло бы стать эффективным средством сокращения потребности в мусорных свалках при восстановлении энергии. Это, однако, зависит от использования соответствующих материалов. Недостаточный контроль горения, особенно пластмасс, содержащих хлор, фтор и бром, создает риск выделения токсичных загрязняющих веществ.
Независимо от того, используются ли пластиковые отходы в качестве топлива или в качестве источника переработанного пластика, они должны быть разделены на разные категории. С этой целью в 1988 году Общество производителей пластмасс (SPI) разработало систему идентификационного кодирования, которая используется во всем мире. Этот код, показанный справа, представляет собой набор символов, нанесенных на пластмассу для идентификации типа полимера с целью обеспечения эффективного разделения различных типов полимеров для переработки. Сокращения кода объясняются в следующей таблице.
Этот код, показанный справа, представляет собой набор символов, нанесенных на пластмассу для идентификации типа полимера с целью обеспечения эффективного разделения различных типов полимеров для переработки. Сокращения кода объясняются в следующей таблице.
| ||||||||||||||||||||||
Несмотря на использование символа вторичной переработки в кодировке пластмасс, у потребителей возникает путаница в отношении того, какие пластмассы легко перерабатываются. В большинстве населенных пунктов по всей территории Соединенных Штатов PETE и HDPE являются единственными пластиками, собираемыми в рамках муниципальных программ утилизации. Тем не менее, некоторые регионы расширяют ассортимент собираемого пластика по мере появления рынков. (Например, в Лос-Анджелесе перерабатывается весь чистый пластик с номерами от 1 до 7). Теоретически, большинство пластиков пригодны для вторичной переработки, и некоторые типы можно использовать в сочетании с другими. Однако во многих случаях существует несовместимость между различными типами, что требует их эффективного разделения. Поскольку пластмассы, используемые в данном производственном секторе (например, в электронике, автомобилестроении и т. д.), как правило, ограничены несколькими типами, эффективная переработка часто лучше всего достигается с помощью целевых потоков отходов.
В большинстве населенных пунктов по всей территории Соединенных Штатов PETE и HDPE являются единственными пластиками, собираемыми в рамках муниципальных программ утилизации. Тем не менее, некоторые регионы расширяют ассортимент собираемого пластика по мере появления рынков. (Например, в Лос-Анджелесе перерабатывается весь чистый пластик с номерами от 1 до 7). Теоретически, большинство пластиков пригодны для вторичной переработки, и некоторые типы можно использовать в сочетании с другими. Однако во многих случаях существует несовместимость между различными типами, что требует их эффективного разделения. Поскольку пластмассы, используемые в данном производственном секторе (например, в электронике, автомобилестроении и т. д.), как правило, ограничены несколькими типами, эффективная переработка часто лучше всего достигается с помощью целевых потоков отходов.
Пластиковый мусор из большинства домохозяйств, даже при некотором разделении пользователей, представляет собой смесь неопознанных кусочков. Утилизация таких смесей является сложной задачей. Процесс float/sink оказался полезным в качестве первого шага. При помещении в среду средней плотности частицы разной плотности отделяются друг от друга: частицы с меньшей плотностью всплывают, а частицы с большей плотностью тонут. Использовались различные разделительные среды, в том числе вода или водные растворы известной плотности (спирт, NaCl, CaCl 2 или ZnCl 2 ).
Как показано в следующей таблице, плотности обычных пластиков достаточно различаются, чтобы их можно было различать таким образом. Цилиндроконическое циклонное устройство, показанное справа, обеспечивает процедуру непрерывной подачи, при которой материал, подлежащий разделению, закачивается в емкость одновременно с разделяющей средой. Некоторые полимеры, такие как полистирол и полиуретан, обычно превращают в вспененные твердые вещества, которые имеют гораздо меньшую плотность, чем твердый материал.
Утилизация таких смесей является сложной задачей. Процесс float/sink оказался полезным в качестве первого шага. При помещении в среду средней плотности частицы разной плотности отделяются друг от друга: частицы с меньшей плотностью всплывают, а частицы с большей плотностью тонут. Использовались различные разделительные среды, в том числе вода или водные растворы известной плотности (спирт, NaCl, CaCl 2 или ZnCl 2 ).
Как показано в следующей таблице, плотности обычных пластиков достаточно различаются, чтобы их можно было различать таким образом. Цилиндроконическое циклонное устройство, показанное справа, обеспечивает процедуру непрерывной подачи, при которой материал, подлежащий разделению, закачивается в емкость одновременно с разделяющей средой. Некоторые полимеры, такие как полистирол и полиуретан, обычно превращают в вспененные твердые вещества, которые имеют гораздо меньшую плотность, чем твердый материал.
| ||||||||||||||
One serious problem in recycling is из-за множества добавок, содержащихся в пластиковых отходах. К ним относятся пигменты для окраски, твердые волокна в композитах, стабилизаторы и пластификаторы. В случае ПЭТФ (или ПЭТФ), который обычно используется для изготовления бутылок, некоторые отходы могут подвергаться механической и термической обработке для производства упаковочных материалов и волокон низкого качества. Для повышения ценности извлеченного ПЭТЭ его можно деполимеризовать перегретым метанолом в диметилтерефталат и этиленгликоль. Затем эти химические вещества очищают и используют для производства первичного ПЭТ. Углеводородные полимеры, такие как полиэтилен и полипропилен, могут быть расплавлены и экструдированы в гранулы для повторного использования. Однако наличие красителей или пигментов ограничивает ценность этого продукта.
Затем эти химические вещества очищают и используют для производства первичного ПЭТ. Углеводородные полимеры, такие как полиэтилен и полипропилен, могут быть расплавлены и экструдированы в гранулы для повторного использования. Однако наличие красителей или пигментов ограничивает ценность этого продукта.
Биоразлагаемые полимеры
Пластмассы, полученные из природных материалов, таких как целлюлоза, крахмал и гидроксикарбоновые кислоты, легче разлагаются под воздействием кислорода, воды, почвенных организмов и солнечного света, чем большинство полимеров на основе нефти. Гликозидные связи в полисахаридах и сложноэфирные группы в полиэфирах представляют собой точки атаки ферментов микроорганизмов, которые облегчают их разложение. Такие биоразлагаемые материалы можно компостировать, разлагать и возвращать в землю в качестве полезных питательных веществ. Тем не менее, важно признать, что правильное компостирование необходимо. Размещение таких материалов на свалке приводит к более медленному анаэробному разложению, в результате которого образуется метан, парниковый газ.
Производные целлюлозы, такие как ацетат целлюлозы, уже давно используются для производства пленок и волокон. Наиболее полезным ацетатным материалом является диацетат, в котором две трети гидроксильных групп целлюлозы этерифицированы. Ацетатные волокна теряют прочность при намокании, поэтому одежду из ацетата необходимо сдавать в химчистку. Другой основной полисахарид, крахмал, менее прочен, чем целлюлоза, но в гранулированной форме он в настоящее время заменяет полистирол в качестве упаковочного материала.
Двумя природными полиэфирами, которые находят все более широкое применение в качестве заменителей пластмасс на нефтяной основе, являются полилактид (PLA) и полигидроксиалканоаты (PHA), последние чаще всего представляют собой сополимеры с полигидроксибутиратом (PHB). Структуры этих полимеров и их мономерных предшественников показаны ниже.
PLA на самом деле является полимером молочной кислоты, но димерный лактид используется в качестве предшественника, чтобы избежать образования воды при прямой полиэтерификации. Бактериальная ферментация используется для получения молочной кислоты из кукурузного крахмала или тростникового сахара. После димеризации до лактида проводят полимеризацию очищенного лактида с раскрытием цикла с использованием соединений двухвалентного олова в качестве катализаторов. PLA можно перерабатывать, как и большинство термопластов, в волокна и пленки. В ситуациях, требующих высокого уровня ударной вязкости, прочности PLA в первозданном виде часто бывает недостаточно. Смеси PLA с полимерами, такими как ABS, обладают хорошей стабильностью формы и визуальной прозрачностью, что делает их полезными для недорогих упаковочных приложений. Материалы PLA в настоящее время используются в ряде биомедицинских приложений, таких как швы, стенты, диализные среды и устройства для доставки лекарств. Однако одним из недостатков полилактидов для биомедицинских применений является их хрупкость.
Бактериальная ферментация используется для получения молочной кислоты из кукурузного крахмала или тростникового сахара. После димеризации до лактида проводят полимеризацию очищенного лактида с раскрытием цикла с использованием соединений двухвалентного олова в качестве катализаторов. PLA можно перерабатывать, как и большинство термопластов, в волокна и пленки. В ситуациях, требующих высокого уровня ударной вязкости, прочности PLA в первозданном виде часто бывает недостаточно. Смеси PLA с полимерами, такими как ABS, обладают хорошей стабильностью формы и визуальной прозрачностью, что делает их полезными для недорогих упаковочных приложений. Материалы PLA в настоящее время используются в ряде биомедицинских приложений, таких как швы, стенты, диализные среды и устройства для доставки лекарств. Однако одним из недостатков полилактидов для биомедицинских применений является их хрупкость.
Молочная кислота имеет хиральный центр, причем (S)(+)-энантиомер представляет собой широко распространенную природную форму (L-молочная кислота). Из-за хиральной природы молочной кислоты существует несколько различных форм полилактида. Поли-L-лактид (PLLA) представляет собой продукт полимеризации (S,S)-лактида. PLLA имеет кристалличность около 37%, температуру стеклования 50-80 ºC и температуру плавления 173-178 ºC. Температура плавления PLLA может быть увеличена на 40-50 ºC, а температура его тепловой деформации может быть увеличена примерно с 60 ºC до 190 ºC путем физического смешивания полимера с PDLA (поли-D-лактидом). PDLA и PLLA образуют высокорегулярный стереокомплекс с повышенной кристалличностью.
Из-за хиральной природы молочной кислоты существует несколько различных форм полилактида. Поли-L-лактид (PLLA) представляет собой продукт полимеризации (S,S)-лактида. PLLA имеет кристалличность около 37%, температуру стеклования 50-80 ºC и температуру плавления 173-178 ºC. Температура плавления PLLA может быть увеличена на 40-50 ºC, а температура его тепловой деформации может быть увеличена примерно с 60 ºC до 190 ºC путем физического смешивания полимера с PDLA (поли-D-лактидом). PDLA и PLLA образуют высокорегулярный стереокомплекс с повышенной кристалличностью.
PHA (полигидроксиалканоаты) синтезируются микроорганизмами, такими как Alcaligenes eutrophus , выращиваются в подходящей среде и питаются соответствующими питательными веществами, так что они быстро размножаются. Как только популяция увеличивается, состав питательных веществ меняется, заставляя микроорганизмы синтезировать ПГА. Собранное количество PHA из организма может достигать 80% от сухого веса организма. Простейшей и наиболее часто встречающейся формой ПГА является поли(R-3-гидроксибутират), ПОБ или П(3ГБ)). Чистый ПОБ, состоящий из 1000-30000 единиц оксикислоты, является относительно хрупким и жестким. В зависимости от микроорганизма, многие из которых созданы для этой цели с помощью генной инженерии, и условий культивирования могут образовываться гомо- или сополиэфиры с различными гидроксиалкановыми кислотами. Такие сополимеры могут иметь улучшенные физические свойства по сравнению с гомо-P(3HB). В настоящее время эти ПГА стоят примерно в два раза дороже, чем пластмассы на нефтяной основе. Также был создан искусственный просо, в листьях и стеблях которого растет ПГА, что дает возможность избежать некоторых затрат, связанных с крупномасштабной бактериальной ферментацией.
Простейшей и наиболее часто встречающейся формой ПГА является поли(R-3-гидроксибутират), ПОБ или П(3ГБ)). Чистый ПОБ, состоящий из 1000-30000 единиц оксикислоты, является относительно хрупким и жестким. В зависимости от микроорганизма, многие из которых созданы для этой цели с помощью генной инженерии, и условий культивирования могут образовываться гомо- или сополиэфиры с различными гидроксиалкановыми кислотами. Такие сополимеры могут иметь улучшенные физические свойства по сравнению с гомо-P(3HB). В настоящее время эти ПГА стоят примерно в два раза дороже, чем пластмассы на нефтяной основе. Также был создан искусственный просо, в листьях и стеблях которого растет ПГА, что дает возможность избежать некоторых затрат, связанных с крупномасштабной бактериальной ферментацией.
В отличие от P(3HB), полимер 4-гидроксибутирата, P(4HB), является эластичным и гибким с более высокой прочностью на разрыв. Сополимеры P(3HB) и P(4HB) синтезированы Comamonas acidovarans . Молекулярная масса остается примерно такой же (400 000–700 000 Да), но термические свойства коррелируют с соотношением этих мономерных звеньев. Т.пл. уменьшается со 179 до 130 (или ниже) с увеличением 4HB, а при увеличении 4HB с 0% до 100% Tg уменьшается с 4 до -46. 4-гидроксибутират (4HB) производится из 1,4-бутандиола микроорганизмами, такими как Aeromonas hydrophila , Escherichia coli или Pseudomonas putida . Затем ферментационный бульон, содержащий 4ГБ, использовали для производства гомополимера П(4ГБ), а также сополимеров с П(3ГБ), [П(3ГБ-4ГБ)]. В следующей таблице перечислены некоторые свойства этих гомополимеров и сополимеров.
Т.пл. уменьшается со 179 до 130 (или ниже) с увеличением 4HB, а при увеличении 4HB с 0% до 100% Tg уменьшается с 4 до -46. 4-гидроксибутират (4HB) производится из 1,4-бутандиола микроорганизмами, такими как Aeromonas hydrophila , Escherichia coli или Pseudomonas putida . Затем ферментационный бульон, содержащий 4ГБ, использовали для производства гомополимера П(4ГБ), а также сополимеров с П(3ГБ), [П(3ГБ-4ГБ)]. В следующей таблице перечислены некоторые свойства этих гомополимеров и сополимеров.
| |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3HV = 3-гидроксивалерат, 3HD = 3-гидроксидеканоат |
Остается открытым вопрос, что более эффективно с точки зрения энергии и затрат – использовать биоразлагаемый пластик или перерабатывать пластик на основе нефти. Однако мало кто сомневается в том, что биоразлагаемые материалы приводят к меньшему загрязнению окружающей среды, если их произвольно выбрасывать после использования, как это часто бывает.
Однако мало кто сомневается в том, что биоразлагаемые материалы приводят к меньшему загрязнению окружающей среды, если их произвольно выбрасывать после использования, как это часто бывает.
Подготовка Гущина к огэ подбор цепочек трансформации. Химия. Новое полное руководство по подготовке к ОГЭ. Медведев Ю.Н. Система оценивания выполнения отдельных заданий и экзаменационной работы в целом
■ Есть ли гарантия, что после занятий с вами мы сдадим ОГЭ по химии на необходимый балл?
Более 80% девятиклассников, прошедших полный курс подготовки к ОГЭ и регулярно выполняющих домашние задания, сдали этот экзамен на отлично! И это при том, что еще за 7-8 месяцев до экзамена многие из них не могли вспомнить формулу серной кислоты и перепутали таблицу растворимости с таблицей Менделеева!
■ Уже январь, знания по химии — на нуле. Уже поздно или еще есть шанс сдать ОГЭ?
Шанс есть, но при условии, что студент готов серьезно работать! Меня не шокирует нулевой уровень знаний. При этом большая часть девятиклассников готовится к ОГЭ. Но нужно понимать, что чудес не бывает. Без активной работы ученика знания «сами собой» в голове не уместятся.
При этом большая часть девятиклассников готовится к ОГЭ. Но нужно понимать, что чудес не бывает. Без активной работы ученика знания «сами собой» в голове не уместятся.
■ Подготовка к ОГЭ по химии – это очень сложно?
Во-первых, это очень интересно! Назвать ОГЭ по химии сложным экзаменом не могу: предлагаемые задания вполне стандартны, круг тем известен, критерии оценивания «прозрачны» и логичны.
■ Как проходит ЕГЭ по химии?
Есть два варианта проведения ОГЭ: с экспериментальной частью и без нее. В первом варианте студентам предлагается 23 задания, два из которых связаны с практической работой. У вас есть 140 минут, чтобы выполнить задание. Во втором варианте нужно решить 22 задачи за 120 минут. 19задания требуют только краткого ответа, остальные требуют развернутого решения.
■ Как (технически) я могу записаться на ваши занятия?
Очень просто!
- Позвоните мне по телефону: 8-903-280-81-91 .
 Звонить можно в любой день до 23.00.
Звонить можно в любой день до 23.00. - Организуем первую встречу для предварительного тестирования и определения уровня группы.
- Вы сами выбираете удобное для Вас время занятий и размер группы (индивидуальные занятия, занятия в парах, мини-группы).
- Все, в назначенное время начинается работа.
Удачи!
Или вы можете просто использовать этот сайт.
■ Как лучше готовиться: в группе или индивидуально?
Оба варианта имеют свои преимущества и недостатки. Занятия в группах оптимальны по соотношению цена-качество. Индивидуальные занятия позволяют более гибкий график, более тонкую «подстройку» курса под потребности конкретного ученика. После предварительного тестирования я порекомендую вам лучший вариант, но окончательный выбор остается за вами!
■ Посещаете ли вы учащихся на дому?
Да, я ухожу. В любой район Москвы (включая районы за МКАД) и в Подмосковье. Дома студенты могут проводить не только индивидуальные, но и групповые занятия.
■ А мы живем далеко от Москвы. Что делать?
Практика удаленно. Скайп — наш лучший помощник. Дистанционные занятия ничем не отличаются от очных: та же методика, те же учебные материалы. Мой логин: repetitor2000. Свяжитесь с нами! Проведем пробный урок — убедитесь, как это просто!
■ Когда можно начать занятия?
Практически в любое время. Идеальный вариант – за год до экзамена. Но даже если до ОГЭ осталось несколько месяцев, обращайтесь к нам! Возможно, есть еще бесплатные «винды», и я могу предложить вам интенсивный курс. Звоните: 8-903-280-81-91!
■ Гарантирует ли хорошая подготовка успешную сдачу ЕГЭ по химии в одиннадцатом классе?
Не гарантирует этого, но очень способствует этому. Основа химии закладывается именно в 8-9 классах. Если школьник хорошо усвоит базовые разделы химии, ему будет намного легче учиться в вузе и готовиться к экзамену. Если вы планируете поступать в вуз с повышенным уровнем требований по химии (МГУ, ведущие медицинские вузы), подготовка должна начинаться не за год до экзамена, а уже в 8-9 классах!
■ Насколько ОГЭ-2019 по химии будет отличаться от ОГЭ-2018?
Изменения не планируются. Существует два варианта экзамена: с практической частью или без нее. Количество заданий, их темы и система оценивания остались такими же, как и в 2018 году.
Существует два варианта экзамена: с практической частью или без нее. Количество заданий, их темы и система оценивания остались такими же, как и в 2018 году.
В демо варианте огэ по Химии 2018 первые 15 заданий являются тестовыми и при ответе на вопрос необходимо выбрать один из четырех вариантов ответа.
Помните, вы всегда можете подписаться. В нашем учебном центре работают лучшие специалисты!
Упражнение 1
Атом, изображенный на рисунке, имеет 9 электронов, распределенных по двум электронным уровням, что означает, что он находится во втором периоде таблицы Менделеева и имеет порядковый номер 9. Этот атом — фтор.
Ответ: фтор
Задание 2 ОГЭ по химии
Неметаллические свойства увеличиваются с увеличением числа электронов на внешнем энергетическом уровне и с уменьшением числа энергетических уровней. То есть слева направо по периоду и снизу вверх по группе. Алюминий, фосфор и хлор находятся в одном периоде и располагаются слева направо.
Ответ: алюминий — фосфор — хлор
Задача 3
Между атомами металла и неметалла образуется ионная связь, между металлами – металлическая связь, между неметаллами – ковалентная связь. Ковалентная связь делится на полярную и неполярную. Между двумя одинаковыми атомами образуется неполярная связь, как, например, в молекуле фтора F-F. А полярный образуется между разными атомами неметаллов с разными значениями электроотрицательности.
Ответ: ковалентная неполярная
ОГЭ по химии задание 4
В соединениях Na 3 N, NH 3 , NH 4 Cl азот имеет степень окисления -3. В HNO2 его степень окисления равна +3.
Ответ: HNO 2
Задача 5
Цинк является амфотерным металлом, образующим амфотерные оксиды и гидроксиды. Следовательно, ZnO является амфотерным оксидом. Na 2 SO 4 представляет собой соль, состоящую из катиона Na+ и аниона SO 4 2-
Ответ: амфотерный оксид и соль
Задание 6
Реакция оксида меди с водородом: CuO + H 2 = Cu + H 2 O
CuO — черный порошок, полученная медь будет красного цвета. Таким образом, в результате реакции будет наблюдаться изменение цвета.
Таким образом, в результате реакции будет наблюдаться изменение цвета.
Ответ: изменение цвета
Задание 7 в ОГЭ по химии
Напишем уравнение диссоциации для каждого из веществ:
H 2 SO 4 = 2H + + SO 4 2-
1 моль серной кислоты диссоциирует на 2 иона водорода и 1 сульфат-ион.
(NH 4) 2 S = 2NH 4 + + S 2-
1 моль сульфида аммония диссоциирует на 2 иона аммония и 1 сульфид-ион.
BaCl 2 = Ba 2+ + 2Cl —
1 моль хлорида бария диссоциирует на 1 ион бария и 2 хлорид-иона
CuSO 4 = Cu 2+ + SO 4 2-
1 моль сульфата меди диссоциирует на 1 ион меди и один сульфат-ион, то есть на одинаковое количество молей анионов и катионов.
Ответ: CuSO 4
Задача 8
MgCl 2 + Ba(NO 3 ) 2 = реакция не идет, так как не образуется газа, осадка или малодиссоциирующего соединения (воды)
Na 2 CO3 + CaCl 2 = CaCO 3 ↓ + 2NaCl В результате реакции выпадает осадок
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O В результате реакции выделяется газ
CuSO 4 + 2KOH = Cu(OH ) 2 ↓ + K 2 SO 4 В результате реакции выпадает осадок
Ответ: NH 4 Cl и NaOH
Задача 9
Cl 2 + H 2 = 2HCl
Ca + O 2 = CaO
S0S 2 + H 2 9 Fe0 = не реагируют
Ответ: азот и вода
Задание 11 по химии ОГЭ
Только нитрат серебра реагирует с соляной кислотой: продолжать, так как не будет образовываться ни газ, ни осадок, ни слабодиссоциирующее соединение (вода).
Соляная кислота не вступает в реакцию с металлами, которые стоят в ряду напряжений металлов после водорода, с оксидом кремния реакция также не пойдет реагировать с хлоридом натрия и сульфатом натрия, потому что обе реакции не образуют газа, осадка или соединения с низкой диссоциацией.
А сульфид натрия с нитратом меди будет реагировать по следующей схеме:
Na 2 S + Cu(NO 3 ) 2 = CuS ↓ + 2NaNO 3
Ответ: Только Na 2 С
Задание 13 в ОГЭ по химии
Разбитый ртутный градусник и вытекшую ртуть ни в коем случае нельзя просто так выбрасывать в мусорное ведро. Ртуть следует собирать в стеклянную банку с плотной крышкой, а стеклянный термометр упаковывать в герметичный полиэтиленовый пакет. Но неправда.
соли тяжелых металлов (в т.ч. свинец) обладают токсическими свойствами, поэтому не рекомендуется покрывать ею игрушки и посуду.
Ответ: только Б
Задание 14
Окислителем в реакциях является элемент, принимающий электроны, то есть понижающий степень окисления.
В первой реакции сера имеет степень окисления -2 слева и 0 справа, то есть она повышает степень окисления и является восстановителем.
Во второй реакции сера понижает степень окисления с 0 до -2 и является окислителем.
В третьей реакции сера понижает степень окисления с +2 до +3 и является восстановителем.
В четвертой реакции сера понижает степень окисления с 0 до +3 и является восстановителем.
Ответ: 3S + 2Al = Al 2 С 3
Задание 15 в ОГЭ по химии
Фосфат аммония — (NH 4)3 PO 4
Молярная масса его 149 г/моль
Массовая доля азота в нем = 14*03%* / 149 = 28 %
Массовая доля кислорода = 100 % * 16 * 4 / 149 = 43 %
Массовая доля фосфора = 100% * 32/149 = 21%
Массовая доля водорода = 100% * 1 * 12/149 = 8%
Ответ: 4
9045 часть химия 2
В тестовой части в ОГЭ за 9 класс по химии задания 16-19 — вопросы, в ответ на которые необходимо записать правильную последовательность нескольких цифр. Демо 2018 задачи:
Демо 2018 задачи:
Задача 16
Магний и кремний расположены в таблице Менделеева в третьем периоде, а значит имеют три электронных слоя в атомах (1) и значения их электроотрицательности меньше, чем у фосфора (4), так как фосфор находится справа в периоде и проявляет более выраженные неметаллические свойства, чем магний и кремний.
Ответ: 14
Задание 17 в ОГЭ по химии
Этанол, или спирт этиловый, имеет формулу — С 2 Н 5 ОН. У него два атома углерода, нет двойных связей. Этанол сгорает с образованием углекислого газа и воды. 1,2,5 не верно.
Этанол представляет собой жидкость, хорошо растворяющуюся в воде при нормальных условиях. 3 правильно.
Спирты, в состав которых входит этанол, вступают в реакцию замещения с щелочными металлами (4).
Ответ: 34
Задание 18
Na 2 CO 3 и Na 2 SiO 3 можно распознать кислотой:
Na 2 CO 3 + HCl = NaCl + CO 2 + H 2 O
NaSiO 3 + HCl = NaCl + H 2 SiO 3 ↓
K 2 CO 3 и Li 2 CO 3 можно распознать с K 3PO4 :
K2CO3 + K3PO4 = нет реакции
3Li 2 CO 3 + 2K 3 PO 4 = 2Li 3 PO 4 ↓ + 3K 2 CO 3
Na2SO4 и NaOH можно узнать по CuCl 2 :
Na 2 SO 4 + CuCl 2 = нет реакции
2NAOH + CUCL 2 \ U003D CU (OH) 2 ↓ + 2NACL
ОТВЕТ: 241
OGE в химии 19 Задача
CAN CAN CAN с концентрированной серлиной кислотой:
2
. .) + S = 3SO 2 + 2H 2 O
.) + S = 3SO 2 + 2H 2 O
А с кислородом:
S + O 2 = SO 2
Оксид цинка является амфотерным оксидом, поэтому может взаимодействовать как с кислотами, так и с основаниями:
ZnO + 2HCl = ZnCl 2 + H 2 O
ZnO + NaOH + H 2 O = Na 2
Хлорид алюминия может взаимодействовать с азотнокислым серебром и гидроксидом калия:
AlCl 3 + 3AgNO 3 + = Al(NO 3) 3 + 3AgCl ↓
3KOH + AlCl 3 = 3KCl + Al(OH) 3 ↓
2Ответ: 423
Ответ на задания 20-23/24 демо версии химия огэ 2018 предлагает развернутый ответ.
Задание 20
Сначала нужно расставить степени окисления и найти элементы, изменяющие степень окисления. Для этой реакции это йод и сера.
Уравнения электронного баланса будут следующими:
S +6 + 8ē = S -2
Сера принимает электроны и поэтому является окислителем.
2I –1 – 2ē → I 2 0
Йод отдает электроны – является восстановителем
Затем необходимо «уравнять» электронные полуреакции, умножив первое уравнение на 4:
S +6 + 8ē = S -2 |*4
2I –1 – 2ē → I 2 0 |*1
8HI + H 2 SO 4 = 4I 2 + H 2 S + 4H 2 O
Задание 21 в ОГЭ по химии
Для решения задачи необходимо составить уравнение реакции:
AgNO 3 + NaCl = AgCl↓ + NaNO 3
n (AgCl) = m (AgCl )/M(AgCl) = 8,61 г/143,5 г/моль = 0,06 моль
Количество прореагировавшего нитрата серебра по уравнению реакции равно количеству выпавшего в осадок хлорида серебра. Далее необходимо найти массу нитрата серебра, содержащуюся в исходном растворе:
Далее необходимо найти массу нитрата серебра, содержащуюся в исходном растворе:
m(AgNO 3 ) = n(AgNO 3 ) M(AgNO 3 ) = 0,06 моль * 170 г/моль = 10,2 г
Массовая доля нитрата серебра в исходном растворе:
ω(AgNO 3 ) = m (AgNO 3 )/м (раствор) = 100% * 10,2г/170г = 6%
В первой экзаменационной модели ОГЭ 9 по химии, которая предполагает «мысленный» эксперимент, задание 23 демонстрационного варианта в следующем виде:
Fe → FeSO 4 → Fe(OH) 2
2+ + 2OH — = Fe(OH) 2
Вторая экзаменационная модель ОГЭ по химии 2018 года содержит реальное экспериментальное задание и содержит задания 22 23. Задание 22 является теоретической частью для выполнения задания 22.
Задание 22 в ОГЭ по химии
Гидроксид железа (II) с использованием предлагаемых реагентов в две стадии можно получить по следующей схеме:
Fe → FeSO 4 → Fe(OH) 2
Или:
CuSO 4 → FeSO 4 → Fe(OH) 2
Реакции, соответствующие этой схеме:
1) Fe + CuSO 4 = FeSO 4 + Cu ↓
В результате реакции медь выпадает в осадок, осадок красный.
2) FeSO 4 + 2NaOH = Fe(OH) 2 ↓ + Na 2 SO 4
В результате второй реакции выпал серо-зеленый осадок гидроксида железа (II). Эта реакция является реакцией ионного обмена, сокращенное ионное уравнение будет иметь вид: Fe 2+ + 2OH — = Fe(OH) 2
Задание 23
Ответ на задание 23 оценивается по двум критериям:
Критерий 1 оценивает соответствие проводимых реакций схеме, составленной в задании 22 и описанию происходящих с веществами изменений:
В результате первой реакции Fe + CuSO 4 = FeSO 4 + Cu↓ выпадает красная медь, кроме того, исчезает синяя окраска раствора, характерная для CuSO 4
В результате второй реакции FeSO 4 + 2NaOH = Fe(OH) 2 ↓ + Na 2 SO 4 выпадает в осадок гидроксид железа(II) серо-зеленого цвета.
Также в ответ на это задание необходимо сделать вывод о свойствах веществ и о том, какие реакции были проведены:
Первая реакция представляет собой окислительно-восстановительную реакцию, в которой более активный металл (железо) заменяет менее активный катион металла (Cu 2+
). Вторая реакция представляет собой реакцию ионного обмена между солью и щелочью, в результате которой образуется осадок.
Вторая реакция представляет собой реакцию ионного обмена между солью и щелочью, в результате которой образуется осадок.
Критерий 2 Оценивает соблюдение общепринятых правил техники безопасности при лабораторных работах: умение безопасно работать с химическим оборудованием и веществами, например, при подборе нужного количества реагента.
Для кого предназначены эти тесты?Данные материалы предназначены для студентов, готовящихся к ОГЭ-2018 по химии . Также их можно использовать для самоконтроля при изучении школьного курса химии. Каждая посвящена определенной теме, с которой девятиклассник встретится на экзамене. Номер теста – это номер соответствующего задания в бланке ОГЭ.
Как устроены тематические тесты? Будут ли публиковаться на сайте другие тематические тесты?Несомненно! Планирую разместить тесты по 23 темам по 10 заданий в каждой. Следите за обновлениями!
 Химические свойства кислот и оснований. (Готовится к выпуску!)
Химические свойства кислот и оснований. (Готовится к выпуску!)Вам кажется, что чего-то не хватает? Хотите расширить некоторые разделы? Нужен новый контент? Что-то нужно исправить? Нашли ошибки?
Всем удачи в подготовке к ОГЭ и ЕГЭ!
Вариант
контрольно-измерительные материалы для подготовки
к государственной (итоговой) аттестации
по ХИМИЯ обучающиеся, освоившие
основные общеобразовательные программы основного
общее образование.
Данный обучающий тест предназначен для выпускников 9 классов, которые собираются сдавать ОГЭ по предмету химия.
Задача : проверка знаний по химии по курсу основной школы, для выявления уровня подготовки учащихся к ОГЭ.
Уровень сложности : базовый, продвинутый, высший
Составитель: Самарченко Наталья Васильевна учитель химии и биологии — высшая категория
Рабочие инструкции
На выполнение работы дается 2 часа (120 минут). Работа состоит из 2 частей, содержащих 22 задания.
Часть 1 содержит 19 заданий. Для каждого задания (1–15) дается 4 варианта ответа, из которых только один правильный. При выполнении Части 1 обведите номер выбранного ответа в экзаменационной работе. Если вы обвели неправильную цифру, зачеркните обведенную цифру крестиком, а затем обведите номер правильного ответа.
(16–19) состоит из 4 заданий, на которые нужно дать краткий ответ в виде набора цифр.
Часть 2 включает 3 задания (20, 21, 22), выполнение которых предполагает написание полного подробного ответа, включая необходимые уравнения реакций и расчеты. Ответы на задания части 2 записываются на отдельном листе.
Ответы на задания части 2 записываются на отдельном листе.
Баллы, полученные учащимися за выполнение всех заданий, суммируются. Итоговая оценка выпускника основной школы определяется по 5-бальной шкале: 0-7 баллов – «2», 9-14 баллов «3»; 15-19 баллов «4»; 20-22 балла «5».
При выполнении работ можно использовать химические элементы периодической системы ДИ. Менделеева, таблица растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов и непрограммируемый калькулятор.
Советуем выполнять задания в том порядке, в котором они даны. Чтобы сэкономить время, пропускайте задачу, которую не можете выполнить сразу, и переходите к следующей. Если у вас осталось время после выполнения всех работ, вы можете вернуться к пропущенным задачам. Баллы, которые вы получаете за все выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать как можно больше очков.
Желаем успехов!
Часть 1
На каждое из заданий 1–15 дается 4 ответа, из которых только один правильный. Обведите номер правильного ответа.
Обведите номер правильного ответа.
1 . Количество электронов во внешнем электронном слое атома с ядерным зарядом +9 равно?
2. Изменяются ли в ряду свойства оксидов от кислых к амфотерным?
1) CaO → SiO 2 → SO 3
2) CO 2 → Al 2 O 3 → MgO
3) SO 3 → P 2 O 5 → Al 2 O 3
4) Na 2 O → MgO → Al 2 O 3
3. Какое из следующих веществ имеет полярную ковалентную связь?
4. Ту же степень окисления, что и у SO 3 , имеет сера в соединении
5. Кислотный оксид и кислота, соответственно, являются?
CO 2 , (NH 4) 2 S
6. К химическим явлениям относится процесс?
Засахаренный джем
Образование накипи в чайнике
Испарение воды
Превращение воды в лед
7. 3 моль катионов образуется при полной диссоциации 1 моля
фосфат натрия
нитрат алюминия
хлорид железа(III)
гидроксид кальция
8. Какое уравнение соответствует реакции обмена?
Какое уравнение соответствует реакции обмена?
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O
2HCl + Ca(OH) 2 = CaCl 2 + 2H 2 O
Zn + 2HCl = ZnCl 2 + H 2
9. Натрий и медь реагируют с
гидроксидом натрия
Водородом
азотной кислотой
10. Возможна ли химическая реакция между?
оксид бария и гидроксид натрия
оксид бария и вода
оксид кремния и вода
оксид кремния и соляная кислота
11 . Кислород не реагирует с
Оксид углерода (IV)
Сероводород
Оксид фосфора (III)
Аммиак
12. Реагирует с соляной кислотой
оксид магния
сероводород
сульфат бария
13. Верны ли следующие утверждения о чистых веществах и смесях?
НО. Минеральная вода является чистым веществом.
B. Духи представляют собой смесь веществ.
1) верно только А
2 ) верно только Б
3) оба утверждения верны
4) оба суждения неверны
14. Какое из веществ соответствует общей формуле C n H 2 n
15. Какова массовая доля кислорода в азотной кислоте?
При выполнении заданий 16-17 из предложенного списка ответов выберите два правильных и обведите их номера. Напишите номера выбранных ответов в указанном месте без дополнительных символов.
16. В ряду химических элементов Si — P — S
1) уменьшается число протонов в ядре
2) уменьшается электроотрицательность
3) увеличивается число электронов во внешнем электронном слое
4) увеличивается радиус атомов увеличивается
5 ) усиленные неметаллические свойства
Ответ: ___________.
17. Среди перечисленных ниже характеристик выберите те, которые относятся к маслу:
Жидкость без запаха
Не растворяется в воде
Имеет определенную температуру кипения
Его компоненты служат пищей для некоторых бактерий.
Растворяется в воде
Ответ: ___________.
18. Установите соответствие между схемой превращения
и степенью изменениястепени окисления восстановителя в ней.
ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ | ||
A) Fe 2 O 3 + CO → Fe + CO 2 | 1) Е-1 → Е 0 | ||
B) Al 2 S 3 + HNO 3 → Al 2 (SO 4) 3 + NO 2 + H 2 O | 2) Е +3 → Е +2 | ||
C) HNO 2 + HI → I 2 + NO + H 2 O | 3) E +5 → E +4 | ||
4) Е +2 → Е +4 | |||
5) E -2 → E +6 | |||
Ответ:
Установите соответствие между исходными веществами и продуктами реакции. ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ | ||
А) H 2 S + O 2 → | |||
B) H 2 SO 3 + Na 2 O → | 2) → SO 2 + H 2 O | ||
C) H 2 SO 4 + NaOH → | 3) → Na 2 SO 4 + H 2 | ||
4) → Na 2 SO 4 + H 2 O | |||
5) → Na 2 SO 3 + H 2 O | |||
Ответ:
Часть 2
20. Приведена схема превращения:
ZnS → X → ZnCl 2 → Zn(OH) 2
21.
22.
процесс его распознавания.
Система оценки экзамена по химии
Части 1 и 2
Правильное выполнение каждого задания Части 1 (1–15) дает 1 очко. За выполнение задания с выбором ответов дается 1 балл при условии, что указана только одна цифра правильного ответа. Если отмечены два и более ответа, включая правильный, то ответ не засчитывается.
За выполнение задания с выбором ответов дается 1 балл при условии, что указана только одна цифра правильного ответа. Если отмечены два и более ответа, включая правильный, то ответ не засчитывается.
З задание с кратким ответом считается выполненным правильно, если в заданиях 16-17 правильная последовательность чисел. За полный правильный ответ на задание дается 2 балла, если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущено две и более ошибок или нет ответа, то ставится 0 баллов. Упражнение 18-19 считается выполненным правильно, если правильно установлено 3 совпадения. Частично правильным считается ответ, в котором найдено 2 совпадения из 3, он оценивается в 1 балл. Остальные варианты считаются неправильным ответом и оцениваются в 0 баллов.
№ задачи | ответ | № задачи | ответ |
Часть 2
Критерии оценки выполнения заданий с развернутым ответом
20. Дана схема превращения:
Дана схема превращения:
ZnS → X → ZnCl 2 → Zn(OH) 2
Напишите уравнения молекулярных реакций, которые можно использовать для
осуществления этих превращений. Для третьего преобразования составьте
сокращенное уравнение ионной реакции.
Ответные элементы | |
Уравнения реакции, соответствующие схеме превращения, записываются: 1) 2ZnS + 3O 2 = 2ZnO + 2SO 2 2) ZnO + 2HCl = ZnCl 2 + H 2 O + 3) ZnCl 2 = Zn(OH) 2 + 2KCl 4) Составлено сокращенное ионное уравнение третьего превращения: Zn +2 + 2OH — = Zn(OH) 2 | |
Критерии оценки | Баллы |
3 уравнения реакции написаны правильно. | |
Правильно написаны 2 уравнения реакции. | |
Правильно написано 1 уравнение реакции. | |
Максимальный балл | |
21. Углекислый газ пропускали через 171 г раствора гидроксида бария с массовой долей 5% до образования карбоната бария. Рассчитайте объем (н.у.с.) прореагировавшего газа.
Элементы ответа (Допускаются другие формулировки ответа, не искажающие его смысла) | |
1) Уравнение реакции составлено: CO 2 + Ba(OH) 2 = BaCO 3 + H 2 O 2) Рассчитана масса и количество вещества гидроксида бария, содержащегося в растворе: m ( Ba(OH)2) = m(p-pa). Вт/100 = 171 . 0,05 =8,55 n(Ba(OH)2)=m(Ba(OH)2)/M(Ba(OH)2)=8,55/171=0,05 моль 3) Определен объем прореагировавшего углекислого газа: По уравнению реакции n(CO 2) = n(Ba(OH) 2) = 0,05 моль В (СО 2) = n (СО 2) . | |
Критерии оценки | Баллы |
Ответ правильный и полный, включая все названные элементы. | |
Все элементы ответа написаны неправильно. | |
Максимальный балл | |
На занятиях химического кружка студенты рассмотрели порошкообразные
вещества черного цвета. При добавлении к ней соляной кислоты и последующем нагревании полученной смеси
образовался зеленый раствор. В полученный раствор влили раствор азотнокислого серебра, в результате выпал творожистый осадок.
Определите состав испытуемого вещества и запишите его название.
Составьте 2 уравнения реакции, которые были выполнены учащимися
в процессе ее распознавания.
Элементы ответа (Допускаются другие формулировки ответа, не искажающие его смысла) | |
Определен состав вещества и записано его наименование: 1) CuO — оксид меди (II). 2 Составлены уравнения реакций, проводимых учащимися в процессе изучения неизвестного вещества: 2) CuO + 2HCl = CuCl 2 + H 2 O 3) CuCl 2 + 2AgNO 3 → Cu(NO 3) 2 + 2AgCl ↓ | |
Критерии оценки | Баллы |
Ответ правильный и полный, включая все названные элементы. | |
Первые 2 элемента написаны правильно. | |
1 из вышеперечисленных элементов написан правильно (1-й или 2-й). | |
Все элементы ответа написаны неправильно. | |
Максимальный балл | |
ОГЭ по химии сдается только по выбору обучающегося, данный тест не входит в перечень обязательных. Химию выбирают ученики, которые после 9 класса планируют поступать в профильный 10 класс школы или профильного колледжа, техникума. Для поступления в медицинский вуз требуется сдать не только химию, но и биологию. Экзамен предполагает ориентацию в теории, ее успешное применение на практике. Предмету необходимо решить множество задач разного уровня сложности из широкого круга тем. Чтобы решить, на какие темы обратить внимание, ознакомьтесь с Программой подготовки к ОГЭ по химии.
Экзамен состоит из заданий, которые разделены на два логических блока:
- В первую часть включены задания на знание теории: здесь нужно дать краткий ответ — число, последовательность чисел, слово .
- Во второй части несколько вопросов, на которые нужно дать развернутые, полные ответы, провести лабораторный эксперимент, написать выводы, выполнить расчеты.
 Крайне важно уметь пользоваться специальным оборудованием, пользоваться алгоритмами решения задач разного уровня сложности.
Крайне важно уметь пользоваться специальным оборудованием, пользоваться алгоритмами решения задач разного уровня сложности.
В 2018 году минимальный порог составлял 9 баллов – это тот минимум, который позволит получить минимальный балл и сертификат.
В ЕГЭ по предмету есть подсказки: таблицы растворимости солей, кислот, оснований в воде, таблица Менделеева, таблицы напряжений металлов. Имея возможность использовать эти материалы, вы без труда сможете решить многие задачи.
- Главный совет, который актуален для каждого экзамена, — спланировать свое обучение. Без четкого плана вам не удастся достичь высокого уровня подготовки. Чтобы сделать ваше планирование максимально эффективным, ознакомьтесь — в нем указаны темы и разделы, требующие особого внимания.
- Оцените свои силы: проще всего онлайн-тестирование. При прохождении теста вы получаете результат и можете оценить, какие типы заданий и темы вызывают у вас наибольшие трудности.

- После того, как вы определили проблемные темы, уделите им больше внимания, чем другим. Для обучения возьмите учебники, справочники.
- Обязательно решать проблемы! Чем больше задач вы решите для подготовки, тем легче будет на экзамене.
- Задайте вопросы: найдите специалиста, который поможет вам в проблемных ситуациях. Это может быть репетитор или школьный учитель. Только специалист может помочь вам проанализировать свои ошибки и не совершать их снова.
- Научитесь пользоваться подсказками — теми таблицами, которые можно взять с собой на экзамен.
- Недостаточно изучать теорию, очень важно тренироваться, чтобы сдавать тесты. Такая форма проверки знаний у многих вызывает затруднения, особенно если она не использовалась на уроках. Решайте больше тестовых заданий разного типа, чтобы они не вызывали страха и непонимания во время экзамена.
- «Решу ОГЭ по химии» поможет вам подготовиться к ЕГЭ и успешно сдать его, рационально используя отведенное время, без напряжения.

ESS Тема 2.2: Сообщества и экосистемы
изображение с сайта www.geo.arizona.edu
Экосистема состоит из разнообразных живых организмов. При изучении экологии эти живые организмы классифицируются на основе уровня организации. Итак, на уровне базовых чисел у нас есть популяция, затем мы определяем вид и сообщество, к которому принадлежит этот организм, как он взаимодействует с экосистемой и другими организмами в экосистеме. Ученые также изучили взаимодействие между различными организмами и классифицировали их взаимодействия по разным типам.
Этот модуль займет минимум 5,5 часов.
Важные идеи
- Взаимодействие видов с окружающей средой приводит к потокам энергии и питательных веществ.
- Фотосинтез и дыхание играют важную роль в потоке энергии в сообществах.
- Пищевые отношения видов в системе можно моделировать с помощью пищевых цепей, пищевых сетей и экологических пирамид.

Большие вопросы:
- Какие сильные и слабые стороны системного подхода и использования моделей были выявлены в этой теме?
- Каковы сильные и слабые стороны моделей пищевых цепей, пищевых сетей и экологических пирамид?
- Как можно использовать пирамиды продуктивности для прогнозирования влияния деятельности человека на экосистемы?
- Как можно использовать системные диаграммы для отображения потока энергии через экосистемы? Каковы сильные и слабые стороны таких диаграмм?
Знание и понимание
2.2.U1 Сообщество – это группа популяций, живущих и взаимодействующих друг с другом в общей среде обитания
- для всего населения в определенной области или регионе в определенное время. Его структура включает в себя множество типов взаимодействий между видами. Некоторые из них связаны с приобретением и использованием продуктов питания, пространства или других ресурсов окружающей среды.
 Другие связаны с круговоротом питательных веществ через всех членов сообщества и взаимной регуляцией размеров популяции. Во всех этих случаях структурированные взаимодействия популяций приводят к ситуациям, когда индивидуумы оказываются втянутыми в борьбу не на жизнь, а на смерть.
Другие связаны с круговоротом питательных веществ через всех членов сообщества и взаимной регуляцией размеров популяции. Во всех этих случаях структурированные взаимодействия популяций приводят к ситуациям, когда индивидуумы оказываются втянутыми в борьбу не на жизнь, а на смерть.В целом экологи считают, что сообщество с высоким разнообразием более сложное и стабильное, чем сообщество с низким разнообразием. Эта теория основана на наблюдении, что пищевые сети сообществ с большим разнообразием более взаимосвязаны. Большая взаимосвязь делает эти системы более устойчивыми к помехам. Если вид удаляется, те виды, которые полагались на него в качестве пищи, имеют возможность переключиться на многие другие виды, которые играют аналогичную роль в этой экосистеме. В экосистеме с низким разнообразием возможные заменители пищи могут отсутствовать или быть ограниченными в изобилии.
2.2.U2 Экосистема – это сообщество и физическая среда, с которой оно взаимодействует.
 Экосистема — это сообщество живых и неживых объектов, которые работают вместе. Экосистемы не имеют определенного размера. Экосистема может быть большой, как пустыня или озеро, или такой маленькой, как дерево или лужа. Если у вас есть террариум, это искусственная экосистема. Вода, температура воды, растения, животные, воздух, свет и почва работают вместе. Если света или воды недостаточно, или если в почве нет нужных питательных веществ, растения погибнут. Если растения умрут, животные, которые от них зависят, умрут. Если животные, которые зависят от растений, умрут, все животные, которые зависят от этих животных, умрут. Экосистемы в природе работают так же. Все части работают вместе, чтобы создать сбалансированную систему!
Экосистема — это сообщество живых и неживых объектов, которые работают вместе. Экосистемы не имеют определенного размера. Экосистема может быть большой, как пустыня или озеро, или такой маленькой, как дерево или лужа. Если у вас есть террариум, это искусственная экосистема. Вода, температура воды, растения, животные, воздух, свет и почва работают вместе. Если света или воды недостаточно, или если в почве нет нужных питательных веществ, растения погибнут. Если растения умрут, животные, которые от них зависят, умрут. Если животные, которые зависят от растений, умрут, все животные, которые зависят от этих животных, умрут. Экосистемы в природе работают так же. Все части работают вместе, чтобы создать сбалансированную систему!Некоторые экосистемы могут пересекать несколько стран, поэтому их сохранение и экология имеют международное значение.
изображение с сайта naturalscience-5.blogspot.com
2.2.U3 Дыхание и фотосинтез как процессы с входом, выходом и превращением энергии и вещества.

[Подробности о хлоропластах, светозависимых и светонезависимых реакциях, митохондриях, системах переноса, аденозинтрифосфате (АТФ) и конкретных промежуточных биохимических веществах не ожидаются]- Опишите фотосинтез и дыхание с точки зрения входа, выхода и преобразования энергии.
Под фотосинтезом следует понимать потребность в углекислом газе, воде, хлорофилле и определенных длинах волн видимого света для производства органических веществ и кислорода. Следует оценить превращение световой энергии в химическую энергию органического вещества.
Следует признать, что дыхание требует органических веществ и кислорода для производства углекислого газа и воды. Без кислорода образуется углекислый газ и другие отходы. Энергия высвобождается в форме, доступной для использования живыми организмами, но в конечном итоге теряется в виде тепла.
Фотосинтез:
входы:
- солнечный свет как источник энергии, углекислый газ и вода
процессы:
- хлорофилл улавливает солнечный свет; энергия расходуется на расщепление молекул воды; водород из воды соединяется с углекислым газом с образованием глюкозы.

выходы:
- глюкоза используется в качестве источника энергии для растений и в качестве строительного материала для других органических молекул; кислород выделяется в атмосферу через устьица.
преобразования:
- световая энергия преобразуется для хранения химической энергии.
Рестагирование :Входы:
- Глюкоза и кислород
Процессы:
- Процессы окисления внутри
. :
- накопленная химическая энергия в кинетическую энергию и тепло
2.2.U4 Дыхание — это превращение органических веществ в углекислый газ и воду во всех живых организмах с выделением энергии.
[Подробности о митохондриях, системах переносчиков, аденозинтрифосфате (АТФ) и конкретных промежуточных биохимических веществах не ожидаются]- Опишите процесс дыхания
- Обобщите уравнение дыхания
Дыхание высвобождает энергию для клеток из глюкозы.
 Это может быть аэробное дыхание, для которого необходим кислород, или анаэробное дыхание, которому он не нужен.
Это может быть аэробное дыхание, для которого необходим кислород, или анаэробное дыхание, которому он не нужен.Дыхание представляет собой серию реакций, в которых из глюкозы высвобождается энергия. Аэробное дыхание — это форма дыхания, в которой используется кислород. Это можно резюмировать следующим уравнением:
глюкоза + кислород → углекислый газ + вода (+ энергия)
Энергия указана в скобках, поскольку она не является веществом. Обратите внимание, что:
- Глюкоза и кислород расходуются
- Углекислый газ и вода образуются как отходы
Аэробное дыхание происходит все время в клетках животных и растений. Большинство вовлеченных реакций происходит внутри митохондрий, крошечных объектов внутри цитоплазмы клетки. Реакции контролируются ферментами.
2.2.U5 Во время дыхания большое количество энергии рассеивается в виде тепла, что увеличивает энтропию в экосистеме, позволяя организмам поддерживать относительно низкую энтропию и, следовательно, высокую организацию.

- Дайте определение энтропии
- Определите, как энергия в организме может быть потеряна
Дыхание — это химическая реакция, при которой пища, вода и кислород превращаются в энергию, которую мы можем использовать (также позволяя нам дышать и т. д.)
В каждой реакции есть 2 вида энергии; полезно и зря. полезная энергия — это то, что нам нужно, а потраченная впустую энергия — это то, что случайно преобразуется при производстве полезной энергии. она тратится впустую, потому что энергию нельзя разрушить или создать, ее можно только изменить. один из видов потерянной энергии, который создается в большинстве реакций, — это тепловая энергия.
Поскольку дыхание является химической реакцией, имеет место передача полезной энергии, однако в качестве побочного продукта этих реакций выделяется тепловая энергия.
2.2.U6 Первичные продуценты в большинстве экосистем преобразуют энергию света в химическую энергию в процессе фотосинтеза.

[Подробности о хлоропластах, светозависимых и светонезависимых реакциях и специфических промежуточных биохимических веществах не ожидаются]- Опишите процесс фотосинтеза
- Объясните, почему фотосинтез так важен
- Опишите, как растения используют некоторые конечные продукты фотосинтеза
Первичные продуценты, также называемые автотрофами, — это организмы, которые могут производить себе пищу. Большинство автотрофов находятся в самом низу пищевой цепи, выступая в качестве источников пищи для животных, находящихся дальше по цепочке. Первичные производители самодостаточны, когда речь идет о еде: они производят свою собственную пищу, используя свет, углекислый газ, воду, а иногда и другие химические вещества.
Продуценты (автотрофы) обычно представляют собой растения или водоросли, которые производят свою собственную пищу с помощью фотосинтеза и образуют первый трофический уровень в пищевой цепи.
 Исключения включают хемосинтетические организмы, которые производят пищу без солнечного света.
Исключения включают хемосинтетические организмы, которые производят пищу без солнечного света. 2.2.U7 Реакция фотосинтеза может быть представлена следующим уравнением. углекислый газ + вода дает глюкозу + кислород
- Обобщите уравнение фотосинтеза
Фотосинтез – это процесс преобразования световой энергии в химическую и накопления ее в связях сахара. Этот процесс происходит в растениях и некоторых водорослях. Для производства сахара растениям нужна только световая энергия, CO2 и вода. Процесс фотосинтеза происходит в хлоропластах, в частности, с использованием хлорофилла, зеленого пигмента, участвующего в фотосинтезе.
Реакция фотосинтеза может быть представлена следующим уравнением слова.
2.2.U8 Фотосинтез производит сырье для производства биомассы
[Биомасса, измеряемая в единицах массы (например, г м-2), следует отличать от продуктивности, измеряемой в единицах расхода (например, г м-2). 2 ч-1 или Дж м-2 ч-1)]
2 ч-1 или Дж м-2 ч-1)]- Дайте определение биомассе
- Определите компенсационную точку
Биомасса является органической, то есть она состоит из материала, полученного из живых организмов, таких как растения и животные . Наиболее распространенными материалами биомассы, используемыми для производства энергии, являются растения, древесина и отходы. Они называются сырьевыми запасами биомассы. Энергия биомассы также может быть невозобновляемым источником энергии.
Биомасса содержит энергию, впервые полученную от солнца: растения поглощают солнечную энергию посредством фотосинтеза и превращают углекислый газ и воду в питательные вещества (углеводы).
2.2.U9 Трофический уровень – это положение, которое организм занимает в пищевой цепи, или положение группы организмов в сообществе, занимающих такое же положение в пищевых цепях
- Дайте определение термину трофический уровень.

- Определите и объясните трофические уровни в пищевых цепях и пищевых цепях, выбранных из местной среды.
В экологии трофический уровень — это положение, которое организм занимает в пищевой цепи, или группа организмов в сообществе, занимающих одинаковое положение в пищевых цепях — что он ест и что его ест.
Экологи рассматривают естественную «экономию энергии», которая в конечном счете опирается на солнечную энергию. Когда они смотрят на экосистему, почти всегда есть некоторые основные виды, которые непосредственно собирают энергию от солнца, например, трава (однако в глубоководных гидротермальных жерлах хемосинтетические археи составляют основу пищевой цепи)
2.2.U10 Продуценты (автотрофы), как правило, растения или водоросли, которые производят себе пищу с помощью фотосинтеза и образуют первый трофический уровень в пищевой цепи. Исключение составляют хемосинтетические организмы, производящие пищу без солнечного света.

- Различают автотрофные и хемосинтетические организмы.
Вся жизнь в конечном счете зависит от первичных продуцентов, организмов, которые улавливают энергию солнечного света путем фотосинтеза. На суше их легко распознать как растения. Хотя морская первичная продукция коралловыми рифами, мангровыми зарослями и водорослями относительно хорошо известна, подавляющее большинство первичной продукции в море приходится на микроскопические одноклеточные растения, называемые фитопланктоном. На фитопланктон приходится 50% производимого кислорода
Примером могут служить фотосинтезирующие растения, которые производят себе пищу из солнечного света (используя процесс, называемый фотосинтезом ), и хемосинтетические бактерии, которые получают энергию для питания из химических веществ в гидротермальных жерлах. Их называют автотрофами или первичными продуцентами .
2.
 2.U11 Пищевые отношения включают производителей, консументов и редуцентов. Их можно смоделировать, используя пищевые цепи, пищевые сети и экологические пирамиды
2.U11 Пищевые отношения включают производителей, консументов и редуцентов. Их можно смоделировать, используя пищевые цепи, пищевые сети и экологические пирамиды
[Различие между накоплением энергии, показанным прямоугольниками i на диаграммах потоков энергии (представляющих различные трофические уровни), и потоками энергии или продуктивности, часто обозначаемыми стрелками ( иногда различной ширины) необходимо подчеркнуть.]- Различие между автотрофом и гетеротрофом
- Определить производителя со ссылкой на именованный пример
- Дать определение потребителя со ссылкой на именованный пример
- Дать определение редуценту со ссылкой на именованный пример
- Дать определение высшего плотоядного животного со ссылкой на именованный образец
- Различать травоядных, плотоядных и всеядных
Всем живым существам нужна пища, чтобы получать энергию для роста, передвижения и размножения.
 Но чем питаются эти живые существа? Насекомые поменьше питаются зелеными растениями, а более крупные – на более мелких и так далее. Эти пищевые отношения в экосистеме называются пищевой цепью. Пищевые цепи обычно расположены в определенной последовательности со стрелкой, показывающей поток энергии. Ниже приведены некоторые живые существа, которые могут вписаться в пищевую цепь 9.0003
Но чем питаются эти живые существа? Насекомые поменьше питаются зелеными растениями, а более крупные – на более мелких и так далее. Эти пищевые отношения в экосистеме называются пищевой цепью. Пищевые цепи обычно расположены в определенной последовательности со стрелкой, показывающей поток энергии. Ниже приведены некоторые живые существа, которые могут вписаться в пищевую цепь 9.0003
Производитель: могут производить себе пищу, так как они используют солнечный свет для производства пищи и называются основой каждой экосистемы, которая помогает остальным видам за счет поступления энергии и новой биомассы. Все это происходит посредством фотосинтеза, когда производитель использует солнце для получения энергии.Потребитель: питаются другими организмами, не содержат пигментов фотосинтеза, поэтому не могут производить себе пищу. Они должны получать энергию, минералы и питательные вещества, поедая другие организмы. Это делает гетеротрофов.
 Травоядные питаются автотрофами, плотоядные — другими гетеротрофами, а всеядные — теми и другими.
Травоядные питаются автотрофами, плотоядные — другими гетеротрофами, а всеядные — теми и другими.Разлагатель: получают пищу при разложении материи мертвого организма. Они разрушают ткани и выделяют питательные вещества для поглощения другими производителями. Редуценты также улучшают питательную способность почвы, разрушая органический материал.
изображение с en.wikipedia.org
Моделирование экосистемы модели
Анимация потока энергии
2.2.U12 Экологические пирамиды включают пирамиды чисел, биомассы и продуктивности и представляют собой количественные модели, которые обычно измеряются для данной площади и времени
- Объясните принципы построения пирамид чисел, пирамид биомассы и пирамид продуктивности и постройте такие пирамиды на основе имеющихся данных.
Экологическая пирамида является иллюстрацией уменьшения энергии при прохождении каждого кормового (трофического) уровня в экосистеме.
 Основание пирамиды велико, поскольку энергетические фабрики экосистемы (производители) преобразуют солнечную энергию в химическую посредством фотосинтеза. Пищевая цепь также может отражать снижение энергии на каждом уровне питания, если стрелки, проведенные между различными уровнями, продолжают уменьшаться в размерах.
Основание пирамиды велико, поскольку энергетические фабрики экосистемы (производители) преобразуют солнечную энергию в химическую посредством фотосинтеза. Пищевая цепь также может отражать снижение энергии на каждом уровне питания, если стрелки, проведенные между различными уровнями, продолжают уменьшаться в размерах.Пирамиды представляют собой графические модели количественных различий, существующих между трофическими уровнями одной экосистемы. Пирамида биомассы представляет постоянный запас каждого трофического уровня, измеряемый в таких единицах, как граммы биомассы на квадратный метр (г·м–2). Биомасса также может быть измерена в единицах энергии, таких как Дж м –2.
2.2.U13 В соответствии со вторым законом термодинамики существует тенденция к уменьшению числа и количества биомассы и энергии вдоль пищевых цепей; следовательно, пирамиды сужаются к вершине
[Эта тема должна быть активно связана с подтемой 1.3, так как возникнут вопросы, требующие от учащихся использовать свои знания термодинамики с потоками энергии в экосистемах]- Обсудить, как энтропия влияет на структуру экологической пирамиды
Энергия теряется при передаче между трофическими уровнями; эффективность этой передачи энергии измеряется эффективностью чистой продукции и эффективностью передачи на трофическом уровне.
 Следующим передается только 10 % энергии, поэтому трофическая эффективность = 10 %.
Следующим передается только 10 % энергии, поэтому трофическая эффективность = 10 %.Эндотермы имеют низкий NPE и используют больше энергии для тепла и дыхания, чем экзотермы, поэтому большинству эндотермов приходится есть чаще, чем экзотермам, чтобы получать энергию, необходимую им для выживания.
Перенос энергии в пищевых сетях определяется первым и вторым законами термодинамики.
Второй закон относится к качеству энергии. Этот закон гласит, что всякий раз, когда энергия трансформируется, часть энергии теряется в менее полезной форме. В экосистемах самые большие потери происходят в виде дыхания. Второй закон объясняет, почему передача энергии никогда не бывает эффективной на 100%. На самом деле экологическая эффективность, то есть количество энергии, передаваемой с одного трофического уровня на другой, колеблется от 5 до 30%. В среднем экологическая эффективность составляет всего около 10%.
Поскольку экологическая эффективность настолько низка, каждый трофический уровень имеет последовательно меньший запас энергии, из которого он может извлекать энергию.
 Вот почему пищевые сети имеют не более четырех-пяти трофических уровней. Кроме того, недостаточно энергии, чтобы поддерживать хищников более высокого порядка
Вот почему пищевые сети имеют не более четырех-пяти трофических уровней. Кроме того, недостаточно энергии, чтобы поддерживать хищников более высокого порядкаизображение с сайта goose.ycp.edu
2.2.U14 Биоаккумуляция – это накопление стойких или не поддающихся биологическому разложению загрязнителей в организме или на трофическом уровне, поскольку они не могут быть расщеплены
- Дайте определение биоаккумуляции со ссылкой на названный пример
Включите концентрацию небиоразлагаемых токсинов в пищевых цепях, ограниченную длину пищевых цепей и уязвимость высших хищников. Рассмотрим термины биоусиление, биоаккумуляция и биоконцентрация.
- Биоаккумуляция относится к тому, как загрязняющие вещества попадают в пищевую цепь. Это увеличение концентрации загрязняющего вещества из окружающей среды к первому организму в пищевой цепи
Если загрязняющее вещество недолговечно, оно распадется до того, как станет опасным.
 Если он не подвижен, то останется на одном месте и вряд ли будет поглощен организмами. Если загрязняющее вещество растворимо в воде, оно будет выведено из организма. Однако загрязняющие вещества, которые растворяются в жирах, могут сохраняться в течение длительного времени.
Если он не подвижен, то останется на одном месте и вряд ли будет поглощен организмами. Если загрязняющее вещество растворимо в воде, оно будет выведено из организма. Однако загрязняющие вещества, которые растворяются в жирах, могут сохраняться в течение длительного времени.Токсины, такие как ДДТ и ртуть, накапливаются в пищевых цепях из-за уменьшения биомассы и энергии
2.2.U15 Биомагнификация – это увеличение концентрации стойких или не поддающихся биологическому разложению загрязнителей в пищевой цепи
- Объяснить биоусиление
- Определить СОЗ
- Объяснить, почему основные потребители подвергаются наибольшему риску токсического воздействия биоусиления
Биомагнификация относится к тенденции загрязняющих веществ концентрироваться по мере их перехода с одного трофического уровня на другой.
 Это увеличение концентрации загрязнителя от одного звена пищевой цепи к другому.
Это увеличение концентрации загрязнителя от одного звена пищевой цепи к другому.
Нас беспокоят эти явления, потому что вместе они означают, что даже небольшие концентрации химических веществ в окружающей среде могут попасть в организмы в достаточно высоких дозах, чтобы вызвать проблемы. Для того чтобы произошла биомагнификация, загрязнитель должен быть:- долгоживущим
- подвижным
- растворимым в жирах
- биологически активным
2.2.U16 Токсины, такие как ДДТ и ртуть, накапливаются в пищевых цепях из-за уменьшения биомассы и энергии
- Объясните, каким образом ДДТ и ртуть накапливаются в пищевой цепи
В окружающей среде насекомые сталкиваются с ДДТ и поглощают часть его своим телом. Часто они получали сублетальную дозу, достаточную, чтобы повредить их, но, возможно, не убить. В любом случае само собой разумеется, что насекомые, либо умирающие, либо просто замедленные приемом пестицидов, становятся легкой мишенью для птиц.
 При проглатывании ДДТ из тел насекомых высвобождается и проникает в ткани тела птицы, особенно в жировые отложения. Поскольку отдельная птица поедает много насекомых, и поскольку ДДТ не покидает тело птицы, и поскольку ДДТ сопротивляется разрушению (либо в окружающей среде, либо в организме), он накапливается в более высоких количествах в тканях птицы. Другими словами, ДДТ, распыленный, скажем, на 1000 сверчков, будет сконцентрирован в одной птице.
При проглатывании ДДТ из тел насекомых высвобождается и проникает в ткани тела птицы, особенно в жировые отложения. Поскольку отдельная птица поедает много насекомых, и поскольку ДДТ не покидает тело птицы, и поскольку ДДТ сопротивляется разрушению (либо в окружающей среде, либо в организме), он накапливается в более высоких количествах в тканях птицы. Другими словами, ДДТ, распыленный, скажем, на 1000 сверчков, будет сконцентрирован в одной птице.2.2.U17 Иногда числовые пирамиды могут отображать разные узоры; например, когда особи на более низких трофических уровнях относительно велики (перевернутые пирамиды) ]
- Определите функцию числовой пирамиды
- Перечислите сильные и слабые стороны числовой пирамиды
Pyramid числа:
показывает количество организмов на каждом трофическом уровне в пищевой цепи. Пирамиды чисел иногда могут отображать разные узоры; например, когда особи на более низких трофических уровнях относительно велики (перевернутые пирамиды).
Преимущество
- простой способ дать общее представление
- удобен для сравнения изменений численности популяции за разное время
Недостаток
- включены все организмы, независимо от их размера
- Идентифицировать функция пирамиды биомассы
- Перечислите сильные и слабые стороны пирамиды биомассы
- преодолевает проблемы пирамид чисел
- Используется только образцы из популяций, поэтому невозможно измерить биомассу ровно
- Организм должен быть убит, чтобы измерение сухой массы
2.2.U18 Пирамида биомассы представляет постоянный запас или запас каждого трофического уровня, измеряемый в таких единицах, как граммы биомассы на квадратный метр (г м-2) или джоули на квадратный метр (Дж м-2)( единиц биомассы или энергии)
[Хотя в литературе есть различия, для этой программы пирамиды биомассы относятся к урожаю на корню (фиксированный момент времени), а пирамиды продуктивности относятся к скорости потока биомассы или энергии]Пирамида биомассы:
Содержит биомассу на каждом трофическом уровне. Пирамида биомассы представляет собой постоянный запас или хранилище каждого трофического уровня, измеряемый в таких единицах, как граммы биомассы на квадратный метр (г м–2). Пирамиды биомассы могут показывать большие количества на более высоких трофических уровнях, потому что они представляют собой биомассу, присутствующую в фиксированный момент времени, хотя могут быть отмечены сезонные колебания.
Пирамида биомассы представляет собой постоянный запас или хранилище каждого трофического уровня, измеряемый в таких единицах, как граммы биомассы на квадратный метр (г м–2). Пирамиды биомассы могут показывать большие количества на более высоких трофических уровнях, потому что они представляют собой биомассу, присутствующую в фиксированный момент времени, хотя могут быть отмечены сезонные колебания.Advantage
Недостаток
59927 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 9000 2. 2. U19 Пирамиды биомассы могут показывать большие количества на более высоких трофических уровнях, потому что они представляют собой биомассу, присутствующую в фиксированный момент времени, хотя могут быть заметны сезонные колебания.
[Хотя в литературе существуют различия, для этой программы пирамиды биомассы относятся к урожаю на корню (фиксированный момент времени), а пирамиды продуктивности относятся к скорости потока биомассы или энергии]
Пирамида биомасса – это диаграмма, представляющая количество биомассы, измеренное в граммах сухой массы на квадратный метр (г м−2), обнаруженное в определенной среде обитания на восходящих трофических уровнях пищевой цепи. Биомасса уменьшается на каждом восходящем уровне пищевой цепи. Пирамида биомассы является более точным представлением потока энергии через пищевую цепь, чем пирамида чисел, но сезонные изменения скорости оборота организмов на определенном уровне могут привести к более высоким или более низким значениям количества энергии. биомассы, отобранной в определенное время, чем среднее количество за весь год.
2.2.U20 Пирамиды продуктивности относятся к потоку энергии через трофический уровень с указанием скорости, с которой этот запас/хранение создается и слабость пирамиды продуктивности Пирамида продуктивности: Преимущество Недостатки
Пирамиды продуктивности относятся к потоку энергии через трофический уровень,
указывает на скорость, с которой создается этот запас/хранилище. Он содержит поток энергии через каждый трофический уровень; показывает энергию, вырабатываемую и доступную в качестве пищи для следующего трофического уровня в течение фиксированного периода времени, измеряемую в таких единицах, как поток биомассы или энергии на квадратный метр (г м-2 год-1) или джоулей на квадратный метр (Дж м-2 год) (единицы биомассы или энергии).
Он содержит поток энергии через каждый трофический уровень; показывает энергию, вырабатываемую и доступную в качестве пищи для следующего трофического уровня в течение фиксированного периода времени, измеряемую в таких единицах, как поток биомассы или энергии на квадратный метр (г м-2 год-1) или джоулей на квадратный метр (Дж м-2 год) (единицы биомассы или энергии).
9,0025
U21 Пирамиды продуктивности целых экосистем в течение года всегда показывают снижение по пищевой цепи.
Энергия течет по пищевой цепи предсказуемым образом, входя в основание пищевой цепи, путем фотосинтеза в первичных продуцентах, а затем продвигаясь вверх по пищевой цепи на более высокие трофические уровни. Поскольку передача энергии с одного трофического уровня на другой неэффективна, на более высокие трофические уровни поступает меньше энергии. Таким образом, диаграммы, показывающие, сколько энергии поступает на каждый трофический уровень, будут иметь отчетливую форму пирамиды.
Поскольку передача энергии с одного трофического уровня на другой неэффективна, на более высокие трофические уровни поступает меньше энергии. Таким образом, диаграммы, показывающие, сколько энергии поступает на каждый трофический уровень, будут иметь отчетливую форму пирамиды.
В соответствии со вторым законом термодинамики существует тенденция к уменьшению числа и количества биомассы и энергии по цепям питания; поэтому пирамиды становятся уже по мере восхождения.
Применение и навыки
2.2.A1 Объясните перенос и преобразование энергии при ее протекании через экосистему.
Почти вся энергия поступает в экосистемы Земли в виде солнечного излучения. Затем эта энергия преобразуется и используется разнообразными организмами, из которых состоят пищевые сети. С помощью фотосинтеза производители превращают солнечный свет в глюкозу, которую затем используют для дыхания. Хлоропласты в растительных клетках используют солнечный свет для преобразования CO2 и воды в глюкозу и газообразный кислород. Затем митохондрии растений используют сахара для получения энергии, чтобы управлять дыханием, их клеточными процессами, необходимыми для выживания.
Затем митохондрии растений используют сахара для получения энергии, чтобы управлять дыханием, их клеточными процессами, необходимыми для выживания.
Объясните пути проникновения солнечной радиации в экосистему, включая:
- • потерю излучения в результате отражения и поглощения
- • преобразование света в химическую энергию
- • потерю химической энергии с одного трофического уровня на другой
- •эффективность передачи
- •общее преобразование света в тепловую энергию экосистемой
- •повторное излучение тепловой энергии в атмосферу.
2.2.A2 Анализ эффективности передачи энергии через систему.
Валовая первичная продукция – это мера энергии, которую растения преобразуют от солнца. Доля этой энергии, которая преобразуется в глюкозу, отражает валовую продуктивность растения. Энергия, остающаяся после дыхания, считается чистой первичной продукцией. В общем, валовая продукция относится к энергии, содержащейся в организме до дыхания, а чистая продукция — к энергии после дыхания. Эти термины можно использовать для описания переноса энергии как у автотрофов, так и у гетеротрофов.
Эти термины можно использовать для описания переноса энергии как у автотрофов, так и у гетеротрофов.
Энергия будет уменьшаться с каждым повышением трофического уровня – второй закон термодинамики гласит, что при любой передаче энергии часть энергии теряется из-за тенденции к увеличению беспорядка (энтропии). Энергия для более высоких трофических уровней также ограничивается потерями из-за метаболического дыхания, а также защитными стратегиями некоторых организмов, которые снижают качество пищи. Передача энергии между трофическими уровнями, как правило, неэффективна, так что чистая продукция на одном трофическом уровне обычно составляет всего 10 % чистой продукции на предыдущем трофическом уровне
2.2.A3 Объясните отношение законов термодинамики к потоку энергии через экосистемы
При изучении потока энергии через экосистемы важны два закона физики. Первый закон термодинамики утверждает, что энергия не может быть создана или уничтожена; его можно только изменить из одной формы в другую. Энергия для функционирования экосистемы поступает от Солнца. Солнечная энергия поглощается растениями, где в ней преобразуется в накопленную химическую энергию.
Энергия для функционирования экосистемы поступает от Солнца. Солнечная энергия поглощается растениями, где в ней преобразуется в накопленную химическую энергию.
Второй закон термодинамики утверждает, что всякий раз, когда энергия преобразуется, происходит потеря энергии за счет выделения тепла. Это происходит, когда энергия передается между трофическими уровнями, как показано в пищевой сети. Когда одно животное питается другим, в процессе происходит потеря тепла (энергии). Дополнительные потери энергии происходят при дыхании и движении. Следовательно, по мере продвижения вверх по трофическим уровням теряется все больше и больше энергии.
2.2.A4 Объясните воздействие стойких или не поддающихся биологическому разложению загрязнителей на экосистему.
Это относится к тому, как долго пестицид остается активным в окружающей среде. Некоторые химические вещества расщепляются разлагающими веществами в почве (они биоразлагаемы) и поэтому не являются стойкими, в то время как другие не могут быть расщеплены микробами (они не поддаются биологическому разложению) и поэтому продолжают действовать в течение многих лет и классифицируются как стойкие пестициды. Ранние пестициды (такие как DTT) были стойкими и наносили большой ущерб окружающей среде, и в настоящее время они в значительной степени заменены биоразлагаемыми инсектицидами, такими как карбаматы и пиретроиды 9.0003
Ранние пестициды (такие как DTT) были стойкими и наносили большой ущерб окружающей среде, и в настоящее время они в значительной степени заменены биоразлагаемыми инсектицидами, такими как карбаматы и пиретроиды 9.0003
изображение из InTech
2.2.S1 Создание моделей пищевых отношений, таких как пищевые цепи, пищевые сети и экологические пирамиды, на основе имеющихся данных
изображение с сайта users.rcn.com |
Системные диаграммы можно использовать для отображения потока энергии через экосистемы. Запасы энергии обычно показаны в виде прямоугольников, которые представляют различные трофические уровни. Потоки энергии обычно показаны в виде стрелок (количество энергии в джоулях или биомасса на единицу представлены толщиной стрелки).
2.2.S2 Построить системные диаграммы, представляющие фотосинтез и дыхание.
Основные термины
потребитель | поток против запасов/хранилищ | трофический уровень | пищевая цепь | производитель |
Классные материалы
Фотосинтез Клеточное дыхание плакат
Построение экологических пирамид рабочий лист
923 Экологические пирамиды1422 Биомагнификация и биоаккумуляция Тематические исследования
Тематические исследования
- Названные примеры пищевой цепи, включающие: производителей, потребителей и разлагателей
- Названные примеры для объяснения биоаккумуляции и биомагнификации Пищевая сеть
Влияние рыболовства на структуру пищевой сети
Как китобойный промысел влияет на пищевую цепьПрезентация и примечания адаптированы из Brad Kremer, P Brooks and Ms.
 McCrindle
McCrindle Правильное использование терминологии является ключевым навыком в ESS. Очень важно правильно использовать ключевые термины при выражении своего понимания, особенно в оценках. Используйте карточки-викторины или другие инструменты, такие как изучение, разброс, космическая гонка, правописание и тест, чтобы помочь вам освоить словарный запас.
Полезные ссылки
Nitche Science — 2.2 Сообщества и экосистемы: дыхание и фотосинтез
Скорость фотосинтеза и дыхание экосистем — Internet Chemistry
Ecosystem Animation — Wardsworth Media
Ecosystem Model — Annenburger Learner
Ecological Pyramid Quizlet
Build a Food Web — Gould League
Build a Food Chain — Parenting The Next Generation
Пищевые цепи – BrainPop
Построить пищевую сеть – Преподаватель Scholastic
Пищевые цепи и пищевые сети от BBC Bitesize
Задание «Открыть пищевую сеть» s — How Stuff Works
Food Chains — USGS
Biomagnification Animation — Living Envrionment
Bioaccumulation Animation — McGraw-Hill
Trade Secret — PBS
Mercury in Fish from Utah State
Minimata Disease — Википедия
Биномиальная номенклатура — Science Pro Online
В новостях
Залив Минамата, Япония — ProQuest, февраль 2007 г.
Исследование обнаружило следовые уровни радиации Фукусимы в альбакоре – KVAL.com 28 апреля 2014 г. 2020
Скрытая жизнь водорослей: как морские каланы, ежи и морские звезды создают океанские леса лучше другого?
Международная ориентирована:
- Экосистемы, такие как озера и леса, могут существовать по политическим границам
Видео-клипы
Ecosystems, Organisms и их окружающая среда
90009000 2 9000 2
9000 2
9000 2
. науки и описывает «экономику» клеточного дыхания и различные процессы, посредством которых наши тела создают энергию в форме АТФ. Тем не менее, получите основную идею. Вам не нужно знать конкретные детали
Хэнк объясняет чрезвычайно сложную серию реакций, в ходе которых растения питаются солнечным светом, углекислым газом и водой, а также производят некоторые побочные продукты, которые нам очень нравятся. Тем не менее, получите основную идею. Вам не нужно знать конкретные детали
Тем не менее, получите основную идею. Вам не нужно знать конкретные детали
Экосистема пастбищ и пищевая цепь.
Хэнк выводит нас на следующий уровень экологических исследований с экологией экосистемы, которая изучает, как энергия, питательные вещества и материалы перемещаются внутри экосистемы (совокупность живых и неживых существ, взаимодействующих в определенном месте), и что в основном сводится к тому, кто кого ест.
Взаимодействия между видами определяют экологические сообщества, и экология сообществ изучает эти взаимодействия везде, где они происходят. Хотя межвидовые взаимодействия в основном конкурентны, конкуренция довольно опасна, поэтому многие взаимодействия на самом деле направлены на то, чтобы обойти прямую конкуренцию и вместо этого найти способы разделить ресурсы, чтобы позволить видам ужиться. Чувствовать любовь?
Чувствовать любовь?
Узнайте все об экологических пирамидах и о том, как отображать количественные данные об отношениях между видами.
Объяснение правила 10 процентов в экосистеме. Примерно 90 процентов энергии теряется при ее передаче вверх по каждому трофическому уровню.
Узнайте о биоусилении, которое может произойти, когда токсины становятся более концентрированными при продвижении по трофическим уровням в пищевой цепи. В качестве примера в видео используется неконтролируемое использование ДДТ. Узнайте, почему у потребителей высокого уровня может происходить биоаккумуляция!
Штат Нью-Йорк регулярно выпускает рекомендации по охране здоровья рыбы, пойманной в местных водах.
