«Цепочки химических превращений в органической химии»
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. ацетат калия → этан → X → этанол → диэтиловый эфир
2.CaC2→ этин → этаналь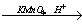 X1
X1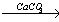 X2
X2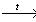 X3
X3
3.Al4C3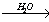 X1
X1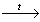
 этаналь
этаналь 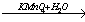 X3
X3 X1
X1 4. CaC2→этин→этаналь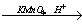 X1
X1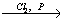 X2
X2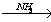 X 3
X 3
5. CaC2 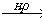 X1
X1 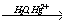 X2→ H3C–COOH
X2→ H3C–COOH  X3→ (CH3)2–C=O
X3→ (CH3)2–C=O
6. HC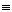 CH
CH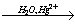 X1
X1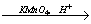
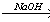 X2
X2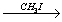 X3
X3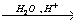 уксусная кислота
уксусная кислота 7.Метилат калия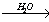 → бромметан
→ бромметан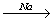 Х2
Х2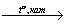 Х3
Х3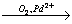
8. Ацетальдегид → ацетат калия → этановая кислота → этилацетат → ацетат кальция → ацетон
9. CH3CHO 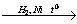 Х1
Х1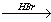 Х2→ этилен → CH3CHO
Х2→ этилен → CH3CHO 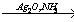 X3
X3
10. CH3COOH→ X1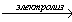 С2H6
С2H6 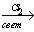
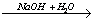 X3
X3 X4
X4 11. C2H5OH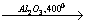 X1
X1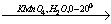 X2
X2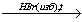 X3
X3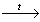
 C2H4O
C2H4O 12. CH2BrCH2CH2Br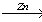 X1
X1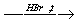 X2→ пропен
X2→ пропен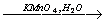 X3→ 1,2- дибромпропан
X3→ 1,2- дибромпропан
13. CH4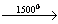 X1→ C6H6
X1→ C6H6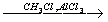
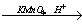 X3
X3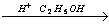 X4
X4 14. карбид алюминия 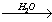 Х1
Х1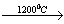 Х2
Х2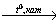 бензол
бензол 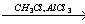
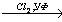 X4
X4 15. 1-хлорпропан 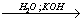 Х1
Х1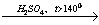 X2
X2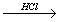 X3
X3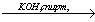 X2→ изопропилбензол
X2→ изопропилбензол
16. этен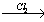 X1
X1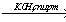
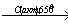 X3→толуол
X3→толуол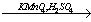 X4
X4 17. C2H4→ C2H4Cl2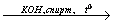 X1
X1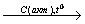 X2
X2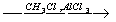 X3
X3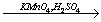
18. CH3CH2CH2OH→ X1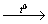 C6H14
C6H14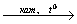 X2
X2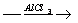 C6H5СН3→ C6H5CООН
C6H5СН3→ C6H5CООН
19. С2Н2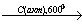 Х1→ C6H5С2Н5
Х1→ C6H5С2Н5
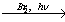 X2
X2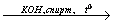 X3
X3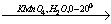 X4
X4 20. ацетилен бензол
бензол этилбензол
этилбензол 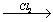 X1
X1 X2
X2 полистирол
полистирол
21. C6H6→C6H5CH3→ C6H5CООН→ C6H5CООCH3→CH3OH→(CH3)2O (укажите условия проведения реакций).
22.
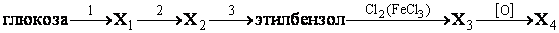
23. C2H2→X1→X2→C6H5CH3→NO2–C6H4–CH3 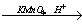 X3
X3
24. CH3-CH2-CH(CH3)-CH3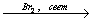 X1
X1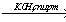 X2
X2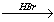 X1
X1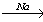 X3CO2
X3CO2
25. CH4→ HCHO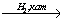 X1
X1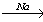 X2
X2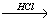 X1
X1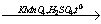 X3
X3
26. пропилацетат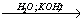 X1→ CH4
X1→ CH4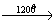 X2
X2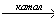 винилацетат
винилацетат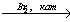 X3
X3
27. CH3-CH2-CHO 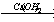 X1
X1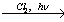 X2
X2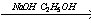 X3
X3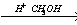 X4
X4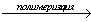 X5
X5
28. Ацетат калия 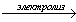 X1
X1 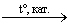 X2
X2 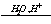 X3
X3 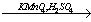 X4
X4 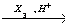 X5
X5
29. этанол 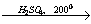 Х1
Х1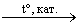 Х2
Х2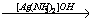 Ag2C2
Ag2C2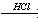 X2
X2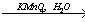 X3
X3
30. C6H6→C6H5-CH(CH3)2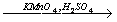 X1
X1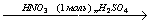 X2
X2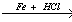 X3
X3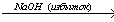 X4
X4
Ответы на задания практической части:
Задание 1
Электролиз раствора ацетата калия:
K(-) (K+) – не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH– | 2
А(+) 2CH3COO––2ē = CH3-CH3 + 2CO2 | 2
Суммарное уравнение:
2CH3COO– + 2H2O = H2+ 2OH– + CH3-CH3 + 2CO2
Или 2CH3COOK + 2H2O = H2+ 2KOH + CH3-CH3 + 2CO2
При нагревании этана в присутствии катализатора Ni, Pt, происходит дегидрирование, X – этен: CH3-CH3 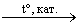 CH2=CH2 + H2
CH2=CH2 + H2
Следующая стадия – гидратация этена:
CH2=CH2 + H2O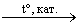 CH3-CH2OH;
CH3-CH2OH;
Перманганат калия в кислой среде – сильный окислитель и окисляет спирты до карбоновых кислот:
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
Наконец, взаимодействие уксусной кислоты и спирта приведет к образованию сложного эфира:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Задание 2
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) C2H2 + H2O 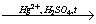 CH3СHO
CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) 2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
5) (CH3COO)2Ca 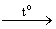 CaCO3 + (CH3)2CO
CaCO3 + (CH3)2CO
Задание 3
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2 CH4C2H2 + 3H2
3) C2H2 + H2O 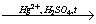 CH3СHO
CH3СHO
4) 3CH3СHO + 2KMnO4 + 3H2O → 2CH3COOK+ CH3COOH+ 2MnO2 + H2O
5) CH3COOK + KOH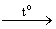 CH4 + K2CO3
CH4 + K2CO3
Задание 4
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) C2H2 + H2O 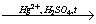 CH3СHO
CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) 2CH3COOH + Cl2 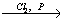 CH2ClCOOH + HCl
CH2ClCOOH + HCl
5) CH2ClCOOH + NH3 CH2(NH2)COOH + HCl
20) CaC2 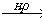 X1
X1 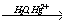 X2→ H3C–COOH
X2→ H3C–COOH  X3→ (CH3)2–C=O
X3→ (CH3)2–C=O
Задание 5
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) Н-С≡С-Н 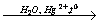 H3C – COH
H3C – COH
3) H3C–COH +2Сu(ОН)2 → H3C–COOH +Сu2О + 2Н2О
4) 2H3C–COOH + Ba(OH)2 →(СН3COO)2Ba + 2Н2О
5) (СН3COO)2Ba (к) 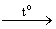 (CH3)2–C=O + BaCO3
(CH3)2–C=O + BaCO3
Задание 6
1) Н-С≡С-Н 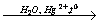 H3C – COH
H3C – COH
2) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
3) H3C–COOH + NaOH→СН3COONa + Н2О
4) СН3COONa + CH3I СН3COOCH3 + NaI
5) СН3COOCH3 + H2O 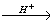 CH3COOH + CH3OH
CH3COOH + CH3OH
Задание 7
1) CH3OK+ H2O 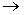 KOH + CH3OH
KOH + CH3OH
2) CH3OH + HBr 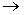 CH3Br + H2O
CH3Br + H2O
3) 2CH3Br + 2Na  С2H6 + 2NaBr
С2H6 + 2NaBr
4) С2H6 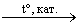 C2H4 + H2
C2H4 + H2
5) 2C2H4 + O2 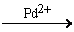 2CH3CHO
2CH3CHO
Задание 8
Ацетальдегид ацетат калия этановая кислота этилацетат ацетат кальция ацетон. Перепишем:
CH3CHO CH3COOK CH3COOH CH3COOC2H5 (CH3COO)2Ca (CH3)2CO
Тип реакции может подсказать сравнение состава исходного и получаемого веществ. Так, для первого превращения видно, что необходимо окислить альдегид в щелочной среде, например:
CH3CHO + 2KMnO4 + 3KOH CH3COOK + 2K2MnO4 + 2H2O
CH3COOK + HCl = CH3COOH + KCl
CH3COOH + C2H5OH 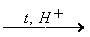 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Чтобы из эфира получить ацетат, надо провести его гидролиз в щелочной среде, причем в качестве щелочи взять гидроксид кальция:
2CH3COOC2H5 + Ca(OH)2 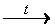 (CH3COO)2Ca + 2C2H5OH
(CH3COO)2Ca + 2C2H5OH
Особую сложность может вызвать последнее превращение, поскольку способы получения кетонов в базовом курсе химии обычно не рассматриваются. Для его осуществления проводят пиролиз (термическое разложение) ацетата кальция:
(CH3COO)2Ca 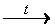 (CH3)2CO + CaCO3
(CH3)2CO + CaCO3
Задание 9
1) CH3CHO + H2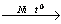 C2H5OH
C2H5OH
2) C2H5OH + HBr C2H5Br + H2O
3) C2H5Br + KOH (спирт) C2H4 + KBr + H2O
4) 2C2H4 + O2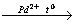 2 CH3CHO
2 CH3CHO
5) CH3CHO + Ag2O + NH3 CH3COONH4 + 2Ag
Задание 10:
1) CH3COOH + KOH CH3COOK + H2O
2) CH3COOK + 2H2O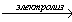 H2+ 2KOH + CH3-CH3 + 2CO2
H2+ 2KOH + CH3-CH3 + 2CO2
3) CH3-CH3 + Cl2 CH3-CH2Cl + HCl
CH3-CH2Cl + HCl
4) CH3-CH2Cl + NaOH (водн) CH3-CH2-OH +NaCl
5) 2CH3-CH2-OH H2O + CH3-CH2-O-CH2-CH3
H2O + CH3-CH2-O-CH2-CH3
Задание 11
1) C2H5OH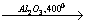 CH2=CH2 + H2O
CH2=CH2 + H2O
2) 3CH2=CH2 + 2KMnO4 + 4H2O 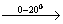 3CH2OH-CH2OH + 2MnO2 + 2KOH
3CH2OH-CH2OH + 2MnO2 + 2KOH
3) CH2OH-CH2OH + 2HBr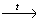 CH2BrCH2Br +2H2O
CH2BrCH2Br +2H2O
4) CH2BrCH2Br +2KOH (спирт) 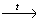 Н-С≡С-Н + 2H2O +2KBr
Н-С≡С-Н + 2H2O +2KBr
5) Н-С≡С-Н +H2O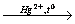
Задание 12
1) CH2BrCH2CH2Br + Zn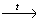 CH2=CH2CH3 + ZnCl2
CH2=CH2CH3 + ZnCl2
2) CH2=CH2CH3+ HBr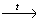 CH3-CH2BrCH3
CH3-CH2BrCH3
3) CH3-CH2BrCH3 +KOH (спирт) CH2=CH2CH3 + KBr
4) CH2=CH2CH3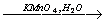 CH2(OH)-CH(OH)-CH3
CH2(OH)-CH(OH)-CH3
5) CH2(OH)-CH(OH)-CH3 + 2HBr 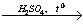 CH2BrCH2BrCH3 + 2H2O
CH2BrCH2BrCH3 + 2H2O
Задание 13
1) 2CH4 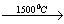 C2H2 + 3H2
C2H2 + 3H2
2) 3C2H2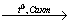 C6H6
C6H6
3) C6H6 + CH3Cl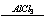 C6H5CH3 + HCl
C6H5CH3 + HCl
4) C6H5CH3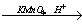 C6H5-COOH
C6H5-COOH
5) C6H5-COOH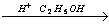 C6H5-COOC2H5 +H2O
C6H5-COOC2H5 +H2O
Задание 14
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2CH4 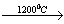 C2H2 + 3H2
C2H2 + 3H2
3) 3C2H2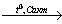 C6H6
C6H6
4) C6H6 + CH3Cl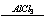 C6H5CH3 + HCl
C6H5CH3 + HCl
5) C6H5CH3 + Cl2 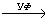 C6H5CH2Cl +HCl
C6H5CH2Cl +HCl
Задание 15:
1) H2CCl-CH2-CH3 + KOH (водн) KCl + H2COH-CH2-CH3
2) H2COH-CH2-CH3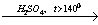 H2C=CH2-CH3 + H2O
H2C=CH2-CH3 + H2O
3) H2C=CH2-CH3 + HCl H3C-CH2Cl-CH3
4) H3C-CH2Cl-CH3 + KOH (спирт) H2C=CH2-CH3 + KCl
5) 
Задание 16 и 17
1) С2H4 + Cl2 CH2Cl-CH
infourok.ru
Методическая разработка «Алгоритм решения превращений по химии»
Методические рекомендации решения «цепочек» превращения по химии.
В заданиях ля школьников по химии на любом этапе обучения и для любой параллели всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Для того, чтобы успешно решать цепочки химических превращений из одного вещества в другое, необходимо изучить свойства веществ, их взаимодействия и особенности каждого класса соединений. Среди качественных задач решение цепочек веществ встречаются чаще всего.
Алгоритм решения «цепочки»:
1.Внимательно прочитайте условие задачи. Если необходимо, можете сделать это не один раз.
Напишите уравнения, с помощью которых можно получить следующие превращения:
Al → → Al2O3 → Al(OH)3 → K[AL(OH)4] → AlCl3 → Al(NO3)3 → AlPO4.
Для каждого превращения составьте уравнения реакций. Если переход в одну стадия невозможен, составьте два и более уравнений реакций.
2.Выпишите цепочку отдельно, из условия задачи. Вы можете пронумеровать количество реакций и ли веществ для удобства. Помните, что каждое следующее вещество является исходным для последующего. Определите к какому классу веществ относиться каждый член цепочки. Под первым номером стоит металл алюминий. исходным продуктом реакции должна стать соль. По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
3.Проверьте себя еще раз. Пробегитесь взглядом по уравнениям реакций, проверьте везде ли стоят нужные коэффициенты. Не забудьте правильно оформить уравнения реакций.
Решение
1.Al + 6HNO3(конц.) => Al(NO3)3 + 3NO2 + 3h3O
2.4Al(NO3)3 => 2AL2O3 + 12NO2 + 3O2
3.Al2O3 + 3h3SO4 => Al2(SO4)3 + 3h3O
Al2(SO4)3 + 6NaOH => 2Al(OH)3 + 3Na2SO4
4.Al(OH)3 +KOH => K[Al(OH)4]
5.K[Al(OH)4] + 4HCl => KCl + AlCl3 + 4h3O
6.AlCl3 + 3AgNO3 => Al(NO3)3 + 3AgCl
7.Al(NO3)3 + K3PO4 => AlPO4 + 3KNO3
Решите «цепочки» самостоятельно:
Ca → CaO → Ca(OH)2 →CaCl2
NaOH
Na2O Na2CO3
NaNO3
Mg→MgO→Mg(OH)2→MgCl2
K2O→ KOH→K2SO4
KNO3
S →SO2 → H2SO3
Na2SO3
Cu→CuO→CuCl2→Cu(OH)2→CuO
Ba Ba(NO3)2 Ba(OH)2 BaO
Zn ZnO Zn(OH)2 ZnSO4
Cu CuO Cu(OH)2 CuO
Fe FeCl2 Fe (OH)2 FeO
Ca CaSO4 Ca(OH)2 CaO
Si SiO2 H2SiO3 K2SiO3
N2 N2O5 HNO3 NaNO3
O2 H2O H2 HCl
H2 H2O Ca(OH)2 CaO
Fe FeO Fe(OH)2 FeCl2
Ca CaO Ca(OH)2 Ca(NO3)2
K K2O KOH K2SO4
Na Na2O NaOH Na2СО3
P P2O5 H3PO4 Na3PO4
Mg MgO Mg(OH)2 MgSO4
Ba BaO Ba(OH)2 BaCl2
Ca → CaO → Ca(OH)2 →Ca(NO3)2
Cu(OH)2 → CuO → CuCl2→ Cu(OH)2
S → SO2 → H2SO3 → CaSO3
Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3
P → P2O5 → H3PO4 → Na3PO4
H2O → O2 → CO2 → CaCO3
Fe(OH)2 → FeO → Fe → FeCl2
C → CO2 → Na2CO3 → H2CO3
infourok.ru
Ответы@Mail.Ru: Как решать химические цепочки?
Во-первых, представить цепочку в норамльном химическом виде: KMnO4 -> O2 -> CuO -> CuCl2 -> CuSO4 -> Cu(OH)2 Дальше всё просто. Такие задания требуют для выполнения только знаний практически всего курса химии. Если их нет, советовать трудно. но некоторые реакции можно найти в учебнике. Например, первый переход — лабораторный способ получения кислорода, вторая реакция наверняка есть в химических свойствах кислорода, третья — в химических свойствах кислот или конкретно соляной кислоты и т. д. Проблемным здесь является четвертое превращение (если оно написано верно): здесь по-хорошему без промежуточного продукта не обойтись: CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl Cu(OH)2 + h3SO4 = CuSO4 + 2h3O Кстати, если в первой реакции заменить хлорид на сульфат, то получится последний переход.
это значит, что перманганат калия нужно разложить так, чтобы получился кислород, затем к кислороду нужно что-то добавить, чтобы получить оксида меди и т. д.
вводишь по две формулы в Google и нажимаешь Enter. например O2+…=KMnO4 и Enter) Решай))
помогите решить Fe-Fe203-Fe(OH)3-Fe203-FeCl3
touch.otvet.mail.ru
Практическая работа №3
Опыт 1. Осуществление цепочки превращений.
MgO + 2HCl ⟶ MgCl2 + H2O
MgO + 2H+ + 2Cl— ⟶ Mg2+ + 2Cl— + H2O
MgO + 2H+ ⟶ Mg2+ + H2O
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg2+ + 2Cl— + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Mg(OH)2↓
Mg2+ + 2OH— ⟶ Mg(OH)2↓
Mg(OH)2 + H2SO4 ⟶ MgSO4 + 2H2O
Mg(OH)2 + 2H+ + SO42- ⟶ Mg2+ + SO42- + 2H2O
Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O
MgSO4 + Na2CO3 ⟶ Na2SO4 + MgCO3↓
Mg2+ + SO42- + 2Na+ + CO32- ⟶ 2Na+ + SO42- + MgCO3↓
Mg2+ + CO32- ⟶ MgCO3↓
Опыт 2. Получение соединений металлов и изучение их свойств.
При добавлении щелочи к хлориду железа (II) образуется осадок темно-зеленого цвета:
FeCl2 + 2NaOH ⟶ 2NaCl + Fe(OH)2↓
Fe2+ + 2Cl— + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Fe(OH)2↓
Fe2+ + 2OH— ⟶ Fe(OH)2↓
Получим из хлорида железа (II) хлорид железа (III), используя в качестве окислителя пероксид водорода:
2FeCl2 + 2HCl + H2O2 ⟶ 2FeCl3 + 2H2O
2Fe3+ + 4Cl— + 2H+ + 2Cl— + H2O2 ⟶ 2Fe3+ + 6Cl— + 2H2O
2Fe3+ + 2H+ + H2O2 ⟶ 2Fe3+ + 2H2O
При добавлении щелочи к хлориду железа (III) образуется осадок рыжего цвета:
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl— + 3Na+ + 3OH— ⟶ 3Na+ + 3Cl— + Fe(OH)3↓
Fe3+ + 3OH— ⟶ Fe(OH)3↓
Опыт 3. Распознавание соединений металлов.
1) Во все пробирки добавить воды.
2) Добавить раствор гидроксида натрия. В пробирках с сульфатом магния и сульфатом цинка образуются осадки:
MgSO4 + 2NaOH ⟶ Na2SO4 + Mg(OH)2↓
Mg2+ + SO42- + 2Na+ + 2OH— ⟶ 2Na+ + SO42- + Mg(OH)2↓
Mg2+ + 2OH— ⟶ Mg(OH)2↓
ZnSO4 + 2NaOH ⟶ Na2SO4 + Zn(OH)2↓
Zn2+ + SO42- + 2Na+ + 2OH— ⟶ 2Na+ + SO42- + Zn(OH)2↓
Zn2+ + 2OH— ⟶ Zn(OH)2↓
При дальнейшем добавлении раствора гидроксида натрия, в пробирки с выпавшими осадками, в одной из пробирок произойдет растворение осадка:
Zn(OH)2 + 2NaOH ⟶ Na2[Zn(OH)4]
Zn(OH)2 + 2Na+ + 2OH— ⟶ 2Na+ + [Zn(OH)4]—
Zn(OH)2 + 2OH— ⟶ [Zn(OH)4]—
В пробирке, где произошло растворение осадка, находился сульфат цинка, а где не растворился осадок – находился сульфат магния.
3) В две пробирки с нераспознанным веществами добавим соляную кислоту, в пробирке с карбонатом кальция будет наблюдаться выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl— ⟶ Ca2+ + 2Cl— + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
4) В оставшуюся пробирку (с сульфатом натрия) добавим хлорид бария, выпадет белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl— ⟶ 2Na+ + 2Cl— + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
gomolog.ru
помогите по химии!! Срочно! ПОЖАЛУЙСТА! 9 КЛАСС….Цепочка превращений
Задание 1 (1). Fe + h3SO4 (р-р) = FeSО4 +h3 FeSO4 +2NaOH =Fe(OH)2 (осадок) +Na2SO4 Fe(OH)2+2HNO3 = Fe(NO3)2+2h3O Задание 1(2) FeCl3+3NaOH =Fe(OH)3 (осадок) +3NaCl Fe(OH)3 +3HNO3=Fe(NO3)3+3h3O Fe(NO3)3+6KCNS = K3[Fe(CNS)6] +3KNO3 Задание 2. Гидроксид никеля (II) — основный гидроксид Ni(OH)2 + 2HCl = NiCl2 + 2h3O Ni(OH)2 = NiO + h3O (при нагревании) Гидроксид никеля (III) — амфотерный гидроксид Ni(OH)3 + 3HCl = NiCl3 + 3h3O Ni(OH)3 + 3NaOH = Na3[Ni(OH)6] 2Ni(OH)3 = Ni2O3 + 3h3O (при нагревании) Задание 3 (1) Во все пробирки прибавить гидроксид натрия образовался синий осадок — в этой пробирке был CuCl2 образовался зеленоватый осадок, который темнеет на воздухе — в этой пробирке был FeCl2 В оставшиеся две пробирки прибавить соляную кислоту. Там, где выделился газ — был K2CO3/ В другой пробирке, где нет изменений при добавлении соляной кислоты — KCl/ Задание 3(2). Во все пробирки прилить раствор щелочи (NaOH)/ Там, где образовался бурый осадок — был FeCl3 Там, где образовался белый осадок, который растворяется в избытке щелочи — был ZnSO4. В оставшиеся две прибирки прибавить хлорную воду. Там, где раствор пожелтел был NaBr/ В оставшейся пробирке Na3PO4
Fe + h3SO4 (р) = FeSo4 +h3 FeSO4 +2NaOH =Fe(OH)2+Na2SO4 Fe(OH)2+HNO3 +2h3O FeCl3+3NaOH =Fe(OH)3 +3NaCL Fe(OH)3 +3HNO3=Fe(NO3)3+3h3O Fe(No3)3+3KNCS =Fe(CNS)3 +3KNO3 гидроксиды никеля проявляют основные свойства, след взаимодействуют с солями, кислотами (см. соединения железа) очень похоже.
touch.otvet.mail.ru
Практическая работа «Осуществление цепочки химических превращений»
Урок химии в 9 классе. «____»________________ 20____ г.
Практическая работа «Осуществление цепочки химических превращений»
Цель. Систематизировать знания учащихся о соединениях металлов.
Задачи.
Образовательные. На основании знаний о металлах и их кислородных соединений совершенствовать умения осуществлять цепочки превращений.
Развивающие. Развивать умения решать экспериментальные задачи, умения проводить лабораторные опыты, записывать уравнения химических реакций в молекулярном и ионном виде.
Воспитательные. Воспитание аккуратности при выполнении практических работ по ТБ; бережное отношение к реактивам.
Ход урока.
Орг. момент.
Выполнение практической работы. Работа выполняется в парах. Учащиеся выполняют задание 1, задание 2 (1 — по выбору учащихся)
Инструкция к выполнению
Практическая работа № 1.
«Осуществление цепочки химических превращений»
Цель. _____________________________________________________________________________.
Оборудование и реактивы: гидроксид натрия, сульфат кальция, карбонат натрия, соляная кислота, нитрат серебра, сульфат цинка, сульфат меди(),пробирки, штатив для пробирок, стеклянная палочка, воронка, фильтровальная бумага, спиртовка, пробиркодержатель, спички.
ТБ: 1) аккуратно работать с реактивами и приборами;
2) не смешивать реактивы без согласования с заданием;
3) Использовать минимальные количества реактивов.
Ход работы.
Задание 1. Проверьте свою готовность к работе – выберите верные утверждения о правилах ТБ при работе в химической лаборатории.
А) пробирки с растворами солей нельзя нагревать в пламени спиртовки;
Б) вещества в лаборатории нельзя пробовать на вкус;
В) при попадании кислоты на кожу данный участок кожи необходимо промыть водой или раствором соды;
Г) работы с растворами солей проводят только в вытяжном шкафу;
Д) чтобы погасить пламя спиртовки, следует накрыть его колпачком.
Вариант 1.
Задание 2. Опытным путем проведите цепочку превращений: CaSO4 →CaCO3 → CaCl2 →AgCl
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
Вариант 2.
Задание 2. Опытным путем проведите цепочку превращений: CuSO4→ Cu(OH)2→ CuO →Cu
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
Вариант 3.
 Задание 2. Опытным путем проведите цепочку превращений: ZnSO4 → Zn(OH)2 →ZnCl2
Задание 2. Опытным путем проведите цепочку превращений: ZnSO4 → Zn(OH)2 →ZnCl2
Na [Zn(OH)4]
Действуйте по следующему плану:
Запишите уравнения предполагаемых реакций и обменяйтесь тетрадями с соседом для проверки. (Если сомневаетесь, обратитесь к учителю.)
______________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________
Для каждого превращения составьте ионные уравнения реакций.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определите вещества, необходимые для соответствующих реакций.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Проведите необходимые опыты.
Рекомендации по осуществлению цепочек превращений.
Для проведения реакции берите твердые вещества в небольшом количестве (на кончике шпателя). Используйте также небольшие объемы (1-2 мл) растворов реактивов.
К полученному при проведении химической реакции осадку, с которым необходимо проводить превращения, добавьте 1-2 мл дистиллированной воды, перемешайте содержимое пробирки и профильтруйте. Затем промойте осадок на фильтре 2-3 раза порциями дистиллированной воды по 1-2 мл. Перенесите осадок с фильтра с помощью палочки в чистую пробирку, затем проводите следующее превращение.
Оформите отчет, заполнив таблицу.
Что делали | Наблюдения | Выводы |
xn--j1ahfl.xn--p1ai
Контрольная работа по химии 9 класс
Контрольная работа по химии за 2 полугодие в 9 классе.
Контрольная работа составлена на основании стандарта среднего (полного) общего образования по химии. Работа составлена в формате контрольной работы и состоит из4 заданий.
Представленная контрольная работа соответствует обязательному содержанию по химии в полной средней школе, охватывает материал 9 класса за 2 полугодие по темам: Неметаллы; Органические вещества.
Цель: Определение уровня овладения учащимися знаниями, умениями, навыками за 2 полугодие курса химии 9 класса.
Задачи: 1. Выявить умения: — называть изученные вещества; — определять принадлежность веществ к различным классам органических и неорганических соединений; составлять реакции ионного обмена в полном и сокращенном ионном виде; составлять электронный баланс для окислительно-восстановительных реакций.
2. Проверить знания о строении и свойствах органических соединений.
3. Выявить умение решать задачи.
4. Определить знания о генетической связи соединений, умения осуществлять цепочки превращений по изученным классам веществ.
При выполнении работы учащиеся могут пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов, а также калькулятором.
Критерии оценивания
Задание 1 – 7 баллов
Задание 2 – 10 баллов
Задание 3 – 5 баллов
Задание 4 – 3 балла
Итого -25 баллов
Оценка «5» — 23-25 баллов
Оценка «4» — 18-22 баллов
Оценка «3» — 13- 17 баллов
Оценка «2» — менее 12 баллов
Промежуточная аттестация по химии
9 класс 2 полугодие
ВАРИАНТ 1
ВАРИАНТ 2
Осуществить цепочку превращений. Дать названия полученным веществам. Для первой реакции составить электронный баланс. Для четвертой реакции составить молекулярное, полное и сокращенное ионные уравнения. (7 баллов)
Ca →CaO→Ca(OH)2→Ca(NO3)2→CaSO4
Fe→FeCl2→Fe(OH)2→FeO→FeSO4
Осуществите цепочку превращений. Дать названия полученным веществам. Любую окислительно-восстановительную реакцию уравнять методом электронного баланса. Для любой реакции ионного обмена составить молекулярное, полное и сокращенное ионные уравнения. (10 баллов)
N2 →NH3 →NO2 →HNO3 →KNO3 →O2
↓
NO2
SiO2 →Si →K2SiO3 →KNO3 →O2 →SiO2
↓
SiC
Дать характеристику соединений по плану:
Формула вещества
Класс веществ
Формула ближайшего гомолога и его название
Химические свойства , характерные для данного класса веществ (5 баллов)
2,2,3-триметилпентан
2,2,3-триметилгексен-1
Решить задачу (3 балла)
Рассчитать объем водорода (н.у.), образующегося при взаимодействии 9,2 г этилового спирта с избытком металлического натрия.
Рассчитайте объем этена (н.у.), необходимый для получения 92 г этилового спирта.
infourok.ru
