Для учащихся 8 класса — Сайт lysakovaen!
«Единственный путь, ведущий к знаниям, — это деятельность».
(Бернард Шоу)
Пусть зимний день с метелями
Мне навевает грусть.
Таблицу Менделеева
Я знаю наизусть!
Динамическая таблица Менделеева
Игра «Таблица Менделеева» — жми на картинку и играй!
Таблица с русскими и латинскими названиями химических элементов
ХЭ таблица.png
Portable Network Image Format 9.3 KB
Естественные семейства элементов
Зависимость свойств элементов от атомног
JPG Image
135. 2 KB
2 KB
Примеры составления молекулярных и структурных формул
Составление структурных формул 8 кл.gif
Graphic Interchange format 12.5 KB
Правила определения валентности
РАЗДАТОЧНЫЙ валентность 8 класс.doc
Microsoft Word Document 35.5 KBИзменение цвета индикаторов в различных средах
Изменение окраски кислотно-основных инди
Microsoft Word Document
39. 5 KB
5 KB
Таблица растворимости
Таблица растворимости солей, кислот и ос
Microsoft Word Document 43.0 KB
Важнейшие классы неорганических соединений
Опорный конспект Классы неорган соед.doc
Microsoft Word Document 92.5 KB
Таблица с названиями кислот и их кислотных остатков
кислоты и остатки.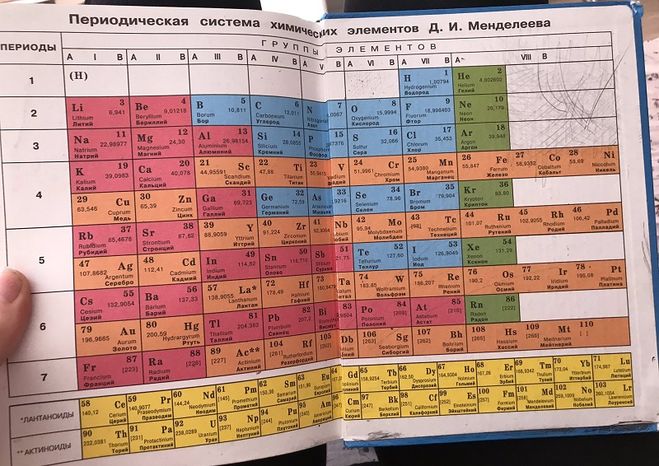 doc
doc
Microsoft Word Document 59.0 KB
Оксиды и соответствующие им гидроксидыРаздаточный ОКСИДЫ 8 класс.doc
Microsoft Word Document 87.0 KB
Опорная схема Генетическая связь между классами неорганических соединений
Генетическая связь.jpg
JPG Image 110.5 KB
Опорная схема «Оксиды»
ОС Оксиды 8 кл.
Microsoft Word Document 88.0 KB
Опорная схема «Основания»
ОС Основания 8 кл.docx
Microsoft Word Document 76.5 KB
Опорная схема «Кислоты»
ОС Кислоты 8 кл.docx
Microsoft Word Document 60.1 KB
Определение степеней окисления
1. png
png
Portable Network Image Format 431.7 KB
Составление формул по с/о
2.png
Portable Network Image Format 383.1 KB
Опорная схема «П/гр Азота»
Microsoft Word Document 81.8 KB
Опорная схема «Азот»
ОС Азот простое вещество.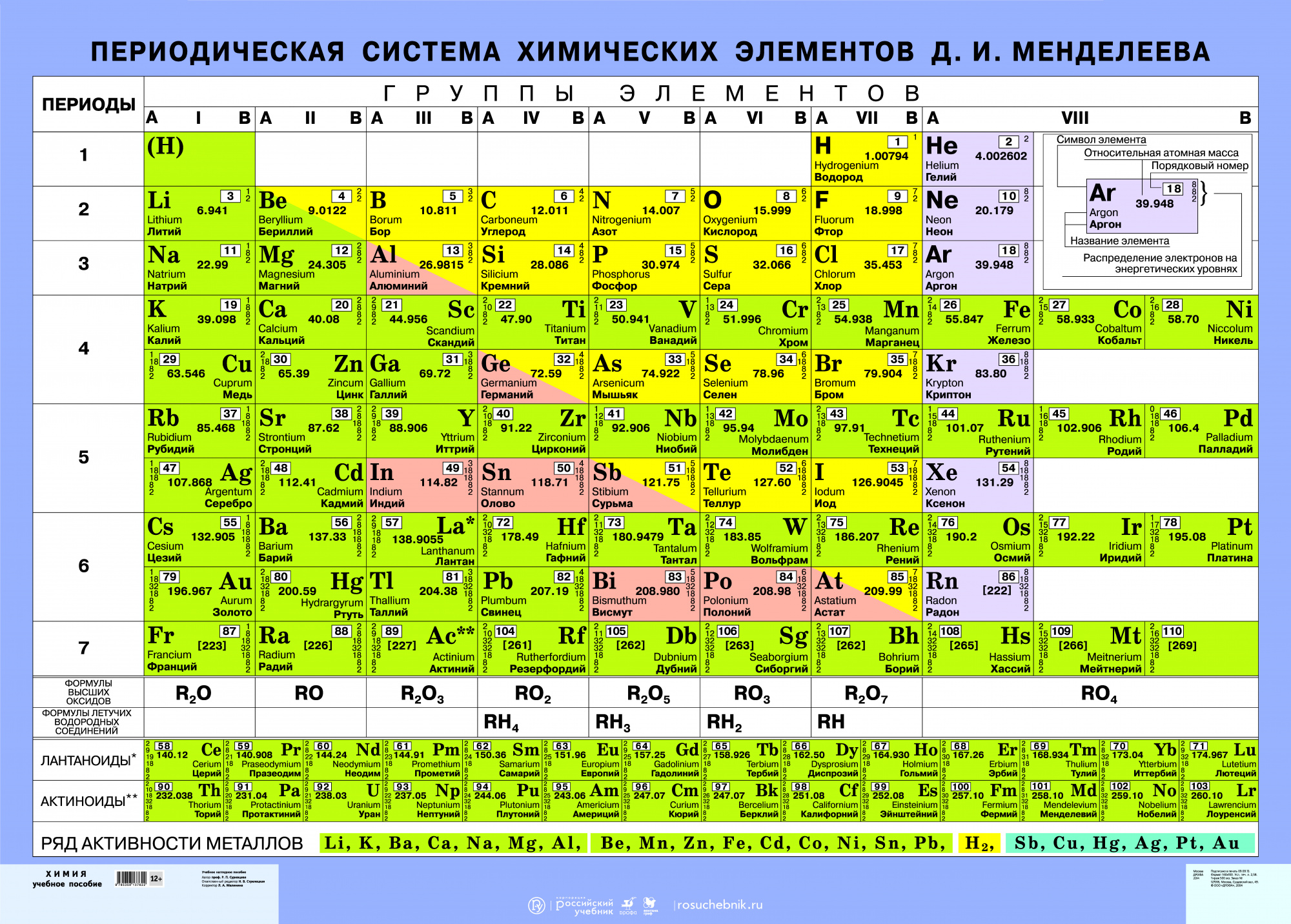 docx
docx
Microsoft Word Document 62.9 KB
Опорная схема «Аммиак»
ОС Аммиак.docx
Microsoft Word Document 51.2 KB
ЭХ ряд активности металлов, таблица и закономерности
ПАМЯТКА ЭХ ряд Ме.doc
Microsoft Word Document 74.0 KB
ОЭО
Относительные электроотрицательности эле
Microsoft Word Document
43. 5 KB
5 KB
доп мат-л по Ме.doc
Microsoft Word Document 2.0 MB
Тривиальные названия некоторых веществ
Кислоты и их кислотные остатки
Экзамен по химии за 10 класс
Экзамен ХИМИЯ за 10 класс.doc
Microsoft Word Document 58.5 KB
ВАЖНЕЙШИЕ альфа АМИНОКИСЛОТЫ. doc
doc
Онлайн тест для учащихся 10 и 11 класса
Интерактивный мультимедиа учебник по органической химии
Химия в таблицах и схемах 1
Хим в табл и сх1.zip
Compressed Archive in ZIP Format 1.3 MB
Химия в таблицах и схемах 2
Хим в табл и сх2.zip
Compressed Archive in ZIP Format
1.
Химия в таблицах и схемах
Хим в табл и сх1.zip
Compressed Archive in ZIP Format 1.3 MB
Краткая характеристика самостоятельных работ учащихся
Виды самостоятельных работ.docx
Microsoft Word Document 13.0 KB
Требования к оформлению реферата
Требования к оформлению реферата. doc
doc
Microsoft Word Document 40.5 KB
Требования к оформлению презентаций
Требования к презентациям.doc
Microsoft Word Document 235.0 KB
Презентация по химии на тему: «Периодический закон Д.И.Менделеева. Периодическая таблица химических элементов» (8 класс) | Презентация к уроку по химии (8 класс):
Слайд 1
Периодическая система Д.И. МенделееваСлайд 2
Д.И.Менделеев
Слайд 3
Каждый химический элемент занимает определенное место в таблице (клетку), где приведены его характеристики
Слайд 4
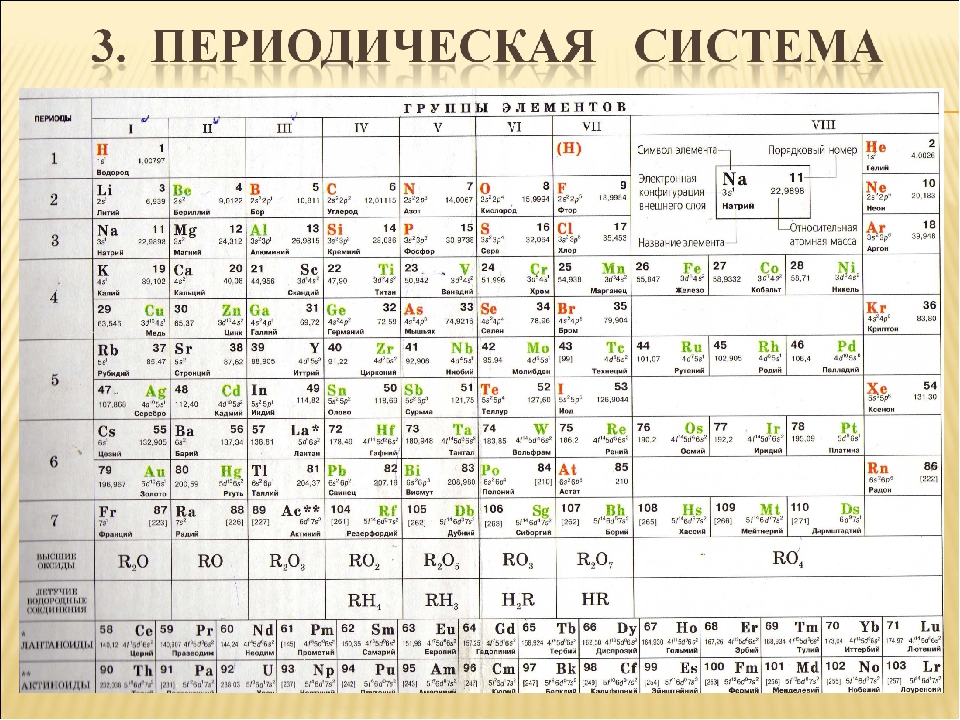
Период Горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов Номер периода показывает число занятых электронами энергетических уровней Каждый период начинается элементом, атомы которого образуют активные металлы и заканчивается элементом, атомы которого образуют благородные газы
Слайд 5
Периоды Малые Большие
Слайд 7
Группы Это вертикальный столбец элементов, атомы которых имеют одинаковое количество валентных электронов. Номер группы показывает число валентных электронов в атомах О 2е, 6е ; S 2e,8e, 6e 8 32
Слайд 8
Группа (А) Главная подгруппа (В) Побочная подгруппа
Слайд 9
Задание 1 1. назовите химические элементы который находится в четвертом периоде, во второй группе, главной подгруппе
Слайд 10
Задание 2 Атомы химического элемента имеет электронную конфигурацию 2е,8е,4е. Назовите положение элемента в ПС
Слайд 11
Задание 3 Охарактеризуйте элемент № 16 Положение в ПС Строение атома Схема строения атома
Слайд 12
Как изменяются свойства атомов химических элементов в группах и в периодах Периодической системы?
Слайд 13
В периоде
Слайд 14
В периодах слева направо: Заряд ядер атомов увеличивается; число занятых электронами энергетических уровней в атомах не изменяется; число электронов на внешнем энергетическом уровне атомов (валентных) увеличивается от 1 до 8; радиус атомов уменьшается; прочность связи электронов внешнего уровня (валент ных) с ядром увеличивается ; металлические свойства атомов элементов убывают ; неметаллические свойства атомов элементов усиливаются. Начало каждого периода совпадает с началом заполнения нового электронного слоя. Каждый период начинается элементом, атомы которого образуют вещество — металл, а заканчивается элементом, атомы которого образуют вещество — благородный газ. В периоде
Слайд 15
В группе (А)
Слайд 16
В главных подгруппах сверху вниз: заряд ядер атомов возрастает; число занятых электронами энергетических уровней увеличивается; радиус атомов растёт; число электронов на внешнем уровне не изменяется, оно равно номеру группы; 5. прочность связи электронов внешнего уровня с ядром уменьшается ; 6. металлические свойства атомов элементов усиливаются ; 7. неметаллические свойства атомов элементов ослабевают . В группе (А)
Слайд 17
Расположите перечисленные химические элементы в порядке возрастания металлических свойств атомов: Натрий, рубидий , калий
Слайд 18
Расположите перечисленные химические элементы в порядке возрастания неметаллических свойств атомов: мышьяк, бром, селен
Слайд 19
Домашнее задание § 35, 36 в. 4-5 стр. 122 в. 1-4 стр. 125
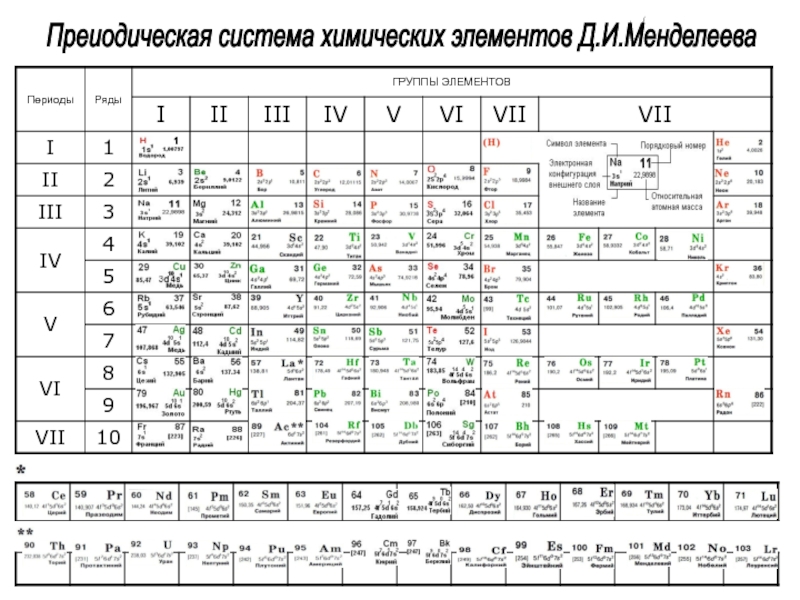
| Периоды | Группы элементов | |||||||||||||
| I | II | III | IV | V | VI | VII | VIII | |||||||
| 1 | ||||||||||||||
| 2 |
4 Be Бериллий 9,012 |
6 C Углерод 12,011 |
8 O Кислород 15,999 |
|||||||||||
| 3 |
11 Na Натрий 22,989 |
12 Mg Магний 24,305 |
13 Al Алюминий 26,982 |
14 Si Кремний 28,086 |
||||||||||
| 4 |
20 Ca Кальций 40,078 |
21 Sc Скандий 44,956 |
23 V Ванадий 50,942 |
25 Mn Марганец 54,938 |
26 Fe Железо 55,847 |
27 Co Кобальт 58,933 |
||||||||
|
32 Ge Германий 72,59 |
36 Kr Криптон 83,80 |
|||||||||||||
| 5 |
37 Rb Рубидий 85,47 |
38 Sr Стронций 87,62 |
40 Zr Цирконий 91,22 |
41 Nb Ниобий 92,906 |
42 Mo Молибден 95,94 |
43 Tc Технеций 97,91 |
44 Ru Рутений 101,07 |
46 Pd Палладий 106,4 |
||||||
|
47 Ag Серебро 107,868 |
48 Cd Кадмий 112,40 |
51 Sb Сурьма 121,75 |
52 Te Теллур 127,60 |
54 Xe Ксенон 131,30 |
||||||||||
| 6 |
57 La* Лантан 138,906 |
72 Hf Гафний 178,49 |
73 Ta Тантал 180,948 |
74 W Вольфрам 183,85 |
77 Ir Иридий 192,22 |
78 Pt Платина 195,08 |
||||||||
|
79 Au Золото 196,967 |
81 Tl Таллий 204,383 |
83 Bi Висмут 280,980 |
84 Po Полоний 208,982 |
|||||||||||
| 7 |
87 Fr Франций 222,019 |
89 Ac^ Актиний 227,028 |
105 Db Дубний [262] |
106 Sg Сиборгий [263] |
109 Mt Мейтнерий [266] |
|||||||||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||||||
| Водородные соед. | RH4 | RH3 | H2R | HR | ||||||||||
| *Лантаноиды |
59 Pr Празеодим 140,908 |
60 Nd Неодим 144,24 |
61 Pm Прометий 144,913 |
62 Sm Самарий 150,36 |
63 Eu Европий 151,96 |
64 Gd Гадолиний 157,25 |
65 Tb Тербий 158,925 |
66 Dy Диспрозий 162,50 |
67 Ho Гольмий 164,930 |
70 Yb Иттербий 173,04 |
71 Lu Лютеций 174,967 |
|||
| ^Актиноиды |
91 Pa Протактиний 231,036 |
93 Np Нептуний 237,049 |
94 Pu Плутоний 244,064 |
95 Am Америций 243,061 |
97 Bk Берклий 247,070 |
98 Cf Калифорний 251,080 |
99 Es Эйнштейний 252,083 |
100 Fm Фермий 257,095 |
101 Md Менделевий 258,099 |
102 No Нобелий [259] |
103 Lr Лоуренсий [260] |
|||
Периодическая таблица — параграф 51 ГДЗ химия 8 Рудзитис
1. Охарактеризуйте строение периодической таблицы элементов.
Периодическая таблица в графической форме выражает суть периодического закона Д. И. Менделеева.
Периодическая таблица состоит из 7 периодов (горизонтальных рядов), каждый из которых начинается с щелочного металла (кроме I периода, который начинается с водорода), а заканчивается благородным газом (кроме VII незавершенного периода). Выделяют 3 малых периода (I, II, III) и 4 больших периода (IV — VII), которые отличаются наличием побочных подгрупп.
Каждый период разделен на группы — вертикальные столбцы. Всего существует 18 групп. Группы условно объединяют в основные (А-группы) и побочные (Б-группы) подгруппы.
Из-за существования побочных подгрупп существуют разные варианты изображения периодической таблицы: короткая — из 8 групп (побочные подгруппы вынесены отдельно), полудлинная — из 18 групп (между IIА-группой и IIIА-группой размещены 10 элементов Б-подгруппы) и длинная — из 32 групп (все элементы вписаны в периоды).
2. Что называют периодом? Что общего между малыми и большими периодами? В чем состоит отличие?
Период — строка периодической таблицы. Период начинается с щелочного металла (кроме I периода) и заканчивается благородным газом (для VII периода пока не открыт). Внутри периода слева направо происходит усиление неметаллических свойств. Это то, что является общим для всех периодов. Отличием является наличие в больших периодах побочных подгрупп.
3. Как изменяются свойства химических элементов: а) в периодах; б) в А-группах?
а) Внутри периода слева направо усиливаются неметаллические свойства и ослабевают металлические. Кроме того, в малых периодах валентность элементов в соединениях с кислородом возрастает от 1 до 7.
б) В А-группах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
4. Чем полудлинный вариант периодической таблицы отличается от классического (короткого) варианта?
Короткий вариант таблицы состоит из 8 групп (побочные подгруппы вынесены отдельно), полудлинный вариант таблицы — из 18 групп (между IIА-группой и IIIА-группой размещены 10 элементов Б-подгруппы).
Тестовые задания
1. Формула летучего водородного соединения химического элемента H3R. В периодической таблице этот элемент находится1) в III группе 3) в VII группе 2) в V группе 4) в IV группе
Валентность III в соединениях с водородом характерна как для III-группы, так и для V-группы. Однако летучие соединения характерны только для V группы.
Ответ: 2) в V группе
2. Установите соответствие между номером периода и числом элементов в периоде1) 1-й период А. 18 2) 2-й и 3-й периоды Б. 32 3) 4-й и 5-й периоды В. 2 4) 6-й период Г. 8
Ответы: 1 — В, 2 — Г, 3 — А, 4 — Б.
Презентация по химии на тему «Периодическая система Д.И.Менделеева » (8 класс)
Инфоурок › Химия ›Презентации›Презентация по химии на тему «Периодическая система Д.И.Менделеева » (8 класс)Скрыть
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:Периодическая система Д.И. Менделеева 8 класс учитель Серегина Е.Н.
2 слайд Описание слайда:Д.И.Менделеев
3 слайд Описание слайда:Каждый химический элемент занимает определенное место в таблице (клетку), где приведены его характеристики
4 слайд Описание слайда:Период Горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов Номер периода показывает число занятых электронами энергетических уровней Каждый период начинается элементом, атомы которого образуют активные металлы и заканчивается элементом, атомы которого образуют благородные газы
5 слайд Описание слайда:Периоды Малые Большие
6 слайд Описание слайда: 7 слайд Описание слайда:Группы Это вертикальный столбец элементов, атомы которых имеют одинаковое количество валентных электронов. Номер группы показывает число валентных электронов в атомах О 2е, 6е; S 2e,8e,6e 8 32
8 слайд Описание слайда:Группа (А) Главная подгруппа (В) Побочная подгруппа
9 слайд Описание слайда:Задание 1 1. назовите химические элементы который находится в четвертом периоде, во второй группе, главной подгруппе
10 слайд Описание слайда:Задание 2 Атомы химического элемента имеет электронную конфигурацию 2е,8е,4е. Назовите положение элемента в ПС
11 слайд Описание слайда:Задание 3 Охарактеризуйте элемент № 16 Положение в ПС Строение атома Схема строения атома
12 слайд Описание слайда:Как изменяются свойства атомов химических элементов в группах и в периодах Периодической системы?
13 слайд Описание слайда:В периоде
14 слайд Описание слайда:В периодах слева направо: Заряд ядер атомов увеличивается; число занятых электронами энергетических уровней в атомах не изменяется; число электронов на внешнем энергетическом уровне атомов (валентных) увеличивается от 1 до 8; радиус атомов уменьшается; прочность связи электронов внешнего уровня (валент ных) с ядром увеличивается; металлические свойства атомов элементов убывают; неметаллические свойства атомов элементов усиливаются. Начало каждого периода совпадает с началом заполнения нового электронного слоя. Каждый период начинается элементом, атомы которого образуют вещество — металл, а заканчивается элементом, атомы которого образуют вещество — благородный газ. В периоде
15 слайд Описание слайда:В группе (А)
16 слайд Описание слайда:В главных подгруппах сверху вниз: заряд ядер атомов возрастает; число занятых электронами энергетических уровней увеличивается; радиус атомов растёт; число электронов на внешнем уровне не изменяется, оно равно номеру группы; 5. прочность связи электронов внешнего уровня с ядром уменьшается; 6. металлические свойства атомов элементов усиливаются; 7. неметаллические свойства атомов элементов ослабевают. В группе (А)
17 слайд Описание слайда:Расположите перечисленные химические элементы в порядке возрастания металлических свойств атомов: Натрий, рубидий , калий
18 слайд Описание слайда:Расположите перечисленные химические элементы в порядке возрастания неметаллических свойств атомов: мышьяк, бром, селен
19 слайд Описание слайда:Домашнее задание § 8 в. 2-4, упр. 1,5,6 § 9 упр 1,2
Курс повышения квалификации
Курс профессиональной переподготовки
Учитель биологии и химии
Курс профессиональной переподготовки
Учитель химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВнеурочная деятельностьВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:
Общая информация
Номер материала: ДВ-031272
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
Периодические таблицы для печати бесплатно (PDF и PNG)
Периодические таблицы для печати являются важным инструментом для химии и других наук.Печатная таблица Менделеева — важный инструмент для студентов и химиков. Вы можете разместить его там, где вам нужно, при решении проблем, пометить его и распечатать новый, когда захотите. Это коллекция бесплатных распечатываемых периодических таблиц в формате PDF или PNG для сохранения, печати и использования. В этих периодических таблицах используются точные данные для названия, атомного номера, символа элемента, атомного веса и электронной конфигурации, полученные от Международного союза чистой и прикладной химии или IUPAC.
Мы сделали список таблиц вместе со ссылками, чтобы вы могли получить подробную информацию о каждой из них. Периодические таблицы HD являются отличными хранителями экрана или справочными таблицами на мобильных устройствах. Их размер соответствует размеру листа бумаги, и вам не нужно беспокоиться о том, чтобы пометить их, потому что вы всегда можете распечатать больше для выполнения домашних заданий или выполнения лабораторных расчетов. Таблицы точно меняют размер, поэтому вы можете просматривать или распечатывать их с любым размером и соотношением сторон, от крошечного до размера плаката.
Чтобы загрузить таблицу, щелкните изображение, щелкните правой кнопкой мыши и сохраните или используйте предоставленные ссылки для загрузки изображений или PDF (если они доступны).
118 Element Muted Color Printable Color Printable Periodic Table
Это наша самая популярная таблица Менделеева для цветной печати. У него есть номер каждого элемента, символ, имя и атомная масса. Эту таблицу Менделеева мы рекомендуем использовать для расчетов и выполнения домашних заданий.
Ссылки для скачивания: Изображение | PDF
Яркая периодическая таблица с 118 элементами
Эта периодическая таблица с 118 элементами представляет собой HD-обои с разрешением 1920 × 1080. Он имеет нашу любимую цветовую схему из всех созданных нами столов.Он включает имена элементов, символы, группы, атомные номера и атомные массы. Это наша любимая цветовая схема.
Ссылки для скачивания: Изображение (белый фон) | Изображение (черный фон)
Цветная рамка Периодическая таблица для печати
Периодическая таблица элементов — 118 элементов Стандартный атомный вес ИЮПАК В этой печатной периодической таблице приведены стандартные значения атомной массы ИЮПАК. Это точная актуальная таблица для расчетов и домашних заданий. Поскольку окрашены только границы плиток элементов, таблицу легко читать и относить к картриджам с тонером.
Ссылки для скачивания: Изображение | PDF
Таблица Менделеева с начислениями
Эта черно-белая печатная таблица Менделеева специально разработана для средних и старших классов. Он включает электронные конфигурации, степени окисления, группы, периоды и многое другое.
Ссылки для скачивания: Изображение | PDF
Таблица Менделеева для детей
Эта таблица Менделеева из 118 элементов для печати идеально подходит для детей или тех, кто хочет получить четкую диаграмму с атомными весами, округленными до обычных двух десятичных знаков.С домашним заданием это намного проще!
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Цветная периодическая таблица
В этой периодической таблице есть названия и символы всех 118 элементов. О, и он также гигантский, так что вы можете покрыть им стену, если хотите.
Ссылки для скачивания: Изображение | PDF
Цветная таблица Менделеева
Эта цветная таблица Менделеева ярко окрашена и оптимизирована для размещения на одном листе бумаги.Наряду с обычной информацией в нем есть квадрат легенды и пронумерованные столбцы, а также фамилии, рекомендованные IUPAC.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица туманности Киля
Эта периодическая таблица доступна в качестве плаката с туманностью Киля (фотография сделана космическим телескопом Хаббла).
Ссылка для скачивания: Изображение
Черно-белая таблица Менделеева
Это ваша бесплатная черно-белая печатная таблица Менделеева, содержащая факты и цифры.Это периодическая таблица с именами, символами элементов, атомными номерами, атомными весами и группами. Значимые цифры Международного союза теоретической и прикладной химии (IUPAC) указаны для атомных масс (принятое единственное значение, а не диапазон атомных масс). Эта диаграмма идеальна, если у вас есть черно-белый принтер или вы просто хотите попрактиковаться в раскрашивании групп элементов самостоятельно.
Ссылки для скачивания: Изображение | PDF
Пустая таблица Менделеева
Заполните пропуски в этой печатной таблице Менделеева, указав символы элементов, группы или все, что вы пытаетесь изучить.Вы можете получить пустую таблицу в виде файла изображения или PDF-файла, чтобы вы могли сохранить ее и распечатать столько копий, сколько вам нужно. Он меняет размеры в соответствии с вашими потребностями. Зигзагообразная линия отделяет металлы от неметаллов. Для вашего удобства указаны номера групп и периодов.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица электроотрицательности
Эта бесплатная периодическая таблица имеет цветовую кодировку для обозначения электроотрицательности атома элемента.Электроотрицательность — это тенденция, которая естественным образом проявляется в периодической таблице Менделеева, но, как видите, это не постоянная тенденция. Используйте таблицу для написания названий соединений и прогнозирования химических реакций. Также интересно посмотреть, где элементы отклоняются от периодичности. Эта печатная таблица Менделеева также содержит основные факты, необходимые для общих вычислений.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица зарядов элементов
В этой таблице для печати перечислены наиболее распространенные заряды или состояния окисления, переносимые атомами каждого элемента.Он содержит основные факты, так что вы можете использовать его как стандартную таблицу Менделеева.
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Периодическая таблица атомных радиусов
Эта цветная периодическая таблица показывает относительные размеры каждого атома. Диаметр каждого атома масштабируется относительно самого большого атома элемента: цезия.Это забавная таблица, которую можно использовать, когда вы рассматриваете тенденции в периодической таблице, потому что она показывает, как на самом деле уменьшается атомный радиус по мере того, как вы перемещаетесь через период, даже если атомы набирают большую массу. Тенденция размера соответствует цветам радуги
Ссылка для скачивания: Изображение | PDF
Периодическая таблица открытия элементов
Когда элементы были обнаружены (периодическая таблица). Каждая ячейка элемента этой таблицы указывает год, в котором этот элемент был обнаружен.Раскраска плиток группирует элементы в соответствии с периодом времени их обнаружения. Посмотрите, сможете ли вы заметить первый искусственный элемент. Подсказка: символ элемента начинается с буквы «Т».
Ссылка для скачивания: Изображение
Периодическая таблица с электронными оболочками
Устали выяснять электронные конфигурации или просто хотите проверить свою работу? Эта таблица для печати показывает название элемента, символ, номер, группу, а также заполнение электронных оболочек.Это одна из самых полных периодических таблиц на сайте.
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Белое на черном Ссылки для скачивания: Изображение | PDF
Периодическая таблица плотности
Каждая ячейка элемента содержит полосу, которая показывает плотность элемента относительно осмия, самого плотного элемента.Состояние вещества, группа, период, название элемента, атомный номер элемента и атомная масса также указаны на этой красочной таблице.
Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Содержание элементов в морской воде
В этой таблице Менделеева из 118 элементов указано среднее содержание каждого химического элемента в морской воде Земли.
Ссылки для скачивания: Изображение | PDF
Изобилие элементов в земной коре
Посмотрите относительное изобилие элементов с помощью этой печатной таблицы Менделеева из 118 элементов.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица температур плавления
Эта ярко окрашенная таблица Менделеева содержит точки плавления элементов. Обычно эти значения приводятся в STP, поэтому, если вы используете другую температуру или давление, ожидайте некоторого отклонения от значения. В основном это руководство, которое помогает проиллюстрировать тенденции в периодической таблице Менделеева.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица точек кипения
Эта красочная периодическая таблица содержит точки кипения каждого элемента.Конечно, температура кипения зависит от атмосферного давления. Обозначения показывают, находится ли значение на уровне моря или нет.
Ссылки для скачивания: Изображение | PDF
Электронная орбитальная периодическая таблица
Периодическая таблица для печати организована в соответствии с внешней электронной оболочкой или электронными орбиталями. Эта таблица делает тенденцию очевидной и подчеркивает, почему таблица имеет знакомую нам форму.
Ссылка для скачивания: Изображение
Металлы, металлоиды и неметаллы Периодические таблицы
Это собрание периодических таблиц для печати, в которых показаны металлы, металлоиды (полуметаллы) и неметаллы, а также свойства этих важных группы элементов.Также перечислены свойства этих групп элементов.
Металлы, металлоиды, неметаллы Таблица [ Изображение ]
Таблица металлов (и список металлов) [ Изображение ]
Таблица металлоидов (и список) [ Изображение ]
Таблица неметаллов (и список) [ Изображение ]
Периодическая таблица круговых плиток
Кто сказал, что плитки элементов должны быть квадратами или прямоугольниками? Вот модная таблица Менделеева, сделанная из круглых плиток.Не волнуйтесь — все обычные факты и цифры сохранились. Плитки элементов содержат символ элемента, имя, атомный номер и атомную массу. Немного перемешайте. Мыслите нестандартно.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица со всем остальным
Это наша самая полная таблица Менделеева. Эта диаграмма содержит всю информацию, которую вы можете захотеть из печатной таблицы Менделеева, включая символы элементов, имена, атомные номера, атомные массы, электронные оболочки, периоды, группы, состояние вещества и многое другое.Эта таблица особенно удобна для просмотра на мониторе, потому что вы можете увеличить масштаб, чтобы просмотреть основные факты.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица без имен
На этой диаграмме показаны символы элементов, атомные номера и атомные веса, но не перечислены имена элементов. Вы можете использовать его, чтобы научиться связывать имена и символы, например, для викторин и т.п. Цветная версия таблицы включает группы элементов и ключ, в то время как черно-белая версия опускает группы, поэтому вы можете их изучить или раскрасить.
Color Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Периодические таблицы на иностранных языках
Японские периодические таблицыЭто собрание периодических таблиц на языках, отличных от английского.
Как пользоваться периодической таблицей
Научитесь читать периодическую таблицу. Теперь у вас есть таблица Менделеева. Вы уверены, что знаете, как ею пользоваться? Вот информация, которую вы можете найти в типичной таблице Менделеева, и способы ее использования для ответа на вопросы об элементах.
Ячейки элементов периодической таблицы
Это набор ячеек отдельных элементов, которые можно сохранить и распечатать. Отдельные ячейки элементов поставляются в виде файлов PNG. Вы также можете загрузить всю коллекцию элементов в виде файла PDF. Доступно несколько цветовых вариаций, в том числе черно-белый набор плиток.
Инструкции по печати периодических таблиц для печати
Вы можете либо распечатать файл изображения высокой четкости (PNG), либо открыть и распечатать файлы PDF.Разложить изображение на несколько страниц и сделать большой настенный плакат очень просто. Мы рекомендуем вам распечатать файлы PDF, потому что они созданы для этой цели!
Особые запросы
Хотите увидеть другую цветовую схему, периодическую таблицу на другом языке, периодическую таблицу для определенного праздника или группы элементов, назначенные по-другому? Дайте нам знать, и мы составим для вас столик!
Печатные периодические таблицы Условия использования
Пожалуйста, распечатайте эти таблицы для личного использования и для раздачи студентам.Вы можете разместить их в своем классе, лаборатории, кухне и т. Д. И отображать их на своем телефоне и компьютере. Вы не можете копировать и размещать периодические таблицы на своем веб-сайте. Вы не можете продавать их или адаптировать для продажи.
Если вы хотите использовать периодическую таблицу (или любое изображение) с сайта для печатной публикации или видео, свяжитесь с нами, чтобы мы могли дать письменное разрешение издателю.
| 7 | 87 223.02 Франций | 88 226,03 Радий | ** | 103 262,11 Лоуренсий | 104 267,12 Резерфордий | 105 270.13 Дубний | 106 269,13 Сиборгий | 107 270,13 Бориум | 108 269,13 Калий | 109 278,16 Мейтнерий | 110 281.17 Дармштадтиум | 111 281,17 Рентгений | 112 285,18 Copernicium | 113 286,18 Нихоний | 114 289.19 Флеровий | 115 289,20 Московий | 116 293,20 Ливерморий | 117 293,21 Теннессин | 118 294.21 Оганессон | ** Актиноиды | ** | 89 227,03 Актиний | 90 232,04 Торий | 91 231,04 Протактиний | 92 238.03 Уран | 93 237,05 Нептуний | 94 244,06 Плутоний | 95 243,06 Америций | 96 247.07 Кюрий | 97 247.07 Беркелиум | 98 251,08 Калифорний | 99 252,08 Эйнштейний | 100 257,10 Фермий | 101 258.10 Менделевий | 102 259,10 Нобелий |
|---|
Периодическая таблица элементов (с печатными формами)
Что такое Периодическая таблица
Таблица, в которой все существующие элементы выстроены в ряды в порядке их атомных номеров, называется периодической таблицей. Сходные атомные номера означают, что элементы имеют похожую атомную структуру и, следовательно, схожие химические свойства.Строки называются точками, а столбцы — группами.
Обычно каждая строка или точка имеют металлические элементы слева, а неметаллы — справа. Шесть групп пронумерованы, причем элементы также имеют свои собственные названия групп, например, щелочные металлы входят в группу 1, галогены — в группу 17, а благородные газы — в группу 18.
Водород — первый элемент в периодической таблице, обладающий большим сходством свойств как со щелочными металлами, так и с галогенами.Из-за этого его иногда помещают отдельно в таблицу. Однако в большинстве случаев он размещается над группой щелочного металла, будучи включенным просто в группу неметалла вместе с такими элементами, как углерод, азот и кислород.
Периодическая таблица Менделеева была впервые разработана и опубликована русским химиком Дмитрием Менделеевым в 1869 году. С тех пор она была расширена с открытием новых металлов, при этом таблица остается чрезвычайно полезной в области химии, а также в других областях науки.
Периодическая таблица элементов
Лантаноиды (атомные номера от 57 до 71) и актиниды (с атомными номерами от 89 до 103) находятся в отдельных строках периодической таблицы. Причину этого можно сформулировать просто: если оставить их в основной таблице, таблица Менделеева станет слишком широкой.
Периодическая таблица для печати с атомной массой и валентностью
JPG Скачать | Загрузить PDF
Здесь все 118 элементов сгруппированы и имеют цветовую кодировку в соответствии с тем, к какому семейству они принадлежат.Символ, атомный номер, атомная масса и валентность каждого элемента указаны в соответствующих квадратах. Файл доступен в форматах JPG и PDF для автономной печати. Не забудьте установить флажок «Подогнать изображение к рамке», чтобы получить правильную распечатку.
Периодическая таблица
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств. Это выражается законом периодичности.»Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. «У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается при переходе от одного элемента к другому. Эта величина может быть только зарядом центрального положительного ядра, существование которого у нас уже есть определенное доказательство ».
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером.Химия — это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. »
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Электронные оболочки
Атом лития имеет два электрона, вращающихся на внутренней оболочке, и только один электрон, вращающийся на его внешней оболочке. Внешняя оболочка неполная, а значит, нестабильная. Атомы Li легко отдают один электрон с образованием положительно заряженных ионов Li + .Эти ионы имеют ту же стабильную электронную конфигурацию, что и благородный газ гелий.
Все атомы группы 1 могут потерять один электрон с образованием положительно заряженных ионов. Например, атомы калия делают это, чтобы образовать ионы с одним и тем же электроном. конфигурация как благородный газ аргон.
Атомы группы 2 теряют два электрона, образуя положительно заряженные ионы. Например, атомы магния образуют ионы Mg 2+ . Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Большинство элементов в группе 3 теряют три электрона с образованием ионов 3+.Однако бор мало склонен к образованию ионов. Он получает структуру благородного газа, разделяя электроны с другими атомами. Это называется ковалентным связыванием.
Элементам групп 15, 16 и 17 легче получить электроны, чем потерять их. Например, атомы кислорода получают два электрона с образованием ионов O 2-. Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Элементы в группе 14 могут потерять четыре или получить четыре электрона для получения структуры благородного газа.Фактически, если они собираются образовывать ионы, элементы группы 14 образуют положительные ионы. Углерод и кремний образуют ковалентные связи. Все миллионы органических соединений углерода основаны на общих электронах в ковалентных связях.
Многие элементы могут образовывать ковалентные связи в зависимости от обстоятельств. Например, связывание в воде H 2 0 в основном ковалентно; и в то время как хлор ионно связан с натрием в хлориде натрия, он связывается с углеродом ковалентно в четыреххлористом углероде.
Автор: Dr.Дуг Стюарт
Периодическая таблица, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1. Более высокий атомный вес, чем тот, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Менделеев понял, что стол перед ним лежит в самом сердце химии.Более того, Менделеев увидел, что его таблица неполная — были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент эка-кремний , после наблюдения зазора в периодической таблице между кремнием и оловом:
Аналогичным образом Менделеев открыл галлий ( eka -алюминий) и скандий ( eka -bor) на бумаге, потому что он предсказал их существование и их свойства еще до их фактических открытий.
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было совершенно разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт — это произошло 27 лет спустя, в 1896 году.
Фактически, потребовалось 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева.
Объяснение найдено
Объяснение было дано в 1913 году Генри Мозли, который стрелял электронами по атомам, что привело к испусканию рентгеновских лучей. Мозли обнаружил, что каждый элемент, который он изучал, излучает рентгеновские лучи с уникальной частотой.
Когда он посмотрел на частоты, излучаемые рядом элементов, он обнаружил закономерность, которая лучше всего объяснялась, если положительный заряд в ядре увеличивался ровно на одну единицу от элемента к элементу.
График, обобщающий результаты Мозли
Другими словами, Мозли обнаружил, что элементы отличаются друг от друга, потому что их атомы имеют разное количество протонов.Он обнаружил, что положение элементов в периодической таблице лучше предсказывается их атомным номером , чем их атомным весом. (Атомный номер элемента равен количеству протонов и, следовательно, электронов в одном из его атомов.)
Открытие Мозли прояснило проблемы кобальт-никелевого и аргонно-калиевого.
При рассмотрении проблемы аргона и калия было известно, что аргон имеет более высокий атомный вес, чем калий. Согласно рассуждению Менделеева, аргон следует поместить после калия в периодической таблице.Но делать это не имело смысла с точки зрения химических свойств.
Работа Мозли показала, что атомный номер аргона равен 18, а калия — 19. Поэтому аргон следует поставить перед калием в периодической таблице на основе атомных номеров. Химики всего мира вздохнули с облегчением, потому что это согласуется с наблюдаемыми химическими свойствами этих элементов.
Мозли также подражал достижению Менделеева открытия новых элементов на бумаге, обнаружив четыре атомных номера без совпадающих элементов.Он предсказал существование элементов с атомными номерами 43, 61, 72 и 75. Эти элементы действительно были обнаружены; мы теперь называем их технецием, прометием, гафнием и рением.
Сегодня химические элементы по-прежнему расположены в порядке возрастания атомного номера (Z), если смотреть на периодическую таблицу слева направо. Мы называем горизонтальные ряды периодами . Например, вот Период 4:
.Мы называем вертикальные ряды группами .
Например, вот группа 2:
Теперь мы также знаем, что химический состав элемента определяется тем, как расположены его электроны — его электронная конфигурация .
Электроны в атомах можно представить как занимающие слои или оболочки, окружающие атомное ядро. Это показано на схеме атома лития в левой части этой страницы. Мы представляем электроны как маленькие планеты, вращающиеся вокруг солнечного ядра, в котором расположены протоны и нейтроны. Это называется боровским представлением атома. На самом деле это приблизительное значение, но это хорошая отправная точка для понимания химических свойств элементов.
Если мы исключим элементы переходных металлов, мы можем сказать, что атомы, которые занимают одну и ту же группу периодической таблицы, имеют одинаковое количество внешних электронов.Например, все элементы в группе 2, показанные слева, имеют два внешних электрона.
Эти внешние электроны называются валентными электронами .
Валентные электроны
Именно валентные электроны вызывают химическую реактивность.
Все элементы в группе 1 имеют один валентный электрон; Группа 2 — два валентных электрона; Группа 13 — три валентных электрона; Группа 14 — четыре валентных электрона; Группа 15 — пять валентных электронов; Группа 16 — шесть валентных электронов; Группа 17, семь валентных электронов; и Группа 18 — восемь валентных электронов, кроме гелия, у которого их два.
Группа 18 — это группа инертных газов, группа инертных элементов. Нежелание благородных газов вступать в химическую реакцию является ключом, который открывает нам понимание того, почему другие элементы действительно реагируют.
Инертные частицы: если атом имеет электронную конфигурацию благородного газа, он будет химически неактивным или будет реагировать с трудом. Реактивные частицы: если атом не имеет той же электронной конфигурации, что и благородный газ, он будет иметь тенденцию реагировать, чтобы достичь этого.
Благородные газы неактивны, потому что их внешние электронные оболочки заполнены. Полная оболочка внешних электронов — особенно стабильное устройство. Это означает, что атомы благородных газов не легко приобретают и не теряют электроны; они вступают в реакцию с от
История периодической таблицы
В 1669 немецкий купец и алхимик-любитель Хенниг Бранд попытался создать Философский камень ; объект, который предположительно мог превращать металлы в чистое золото. Он нагрел остатки кипяченой мочи, и жидкость вылилась и загорелась.Это было первое открытие фосфора.В 1680 Роберт Бойль также открыл фосфор, и это стало достоянием общественности.
В 1809 было открыто по крайней мере 47 элементов, и ученые начали видеть закономерности в характеристиках.
В 1863 английский химик Джон Ньюлендс разделил тогда открытые 56 элементов на 11 групп на основе характеристик.
В 1869 Русский химик Димитрий Менделеев начал разработку таблицы Менделеева, упорядочивая химические элементы по атомной массе.Он предсказал открытие других элементов и оставил для них свободные места в своей периодической таблице.
В 1886 французский физик Антуан Бекерель впервые обнаружил радиоактивность. Студент Томсона из Новой Зеландии Эрнест Резерфорд назвал три типа излучения; альфа, бета и гамма-лучи. Мари и Пьер Кюри начали работать над излучением урана и тория, а затем открыли радий и полоний. Они обнаружили, что бета-частицы заряжены отрицательно.
В 1894 сэр Уильям Рамзи и лорд Рэлей открыли благородные газы, которые были добавлены в периодическую таблицу как группу 0.
В 1897 английский физик Дж. Дж. Томсон впервые открыл электроны; маленькие отрицательно заряженные частицы в атоме. Джон Таунсенд и Роберт Милликен определили их точный заряд и массу.
В 1900 Бекерель обнаружил, что электроны и бета-частицы, идентифицированные Кюри, — это одно и то же.
В 1903 Резерфорд объявил, что радиоактивность вызвана распадом атомов.
В 1911 Резерфорд и немецкий физик Ганс Гейгер обнаружили, что электроны вращаются вокруг ядра атома.
В 1913 Бор обнаружил, что электроны движутся вокруг ядра с дискретной энергией, называемой орбиталями. Излучение испускается при движении с одной орбиты на другую.
В 1914 Резерфорд впервые идентифицировал протоны в атомном ядре.Он также впервые трансмутировал атом азота в атом кислорода. Английский физик Генри Мозли предоставил атомные номера, основанные на количестве электронов в атоме, а не на атомной массе.
В 1932 Джеймс Чедвик впервые открыл нейтроны и идентифицировали изотопы. Это была полная основа периодической таблицы. В том же году англичанин Кокрофт и ирландец Уолтон впервые расщепили атом, бомбардируя литий в ускорителе частиц, превратив его в два ядра гелия.-, Fe4 [Fe (CN) 6] 3, Nh5NO3, so42-, ch4cooh, cuso4 * 5h3o).
Степень окисления атома — это заряд этого атома после ионного приближения его гетероядерных связей. Степень окисления является синонимом степени окисления. Определить степень окисления по структуре Льюиса (рис. 1a) даже проще, чем по молекулярной формуле (рис. 1b). Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Связи между атомами одного элемента (гомоядерные связи) всегда делятся поровну.
Рис. 1. Различные способы отображения степеней окисления этанола и уксусной кислоты. R — это сокращение для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не изменяет степень окисления центрального атома. → Скачать изображение высокого качестваПри работе с органическими соединениями и формулами с несколькими атомами одного и того же элемента легче работать с молекулярными формулами и средними степенями окисления (рис. 1d).Органические соединения можно записать таким образом, что все, что не изменяется до первой связи C-C, заменяется сокращением R (рис. 1c). В отличие от радикалов в органических молекулах, R не может быть водородом. Поскольку электроны между двумя атомами углерода распределены равномерно, группа R не изменяет степень окисления атома углерода, к которому она присоединена. Вы можете найти примеры использования на странице Разделите окислительно-восстановительную реакцию на две полураакции.
Правила присвоения степеней окисления
- Степень окисления свободного элемента всегда равна 0.
- Степень окисления одноатомного иона равна заряду иона.
- Фтору в соединениях всегда присваивается степень окисления -1.
- Щелочные металлы (группа I) всегда имеют степень окисления +1.
- Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2.
- Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2 ), где она равна -1, и соединений с фтором (OF 2 ), где она равна +2.
- Водород имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления -1 в сочетании с металлами.
- Алгебраическая сумма степеней окисления элементов в соединении равна нулю.
- Алгебраическая сумма степеней окисления иона равна заряду иона.
