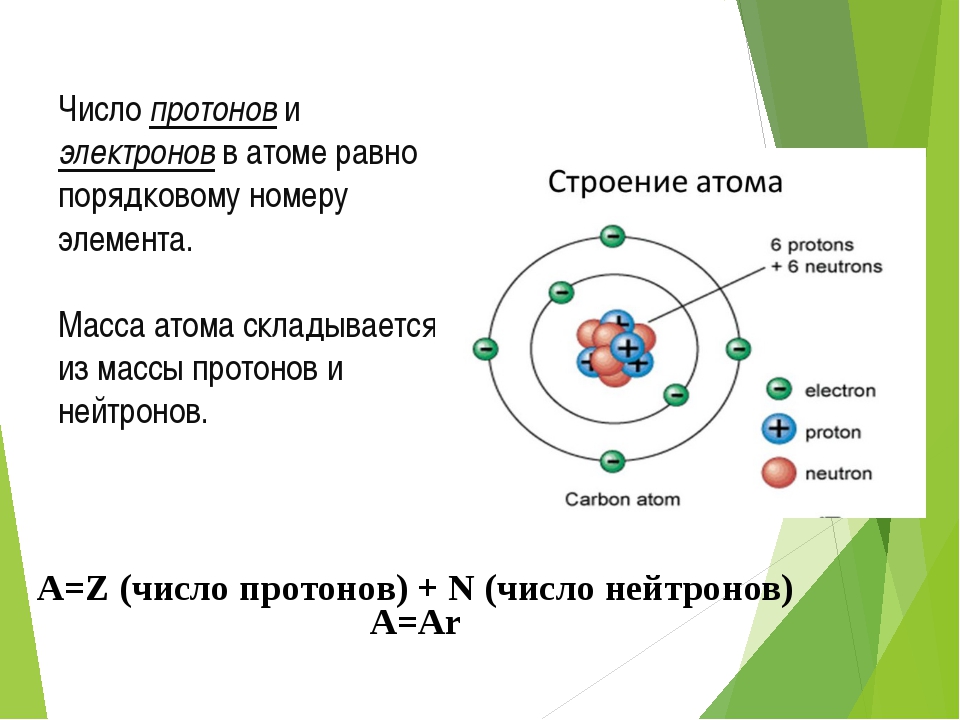
№ п/п | Этапы урока | Деятельность учителя | Деятельность учащихся | Формируемые УУД | 1. | Мотивационно-ориентировочный – помогает определить проблему, план ее решения | Организует деятельность учащихся по актуализации знаний. Выполни задание (Приложение 1, слайд 2). Запишите формулы веществ, укажите, какое из этих веществ является простым, а какое сложным, вычислите относительные молекулярные массы, если известно, что в состав молекулы входят 2 атома фосфора и 5 атомов кислорода; 2 атома водорода. Дополните, пожалуйста, предложенную схему — цепочку, вставьте пропущенные слова (слайд 3-4). Учитель организует дискуссию. На свете много великих тайн. Вот, например, яблоко. — Какая же это тайна? Съесть его и – все дела! — А если разрезать яблоко пополам, что тогда? — А если каждую из этих половинок – ещё раз пополам? — Правильно! Но сколько раз можно делить это яблоко? Есть ли предел делению его на части? Вот вам и великая тайна – делимость вещества. О чём же пойдёт речь сегодня на уроке? Возможно ли дальнейшее деление атома? Атом — это фундаментальное понятие, рассматриваемое не только в курсе химии, но и в курсе физики. Действительно ли можно разделить атом на более мелкие части? | Учащиеся выполняют задания на карточках (4 варианта) (Приложение № 4) Учащиеся вставляют пропущенные термины, вставляя заключительное слово АТОМ (Приложение № 5) Получатся две половинки яблока. — Яблоко разделится на 4 части. — А если ещё? — Получится 8 частей. Учащиеся вставляют пропущенные слова. Выдвигают гипотезу: атом можно разделить на более мелкие части. | умение организовать свою работу, распределить время; умение работать с различными формами заданий | 2. | Операционно-исполнительский – этап решения проблемы. | Учитель организует деятельность учащихся по осмыслению понятия АТОМ. Идеи атомного строения возникли ещё в античном мире. Ещё 2500 лет назад древнегреческий философ Демокрит полагал, что любой предмет состоит из мельчайших частиц – атомов. Само слово «атом», кстати, означает «неделимый». Так считали учёные вплоть до конца 19 века, когда было доказано, что атом делим, что он состоит из более мелких или элементарных частиц. Наш русский учёный М.ВЛомоносов считал, что существует два вида материи “элементы” (атом), “корпускулы” (молекулы). Атом, как и яблоко, можно разделить на части или на составляющие. -Что же входит в состав атома? — Что Вы знаете из курса физики по данному вопросу? Заглянем на страницы истории и проведём своё расследование. Выясним из чего же состоит атом. -Какую роль в атомах играют нейтроны? Учитель подводит итог дискуссии Проанализируйте данные таблицы (слайд 24 ) и определите черты сходства и различия элементарных частиц: протонов, нейтронов и электронов. Обсудим некоторые термины.
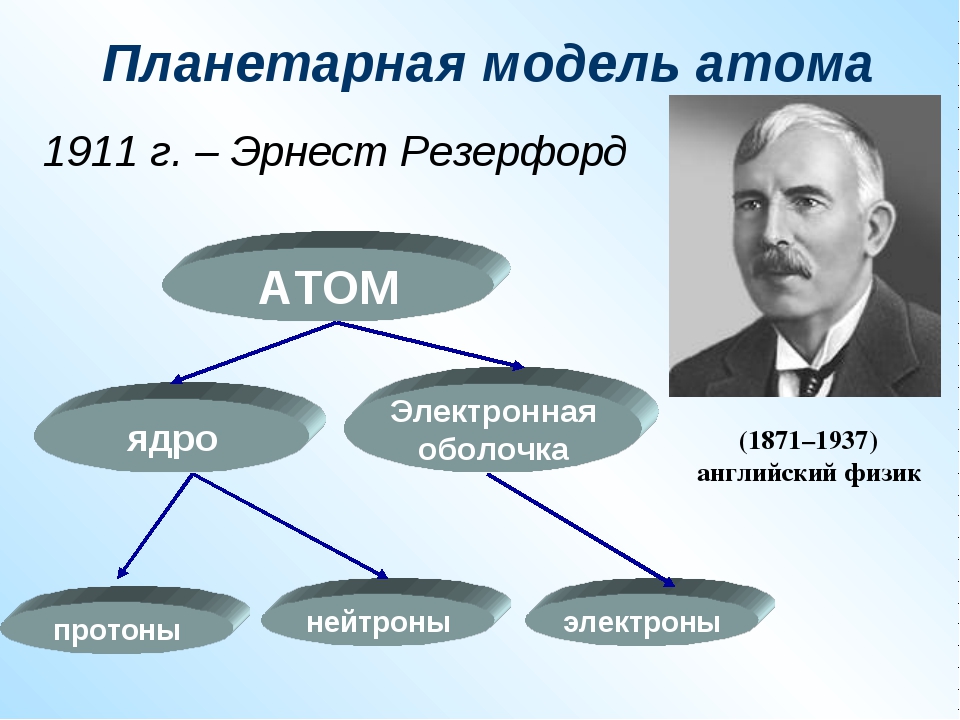
Строение всех атомов зашифровано в периодической системе химических элементов Д. И. Менделеева. Вы, знаете, что каждому химическому элементу присвоен порядковый номер и для каждого элемента подсчитана атомная масса. Учитель организует деятельность учащихся по осмыслению понятия атом с учётом вновь приобретённых знаний. В чем он заключается, мы сейчас узнаем. Введем следующие обозначения( слайд 25) Z – порядковый номер химического элемента М – массовое число,М =Ar N – число нейтронов Z – указывает на заряд ядра, а следовательно на число протонов, а так как атом нейтрален, то число протонов равно числу электронов. М – сумма протонов и нейтронов в ядре атома М = Z + N Приведём пример( разбирается 2-3 примера). Na Z= 11, е- = 11, р+ = 11, n0= 23-11=12 Учитель оказывает помощь при формулировании выводов учащимися понятия атома. | Учащиеся включаются в активный поиск, исследование Учащиеся делают экспресс-сообщения, слушают, делают выводы, обобщают полученные сведения. (Приложение № 1) На сегодня известно, что в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Нейтроны подобны ленивому человеку в доме. Он никому не доставляет неприятностей – просто смотрит телевизор. В доме ссорятся, спорят. Но он способен гасить очаг напряжения своей коронной фразой: «Замолчите сейчас же! Я смотрю телевизор». После этого в доме восстанавливается мир. Таким же образом нейтроны не позволяют ядру разваливаться на части. Протоны, отталкиваясь друг от друга, разделены нейтронами, что не дает ядру распасться. Учащиеся перечерчивают таблицу в тетради. (Приложение № 2) Учащиеся включаются в активный познавательный процесс. Учащиеся анализируют состав атомов химических элементов, ориентируясь на вновь приобретённые знания. Учащиеся делают выводы. ( слайд 26 — 27) 1.Атом- мельчайшая химически неделимая частица. 2.Атом-электронейтральная частица. 3.В центре атома находится положительно заряженное ядро, вокруг которого двигаются электроны. 4. Ядро состоит из протонов и нейтронов. Вся масса атома сосредоточена в его ядре. 5. Порядковый номер химического элемента численно равен заряду ядра атома и соответствует количеству протонов и электронов. 6. Чтобы найти количество нейтронов надо из массового числа вычесть порядковый номер химического элемента. | умение обобщать, анализировать, рассуждать умение работать с различными формами заданий, умение читать схемы, выстраивать логические цепочки Развитие умения устанавливать логические связи между причиной и следствием. Умение видеть главные аспекты, обобщать, резюмировать Умение переносить предметные знания на другие сферы деятельности человека Умение переносить предметные знания на другие сферы деятельности человека Развитие умения переводить информацию, записанную в виде текста в символы, и наоборот, умение анализировать количественное представление зависимости Развитие метапредметного навыка быстрой работы с математическими выражениями Развитие умения переводить информацию, записанную в виде символов в текстовую и словесную форму, умение анализировать количественное представление зависимости. | 3 | Рефлексивно-оценочный этап — предназначен для осмысления и оценки результатов проведенных исследований, оценки и самооценки учебной деятельности. | Учитель подводит итоги работы и организует деятельность учащихся по самоконтролю полученных знаний. Итак, подведём итоги урока
Учитель задаёт домашнее задание 4.Домашняя работа. § 6 Рассчитать число элементарных частиц для первых 20 элементов ПС. | Учащиеся заполняют таблицы с учётом новых знаний и проводят взаимопроверку (обмен тетрадями).Слайды 28,29). Учащиеся принимают активное участие в оценивании работы на уроке одноклассников и исправляют выявленные ошибки. | Умение делать вывод, кратко резюмировать Развитие умения развивать обратную логическую цепочку Умение выделять и осознавать уто, что уже усвоено и что еще подлежит усвоению, самооценивания качества и уровня усвоения материала. |
Презентация «Основные сведения строения атома» | Презентация к уроку по химии (8 класс) на тему:
Слайд 1
Основные сведения о строении атома. Состав атомных ядер. Химия 8 классСлайд 2
Семь металлов создал свет По числу семи планет: Медь, железо, серебро… Дал нам Космос на добро. Злато, олово, свинец… Сын мой, сера — их отец. А еще ты должен знать: Всем им ртуть – родная мать.
Слайд 3
Вещества, образованные атомами одного химического элемента, называют простыми . Вещества, которые образованны атомами разных химических элементов, называют сложными или химическими соединениями химическое соединение ( Молекула воды H 2 O ) простые вещества ( молекула водорода) Н 2 Вопрос: Какие три формы существования элемента вы знаете? Свободные атомы Простые вещества Химические соединения → →
Слайд 4
Основные этапы познания атома: 1. Демокрит – ввёл понятие «атом –неделимый» 2. Стони (ирландский физик) – доказал, что электричество переносится электронами( ē ). Они входят в состав атома. 3. Томсон и Перрен – доказали, что катодные лучи это ē и они имеют отрицательный заряд + К А поток электронов свечение стекла
Они входят в состав атома. 3. Томсон и Перрен – доказали, что катодные лучи это ē и они имеют отрицательный заряд + К А поток электронов свечение стекла
Слайд 5
Основные этапы познания атома: 4. Беккерель – обнаружил, что соли урана испускают излучение, засвечивая фотопластинку. Назвал это излучение – радиоактивность . α – положительно заряженные частицы β– отрицательно заряженные ( ē ) γ – нейтральные ( нейтроны ) + k A α β γ соль урана
Слайд 6
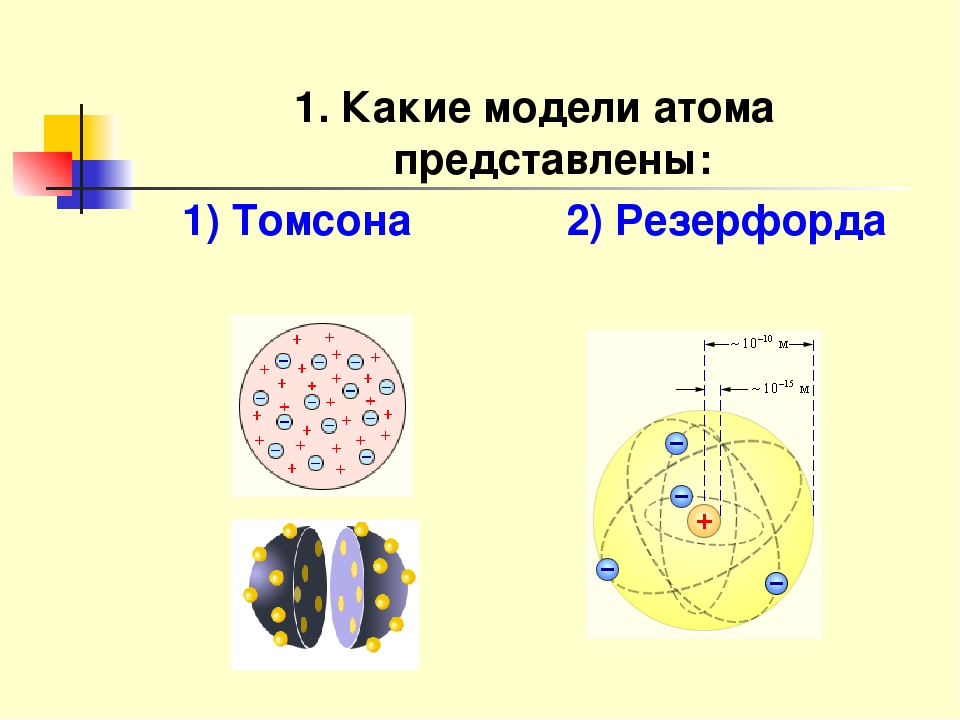
Модели атомов — + — + — + — + Модель атома Резерфорда (планетарная) Модель атома Томпсона
Слайд 7
Строение атома Протоны Р + ядро электронные оболочки Атом Электроны ē Нейтроны N 0
Слайд 8
Определить число протонов, нейтронов и электронов для элементов: Водорода. Гелия. Лития. Натрия. Магния. Кислорода. Серы. Кальция
Слайд 9
Вопросы 1. Какие научные открытия доказали, что атом сложная частица? 2. Чему равен заряд ē ? 3. Из чего состоит ядро? 4. Чему равен заряд P + ? 5. Где сосредоточена вся масса атома? 6.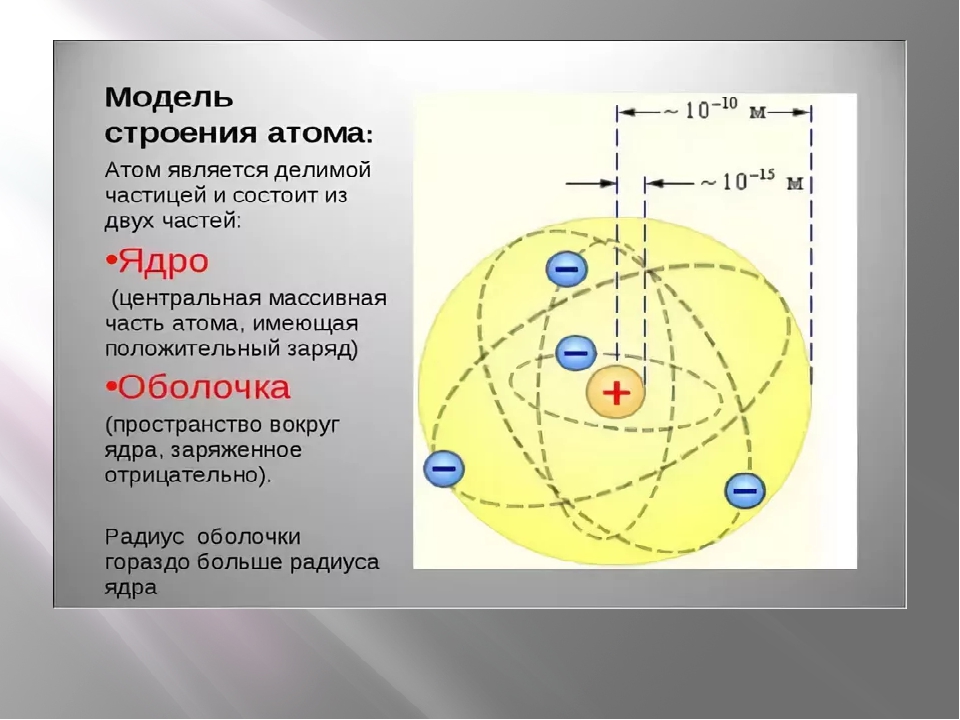 Чему равен заряд N 0 ?
Чему равен заряд N 0 ?
Слайд 10
Домашнее задание: § 6 Упр. 1, 3, 5
| 1. |
Число протонов и заряд ядра
Сложность: лёгкое |
1 |
| 2. |
Число электронов
Сложность: лёгкое |
1 |
3.
|
Число нейтронов в атоме
Сложность: лёгкое |
1 |
| 4. |
Основные понятия
Сложность: лёгкое |
1 |
5.
|
Сложность: среднее |
2 |
| 6. |
Число нейтронов и электронов в нуклиде
Сложность: среднее |
2 |
7.
|
Состав атома
Сложность: среднее |
2 |
| 8. |
Количество нейтронов
Сложность: сложное |
3 |
9.
|
Определи элемент
Сложность: сложное |
3 |
| 10. |
Молекулярные массы хлоридов
Сложность: сложное |
4 |
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
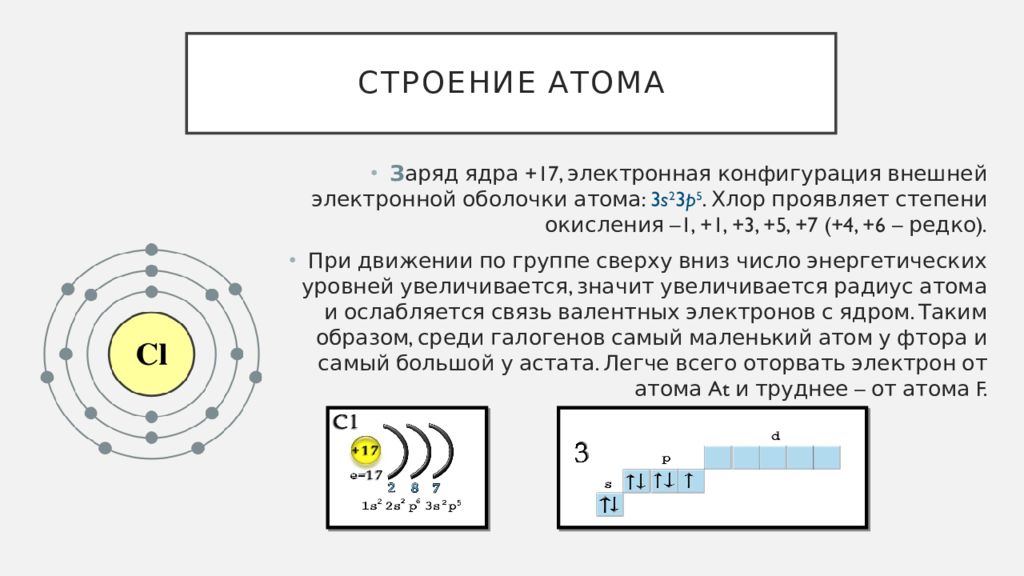
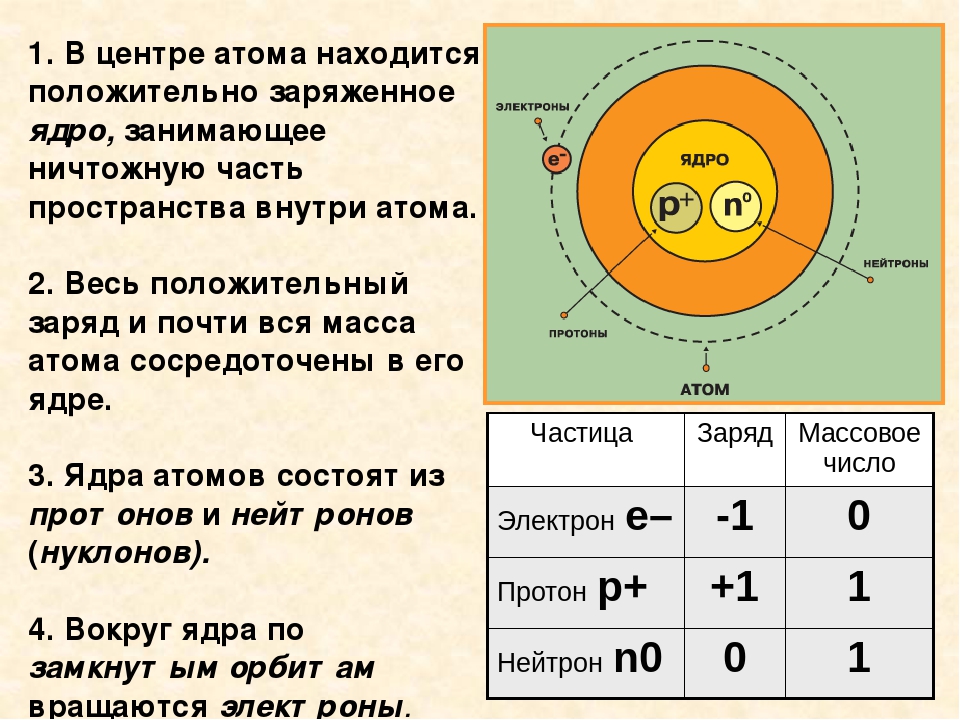
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
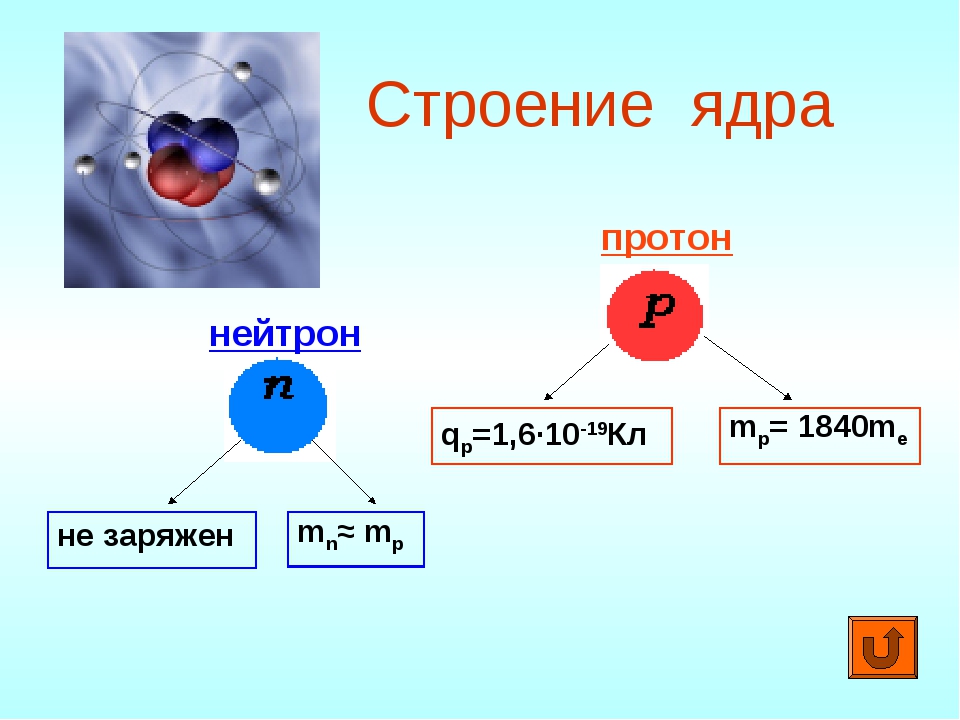
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.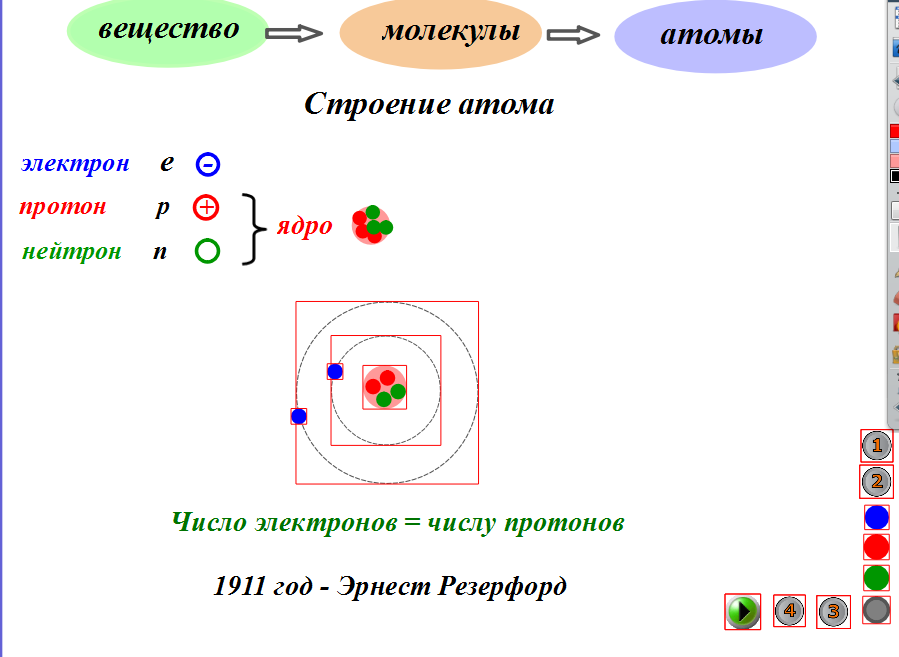 И. Менделеева.
И. Менделеева.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому.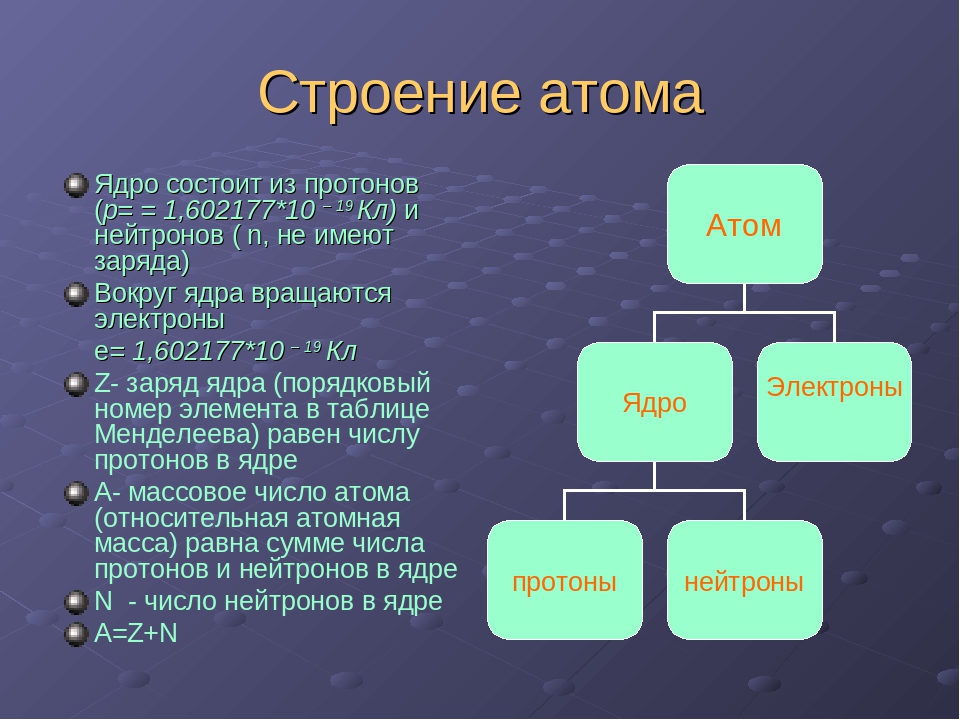 Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Урок 5: Строение атома — 100urokov.ru
План урока:
Строение атома
Ядро атома
Электроны в атоме
Главные правила образования оболочки электронов в атоме
Периодичность свойств элементов. Электроотрицательность
Строение атома
Сегодня мы будем путешествовать в микромир – мир атома. Даже если превратить нас в песчинку, то по сравнению с размером ядра атомов химических элементов, мы будем гигантами.
Атом нельзя увидеть, невозможно потрогать, он на столько мал, что существует только в нашем воображении. До XIX века учёные оперировали только одной характеристикой атома – это его масса. Наука не оперировала понятиями, что ядро атома содержит более мелкие частицы.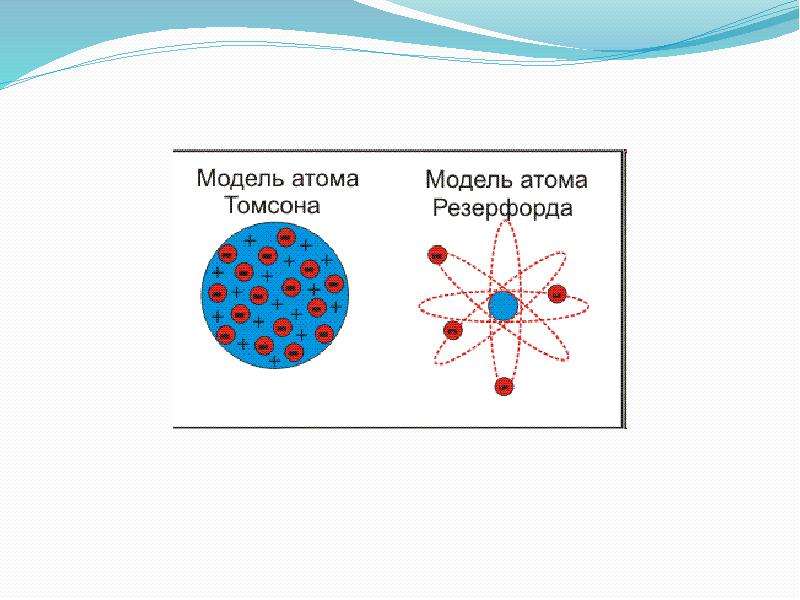 Почему элементы отличаются массой. Атом долгое время считали «неделимым». Но отличия в массе подвигли искать причину в строении.
Почему элементы отличаются массой. Атом долгое время считали «неделимым». Но отличия в массе подвигли искать причину в строении.
Как описать строение, то чего невозможно увидеть, а можно только представить. Ведь современные электронные микроскопы появились только в XX веке.
Атом – как мельчайшая частица, известна ещё с древних времён. Древнегреческий философ Демокрит считал, что свойства веществ определяются определённым типом атома. Даже тонкая материя, душа, по его мнению, состоит из атомов. Так тела бывают в разных агрегатных состояниях, поэтому атомы металлов будут с зубцами, жидкости будут обладать гладкими, это будет причиной их текучести.
Долгое время атом считали неделимым. Заглянув в словарь синонимов, можно увидеть пару синонимов для слова атом, неделимый, мельчайшая частица. Теория о неделимости существовала до XIX века, пока экспериментально не подтвердили, что ядро атома состоит из более мелких частиц. Но как они располагаются в атоме, как конфеты драже в кармашке, или по версии Томсона, который сравнивал электроны с изюминками, хаотично разбросанных в кексе.
В конце XIX века, начале XX происходит стремительное развитие науки, открываются новые частицы α и β. Позже было установлено, что это ядро атома элемента Не и электроны.
Английский физик Резерфорд сравнил атом с Солнечной системой. Солнце – это очень большая звезда, которая находится в центре. Масса Солнца занимает 99,86 % от массы всей Солнечной системы. Подобно планетам, электроны вращаются вокруг ядра, каждый из них занимает своё положение — орбиталь. Т.е. электроны – это оболочка атома.
В ходе данных исследований было доказано, что атом представляет совокупность заряженных и нейтральных частичек.
Анализируя размеры, важно запомнить, что радиус ядра атома, будет всегда значительно меньше радиуса всего атома. Этот факт объясняется тем, что частицы составляющие ядро более компактно упакованы, чем электроны.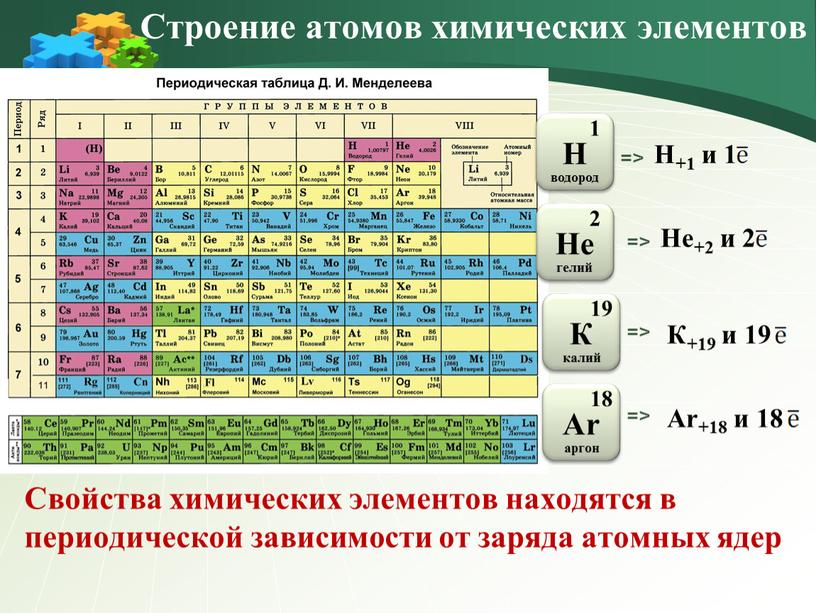
Ядро атома
Орешки фундука явно вы видели. В середине ореха находится большое ядро, занимающее почти всю массу ореха, оставляя малое пространство между скорлупой.
Ядро атома элемента имеет в составе протоны и нейтроны, которые принято называть нуклонами.
Данные частицы не относятся к элементарным, научно доказано, что они состоят с кварков (в словарь). Нейтроны в ядре атома не несут никакого заряда, они нейтральны. Протоны в ядре атома определяют его заряд.
Сумма протонов и нейтронов составляет массовое число ядра атома (нуклонное).
Вы наверняка замечали, что значение Ar в ПСХЭ имеет вид не целого числа, с чем это связано? Причина кроется в том, что химические элементы существуют в виде изотопов.
Чтобы понять суть этого понятия, давайте вспомним, чем особенный каждый элемент? Заряд ядра атома постоянен, другими словами, неизменимое количество протонов. Значит, это будет разновидность элементов, которые будут отличаться нуклонным числом, и как следствие, количеством нейтронов.
Именно по причине существования изотопов, Ar не имеет целого числового значения. Например, количество изотопов хлора – 2.
Источник
Масса изотопов и их процентное содержание составляют относительную массу элемента.
Возможно, вы ранее замечали, что в ПСХЭ есть пара элементов, которые нарушают порядок размещения по увеличению относительной атомной массы. Это пары K – Ar, Co – Ni, Te – I.
Некоторые изотопы отличаются особенной способностью самовольно превращаться в другие элементы – это явление носит название радиоактивность, а сами элементы – радиоактивные. Таким образом, они делятся на стабильные и радиоактивные изотопы.
Изотопы элементов после Висмута в ПСХЭ, начиная с 84, будут относиться к радиоактивным элементам.
В ходе распада радиоактивного изотопа образуются новые элементы, также могут выделяться частицы α (ядра атома ), β – это поток электронов ( , γ – это поток электромагнитных нейтральных частиц – фотонов.
Электроны в атоме
Давайте рассмотрим, какое место занимают электроны в атоме.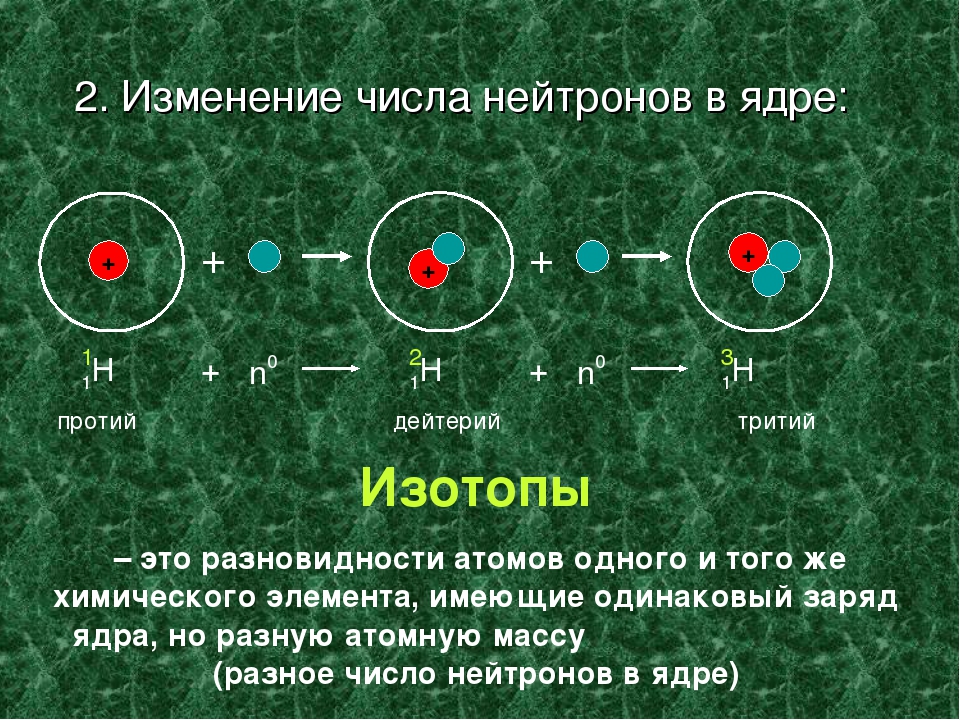 Если ядро составляет 99,86 % от массы, а, как известно, что количество протонов и электронов равно. То на долю электронов приходится всего 0,14% от массы.
Если ядро составляет 99,86 % от массы, а, как известно, что количество протонов и электронов равно. То на долю электронов приходится всего 0,14% от массы.
На данный момент, электрон считают элементарной частицей.
Модель Резерфорда (планетарная) на очень примитивном уровне даёт представление,как располагаются электроны и протоны в атоме, поскольку атом имеет достаточно сложное строение.
Электрон настолько мал и находится в постоянном движении с достаточно большой скоростью, что зафиксировать его в определённом месте и времени сложно. Именно по этой причине говорят, что электрон в атоме находится не в заданной точке, а может там предположительно находиться, потому что его зафиксировать в определённый момент времени невозможно.
Источник
Ядро атома Водорода имеет 1 протон, вокруг которого вращается один электрон. Но как быть, если количество электронов в атоме будет два и более, каким образом они будут размещаться.
Поскольку они двигаются с достаточной большой скоростью, то чтобы указать распределение электронов в атоме используют 4 числа – орбитальные характеристики.
Прежде чем, мы перейдём к орбитальным характеристикам, давайте представим многоэтажный дом, в который необходимо разместить жителей, в нашем случае – это электроны.
Первая орбитальная характеристика
Другими словами, представляем, что наш многоэтажный дом содержит 7 этажей. Цифры 1, 2, 3, 4, 5, 6, 7 обозначают номер этажа или энергетические уровни электрона в атоме.
Вторая орбитальная характеристика
Возвращаемся к нашему, многоэтажному дому, орбитальное число показывает типы орбиталей или в сравнении с домом квартиры s, p, d и f.
Третья орбитальная характеристика
Представить квартиру, в виде ячейки или квадрата, так вот магнитное квантовое число указывает число орбиталей.
Смотрим, на первом этаже размещается только s-квартиры, которые будут однокомнатными. На втором этаже уже имеется две квартиры s и р, т.е. однокомнатная и трёхкомнатная. На третьем этаже s, p, d. Четвёртый, пятый и шестой этажи размещают 4 квартиры s, p, d и f.
На втором этаже уже имеется две квартиры s и р, т.е. однокомнатная и трёхкомнатная. На третьем этаже s, p, d. Четвёртый, пятый и шестой этажи размещают 4 квартиры s, p, d и f.
Четвёртая орбитальная характеристика
Это означает, что в одной ячейке (квадрате), может поселиться не больше двух электронов.
Вот на таком достаточно примитивном уровне, мы рассмотрели состояние электронов в атоме. Но как они там располагаются? Каждый электрон занимает своё определённое место, согласно энергии.
Рассмотрим распределение электронов по энергетическим уровням в атоме. Наверняка вы заметили, что наш дом семиэтажный. Как думаете, по какой причине? ПСХЭ содержит 7 периодов (7 этажей). Если элемент находится во втором периоде, значит, его электроны будут занимать 1 и 2 этаж и никаким образом не могут попасть на 5 или 6 этажи. В данном примере 2 этаж будут называть внешним, научным языком – внешним энергетическим уровнем (он крайний).
Главные правила образования оболочки электронов в атоме
Источник
Давайте дадим волю фантазии, допустим, к нашему семиэтажному дому подошёл Бор, не лес как вы могли подумать, а элемент.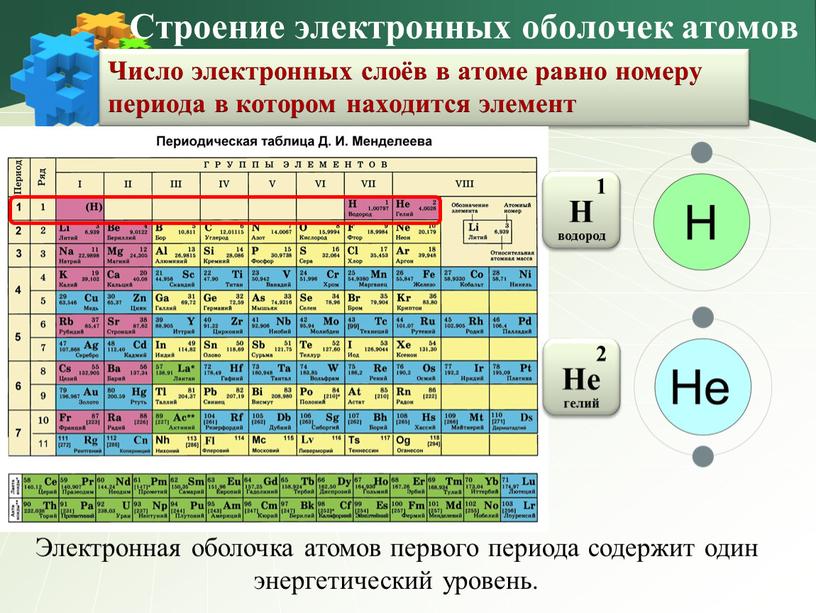 Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
Составим электронную и графическую схему элемента на примере Si и V с помощью алгоритма.
Обратите внимание, чтобы составить электронную формулу элемента, достаточно знать его расположение в ПСХЭ. Итак, начинаем по порядку.
- Кремний, находится под № 14, символ Si.Ar (Si) = 28
- Заряд ядра +14. e = 14, р = 14, n = 28 – 14 = 14
- III период, IV (А)группа.
- Энергетических уровней 3. Не забываем, что следуя правилу Гунда, электроны занимают, ячейку по одному на внешнем p-подуровне
- Исходя с этого всего, электронная оболочка атома записывается в виде формулы
- Ванадий, № 23, символ V.

- Заряд ядра +23. Электронов 23.
- IV период, V(Б) группе.
- Энергетических уровней 4. IV открывает большие периоды, которые имеют свою особенность заполнения. Применив принцип Клечковского, мы увидим, что изначально заполняется 4s-подуровень, а только тогда 3d-подуровень.
- Исходя с этого всего, схема строения электронной оболочки атома запишется в следующем виде.
Существует основное состояние электрона в атоме и возбуждённое, которое возникает, если к атому применить некоторую определённую энергию. Электроны во внешнем электронном слое атома имеют способность перемещаться, занимая место на свободной орбитали, образуя при этом возбуждённое состояние.
Обратите внимание, число неспаренных электронов отвечает валентности элементов: Li (I), Be (II), B (III), C (II и IV).
Периодичность свойств элементов. Электроотрицательность
С развитием учения о строении атома, периодический закон занимает ещё больше значимое место в естествознании. Уже неоднократно говорилось, что ПСХЭ является уникальной подсказкой. Достаточно знать расположение и строение электронных оболочек атомов элементов, и возникает возможность судить о том, какими характеристиками он будет обладать. В настоящее время периодический закон имеет формулировку, данную Менделеевым, с небольшим уточнением.
Уже неоднократно говорилось, что ПСХЭ является уникальной подсказкой. Достаточно знать расположение и строение электронных оболочек атомов элементов, и возникает возможность судить о том, какими характеристиками он будет обладать. В настоящее время периодический закон имеет формулировку, данную Менделеевым, с небольшим уточнением.
За то, какими свойствами будет наделён элемент, отвечают электроны, которые размещены на внешнем энергетическом уровне. Их ещё называют валентные электроны атома, именно они отвечают за периодическое изменение свойств элементов.
С увеличением массы атома в пределах периода, количество электронов также возрастает, пока не заполнятся все вакантные ячейки уровня.
В ходе химической реакции происходит «движение» электронов. Т.е. одни элементы будут отдавать их, а вторые принимать.
Электроотрицательность — это способность атома «оттягивать» на себя электронную плотность других атомов
При образовании химических связей, каждый атом стремится «к совершенству», т. е. завершить энергетический уровень. Такой уровень имеют благородные газы ns2np6. А остальным чтобы получить данную конфигурацию необходимо отдать, либо принять электроны.
е. завершить энергетический уровень. Такой уровень имеют благородные газы ns2np6. А остальным чтобы получить данную конфигурацию необходимо отдать, либо принять электроны.
Рассмотрим на примере, образования вещества NaCl.
Отдав свой один электрон с внешнего 3s-уровня, атом Натрия образует ион Na+, по своей электронной конфигурации аналогичный Неону. Хлор принимая электрон, образует ион Cl− – принимая электронную конфигурацию Аргона.
Обобщая данный пример, сделаем вывод, элементы, которые содержат малое количество электронов на внешнем уровне (1 – 3) будут только отдавать электроны – и они будут относиться к металлам. Неметаллы характеризуются способностью принимать электроны.
Источник
Из определения сделаем вывод, что наибольшую электроотрицательность имеет Фтор (F), нет ни одного элемента, кому бы он смог отдать свой электрон, а будет только забирать. Минимальную ЭО будет иметь Франций (Fr).
Ещё одна важная причина изменения свойств элементов, которая изменяется периодически, это радиус атома. Если ЭО характеризует неметаллы, то по радиусу судят о металлических свойствах. Металлы легко отдают электроны, чем дальше они находятся от ядра, тем легче «отрываются». Радиус атома с увеличением заряда ядра в периоде уменьшается, так как ядро начинает сильнее притягивать электроны.
Если ЭО характеризует неметаллы, то по радиусу судят о металлических свойствах. Металлы легко отдают электроны, чем дальше они находятся от ядра, тем легче «отрываются». Радиус атома с увеличением заряда ядра в периоде уменьшается, так как ядро начинает сильнее притягивать электроны.
Источник
Краткие выводы
Строение атома – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Цели урока:
обучающие:
- сформировать знания о строении атома, познакомить с планетарной моделью атома по Резерфорду;
- дать понятия отрицательного и положительного иона;
- научить изображать атом и ион химического элемента.
развивающие:
- развить интерес учащихся к предмету с помощью различных составляющих;
- расширение кругозора в области исторических знаний об изучении электрических зарядов;
- развитие навыков выделять электрические явления в природе и технике.

- сформировать элементы творческого поиска на основе приёма обобщения, продолжить работу по формированию умений составлять, анализировать, делать выводы.
воспитательные:
- воспитать умения и навыки коллективной работы;
- содействовать формированию мировоззренческой идеи познаваемости явлений и свойств окружающего мира.
Оборудование(демонстрационное) мультимедийный компьютерный класс.
Лабораторное оборудование (для практической работы) полиэтиленовые пленки (2 шт.), бумажная полоска; пластмассовая линейка, комочек ваты.
Раздаточный материал: таблица Менделеева.
Тип урока: изучение и первичное закрепление новых знаний.
Форма урока: урок с использованием ИКТ.
План урока:
Этапы урока |
Деятельность учителя |
Деятельность ученика |
Время |
1. |
Показ слайда по изученной теме, вопрос по рисунку. |
Отвечают на вопросы учителя после просмотра слайда |
1 мин |
2. Работа в группах. Выполнение практической работы |
Объяснение цели выполнения работы, совместный анализ результатов деятельности. |
Выполнение практической работы, демонстрация опыта, ответы на вопросы. |
5мин |
3. Открытие нового знания |
Обеспечить усвоения новых знаний |
Формулируют цель. Участвуют в диалоге с учителем, отвечают на вопросы, делают выводы, делают краткие записи в тетради. |
15 мин |
Динамическая пауза |
Создать атмосферу и обеспечить выполнение |
Выполняют под счет ученика |
2 мин |
4. Первичное закрепление изученного материала |
Закрепление изученного материала при разборе задач, вопросов. |
Решают задачи в группах и отвечают на вопросы учителя. |
8 мин |
5. Самостоятельная работа за компьютерами |
Контроль за выполнением теста |
Учащиеся выполняют тест за компьютерами |
5 мин |
6. |
Анализ и оценка успешности работы на уроке. |
Записывают д/з, считают жетоны и работают со своим листом самооценки, чтобы определить отметку за урок по критериям учителя. |
4 мин |
Ход урока
Организационный момент.
Эпиграф урока.
Науку все глубже постигнуть стремись,
Познанием вечного жаждой томись.
Лишь первых познаний блеснет тебе свет,
Узнаешь; предела для знания нет.ФИРДОУСИ (Персидский и таджикский поэт)
Сегодня на уроке мы продолжим разговор об электризации тел и выясним, почему при взаимодействии одно тело заряжается положительно, другое – отрицательно.
Не забывайте, для того, чтобы получить сегодня хорошую оценку, набирайте жетоны за правильные ответы.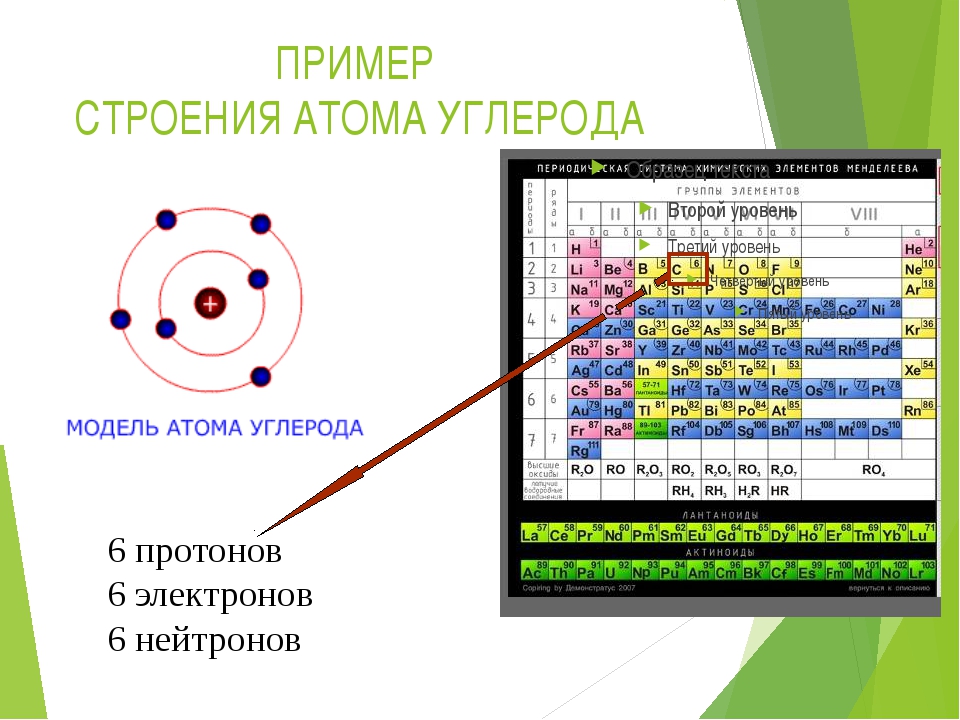
(Жетоны используются на каждом уроке, за пять набранных жетонов ставится оценка «5»).
Презентация «Строение атома»
1 слайд: Объясните, что вы видите на картинке?
(Ответы учащихся).
Работа в группах:
Серия экспериментов «Электрическое поле»
Каждое задание проделывает группа учащихся и дают ответы на вопросы.
Получают жетоны.
1. Изучение зависимости силы взаимодействия заряженных тел от абсолютного значения зарядов и расстояния между ними
Приборы и материалы: полиэтиленовые пленки (2 шт.), бумажная полоска.
Порядок выполнения работы
1. Положите две полиэтиленовые пленки рядом на стол (параллельно друг другу) и проведите по ним один раз рукой. Поднимите пленки за концы, разведите их и, медленно сближая, наблюдайте за их взаимодействием.
2. Повторите опыт с этими же пленками, натерев их рукой. Как изменилась сила взаимодействия пленок?
3. Проделайте аналогичные опыты с полиэтиленовой пленкой и бумажной полоской.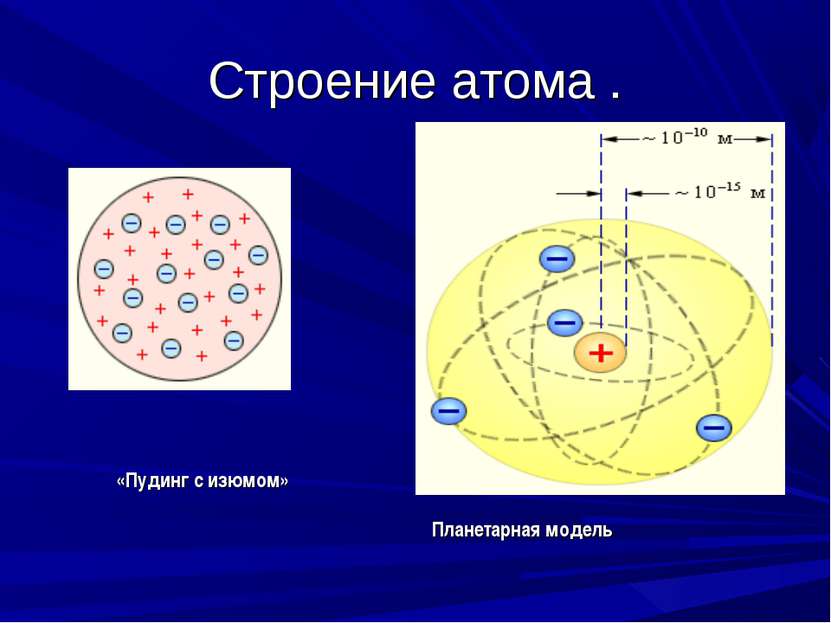 Для их электризации положите на бумажную полоску полиэтиленовую пленку и потрите их рукой (первый раз – слегка, второй раз – сильнее). Каждый раз разводите полоски и, медленно поднося друг к другу, наблюдайте за их взаимодействием.
Для их электризации положите на бумажную полоску полиэтиленовую пленку и потрите их рукой (первый раз – слегка, второй раз – сильнее). Каждый раз разводите полоски и, медленно поднося друг к другу, наблюдайте за их взаимодействием.
4. Ответьте на вопросы:
- По какому признаку вы судите о силе взаимодействия заряженных тел?
- Как взаимодействуют заряженные полиэтилен с полиэтиленом и полиэтилен с бумагой?
- На оба ли заряженных тела действует электрическая сила?
- От чего зависит сила взаимодействия заряженных тел?
- Как зависит сила взаимодействия заряженных тел от значения зарядов и расстояния между ними?
2. Наблюдение парения заряженной пушинки в электрическом поле
Приборы и материалы: пластмассовая линейка, комочек ваты.
Порядок выполнения работы
1. Положите пластмассовую линейку на стол и натрите ее бумагой.
2. Распушите очень маленький комочек ваты и положите его на линейку.
3. Поднимите наэлектризованную линейку и легонько сдуйте с нее пушинку вверх.
4. Поместите быстро линейку снова к пушинке и наблюдайте за ее движением в электрическом поле заряженной линейки. (Если пушинка прилипнет к линейке, сдуйте ее и снова повторите опыт.)
5. Ответьте на вопросы:
- Какие силы действуют на пушинку во время ее парения?
- Почему пушинка не падает в электрическом поле?
Комментарий учителя (после разбора опыта).
Этот опыт показывает возможность уравновешивания силы тяжести, действующей на тело, силой электрического поля
2 слайд:
Учащиеся отвечают на вопросы:
Подумайте:
- Зачем при перевозке горючих жидкостей к корпусу автоцистерны прикрепляют цепь, которая при движении волочится по земле?
- Для заземления цистерны бензовоза к ней прикрепляют стальную цепь, нижний конец которой несколькими звеньями касается земли.
 Почему такой цепи нет у железнодорожной цистерны?
Почему такой цепи нет у железнодорожной цистерны? - Может ли одно и тоже тело, например эбонитовая палочка, при трении электризоваться то отрицательно, то положительно?
Открытие нового знания
Что такое физическое тело? (Ответ учащихся — это предметы, которые нас окружают.)
Что такое вещество? (Ответ учащихся — это то, из чего состоит физическое тело.)
Любое вещество состоит из молекул, молекулы из атомов.
О чем сегодня мы говорим на уроке? (версии учащихся)Постановка цели.
3 слайд: Итак, тема урока «Строение атома» (запишите в тетрадь)
4 слайд: (из истории)
Нас интересует строение одной очень маленькой частички — атома. Слово “атом” придумал очень давно более 2500 лет назад древнегреческий философ Демокрит. С греческого “атом” — “неделимый”.
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома.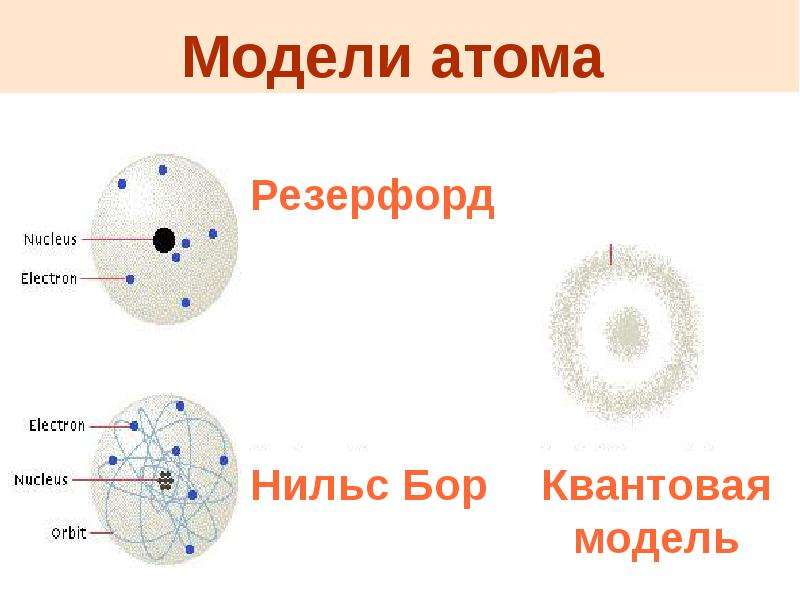
В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
5 слайд: Ученые Джозеф Томсон и Эрнест Резерфорд предложили свои модели строения атома. Кто же был прав?
6 слайд: В 1903 году Джозеф Томсон предложил одну из первых моделей «Кекс с изюминкой», т. е. атом представляет собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны.
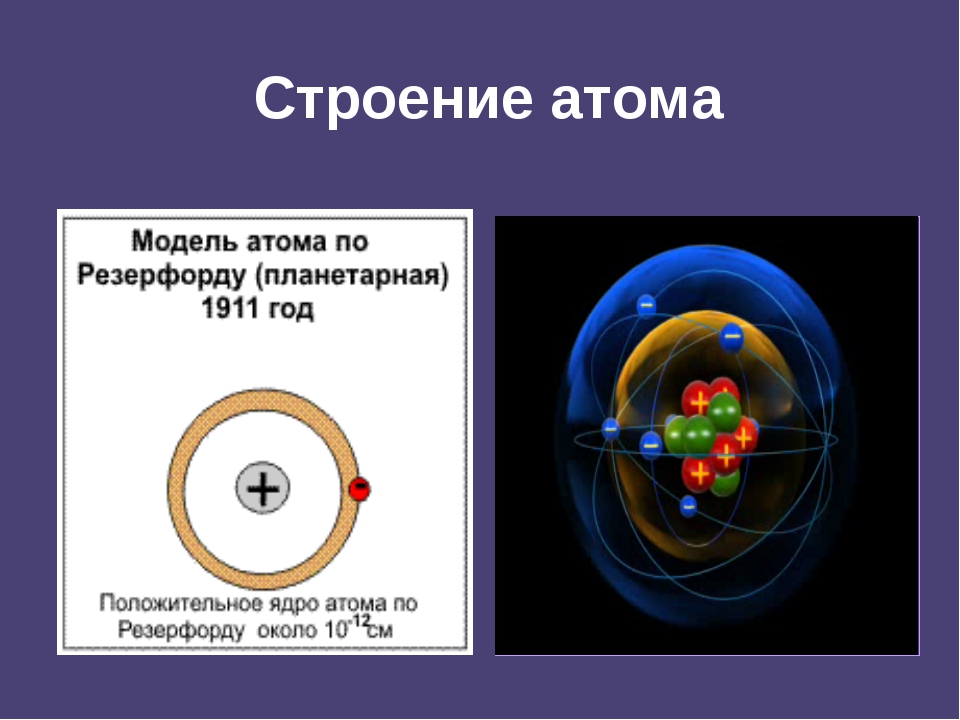
7 слайд: В 1911 году Резерфорд провел ряд опытов по исследованию состава и строения атома. В центре атома находится положительно заряженное ядро, вокруг ядра движутся электроны. Эту модель назвал «планетарной моделью», схожей с нашей Солнечной системой.
Запишите в тетрадь: Резерфорд – планетарная модель атома.
8 слайд: Атом состоит: из положительно заряженного ядра, в котором протоны – положительные частицы, нейтроны – без заряда (имеют только массу), вокруг ядра движутся отрицательные электроны.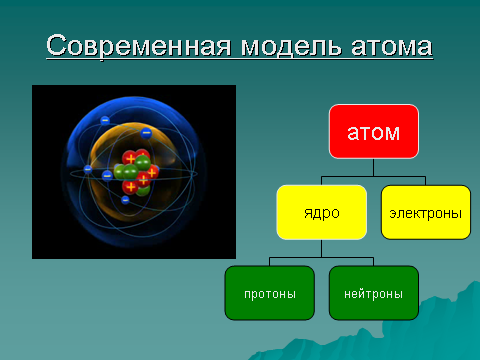 Сколько положительных частиц в атоме, столько и отрицательных, поэтому атом в целом нейтрален.
Сколько положительных частиц в атоме, столько и отрицательных, поэтому атом в целом нейтрален.
Зарисуйте в тетрадь схему.
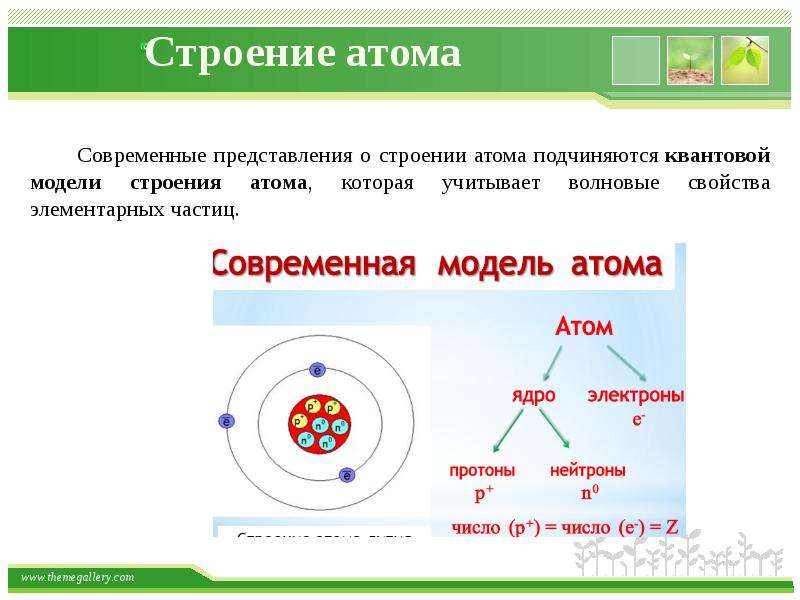
Строение всех атомов зашифровано в периодической системе химических элементов, которую создал Менделеев. Порядковый номер химического элемента показывает электрический заряд ядра атома.
Положите перед собой листочки с таблицей Менделеева.
Рассмотрим химический элемент водород:
Какой у него порядковый номер?
Ученик: (предполагаемый ответ)у него первый порядковый номер,
Чему равен заряд ядра?
Ученик: (предполагаемый ответ) Заряд ядра равен 1
Сколько в атоме протонов, электронов?
Ученик: (предполагаемый ответ) число протонов в ядре 1, но т.к. атом нейтрален, то и на оболочках 1 отрицательный электрон.
9 слайд: Атом — электрически нейтральная частица, суммарный положительный заряд ядра равен суммарному отрицательному заряду электронов. Общее число протонов и нейтронов в ядре выражается массовым числом:
A = Z + N.
А – атомная масса, Z – число электронов, N – число нейтронов
(Аналогично, для гелия, железа.)
10 слайд:
Собрать, сколько надо, частиц всех сортов,
И атом — пожалуйста — вот он, готов!
Но в общее дело их вклады неравны…
Так кто же из этих частиц самый главный –
Пузатый протон, флегматичный нейтрон,
А может быть, юркий малец электрон?
Итак, какая задача стоит перед нами?
Выяснить, какие частицы в атоме главные?
Изменяем число электронов
Если при электризации тело получает положительный заряд, это значит, что от атома отделился отрицательный электрон. Какой заряд данной частицы? (ответы учащихся).
11 слайд: Если при электризации тело получает отрицательный заряд, это значит, что к атому присоединился отрицательный электрон. Как станет называться частица? (отрицательным ионом).
12 слайд: Какой сделаем вывод? Запишите его в тетрадь:
(Частица, которая получилась при отдаче (потере) электрона, называется положительным ионом.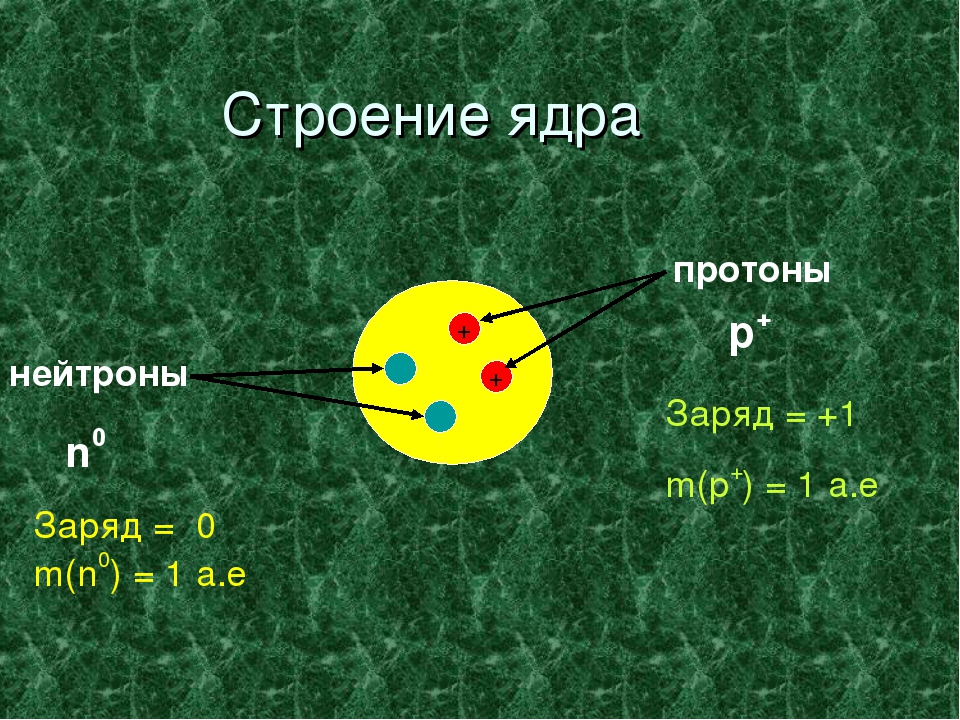
Частица, которая получилась при принятии (присоединении) электрона, называется отрицательным ионом.)
Вывод: вид атома не изменился.
13 слайд: Изменим число нейтронов в атоме.
Запишите в тетрадь:
Атомы одного вида, но имеющие разные числа нейтронов (разные массы), называются изотопами.
Сделайте вывод. (вид атома не изменился).
14 слайд: Изменим число протонов в атоме.
Вывод: (вид атома изменился). Получили новый химический элемент.
Запишите в тетрадь:
Вывод: Главная характеристика химического элемента не число электронов, а заряд ядра.
Динамическая пауза
Пока занимались мы, тихо, но прытко
В класс к нам пробралась сеньора ошибка.
Чтоб убралась она без оглядки
Сделать придется физическую зарядку.
Правильно – вверх, неверно – вперед,
Ответ посчитаем — ошибка уйдет.
Первичное закрепление изученного материала. (карточки на столах)
Упражнение 1. (устно)
В ядре атома бора 10 частиц. Вокруг ядра движутся 5 электронов. Сколько в ядре протонов и сколько нейтронов?
(Учащиеся получают жетоны)
Упражнение 2. (в группе)
Изобразить атом лития
Вопросы: От атома отделили один электрон, как будет называться данная частица? (изобразить).
Каков ее заряд?
(За верно выполненное задание получает жетон)
Упражнение 3. (в группе)
Изобразить атом бериллия
К атому присоединился один электрон, как будет называться данная частица? (изобразить)
Каков ее заряд?
(За верно выполненное задание получает жетон)
Самостоятельная работа
ТЕСТ (Учащиеся рассаживаются за компьютеры).
Тест на проверку знаний по теме: «Электризация тел» |
|
|||||
Вопрос 1. От какого слова произошло слово электричество»? |
||||||
Ответ: |
|
|
|
|
|
|
Вопрос 2. Как наэлектризовать тела? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 3. Что такое диэлектрик? |
|
|
|
|
||
Ответ: |
|
|
|
|
|
|
Вопрос 4. Бесконечно ли можно делить заряд? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 5. Какие частицы в атоме движутся вокруг ядра? |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 6. Как образуется из атома положительный ион? |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 7. Какой знак несет заряд электрона? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 8. В каких единицах измеряется заряд? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 9. Какие частицы входят в состав ядра атома? |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 10. Как называется прибор для обнаружения электрического заряда? |
|
|||||
Ответ: |
|
|
|
|
|
|
|
ВАШ РЕЗУЛЬТАТ |
|
|
|
|
|
Жетоны за тест
Итог урока
Подводя итог урока, ответьте на вопосы:
- Каков состав атома?
- Каков состав атомного ядра?
- Электрический заряд электрона?
- Как называется частица, присоединившая электрон?
- Как называется частица, потерявшая электрон?
- Назовите ученого, предложившего планетарную модель атома?
Рефлексия
(За ответы – жетоны). Подсчет жетонов. Выставление оценок
Домашнее задание
Д/з: § 30, ответить на вопросы, упр. 11
Урок заканчивается стихотворением поэта Валерия Брюсова, в 1922 году написал стихотворение, в котором провел аналогию между строением атома и Солнечной системой.
“Мир электрона”
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом —
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Их мудрецы, свой мир бескрайний
Поставив центром бытия,
Спешат проникнуть в искры тайны
И умствуют, как ныне я.
А в миг, когда из разрушенья
Творятся точки новых сил.
Кричат, в мечтах самовнушенья.
Что Бог свой светоч загасил.
Структура атома | Примечания, видео, контроль качества и тесты | 8 класс> Наука> Материя
Структура атома
Представление Дальтона о неделимости атома было полностью дискредитировано рядом экспериментальных данных, полученных учеными. В результате обширных исследований был сделан вывод, что атомы состоят из трех субатомных частиц: электронов, протонов и нейтронов.
Субатомные частицы атома
Масса субатомных частиц очень мала.Масса этих частиц не может быть выражена в граммах. Следовательно, их массы выражаются в другой единице, называемой атомной единицей массы. Эта атомная единица массы записывается как. м. u. коротко.
И протон, и электрон имеют электрический заряд. Этот заряд измеряется в единицах, кратко называемых кулонами.
1. Электронный
Характеристики электрона: Электрон — это отрицательно заряженная частица, находящаяся в атоме всех элементов.Электрон находится вне ядра в атоме. Единственный атом водорода содержит один электрон, все остальные содержат более одного электрона.
Источник: felipe1457.blogspot.comРис: Электрон
Масса: Масса электрона составляет примерно 1/1836 массы атома водорода. Масса атома водорода 1 а. м. u, следовательно, относительная масса электрона = 1/1836 a.м. u. Атомная масса — это единица массы, используемая для выражения относительных масс атомов. Он равен 9,109 х 10 -31 кг.
Зарядов: Обнаружено, что электрон несет 1,602 x 10 -19 кулонов отрицательного заряда. Было показано, что это количество заряда является наименьшим отрицательным зарядом, переносимым любой частицей. Таким образом, заряд, переносимый электроном, принимается за единицу отрицательного заряда (-1).
2. Протон
Характеристики протона Протон — это положительно заряженная частица, содержащаяся в атомах всех элементов.Они расположены в ядре атома. Только атомы водорода содержат один протон в своем ядре, атом всех остальных элементов содержит более одного протона.
а. Протон — это положительно заряженная частица, присутствующая в ядрах атомов всех элементов.
Источник: www.quora.comРис. Протон атома водорода
б. Масса : Масса протона практически равна массе атома водорода i.е. В 1836 раз больше, чем у электрона. Относительная масса элемента равна 1,005757 а. м. u. которая принимается равной 1 a. м. u. Абсолютная масса протона 1,672 x 10 -27 кг.
г. Заряд : Электрон на протоне равен по величине и противоположен по знаку электрону. Заряд, переносимый протоном, равен 1,602 x 10 -19 кулонов, что считается одной единицей положительного заряда (+). Таким образом, говорят, что протон несет единичный положительный заряд.
3. Нейтрон
Характеристики нейтронов Нейтрон — это нейтральная частица, находящаяся в ядре атома. Атомы всех элементов содержат нейтроны, кроме атома водорода, который не содержит нейтронов. Таким образом, элементарной частицей, отсутствующей в атоме водорода, является нейтрон. Атом водорода содержит только один протон и один электрон.
а. Заряд: Нейтрон не несет заряда, т.е. е. это нейтральная частица.
Источник: www.hk-phy.orgРис: Нейтрон
б. Масса: Масса нейтрона почти равна массе протона. Таким образом, относительная масса нейтрона = 1 а. м. u. а его абсолютная масса = 1,6 х 10 -27 кг.
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атомаВ оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc. Изучение различных электронных конфигураций в электронных оболочках вокруг ядра атомаАтомная модель электронных конфигураций.
Encyclopædia Britannica, Inc. Посмотрите все видео по этой статьеБольшая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств.В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил.После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасБольшая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать.Каждый отдельный атом состоит из более мелких частиц, а именно из электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы.Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов.Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома ядро еще более миниатюрное. Он находится в той же пропорции к атому, что и мрамор на футбольном поле. По объему ядро занимает всего 10 −14 метров пространства в атоме, то есть 1 часть на 100 000.Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метрам. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на небольшой размер ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов.Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы. Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.Например, если у атома Z = 6, это углерод, тогда как Z = 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
атом | Определение, структура, история, примеры, диаграммы и факты
Атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.Это также мельчайшая единица вещества, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Оболочечная модель атомаВ оболочечной модели атома электроны занимают разные энергетические уровни или оболочки. Оболочки K и L показаны для атома неона.
Encyclopædia Britannica, Inc. Изучение различных электронных конфигураций в электронных оболочках вокруг ядра атомаАтомная модель электронных конфигураций.
Encyclopædia Britannica, Inc. Посмотрите все видео по этой статьеБольшая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств.В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других случаях электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома и составляющих его частиц и сил.После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, сформулированных на протяжении веков. Для дополнительной информации, относящейся к структуре ядра и элементарным частицам, см. субатомных частиц.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасБольшая часть вещества состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать.Каждый отдельный атом состоит из более мелких частиц, а именно из электронов и ядер. Эти частицы электрически заряжены, и электрические силы, действующие на заряд, несут ответственность за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы.Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда. Протоны, нейтроны и окружающие их электроны — долгоживущие частицы, присутствующие во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов.Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, имеют размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1-2 Å. По сравнению с общим размером атома ядро еще более миниатюрное. Он находится в той же пропорции к атому, что и мрамор на футбольном поле. По объему ядро занимает всего 10 −14 метров пространства в атоме, то есть 1 часть на 100 000.Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 −15 метрам. Диаметр ядра зависит от количества содержащихся в нем частиц и колеблется от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на небольшой размер ядра, практически вся масса атома сосредоточена в нем. Протоны — массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов.Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их широкую вариацию массы. Самое легкое ядро, ядро водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Самой важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.Например, если у атома Z = 6, это углерод, тогда как Z = 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, так что положительный и отрицательный заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Загрузить структуру решений Atom PDF
Решения NCERT для науки класса 9 Глава 4: Структура атома Решения NCERT , представленные здесь, помогут студентам прояснить базовые концепции.Эти решения были подготовлены академическими экспертами с многолетним опытом. Мы предоставили ответы на все упражнения, а также на дополнительные вопросы, которые помогут студентам в учебе.
С помощью NCERT Solutions for Class 9 Science Chapter 4 студенты смогут понять концепции, связанные со структурой атома, его открытием, концепцией заряженной частицы, орбитальными оболочками, валентностью, атомным и массовым числом, и различные другие явления, связанные с атомом.Мы также предоставили вам PDF-файл «Решения для класса 9 по науке», глава 4, а также несколько советов по подготовке и практических вопросов.
ВАЖНЫЕ ВОПРОСЫ ДЛЯ ПРАКТИКИ НАУКИ КЛАССА 9 ГЛАВА 4
Решения NCERT для науки класса 9 Глава 4: Структура атома
Глава 4 Научный класс 9 посвящен открытию и структуре атома. Кроме того, студенты познакомятся с работами известных ученых, которые вместе со своими теориями разработали различные модели.Перед тем как перейти к главе 4 «Решения NCERT для класса 9, наука », давайте рассмотрим темы и подтемы в этой главе:
Также чек :
Решения NCERT для науки класса 9 Глава 4: Решенные упражнения и вопросы в тексте
Здесь мы предоставим вопросы к упражнениям в конце главы, а также ответы на интерактивные вопросы, чтобы учащимся не приходилось тратить свое драгоценное время на поиск решений.Студенты могут просмотреть это решение здесь, а также загрузить его в формате PDF. Решения для Science Chapter 4 Class 9, представленные здесь, на Embibe, решаются экспертами на легком для понимания языке для всех студентов CBSE Class 9 .
СКАЧАТЬ НАУК КЛАССА 9 ГЛАВА 4 РЕШЕНИЯ NCERT PDF
Загрузите NCERT Solutions for Class 9 Science также для других глав:
CBSE, класс 9, наука, глава 4, вопросы и ответы: описание главы
В этой главе вы узнаете об основных терминах, используемых при изучении атома, таких как атомный номер, атомная масса, нейтроны и валентность.Вы также узнаете о различных атомных моделях, их особенностях и ограничениях. Изучение начнется с заряженных частиц в веществе, а затем — с основной структуры атома.
Модель атома Томсона, Модель атома Резерфорда и Модель атома Бора объясняются, и изучаются ограничения этих моделей. Затем студенты будут знать, что такое снаряды и орбитали. Вы также познакомитесь с учеными, внесшими свой вклад в изучение атома.Наконец, вы познакомитесь с терминами — Изотопы и Изобары.
Класс 9, естественные науки Глава 4 Важные вопросы
Ниже мы расположили несколько важных и дополнительных вопросов, которые помогут студентам в подготовке к экзаменам:
| Тип короткого ответа Вопросы 1. Определите следующее: a) Атомный номер b) Массовый номер c) Валентность d) Изотопы e) Изобары 2. На основе модели атома Томсона объясните, насколько атом нейтрален в целом. 3. Нарисуйте эскиз модели атома Бора с тремя оболочками. 4. Если K- и L-оболочки атома заполнены, то каким будет общее количество электронов в атоме? |
| Тип длинного ответа Вопросы 1. Для символа «Водород, Дейтерий и Тритум» внесите в таблицу три субатомных частицы, обнаруженные в каждой из них. 2. Запишите электронную конфигурацию любой пары изотопов и изобар. 3. Сравните свойства электронов, протонов и нейтронов. 4. Как определить валентность хлора, серы и магния? 5. Опишите модель атома Бора. 6. Обобщите правила записи распределения электронов в различных оболочках для первых восемнадцати элементов. |
NCERT, класс 9, наука, глава 4 Советы по подготовке
Нет никаких конкретных советов, которые помогут вам пройти главу.Что вы можете сделать, так это составить правильное расписание занятий, быть уверенным, делать заметки, решать как можно больше вопросов и продолжать пересматривать. Используйте решения NCERT для PDF-файла с разделом 9 по науке, глава 4, предоставленные нами для справки, если вы застряли.
Если вы будете следовать приведенным выше советам, мы заверяем вас, что ваши оценки улучшатся.
Часто задаваемые вопросы, связанные с решениями NCERT для науки класса 9 Глава 4
Здесь мы предоставили некоторые из часто задаваемых вопросов, относящихся к научному решению Класса 9 Глава 4:
Q1: На основе модели атома Томпсона объясните, почему атом нейтрален в целом. A: Согласно модели атома Томпсона,
(i) атом содержит положительно заряженную сферу, в которую имплантированы отрицательно заряженные электроны.
(ii) Электроны и протоны равны по величине, следовательно, атом в целом электрически нейтрален.
A: Набросок модели атома Бора выглядит следующим образом:
A: В эксперименте по рассеянию ∝-частиц, когда вместо золота используется любая другая металлическая фольга,
ОТВЕТ КЛЮЧ: СОЗДАТЬ АТОМ ЧАСТЬ I: ЭКРАН АТОМА Построить симуляцию атома (атом)
Блок 2 Атомная структура
Раздел 2 Атомная структура Большая идея: Атомная структура объясняет закономерности в поведении элементов и позволяет нам предсказать химическое и физическое поведение данного элемента.Организация элементов
Дополнительная информацияСОДЕРЖАНИЕ ЭНЕРГИИ ИОНИЗАЦИИ
ИОНИЗАЦИЯ ЭНЕРГИЯ ИОНИЗАЦИЯ ЭНЕРГИЯ СОДЕРЖАНИЕ Что такое энергия ионизации? Определение t энергии ионизации Что влияет на энергию ионизации? Общее изменение по периодам Вариация по группам вниз Вариант
Дополнительная информацияSCPS Chemistry Worksheet Периодичность A.Таблица Менделеева 1. Какие металлы? Обведите свои ответы: C, Na, F, Cs, Ba, Ni
SCPS Chemistry Worksheet Периодичность A. Периодическая таблица 1. Какие металлы? Обведите свои ответы: C, Na, F, Cs, Ba, Ni. Какой металл в приведенном выше списке имеет наиболее металлический характер? Объясни. Цезий как
Дополнительная информация2 Строение атомов
ГЛАВА 4 2 СТРУКТУРА АТОМОВ РАЗДЕЛ АТОМЫ КЛЮЧЕВЫЕ ИДЕИ Читая этот раздел, имейте в виду следующие вопросы: Что общего у атомов одного и того же элемента? Что такое изотопы? Как устроен элемент
Дополнительная информацияТаблица ионов и их зарядов
Ионы и их заряды Рабочий лист Имя Дата Учитель Схема зарядов на основе групп периодической таблицы, включая переходные металлы и благородные газы: IA IIA Transition IIIA IVA VA VIA VIIA VIIIA металлов
Дополнительная информацияБЛОК (2) АТОМЫ И ЭЛЕМЕНТЫ
БЛОК (2) АТОМЫ И ЭЛЕМЕНТЫ 2.1 Элементы Элемент — это фундаментальное вещество, которое не может быть расщеплено химическим путем на более простые вещества. Каждый элемент представлен аббревиатурой
. Дополнительная информацияТенденции дневника периодической таблицы
Тенденции дневника периодической таблицы Тенденции — это модели поведения, которым следуют атомы в периодической таблице элементов. Тенденции сохраняются большую часть времени, но есть исключения или всплески, когда
Дополнительная информацияСОДЕРЖАНИЕ ЭНЕРГИИ ИОНИЗАЦИИ
ИОНИЗАЦИЯ ЭНЕРГИЯ ИОНИЗАЦИЯ ЭНЕРГИЯ СОДЕРЖАНИЕ Что такое энергия ионизации? Определение t энергии ионизации Что влияет на энергию ионизации? Общее изменение по периодам Вариация по группам вниз Вариант
Дополнительная информацияПРОТОНЫ И ЭЛЕКТРОНЫ
отражать. Представьте, что у вас есть миска с апельсинами, бананами, ананасами, ягодами, грушами и арбузом.Как вы определяете каждый фрукт? Скорее всего, вы знакомы с характеристиками
Дополнительная информацияМодель атома Бора
Модели Бора Модель атома Бора фокусируется на электронах и их расположении. Бор заявил, что электроны движутся с постоянной скоростью по фиксированным орбитам вокруг ядра, как планеты вокруг Солнца. Бор
Дополнительная информацияПЕРИОДИЧЕСКАЯ ТАБЛИЦА.отражать
размышлять Предположим, вы хотите организовать свой шкафчик в школе. Как можно было все разделить и организовать организованно? Вы можете разместить книги, блокноты и папки на отдельной полке
Дополнительная информацияПериодическая таблица вопросов
Вопросы о таблице Менделеева 1. Элементы, характеризуемые как неметаллы, расположены в таблице Менделеева в (1) крайнем левом углу; (2) низ; (3) центр; (4) вверху справа.2. Элемент, который является жидкостью на STP, составляет
Дополнительная информацияТенденции основ периодической таблицы
Тенденции Основ Периодической таблицы Тенденции — это модели поведения, которым следуют атомы в периодической таблице элементов. Тенденции сохраняются большую часть времени, но есть исключения или всплески, когда
Дополнительная информацияПериодическая таблица, валентность и формула
Периодическая таблица, валентность и формула Происхождение периодической таблицы Мендельев в 1869 году предположил, что существует связь между химическими свойствами элементов и их атомными массами.Он заметил
Дополнительная информацияМолекулярные модели в биологии
Молекулярные модели в биологии Цели: После этой лабораторной работы студент сможет: 1) Понять свойства атомов, образующих связи. 2) Понять, как и почему атомы образуют ионы. 3) Модель ковалентная,
Дополнительная информациянейтроны присутствуют?
Лист заданий AP Chem Summer # 1 Атомная структура 1.а) Для иона 39 K + укажите, сколько электронов, сколько протонов и сколько 19 нейтронов присутствует? б) Какая из этих частиц имеет наименьшее
Дополнительная информация19.1 Связь и молекулы
Большая часть материи вокруг вас и внутри вас находится в форме соединений. Например, ваше тело на 80 процентов состоит из воды. В последнем разделе вы узнали, что вода, H 2 O, состоит из водорода и
Дополнительная информация Банк вопросовдля 9-го класса Научная структура атома 9-я научная структура CBSE атома
Переключить навигацию 00
- Железные дороги
- UPSC
- Банковское дело
- SSC
- CLAT
- JEE Main & Advanced
- NEET
- NTSE
- KVPY
- Обучение
- Оборона
- 12-й класс
- 11-й класс
- 10-й класс
- 9 класс
- 8-й класс
- 7-й класс
- 6-й класс
- 5 класс
- 4-й класс
- 3-й класс
- 2-й класс
- 1-й класс
- Другой экзамен
- Дошкольное образование
- Государственные экзамены депутата
- Государственные экзамены UP
- Государственные экзамены Раджастана
- Государственные экзамены Джаркханда
- Государственные экзамены Чхаттисгарх
- Государственные экзамены Бихара
- Экзамены штата Харьяна,
- Государственные экзамены Гуджарата
- Государственные экзамены MH
- Государственные экзамены штата Химачал
- Государственные экзамены Дели
- Государственные экзамены Уттаракханда
- Государственные экзамены Пенджаба
- Государственные экзамены J&K
- Видео
- Учебные пакеты
- Серия испытаний
- Решения Ncert
- Образцы статей
- Банк вопросов
- Ноты
- Решенные статьи
- Текущие дела

 (Приложение № 5)
(Приложение № 5)

 Но это не просто числа, они имеют физический смысл.
Но это не просто числа, они имеют физический смысл. Экспериментально доказано, что ядро состоит из протонов (положительных частиц) и нейтронов (нейтральных частиц) ( слайд 23)
Экспериментально доказано, что ядро состоит из протонов (положительных частиц) и нейтронов (нейтральных частиц) ( слайд 23)

 Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева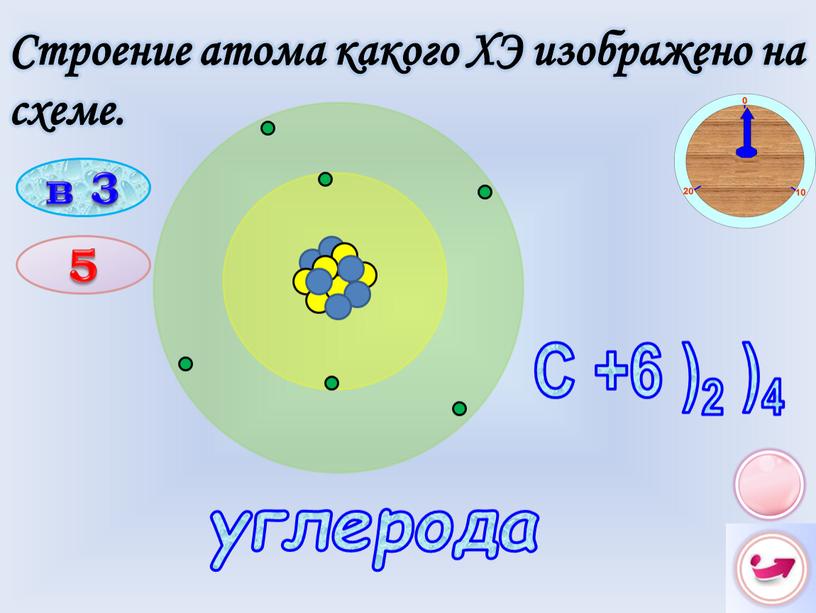
 Актуализация знаний и мотивация деятельности
Актуализация знаний и мотивация деятельности
 Рефлексия деятельности (итог урока)
Рефлексия деятельности (итог урока) Почему такой цепи нет у железнодорожной цистерны?
Почему такой цепи нет у железнодорожной цистерны?