Урок 30. ковалентная химическая связь.полярная и неполярная ковалентная связь — Химия — 8 класс
Урок Конспект Дополнительные материалы КонспектКовалентная химическая связь. Полярная и неполярная ковалентная химическая связь
Неметаллы имеют на внешнем уровне большее число электронов, чем металлы: ки-слород – , азот, хлор, фтор, водород.
Поэтому способ образования химической связи у них иной.
•
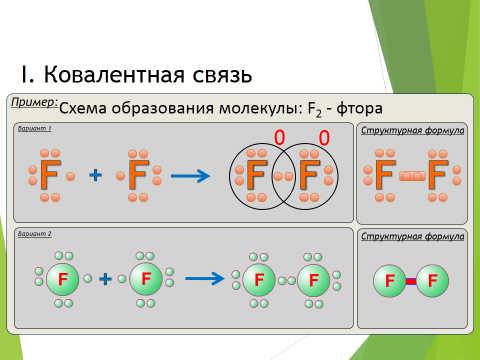
Молекула хлора состоит из двух атомов хлора. На внешнем энергетическом уровне хлора содержится семь электронов. Два атома объединяют свои электроны, в результате образуются общие электронные пары:
Общую электронную пару можно заменить чёрточкой: Cl – Cl (графическая формула).
Общих электронных пар может быть несколько:
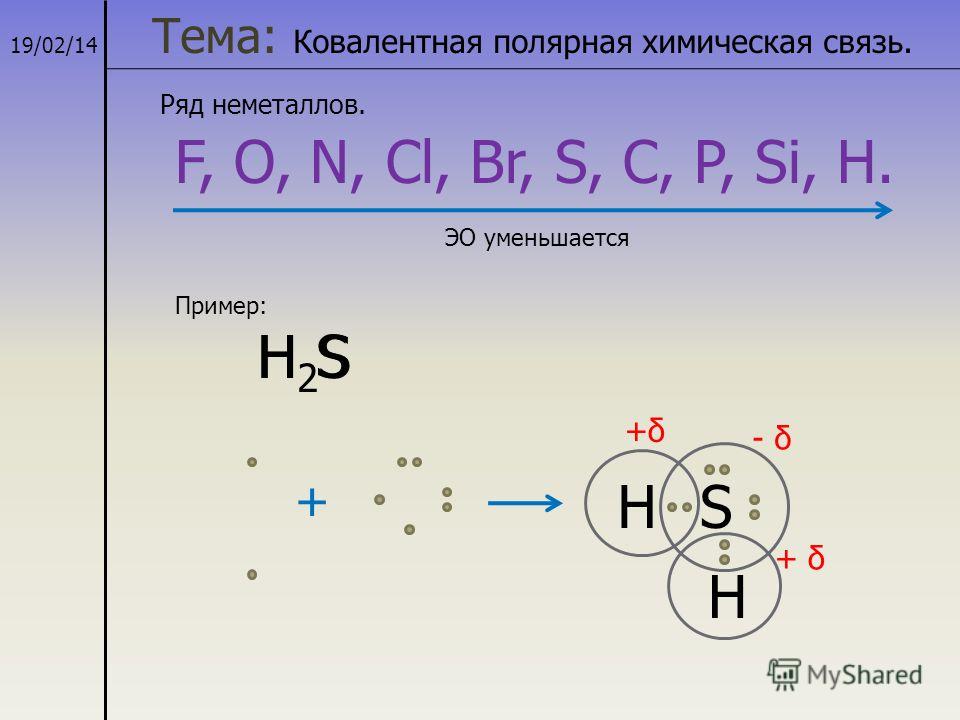
Подобным образом соединяются атомы кислорода и водорода в молекуле воды. Атом кислорода обладает более высокой электроотрицательностью и притягивает к себе электронные пары:
Поэтому на кислороде будет возникать частичный отрицательный заряд, на атомах водорода – частичный положительный заряд.
В зависимости от наличия смещения общих электронных пар к одному из атомов химических элементов различают ковалентную полярную и ковалентную неполярную химическую связь. Полярная ковалентная связь образуется между атомами химических элементов с разным значением относительной электроотрицательности, поэтому общая электронная пара смещена в сторону одного из атомов. Неполярная ковалентная связь образуется между атомами с одинаковым значением относительной электроотрицательности, поэтому общая электронная пара одинаково притягивается к ядрам взаимодействующих атомов.
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H2, O2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2:
σ
Cl – Cl , σ (p – p) — одинарная связь
Демонстрация образования молекулы водорода
Рассмотрим механизм образования молекулы кислорода:
О2 – кнс.
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p – p)
и одна π (р – р)
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных
неметаллов, отличающихся по значениям электроотрицательности (Например,
HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Элемент | K | Na | Ca | Al | H | Br | N | Cl | O | F |
ЭО | 0.82 | 0.93 | 1 | 1.61 | 2.2 | 2.96 | 3.04 | 3.16 | 3.44 | 4.0 |
Механизм образования связи.
Каждый атом
неметалла отдает в общее пользование другому атому свои наружные не спаренные
электроны. Образуются общие электронные пары. Общая электронная пара смещена к
более электроотрицательному элементу.
Образуются общие электронные пары. Общая электронная пара смещена к
более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:
Структурная формула молекулы НCl:
σ
Н → Cl ,
σ (s – p)
— одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)
Свойства ковалентной связи
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О→Спо донорно-акцепторному механизму |
155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в
молекуле аммиака NH3 и четырёхвалентен в ионе
аммония NH4+ (валентные возможности
расширяются за счёт участия неподелённой электронной пары атома азота в
образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность* – обуславливает форму молекулы в пространстве.
* — подробнее будет изучено в старших классах. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. (см. «гибридизация»)
Закрепление
№2. Напишите механизм образования молекул с ковалентным типом связи, определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
Ковалентная полярная химическая связь. 8-й класс
Цели:
изучить механизм образования ковалентной полярной химической связи.Задачи:
- Образовательные:
- изучить механизм образования ковалентной полярной химической связи;
- научиться составлять электронные формулы молекул веществ с ковалентной полярной связью;
- ввести понятие электроотрицательности и на основе этого объяснить природу ковалентной полярной связи.
- Развивающие:
- закрепить знания учащихся о распределении электронов в атоме;
- формировать умения написания электронных формул веществ;
- формировать умения определять вид ковалентной связи.
- Воспитательные:
- воспитывать умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.

- воспитывать умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.
Тип урока: комбинированный.
Оборудование:
- Презентация в PowerPoint.
- Периодическая система химический элементов Д.И.Менделеева.
- Учебник: О.С.Габриелян, Химия, 8 класс, часть 1.
ХОД УРОКА
1. Организационный момент
Учитель: Добрый день! В начале урока давайте вспомним с вами тот материал, который изучался нами на предыдущем уроке.
2. Актуализация знаний
Слайд 1. Дается задание конкретному ученику и всему классу.
Слайд 2.
Учитель: Мы условно разделили элементы на металлы и неметаллы. Рассмотрели, как образуются связи между атомами металлов и неметаллов (как называется такой вид связи?), между атомами одного и того же элемента неметалла (как называется такой вид связи?)
Ученики (вставляют пропущенные фразы): ионная связь, ковалентная неполярная.
Слайд 3.
Учитель: А какой тип связи мы можем ожидать при образовании соединений между атомами разных неметаллов?
Ученики: Вероятно, тоже ковалентную, но, какую?
Слайд 4.
Учитель: Да, очевидно, опять ковалентную связь – засчет образования общих электронных пар.
Но ведь элементы – то разные!!!
Наверное, следует ожидать, что такая ковалентная связь будет отличаться от рассмотренной ранее ковалентной связи.
Слайд 5.
Учитель: Атомы разных элементов по-разному относятся к общим электронным парам: те неметаллы, что сильнее, будут сильнее оттягивать к себе общие электронные пары, совсем как у Крылова: «У сильного всегда бессильный виноват…»
3. Изучение нового материала
Изучение нового материала
Слайд 6.
Учитель: Давайте запишем с вами сегодняшнее число и тему урока: «Ковалентная полярная связь».
Слайд 7.
Учитель: Цель нашего урока:
1. Продолжить формирование понятия о ковалентной химической связи.
2. Познакомить учащихся с полярной ковалентной химической связью и электроотрицательностью (ЭО) как мерой неметалличности элементов.
3. Продолжить формирование умения записывать схемы образования молекул бинарных соединений элементов – неметаллов.
Слайд 8.
Учитель: Что же такое электроотрицательность? Запишите это определение к себе в тетрадь. Способность атомов химических элементов оттягивать к себе общие электронные пары, называется электроотрицательностью (ЭО).
Слайд 9.
Учитель: Посмотрите на данный слайд. На нем расположен ряд электроотрицательности элементов в порядке возрастания. Значит, самым электроотрицательным элементом будет…
Ученики: Фтор.
Учитель: Правильно. Такой же ряд есть в ваших учебниках. Найдите его. Он располагается на последней странице, где расположена таблица растворимости кислот, оснований и солей (учитель показывает место нахождения этого ряда в учебнике).
Ответьте мне на вопрос: Какой из элементов будет более электроотрицательным – углерод или азот?
Ученики: Азот, т.к. он располагается правее углерода и ближе к самому электроотрицательному элементу – фтору.
Учитель: Правильно.
Слайд 10.
Учитель: Запишите в тетрадь (на странице 64, §11) как изменяется ЭО в периоде и подгруппе (смотрите запись курсивом со слов: в каждом периоде…) – работа с учебником.
Слайд 11.
Учитель: Ряд электроотрицательности элементов поможет вам определить, в сторону атомов какого химического элемента будут смещены общие электронные пары, а, следовательно, на каком из атомов будет избыточный отрицательный заряд (он будет обозначаться буквой «δ» – греч.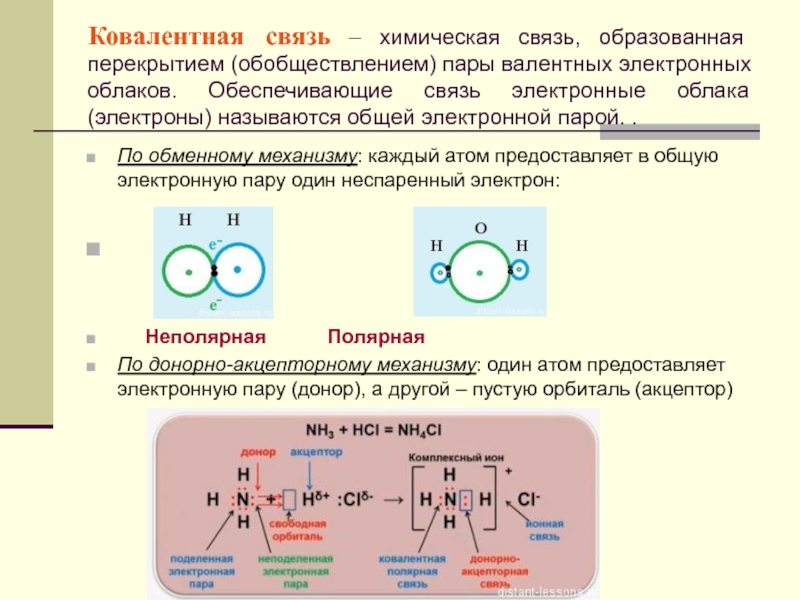 дельта), а, значит, где будет отрицательный полюс молекулы.
дельта), а, значит, где будет отрицательный полюс молекулы.
Слайд 12.
Учитель: Разумеется, атомы менее электроотрицательного элемента будут иметь избыточный положительный заряд, т.е. будут представлять собой как бы положительный полюс молекулы с зарядом δ+.
Вот вам и стало понятно название этой разновидности ковалентной связи – полярная.
Слайд 13.
Учитель: Между атомами одного и того же элемента неметалла, т.е. с одинаковой электроотрицательностью, общие электронные пары не смещеныни к одному из атомов, поэтому они не имеют заряда – полюса и это неполярная ковалентная связь.
Слайд 14.
Учитель: Теперь давайте с вами запишем алгоритм образования молекулы SCl2.
Слайд 15.
Учитель:
1. Определить число внешних электронов у атомов неметаллов и по формуле 8 – N число неспаренных электронов (где N номер группы, в которой расположен химический элемент). Записать электронные формулы атомов:
Слайд 16.
2. Записать символ элемента – неметалла, который представлен одним атомом (S), в центр и знаком «плюс» – два атома другого элемента (Сl):
Слайд 17.
3. Записать электронную и структурную формулы получившейся молекулы:
→
→
Сl – S – Cl
Слайд 18.
4. Определить по ряду электроотрицательности, к атомам какого из элементов смещены общие электронные пары, и заменить черточки маленькими стрелками, обозначить полюса:
Clδ– ← Sδ+ → Clδ–
Слайд 19.
Учитель: Давайте теперь с вами закрепим изученный материал. Для этого выполним упражнение 2 на странице 66.
Учитель: Подведем итог сегодняшнего урока, выставим оценки.
4. Домашнее задание
Учитель: Домашним заданием вам будет следующее –
- §11, закончить 2, стр. 66
- Повторить все виды химической связи: определения, механизм образования.
– Всем спасибо!!!
Используемая литература:
- О.С.Габриелян, Химия. 8 класс, часть 1 – М.: Дрофа, 2008.
- О.С.Габриелян, Н.П.Воскобойникова, А.В.Яшукова. Химия. Настольная книга учителя. 8 класс – М.: Дрофа, 2007.
Ковалентная полярная химическая связь — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 11. Электроотрицательность (ЭО) — это способность атомов оттягивать к себе электронные пары.
2.
3. Если ковалентная химическая связь образуется между атомами разных элементов-неметаллов, то общие электронные пары смещены в сторону более электроотрицательного элемента. На нём возникает избыточный отрицательный заряд, а на атоме-партнёре — избыточный положительный заряд. Такая связь называется ковалентной полярной.
4.
5. Дополните таблицу «Ковалентная полярная связь».
ЧАСТЬ 2
1. Поиграйте в «крестики-нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной полярной связью, и запишите схемы их образования.
2. Выберите формулы соединений с ковалентной полярной химической связью. Из букв, соответствующих правильным ответам, вы составите слово, означающее имитацию алмаза или другого драгоценного камня, выполненного из стекла: страз.

1) HF С
3) FeBr3 Т
5) SO2 Р
7) CO2 А
9) PCl5 З
3. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одного периода. Точные значения электроотрицательности найдите с помощью Интернета. Сделайте вывод:
С увеличением порядкового номера ЭО растёт.
4. Постройте график зависимости порядкового номера химического элемента от электроотрицательности элементов одной главной подгруппы. Точные значения электроотрицатель¬ности найдите с помощью Интернета.
В группе с увеличением порядкового номера ЭО уменьшается.
5. Наиболее полярной является химическая связь в молекуле:
4) фтороводорода — HF
6. Расположите следующие вещества в порядке уменьшения полярности химической связи.
4) фосфид калия — К3Р
2) фосфид алюминия — АlР
3) хлорид фосфора (V) — РСl5
1) белый фосфор — Р4
| 1. |
Характеристика ковалентной связи
Сложность: лёгкое |
1 |
| 2. |
Образование ковалентной неполярной связи
Сложность: лёгкое |
1 |
3.
|
Образование ковалентной полярной связи
Сложность: лёгкое |
1 |
| 4. |
Неспаренные электроны
Сложность: среднее |
2 |
| 5. |
Число общих электронных пар
Сложность: среднее |
2 |
6.
|
Формулы веществ с ковалентной связью
Сложность: среднее |
3 |
| 7. |
Длина ковалентной связи
Сложность: среднее |
3 |
| 8. |
Изменение длины связи
Сложность: сложное |
4 |
9.
|
Прочность связи
Сложность: сложное |
4 |
Ковалентная полярная связь. Электроотрицательность
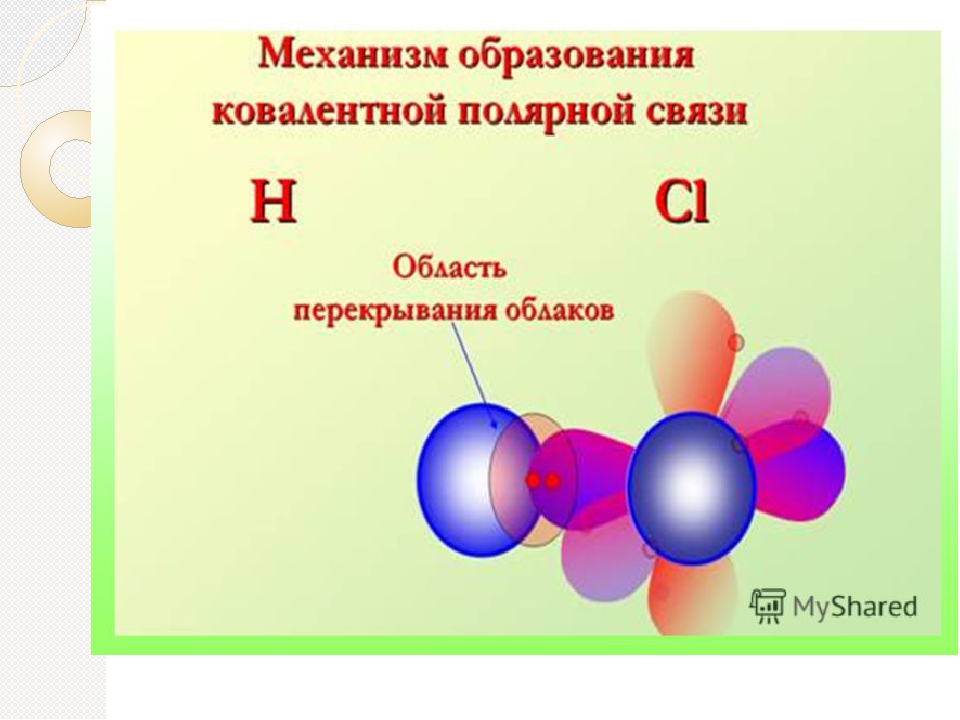
Основной особенностью ковалентной полярной связи является то, что она образуется между атомами различных неметаллов. Как, например, в молекуле HCl. У атома водорода в нашем случае один неспаренный электрон, ему до завершения внешнего энергетического уровня не хватает одного электрона. У атома хлора семь электронов на внешнем уровне, один из которых неспаренный, ему тоже не хватает одного электрона до завершения уровня. Тогда атом водорода и атом хлора объединяют свои неспаренные электроны и между ними образуется химическая связь. Эту связь тоже можно изобразить в виде чёрточки.
Образовавшаяся общая электронная пара не в равной степени будет принадлежать этим атомам. Для этой оценки используют понятие электроотрицательности. Электроотрицательность (ЭО) – способность атомов химического элемента притягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность
служит характеристикой металличности и неметалличности химических элементов.
Первое место по электроотрицательности занимает фтор, он же самый
неметаллический, второе место занимает кислород и третье – азот.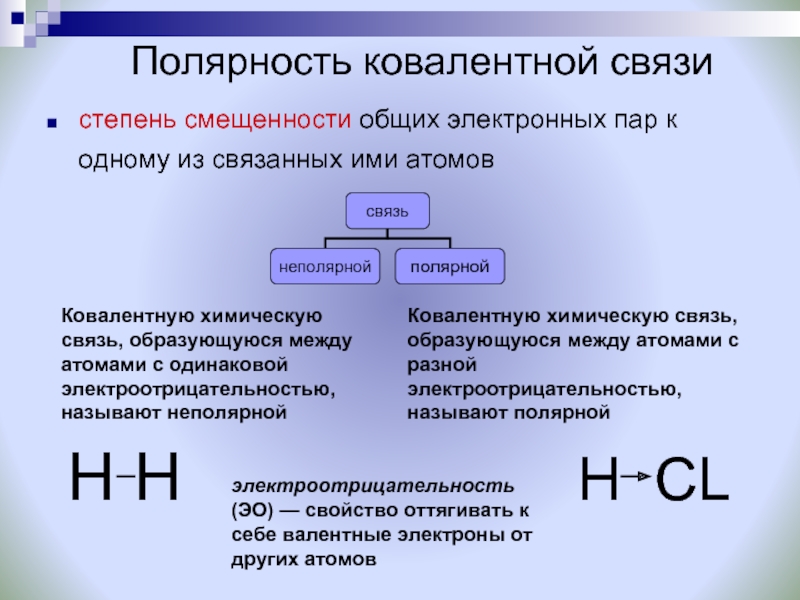
Т.к. электроотрицательность – мера металличности, то она, как правило, по периодам и группам изменяется в той же последовательности, т.е. в периодах слева направо увеличивается, а в группах сверху вниз уменьшается.
Посмотрев на молекулу HCl, можно с уверенностью определить, что в данной молекуле более электроотрицательный атом хлора, поэтому общая электронная пара будет смещена больше к нему. В результате этого, на атомах появляются частичные заряды. Смещение электронной плотности показывается стрелкой, а частичные заряды буквой дельта. В молекуле появляется два полюса: положительный и отрицательный, поэтому такую связь называют полярной.
Механизм образования связей в молекуле воды (Н2О)
Водород – элемент IA группы, значит, у него один электрон, который участвует в образовании химической связи. У второго атома водорода тоже один электрон, который участвует в образовании химической связи. Атом кислорода находится в VIA группе, поэтому у него на внешнем уровне 6 электронов, а число неспаренных находим по формуле 8 – 6 = 2. Эти два электрона и будут участвовать в образовании химической связи. Неспаренные электроны объединяются и образуется две общие электронные пары. Из этих атомов более электроотрицательный кислород, поэтому именно к нему будут смещены общие пары электронов и молекула будет полярной, связь – ковалентной полярной.
Доказано, что молекула воды на самом деле имеет не линейное строение, а угловое. В этой молекуле атом водорода связан только одной связью с кислородом, а кислород двумя связями с атомами водорода. Это число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же или других элементов, называется валентностью.
Условно
валентность обозначается черточкой, когда необходимо записать
структурные формулы. Например, в молекуле NH3,
атом азота связан с тремя атомами водорода. Поэтому говорят, азот
трехвалентен. В молекуле СН4четырехвалентный углерод
связан с одновалентными атомами водорода.
Например, в молекуле NH3,
атом азота связан с тремя атомами водорода. Поэтому говорят, азот
трехвалентен. В молекуле СН4четырехвалентный углерод
связан с одновалентными атомами водорода.
Следует различать элементы с постоянной и переменной валентностью. Элементами с постоянной валентность являются:
· H, Cl, F – одновалентные,
· О – двухвалентный,
· B, Al – трехвалентные.
Элементы с переменной валентностью: S, N, C, P и др.
Для вывода формулы соединения азота с кислородом, где азот четырехвалентен, нужно сделать так: записываем знаки NO. Над знаками элементов ставим валентности римскими цифрами. У азота она дана по условию – четыре, у кислорода она постоянная и равна двум. Найдем наименьшее общее кратное между валентностями. Наименьшее общее кратное равно четырем. Разделим наименьшее общее кратное на валентности и получим индексы. Четыре делим на четыре будет единица, помните, индекс единица не ставится, затем четыре делим на два, будет два, следовательно, индекс у кислорода будет два.
Аналогично поступают, когда по формуле, необходимо найти валентности элементов. Определим валентность фосфора в соединении Р2О3. У кислорода, как нам известно, валентность постоянная и равна двум. Определим число валентностей всех атомов кислорода, для этого 2 умножим на три, будет шесть. Разделим шесть на число атомов фосфора, т.е. на два, в результате будет три, значит, валентность фосфора в нашем случае равна трем.
Ковалентная неполярная связь. Химия. 8 класс. Конспект урока
УМК «Химия. 8 класс» О. С. Габриеляна.
С. Габриеляна.
Тип урока: изучение нового материала.
Цель урока: продолжить знакомство учащихся с типами химической связи.
Задачи:
- познакомить с ковалентной химической связью и её видом – неполярной связью;
- научить записывать схемы образования ковалентной неполярной связи;
- формировать понятие о кратности связи;
- формирование умение выделять главное, делать выводы;
- стимулирование познавательной активности учащихся, развитие познавательного интереса к предмету.
Использованные источники:
- Габриелян О.С. Химия. 8 класс – М.: Дрофа, 2012г.
- Габриелян О.С. Настольная книга учителя. Химия. 8 класс – М.: Дрофа, 2012г.
- Штремплер Г.И. Химия на досуге. Загадки, игры, ребусы — М.: Просвещение, 1993г.
- Алигберов А.И.Занимательная химия- М., Просвещение, 2002 г.
Оборудование: периодическая система химических элементов, магнитофон, «Следы колобков», карточки с заданиями.
Уроки изучения нового материала, проведенные в необычной игровой форме, особенно на начальных этапах изучения химии помогают развитию познавательного интереса к предмету, снимают психологические моменты (трудность восприятия, сложность предмета), помогают привлечь в работу на уроке максимальное число учащихся.
Одним из таких уроков является урок изучения нового материала с необычным названием «Волшебный конверт» (детективная история). В основу – положен игровой момент – «подслушанный разговор ночной разговор известных детских киногероев Колобков», который и обыгрывается потом на уроке. Поэтому, необходимо создать соответствующий настрой – музыкальное сопровождение беседы Колобков (монтаж из фильмов), портреты Колобков, спрятанные по кабинету «следы» и т. д.
д.
Ход урока
I. Актуализирующее начало
Случилось это вчера вечером. Было уже совсем поздно… На улице темно и неуютно.… Все дома заснули — а я всё готовлюсь к урокам. Нервничаю… Переживаю.… Устало опускаю голову и, о, боже засыпаю. … И в это короткий миг между сном и явью мне вдруг показалось, что слышу я чьи – то голоса.… Всё … Галлюцинации. … Не может быть. … Нет снова … Голоса все громче и громче … Спорят. … Ругаются. Прислушиваюсь и узнаю их. Да это же Колобки…
Да и история очень уж интересная. Слушаю …. Удивляюсь. … Ухмыляюсь.… Просыпаюсь.… Смотрю в окно. … И всё забываю.… Решаю – галлюцинации. Прихожу в школу, открываю кабинет. И …. Вижу их портрет и записку. Прочитаем?
|
Уважаемая Ирина Александровна! Услышанная вами история является чистой правдой!!!! Нам кажется, что эта история будет полезной и познавательной для всех восьмиклассников, ведь в город, в который мы совершили путешествие по анонимному звонку женщины, вам как химикам, тоже будет полезно побывать. Но чтобы попасть в этот город Вам надо воспользоваться нашими подсказками… Следы от наших ног еще не смыла вода. P. S. Чтобы следы оказались полезными напишите электронную и молекулярную формулы тех веществ, о которых идет речь. Дерзайте !!! |
II. Анализ знаний учащихся
(Работа учащихся у доски по составлению электронных и молекулярных формул веществ с подробными комментариями)
** Это чисто «алюминиевый минерал» – боксит состоит из двух элементов:
Из глины я обыкновенной
Но я на радость современный
Я не боюсь электротока
Бесстрашно в воздухе лечу
Служу на кухне я без срока
Мне все задачи по плечу
Горжусь своим я именем:
Зовусь я … алюминием!
Я жилец квартиры восемь
Я могу зажечь на спор
Спичку, свечку и костёр
Кто вам всем дышать даёт,
Атмосферный кислород.
*Рубин (карбункул) – это окрашенная в кроваво–красный цвет, прозрачная разновидность минерала корунда (его формулу вам и надо написать) – «кто яхонт червленый при себе носит, снов страшных и лихих не видит» — прозрачная, блестящая, окрашенная в синий
цвет другая разновидность корунда называется сапфиром.
(задание следа дифференцировано и рассчитано на разные классы: обязательно написание молекулярной формулы, а электронной только в сильном классе)
Расположите следы по порядку и прочитайте слово.
- Какая связь существует между полученным словом и отгаданными нами веществами?
- Какой тип связи во всех этих веществах?
- Что такое ион?
- Какие силы лежат в основе притяжения ионов?
- Как образуются ионы? Как образуются положительно заряженные ионы? Как образуются отрицательно заряженные ионы?
- Какое еще определение ионной связи можно дать?
Ой, что это? Еще одна записка?! Действительно. …
И как мы её не заметили? Прочитаем.
III. Изучение нового материала
(Идёт параллельно чтению записки и работой с картинами – загадками)
|
Молодцы! Вот вы и дошли до пункта назначения.… Не забудьте, заветное слово вам еще пригодится. А вот он и город. Посмотрите вокруг.… Удивились? … Мы тоже – одни близнецы – двойники. Да такие дружные.…* Жаль, что разговаривать с вами они не будут. Но мы всё записали – читайте. Угадали вещества? Но чтобы приблизиться к разгадке тайны, воспользуйтесь подсказками нашей коллеги – криминалиста Колбочкиной:
Ирина Александровна! Вы не спите? Подсказывайте…** Молодцы!!! Много узнали нового? Мы тоже… Так кто же пригласил нас в этот город? Мы догадались. А вы? Кто она – химическая связь? Какие её типы Вы знаете? А чтобы быть уверенными, напишите на наших визитках ответы на наши вопросы (не забудьте указать координаты!)*** До свидания! Не прощаемся! До скорой встречи! |
*Вниманию учащихся предлагается макет дома, квартиры в котором занимают картинки с изображением близнецов. Учащиеся читают задания на картинках и отгадывают загадки. После этого продолжается чтение записки и выполнение заданий с подробными комментариями.
|
Жили в этой квартире 2 старичка. Ростом они были невелики, зато глаза у них были большие и голубые. На месте не стояли ни минутки. Говорили много. Хвастались. — Сколько нам лет? — Не помним! Родились … в 1787 году,… а может быть раньше… — Как зовут? — «Рождающие воду»…, а вообще… не помним…»
Н2 Н–Н |
А здесь живут высокие поэты. Их стихи пользуются неизменным успехом
Поэзия есть тот же кислород.
Но стихи их нам бывает понять тяжело.
О2 О=О |
|
Странные эти братья. Не от мира сего. А главное – высокого мнения о себе. Парят в облаках и постоянно смотрят на всех свысока. Ведь, как они говорят, без них нет жизни на Земле. Они — составная часть, какой – то белковины, которую плетут круглосуточно с самого рождения.
N2 N≡N |
|
**Объяснение учителя (подробное объяснение учителя механизма образования ковалентной связи, её кратности, длины, электронных и структурных формул, запись основных положений в тетрадь)
Подводим итог, связь, образующаяся за счет обобществления электронов, называется ковалентной связью.
Ковалентная связь – это связь, возникающая в результате образования общих электронных пар (запись в тетради).
Ковалентная неполярная связь – это связь, возникающая в результате образования общих электронных пар между атомами одного и того же элемента – неметалла.
IV. Закрепление знаний
Вот такая история приключилась с нами. Именно её я просто забыла. А вот колобкам спасибо! Ведь именно они помогли мне объяснить новый материал. Спасибо колобкам! Спасибо Вам!
Домашнее задание §10.
типов химических облигаций | Химия [Магистр]
Введение в склеивание
Химическая связь описывает множество взаимодействий, которые удерживают атомы вместе в химических соединениях.
Цели обучения
Перечислите типы химических связей и их общие свойства
Основные выводы
Ключевые моменты
- Химические связи — это силы, которые удерживают атомы вместе, чтобы образовать соединения или молекулы.

- Химические связи включают ковалентные, полярные ковалентные и ионные связи.
- Атомы с относительно схожей электроотрицательностью разделяют между собой электроны и связаны ковалентными связями.
- Атомы с большой разницей в электроотрицательности переносят электроны с образованием ионов. Затем ионы притягиваются друг к другу. Это притяжение известно как ионная связь.
Ключевые термины
- связь : связь или сила между соседними атомами в молекуле или соединении.
- ионная связь : притяжение между двумя ионами, используемое для создания ионного соединения. Это притяжение обычно возникает между металлом и неметаллом.
- ковалентная связь : взаимодействие между двумя атомами, которое включает в себя совместное использование одного или нескольких электронов, чтобы каждый атом удовлетворял правилу октетов. Это взаимодействие обычно возникает между двумя неметаллами.
- внутримолекулярный : относится к взаимодействиям внутри молекулы.
- межмолекулярные силы : Относится к взаимодействиям между двумя или более молекулами.
Химические связи
Химические связи — это связи между атомами в молекуле. Эти связи включают в себя сильные внутримолекулярные взаимодействия , такие как ковалентные и ионные связи. Они связаны с более слабыми межмолекулярными силами , такими как диполь-дипольные взаимодействия, лондонские дисперсионные силы и водородные связи. Более слабые силы будут обсуждены в более поздней концепции.
Химические связи : На этих рисунках показаны примеры химической связи с использованием точечной нотации Льюиса.Водород и углерод не связаны, в то время как в воде существует одинарная связь между водородом и кислородом. Связи, особенно ковалентные связи, часто представляют в виде линий между связанными атомами. Ацетилен имеет тройную связь, особый тип ковалентной связи, который будет обсуждаться позже.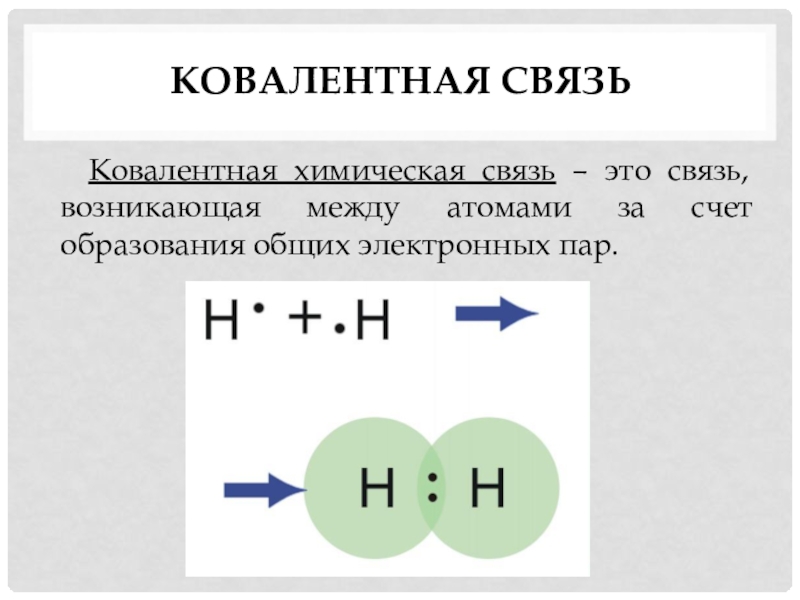
Ковалентные облигации
Химические связи — это силы притяжения, связывающие атомы вместе. Связи образуются при взаимодействии валентных электронов, электронов внешней электронной «оболочки» атома.Характер взаимодействия между атомами зависит от их относительной электроотрицательности. Атомы с равной или подобной электроотрицательностью образуют ковалентные связи, в которых валентная электронная плотность распределяется между двумя атомами. Электронная плотность находится между атомами и притягивается к обоим ядрам. Этот тип связи чаще всего образуется между двумя неметаллами.
Когда разница в электроотрицательности больше, чем между ковалентно связанными атомами, пара атомов обычно образует полярную ковалентную связь.Электроны по-прежнему распределяются между атомами, но электроны не одинаково притягиваются к обоим элементам. В результате большую часть времени электроны обычно находятся около одного конкретного атома. Опять же, между неметаллами обычно возникают полярные ковалентные связи.
Ионные связи
Наконец, для атомов с наибольшей разницей в электроотрицательности (таких как металлы, связывающиеся с неметаллами), связывающее взаимодействие называется ионным, и валентные электроны обычно представляются как передающиеся от атома металла к неметаллу.После того, как электроны были перенесены на неметалл, и металл, и неметалл считаются ионами. Два противоположно заряженных иона притягиваются друг к другу, образуя ионное соединение.
Связи, стабильность и соединения
Ковалентные взаимодействия являются направленными и зависят от перекрытия орбиталей, в то время как ионные взаимодействия не имеют особой направленности. Каждое из этих взаимодействий позволяет задействованным атомам получить восемь электронов в своей валентной оболочке, удовлетворяя правило октетов и делая атомы более стабильными.
Эти атомные свойства помогают описывать макроскопические свойства соединений. Например, ковалентные соединения меньшего размера, которые удерживаются вместе более слабыми связями, часто бывают мягкими и податливыми.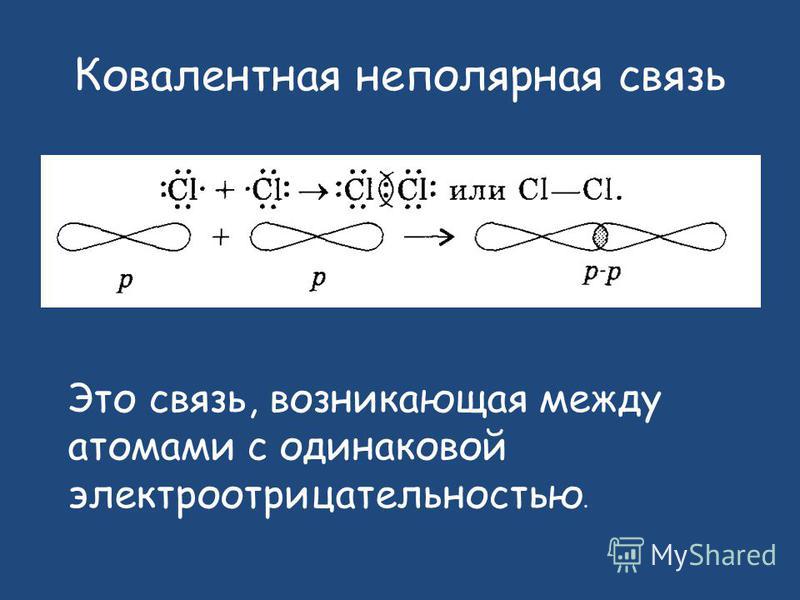 С другой стороны, дальнодействующие ковалентные взаимодействия могут быть довольно сильными, что делает их соединения очень прочными. Ионные соединения, хотя и состоят из сильных связывающих взаимодействий, имеют тенденцию образовывать хрупкие кристаллические решетки.
С другой стороны, дальнодействующие ковалентные взаимодействия могут быть довольно сильными, что делает их соединения очень прочными. Ионные соединения, хотя и состоят из сильных связывающих взаимодействий, имеют тенденцию образовывать хрупкие кристаллические решетки.
Ионные связи
Ионные связи — это подмножество химических связей, которые возникают в результате переноса валентных электронов, обычно между металлом и неметаллом.
Цели обучения
Обобщить характерные особенности ионных связей
Основные выводы
Ключевые моменты
- Ионные связи образуются в результате обмена валентными электронами между атомами, обычно между металлом и неметаллом.
- Потеря или усиление валентных электронов позволяет ионам подчиняться правилу октетов и становиться более стабильными.
- Ионные соединения обычно нейтральны. Таким образом, ионы объединяются таким образом, чтобы нейтрализовать их заряды.
Ключевые термины
- валентные электроны : электроны атома, которые могут участвовать в образовании химических связей с другими атомами. Это самые дальние электроны от ядра.
- правило октетов : атом наиболее стабилен, когда в его валентной оболочке восемь электронов.
Образование иона
Ионные связи — это класс химических связей, которые возникают в результате обмена одного или нескольких валентных электронов от одного атома, обычно металла, на другой, обычно неметалл.Этот обмен электронами приводит к электростатическому притяжению между двумя атомами, которое называется ионной связью. Атом, который теряет один или несколько валентных электронов, чтобы стать положительно заряженным ионом, известен как катион, в то время как атом, который приобретает электроны и становится отрицательно заряженным, известен как анион.
Этот обмен валентными электронами позволяет ионам достигать электронных конфигураций, имитирующих конфигурации благородных газов, удовлетворяющих правилу октетов.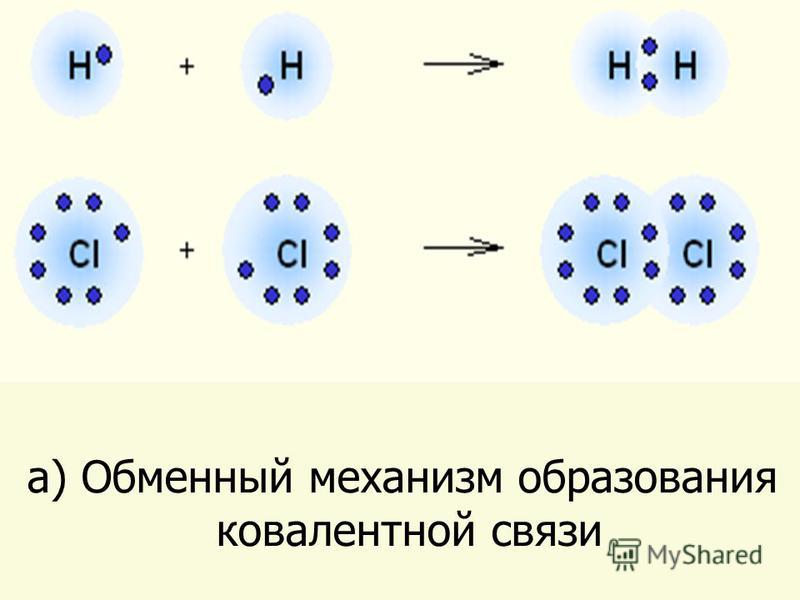 Правило октета гласит, что атом наиболее стабилен, когда в его валентной оболочке восемь электронов.Атомы с менее чем восемью электронами, как правило, удовлетворяют правилу дуэта, имея два электрона в их валентной оболочке. Удовлетворяя правилу дуэта или правилу октетов, ионы становятся более стабильными.
Правило октета гласит, что атом наиболее стабилен, когда в его валентной оболочке восемь электронов.Атомы с менее чем восемью электронами, как правило, удовлетворяют правилу дуэта, имея два электрона в их валентной оболочке. Удовлетворяя правилу дуэта или правилу октетов, ионы становятся более стабильными.
Катион обозначается положительным индексом заряда (+ что-то) справа от атома. Анион обозначается отрицательным индексом заряда (- что-то) справа от атома. Например, если атом натрия теряет один электрон, он будет иметь на один протон больше, чем электрон, что дает ему общий заряд +1.Химический символ иона натрия — Na +1 или просто Na + . Точно так же, если атом хлора получает дополнительный электрон, он становится ионом хлора, Cl — . Оба иона образуются, потому что ион более стабилен, чем атом, из-за правила октетов.
Формирование ионной связи
Когда образуются противоположно заряженные ионы, они притягиваются своими положительными и отрицательными зарядами и образуют ионное соединение. Ионные связи также образуются, когда между двумя атомами существует большая разница в электроотрицательности.Это различие вызывает неравное распределение электронов, так что один атом полностью теряет один или несколько электронов, а другой атом получает один или несколько электронов, например, при создании ионной связи между атомом металла (натрия) и неметаллом (фтор). .
Образование фторида натрия : Перенос электронов и последующее притяжение противоположно заряженных ионов.
Определение формулы ионного соединения
Для определения химических формул ионных соединений должны выполняться следующие два условия:
- Каждый ион должен подчиняться правилу октетов для максимальной стабильности.
- Ионы соединятся таким образом, что все ионное соединение будет нейтральным. Другими словами, заряды ионов должны уравновешиваться.
Магний и фтор образуют ионное соединение.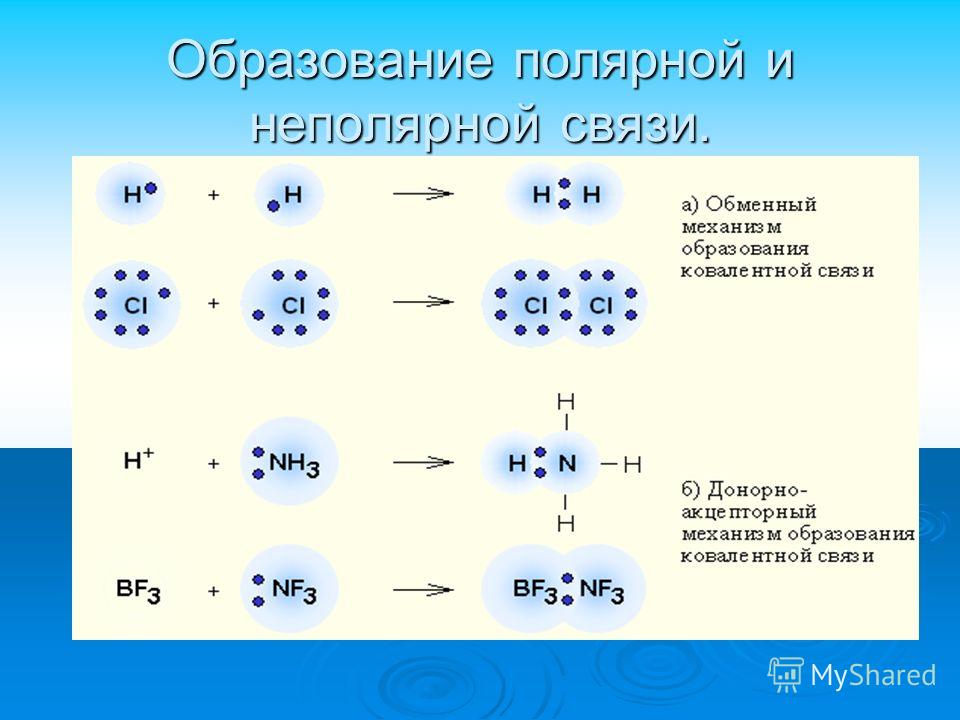 Какая формула соединения?
Какая формула соединения?
Mg чаще всего образует ион 2+. Это связано с тем, что Mg имеет два валентных электрона, и он хотел бы избавиться от этих двух ионов, чтобы подчиняться правилу октетов. Фтор имеет семь валентных электронов и обычно образует ион F —, потому что он получает один электрон, чтобы удовлетворить правилу октетов.Когда Mg 2+ и F — объединяются с образованием ионного соединения, их заряды должны уравновешиваться. Следовательно, одному Mg 2+ нужны два иона F — для нейтрализации заряда. 2+ Mg уравновешивается наличием двух заряженных ионов -1. Следовательно, формула соединения — MgF 2 . Нижний индекс два указывает, что есть два фтора, которые ионно связаны с магнием.
В макроскопическом масштабе ионные соединения образуют структуры кристаллической решетки, которые характеризуются высокими температурами плавления и кипения и хорошей электропроводностью при плавлении или растворении.
Пример
Магний и фтор образуют ионное соединение. Какая формула соединения?
Mg чаще всего образует ион 2+. Это связано с тем, что Mg имеет два валентных электрона, и он хотел бы избавиться от этих двух ионов, чтобы подчиняться правилу октетов. Фтор имеет семь валентных электронов и, как таковой, обычно образует ион F — , потому что он получает один электрон, чтобы удовлетворить правилу октетов. Когда Mg 2+ и F — объединяются с образованием ионного соединения, их заряды должны уравновешиваться.Следовательно, для баланса одного Mg 2+ необходимы два иона F — . 2+ Mg уравновешивается наличием двух заряженных ионов -1. Следовательно, формула соединения — MgF 2 . Нижний индекс два указывает, что есть два фтора, которые ионно связаны с магнием.
Ковалентные облигации
Ковалентная связь включает в себя два атома, обычно неметаллов, которые разделяют валентные электроны.
Цели обучения
Различение ковалентных и ионных связей
Основные выводы
Ключевые моменты
- Ковалентные связи включают два атома, обычно неметаллов, которые имеют общую электронную плотность, чтобы сформировать сильные связывающие взаимодействия.
- Ковалентные связи включают одинарные, двойные и тройные связи и состоят из сигма- и пи-связывающих взаимодействий, в которых совместно используются 2, 4 или 6 электронов соответственно.
- Ковалентные соединения обычно имеют более низкие температуры плавления и кипения, чем ионные соединения.
Ключевые термины
- электроотрицательность : тенденция атома или молекулы притягивать электроны и, таким образом, образовывать связи.
- одинарная связь : Тип ковалентной связи, при которой только два электрона разделяются между атомами.
Формирование ковалентных связей
Ковалентные связи — это класс химических связей, в которых валентные электроны распределяются между двумя атомами, обычно двумя неметаллами. Образование ковалентной связи позволяет неметаллам подчиняться правилу октетов и, таким образом, становиться более стабильными. Например:
- Атом фтора имеет семь валентных электронов. Если он разделяет один электрон с атомом углерода (который имеет четыре валентных электрона), у фтора будет полный октет (его семь электронов плюс тот, который он делит с углеродом).
- Углерод будет иметь пять валентных электронов (четыре и один совместно с фтором). Ковалентное разделение двух электронов также известно как «одинарная связь». Углерод должен будет образовать четыре одинарные связи с четырьмя различными атомами фтора, чтобы заполнить свой октет. В результате получается CF 4 или четырехфтористый углерод.
Ковалентное связывание требует определенной ориентации между атомами для достижения перекрытия между связывающими орбиталями. Взаимодействия ковалентного связывания включают сигма-связывание ( σ ) и пи-связывание ( π ).Сигма-связи являются самым сильным типом ковалентного взаимодействия и образуются за счет перекрытия атомных орбиталей вдоль оси орбиты. Перекрытые орбитали позволяют общим электронам свободно перемещаться между атомами. Связи Pi являются более слабым типом ковалентных взаимодействий и возникают в результате перекрытия двух долей взаимодействующих атомных орбиталей выше и ниже оси орбиты.
Взаимодействия ковалентного связывания включают сигма-связывание ( σ ) и пи-связывание ( π ).Сигма-связи являются самым сильным типом ковалентного взаимодействия и образуются за счет перекрытия атомных орбиталей вдоль оси орбиты. Перекрытые орбитали позволяют общим электронам свободно перемещаться между атомами. Связи Pi являются более слабым типом ковалентных взаимодействий и возникают в результате перекрытия двух долей взаимодействующих атомных орбиталей выше и ниже оси орбиты.
Ковалентные связи могут быть одинарными, двойными и тройными.
- Одинарные связи возникают, когда два электрона являются общими и состоят из одной сигма-связи между двумя атомами.
- Двойные связи возникают, когда четыре электрона разделяются между двумя атомами и состоят из одной сигма-связи и одной пи-связи.
- Тройные связи возникают, когда шесть электронов разделяются между двумя атомами и состоят из одной сигма-связи и двух пи-связей (дополнительную информацию о пи- и сигма-связях см. Далее в концепции).
Ионные соединения против молекулярных соединений
В отличие от ионной связи, ковалентная связь сильнее между двумя атомами с аналогичной электроотрицательностью.Для атомов с равной электроотрицательностью связь между ними будет неполярным ковалентным взаимодействием. В неполярных ковалентных связях электроны поровну распределяются между двумя атомами. Для атомов с разной электроотрицательностью связь будет полярным ковалентным взаимодействием, при котором электроны не будут распределяться поровну.
Ионные твердые вещества обычно характеризуются высокими температурами плавления и кипения наряду с хрупкими кристаллическими структурами. С другой стороны, ковалентные соединения имеют более низкие температуры плавления и кипения.В отличие от ионных соединений, они часто не растворяются в воде и не проводят электричество при растворении.
Полярные и неполярные ковалентные связи: определения и примеры — видео и стенограмма урока
Знаете ли вы, что некоторые типы химических связей ведут себя так же, как дети играют с игрушками? В этом уроке вы узнаете о двух типах связей, называемых полярными и неполярными ковалентными связями.
Неполярные ковалентные связи
Вы когда-нибудь наблюдали, как малыши играют вместе с игрушкой? Иногда они делятся игрушками поровну, а иногда один ребенок забирает игрушку другого ребенка. Некоторые виды химической связи очень похожи на то, как дети играют с игрушками. Неполярные ковалентные связи — это тип связи, который возникает, когда два атома разделяют пару электронов друг с другом. Эти общие электроны склеивают два или более атома вместе, образуя молекулу.Подобно детям, которые делят игрушки, атомы, участвующие в неполярной ковалентной связи, в равной степени разделяют электроны. Примером неполярной ковалентной связи является связь между двумя атомами водорода, потому что они в равной степени разделяют электроны. Другой пример неполярной ковалентной связи — это связь между двумя атомами хлора, потому что они в равной степени разделяют электроны. Неполярные ковалентные связи — это очень прочные связи, требующие большого количества энергии для разрыва связи.
Неполярные ковалентные связи чрезвычайно важны в биологии.Они образуют кислород, которым мы дышим, и помогают формировать наши живые клетки. Один из видов неполярной ковалентной связи, который очень важен в биологии, называется пептидной связью . Пептидная связь объединяет цепи аминокислот, которые участвуют в построении белков. Аминокислоты состоят из нескольких атомов, таких как углерод, кислород, азот и водород.
Полярные ковалентные связи
Вы когда-нибудь видели, как двое детей играют, и один ребенок ведет себя как хулиган по отношению к другому ребенку? Ребенок-хулиган, кажется, проводит больше времени, играя с игрушкой, чем другой ребенок.Они не одинаково делятся игрушками.
Это неравное разделение также происходит с типом связи, называемым полярной ковалентной связью.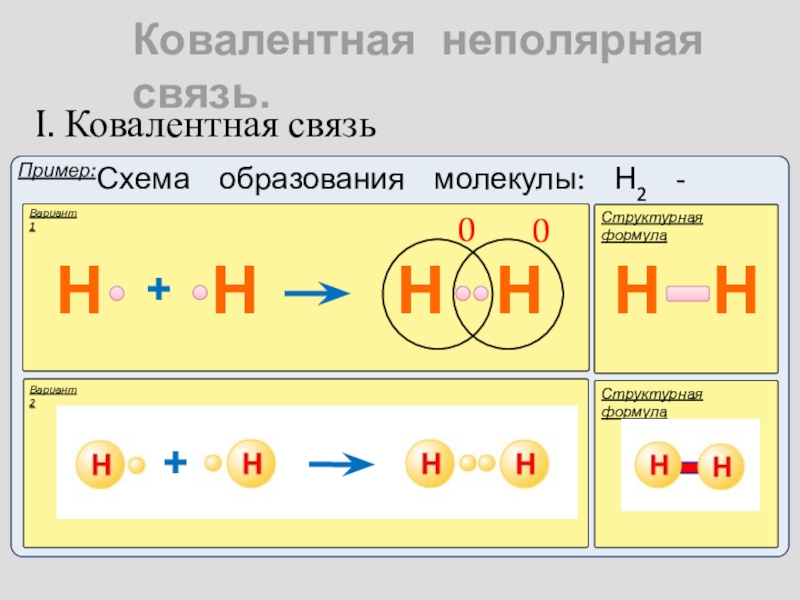 Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. В полярной ковалентной связи электроны не распределяются поровну, потому что один атом проводит с электронами больше времени, чем другой. В полярных ковалентных связях один атом имеет более сильное притяжение, чем другой атом, и притягивает электроны.Помните, как электроны несут отрицательный заряд? Что ж, когда электроны проводят больше времени с одним атомом, это заставляет этот атом нести частичный отрицательный заряд. Атом, который не проводит столько времени с электронами, несет частичный положительный заряд. Чтобы вспомнить полярную ковалентную связь, вместо этого скажите «ковалентный пуллер» и помните, что один атом «притягивает» электроны больше, чем другой.
Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. В полярной ковалентной связи электроны не распределяются поровну, потому что один атом проводит с электронами больше времени, чем другой. В полярных ковалентных связях один атом имеет более сильное притяжение, чем другой атом, и притягивает электроны.Помните, как электроны несут отрицательный заряд? Что ж, когда электроны проводят больше времени с одним атомом, это заставляет этот атом нести частичный отрицательный заряд. Атом, который не проводит столько времени с электронами, несет частичный положительный заряд. Чтобы вспомнить полярную ковалентную связь, вместо этого скажите «ковалентный пуллер» и помните, что один атом «притягивает» электроны больше, чем другой.
На самом деле ваша жизнь зависит от полярных ковалентных связей.Вы ведь пьете воду? Молекула воды, сокращенно h3O, является примером полярной ковалентной связи. Электроны распределяются неравномерно: атом кислорода проводит с электронами больше времени, чем атомы водорода. Поскольку электроны проводят больше времени с атомом кислорода, он несет частично отрицательный заряд.
Другой пример полярной ковалентной связи — между водородом и атомом хлора. В этой связи атом хлора проводит с электронами больше времени, чем атом водорода. Из-за этого неравномерного распределения электронов атом хлора несет частичный отрицательный заряд, а атом водорода несет частичный положительный заряд.
Как предсказать тип связи с помощью электроотрицательности
Вам может быть интересно: как узнать, какой тип связи будет возникать между атомами? Вы можете предсказать, какой тип связи образуется, глядя на электроотрицательность каждого атома, участвующего в связи. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи. Некоторые атомы имеют более высокую электроотрицательность, а другие — более низкую. Электроотрицательность похожа на перетягивание каната между двумя атомами.Если у вас есть один человек на стороне веревки, которая сильнее другого, то этот более сильный человек будет тянуть сильнее, таща другого человека в своем направлении. С другой стороны, если бы у вас было два человека равной силы, то веревка не сместилась бы ни в одном направлении и оставалась бы в одном месте.
Как в перетягивании каната, если у вас есть более сильный атом с более высокой электроотрицательностью, он сможет тянуть электроны в своем направлении.Поскольку атомы имеют разную электроотрицательность, электроны распределяются неравномерно. С другой стороны, если у вас есть два атома с одинаковой силой или с одинаковой электроотрицательностью, то электроны не будут тянуться в каком-либо одном направлении и останутся посередине двух атомов. Поскольку притяжения нет, электроны распределяются между двумя атомами поровну.
Помните, периодическая таблица Менделеева похожа на дорожную карту, которая может рассказать вам свойства каждого элемента? Дополнительная тенденция, которую может определить таблица Менделеева, — это электроотрицательность элемента.Прежде чем я опишу тенденцию, сначала вспомните, что водород считается неметаллом и перемещается в крайнее правое положение вместе с другими неметаллами. Тенденция электроотрицательности, которую я собираюсь описать, не включает благородные газы и большинство переходных металлов. Помните, благородные газы расположены в последнем столбце периодической таблицы, а переходные металлы расположены в группах с 3 по 12 периодической таблицы. Теперь, когда вы знаете исключения, основная тенденция заключается в том, что при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается.
Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор. И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий.
Теперь, когда вы знаете тенденции электроотрицательности периодической таблицы, вы можете определить тип связи, которая будет образовываться в молекуле. Если электроотрицательность между двумя атомами в основном одинакова, образуется неполярная ковалентная связь .Например, два атома фтора имеют одинаковую электроотрицательность. Поскольку между двумя атомами нет разницы в электроотрицательности, они в равной степени будут разделять электроны, образуя неполярную ковалентную связь.
Если атомы расположены близко друг к другу в периодической таблице, они будут иметь немного другую электроотрицательность. Если разница в электроотрицательности между двумя атомами небольшая, то образуется полярная ковалентная связь . Эта небольшая разница в электроотрицательности заставляет один атом иметь более сильное притяжение электронов, чем другой атом.Это более сильное притяжение заставляет электроны распределяться неравномерно и проводить больше времени рядом с атомом с более высокой электроотрицательностью. Например, глядя на атомы, входящие в состав молекулы воды, можно увидеть, что атомы водорода и кислорода расположены довольно близко в периодической таблице. Поскольку они расположены довольно близко друг к другу, разница в электроотрицательности будет незначительной. Атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, поэтому электроны проводят больше времени вокруг кислорода.
Краткое содержание урока
В этом уроке вы узнали о двух типах связей: неполярных ковалентных и полярных ковалентных. Неполярные ковалентные связи — это тип химической связи, при которой два атома разделяют пару электронов друг с другом. Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. Вы также узнали, как можно посмотреть на тенденции электроотрицательности периодической таблицы, чтобы предсказать тип связи, которая будет образовываться. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи.
Глядя на таблицу Менделеева, при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается. Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор. И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий.Если электроотрицательность двух атомов в основном одинакова, образуется неполярная ковалентная связь, а если электроотрицательность немного отличается, образуется полярная ковалентная связь.
Результаты обучения
После этого урока вы сможете:
- различать неполярные и полярные ковалентные связи
- Приведите примеры каждого типа облигации
- Объясните, что такое пептидная связь.
- Определить электроотрицательность
- Объясните, как предсказать, образуется ли неполярная ковалентная связь или полярная ковалентная связь, используя тенденции электроотрицательности периодической таблицы.
ковалентная связь | Определение, свойства, примеры и факты
Ковалентная связь , в химии, межатомная связь, которая возникает в результате совместного использования пары электронов между двумя атомами.Связывание возникает из-за электростатического притяжения их ядер к одним и тем же электронам. Ковалентная связь образуется, когда связанные атомы имеют более низкую общую энергию, чем у широко разделенных атомов.
полярная ковалентная связьВ полярных ковалентных связях, например, между атомами водорода и кислорода, электроны не передаются от одного атома к другому, поскольку они находятся в ионной связи. Вместо этого некоторые внешние электроны просто проводят больше времени рядом с другим атомом. Эффект этого орбитального искажения состоит в том, чтобы вызвать региональные сетчатые заряды, которые удерживают атомы вместе, например, в молекулах воды.
Британская энциклопедия, Inc.Подробнее по этой теме
Кристалл: ковалентные связи
Кремний, углерод, германий и некоторые другие элементы образуют твердые тела с ковалентными связями. В этих элементах есть четыре электрона во внешнем …
Далее следует краткое рассмотрение ковалентных связей. Для полной обработки: см. химическая связь: Ковалентные связи.
Молекулы с ковалентными связями включают неорганические вещества: водород, азот, хлор, воду и аммиак (H 2 , N 2 , Cl 2 , H 2 O, NH 3 ) вместе с все органические соединения. В структурных представлениях молекул ковалентные связи обозначены сплошными линиями, соединяющими пары атомов; например,
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасОдинарная линия обозначает связь между двумя атомами ( i.е., с одной электронной парой), двойные линии (=) указывают на двойную связь между двумя атомами ( то есть, с участием двух электронных пар), а тройные линии (≡) представляют тройную связь, как было обнаружено, например, в оксиде углерода (C≡O). Одинарные связи состоят из одной сигма (σ) связи, двойные связи имеют одну σ и одну пи (π) связь, а тройные связи имеют одну σ и две π связи.
Идея о том, что два электрона могут быть разделены между двумя атомами и служить связующим звеном между ними, была впервые введена в 1916 году американским химиком Г.Н. Льюис, который описал образование таких связей как результат стремления определенных атомов объединяться друг с другом, чтобы оба имели электронную структуру соответствующего атома благородного газа.
Ковалентные связи являются направленными, что означает, что атомы, связанные таким образом, предпочитают определенные ориентации относительно друг друга; это, в свою очередь, придает молекулам определенные формы, как в угловой (изогнутой) структуре молекулы H 2 O. Ковалентные связи между идентичными атомами (как в H 2 ) неполярны — i.например, электрически однородны — в то время как атомы между разнородными атомами полярны — то есть один атом заряжен слегка отрицательно, а другой — слегка положительно. Этот частичный ионный характер ковалентных связей увеличивается с разницей в электроотрицательности двух атомов. См. Также ионную связь .
Химические связи — Принципы биологии
Как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует во внешней области, где электроны присутствуют в атоме.Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может вместить до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; следовательно, в самой нижней оболочке занято только одно место. Гелий имеет два электрона; следовательно, он может полностью заполнить нижнюю оболочку двумя своими электронами. Если вы посмотрите на таблицу Менделеева, вы увидите, что водород и гелий — единственные два элемента в первой строке.Это потому, что в их первой оболочке есть только электроны. Водород и гелий — единственные два элемента, которые имеют самую низкую оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов. Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут сформированы.
Еще раз взглянув на таблицу Менделеева (рис. 1), вы заметите, что там семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке.Элементы в определенной строке имеют увеличивающееся количество электронов по мере того, как столбцы перемещаются слева направо. Хотя у каждого элемента одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. Литий имеет только один электрон во внешней оболочке, бериллий имеет два электрона, бор имеет три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не все элементы имеют достаточно электронов, чтобы заполнить свои внешние оболочки, но атом наиболее стабилен, когда все позиции электронов на внешней оболочке заполнены. Из-за этих вакансий во внешних оболочках мы видим образование химических связей или взаимодействия между двумя или более одинаковыми или разными элементами, которые приводят к образованию молекул. Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и будут связываться с другими элементами для достижения этой цели, разделяя электроны, принимая электроны от другого атома или отдавая электроны другому атому.Поскольку внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов. Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Когда атом не содержит равного количества протонов и электронов, он называется ионом . Поскольку количество электронов не равно количеству протонов, каждый ион имеет чистый заряд.Положительные ионы образуются при потере электронов и называются катионами. Отрицательные ионы образуются путем захвата электронов и называются анионами.
Например, у натрия только один электрон на внешней оболочке. Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий теряет электрон, у него теперь будет 11 протонов и только 10 электронов, а общий заряд останется +1. Теперь он называется ионом натрия.
У атома хлора семь электронов на внешней оболочке.Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, придавая ему чистый отрицательный (–1) заряд. Теперь он называется хлорид-ионом. Это движение электронов от одного элемента к другому называется переносом электронов. Как показано на рисунке 1, атом натрия (Na) имеет только один электрон в своей внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов в своей внешней оболочке.Атом натрия отдаст свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый теперь является ионом и имеет заряд +1 (натрий) или –1 (хлорид).
Рис. 1 Элементы имеют тенденцию заполнять свои внешние оболочки электронами. Для этого они могут отдавать или принимать электроны от других элементов.Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и ван-дер-ваальсовы взаимодействия. Ионные и ковалентные связи — это сильные взаимодействия, для разрыва которых требуется больше энергии. Когда элемент отдает электрон из своей внешней оболочки, как в примере с атомом натрия выше, образуется положительный ион (рис. 2). Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительный и отрицательный заряды притягиваются, эти ионы остаются вместе и образуют ионную связь , или связь между ионами.Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl — объединяются, чтобы произвести NaCl, электрон от атома натрия остается с другими семью от атома хлора, и ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. заряжать.
Рис. 2 При образовании ионного соединения металлы теряют электроны, а неметаллы приобретают электроны для достижения октета.Ковалентные облигации
Другой тип прочной химической связи между двумя или более атомами — это ковалентная связь . Эти связи образуются, когда электрон разделяется между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках. В отличие от ионных связей ковалентные связи не диссоциируют в воде.
Интересно, что химики и биологи по-разному измеряют прочность связи.Химики измеряют абсолютную прочность связи (теоретическую прочность), в то время как биологов больше интересует, как связь ведет себя в биологической системе, которая обычно представляет собой водную (на водной основе). В воде ионные связи распадаются гораздо легче, чем ковалентные связи, поэтому биологи сказали бы, что они слабее ковалентных связей. Если вы посмотрите в учебник химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее смотрите.
Атомы водорода и кислорода, которые объединяются в молекулы воды, связаны ковалентными связями. Электрон от атома водорода делит свое время между внешней оболочкой атома водорода и неполной внешней оболочкой атома кислорода. Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимы два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O. Электроны распределяются между атомами, разделяя их время на «заполнение» внешняя оболочка каждого.Это совместное использование является более низким энергетическим состоянием для всех задействованных атомов, чем если бы они существовали без заполненных внешних оболочек.
Есть два типа ковалентных связей: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые разделяют электроны в равной степени. Например, атом кислорода может связываться с другим атомом кислорода, чтобы заполнить их внешние оболочки. Эта ассоциация неполярна, потому, что электроны будут равномерно распределены между каждым атомом кислорода.Между двумя атомами кислорода образуются две ковалентные связи, потому что кислород требует, чтобы два общих электрона заполняли его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи обнаружен в молекуле метана (CH 4 ). У атома углерода четыре электрона во внешней оболочке, и ему нужно еще четыре, чтобы заполнить его. Он получает эти четыре из четырех атомов водорода, каждый из которых обеспечивает один.Все эти элементы делят электроны в равной степени, создавая четыре неполярные ковалентные связи (рис. 3).
В полярной ковалентной связи электроны, разделяемые атомами, проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ +) или слегка отрицательный (δ–) заряд. Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени рядом с ядром кислорода, придавая ему небольшой отрицательный заряд, чем они проводят рядом с ядрами водорода, придавая этим молекулам небольшой положительный заряд.
Рис. 3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом на атомах водорода и слегка отрицательным зарядом на кислороде. Примеры неполярных связей включают метан (в центре) и кислород (справа).Водородные облигации
Ионные и ковалентные связи — это прочные связи, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Могут образоваться и более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрушения которых не требуется много энергии.Две часто встречающиеся слабые связи — это водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи создают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положительный (δ +), он будет притягиваться к соседним отрицательным частичным зарядам (δ–).Когда это происходит, возникает слабое взаимодействие между зарядом δ + атома водорода одной молекулы и зарядом δ– другой молекулы. Это взаимодействие называется водородной связью. Этот тип облигации распространен; например, жидкая природа воды обусловлена водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородная связь, вода была бы газом, а не жидкостью при комнатной температуре.
Рис. 4 Водородные связи образуются между слегка положительными (δ +) и слегка отрицательными (δ–) зарядами полярных ковалентных молекул, таких как вода.Водородные связи могут образовываться между разными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, чтобы придать молекуле ДНК характерную двухцепочечную структуру. Водородные связи также ответственны за некоторые трехмерные структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, ван-дер-ваальсовы взаимодействия представляют собой слабое притяжение или взаимодействие между молекулами.Они возникают между полярными ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, которые образуются при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
Список литературыЕсли не указано иное, изображения на этой странице лицензированы OpenStax в соответствии с CC-BY 4.0.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]: IBRqRY3C @ 8 / Строительные блоки молекулы
Полярная ковалентная связь | Примеры полярных ковалентных связей
Полярная ковалентная связь.
Образование ковалентной связи:
При химической связи существуют разные типы связей между двумя или более атомами. Ковалентная связь образуется, когда электронные пары разделены между двумя атомами. Количество общих электронных пар может варьироваться от атома к атому. Если атомы разделяют одну пару электронов, тогда образуется одинарная связь, для атомов, разделяющих две пары электронов, образуется двойная связь, а у атомов, разделяющих три пары электронов, образуется тройная связь.
Запись электронной конфигурации атома:
Первым шагом к пониманию образования ковалентной связи является определение количества валентных электронов для данных атомов. Валентные электроны — это количество электронов на внешней орбите. Электронная конфигурация атомов написана для идентификации валентных электронов. По количеству валентных электронов образуется ковалентная связь.
Число валентных электронов на один атом кислорода равно 6.Следуйте диаграмме ниже:
Используя электронную конфигурацию, электроны могут быть расположены по орбитам. Для данного атома кислорода первая орбита n = 1, которая содержит 2 электрона, а вторая орбита n = 2, которая содержит 6 электронов. Последняя орбита определяет количество валентных электронов. Следуйте диаграмме кислорода, показанной ниже:
Следовательно, атом кислорода имеет 6 валентных электронов.
Ковалентная связь образуется так, что атомы достигают конфигурации стабильного состояния.Стабильное состояние обычно возникает, когда атомы имеют 8 электронов на внешней орбите. В периодической таблице есть несколько атомов, у которых уже есть октет. Это означает, что им не нужно образовывать какую-либо химическую связь для достижения стабильного состояния. К таким атомам относятся Ne, Ar, Kr и т. Д., Они называются благородными газами.
Электронная конфигурация Neon Ne с атомным номером 10 приведена ниже:
Определения полярной ковалентной связи:
Как уже упоминалось, ковалентная связь образуется в результате совместного использования пары электронов.Есть два типа ковалентных связей: полярная ковалентная связь и неполярная ковалентная связь. Полярная ковалентная связь образуется, когда атомы делят электроны между собой неравномерно. Это приводит к частичным положительным и отрицательным зарядам на каждом атоме. Неполярная ковалентная связь, однако, имеет равное распределение электронных пар друг с другом.
Ниже приведены примеры соединений, образованных за счет полярной ковалентной связи.
Образование соединения HF:
Соединение фтористого водорода HF образуется полярной ковалентной связью.
1. Электроны распределяются между атомами водорода и фтора.
2. Первый шаг — записать электронную конфигурацию каждого атома водорода и фтора.
3. Определите количество валентных электронов для каждого из атомов. Следуйте диаграмме ниже:
· Атом водорода имеет один электрон на внешней орбите. Итак, количество валентных электронов равно одному. Водороду понадобится еще один электрон, чтобы достичь стабильного состояния.
· Атом фтора имеет 7 электронов во внешней оболочке, поэтому количество валентных электронов равно 7.Фтору нужен еще один электрон для завершения октета. (8 электронов во внешней оболочке.)
· Водород и фтор образуют полярную ковалентную связь, разделяя электронную пару.
· Общая электронная пара больше притягивается атомом фтора, из-за чего он получает на нем частичный отрицательный заряд.
· Атом водорода получает частичный положительный заряд из-за неравного распределения пары электронов.
· Эти заряды на атомах приводят к электроотрицательной разнице между двумя атомами во время образования полярной ковалентной связи.
Образование CO 2 :
Следуйте другому примеру для образования полярной ковалентной связи в CO 2 .
1. Есть два атома кислорода и один атом углерода, образующие одну молекулу диоксида углерода CO 2. .
2. Первый шаг — записать электронную конфигурацию каждого атома углерода и кислорода.
3. Затем определите количество валентных электронов для каждого из атомов. Следуйте диаграмме ниже:
· Атом углерода имеет 4 электрона на внешней орбите.Это означает, что атому углерода нужно еще четыре электрона, чтобы достичь стабильного состояния.
· Атом кислорода имеет 6 электронов на внешней орбите, это означает, что для достижения конфигурации стабильного состояния требуется еще 2 электрона. Следуйте диаграмме ниже, чтобы понять образование связи:
· Существует образование двойной связи между атомом углерода и кислорода, что означает, что углерод разделяет две пары электронов от каждого атома кислорода.
· Поскольку имеется два атома кислорода, образуются четыре связи, и углерод может образовывать октет.
· Атомы кислорода обладают высокой электроотрицательностью, из-за чего углерод получает положительный заряд, а кислород — отрицательный.
· Из-за такого неравномерного распределения зарядов образующиеся связи являются полярными ковалентными связями.
Электроотрицательность | Атомные комбинации | Сиявула
3.3 Электроотрицательность (ESBMD)
До сих пор мы рассматривали ковалентные молекулы. Но как мы узнаем, что они ковалентны? Ответ приходит от электроотрицательности.Каждый элемент (кроме благородных газов) имеет значение электроотрицательности.
Электроотрицательность — это мера того, насколько сильно атом притягивает к себе общую электронную пару. В таблице ниже показаны значения электроотрицательности некоторых элементов.
Полный список электроотрицательностей см. В таблице Менделеева в начале книги. В этой периодической таблице значения электроотрицательности приведены в правом верхнем углу. Не путайте эти значения с другими числами, указанными для элементов.Электроотрицательность всегда будет между \ (\ text {0} \) и \ (\ text {4} \) для любого элемента. Если вы используете число больше \ (\ text {4} \), значит, вы не используете электроотрицательность.
В зависимости от того, какой источник вы используете для определения электроотрицательности, вы можете увидеть немного разные значения.
Элемент | Электроотрицательность | Элемент | Электроотрицательность |
| \ | |||
| \ \ (\ text {2,1} \) | Литий (\ (\ text {Li} \)) | \ (\ text {1,0} \) | |
Бериллий ( \ (\ text {Be} \)) | \ (\ text {1,5} \) | Бор (\ (\ text {B} \)) | \ (\ text { 2,0} \) |
Углерод (\ (\ text {C} \)) | \ (\ text {2,5} \) | Азот (\ (\ text { N} \)) | \ (\ text {3,0} \) |
Кислород (\ (\ text {O} \)) | \ (\ text {3,5 } \) | Фтор (\ (\ text {F} \)) | \ (\ t ext {4,0} \) |
Натрий (\ (\ text {Na} \)) | \ (\ text {0,9} \) | Магний (\ (\ text {Mg} \)) | \ (\ text {1,2} \) |
Алюминий (\ (\ text {Al} \)) | \ (\ text {1 , 5} \) | Кремний (\ (\ text {Si} \)) | \ (\ text {1,8} \) |
Фосфор (\ (\ text {P } \)) | \ (\ text {2,1} \) | Сера (\ (\ text {S} \)) | \ (\ text {2,5} \) |
Хлор (\ (\ text {Cl} \)) | \ (\ text {3,0} \) | Калий (\ (\ text {K} \)) | \ (\ text {0,8} \) |
Кальций (\ (\ text {Ca} \)) | \ (\ text {1,0} \) | Бром (\ (\ text {Br} \)) | 9000 4 \ (\ text {2,8} \) |
Таблица 3.2: Таблица электроотрицательностей для выбранных элементов.
- Электроотрицательность
Электроотрицательность — это химическое свойство, которое описывает способность атома притягивать электроны к себе.
Концепция электроотрицательности была введена Линусом Полингом в 1932 году, и это стало очень полезным для объяснения природы связей между атомами в молекулах. За эту работу Полинг был удостоен Нобелевской премии по химии в 1954 году.Он также получил Нобелевскую премию мира в 1962 году за свою кампанию против наземных ядерных испытаний.
Чем больше электроотрицательность атома элемента, тем сильнее его притягивающее притяжение для электронов. Например, в молекуле бромистого водорода (\ (\ text {HBr} \)) электроотрицательность брома (\ (\ text {2,8} \)) выше, чем у водорода (\ (\ text { 2,1} \)), и поэтому общие электроны будут проводить больше времени ближе к атому брома. Бром будет иметь слегка отрицательный заряд, а водород — слегка положительный.В такой молекуле, как водород (\ (\ text {H} _ {2} \)), где электроотрицательность атомов в молекуле одинакова, оба атома имеют нейтральный заряд.
Рабочий пример 9: Расчет разницы электроотрицательностей
Рассчитайте разность электроотрицательностей водорода и кислорода.
Считайте электроотрицательность каждого элемента периодической таблицы.
Из периодической таблицы мы находим, что водород имеет электроотрицательность \ (\ text {2,1} \), а кислород имеет электроотрицательность \ (\ text {3,5} \).
Вычислить разность электроотрицательностей
\ (\ text {3,5} — \ text {2,1} = \ text {1,4} \)
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы получить доступ к своему будущему. Упражнение 3.7.Вычислить разность электроотрицательности между: \ (\ text {Be} \) и \ (\ text {C} \), \ (\ text {H} \) и \ (\ text {C} \), \ (\ text {Li} \) и \ (\ text {F} \), \ (\ text {Al} \) и \ (\ text {Na} \), \ (\ text {C} \) и \ (\ текст {O} \).
\ (\ text {Be} \) и \ (\ text {C} \): \ (\ text {2,5} — \ text {1,5} = \ text {1,0}. \)
\ (\ text {H} \) и \ (\ text {C} \): \ (\ text {2,5} — \ text {2,1} = \ text {0,4}. \)
\ (\ text {Li} \) и \ (\ text {F} \): \ (\ text {4,0} — \ text {1,0} = \ text {3,0}. \)
\ (\ text {Al} \) и \ (\ text {Na} \): \ (\ text {1,5} — \ text {0,9} = \ text {0,6}. \)
\ (\ text {C} \) и \ (\ text {O} \): \ (\ text {3,5} — \ text {2,5} = \ text {1,0}.\)
Электроотрицательность и связывание (ESBMF)
Разность электроотрицательности между двумя атомами может использоваться для определения типа связи между атомами. В таблице ниже приведены приблизительные значения. Хотя мы привели здесь диапазоны, связывание больше похоже на спектр, чем на набор прямоугольников.
| Разница электроотрицательностей | Тип связи |
| \ (\ text {0} \) | Неполярный ковалентный |
| \ (\ text {0} \) — \ (\ text {1} \) | Слабый полярный ковалентный |
| \ (\ text {1,1} \) — \ (\ text {2} \) | Сильный полярный ковалент |
| \ (> \) \ (\ text {2,1} \) | Ионный |
Обратите внимание, что металлическое соединение здесь не приводится.Металлы обладают низкой электроотрицательностью, поэтому валентные электроны не сильно притягиваются ни к одному атому. Вместо этого валентные электроны слабо разделяются всеми атомами в металлической сети.
Неполярные и полярные ковалентные связи (ESBMG)
Важно иметь возможность определить, является ли молекула полярной или неполярной, поскольку полярность молекул влияет на такие свойства, как растворимость , точки плавления , и точки кипения .
Электроотрицательность можно использовать для объяснения разницы между двумя типами ковалентных связей. Неполярные ковалентные связи возникают между двумя идентичными атомами неметалла, например \ (\ text {H} _ {2} \), \ (\ text {Cl} _ {2} \) и \ (\ text {O} _ {2} \). Поскольку два атома имеют одинаковую электроотрицательность, электронная пара в ковалентной связи делится между ними поровну. Однако, если два разных атома неметалла связаны, то общая электронная пара будет сильнее притягиваться атомом с более высокой электроотрицательностью.{-}} \) атомов), сама молекула не полярна. В Причина в том, что \ (\ text {CO} _ {2} \) является линейной молекулой с одинаковыми концевыми атомами и, следовательно, симметричной. Таким образом, нет никакой разницы в заряде между двумя концами. молекулы.
- Полярные молекулы
Полярная молекула — это молекула, один конец которой имеет слегка положительный заряд, а другой конец — слегка отрицательный. Примеры включают воду, аммиак и хлористый водород.
- Неполярные молекулы
Неполярная молекула — это молекула, в которой заряд равномерно распределен по всей молекуле, или симметричная молекула с полярными связями. Примеры включают диоксид углерода и кислород.
Чтобы определить, является ли молекула симметричной, сначала посмотрите на атомы вокруг центрального атома. Если они разные, то молекула несимметрична. Если они одинаковы, то молекула может быть симметричной, и нам нужно посмотреть на форму молекулы.
Мы можем легко предсказать, какие молекулы могут быть полярными, а какие — неполярными, глядя на форму молекулы. Следующее упражнение поможет вам определить это и поможет вам больше узнать о симметрии.
Полярные и неполярные молекулы
В следующей таблице перечислены молекулярные формы. Соберите молекулу, указанную для каждого случая, с помощью желейных яиц и зубочисток. Определите, симметрична ли форма. (Выглядит ли она одинаково, как бы вы на нее ни смотрели?) Теперь решите, полярная или неполярная молекула.
Геометрия | Молекула | Симметричный | Полярный или неполярный |
| 9000 9000 { | 9000 Line \) | ||
Линейный | \ (\ text {CO} _ {2} \) | ||
Линейный | \ (\ text {HCN} \) | ||
Изогнутый или угловой | \ (\ text {H} _ {2} \ text {O} \) | ||
Тригональный плоский | \ (\ text {BF} _ {3} \) | ||
Тригональная плоская | \ (\ text {BF} _ {2} \ text {Cl} \) | ||
| Тригональная 9025 пирамидальная4 | \ (\ text {NH} _ {3} \) | 902 55 | |
Тетраэдр | \ (\ text {CH} _ {4} \) | ||
Тетраэдр | \ (\ text {CH} _ {3} \ text {Cl } \) | ||
Тригональный бипирамидальный | \ (\ text {PCl} _ {5} \) | ||
Тригональный бипирамидальный | \ текст \ } _ {4} \ text {F} \)|||
Октаэдрический | \ (\ text {SF} _ {6} \) | ||
Октаэдрический | 9025 \ (\ text {SF} _ {5} \ text {Cl} \) |
Рабочий пример 10: Полярные и неполярные молекулы
Укажите, является ли водород (\ (\ text {H} _ {2} \)) полярным или неполярным.
Определите форму молекулы
Молекула линейная. Есть одна связывающая пара электронов и нет неподеленных пар.
Запишите электроотрицательность каждого атома
Водород: \ (\ text {2,1} \)
Определить разность электроотрицательностей для каждой связи
Есть только одна облигация и разница в \ (\ text {0} \).
Определите полярность каждой связи
Связь неполярная.
Определите полярность молекулы
Молекула неполярная.
Рабочий пример 11: Полярные и неполярные молекулы
Укажите, является ли метан (\ (\ text {CH} _ {4} \)) полярным или неполярным.
Определите форму каждой молекулы
Молекула тетраэдрическая. Есть четыре связывающих пары электронов и нет неподеленных пар.
Определить разность электроотрицательностей для каждой связи
Есть четыре облигации.Поскольку каждая связь находится между углеродом и водородом, нам нужно рассчитать только одну разность электроотрицательностей. Это: \ (\ text {2,5} — \ text {2,1} = \ text {0,4} \)
Определите полярность каждой связи
Каждая связь полярная.
Определите полярность молекулы
Молекула симметрична и поэтому неполярна.
Рабочий пример 12: Полярные и неполярные молекулы
Укажите, является ли цианистый водород (\ (\ text {HCN} \)) полярным или неполярным.
Определите форму молекулы
Молекула линейная. Имеется четыре пары скрепления, три из которых образуют тройную связь и считаются как \ (\ text {1} \). На атоме азота находится одна неподеленная пара.
Определите разность электроотрицательности и полярность для каждой связи
Есть две облигации. Один между водородом и углеродом, а другой между углеродом и азотом. Разница электроотрицательностей между углеродом и водородом равна \ (\ text {0,4} \), а разность электроотрицательностей между углеродом и азотом равна \ (\ text {0,5} \).Обе связи полярны.
Определите полярность молекулы
Молекула несимметрична и поэтому полярна.
Зарегистрируйтесь, чтобы получить стипендию и возможности карьерного роста. Используйте практику Сиявулы, чтобы получить наилучшие возможные оценки.
Зарегистрируйтесь, чтобы разблокировать свое будущееЭлектроотрицательность
Упражнение 3.8Что такое электроотрицательность бериллия?
\ (\ текст {2,1} \)
Что такое электроотрицательность хлора?
\ (\ текст {3,0} \)
Какой атом в молекуле будет иметь слегка положительный заряд, а какой — слегка отрицательный? Изобразите это на эскизе молекулы с использованием частичных зарядов.
Водород будет иметь слегка положительный заряд, а хлор — слегка отрицательный.
Является ли связь неполярной или полярной ковалентной связью?
Полярная ковалентная связь. Разница электроотрицательности: \ (\ text {3,0} — \ text {2,1} = \ text {0,9} \). Связь слабополярная.
Полярная или неполярная молекула?
Хлористый водород линейный и, следовательно, полярная молекула.
Заполните таблицу ниже:
Молекула | Разница в электроотрицательности между атомами | Неполярная / полярная ковалентная связь | Полярная / неполярная молекула | (\ text {H} _ {2} \ text {O} \)|||
\ (\ text {HBr} \) | ||||||
\ (\ text {F } _ {2} \) | ||||||
\ (\ text {CH} _ {4} \) | ||||||
\ (\ text {PF} _ {5} \ ) | ||||||
\ (\ text {BeCl} _ {2} \) | ||||||
\ (\ text {CO} \) | ||||||
\ (\ text {SO} _ {2} \) | 9 0931||||||
\ (\ text {BF} _ {3} \) |
Молекула | Разница в электроотрицательности между атомами | Неполярная / полярная ковалентная связь | Полярная / неполярная молекула | (\ text {H} _ {2} \ text {O} \)\ (\ text {3,5} — \ text {2,1} = \ text {1,4} \) | Полярная ковалентная связь | Полярная молекула.Вода имеет изогнутую или угловатую форму. |
\ (\ text {HBr} \) | \ (\ text {2,8} — \ text {2,1} = \ text {0,7} \) | Полярная ковалентная связь | Полярная молекула. Бромистый водород линейен. | |||
\ (\ text {F} _ {2} \) | \ (\ text {4,0} — \ text {4,0} = \ text {0} \) | Неполярная ковалентная связь | Неполярная молекула. | |||
\ (\ text {CH} _ {4} \) | \ (\ text {2,5} — \ text {2,1} = \ text {0,4} \) | Полярная ковалентная связь | Неполярная молекула.Метан тетраэдрический. | |||
\ (\ text {PF} _ {5} \) | \ (\ text {4,0} — \ text {2,1} = \ text {1,9} \) | Полярная ковалентная связь | Неполярная молекула. Пентафторид фосфора является тригонально-бипрамидным и симметричным. | |||
\ (\ text {BeCl} _ {2} \) | \ (\ text {3,0} — \ text {1,5} = \ text {1,5} \) | Полярная ковалентная связь | Неполярная молекула.Хлорид бериллия линейный и симметричный. | |||
\ (\ text {CO} \) | \ (\ text {3,5} — \ text {2,5} = \ text {1,0} \) | Полярная ковалентная связь | Полярная молекула. Окись углерода линейна, но не симметрична. | |||
\ (\ text {C} _ {2} \ text {H} _ {2} \) | \ (\ text {2,5} — \ text {2,1} = \ text {0,4} \) | Полярная ковалентная связь | Неполярная молекула.Ацетилен бывает линейным и симметричным. | |||
\ (\ text {SO} _ {2} \) | \ (\ text {3,5} — \ text {2,5} = \ text {1,0} \) | Полярная ковалентная связь | Полярная молекула. Диоксид серы изогнутый, угловатый и несимметричный. | |||
\ (\ text {BF} _ {3} \) | \ (\ text {4,0} — \ text {2,0} = \ text {2,0} \) | Полярная ковалентная связь | Неполярная молекула.Трифторид бора является тригонально-пирамидальным и несимметричным. |
Dr Thornton JERFSA — Honors Chemistry Unit 3: Covalent & Ionic Bonding
Science
SC.912.P.8.6
Различайте силы связывания, удерживающие соединения, и другие силы притяжения, включая водородные связи и ван дер Силы Ваальса.
Оценка когнитивной сложности: Уровень 2: Базовое применение навыков и концепций Химия нити
SC.912.P.8.7
Интерпретируйте формульные представления молекул и соединений с точки зрения состава и структуры.
Рейтинг когнитивной сложности Уровень 2: Базовое применение навыков и концепций Нейтральная химия
Рейтинг когнитивной сложности: Уровень 3: Стратегическое мышление и комплексное мышление Странд
ХимияПриоритет (ы): Science Connection
SC.912.P.8.1 Изучите научную теорию атомов (также известную как атомная теория), используя модели для объяснения движения частиц в твердых телах, жидкостях и газах.
SC.912.P.8.7 Изучите научную теорию атомов (также известную как атомная теория), признав, что атомы являются наименьшей единицей элемента и состоят из субатомных частиц (электронов, окружающих ядро, содержащее протоны и нейтроны).
Florida Standards Connections
MAFS.K12.MP.4: Модель с математикой
Точки доступа НезависимыеSC.912.P.8.In.3: Определите ядро как центр атома.
ПоддерживаетсяSC.912.P.8.Su.3: Помните, что атомы — это крошечные частицы в материалах, слишком маленькие, чтобы их можно было увидеть.
Совместное участиеSC.912.P.8.Pa.3: Осознайте, что части объекта могут быть соединены в единое целое.
SC.912.P.8.7 Интерпретация формул представления молекул и соединений с точки зрения состава и структуры. Когнитивная сложность
Уровень рейтинга 2: Базовое применение навыков и концепций
Химия нитей Предварительная оценка: Science ConnectionSC. 8.P.8.5
Признайте, что существует конечное число элементов и что их атомы объединяются множеством способов, образуя соединения, составляющие все живые и неживые вещи, с которыми мы сталкиваемся.
SC.8.P.8.6 Признать, что элементы сгруппированы в периодической таблице в соответствии с сходством их свойств.
SC.8.P.8.8 Выявление основных примеров, сравнение и классификация свойств соединений, включая кислоты, основания и соли.
SC.8.P.9.1 Исследуйте закон сохранения массы, демонстрируя и делая вывод, что масса сохраняется, когда вещества претерпевают физические и химические изменения.
Honors Science SC.912.P.8.13:
Определите выбранные функциональные группы и расскажите, как они влияют на свойства углеродных соединений.Примечания / примеры: распознавать функциональные группы в структурных формулах молекул углерода (например, сахара, белки, нуклеотиды, аминокислоты, гидроксильные группы, образующие спирты, карбонильные группы, образующие альдегиды и кетоны, карбоксильные группы, образующие карбоновые кислоты и т. Д.).
FCATBig Idea:
MatterBenchmark: 8.6: Различать силы связывания, удерживающие соединения вместе, и другие силы притяжения, включая водородные связи и силы Ван-дер-Ваальса.
8.7 Интерпретация формул, представленных молекулами и соединениями с точки зрения состава и структуры.
Пределы содержания: 8.6- Опишите, как атомы объединяются в молекулы за счет ионных, ковалентных и водородных связей. Сравните и сопоставьте характеристики взаимодействий между атомами в ионных и ковалентных соединениях и то, как эти связи образуются.



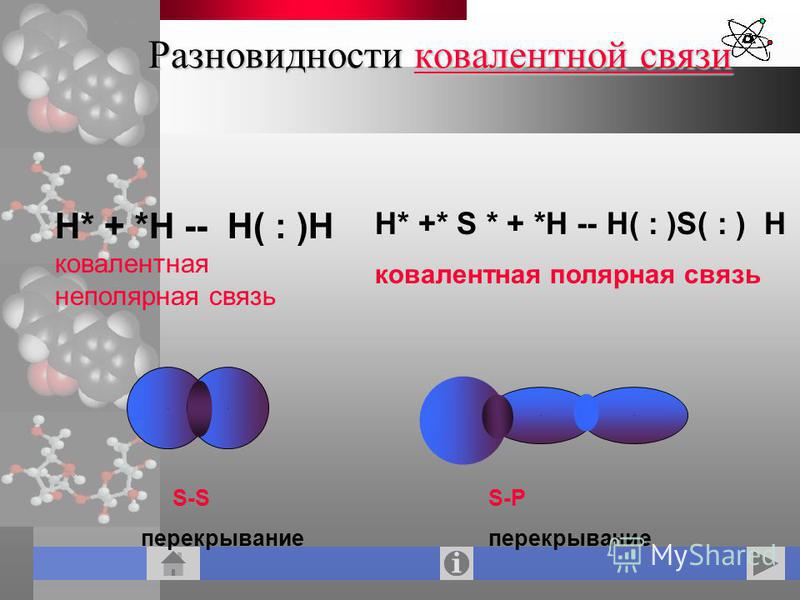 Одно мы поняли – без них умрем мы.
Одно мы поняли – без них умрем мы.
