Химия 8 класс — параграф 16 задание 3 Рудзитис, Фельдман, ГДЗ, решебник, онлайн
ГДЗ / Решебники / 8 класс / Химия / Рудзитис / §16 задание 3
ГДЗ(готовые домашние задания), решебник онлайн по химии за 8 класс авторов Рудзитис, Фельдман параграф 16, подумай, ответь, выполни…, задание 3 — вариант решения номера 3
§1. Предмет химии. Вещества и их свойства:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§2. Методы познания в химии:
Подумай, ответь, выполни…: 1 2 Тестовые задания
§4. Чистые вещества и смеси:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§6.
 Физические и химические явления. Химические реакции:
Физические и химические явления. Химические реакции:Подумай, ответь, выполни…: 1 2 3 Тестовые задания Лабораторный опыт
§7. Атомы, молекулы и ионы:
Подумай, ответь, выполни…: 2 3 4 5 6 7 8 Тестовые задания
§8. Вещества молекулярного и немолекулярного строения:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§9. Простые и сложные вещества:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§10.
 Химические элементы:
Химические элементы:Подумай, ответь, выполни…: 1 2 Тестовые задания Лабораторный опыт
§11. Относительная атомная масса химических элементов:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§12. Знаки химических элементов:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§13. Закон постоянства состава веществ:
Подумай, ответь, выполни…: 1 2 3
§14. Химические формулы. Относительная молекулярная масса:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 Тестовые задания
§15.
 Вычисления по химическим формулам. Массовая доля элемента в соединении:
Вычисления по химическим формулам. Массовая доля элемента в соединении:Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 Тестовые задания
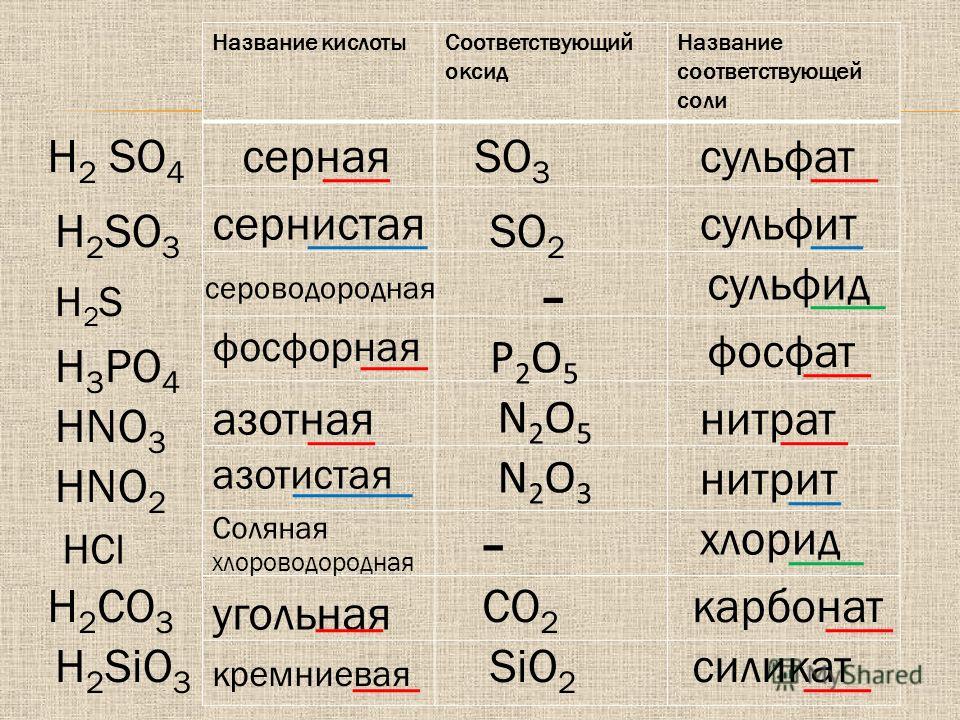
§16. Валентность химических элементов. Определение валентности элементов по формулам их соединений:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§17. Составление химических формул по валентности:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§18.
 Атомно-молекулярное учение:
Атомно-молекулярное учение:Подумай, ответь, выполни…: 1 2 3
§19. Закон сохранения массы веществ:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§20. Химические уравнения:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§21. Типы химических реакций:
Подумай, ответь, выполни…: 1 2 3 Лабораторный опыт 1 Лабораторный опыт 2
§22. Кислород, его общая характеристика, нахождение в природе и получение:
Подумай, ответь, выполни.
§23. Свойства кислорода:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания Лабораторный опыт
§24. Применение кислорода. Круговорот кислорода в природе:
Подумай, ответь, выполни…: 2 3 4 5 Тестовые задания
§25. Практическая работа 3. Получение и свойства кислорода:
Практическая работа 3
§26. Озон. Аллотропия кислорода:
Подумай, ответь, выполни.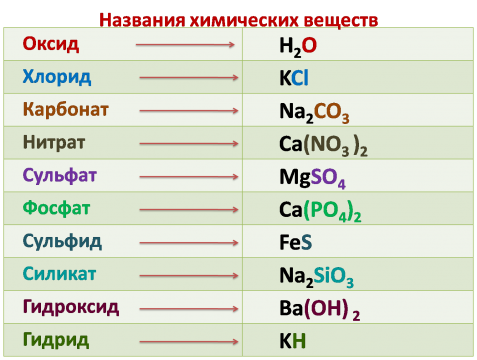 ..:
1
2
3
Тестовые задания
..:
1
2
3
Тестовые задания
§27. Воздух и его состав:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 Тестовые задания
§28. Водород, его общая характеристика, нахождение в природе и получение:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§29. Свойства и применение водорода:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания Лабораторный опыт
§30.
 Практическая работа 4. Получение водорода и исследование его свойств:
Практическая работа 4. Получение водорода и исследование его свойств:Практическая работа 4
§31. Вода:
Подумай, ответь, выполни…: 1 2 3 4
§32. Химические свойства и применение воды:
Подумай, ответь, выполни…: 1 Тестовые задания
§33. Вода – растворитель. Растворы:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§34. Массовая доля растворённого вещества:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 9 Тестовые задания
§36.
 Количество вещества. Моль. Малярная масса:
Количество вещества. Моль. Малярная масса:Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§37. Вычисления с использованием понятий «количество вещества» и «молярная масса»:
Подумай, ответь, выполни…: 1 2 3
§38. Закон Авогадро. Малярный объём газов:
Подумай, ответь, выполни…: 1 2 3 4
§39. Объёмные отношения газов при химических реакциях:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§40. Оксиды:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§41.
 Гидроксиды. Основания:
Гидроксиды. Основания:Подумай, ответь, выполни…: 1 2 3
§42. Химические свойства оснований:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт 1 Лабораторный опыт 3 Лабораторный опыт 4
§43. Амфотерные оксиды и гидроксиды:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
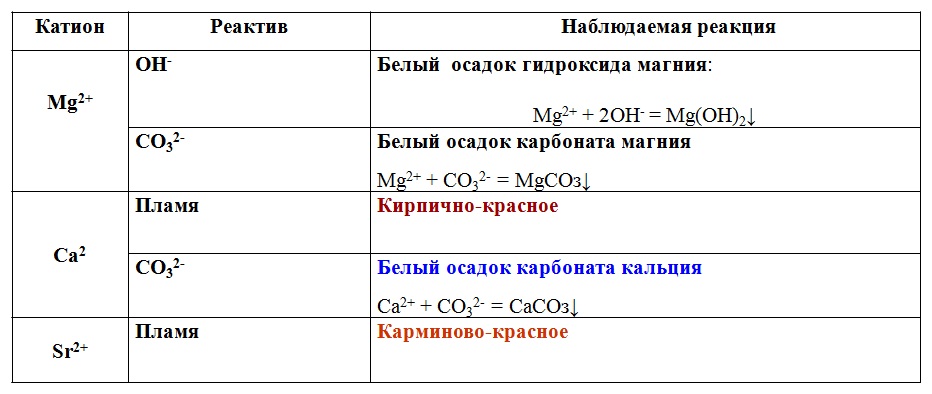
§44. Кислоты:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§45.
 Химические свойства кислот:
Химические свойства кислот:Подумай, ответь, выполни…: 1 2 3 4 5 Лабораторный опыт 2
§46. Соли:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§47. Химические свойства солей:
Подумай, ответь, выполни…: 1 2 3 4 5
§48. Практическая работа 6. Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений»:
Практическая работа 6
§49. Классификация химических элементов:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§50.
 Периодический закон Д. И. Менделеева:
Периодический закон Д. И. Менделеева:Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§51. Периодическая таблица химических элементов:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§52. Строение атома:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§53. Распределение электронов по энергетическим уровням:
Подумай, ответь, выполни…: 1 2 Тестовые задания
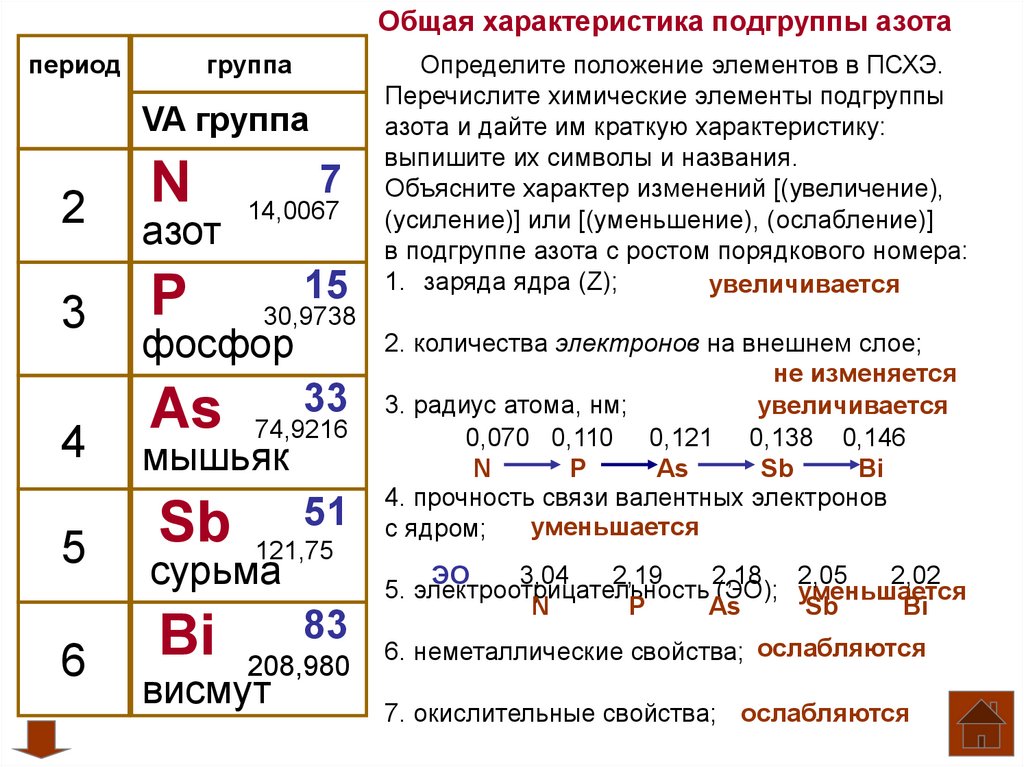
§54. Значение периодического закона:
Подумай, ответь, выполни…: 1 2
§55.
 Электроотрицательность химических элементов:
Электроотрицательность химических элементов:Подумай, ответь, выполни…: 1 2 Тестовые задания
§56. Основные виды химической связи:
Подумай, ответь, выполни…: 1 2 3 4
§57. Степень окисления:
Подумай, ответь, выполни…: 1 2 3 4
Химия 8 класс. Тесты, тренажеры, контрольные работы
Тесты и тренажеры по химии- Химия 8: Окислительно-восстановительные реакции — 12 вопросов.… …
- Химия 8: Классификация и свойства кислот, оснований, оксидов, солей — 12 вопросов.… …
- Химия 8: Электролитическая диссоциация — 16 вопросов.… …
- Химия 8: Химические реакции. Уравнения реакций — 10 вопросов.… …
- Химия 8: Соединение химических элементов — 10 вопросов.
 … …
… … - Химия 8: Кристаллические решетки — 12 вопросов.… …
- Химия 8: Оксиды, основания, кислоты и соли — 10 вопросов.… …
- Химия 8: Бинарные соединения — 10 вопросов.… …
- Химия 8 класс: ИТОГОВЫЙ ТЕСТ за год — 26 вопросов.… …
- Химия 8 класс: Тест за III триместр — 24 вопроса.… …
- Химия 8 класс: Тест за II триместр — 24 вопроса.… …
- Химия 8 класс: Тест за I триместр — 28 вопросов.… …
- Химия 8: Молярная масса. Молярный объем — 14 вопросов.… …
- Химия 8: Атомы химических элементов — 12 вопросов.… …
- Химия 8: Химическая связь — 10 вопросов.… …
- Химия 8: Строение электронных оболочек атома — 12 вопросов.… …
- Химия 8: Строение атома химического элемента — 14 вопросов.… …
- Химия 8: Химическая формула — 14 вопросов.… …
- Химия 8: Физические и химические свойства веществ — 20 вопросов.… …
УМК Габриелян — Павлова. Контр. и самост. работы по химии: 8 класс.
Контр. и самост. работы по химии: 8 класс.
УМК Габриелян — Ястребова. Поурочные планы по химии 8кл.
К любому УМК — Добротин. Химия 8. Контрольные работы в новом формате (итоговая КР)
Химия 8 класс. Основные темыВведение
§ 1. Химия — часть естествознания
§ 2. Предмет химии. Вещества
§ 3. Превращения веществ. Роль химии в жизни человека
§ 4. Краткий очерк о истории развития химии
§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
§ 6. Химические формулы. Относительная атомная и молекулярная массы
Глава первая. Атомы химических элементов
§ 7. Основные сведения о строении атомов
§ 8. Изменения в составе ядер атомов химических элементов. Изотопы
§ 9. Строение электронных оболочек атомов
§ 10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
§ 11. Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой
§ 12. Ковалентная полярная химическая связь
§ 13. Металлическая химическая связь
Глава вторая. Простые вещества
§ 14. Простые вещества — металлы
§ 15. Простые вещества — неметаллы
§ 16. Количество вещества
§ 17. Молярный объём газов
Глава третья. Соединения химических элементов
§ 18. Степень окисления
§ 19. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
§ 20. Основания
§ 21. Кислоты
§ 22. Соли
§ 23. Кристаллические решётки
§ 24. Чистые вещества и смеси
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
Глава четвёртая. Изменения, происходящие с веществами
§ 26. Физические явления в химии
§ 27. Химические реакции
§ 28. Химические уравнения
§ 29. Расчёты по химическим уравнениям
§ 30. Реакции разложения
§ 31. Реакции соединения
§ 32. Реакции замещения
§ 33.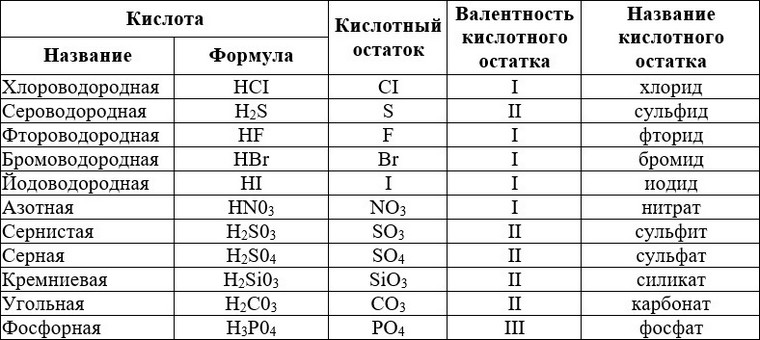 Реакция обмена
Реакция обмена
§ 34. Типы химических реакций на примере свойств воды
Глава пятая. Растворение. Растворы. Реакции ионного обмена
§ 35. Растворение. Растворимость веществ в воде
§ 36. Электролитическая диссоциация
§ 37. Основные положения теории электролитической диссоциации
§ 38. Ионные уравнения
§ 39. Кислоты, их классификация и свойства
§ 40. Основания, их классификация и свойства
§ 41. Оксиды, их классификация и свойства
§ 42. Соли, их классификация и свойства
§ 43. Генетическая связь между классами веществ
§ 44. Окислительно-восстановительные реакции
Рекомендуемые материалы для очного контроля знаний
по предмету «Химия 8 класс»:
- Контрольно-измерительные материалы по химии 8 класс / Н.П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016
- Химия. 8 класс. Тетрадь для оценки качества знаний. Габриелян О.С., Купцова А.В. (2015, 112с.)
- Химия. 8 класс. Контрольные и проверочные работы.
 Габриелян О.С. и др. (2014, 224с.)
Габриелян О.С. и др. (2014, 224с.) - Химия в тестах, задачах, упражнениях. 8 класс. Габриелян О.С., Смирнова Т.В., Сладков С.А. (2014, 224с.)
- Контрольные и самостоятельные работы по химии. 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
- Тесты по химии. 8 класс. Первоначальные химические понятия… К учебнику Рудзитиса Г.Е., … (2013, 144с.)
- Тесты по химии. 8 класс. Периодический закон и периодическая система… К учебнику Рудзитиса Г.Е., …(2013, 96с.)
- Химия 8 класс. Тесты. В 2 ч. Ким Е.П. (2011; 64с., 64с.)
- Химия 8 класс. Экспресс-диагностика. Расулова Г.Л. (2014, 112с.)
Перейти на Главную страницу сайта.
1.2: Классификация вещества — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21692
Цели обучения
- Классифицировать материю.

Химики изучают структуру, физические свойства и химические свойства материальных веществ. Они состоят из материи , то есть всего, что занимает пространство и имеет массу. Золото и иридий — это материя, как и арахис, люди и почтовые марки. Дым, смог и веселящий газ — это материя. Однако энергия, свет и звук не являются материей; идеи и эмоции тоже не имеют значения.
Масса объекта — это количество содержащейся в нем материи. Не путайте массу объекта с его вес , который представляет собой силу, вызванную гравитационным притяжением, которое действует на объект. Масса — это фундаментальное свойство объекта, не зависящее от его местоположения. С физической точки зрения масса объекта прямо пропорциональна силе, необходимой для изменения его скорости или направления. Более подробное обсуждение различий между весом и массой и единицами, используемыми для их измерения, включено в Основные навыки 1 (раздел 1.9). Вес, с другой стороны, зависит от местоположения объекта. Космонавт, масса которого 95 кг весит около 210 фунтов на Земле, но только около 35 фунтов на Луне, потому что гравитационная сила, которую он или она испытывает на Луне, составляет примерно одну шестую силы, испытываемой на Земле. В практических целях в лабораториях вес и масса часто используются взаимозаменяемо. Поскольку считается, что сила тяжести одинакова на всей поверхности Земли, 2,2 фунта (вес) равняется 1,0 кг (масса), независимо от местоположения лаборатории на Земле.
Космонавт, масса которого 95 кг весит около 210 фунтов на Земле, но только около 35 фунтов на Луне, потому что гравитационная сила, которую он или она испытывает на Луне, составляет примерно одну шестую силы, испытываемой на Земле. В практических целях в лабораториях вес и масса часто используются взаимозаменяемо. Поскольку считается, что сила тяжести одинакова на всей поверхности Земли, 2,2 фунта (вес) равняется 1,0 кг (масса), независимо от местоположения лаборатории на Земле.
При нормальных условиях существует три различных состояния вещества: твердое, жидкое и газообразное. Твердые тела относительно жесткие и имеют фиксированные формы и объемы. Камень, например, является твердым телом. Напротив, жидкости имеют фиксированный объем, но текут, принимая форму своих емкостей, таких как напиток в банке. Газы , такие как воздух в автомобильной шине, не имеют ни фиксированной формы, ни фиксированного объема и расширяются, чтобы полностью заполнить свои сосуды. В то время как объем газов сильно зависит от их температуры и давления (величины силы, действующей на данную площадь), объемы жидкостей и твердых тел практически не зависят от температуры и давления. Материя часто может переходить из одного физического состояния в другое в процессе, называемом физическое изменение . Например, жидкую воду можно нагреть с образованием газа, называемого паром, или пар можно охладить с образованием жидкой воды. Однако такие изменения состояния не влияют на химический состав вещества.
В то время как объем газов сильно зависит от их температуры и давления (величины силы, действующей на данную площадь), объемы жидкостей и твердых тел практически не зависят от температуры и давления. Материя часто может переходить из одного физического состояния в другое в процессе, называемом физическое изменение . Например, жидкую воду можно нагреть с образованием газа, называемого паром, или пар можно охладить с образованием жидкой воды. Однако такие изменения состояния не влияют на химический состав вещества.
Чистые вещества и смеси
Чистое химическое вещество – это любое вещество, имеющее фиксированный химический состав и характерные свойства. Кислород, например, представляет собой чистое химическое вещество, представляющее собой бесцветный газ без запаха при температуре 25°C. Очень немногие образцы материи состоят из чистых веществ; вместо этого большинство из них представляют собой смеси, представляющие собой комбинации двух или более чистых веществ в различных пропорциях, в которых отдельные вещества сохраняют свою идентичность. Воздух, водопроводная вода, молоко, сыр с плесенью, хлеб и грязь — все это смеси. Если все части материала находятся в одном и том же состоянии, не имеют видимых границ и однородны на всем протяжении, то материал 9.0030 однородный . Примерами однородных смесей являются воздух, которым мы дышим, и водопроводная вода, которую мы пьем. Однородные смеси также называют растворами. Так, воздух есть раствор азота, кислорода, водяного пара, двуокиси углерода и некоторых других газов; водопроводная вода представляет собой раствор небольшого количества нескольких веществ в воде. Однако конкретные составы обоих этих растворов не фиксированы, а зависят как от источника, так и от местоположения; например, состав водопроводной воды в Бойсе, штат Айдахо, отличается от состава водопроводной воды в Буффало, штат Нью-Йорк.
Очень немногие образцы материи состоят из чистых веществ; вместо этого большинство из них представляют собой смеси, представляющие собой комбинации двух или более чистых веществ в различных пропорциях, в которых отдельные вещества сохраняют свою идентичность. Воздух, водопроводная вода, молоко, сыр с плесенью, хлеб и грязь — все это смеси. Если все части материала находятся в одном и том же состоянии, не имеют видимых границ и однородны на всем протяжении, то материал 9.0030 однородный . Примерами однородных смесей являются воздух, которым мы дышим, и водопроводная вода, которую мы пьем. Однородные смеси также называют растворами. Так, воздух есть раствор азота, кислорода, водяного пара, двуокиси углерода и некоторых других газов; водопроводная вода представляет собой раствор небольшого количества нескольких веществ в воде. Однако конкретные составы обоих этих растворов не фиксированы, а зависят как от источника, так и от местоположения; например, состав водопроводной воды в Бойсе, штат Айдахо, отличается от состава водопроводной воды в Буффало, штат Нью-Йорк. Хотя большинство растворов, с которыми мы сталкиваемся, являются жидкими, растворы также могут быть твердыми. Серое вещество, до сих пор используемое некоторыми стоматологами для пломбирования полостей зубов, представляет собой сложный твердый раствор, содержащий 50 % ртути и 50 % порошка, состоящего в основном из серебра, олова и меди с небольшими количествами цинка и ртути. Твердые растворы двух и более металлов принято называть сплавами.
Хотя большинство растворов, с которыми мы сталкиваемся, являются жидкими, растворы также могут быть твердыми. Серое вещество, до сих пор используемое некоторыми стоматологами для пломбирования полостей зубов, представляет собой сложный твердый раствор, содержащий 50 % ртути и 50 % порошка, состоящего в основном из серебра, олова и меди с небольшими количествами цинка и ртути. Твердые растворы двух и более металлов принято называть сплавами.
Если состав материала не совсем однороден, то он гетерогенен (например, тесто для печенья с шоколадной крошкой, сыр с плесенью и грязь). Смеси, которые кажутся гомогенными, после микроскопического исследования часто оказываются гетерогенными. Молоко, например, кажется однородным, но при рассмотрении под микроскопом оно ясно состоит из крошечных шариков жира и белка, диспергированных в воде. Компоненты гетерогенных смесей обычно можно разделить простыми средствами. Смеси твердой и жидкой фаз, такие как песок в воде или чайные листья в чае, легко отделяются путем фильтрации, которая заключается в пропускании смеси через барьер, такой как сито, с отверстиями или порами, которые меньше, чем твердые частицы. В принципе, смеси двух или более твердых веществ, таких как сахар и соль, можно разделить путем микроскопического исследования и сортировки. Однако обычно необходимы более сложные операции, например, при отделении золотых самородков от речного гравия путем промывки. Сначала из речной воды отфильтровывают твердый материал; затем твердые вещества отделяют путем осмотра. Если золото внедрено в горную породу, возможно, его придется выделять химическими методами.
В принципе, смеси двух или более твердых веществ, таких как сахар и соль, можно разделить путем микроскопического исследования и сортировки. Однако обычно необходимы более сложные операции, например, при отделении золотых самородков от речного гравия путем промывки. Сначала из речной воды отфильтровывают твердый материал; затем твердые вещества отделяют путем осмотра. Если золото внедрено в горную породу, возможно, его придется выделять химическими методами.
. Гомогенные смеси (растворы) могут быть разделены на составляющие их вещества физическими процессами, основанными на различиях в некоторых физических свойствах, таких как различия в их температурах кипения. Двумя из этих методов разделения являются дистилляция и кристаллизация. Дистилляция использует разницу в летучести, меру того, насколько легко вещество превращается в газ при данной температуре. Простой перегонный аппарат для разделения смеси веществ, хотя бы одно из которых является жидкостью. Наиболее летучий компонент закипает первым и снова конденсируется в жидкость в водоохлаждаемом холодильнике, из которого стекает в приемную колбу. Если перегоняют, например, раствор соли и воды, то более летучий компонент, чистая вода, собирается в приемной колбе, а соль остается в перегонной колбе.
Простой перегонный аппарат для разделения смеси веществ, хотя бы одно из которых является жидкостью. Наиболее летучий компонент закипает первым и снова конденсируется в жидкость в водоохлаждаемом холодильнике, из которого стекает в приемную колбу. Если перегоняют, например, раствор соли и воды, то более летучий компонент, чистая вода, собирается в приемной колбе, а соль остается в перегонной колбе.
Смеси двух или более жидкостей с разными точками кипения можно разделить с помощью более сложного перегонного аппарата. Одним из примеров является переработка сырой нефти в ряд полезных продуктов: авиационное топливо, бензин, керосин, дизельное топливо и смазочное масло (в приблизительном порядке убывания летучести). Другим примером является дистилляция спиртных напитков, таких как бренди или виски. (Эта относительно простая процедура доставила немало головной боли федеральным властям в XIX веке.20-е годы в эпоху Сухого закона, когда нелегальные перегонные аппараты распространялись в отдаленных регионах Соединенных Штатов!)
Другим примером является дистилляция спиртных напитков, таких как бренди или виски. (Эта относительно простая процедура доставила немало головной боли федеральным властям в XIX веке.20-е годы в эпоху Сухого закона, когда нелегальные перегонные аппараты распространялись в отдаленных регионах Соединенных Штатов!)
Кристаллизация разделяет смеси на основе различий в растворимости, мера того, сколько твердого вещества остается растворенным в заданном количестве указанной жидкости . Большинство веществ лучше растворяются при более высоких температурах, поэтому смесь двух или более веществ можно растворить при повышенной температуре, а затем дать медленно остыть. В качестве альтернативы жидкости, называемой растворителем, можно позволить испариться. В любом случае наименее растворимое из растворенных веществ, то, которое с наименьшей вероятностью останется в растворе, обычно сначала образует кристаллы, и эти кристаллы можно удалить из оставшегося раствора фильтрованием.
Большинство смесей можно разделить на чистые вещества, которые могут быть элементами или соединениями. элемент , такой как серый металлический натрий, представляет собой вещество, которое нельзя разложить на более простые путем химических превращений; соединение , такое как белый кристаллический хлорид натрия, содержит два или более элементов и имеет химические и физические свойства, которые обычно отличаются от свойств элементов, из которых оно состоит. Лишь за некоторыми исключениями, конкретное соединение имеет один и тот же элементный состав (одинаковые элементы в одних и тех же пропорциях) независимо от его источника или истории. Химический состав вещества изменяется в процессе, называемом химическая замена . Превращение двух или более элементов, таких как натрий и хлор, в химическое соединение, хлорид натрия, является примером химического изменения, часто называемого химической реакцией. В настоящее время известно около 118 элементов, но из этих 118 элементов получены миллионы химических соединений. Известные элементы перечислены в периодической таблице.
Химический состав вещества изменяется в процессе, называемом химическая замена . Превращение двух или более элементов, таких как натрий и хлор, в химическое соединение, хлорид натрия, является примером химического изменения, часто называемого химической реакцией. В настоящее время известно около 118 элементов, но из этих 118 элементов получены миллионы химических соединений. Известные элементы перечислены в периодической таблице.
Рисунок \(\PageIndex{5}\): Разложение воды на водород и кислород с помощью электролиза. Вода — это химическое соединение; водород и кислород являются элементами. батарея подключена к аноду и катоду, помещенному в химический стакан, наполненный водой. Две перевернутые пробирки погружают в воду и помещают над каждым из электродов для сбора газообразных продуктов. Увеличительные указатели показывают молекулярную структуру воды в стакане, а также газообразный водород, собранный на стороне анода, и газообразный кислород на стороне катода.

Различные определения материи: Различные определения материи, YouTube (открывается в новом окне) [youtu.be]
В общем, обратный химический процесс расщепляет соединения на их элементы. Например, вода (соединение) может быть разложена на водород и кислород (оба элемента) в процессе, называемом электролизом. При электролизе электричество обеспечивает энергию, необходимую для разделения соединения на составные элементы (рис. \(\PageIndex{5}\)). Подобный метод широко используется для получения чистого алюминия, элемента, из его руд, представляющих собой смеси соединений. Поскольку для электролиза требуется много энергии, стоимость электроэнергии является самой большой статьей расходов, связанных с производством чистого алюминия. Таким образом, переработка алюминия является экономически выгодной и экологически чистой.
Общая организация материи и методы разделения смесей представлены на рисунке \(\PageIndex{6}\).
Пример \(\PageIndex{1}\)
Идентифицировать каждое вещество как соединение, элемент, гетерогенную смесь или гомогенная смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок, содержащий атомы алюминия и кислорода в соотношении 2:3
- селен
Дано : химическое вещество
Запрошено : его классификация
Стратегия:
- Решите, является ли вещество химически чистым. Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением.
- Если вещество не является химически чистым, оно представляет собой либо гетерогенную смесь, либо гомогенную смесь. Если его состав везде однороден, то это однородная смесь.

Раствор
- A Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрованием. B Поскольку состав раствора везде однороден, это однородная смесь.
- А Апельсиновый сок содержит как твердые, так и жидкие частицы (мякоть); он не является химически чистым. B Поскольку его состав неоднороден, апельсиновый сок представляет собой неоднородную смесь.
- A Компакт-диск представляет собой твердый материал, содержащий более одного элемента, по краям которого видны области разного состава. Следовательно, компакт-диск не является химически чистым. B Области разного состава указывают на то, что компакт-диск представляет собой неоднородную смесь.
- A Оксид алюминия представляет собой отдельное химически чистое соединение.
- A Селен — один из известных элементов.

Упражнение \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- Заправка для салата «ранчо»
- сахар столовый (сахароза)
- Ответ А
раствор
- Ответ Б
элемент
- Ответ C
гетерогенная смесь
- Ответ D
компаунд
Различные определения изменений: Различные определения изменений, YouTube(opens in new window) [youtu.be] (opens in new window)
Резюме
Вещество можно классифицировать по физическим и химическим свойствам. Материя – это все, что занимает пространство и имеет массу. Три состояния вещества – твердое, жидкое и газообразное. Физическое изменение предполагает переход вещества из одного состояния вещества в другое без изменения его химического состава. Большая часть материи состоит из смесей чистых веществ, которые могут быть гомогенными (однородными по составу) или гетерогенными (разные области обладают разным составом и свойствами). Чистые вещества могут быть как химическими соединениями, так и элементами. Соединения можно разложить на элементы химическими реакциями, но нельзя разделить химическими средствами элементы на более простые вещества. Свойства веществ можно разделить на физические и химические. Ученые могут наблюдать физические свойства без изменения состава вещества, тогда как химические свойства описывают склонность вещества к химическим изменениям (химическим реакциям), которые изменяют его химический состав. Физические свойства могут быть интенсивными или экстенсивными. Интенсивные свойства одинаковы для всех образцов; не зависят от размера выборки; и включают, например, цвет, физическое состояние и температуры плавления и кипения.
Материя – это все, что занимает пространство и имеет массу. Три состояния вещества – твердое, жидкое и газообразное. Физическое изменение предполагает переход вещества из одного состояния вещества в другое без изменения его химического состава. Большая часть материи состоит из смесей чистых веществ, которые могут быть гомогенными (однородными по составу) или гетерогенными (разные области обладают разным составом и свойствами). Чистые вещества могут быть как химическими соединениями, так и элементами. Соединения можно разложить на элементы химическими реакциями, но нельзя разделить химическими средствами элементы на более простые вещества. Свойства веществ можно разделить на физические и химические. Ученые могут наблюдать физические свойства без изменения состава вещества, тогда как химические свойства описывают склонность вещества к химическим изменениям (химическим реакциям), которые изменяют его химический состав. Физические свойства могут быть интенсивными или экстенсивными. Интенсивные свойства одинаковы для всех образцов; не зависят от размера выборки; и включают, например, цвет, физическое состояние и температуры плавления и кипения. Экстенсивные свойства зависят от количества материала и включают массу и объем. Соотношение двух экстенсивных свойств, массы и объема, является важным интенсивным свойством, называемым плотностью.
Экстенсивные свойства зависят от количества материала и включают массу и объем. Соотношение двух экстенсивных свойств, массы и объема, является важным интенсивным свойством, называемым плотностью.
Авторы и авторство
1.2: Classification of Matter распространяется под лицензией CC BY-NC-SA 3.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- химическая замена
- компаунд
- Кристаллизация
- дистилляция
- элемент
- газ
- гетерогенная смесь
- гомогенная смесь
- жидкость
- масса
- материя
- Физическое изменение
- давление
- твердый
- вес
Различные виды химии – химия и биохимия
По сути, химия – это изучение материи и ее изменений. То, как химики изучают материю и изменения, и типы изучаемых систем резко различаются. Традиционно химия делится на пять основных поддисциплин: органическая, аналитическая, физическая, неорганическая, и биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, бионеорганическую химию, химию окружающей среды и так далее. Все эти области химии в некоторой степени рассматриваются на наших занятиях здесь, в UWL, а также в исследовательских интересах нашего факультета на химическом факультете. Следующие описания пяти основных субдисциплин были написаны несколькими нашими преподавателями в своей области знаний. Все наши преподаватели будут рады уточнить и/или обсудить другие аспекты химии, которые не описаны ниже! Аккредитованные программы UW-La Crosse по химии и биохимии сочетают технический, практический исследовательский опыт с развитием практических навыков.
То, как химики изучают материю и изменения, и типы изучаемых систем резко различаются. Традиционно химия делится на пять основных поддисциплин: органическая, аналитическая, физическая, неорганическая, и биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, бионеорганическую химию, химию окружающей среды и так далее. Все эти области химии в некоторой степени рассматриваются на наших занятиях здесь, в UWL, а также в исследовательских интересах нашего факультета на химическом факультете. Следующие описания пяти основных субдисциплин были написаны несколькими нашими преподавателями в своей области знаний. Все наши преподаватели будут рады уточнить и/или обсудить другие аспекты химии, которые не описаны ниже! Аккредитованные программы UW-La Crosse по химии и биохимии сочетают технический, практический исследовательский опыт с развитием практических навыков.
Органика Органическая химия – это раздел химии, который включает изучение молекул жизни. В основном он касается изучения структуры и поведения этих молекул, которые состоят всего из нескольких различных типов атомов: углерода, водорода, кислорода, азота и некоторых других. Это атомы, используемые для создания молекул, необходимых всем растениям и животным для их выживания. Традиционные химики-органики занимаются синтезом новых молекул и разработкой новых реакций, которые могли бы сделать эти синтезы более эффективными. Типы молекул, синтезируемых химиками-органиками, включают полезные вещи, такие как лекарства, ароматизаторы, консерванты, ароматизаторы, пластмассы (полимеры) и сельскохозяйственные химикаты (удобрения и пестициды), а иногда включают необычные молекулы, встречающиеся в природе, или те, которые могут просто создать проблему для человека. делать. Кроме того, понимание органической химии важно для изучения биохимии и молекулярной биологии, потому что биомолекулы, такие как белки, сахара, жиры и нуклеиновые кислоты (ДНК и РНК), являются органическими молекулами, хотя и очень большими.
В основном он касается изучения структуры и поведения этих молекул, которые состоят всего из нескольких различных типов атомов: углерода, водорода, кислорода, азота и некоторых других. Это атомы, используемые для создания молекул, необходимых всем растениям и животным для их выживания. Традиционные химики-органики занимаются синтезом новых молекул и разработкой новых реакций, которые могли бы сделать эти синтезы более эффективными. Типы молекул, синтезируемых химиками-органиками, включают полезные вещи, такие как лекарства, ароматизаторы, консерванты, ароматизаторы, пластмассы (полимеры) и сельскохозяйственные химикаты (удобрения и пестициды), а иногда включают необычные молекулы, встречающиеся в природе, или те, которые могут просто создать проблему для человека. делать. Кроме того, понимание органической химии важно для изучения биохимии и молекулярной биологии, потому что биомолекулы, такие как белки, сахара, жиры и нуклеиновые кислоты (ДНК и РНК), являются органическими молекулами, хотя и очень большими. Студенты, изучающие органическую химию, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, делают карьеру в медицине или могут искать другие возможности трудоустройства.
Студенты, изучающие органическую химию, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, делают карьеру в медицине или могут искать другие возможности трудоустройства.
Вернуться к началу
Аналитическая Аналитическая химия — это наука об идентификации и количественном определении материалов в смеси. Химики-аналитики могут изобретать процедуры анализа, а также использовать или модифицировать существующие. Они также контролируют, выполняют и интерпретируют анализ. Студенты, изучающие аналитическую химию, часто продолжают работать в лабораториях судебной экспертизы, экологических или фармацевтических компаниях, работают, управляют и / или разрабатывают процедуры обеспечения качества, проводят исследования или преподают в колледжах и университетах.
Вернуться к началу
Физическая Физическая химия – это изучение фундаментальных физических принципов, определяющих поведение атомов, молекул и других химических систем. Физические химики изучают широкий спектр тем, таких как скорость реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, которые специализируются на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании. Многие текущие исследования физической химии в промышленности и научных кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие происходят столкновения и перегруппировки связей, как быстро они происходят, сколько стадий и т. д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в формы, которые они имеют, как структура связана с функцией, что заставляет нерв работать и т.
Физические химики изучают широкий спектр тем, таких как скорость реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, которые специализируются на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании. Многие текущие исследования физической химии в промышленности и научных кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие происходят столкновения и перегруппировки связей, как быстро они происходят, сколько стадий и т. д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в формы, которые они имеют, как структура связана с функцией, что заставляет нерв работать и т. д.) — этот тип исследования является биофизической химией. Третьи могут использовать физические методы для характеристики полимеров или изучения экологических систем.
д.) — этот тип исследования является биофизической химией. Третьи могут использовать физические методы для характеристики полимеров или изучения экологических систем.
Вернуться к началу
Неорганическая Под неорганической химией обычно понимаются области химии, которые не имеют отношения к углероду. Однако углерод очень важен во многих неорганических соединениях, и существует целая область исследований, известная как металлоорганическая химия, которая представляет собой гибрид традиционных дисциплин органической и неорганической химии. Некоторыми областями неорганической химии, которые особенно важны, являются катализ, химия материалов и бионеорганическая химия. Катализаторы — это химические вещества, которые увеличивают скорость реакции, не расходуясь, и обычно основаны на переходных металлах (обычно) металлоорганических комплексах переходных металлов). Это чрезвычайно важная область для промышленности, и многие химики, которых можно было бы назвать как химики-неорганики или металлоорганические химики работают в этой области. Химия материалов — это область, связанная с проектированием и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества. Часто химики-неорганики, работающие в этой области, занимаются синтезом и определением характеристик соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Бионеорганические химики изучают функцию металлосодержащих соединений в живых организмах. Студенты, изучающие неорганическую химию, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие возможности трудоустройства.
Химия материалов — это область, связанная с проектированием и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества. Часто химики-неорганики, работающие в этой области, занимаются синтезом и определением характеристик соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Бионеорганические химики изучают функцию металлосодержащих соединений в живых организмах. Студенты, изучающие неорганическую химию, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие возможности трудоустройства.
Вернуться к началу
Биохимия Биохимия — это изучение химических принципов, лежащих в основе основных биологических систем. По существу, биохимические исследования направлены на то, чтобы охарактеризовать связь между структурой и функцией биологических макромолекул. В частности, биохимические исследования позволили получить более полное представление о регенеративной медицине, инфекционных заболеваниях, трансплантации органов/тканей, клинической диагностике и генетических заболеваниях. Студенты, которые специализируются на биохимии, делают очень успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или государственные исследовательские учреждения. Некоторые студенты также объединяют свои знания в области биохимии со степенью магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше взвешивать затраты и прибыль при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» нажмите здесь.
Студенты, которые специализируются на биохимии, делают очень успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или государственные исследовательские учреждения. Некоторые студенты также объединяют свои знания в области биохимии со степенью магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше взвешивать затраты и прибыль при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» нажмите здесь.
Вернуться к началу
Графические обозначения:
Органическая химия : Восстановление камфоры боргидридом натрия.
Аналитическая химия : Масс-спектр диэтиламина.
Физическая химия : Иллюстрация момента инерции молекулы, такой как этан.
Неорганическая химия : Рентгеновская кристаллическая структура нового твердого неорганического соединения, синтезированного исследовательской группой доктора Роба Макгаффа.

 … …
… … Габриелян О.С. и др. (2014, 224с.)
Габриелян О.С. и др. (2014, 224с.)