Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| М | кг/моль, г/моль | |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля |  | Безразмерная |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|
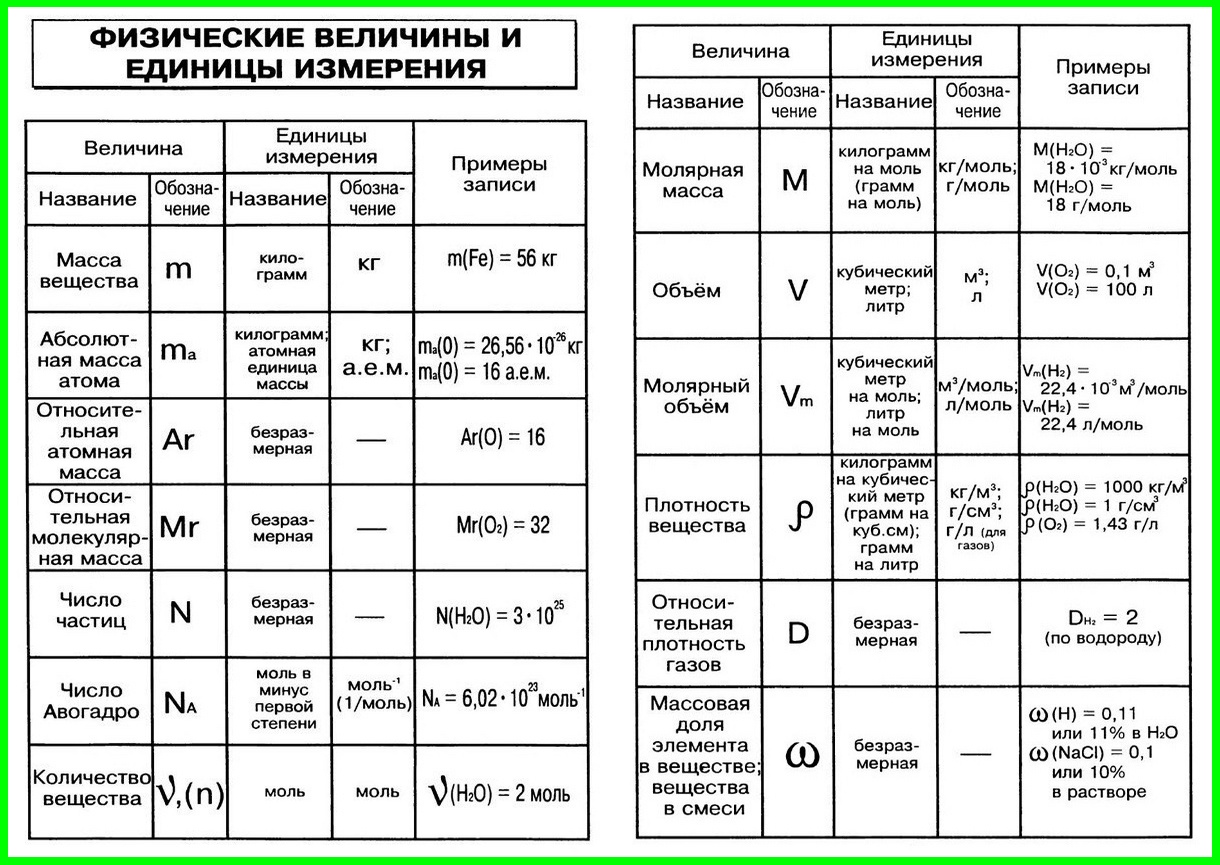
2. Соотношения между единицами физических величин

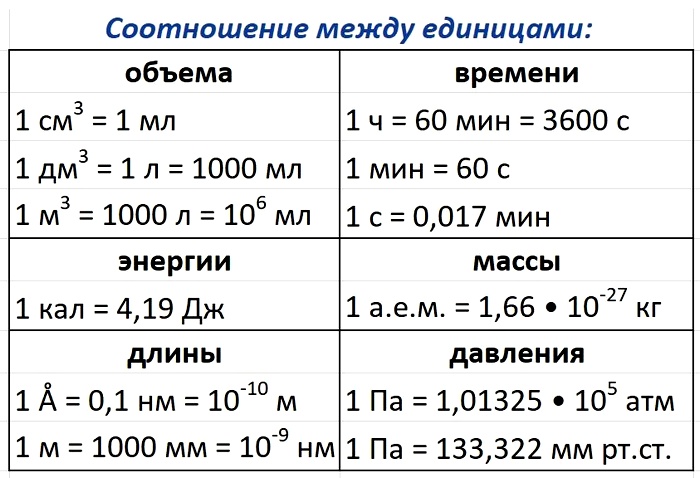

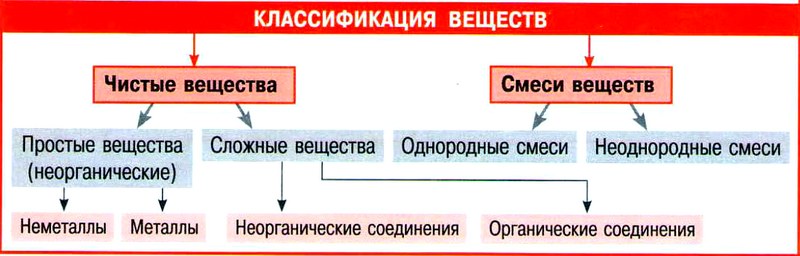
3. Химические формулы в 8 классе
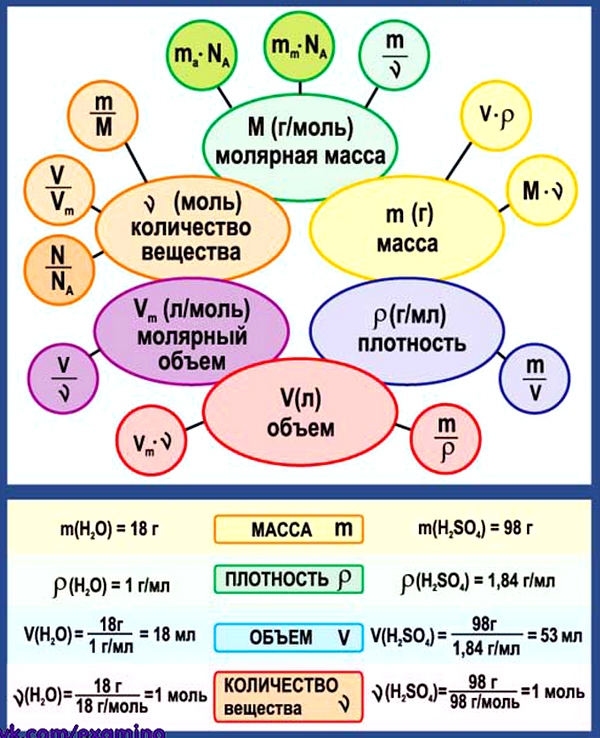
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
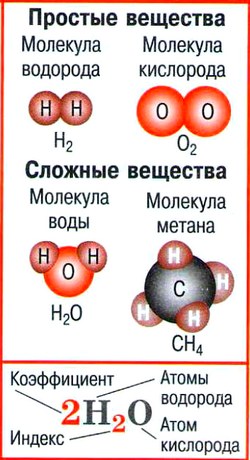
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Важнейшие классы неорганических веществ

Воздух. Кислород. Горение

Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Химия, 8–9 класс: уроки, тесты, задания
Первоначальные химические понятия и теоретические представления
-
Предмет химии
-
Физические тела и вещества
-
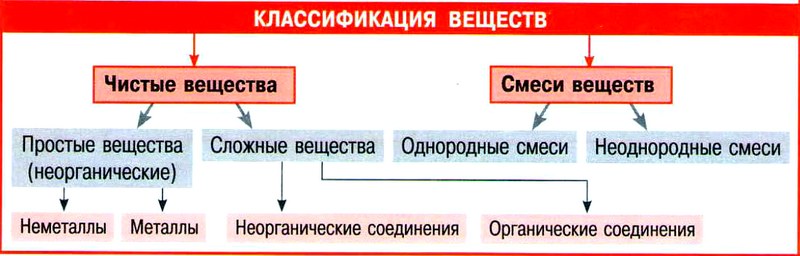
Чистые вещества и смеси
-
Разделение смесей. Методы очистки веществ
-
Атомы и молекулы
-
Химические элементы. Знаки химических элементов
-
Закон постоянства состава
-
Химические формулы
-
Простые и сложные вещества
-
Валентность. Степень окисления. Составление формул по валентностям и степеням окисления
-
Физические и химические явления
-
Признаки и условия протекания химических реакций
-
Закон сохранения массы веществ
-
Уравнения химических реакций
Классы неорганических веществ
-
Классификация веществ
-
Металлы
-
Неметаллы
-
Оксиды
-
Основания
-
Кислоты
-
Амфотерные гидроксиды
-
Соли
-
Взаимосвязь между классами неорганических веществ
Периодический закон и строение атомов
-
Периодический закон
-
Периодическая система
-
Строение ядра атома
-
Строение электронной оболочки атома
-
Периодическая таблица и закономерности изменения свойств химических элементов
Строение вещества
-
Электроотрицательность химических элементов
-
Типы химической связи
-
Ионная связь
-
Ковалентная связь
-
Металлическая связь
-
Аморфные и кристаллические вещества
-
Кристаллические решётки
Окислительно-восстановительные реакции
-
Степень окисления
-
Окислители и восстановители, окисление и восстановление
Растворы
-
Состав растворов
-
Растворение. Растворимость
-
Электролиты и неэлектролиты
-
Электролитическая диссоциация кислот, оснований и солей
-
Свойства ионов
-
Среда растворов. Индикаторы
-
Реакции ионного обмена. Реакция нейтрализации
Классификация химических реакций и закономерности их протекания
-
Классификация химических реакций по числу и составу вступивших в реакцию и образовавшихся веществ
-
Классификация химических реакций по тепловому эффекту
-
Классификация химических реакций, ОВР
-
Скорость протекания химической реакции. Катализаторы
Химия неметаллов
-
Водород
-
Кислород
-
Вода
-
Галогены. Хлор и его соединения
-
Сера и её соединения
-
Азот и его соединения
-
Фосфор и его соединения
-
Углерод и его соединения
-
Кремний и его соединения
Химия металлов
-
Щелочные металлы и их соединения
-
Щелочноземельные металлы и их соединения
-
Алюминий и его соединения
-
Железо и его соединения
Органические вещества
-
Состав и строение органических веществ
-
Углеводороды. Полимеры
-
Спирты
-
Карбоновые кислоты
-
Жиры
-
Углеводы
-
Белки
Человек в мире веществ, материалов и химических реакций
-
Природные источники углеводородов
-
Химия и пища. Химия и здоровье
Методы исследования в химии
-
Методы научного познания. Химический эксперимент
-
Получение, собирание и распознавание газов
-
Обнаружение ионов
Расчётные задачи по химии
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
Класс заполнен на 100 %
Конспект по химии для 8 класса «Основные понятия химии»
Основные понятия химии.
Понятия.Определение.
Химия
Наука о веществах, их свойствах и превращениях
Вещество
Это то, из чего состоят физические тела
Химический элемент
Определенный вид атомов с одинаковым зарядом ядра
Атом
Электронейтральная частица
(состоящая из положительно заряженного ядра и одного или несколько отрицательно заряженных электронов;
Наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ)
Молекула
Состоит из одного или нескольких видов атомов
Валентность
Свойство атомом замещать или присоединять в соединениях определенное число атомов другого элемента
Степень окисления
Это условный заряд атомов химического элемента в соединении (Са+2О-2, Са+2Сl2-1)
Простые вещества
Образованы атомами одного химического элемента
Сложные вещества
Образованы атомами разных химических элементов
Свойства вещества
Это признаки, по которым одни вещества отличаются от других
Хим — кие явления или химические реакции
Явления, в результате которых их одного вещества образуется другое
Физические явления
Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную массу
Аллотропия
Способность атомов одного химического элемента образовывать несколько простых веществ
Относительная атомная масса
Масса атома (выраженная в углеродных единицах)
Относительная молекулярная масса
Масса молекулы вещества
(выраженная в углеродных единицах)
Моль
Количество вещества ( ν = m/М) ( ν = N/Nа)
Молярная масса
Масса 1 моля вещества (М = m/ν) ( ν = V/Vа)
Массовая доля вещества в смеси
Отношение массы вещества к массе смеси
ω = mв-ва/mсмеси или ω = mв-ва/mсмеси * 100 %
Молярная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
ω = νв-ва/νсмеси или ω = νв-ва/νсмеси * 100 %
Объемная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
ω = Vв-ва/Vсмеси или ω = Vв-ва/Vсмеси * 100 %
Относительная плотность
Отношение массы данного объема газа к массе такого же объема другого газа. D = m1/m2
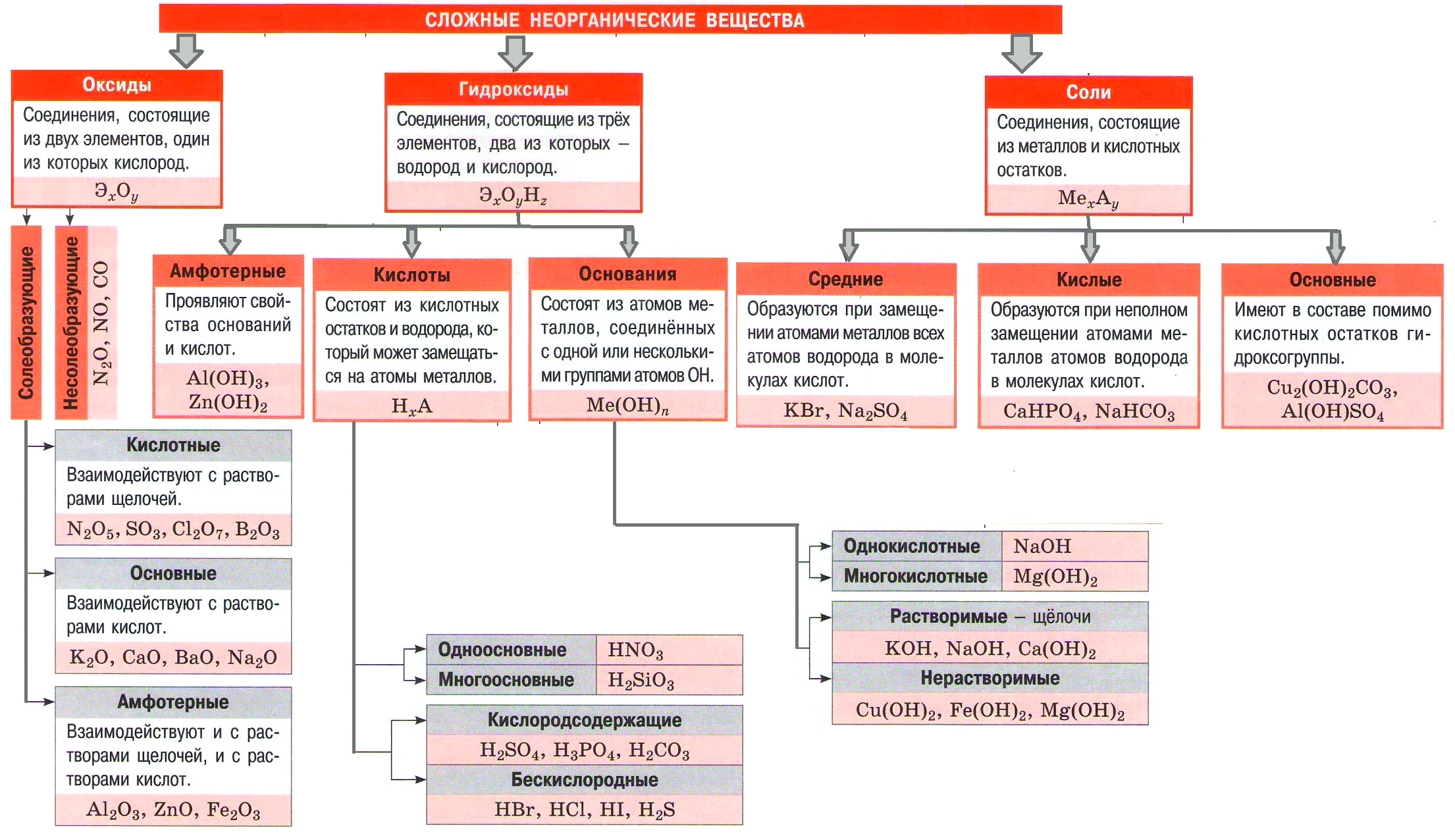
Оксиды
Это сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления – 2 )
Основания
Это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионоа (КОН)
Кислоты
Это сложные вещества, состоящие из атомов водорода и кислотного остатка (Н3РО4)
Соли
Это сложные вещества, состоящие из ионов металлов и кислотных остатков (К3РО4)
Химическое уравнение
Условная запись химической реакции с помощью химических формул и математических законов.
2Н2 + О2 = 2Н2О
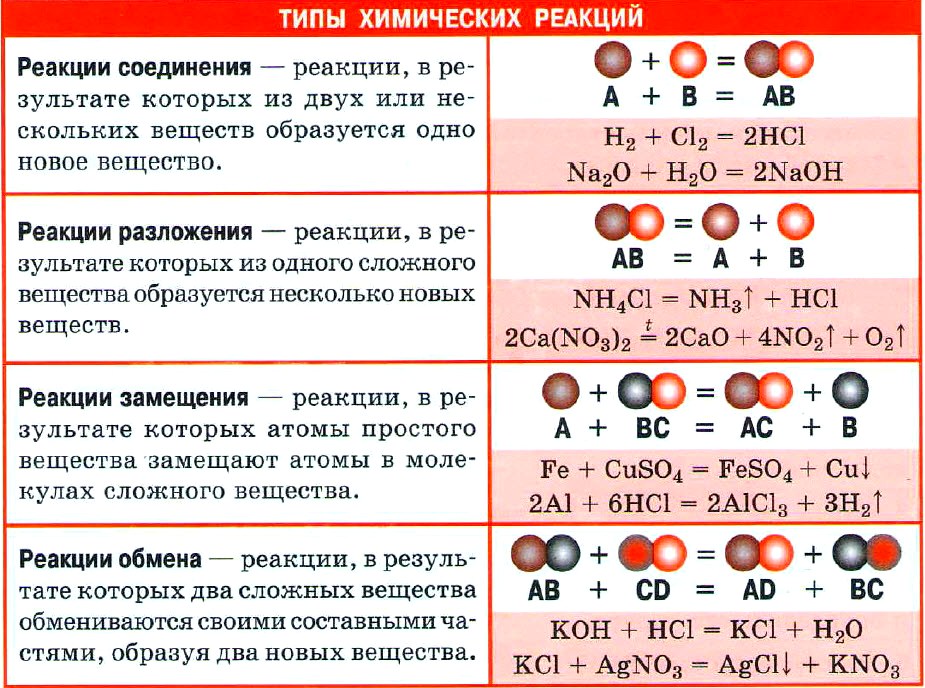
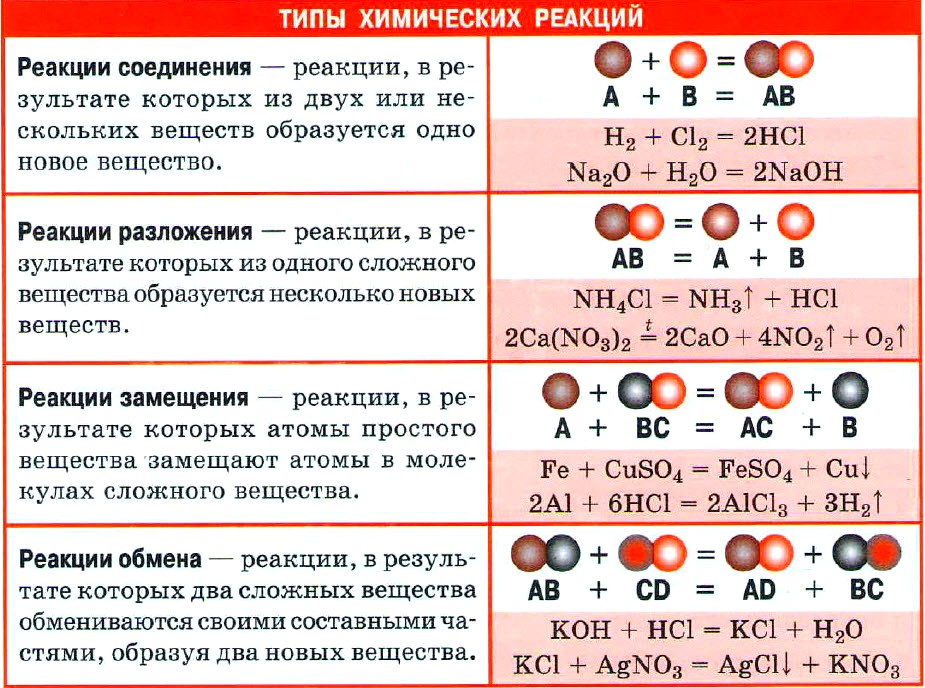
Реакции соединения
Это такие реакции, в результате которых из одного или нескольких простых веществ образуется одно сложное
Р2О5 + 3 Н2О = 2 Н3РО4
Реакции разложения
Это такие реакции, в результате которых из одного сложного вещества образуется два и более новых в – в
Са(ОН)2 = СаО + Н2О
Реакции замещения
Это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе
Zn + НСl = ZnCl2 + Н2↑
Реакции обмена
Это реакции, в результате которых два сложных вещества обмениваются своими составными частями
2КОН + СаSО4 = Са(ОН)2 + К2SО4
Обратимые реакции
Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном ( 2 SО2 + О2 = 2 SО3)
Ионные уравнения реакций
Реакции между ионами
2КОН + СаSО4 = Са(ОН)2 + К2SО4
2К+ + 2ОН— + Са+2 + SО4-2 = Са+2 + 2ОН— + 2К+ + SО4-2
Катализаторы
Это вещества, изменяющие скорость химических реакций, но по окончании их остающиеся качественно и количественно неизменными
Ферменты
Биологические катализаторы белковой природы
Электролиты
Вещества, растворы которых проводят электрический ток.
Неэлектролиты
Вещества, растворы которых не проводят электрический ток
Основные классы неорганических соединений
Простые вещества
Металлы Неметаллы
Сложные вещества
Оксиды
Оксиды металлов Оксиды неметаллов
(основные оксиды) (кислотные оксиды)
Основания Кислоты
Соли
————————————————————————————————
Способы получения:
Оксидов –
— взаимодействие простых веществ с кислородом
С + О2 = СО2
4 К + О2 = 2К2О
— термическое разложение оснований, кислот, солей
Са(ОН)2 = СаО + Н2О
2Н3ВО3 = В2О3 + Н2О
СаСО3 = СаО + СО2
— взаимодействие простых веществ и солей с кислотами
С + 4НNО3 (р-р) = СО2 + 4NО2 + Н2О
Сu + 4НNО3 (конц.) = Сu(NО3)2 + 2NО2 + 2Н2О
К2SО3 + 2Н2SО4 = 2КНSО4 + SО2↑ + Н2О
Оснований –
— взаимодействие металлов или их оксидов с водой
2К + 2Н2О = 2КОН + Н2↑
К2О + Н2О = 2КОН
— действие щелочей на водные растворы солей
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
— электролиз раствора солей
2КCl + 2Н2О = 2КОН + Н2↓ +Cl2↑
Кислот –
— взаимодействие простых веществ с водородом
Cl2 + Н2 = 2НСl
— взаимодействие воды с кислотными оксидами(ангидридами)
N2О5 + Н2О = 2НNО3
— окисление простых веществ
3Р + 5НNО3 + 2Н2О = 3Н3РО4 + 5NО
Вr2 + 2Сl2 + 2Н2О = НВrО3 + 4НСl
— взаимодействие солей с кислотами
NaCl (тв.) + Н2SО4 = НСl↑ + NaHSO4
Солей –
— взаимодействия кислот и оснований
КОН + НСl = КСl + Н2О
— взаимодействия кислот и основными оксидами
Н2SО4 + СuО = СuSО4 + Н2О
— взаимодействия щелочей с кислотными оксидами
КОН + SiО2 = К2SiО3 + Н2О
— взаимодействия кислотных и основных оксидов
К2О + СО2 = К2СО3
— взаимодействия щелочей с солями
3КОН + FeСl3 = 3КСl + Fe(ОН)3↓
— взаимодействия кислот с солями
К2СО3 + 2НСl = 2КСl + СО2↑ + Н2О
— взаимодействия двух солей
Na2SO4 + ВаCl2 = ВаSO4 + 2NaCl
— взаимодействия простых веществ
2К + Cl2 = 2КCl
Контрольная работа
Вариант – 1
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) оксид серы(IV ) + вода = сернистая кислота
б) серная кислота + цинк = сульфат цинка + водород
в) гидроксид железа(II ) = оксид железа(II) + вода
2. Вычислите массовую долю алюминия и серы в сульфиде алюминия.
3. Вычислите массу натрия, необходимого для получения 10,7г хлорида
натрия в избытке хлора.
4.Сколько граммов сульфата меди и сколько граммов воды надо взять,
чтобы приготовить 250 грамм 25%-ного раствора его?
Вариант – 2
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) азотная кислота + гидроксид хрома(III) = нитрат хрома(III) + вода
б) гидроксид алюминия = оксид алюминия + вода
в) оксид углерода(IV) + вода = угольная кислота
2. Вычислите массовую долю железа и кислорода в оксиде железа (III)
3. Рассчитайте объем водорода полученного при взаимодействии 48 г магния с избытком соляной кислоты.
4. Сколько граммов нитрата цинка и сколько граммов воды надо взять, чтобы приготовить 50
Контрольная работа
Вариант – 1
1. Составьте уравнения химических реакций, соответствующих схеме:
С → СО → СО2 → Н2СО3 → Nа2СО3 → СО2
2. Опишите способы распознавания газов: водорода и аммиака, помещенных в цилиндр без этикеток.
3. Какой объем водорода (н.у.) потребуется для взаимодействия с оксидом железа (III) массой 640 кг, содержащего 25% примесей? Какое количество вещества воды при этом образуется?
4. Рассчитайте массу цинка, который нужно растворить в соляной кислоте, чтобы получить водород, необходимый для восстановления оксида меди(II) массой 20г до металла.
5. При сливании 400г 9,8%-ного раствора серной кислоты с раствором, содержащим избыток хлорида бария, получили осадок, масса которого:
а) 93,2г б)39,2г в)186,6г г)23,3г
Вариант – 2
1. Составьте уравнения химических реакций, соответствующих схеме:
S → SО2 → SО3 → Н2 SО4 → СаSО4 → Са(ОН)2
2. Опишите способы распознавания газов: кислорода и углекислого газа, помещенных в цилиндр без этикеток.
3. Какой объем воздуха (н.у.) потребуется для взаимодействия с 270г алюминия, содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
4. При восстановлении улем, при высокой температуре, смеси карбоната цинка и оксида цинка (масса смеси 53 кг) получен цинк массой 39 кг. Рассчитайте массовую долю оксида цинка в исходной смеси.
5. При сливании 25г 16%-ного раствора гидроксида натрия с раствором, содержащим избыток хлорида железа (III), получили осадок, масса которого:
а) 3,57г б) 7,14г в) 2,38г г) 4,76г
Онлайн уроки по химии за 8 класс

Ярко и красиво! Мы начинаем изучать Химию- одну из самых увлекательных наук! 


Сегодня вы узнаете основные понятия, без которых невозможно представить себе химию как науку!


На этом уроке мы поговорим о атомно- молекулярном учении


Сейчас мы рассмотрим основной закон в химии- Периодический


На этой странице мы поговорим о базовых химических понятиях, без которых дальнейшее изучение химии бесполезно


Что такое чистота вещества? Здравый смысл подсказывает, что это количество примесей в смеси.


Одно из самых увлекательных занятий в химии это Химическая реакция!


Продолжим изучение химической реакции как одной из основ химической науки!


В повседневной жизни нам приходится решать множество задач, так или иначе связанных с химией – выбрать подходящий клей, правильно разбавить уксус, подобрать пятновыводитель


Сейчас мы поговорим о газах и о их роли в природе


Кислород – самый распространенный на Земле химический элемент!


Ты уже неоднократно встречался с различными типами соединений.
На этом уроке мы приведём эти знания в единую систему


Из них состоит все!


После подробного изучения строения атома и состояния электронных оболочек можно приступать к вопросу о том, каким же образом происходит соединение атомов в молекулы.


В этом разделе мы поговорим об одних из самых красивых предметах- кристаллах!


Когда мы видим ржавчину на железе или темный налет на серебре, мы часто можем услышать фразу – «металл окислился».
Разберём подробнее, что значит это выражение с точки зрения химии


На этом уроке мы поговорим о водороде – химическом элементе и простом веществе. Ты узнаешь о его роли в космосе и в нашей жизни, почему люди отказались использовать водород в дирижаблях, можно ли бензобак заменить на водородобак и другие интересные факты


В этом уроке мы познакомимся с немногочисленной, но очень важной группой химических элементов


Согласись, полезно знать как быстро будут проходить твои опыты!


В этом уроке вы узнаете про серу, чем она вредна и чем полезна, как между собой связано Чёрное море и тухлые яйца, как правильно разбавлять электролит для аккумулятора и ещё много полезного и интересного


«Азот» в переводе с греческого – «безжизненный». Однако в наше время всем и каждому хорошо известно, что это далеко не так. На этом уроке мы по полочкам разложим всё самое интересное и полезное про этот элемент с самым, пожалуй, противоречивым названием.


Азот образует оксиды, в которых проявляет степени окисления от +1 до +5.


Фосфор- один из самых распространенных и жизненно важных химических элементов


Углерод – химический элемент IVгруппы периодической системы химических элементов


Кремний – химический элемент IV группы периодической системы.
Это самый распространённый после кислорода элемент в земной коре (26 % по массе).


Из всех химических элементов металлы представляют абсолютное большинство – ученые выделяют 94 металла


Алюминий – химический элемент III группы периодической системы элементов.


Без этого металла прогресс человечества был бы невозможен!


Поговорим о сплавах железа и каким химическим воздействиям оно подвергается в природе. Роль железа в живых организмах и у человека





Лэйдл предлагает пройти уроки химии за 8 класс в режиме онлайн и быстро освоить школьную программу. Курс включает в себя не только теоретические, но и практические занятия, которые научат ребенка пользоваться формулами и решать даже сложные задачи. Сама же программа хорошо структурирована – темы раскрываются последовательно, что упрощает изучение материала.
Онлайн-уроки включают в себя основополагающие сведения о химии как науке, предмете и методах ее изучения. Кроме того, школьнику предстоит изучить свойства атомов и молекул, валентность вещества, основные химические реакции, элементы из таблицы Менделеева.
3 причины изучать уроки с Лэйдл
- Четкая структура занятий.
В нашей команде работают исключительно профессиональные педагоги, которые структурировали школьную программу и постарались сделать уроки максимально полезными и интересными. Ребенок больше не будет путаться в терминологии или искать дополнительную информацию в Интернете. - Наглядные материалы.
Чтобы материал усваивался легко, мы снабдили каждый урок мультимедийными файлами (фото или видео), задачами и упражнениями. Так что школьнику предстоит не только читать о свойствах химических веществ, но и учиться применять полученные знания на практике. - Доступность.
Здесь речь идет не только о демократичной стоимости онлайн-уроков, но и простоте их получения. Вам достаточно пройти регистрацию – и весь курс химии за 8 класс окажется под рукой.
Начните изучение химии прямо сейчас – пройдите пробный урок и оформите подписку на Лэйдл!
Что изучает химия? — урок. Химия, 8–9 класс.
Изучая природоведение, физику, биологию, вы уже познакомились с понятиями «физическое тело» и «вещество», имеете представление о составе физических тел. Например, кусок гранита и зерно — это физические тела. Они неоднородны.
 |
В состав зерна входят крахмал, белки, растительные жиры. Гранит состоит из кварца, слюды и полевого шпата. Белки, растительные жиры, кварц, слюда, полевой шпат, крахмал — это вещества.
Вещества — это то, из чего состоят физические тела.
Веществ очень много, и каждое из них характеризуется определёнными свойствами.
Признаки, по которым вещества отличаются друг от друга или сходны между собой, называются свойствами веществ.
Важной задачей химии является изучение веществ, их свойств, и прогнозирование использования веществ в народном хозяйстве.
Пример:
вещество алюминий можно охарактеризовать так. Алюминий — металл серебристо-белого цвета. Сравнительно легкий (\(p =\) \(2,7\) \(г/\)см3), плавится при температуре \(660\) °С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используется в самолето- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Важнейшая задача химии — получение веществ, необходимых в народном хозяйстве (пластмасс, минеральных удобрений, лекарств и др.), из других веществ путём химических превращений.
Таким образом, на вопрос, что такое химия, можно ответить так.
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Источники:
http://www.greeninfo.ru/for_landscaping/stones.html
http://www.ezospirit.com.ua/A/Enc/Z/zerno.jpg
Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля |  | Безразмерная |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|

2. Соотношения между единицами физических величин

3. Химические формулы в 8 классе
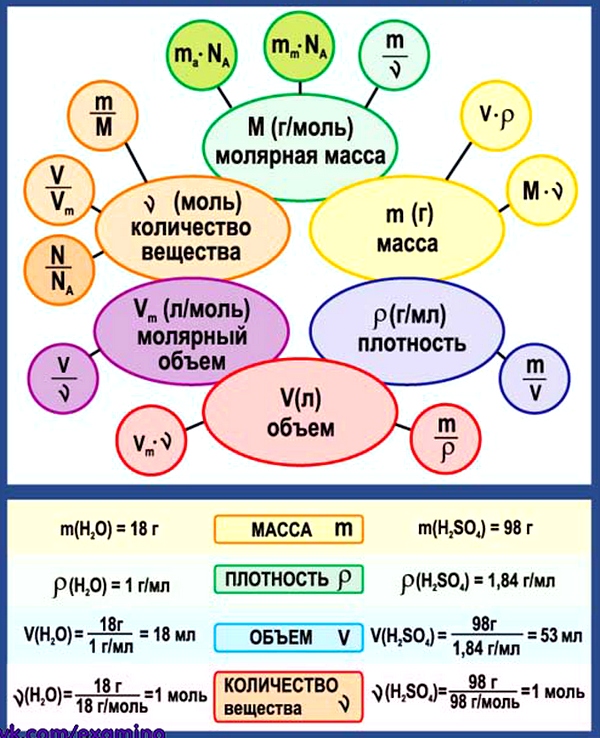
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
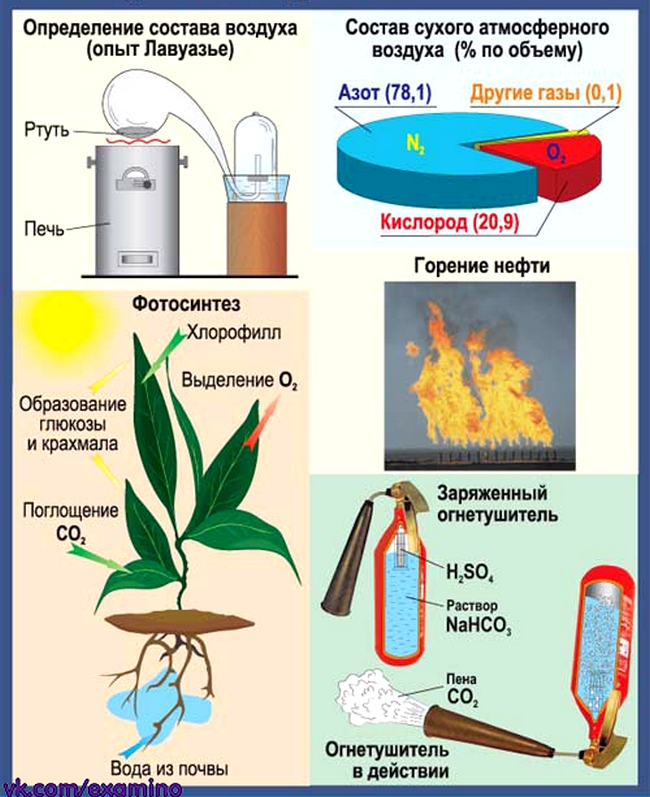
Важнейшие классы неорганических веществ
Воздух. Кислород. Горение
Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
ХИМИЯ. Опорные конспекты на сайте УЧИТЕЛЬ.ПРО
Конспекты по предмету «ХИМИЯ»
Изучение Химии шаг за шагом. Онлайн-учебник и сборник задач.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Кодификатор ОГЭ Проверить знания Выбрать репетитора
Химия 8 класс
Первоначальные химические понятия. Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
- Вещества и их свойства. Чистые вещества и смеси
- Физические и химические явления
- Атомы, молекулы и ионы
- Простые и сложные вещества
- Химические элементы и их знаки
- Относительная атомная масса
- Закон постоянства состава веществ
- Химическая формула. Индекс. Коэффициент
- Массовая доля элемента в соединении
- Химия 8 класс. Все формулы и определения
- Оксиды (названия, классификация, получение)
- Свойства оксидов
- Основания (названия, получение, свойства)
- Строение атома. Массовое число
- Строение электронных оболочек атомов
- Периодическая система химических элементов
- Закономерности изменения свойств элементов
- Строение веществ. Электроотрицательность
- Химическая связь: ковалентная, ионная, металлическая
- Валентность химических элементов
- Определение валентности + примеры
- Кислород: характеристика, свойства, получение
- Кислоты: классификация, свойства, получение
- Соли: классификация, свойства, получение
- Амфотерные оксиды и гидроксиды
- Водород: характеристика, получение
- Химические свойства водорода. Применение
- Вода. Свойства воды. Водные растворы
Химия 9 класс
Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. Общие свойства металлов. Металлы IA—IIIA-групп периодической таблицы химических элементов. Железо. Металлургия. Краткий обзор важнейших органических веществ (Углеводороды, производные углеводородов).
(остальные конспекты готовятся к публикации)
Химия 10 класс. КонтрольныеОГЭ по Химии
- Химическая реакция (справочник для ОГЭ)
Решения задач по химии
(скоро будут ещё)
Проверить свои знания Подобрать репетитора
Источники идей и источники цитат для конспектов по Химии:
- Учебник по химии для 8 класса / Г. Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
- Учебник по химии для 9 класса / Г. Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
- Ковалевская Н.Б. ХИМИЯ в таблицах и схемах. 8 класс. Для самостоятельной работы в школе и дома — М.: «Издат-Школа XXI век», 2004.
- ОГЭ. Универсальный справочник по химии / Е.Ю. Шапаренко. — Москва : Эксмо.
- Задачи по химии и способы их решения. 8—9 кл. / О. С. Габриелян, П. В. Решетов, И. Г. Остроумов. — М.: Дрофа.
- Сборник задач и упражнений по химии: Школьный курс / В. В. Еремин, Н. Е. Кузьменко. — М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2005
- Справочник по химии: 8-9 классы. ФГОС / А.Д. Микитюк — М.: Издательство «Экзамен», 2019
- ЕГЭ. Химия: алгоритмы выполнения типовых заданий / Е.В. Крышилович, В.А. Мостовых — М.: Эксмо, 2018
- Химия. Самоучитель. Книга для тех, кто хочет сдать экзамены, а также понять и полюбить химию / Е. Н. Френкель. — Москва : Издательство АСТ, 2017
(с) Цитаты из вышеуказанных учебных пособий использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ).
Восьмой класс (8 класс) Вопросы по органической химии для тестов и рабочих листов
Вы можете создавать печатные тесты и рабочие листы из этих 8 класс по органической химии вопроса! Выберите один или несколько вопросов, установив флажки над каждым вопросом. Затем нажмите кнопку добавить выбранные вопросы к кнопке теста перед переходом на другую страницу.
Выбрать все вопросы Четыре класса органической химии, необходимые живым существам:- углеводы, белки, витамины и липиды.
- углеводы, белки, нуклеиновые кислоты и витамины.
- углеводы, белки, нуклеиновые кислоты и липиды.
- углеводы, витамины, нуклеиновые кислоты и липиды.
6, 7 и 8 классы | Наука | Средняя школа | Химия
Эта викторина по естествознанию называется «Химия — кислоты и основания» и написана учителями, чтобы помочь вам, если вы изучаете этот предмет в средней школе. Воспроизведение образовательных викторин — отличный способ узнать, что вы в 6, 7 или 8 классе — в возрасте от 11 до 14 лет.
Игра в эту викторину стоит всего 12,50 долларов в месяц, а участие в более 3500 других, которые помогут вам с вашим школьное задание. Вы можете подписаться на странице Присоединяйтесь к нам
Вы когда-нибудь задумывались, почему некоторые вещи действительно кислые? Все это связано с уровнем кислоты в продуктах и степенью их нейтрализации оснований.
Слово кислота происходит от латинского слова acere , что означает «кислый». Сама по себе кислота — это коррозионный металл. Однако в пищевых продуктах при смешивании с различными основами его вредное воздействие уменьшается, даже устраняется и остается только кислый вкус. Чтобы проверить, содержит ли пищевое соединение кислоты, используют кусочек лакмусовой бумаги, погружая лакмус в соединения. Если лакмусовая бумажка станет красной, соединение содержит кислоты.
Основы в продуктах могут казаться скользкими.Они помогают уменьшить количество кислот, содержащихся в пище. При тестировании на основы лакмусовая бумага станет синей.
В 17 веке ирландский химик по имени Роберт Бойль первым обозначил вещества как кислоты или основания. Он на самом деле называл основания щелочами .
В конце 1800-х годов шведский ученый Сванте Аррениус считал, что вода может растворять кислотные соединения. При добавлении воды отдельные ионы отделяются, тем самым ослабляя коррозионную способность кислоты. Ионы представляют собой атом или молекулу, которые приобрели электрический заряд. Они приобретают этот заряд, теряя или приобретая электроны.
Аррениус считал, что кислотные соединения содержат водород, такой как соляная кислота или HCl. Кроме того, он считал, что основания при растворении в воде выделяют ионы гидроксида (OH —) или отрицательный заряд. Примером основания может быть гидроксид натрия (NaOH), также известный как поваренная соль. Наконец, Аррениус смог определить, что все кислоты выделяют H + (ион водорода с положительным зарядом) в растворы, а все основания выделяют OH —.Таким образом, концепция, согласно которой основания могут ослаблять кислоты, известна как нейтрализация .
Как работает нейтрализация ? Поскольку кислоты выделяют H + , а основания выделяют OH — , когда их смешивают вместе, вы получаете H 2 O, который представляет собой простую воду. Смесь этих двух веществ всегда будет давать воду вместе с солью (NaCl).
В 1909 году датский биохимик Сёрен Соренсен разработал способ определения степени кислотности. Этот тест был основан на шкале, известной как шкала pH .Шкала pH варьируется от 0 до 14. Вещества, которые тестируют от 0 до чуть ниже 7, являются кислотами, а вещества, которые тестируют чуть выше 7 и до 14, являются основаниями. Вещества, которые проверяются прямо на 7, называются нейтральными веществами.
Примеры веществ и их уровней pH :
Желудочная кислота имеет уровень pH 1
Лимонный сок имеет уровень pH 2
.
Сода имеет уровень pH 4
.
Дождевая вода имеет уровень pH 5
.
Молоко имеет уровень pH 6
.
Чистая питьевая вода имеет уровень pH 7
.
Уровень pH яичного белка составляет 8
.
Пищевая сода имеет уровень pH 9
.
Антацид Tums® имеет уровень pH 10
.
Драно имеет уровень pH 13
.
Гидроксид натрия (NaOH) имеет уровень pH 14
Наконец, в 1923 году два разных ученых (Йоханнес Бренстед, датчанин, и Томас Лоури, англичанин) расширили теории, введенные Аррениусом относительно кислот и оснований.Они считали, что любое вещество, имеющее ион водорода (H + ), было кислотой. Эти кислые вещества (то есть вещества, дарившие положительный ион водорода) часто назывались донорами протонов и . Это было получено, потому что когда электроны удаляются из водорода, конечным продуктом является протон.
Согласно Бренстеду и Лоури, как кислоты, так и основания связаны с величиной концентрации ионов водорода. Кислоты увеличивают концентрацию ионов водорода, а основания уменьшают концентрацию ионов водорода.
Итак, в следующий раз, когда вы попробуете что-то кислое, вы поймете, что степень кислинки напрямую зависит от уровня кислоты, содержащейся в пище.
Теперь, когда вы немного узнали о пищевых кислотах и щелочах, давайте посмотрим, на сколько из следующих десяти вопросов вы можете ответить правильно.
.