Дидактический материал по химии 8 класс
Автор: Чистофорова Елена Анатольевна
учитель биологии и химии
Образовательное учреждение: ГC(К)ОУ для обучающихся, воспитанников
с ограниченными возможностями здоровья «Петровск — Забайкальская специальная (коррекционная) общеобразовательная школа-интернат»
Предмет: химия
Тема: Обобщающий урок по темам «Кислород. Горение. Водород».
Класс: 8
УМК: Химия 8 класс: учебник для общеобразовательных учреждений/ Г.Е.Рудзитис, Ф.Г.Фельдман.
Проведение уроков с использованием интерактивной доски в учебном процессе способствует повышению уровня применения наглядности на уроке и производительности урока, установлению межпредметных связей, воспитанию интереса учащихся к учебному предмету, позволяет сделать процесс обучения интересным, насыщенным.
Работа с интерактивной доской помогает эффективно закрепить и проверить знания учащихся. Важно отметить, что ученики, которые раньше не проявляли особого интереса к учебе, теперь с энтузиазмом выходят отвечать к интерактивной доске.
Описание разработки.
Разработка учебных занятий по химии в 8 классе. Методический материал разработан с помощью программного обеспечения Elite Panaboard book для интерактивной доски Elite Panaboard.
Комментарии: Цифровой образовательный ресурс можно использовать для
проведения обобщающего урока химии в 8 классе, при изучении темы «Кислород. Горение. Водород».
Урок химии в 8 классе.
Обобщающий урок по темам «Кислород. Горение. Водород».
Задачи урока:
Образовательные: обобщение, углубление и систематизация знаний по теме «Кислород. Горение. Водород». Активизировать знания учащихся о процессах горения и медленного окисления.
Коррекционно—развивающие: развитие мышления учащихся, в том числе умения анализировать, активизировать познавательный интерес. Развивать эмоциональную сферу учащихся.
Воспитательные: воспитание потребности в знаниях, целеустремленность, наблюдательность, умение работать в коллективе. Экологическое воспитание — напомнить о значении кислорода для жизни на Земле, необходимости его сбережения, охраны окружающей среды.
Формы организации учебной деятельности: коллективная, групповая, индивидуальная
Методы работы: самостоятельная и под руководством учителя.
Оснащение урока: компьютер + интерактивная доска, учебник 8 класс Химия .
Скриншоты страниц и методические рекомендации по использованию дидактического материала
№ страниц
Страница
Пояснения
1

Титульная страница разработки
2

Вступительная беседа.
Тему сегодняшнего урока вы назовете сами, если отгадаете загадки.
Проверка: два щелчка по тексту.
Назовите химические формулы кислорода и водорода.
Проверка: открываем шторку и проверяем
Называем тему урока
3
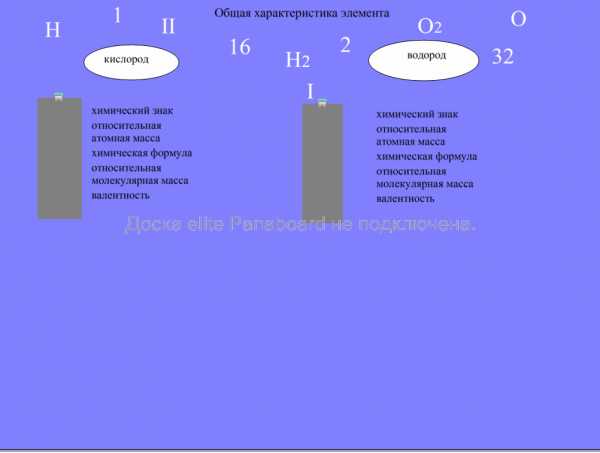
Общая характеристика химического элемента. Работа у доски. Учащиеся перемещают химические значки на соответствующие строчки.
Проверка: открываем шторку и проверяем
4
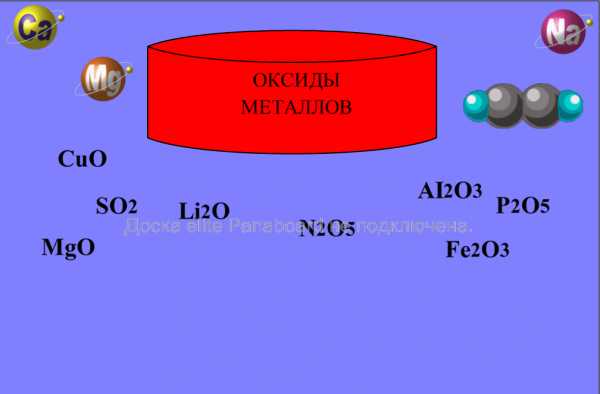
Какие вещества называются оксидами? Ученик работает у доски. Нужно выбрать оксиды металлов и поместить их в цилиндр. Проверка: правильные ответы скроются за цилиндр, а неправильные останутся на поверхности
5

Условия возникновения горения. Ученик работает у доски. При перемещении текста в прямоугольник высвечивается слово верно или неверно. Текст со словом верно скрывается за прямоугольником, а со словом неверно остаётся на поверхности.
6

Найдите в тексте оксиды. Самостоятельная работа учащихся в тетради. После выполнения работы дети обмениваются своими тетрадями и проводят взаимопроверку.
Проверка: Правильные ответы за пределами страницы. Можно проверить правильность выполнения, вытянув прямоугольник с ответами за проверку.
7

Решить уравнения реакций и расставить коэффициенты. Учащиеся самостоятельно решают уравнения в тетради, затем проверяют друг у друга.
Проверка: Открываем шторку и проверяем.
8
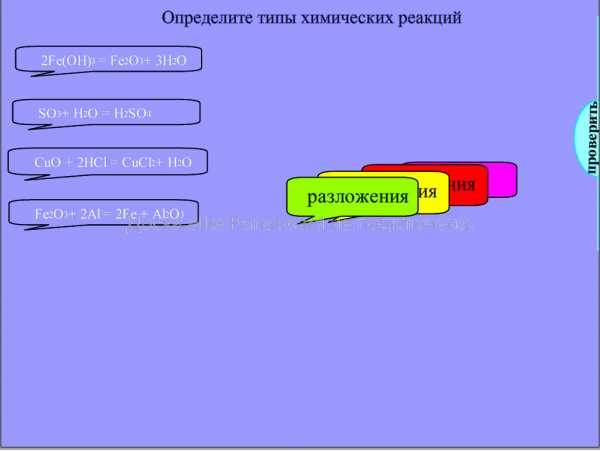
Типы химических реакций.
Учащиеся работают у доски. Перемещают прямоугольники, размещая их напротив соответствующей реакции. Правильные ответы за пределами страницы.
Проверка: Потянув за слово проверить вытягиваем правильные ответы.
9

Составление химических формул веществ. Используя инструмент клонирования, учащиеся по очереди выходят к доске и составляют формулы, все вместе проверяем.
10

Рефлексия. Используя инструмент клонирования, подарить капельке цветок с улыбкой, если урок был интересным и у вас хорошее настроение, а если у вас плохое настроение, то цветок, который плачет.
Изображения взяты из галереи программного обеспечения Elite Panaboard book для интерактивной доски Elite Panaboard.
infourok.ru
ГДЗ Радецкий 8 класс Химия
Авторы: А.М. Радецкий.
Выберите задание:
Работа 1
1 2 3 48 класс
Работа 2
1 2 3 4Тема 1
Работа 3
1 2 3 4 Работа 4
1
2
3
4Тема 2
Работа 5
1 2 3 4Тема 3
Работа 6
1 2 3 4 Тема 4
Дополнительные задания
1 2 3 4 5 6 7 8 9klassgdz.ru
ГДЗ по Химии за 8‐9 класс дидактический материал А.М. Радецкий
Решебники, ГДЗ
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- 2 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 3 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Немецкий язык
- Литература
- Человек и мир
- Музыка
- Окружающий мир
- Испанский язык
- 4 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
megaresheba.ru
Учебно-методический материал по химии (8 класс) на тему: Химия, дидактический материал
Тема: «Химические формулы. Относительная молекулярная масса. Вычисления по химическим формулам» 8 класс
В 1
1. Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu 2 S и MgO
4. Вычислить массу меди, которую можно выделить из Cu 2 S массой 700г.
В 2
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле 3 С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe2 O3 и SО 3
4. Вычислить массу С О 2, содержащего 48 г углерода.
В 3
1.Вычислить относительные молекулярные массы веществ: HCl , CH 4, Al2 O3 , CuO
2. Какую информацию можно узнать по химической формуле 7 Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу кальция, которая содержится в 250г CaCO 3
В 4
1.Вычислить относительные молекулярные массы веществ:K2 O , C2H 4, Ph4 , SО 2
2. Какую информацию можно узнать по химической формуле С 3 H 8?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу Fe2 O3, в которой содержится 2,4 г железа
В 5
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 2 Mg3Р2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 6
1.Вычислить относительные молекулярные массы веществ: С О , SО 2, Fe O , h3 SO3
2. Какую информацию можно узнать по химической формуле С O 2 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe O и SО 2
4. Вычислить массу S О 2, содержащего 36 г серы.
В 7
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле 3 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 S3 и Cu 2O
4. Вычислить массу углерода, которая содержится в 400г CaCO 3
В 8
1.Вычислить относительные молекулярные массы веществ: K2 SО 3 , C5H 10, P 2 О 5 , SО 3
2. Какую информацию можно узнать по химической формуле 4 H 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу Al2 S3, в которой содержится 10,2 г алюминия
В 9
1.Вычислить относительные молекулярные массы веществ: K2 O , P 2 О 5 , Al2 S3 , SО 2
2. Какую информацию можно узнать по химической формуле 2 СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe2 O3
4. Вычислить массу Fe 3О4, в которой содержится 12 г железа
В 10
1.Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле 5Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу Fe2 O3, в которой содержится 68 г железа
В 11
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле С O 2 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 12
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 2 С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу S О 2, содержащего 36 г серы.
В 13
1.Вычислить относительные молекулярные массы веществ: С О , SО 3, Fe O , h3 SO4
2. Какую информацию можно узнать по химической формуле 3 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу меди, которую можно выделить из Cu S массой 70г.
В 14
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле 9 N 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe O
4. Вычислить массу Fe2 O3, в которой содержится 56 г железа
В 15
1.Вычислить относительные молекулярные массы веществ:K2 O , P 2 О 5 , Al2 S3 , SО 2
2. Какую информацию можно узнать по химической формуле Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу S О 3, содержащего 72 г серы.
В 16
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 3 СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу меди, которую можно выделить из Cu S массой 400г.
В 17
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 3, Fe2 O3 , h3O
2. Какую информацию можно узнать по химической формуле 10 Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу Al2 S3, в которой содержится 104 г алюминия
В 18
1.Вычислить относительные молекулярные массы веществ: HClO3 , C6H 12, Al2 S3 , CuCl
2. Какую информацию можно узнать по химической формуле Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Fe O и SО 2
4. Вычислить массу углерода, которая содержится в 200г CaCO 3
В 19
1.Вычислить относительные молекулярные массы веществ: HCl , CH 4, Al2 O3 , CuO
2. Какую информацию можно узнать по химической формуле С 3 H 8 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe2 O3
4. Вычислить массу меди, которую можно выделить из Cu S массой 70г.
В 20
1.Вычислить относительные молекулярные массы веществ: С 3 H 8 , Cu 2 S , Nh4 , MgO
2. Какую информацию можно узнать по химической формуле 2 Mg3Р2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Al2 O3 и CuO
4. Вычислить массу S О 2, содержащего 36 г серы.
В 21
1.Вычислить относительные молекулярные массы веществ: HBr , H 2CO3, Al N , CuI2
2. Какую информацию можно узнать по химической формуле CaCO 3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу Fe 3О4, в которой содержится 12 г железа
В 22
1.Вычислить относительные молекулярные массы веществ: С 4 H 10 , Cu S , HNО3 , Mg3Р2
2. Какую информацию можно узнать по химической формуле 3 O 2?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 5 H 10 и P 2 О 5
4. Вычислить массу Fe2 O3, в которой содержится 68 г железа
В 23
1.Вычислить относительные молекулярные массы веществ: С О , SО 2, Fe O , h3 SO3
2. Какую информацию можно узнать по химической формуле 2Nh4 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в СаО и Fe O
4. Вычислить массу серы, которую можно выделить из Cu 2 S массой 800г.
В 24
1.Вычислить относительные молекулярные массы веществ: HClO4 , C2H 2, Al2 S3 , CuCl2
2. Какую информацию можно узнать по химической формуле СаО?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу Fe2 O3, в которой содержится 56 г железа
В 25
1.Вычислить относительные молекулярные массы веществ: С 3 H 6 , Cu 2S , HNО2 , Mg3N2
2. Какую информацию можно узнать по химической формуле Al2 S3 ?
3. Рассчитать массовую долю каждого элемента и массовые отношения в С 3 H 8 и SО 3
4. Вычислить массу меди, которую можно выделить из Cu S массой 400г.
В 26
1.Вычислить относительные молекулярные массы веществ: С О 2 , SО 2, Fe O , h3S
2. Какую информацию можно узнать по химической формуле 2 Al2 O3?
3. Рассчитать массовую долю каждого элемента и массовые отношения в Cu S и Nh4
4. Вычислить массу S О 3, содержащего 72 г серы.
Литература:
- Боровских Т.А. дидактические карточки-задания по химии. 8 класс. – М: «Экзамен», 2004
- Радецкий А.М. Задания для текущего и итогового контроля знаний учащихся по химии 8-8 классы. — М:Гуманитарный издательский центр «Владос», 2003
nsportal.ru
ГДЗ по химии для 8‐9 класса дидактический материал А.М. Радецкий
- ГДЗ
- 1 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- 2 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Технология
- 3 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
- 4 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Украинский язык
- Информатика
- Основы здоровья
resheba.me
ГДЗ по химии 8-9 класс дидактические материалы Радецкий А.М. Решебник
GDZ.RU- 1 класс
- Математика
- Английский язык
- Русский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- 2 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- 3 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
- 4 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Испанский язык
- 5 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
gdz.ru
Решебник по химии за 8 класс к дидактическому материалу А.М.РадецкийВсе главы
Тема I. Первоначальные химические понятия. Работа 1. Химические элементы. Простые и сложные вещества
Тема I. Первоначальные химические понятия. Работа 2. Химические формулы. Относительная молекулярная масса
Тема I. Первоначальные химические понятия. Работа 3. Валентность
Тема I. Первоначальные химические понятия. Работа 4. Химические уравнения
Тема I. Первоначальные химические понятия. Работа 5. Типы химических реакций
Тема I. Первоначальные химические понятия. Работа 6. Количество вещества. Моль. Молекулярная масса
Тема I. Первоначальные химические понятия. Работа 7. Итоговая по теме I
Тема II. Кислород. Оксиды. Горение. Работа 1. Получение и свойства кислорода
Тема II. Кислород. Оксиды. Горение. Работа 2. Состав воздуха. Горение веществ в воздухе
Тема II. Кислород. Оксиды. Горение. Итоговая работа по теме II
Тема II. Кислород. Оксиды. Горение. Работа 3. Итоговая по теме II
Тема III. Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода
Тема III. Водород. Кислоты. Соли. Работа 2. Свойства кислот. Соли
Тема III. Водород. Кислоты. Соли. Работа 3. Итоговая по теме III
Тема IV. Вода. Растворы. Основания. Работа 1. Вычисление массовой доли и массы вещества в растворе
Тема IV. Вода. Растворы. Основания. Работа 2. Химические свойства воды. Основания
Тема IV. Вода. Растворы. Основания. Работа 3. Итоговая по теме IV
Тема V. Важнейшие классы неорганических соединений. Работа 1. Классификация неорганических соединений
Тема V. Важнейшие классы неорганических соединений. Работа 2. Взаимосвязь между оксидами, основаниями, кислотами и солями
Тема V. Важнейшие классы неорганических соединений. Работа 3. Взаимодействие между отдельными классами неорганических соединений
Тема V. Важнейшие классы неорганических соединений. Работа 4. Итоговая по теме V
Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 1. Периоды, группы, подгруппы периодической системы химических элементов
Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 2. Строение атома
Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 3. Итоговая по теме VI
Тема VII. Химическая связь. Строение веществ. Работа 1. Химическая связь. Кристаллические решетки
Тема VII. Химическая связь. Строение веществ. Работа 2. Элекроотрицательность и степень окисления
Тема VII. Химическая связь. Строение веществ. Работа 3. Окислительно-восстановительные реакции
Тема VII. Химическая связь. Строение веществ. Работа 4. Итоговая по теме VII
Тема VIII. Молекулярный объем газов. Работа 1. Расчетные задачи по теме: «Молекулярный объем газов»
Тема IX. Галогены. Работа 1. Хлор. Хлорводород. Соляная кислота
Тема IX. Галогены. Работа 2. Фтор. Бром. Иод
Тема IX. Галогены. Работа 3. Расчетные задачи по теме Галогены
Тема IX. Галогены. Работа 4. Итоговая по теме VIII
Тема IX. Галогены. Итоговая работа по теме IX
5terka.com
