Номер 222 — ГДЗ по Алгебре 7 класс Учебник Мерзляк, Якир, Полонский (решебник)
Номер 222 — ГДЗ по Алгебре 7 класс Учебник Мерзляк, Якир, Полонский (решебник) — GDZwowПерейти к содержанию
Search for:
Авторы: Мерзляк А. Г., Якир М. С., Полонский В. Б.
Издательство: Вентана-Граф
Тип: Учебник
Выберите номер
12345678910111213141516171819202122232425262728293031323334353637383940414243444546474849505152535455565758596061626364656667686970717273747576777879808182838485868788899091929394959697989910010110210310410510610710810911011111211311411511611711811912012112212312412512612712812913013113213313413513613713813914014114214314414514614714814915015115215315415515615715815916016116216316416516616716816917017117217317417517617717817918018118218318418518618718818919019119219319419519619719819920020120220320420520620720820921021121221321421521621721821922022122222322422522622722822923023123223323423523623723823924024124224324424524624724824925025125225325425525625725825926026126226326426526626726826927027127227327427527627727827928028128228328428528628728828929029129229329429529629729829930030130230330430530630730830931031131231331431531631731831932032132232332432532632732832933033133233433533633733833934034134234334434534634734834935035135235335435535635735835936036136236336436536636736836937037137237337437537637737837938038138238338438538638738838939039139239339439539639739839940040140240340440540640740840941041141241341441541641741841942042142242342442542642742842943043143243343443543643743843944044144244344444544644744844945045145245345445545645745845946046146246346446546646746846947047147247347447547647747847948048148248348448548648748848949049149249349449549649749849950050150250350450550650750850951051151251351451551651751851952052152252352452552652752852953053153253353453553653753853954054154254354454554654754854955055155255355455555655755855956056156256356456556656756856957057157257357457557657757857958058158258358458558658758858959059159259359459559659759859960060160260360460560660760860961061161261361461561661761861962062162262362462562662762862963063163263363463563663763863964064164264364464564664764864965065165265365465565665765865966066166266366466566666766866967067167267367467567667767867968068168268368468568668768868969069169269369469569669769869970070170270370470570670770870971071171271371471571671771871972072172272372472572672772872973073173273373473573673773873974074174274374474574674774874975075175275375475575675775875976076176276376476576676776876977077177277377477577677777877978078178278378478578678778878979079179279379479579679779879980080180280380480580680780880981081181281381481581681781881982082182282382482582682782882983083183283383483583683783883984084184284384484584684784884985085185285385485585685785885986086186286386486586686786886987087187287387487587687787887988088188288388488588688788888989089189289389489589689789889990090190290390490590690790890991091191291391491591691791891992092192292392492592692792892993093193293393493593693793893994094194294394494594694794894995095195295395495595695795895996096196296396496596696796896997097197297397497597697797897998098198298398498598698798898999099199299399499599699799899910001001100210031004100510061007100810091010101110121013101410151016101710181019102010211022102310241025102610271028102910301031103210331034103510361037103810391040104110421043104410451046104710481049105010511052105310541055105610571058105910601061106210631064106510661067106810691070107110721073107410751076107710781079108010811082108310841085108610871088108910901091109210931094109510961097109810991100110111021103110411051106110711081109111011111112111311141115111611171118111911201121112211231124112511261127112811291130113111321133113411351136113711381139114011411142114311441145114611471148114911501151115211531154115511561157115811591160116111621163116411651166116711681169117011711172117311741175117611771178117911801181118211831184118511861187118811891190119111921193119411951196119711981199120012011202120312041205120612071208120912101211121212131214121512161217121812191220122112221223122412251226122712281229123012311232123312341235
Выберите номер
Проверь себя №1
123456789101112
Проверь себя №2
123456789101112
Проверь себя №3
123456789101112
Проверь себя №4
123456789101112
Проверь себя №5
123456789101112
Проверь себя №6
123456789101112
Проверь себя №7
123456789101112
Выберите параграф
§1§2§4§5§6§7§8§10§11§12§14§15§16§18§20§21§22§23§24§25§26
Выберите страницу
67891011151617181921222324252627283334353738394041424346474849505153545556575960616364656667687071727374767778798082838485868788899091939495969899100101103104105106107108109111112113114115116118119120121124125126127128129138139140141142143144145146147149150151152153157158159160161162166167168169170171172173174175176183184185186189190191192193194199200201202203205206207209210211212213214216217218219220221222223224227228229230231232233234235-236
Adblockdetector
Colorful Packages: Инкапсуляция флуоресцентных белков в сложных коацерватных мицеллах
1. Miyawaki A., Niino Y. Молекулярные шпионы для биоимиджинга — зонды на основе флуоресцентных белков. Мол. Клетка. 2015; 58: 632–643. doi: 10.1016/j.molcel.2015.03.002. [PubMed] [CrossRef] [Google Scholar]
Miyawaki A., Niino Y. Молекулярные шпионы для биоимиджинга — зонды на основе флуоресцентных белков. Мол. Клетка. 2015; 58: 632–643. doi: 10.1016/j.molcel.2015.03.002. [PubMed] [CrossRef] [Google Scholar]
2. Enterina J.R., Wu L., Campbell R.E. Новые технологии флуоресцентных белков. Курс. мнение хим. биол. 2015;27:10–17. doi: 10.1016/j.cbpa.2015.05.001. [PubMed] [CrossRef] [Академия Google]
3. Циммер М. Зеленый флуоресцентный белок (GFP): применение, структура и связанное с ним фотофизическое поведение. хим. 2002; 102:759–781. doi: 10.1021/cr010142r. [PubMed] [CrossRef] [Google Scholar]
4. Цзянь Р.Ю. Зеленый флуоресцентный белок. Анну. Преподобный Биохим. 1998; 67: 509–544. doi: 10.1146/annurev.biochem.67.1.509. [PubMed] [CrossRef] [Google Scholar]
5. Шимомура О., Джонсон Ф.Х., Сайга Ю. Экстракция, очистка и свойства аэкворина, биолюминесцентного белка из светящегося гидромедузы, Акварея . Дж. Селл. Комп. Физиол. 1962; 59: 223–239. doi: 10.
6. Morise H., Shimomura O., Johnson F.H., Winant J. Межмолекулярный перенос энергии в биолюминесцентной системе Aequorea . Биохимия. 1974; 13: 2656–2662. doi: 10.1021/bi00709a028. [PubMed] [CrossRef] [Google Scholar]
7. Prasher D.C., Eckenrode V.K., Ward W.W., Prendergast F.G., Cormier M.J. Первичная структура Aequorea victoria зеленый флуоресцентный белок. Ген. 1992; 111: 229–233. doi: 10.1016/0378-1119(92)90691-H. [PubMed] [CrossRef] [Google Scholar]
8. Мац М.В., Фрадков А.Ф., Лабас Ю.А., Савицкий А.П., Зарайский А.Г., Маркелов М.Л., Лукьянов С.А. Флуоресцентные белки небиолюминесцентных видов Anthozoa . Нац. Биотехнолог. 1999; 17: 969–973. дои: 10.1038/13657. [PubMed] [CrossRef] [Google Scholar]
9. Karasawa S., Araki T., Nagai T., Mizuno H., Miyawaki A. Сине-излучающие и оранжево-излучающие флуоресцентные белки как донорно-акцепторная пара для флуоресценции. резонансный перенос энергии.
10. Мерзляк Э.М., Годхарт Ю., Щербо Д., Булина М.Е., Щеглов А.С., Фрадков А.Ф., Гайнцева А., Лукьянов К.А., Лукьянов С., Гаделла Т.В.Дж. и др. Яркий мономерный красный флуоресцентный белок с увеличенным временем жизни флуоресценции. Нац. Методы. 2007; 4: 555–557. doi: 10.1038/nmeth2062. [PubMed] [CrossRef] [Google Scholar]
11. Щербо Д., Мерфи К.С., Ермакова Г.В., Соловьева Е.А., Чепурных Т.В., Щеглов А.С., Верхуша В.В., Плетнев В.З., Хейзелвуд К.Л., Рош П.М., и др. Дальнекрасные флуоресцентные метки для визуализации белков в живых тканях. Биохим. Дж. 2009 г.;418:567–574. doi: 10.1042/BJ20081949. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Cranfill P.J., Sell B.R., Baird M.A., Allen J.R., Lavagnino Z., de Gruiter H.M., Kremers G.J., Davidson M.W., Ustione A., Piston Д.В. Количественная оценка флуоресцентных белков. Нац. Методы. 2016;13:557–562. doi: 10.1038/nmeth.3891. [PubMed] [CrossRef] [Google Scholar]
2016;13:557–562. doi: 10.1038/nmeth.3891. [PubMed] [CrossRef] [Google Scholar]
13. Щербо Д., Мерзляк Е.М., Чепурных Т.В., Фрадков А.Ф., Ермакова Г.В., Соловьева Е.А., Лукьянов К.А., Богданова Е.А., Зарайский А.Г., Лукьянов С. , и другие. Яркий дальнекрасный флуоресцентный белок для визуализации всего тела. Нац. Методы. 2007; 4: 741–746. doi: 10.1038/nmeth2083. [PubMed] [CrossRef] [Академия Google]
14. Чудаков Д.М., Мац М.В., Лукьянов С., Лукьянов К.А. Флуоресцентные белки и их применение в визуализации живых клеток и тканей. Физиол. 2010; 90:1103–1163. doi: 10.1152/physrev.00038.2009. [PubMed] [CrossRef] [Google Scholar]
15. Rhee J.K., Hovlid M., Fiedler J.D., Brown S.D., Manzenrieder F., Kitagishi H., Nycholat C., Paulson J.C., Finn M.G. Красочные вирусоподобные частицы: упаковка флуоресцентного белка капсидом Qβ. Биомакромолекулы. 2011;12:3977–3981. дои: 10.1021/bm200983к. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Seebeck F.P. , Woycechowsky KJ, Zhuang W., Rabe J.P., Hilvert D. Простая система маркировки для инкапсуляции белка. Варенье. хим. соц. 2006; 128:4516–4517. doi: 10.1021/ja058363s. [PubMed] [CrossRef] [Google Scholar]
, Woycechowsky KJ, Zhuang W., Rabe J.P., Hilvert D. Простая система маркировки для инкапсуляции белка. Варенье. хим. соц. 2006; 128:4516–4517. doi: 10.1021/ja058363s. [PubMed] [CrossRef] [Google Scholar]
17. Minten I.J., Hendriks L.J., Nolte R.J., Cornelissen J.J. Контролируемая инкапсуляция нескольких белков в вирусные капсиды. Варенье. хим. соц. 2009; 131:17771–17773. doi: 10.1021/ja907843s. [PubMed] [CrossRef] [Академия Google]
18. Ноллес А., Вестфаль А.Х., де Хооп Дж.А., Фоккинк Р.Г., Клейн Дж.М., ван Беркель В.Дж.Х., Борст Дж.В. Инкапсуляция GFP в сложные коацерватные мицеллы. Биомакромолекулы. 2015;16:1542–1549. doi: 10.1021/acs.biomac.5b00092. [PubMed] [CrossRef] [Google Scholar]
19. Nolles A., van Dongen N.J.E., Westphal A.H., Visser A.J.W.G., Kleijn J.M., van Berkel WJH, Borst J.W. Инкапсуляция в сложные мицеллы коацерватного ядра способствует димеризации EGFP. физ. хим. хим. физ. 2017;19: 11380–11389. doi: 10.1039/C7CP00755H. [PubMed] [CrossRef] [Google Scholar]
20. Zacharias D.A., Violin J.D., Newton A.C., Tsien R.Y. Разделение модифицированных липидами мономерных GFP на мембранные микродомены живых клеток. Наука. 2002; 296:913–916. doi: 10.1126/science.1068539. [PubMed] [CrossRef] [Google Scholar]
Zacharias D.A., Violin J.D., Newton A.C., Tsien R.Y. Разделение модифицированных липидами мономерных GFP на мембранные микродомены живых клеток. Наука. 2002; 296:913–916. doi: 10.1126/science.1068539. [PubMed] [CrossRef] [Google Scholar]
21. Sniegowski J.A., Phail M.E., Wachter R.M. Эффективность созревания, чувствительность к трипсину и оптические свойства вариантов Arg96, Glu222 и Gly67 зеленого флуоресцентного белка. Биохим. Биофиз. Рез. коммун. 2005; 332: 657–663. doi: 10.1016/j.bbrc.2005.04.166. [PubMed] [CrossRef] [Академия Google]
22. Кремерс Г.Дж., Гоэдхарт Дж., ван ден Хеувел Д.Дж., Герритсен Х.С., Гаделла Т.В.Дж. Усовершенствованные зеленые и синие флуоресцентные белки для экспрессии в клетках бактерий и млекопитающих. Биохимия. 2007;46:3775–3783. doi: 10.1021/bi0622874. [PubMed] [CrossRef] [Google Scholar]
23. Goedhart J., von Stetten D., Noirclerc-Savoye M., Lelimousin M., Joosen L., Hink M.A., van Weeren L., Gadella T.W.J., Royant A. , Направленная структурой эволюция голубых флуоресцентных белков с квантовым выходом 93% нац. коммун. 2012;3:751. doi: 10.1038/ncomms1738. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
коммун. 2012;3:751. doi: 10.1038/ncomms1738. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
Голубые и желтые суперфлуоресцентные белки с улучшенной яркостью, сворачиванием белков и радиусом Форстера FRET. Биохимия. 2006; 45: 6570–6580. doi: 10.1021/bi0516273. [PubMed] [CrossRef] [Google Scholar]
25. Сакауэ-Савано А., Курокава Х., Моримура Т., Ханю А., Хама Х., Осава Х., Кашиваги С., Фуками К., Мията Т. ., Миёси Х. и др. Визуализация пространственно-временной динамики развития многоклеточного клеточного цикла. Клетка. 2008; 132: 487–49.8. doi: 10.1016/j.cell.2007.12.033. [PubMed] [CrossRef] [Google Scholar]
26. Shaner N.C., Campbell R.E., Steinbach P.A., Giepmans B.N., Palmer A.E., Tsien R.Y. Улучшенные мономерные красные, оранжевые и желтые флуоресцентные белки, полученные из Discosoma sp. красный флуоресцентный белок. Нац. Биотехнолог. 2004; 22:1567–1572. doi: 10.1038/nbt1037. [PubMed] [CrossRef] [Google Scholar]
27. Shu X., Shaner N. C., Yarbrough C.A., Tsien R.Y., Remington S.J. Новые хромофоры и скрытые заряды контролируют цвет mFruits. Биохимия. 2006;45:9639–9647. doi: 10.1021/bi060773l. [PubMed] [CrossRef] [Google Scholar]
C., Yarbrough C.A., Tsien R.Y., Remington S.J. Новые хромофоры и скрытые заряды контролируют цвет mFruits. Биохимия. 2006;45:9639–9647. doi: 10.1021/bi060773l. [PubMed] [CrossRef] [Google Scholar]
28. Albertazzi L., Arosio D., Marchetti L., Ricci F., Beltram F. Количественный анализ FRET с парой флуоресцентных белков EGFP-mCherry. Фотохим. Фотобиол. 2009; 85: 287–297. doi: 10.1111/j.1751-1097.2008.00435.x. [PubMed] [CrossRef] [Google Scholar]
29. Арпино Дж.А., Ризкалла П.Дж., Джонс Д.Д. Кристаллическая структура усиленного зеленого флуоресцентного белка с разрешением 1,35 A выявляет альтернативные конформации Glu222. ПЛОС ОДИН. 2012;7:e47132. doi: 10.1371/journal.pone.0047132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Ноллес А. Инкапсуляция mTurquoise2 и mTurquoise2-His. Вагенингенский университет и исследования; Wageningen, The Netherlands: 2017. [Google Scholar]
31. Lindhoud S., Norde W., Cohen Stuart M.A. Обратимость и релаксационное поведение мицеллообразования полиэлектролитного комплекса.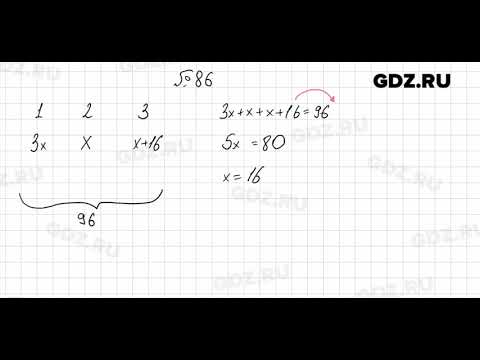
32. Rostkowski M., Olsson M.H.M., Søndergaard C.R., Jensen J.H. Графический анализ pH-зависимых свойств белков, предсказанных с помощью PROPKA. Структура БМК. биол. 2011;11:6. дои: 10.1186/1472-6807-11-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Олссон М.Х., Сондергаард К.Р., Ростковски М., Дженсен Дж.Х. PROPKA3: Последовательная обработка внутренних и поверхностных остатков в эмпирических прогнозах p K a. Дж. Хим. Теория вычисл. 2011;7:525–537. doi: 10.1021/ct100578z. [PubMed] [CrossRef] [Google Scholar]
34. Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T.N., Weissig H., Shindyalov I.N., Bourne P.E. Банк данных по белкам. Нуклеиновые Кислоты Res. 2000; 28: 235–242. doi: 10.1093/нар/28.1.235. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Хауптс У., Майти С., Швилле П., Уэбб В.В. Динамика колебаний флуоресценции зеленого флуоресцентного белка, наблюдаемая с помощью корреляционной спектроскопии флуоресценции.
36. Han L., Zhao Y., Zhang X., Peng J., Xu P., Huan S., Zhang M. Теги RFP для маркировки белков секреторного пути. Биохим. Биофиз. Рез. коммун. 2014; 447: 508–512. doi: 10.1016/j.bbrc.2014.04.013. [PubMed] [CrossRef] [Академия Google]
37. Nolles A. CD Спектры флуоресцентных белков при pH 9,0 или 10,0 и при pH 7,0. Вагенингенский университет и исследования; Wageningen, The Netherlands: 2017. [Google Scholar]
38. Visser N.V., Hink M.A., Borst J.W., van der Krogt G.N.M., Visser A.J.W.G. Спектроскопия кругового дихроизма флуоресцентных белков. ФЭБС лат. 2002; 521:31–35. doi: 10.1016/S0014-5793(02)02808-9. [PubMed] [CrossRef] [Google Scholar]
39. Брамс С., Брамс Дж. Определение вторичной структуры белка в растворе методом вакуумного ультрафиолетового кругового дихроизма. Дж. Мол. биол. 1980;138:149–178. doi: 10.1016/0022-2836(80)90282-X. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
40. Вуди Р. В. Круговой дихроизм. Методы Энзимол. 1995; 246:34–71. [PubMed] [Google Scholar]
41. Воец И.К., де Кейзер А., Коэн Стюарт М.А. Сложные коацерватные мицеллы. Доп. Коллоидный интерфейс Sci. 2009; 147–148: 300–318. doi: 10.1016/j.cis.2008.09.012. [PubMed] [CrossRef] [Google Scholar]
42. Blocher W.C., Perry S.L. Комплексные материалы на основе коацерватов для биомедицины. ПРОВОДА Наномед. Нанобиотехнология. 2016 г.: 10.1002/wnan.1442. [PubMed] [CrossRef] [Академия Google]
43. Кайитмазер А.Б., Сейрек Э., Дубин П.Л., Стаггемейер Б.А. Влияние жесткости цепи на взаимодействие полиэлектролитов с противоположно заряженными мицеллами и белками. Дж. Физ. хим. Б. 2003; 107:8158–8165. doi: 10.1021/jp034065a. [CrossRef] [Google Scholar]
44. Cooper C.L., Goulding A., Kayitmazer A.B., Ulrich S., Stoll S., Turksen S., Yusa S., Kumar A., Dubin P.L. Влияние жесткости цепи полиэлектролита, подвижности заряда и последовательности заряда на связывание с белками и мицеллами. Биомакромолекулы. 2006; 7: 1025–1035. дои: 10.1021/bm050592ж. [PubMed] [CrossRef] [Google Scholar]
Биомакромолекулы. 2006; 7: 1025–1035. дои: 10.1021/bm050592ж. [PubMed] [CrossRef] [Google Scholar]
45. Du X., Dubin P.L., Hoagland D.A., Sun L. Белково-селективная коацервация с гиалуроновой кислотой. Биомакромолекулы. 2014; 15:726–734. doi: 10.1021/bm500041a. [PubMed] [CrossRef] [Google Scholar]
46. Де Вос В. М., Леермакерс Ф. А., де Кейзер А., Коэн Стюарт М. А., Кляйн Дж. М. Полевой теоретический анализ движущих сил поглощения белков полиэлектролитными щетками с одинаковым зарядом: Эффекты регуляции заряда и пятнистости. Ленгмюр. 2010;26:249–259. doi: 10.1021/la902079u. [PubMed] [CrossRef] [Google Scholar]
47. Дэй Р. Н., Дэвидсон М. В. Палитра флуоресцентных белков: инструменты для визуализации клеток. хим. соц. 2009; 38: 2887–2921. doi: 10.1039/b901966a. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Micsonai A., Wien F., Kernya L., Lee Y.H., Goto Y., Refregiers M., Kardos J. Точное предсказание вторичной структуры и Распознавание кратности для спектроскопии кругового дихроизма. проц. Натл. акад. науч. США. 2015;112:E3095–E3103. doi: 10.1073/pnas.1500851112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 2015;112:E3095–E3103. doi: 10.1073/pnas.1500851112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Долински Т.Дж., Чодровски П., Ли Х., Нильсен Дж.Э., Дженсен Дж.Х., Клебе Г., Бейкер Н.А. биомолекулярные структуры для молекулярного моделирования. Нуклеиновые Кислоты Res. 2007; 35:W522–W525. doi: 10.1093/nar/gkm276. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Baker N.A., Sept D., Joseph S., Holst M.J., McCammon J.A. Электростатика наносистем: приложение к микротрубочкам и рибосомам. проц. Натл. акад. науч. США. 2001;98:10037–10041. doi: 10.1073/pnas.181342398. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Schrödinger, LLC . Система молекулярной графики MacPyMOL, версия 1.4. Шредингер, ООО; Нью-Йорк, штат Нью-Йорк, США: 2016. [Google Scholar]
52. Chong S., Mersha F.B., Comb D.G., Scott M.E., Landry D., Vence L.M., Perler F.B., Benner J., Kucera R.B., Hirvonen C.A., и другие. Одноколоночная очистка свободных рекомбинантных белков с использованием саморасщепляющейся аффинной метки, полученной из элемента сплайсинга белка. Ген. 1997;192:271–281. doi: 10.1016/S0378-1119(97)00105-4. [PubMed] [CrossRef] [Google Scholar]
Одноколоночная очистка свободных рекомбинантных белков с использованием саморасщепляющейся аффинной метки, полученной из элемента сплайсинга белка. Ген. 1997;192:271–281. doi: 10.1016/S0378-1119(97)00105-4. [PubMed] [CrossRef] [Google Scholar]
53. Evans T.C., Jr., Xu M.Q. Лигирование белков, опосредованное интеином: использование мастеров побега природы. Биополимеры. 1999; 51: 333–342. doi: 10.1002/(SICI)1097-0282(1999)51:5<333::AID-BIP3>3.0.CO;2-#. [PubMed] [CrossRef] [Google Scholar]
54. Сюй М.К., Паулюс Х., Чонг С. Слияния с саморасщепляющимися интеинами для очистки белков. Методы Энзимол. 2000;326:376–418. [PubMed] [Академия Google]
55. Biasini M., Bienert S., Waterhouse A., Arnold K., Studer G., Schmidt T., Kiefer F., Gallo Cassarino T., Bertoni M., Bordoli L., et al. SWISS-MODEL: Моделирование третичной и четвертичной структуры белка с использованием эволюционной информации. Нуклеиновые Кислоты Res. 2014;42:W252–W258. doi: 10.1093/nar/gku340. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Арнольд К., Бордоли Л., Копп Дж., Шведе Т. Рабочее пространство SWISS-MODEL: веб-среда для моделирования гомологии структуры белка . Биоинформатика. 2006;22:195–201. doi: 10.1093/биоинформатика/bti770. [PubMed] [CrossRef] [Google Scholar]
Арнольд К., Бордоли Л., Копп Дж., Шведе Т. Рабочее пространство SWISS-MODEL: веб-среда для моделирования гомологии структуры белка . Биоинформатика. 2006;22:195–201. doi: 10.1093/биоинформатика/bti770. [PubMed] [CrossRef] [Google Scholar]
57. Кифер Ф., Арнольд К., Кюнцли М., Бордоли Л., Шведе Т. Репозиторий SWISS-MODEL и связанные ресурсы. Нуклеиновые Кислоты Res. 2009; 37:D387–D392. doi: 10.1093/nar/gkn750. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Guex N., Peitsch M.C., Schwede T. Автоматическое сравнительное моделирование структуры белков с помощью SWISS-MODEL и Swiss-PdbViewer: историческая перспектива. Электрофорез. 2009 г.;30:С162–С173. doi: 10.1002/elps.200
0. [PubMed] [CrossRef] [Google Scholar]
59. Субач О.М., Малашкевич В.Н., Зенчек В.Д., Морозова К.С., Пяткевич К.Д., Алмо С.С., Верхуша В.В. Структурная характеристика ацилиминсодержащих синих и красных хромофоров во флуоресцентных белках mTagBFP и TagRFP. хим. биол. 2010;17:333–341. doi: 10.1016/j.chembiol.2010.03.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.chembiol.2010.03.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Кристаллическая структура и фотодинамическое поведение синего варианта Y66H/Y145F зеленого флуоресцентного белка. Биохимия. 1997;36:9759–9765. doi: 10.1021/bi970563w. [PubMed] [CrossRef] [Google Scholar]
61. Рекас А., Алаттиа Дж. Р., Нагаи Т., Мияваки А., Икура М. Кристаллическая структура венеры, желтого флуоресцентного белка с улучшенным созреванием и пониженной чувствительностью к окружающей среде. Дж. Биол. хим. 2002; 277:50573–50578. doi: 10.1074/jbc.M209524200. [PubMed] [CrossRef] [Google Scholar]
62. Kikuchi A., Fukumura E., Karasawa S., Mizuno H., Miyawaki A., Shiro Y. Структурная характеристика тиазолинсодержащего хромофора в оранжевом флуоресцентном белке , мономерный Кусабира Апельсин. Биохимия. 2008;47:11573–11580. doi: 10.1021/bi800727v. [PubMed] [CrossRef] [Академия Google]
63. Коппель Д.Е. Анализ полидисперсности макромолекул методом корреляционной спектроскопии интенсивностей. Метод кумулянтов. Дж. Хим. физ. 1972; 57: 4814–4820. дои: 10.1063/1.1678153. [CrossRef] [Google Scholar]
Метод кумулянтов. Дж. Хим. физ. 1972; 57: 4814–4820. дои: 10.1063/1.1678153. [CrossRef] [Google Scholar]
64. Берн Б.Дж., Пекора Р. Динамическое рассеяние света с применением в химии, биологии и физике. Курьер Довер; Нью-Йорк, штат Нью-Йорк, США: 1976. [Google Scholar]
65. Provencher S.W. Contin — универсальная программа регуляризации с ограничениями для обращения зашумленных линейных алгебраических и интегральных уравнений. вычисл. физ. коммун. 1982;27:229–242. doi: 10.1016/0010-4655(82)90174-6. [CrossRef] [Google Scholar]
66. Provencher S.W. Метод ограниченной регуляризации для инвертирования данных, представленных линейными алгебраическими или интегральными уравнениями. вычисл. физ. коммун. 1982; 27: 213–227. doi: 10.1016/0010-4655(82)90173-4. [CrossRef] [Google Scholar]
67. Скакун В.В., Хинк М.А., Дигрис А.В., Энгель Р., Новиков Э.Г., Апанасович В.В., Виссер А.Дж.В.Г. Глобальный анализ данных о флуктуациях флуоресценции. Евро. Биофиз. Дж. 2005; 34: 323–334. дои: 10.1007/s00249-004-0453-9. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1007/s00249-004-0453-9. [PubMed] [CrossRef] [Google Scholar]
68. Скакун В.В., Энгель Р., Дигрис А.В., Борст Дж.В., Виссер А.Дж.В.Г. Глобальный анализ автокорреляционных функций и распределений счета фотонов. Передний. Бионауч. Элитный Эд. 2011;3:489–505. дои: 10.2741/e264. [PubMed] [CrossRef] [Google Scholar]
69. Велапольди Р.А., Тоннесен Х.Х. Скорректированные эмиссионные спектры и квантовые выходы для ряда флуоресцентных соединений в видимой области спектра. Дж. Флуоресц. 2004; 14: 465–472. doi: 10.1023/B:JOFL.0000031828.96368.с1. [PubMed] [CrossRef] [Google Scholar]
70. Huang X.Q., Miller W. Эффективный по времени алгоритм локального сходства в линейном пространстве. Доп. заявл. Мат. 1991; 12: 337–357. doi: 10.1016/0196-8858(91)
-D. [CrossRef] [Google Scholar] 71. Robert X., Gouet P. Расшифровка ключевых особенностей белковых структур с помощью нового сервера ENDscript. Нуклеиновые Кислоты Res. 2014;42:W320–W324. doi: 10.1093/nar/gku316.
