Практическая работа «Алюминий» химия 10 клас
Вариант1
Часть А
А1. Элемент, электронная формула которого 1s22s22p63s23p1 образует высший оксид, проявляющий свойства:
1) несолеобразующего 2) кислотного 3) основного 4) амфотерного
А2. В атоме алюминия число свободных 3d-орбиталей равно:
1) 0 2) 2 3) 5 4) 3
А3. Верны ли утверждения о гидроксиде алюминия?
А. Гидроксид алюминия проявляет только кислотные свойства.
Б. Гидроксид алюминия проявляет только основные свойства?
1) верно только А 3) верны оба утверждения
2) верно только Б 4) оба утверждения неверны
А4. Реакции концентрированной серной кислоты с алюминием при (о.
1) 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O 2) не взаимодействуют
3) 2Al + 5H2SO4 = Al2(SO4)3 + 2S + 5H2O 4) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
А5. При нагревании гидроксида алюминия образуются:
1) Al2O3 и H2O 3) Al и H2O 2) Al и H2 4) Al2O3 и H2
А6. Веществами Х и Y в схеме химической реакции Al2S3 + H2O → X + Y являются:
1) Al(HS)3 и H2S 2) Al(OH)3 и H2S 3) Al(OH)S и H2S 4) Al2O3 и Al(HS) 3
Часть В
В1. Установите соответствие между металлом и способом его электролитического получения в промышленности:
Установите соответствие между металлом и способом его электролитического получения в промышленности:
МЕТАЛЛ СПОСОБ ПОЛУЧЕНИЯ
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
В2. Установите соответствие между формулой соли и окраской индикаторов в ее водном растворе:
ФОРМУЛА СОЛИ ОКРАСКА ИНДИКАТОРОВ
А) KF 1) лакмус красный, фенолфталеин малиновый
Б) Al2(SO4)3 2) лакмус красный, фенолфталеин бесцветный
В) С6Н5ОNa 3) лакмус синий, фенолфталеин малиновый
Г) LiNO3
4) лакмус фиолетовый, фенолфталеин малиновый5) лакмус синий, фенолфталеин бесцветный
6) лакмус фиолетовый, фенолфталеин бесцветный
Вариант2
Часть А
А1. Сумма протонов, нейтронов и электронов в атоме 27Al равна:
Сумма протонов, нейтронов и электронов в атоме 27Al равна:
1) 27 2) 40 3) 13 4) 14
А2. В ряду Al → Si → P → S
1) увеличивается число энергетических уровней в атомах
2) уменьшается радиус атома
3) усиливаются металлические свойства элементов
4) уменьшается высшая степень окисления элементов
А3. Алюминий реагирует с каждым из набора веществ:
1) азот и хлорид натрия 2) кислород и концентрированная азотная кислота (о.у.)
3) соляная кислота и гидроксид натрия 4) аргон и нашатырь
А4. Водород может выделиться при протекании реакции:
1) Al + NaOH + H2O = 2) Ag + HCl = 3) Fe + CuSO4 = 4) P + HNO3 =
А5. Гидроксид алюминия проявляет амфотерные свойства при взаимодействии с:
1) NaOH и Cs2SO4 2) KOH и Na2O 3) H2SO4 и KOH 4) HCl и CaCl2
А6. В схеме превращений Al → X 1→ X2→ Al веществами Х1 и X2 могут быть
В схеме превращений Al → X 1→ X2→ Al веществами Х1 и X2 могут быть
соответственно:
1) Al(NO3)3 и Al(OH)3 2) AlPO4 и Al(OH)3 3) Al(OH)3 и Al2(СO3)3 4) Al2O3 и AlCl3
Часть В
В1. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора с инертными электродами:
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
А) AlCl3 1) металл, галоген
Б) RbOH 2) гидроксид металла, хлор, водород
В) Hg(NO3)2
3) металл, кислородГ) AuCl3 4) металл, кислота, кислород
5) водород, кислород
6) водород, галоген
В2.
НАЗВАНИЕ СОЛИ СПОСОБНОСТЬ К ГИДРОЛИЗУ
А) ацетат аммония 1) по катиону
Б) сульфид алюминия 2) по аниону
В) ортофосфат калия 3) по катиону и аниону
Г) сульфат хрома(II) 4) гидролиз не происходит
Задания | А1 | А2 | А3 | А4 | А5 | А6 | В1 | В2 |
вариант 1 | 4 | 3 | 4 | 2 | 1 | 2 | 3511 | 3236 |
вариант 2 | 2 | 2 | 3 | 1 | 3 | 4 | 2541 | 3321 |
Точка роста | МБОУ «Убеевская СОШ» Красноармейского района
/news/2023/02/16/prakticheskaya-rabota-po-teme-manometri-v-7-klasse/?id=29cd932c-34f5-499c-b2ee-5ae936474eff/news/2023/02/16/prakticheskaya-rabota-po-teme-manometri-v-7-klasse/?id=29cd932c-34f5-499c-b2ee-5ae936474eff
Общая информация о центре «Точка роста»
В образовательном центре естественно-научной и технологической направленностям «Точка роста» МБОУ «Убеевская СОШ» будет осуществляться единый подход к общеобразовательным программам, составленным в соответствии с предметными областями: «Естественно-научные предметы» и «Технология».
В рамках плана мероприятий федерального проекта «Современная школа» национального проекта «Образование» в МБОУ «Убеевская СОШ» с 01.09.2021 г. начнет работу Центр образования естественно-научной и технологической направленностей «Точка роста».
Функции Центра:
• участие в реализации основных общеобразовательных программ в части предметных областей «Естественно-научные предметы» и «Технология»;
• реализация разноуровневых дополнительных общеобразовательных программ естественнонаучного и технологического направленностей, а также иных программ в рамках внеурочной деятельности;
• обеспечение создания, апробации и внедрения модели равного доступа к современным общеобразовательным программам естественно-научного и технологического профилей;
• внедрение сетевых форм реализации программ дополнительного образования;
• организация внеурочной деятельности в учреждении, разработка соответствующих образовательных программ; • вовлечение учащихся и педагогов в проектную деятельность;
• обеспечение реализации мер по непрерывному развитию педагогических и управленческих кадров, включая повышение квалификации руководителя и педагогов Центра, реализующих основные и дополнительные общеобразовательные программы естественнонаучного, технологического профилей;
• реализация мероприятий по информированию и просвещению населения в области естественно-научных и технологических компетенций;
• информационное сопровождение учебно-воспитательной деятельности Центра, системы внеурочных мероприятий с совместным участием детей, педагогов, родительской общественности, в том числе на сайте образовательной организации и иных информационных ресурсах;
• содействие созданию и развитию общественного движения учащихся, направленного на личностное развитие, социальную активность через проектную деятельность, различные программы дополнительного образования.
Задачи Центра:
1. СОВЕРШЕНСТВОВАНИЕ УСЛОВИЙ для повышения качества общего образования в общеобразовательных организациях, расположенных в сельской местности и малых городах.
2. РАСШИРЕНИЕ ВОЗМОЖНОСТЕЙ обучающихся в освоении учебных предметов естественно-научной и технологической направленностей.
3. ПРАКТИЧЕСКАЯ ОТРАБОТКА учебного материала по учебным предметам «Физика», «Химия», «Биология».
4. ПОВЫШЕНИЕ ОХВАТА обучающихся общеобразовательных организаций сельской местности и малых городов образовательными программами общего и дополнительного образования естественно-научной и технологической направленностей на современном оборудовании.
Ожидаемые результаты:
1. Модернизация материально-технической базы для реализации образовательных программ цифрового, технического, естественнонаучного и гуманитарного профилей.
2. Обновление:
— перечня средств обучения и УМК;
— содержания образовательных программ;
— методик преподавания и оценивания.
3. Актуализация дизайна инфраструктуры
4. Внедрение дистанционных программ
5. Развитие сетевых форм
ДОКУМЕНТЫ
Распоряжение Министерства просвещения Российской Федерации от 17 декабря 2019 года №Р-133 «Об утверждении методических рекомендаций по созданию (обновлению)» материально-технической базы общеобразовательных организаций, расположенных в сельской местности и в малых городах для формирования у обучающихся современных технологических и гуманитарных навыков при реализации основных и дополнительных общеобразовательных программ цифрового и гуманитарного профилей в рамках региональных проектов, обеспечивающих достижение целей, показателей и результатов федерального проекта «Современная школа» национального проекта «Образование»
Создание Центров образования цифрового и гуманитарного профилей «Точка роста» в 2020 году (презентация)
Приказ Минобразования Чувашии от 03.12.2019 № 2188 о сопровождении Центров образования цифрового и гуманитарного профилей «Точка роста» в Чувашской Республике
РЕЖИМ ЗАНЯТИЙ
График работы кабинета химии и биологии
График работы кабинета физики
Прикрепленные файлы
docx | Общая информация о центре «Точка роста» | 33,83 Kb | 24. 12.2021 12.2021 | |
| Должностная инструкция педагога | 496,3 Kb | 24.12.2021 | ||
docx | Педагоги | 13,28 Kb | 24. 12.2021 12.2021 | |
| Приказ Министерства образования и молодежной политики ЧР №1169-р от 26 декабря 2020г.» О создании центров образования «Точка роста» | 426,57 Kb | 24.12.2021 | ||
метод. реком. реком. | 526,88 Kb | 24.12.2021 | ||
docx | Программа внеурочной деятельности по химии в 9 классе | 332,21 Kb | 24.12.2021 | |
docx | РП биология 5-6 кл. внеурочка внеурочка | 197,05 Kb | 24.12.2021 | |
docx | Рабочая программа кружка «Мир простых механизмов» 5-7 кл | 41,52 Kb | 27.12.2021 | |
docx | Рабочая программа по химии для 8-9 классов | 623,06 Kb | 24. 12.2021 12.2021 | |
| Положение о точке роста | 1001,19 Kb | 24.12.2021 | ||
docx | Дополнительная информация | 12,24 Kb | 24. 12.2021 12.2021 | |
docx | Рабочая программа по биологии в 5-9 классах | 702,32 Kb | 24.12.2021 | |
| Материально — техническая база | 251,74 Kb | 24. 12.2021 12.2021 | ||
doc | Рабочая программа кружка «Мой первый робот» 7 кл. | 150,5 Kb | 27.12.2021 | |
| Р-6 от 12.01.2021. Методические рекомендации по созданию центров ТР | 526,88 Kb | 24. 12.2021 12.2021 | ||
| Приказ от 12.01.2021 № 7 Об утвержд. отв. лица и перечня школ ТР | 426,57 Kb | 24.12.2021 | ||
docx | РП физика 7-9 | 543,43 Kb | 24. 12.2021 12.2021 | |
| Должностная инструкция руководителя центра | 593,01 Kb | 24.12.2021 | ||
| Приказ 45 | 540,22 Kb | 24.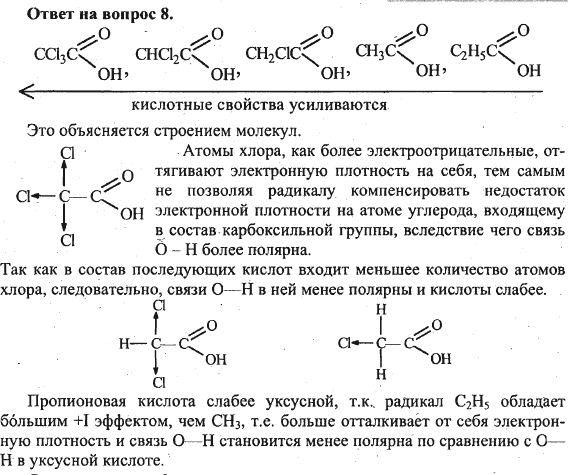 12.2021 12.2021 | ||
| Об утверждении методических рекомендаций | 540,88 Kb | 24.12.2021 |
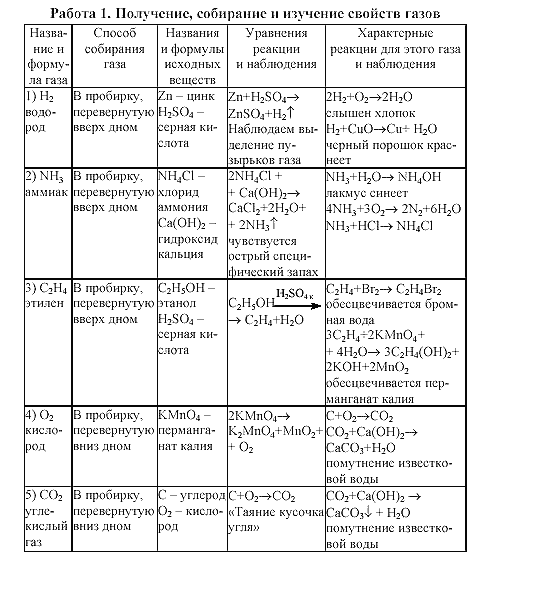
NCERT Класс 10. Руководство для научной лаборатории Типы реакций
Содержание
- 0.1 Химия. Практический класс 10. Типы реакций Введение
- 1 NCERT Класс 10.
 Руководство для научной лаборатории. 006 2 NCERT Класс 10 Руководство по научной лаборатории Viva Voce
Руководство для научной лаборатории. 006 2 NCERT Класс 10 Руководство по научной лаборатории Viva Voce - 3 NCERT Класс 10 Руководство по научной лаборатории Практические вопросы
- 4 NCERT Класс 10 Руководство по научной лаборатории Вопросы
- 5 NCERT Класс 10 Руководство по научной лаборатории Вопросы с множественным выбором (MCQ)
- 6 Руководство по научной лаборатории NCERT для класса 10. Вопросы, основанные на навыках наблюдения
- 7 Руководство для научной лаборатории. Вопросы для класса 10, основанные на навыках отчетности и интерпретации
- 8 Руководство по научной лаборатории CBSE для класса 10. Ключ для подсчета очков с объяснением
| Доска | CBSE |
| Учебник | НЦЕРТ |
| Класс | Класс 10 |
| Тема | Наука (химия) |
| Название эксперимента | Типы реакций |
| Категория | Руководство по научной лаборатории класса 10 |
NCERT Класс 10 Руководство по научной лаборатории Типы реакций
Химия Практический класс 10 Типы реакций Введение > Химическая реакция: Реакция, в которой два или более веществ новые свойства называют химической реакцией.
> Химическая реакция проявляет следующие свойства:
1. Выделяется тепло (либо поглощается, либо выделяется), могут выделяться пузырьки, может изменяться цвет или рН.
2. Реагенты реагируют с образованием нового продукта. Это включает в себя разрыв старых связей и образование новых связей между атомами.
3. Атомы реагента либо теряют, либо приобретают, либо обмениваются электронами, образуя новые соединения.
4. Суммарная масса атомов, реагирующих в реакции, всегда сохраняется. Атомы не создаются и не разрушаются, их масса и число остаются прежними.
Типы химических реакций: Реакция сочетания, реакция разложения, реакция замещения, реакция двойного замещения, экзотермические и эндотермические реакции.
> Реакция комбинирования: Когда два или более реагента вступают в химическую реакцию вместе с образованием одного продукта, такая реакция называется реакцией комбинирования. Реагентами могут быть два элемента, элемент и соединение или два соединения.
> Реакция разложения: Когда соединение распадается с образованием более простых продуктов, эта реакция называется реакцией разложения. Разложение может происходить под действием тепла, света и электричества.
> Реакция смещения: Металлы имеют разную реакционную способность, некоторые из них более реакционноспособны, некоторые менее реактивны. Когда более активный металл вытесняет менее активный металл из его солевого раствора, химическая реакция называется реакцией замещения.
> Реакция двойного замещения: Когда два солевых раствора (содержащих два разных иона металла) реагируют друг с другом, менее реакционноспособный ион металла замещается более реакционноспособным ионом металла. В результате обмена ионами образуются две новые соли. Такая реакция называется реакцией двойного замещения.
Если соль, образовавшаяся в указанной выше реакции, нерастворима в воде, то такая реакция называется реакцией осаждения.
> Экзотермическая реакция: В химической реакции выделение тепла называется экзотермической реакцией.
> Эндотермическая реакция: В химической реакции, когда для ее протекания требуется тепло, такая реакция называется эндотермической.
Расширенное обучение
> SO 2 : Двуокись серы является хорошим восстановителем. В присутствии воды диоксид серы способен обесцвечивать вещества. В частности, это полезно для отбеливания бумаги и деликатных материалов, таких как одежда. Кислород в атмосфере повторно окисляет восстановленные красители, восстанавливая цвет.
> SO 3 : Триоксид серы вызывает серьезные ожоги как при вдыхании, так и при проглатывании, поскольку по своей природе он обладает высокой коррозионной активностью. С SO 3 следует обращаться с особой осторожностью, так как он бурно реагирует с водой и образует высококоррозионную серную кислоту.
NCERT Class 10 Science Lab Manual Experiment 3
Цель
Провести и наблюдать следующие реакции и классифицировать их на:
(a) Реакция сочетания (b) Реакция разложения
(c) Реакция замещения (d) Реакция двойного замещения.
1. Действие воды на негашеную известь.
2. Действие тепла на кристаллы железного купороса.
3. Гвозди железные, выдержанные в растворе медного купороса.
4. Взаимодействие растворов сульфата натрия и хлорида бария.
Теория
Действие воды на быстрое время
> Гашеная известь представляет собой оксид кальция (CaO). Он соединяется с водой с образованием гидроксида кальция [Ca(OH) 2 ], также называемого гашеной известью.
> Два вещества соединяются с образованием одного продукта, следовательно, это реакция соединения.
> В ходе реакции выделяется тепло, поэтому она называется экзотермической реакцией.
> Раствор гашеной извести окрашивает красную лакмусовую бумагу в синий цвет, следовательно, он является щелочным по своей природе.
> Свежеприготовленную гашеную известь также называют известковой водой.
> Он становится молочным, когда через него проходит углекислый газ.
Воздействие тепла на кристаллы сульфата железа
> Кристаллы сульфата железа светло-зеленого цвета. Цвет обусловлен кристаллизационной водой.
> При нагревании кристаллы сульфата железа претерпевают следующие изменения:
> Цвет меняется на коричневый и выделяются газы из-за образования новых соединений.
> Одно соединение разлагается с образованием трех новых соединений, поэтому это называется реакцией разложения. Газ
> SO 2 и SO 3 превращает влажную синюю лакмусовую бумагу в красную, следовательно, он имеет кислотную природу.
> SO 2 проявляет восстановительные свойства: он меняет оранжевый цвет подкисленного дихромата калия на зеленый, когда через него пропускают газ SO 2 .
> Кристаллизационная вода выделяется кристаллами.
> ТАК 2 газ имеет запах удушья, не вдыхайте газ, держите горлышко пробирки подальше от лица.
Железные гвозди, выдержанные в растворе сульфата меди
> Железные гвозди, выдержанные в синем растворе сульфата меди, показывают следующие изменения:
(a) Раствор синего цвета медленно меняется на светло-зеленый.
(b) Ионы Fe 2+ замещают ионы Cu 2+ и образуют в растворе сульфат железа, поэтому эта реакция называется реакцией замещения.
(c) На железном гвозде осаждаются красноватые ионы меди.
(d) Атом Fe образует ионы Fe 2+ за счет потери электронов и подвергается окислению, а ионы Cu 2+ приобретают электроны, превращаясь в атом Cu и подвергаясь восстановлению.
Реакция между растворами сульфата натрия и хлорида бария
> Раствор сульфата натрия и раствор хлорида бария бесцветны.
> Смешивание обоих растворов дает осадок белого цвета из-за образования сульфата бария
> Обмен ионами происходит в реакции и называется реакцией двойного замещения.
> Сульфат бария нерастворим в воде и поэтому образует осадок.
Необходимые материалы
Стакан, четыре пробирки, держатель для пробирок, щипцы, штатив для пробирок, пипетка, кусок наждачной бумаги и горелка Бунзена. Требуемые химикаты: Небольшой кусочек негашеной извести, кристаллы сульфата железа, железные гвозди (чистые и не ржавые), раствор сульфата меди, раствор сульфата натрия, раствор хлорида бария и дистиллированная вода.
Меры предосторожности
- Не прикасайтесь к негашеной извести руками, используйте щипцы.
- При смешивании негашеной извести и воды выделяется большое количество тепла, поэтому добавляйте воду по каплям и используйте химический стакан из боросила.
- Для обогрева используйте трубки из твердого стекла.
- Никогда не вдыхайте газ, только дуйте газом.
- Не прикасайтесь к химическим веществам руками.
- Держите горлышко пробирки подальше от лица во время нагревания.

- Железные гвозди должны быть тщательно очищены с помощью наждачной бумаги, прежде чем погрузить их в раствор медного купороса.
NCERT Class 10 Science Lab Manual Viva Voce
Вопрос 1:
Приведите два примера комбинированной реакции.
Вопрос 2:
При смешивании нитрата свинца с раствором йодида калия назовите соединение, которое образуется и дает желтый осадок.
Ответ:
При смешивании нитрата свинца и йодида калия образуется йодид свинца в виде желтого осадка, а другим продуктом является нитрат калия.
Вопрос 3:
Что произойдет, если опустить железный гвоздь в раствор сульфата железа зеленого цвета?
Ответ:
Нет изменений.
Вопрос 4:
Что такое медный купорос и зеленый купорос?
Ответ:
Медный купорос — CuSO 4 .5H 2 0
Зеленый купорос — FeSO 4 . 7H 2 0.
7H 2 0.
Вопрос 5:
Каково химическое название и формула извести?
Ответ:
Оксид кальция, CaO.
Вопрос 6:
Назовите тип реакции при нагревании медного купороса, т. е. CuSO 4 .5H 2 O.
Ответ:
Это реакция разложения.
Вопрос 7:
Какова химическая формула известняка?
Ответ:
Формула известняка CaCO 3
Вопрос 8:
FeSO 4 .7H 2 O – это формула сульфата железа. Что означает 7H 2 O?
Ответ:
7H 2 O – кристаллизационная вода, т. е. для образования кристалла одной молекуле FeSO 4 требуется семь молекул воды.
Вопрос 9:
Какова природа газообразных диоксида серы и триоксида серы?
Ответ:
Как SO 2 , так и SO 3 имеют кислую природу.
Вопрос 10:
Какого цвета металл железа и меди?
Ответ:
Железо имеет серый цвет, а медь — красновато-коричневый цвет.
Вопрос 11:
Приведите сбалансированное химическое уравнение, показывающее реакцию между сульфатом натрия и хлоридом бария.
Ответ:
NCERT Класс 10 Руководство по научной лаборатории Практические вопросы
Вопрос 1:
Назовите три типа реакции разложения.
Ответ:
Три типа реакции разложения связаны с
Вопрос 2:
Раствор хлорида бария смешивается с раствором сульфата натрия с образованием белого осадка. Выпадение осадка происходит за счет какой соли.
Ответ:
Белый осадок возникает из-за образования сульфата бария.
Вопрос 3:
Что происходит, когда цинк добавляется к сульфату меди синего цвета?
Ответ:
Медный купорос синего цвета становится бесцветным.
Вопрос 4:
Железный гвоздь погружают в раствор медного купороса синего цвета. Какие наблюдения?
Ответ:
Железный гвоздь приобретает красновато-коричневый налет, а окрашенный в синий цвет раствор медного купороса становится зеленым.
Вопрос 5:
Если вы добавите воду в известь (CaO), какие изменения вы заметите?
Ответ:
Реакция между известью (CaO) и водой сильно экзотермична. При образовании Ca(OH) 9 выделяется большое количество тепла.0130 2 гашеная известь.
Вопрос 6:
Укажите условие, необходимое для реакции смещения.
Ответ:
Реакция замещения возможна только тогда, когда более активный металл вытесняет менее активный металл.
Вопрос 7:
Назовите цвет газа, образующегося при нагревании нитрата свинца.
Ответ:
Образуется газ двуокиси азота коричневого цвета.
Вопрос 8:
Какова химическая формула известковой воды? Как его обычно называют?
Ответ:
Химическая формула известковой воды Ca(OH) 2 . Ca(OH) 2 обычно называют гашеной известью.
Вопрос 9:
Углекислый газ следует пропускать через известковую воду только на короткое время. Объяснить, почему?
Ответ:
Меньшее количество углекислого газа сделает известковую воду мутной, а избыток CO 2 сделает ее бесцветной.
Вопрос 10:
Какое химическое вещество получается при избытке CO 2 пропускают через известковую воду?
Ответ:
При пропускании избытка газа CO 2 через известковую воду образуется бикарбонат кальция (CaHCO 3 ), растворимый в воде.
Вопрос 11:
Что происходит при совместной реакции сульфата натрия и раствора хлорида бария?
Ответ:
Образуется хлорид натрия и белый осадок сульфата бария.
Вопрос 12:
Что вы подразумеваете под водным раствором?
Ответ:
Раствор, приготовленный в воде, называется водным раствором.
Вопрос 13:
Что вы подразумеваете под раствором осадка?
Ответ:
Когда полученный раствор не растворяется в воде, говорят, что получен осадок.
Вопрос 14:
Назовите продукты, полученные при разложении кристаллов сульфата железа.
Ответ:
При разложении кристаллов сульфата железа образуются продукты Fe 2 O 3 , SO 2 , SO 3 и 14H 2 0, то есть оксид железа, диоксид серы, триоксид серы и вода.
NCERT Класс 10 Руководство по научной лаборатории Вопросы
Вопрос 1:
Почему меняется цвет сульфата меди, когда в него погружают железный гвоздь?
Ответ:
При добавлении железного гвоздя в медный купорос происходит реакция замещения. Железо более реакционноспособно, чем медь, вытесняет медь с образованием зеленого раствора сульфата железа, а медь (розовато-коричневый) вытесняет металл.
Железо более реакционноспособно, чем медь, вытесняет медь с образованием зеленого раствора сульфата железа, а медь (розовато-коричневый) вытесняет металл.
Вопрос 2:
Как бы вы разработали процедуру, чтобы показать, что Mg > Fe > Cu в ряду реактивности?
Ответ:
Этап 1: Добавьте металлический сульфат магния в сульфат железа, взятый в одну пробирку, и сульфат меди, взятый в другую пробирку, подождите некоторое время и запишите наблюдения.
Шаг 2: Добавьте металл Fe в сульфат магния, взятый в одну пробирку, и в сульфат меди, взятый в другую пробирку, подождите некоторое время и запишите наблюдения.
Шаг 3: Добавьте металлическую медь в пробирку с сульфатом магния и в другую пробирку с сульфатом железа. Наблюдайте и записывайте.
Вы заметите, что магний может вытеснять Fe и Cu из растворов их солей, Fe может вытеснять только медь из растворов солей, а Cu не может вытеснять ни один из металлов из растворов солей.
Следовательно, можно проверить реакционную способность и доказать, что Mg является наиболее реакционноспособным металлом, а медь — наименее реакционноспособным металлом среди Mg, Fe и Cu.
Вопрос 3:
Каков основной принцип этого эксперимента?
Ответ:
Более активный металл может вытеснить менее активный металл.
Вопрос 4:
Почему происходит следующая реакция?
Ответ:
Хлор более активен, чем йод, поэтому он вытесняет ионы йода из своего водного раствора и высвобождает йод.
Вопрос 5:
Сульфат натрия и хлорид бария являются ________ (ионными/ковалентными) соединениями.
Ответ:
Ионный.
Вопрос 6:
При образовании белого осадка сульфата бария ___________ (сразу/через некоторое время после
смешивания двух растворов) реакция между ___________ (ионными/ковалентными) соединениями является ___________ (мгновенной/медленной).
Ответ:
немедленно, ионный, мгновенный.
Вопрос 7:
Что может произойти при смешивании растворов Pb(NO 3 ) 2 и KCl? Предсказать (можно попробовать экспериментально проверить).
Ответ:
Происходит реакция замещения и образуется желтый осадок йодида свинца.
Вопрос 8:
Каково промышленное применение изучаемого типа реакции?
Ответ:
Эти реакции используются при извлечении металлов в промышленности. Эти реакции также полезны в упаковочной и пищевой промышленности.
NCERT Class 10 Science Lab Manual Вопросы с несколькими вариантами ответов (MCQ)
Вопросы, основанные на процедурных и манипулятивных навыках
1. Добавление воды в известь
(a) эндотермическая реакция
(б) реакция разложения
(в) экзотермическая реакция
(г) реакция замещения.
2. Соединение, также известное как медный купорос,
3. Химическая формула извести:
4. Химическая формула гашеной извести:
5. Химическая формула нитрата свинца:
6. Пример реакции воды и негашеной извести. из
(a) комбинированная реакция
(b) экзотермическая реакция
(c) обе (a) и (b)
(d) ни одна из них.
7. Сколько молекул воды содержится в кристалле молекулы сульфата меди?
(а) 5
(б) 7
(в) 2
(г) 3.
8. Сколько молекул воды содержится в кристалле молекулы сульфата железа?
(a) 5
(b) 2
(c) 7
(d) 10.
9. Какая из следующих реакций является эндотермической?
10. Какого цвета FeSO 4 .7H 2 O?
(а) синий
(б) зеленый
(в) белый
(г) коричневый.
11. Какого цвета CuSO 4 .5H 2 O?
(а) синий
(б) зеленый
(в) белый
(г) желтый.
12. Четыре студента использовали различные способы сжигания магниевой ленты во время эксперимента, как показано ниже.
Учащийся выбрал правильный путь:
NCERT Класс 10 Руководство по научной лаборатории Вопросы, основанные на навыках наблюдения
13. Медную монету погружают в раствор сульфата меди синего цвета, цвет, полученный через полчаса,
(a) красноватый
(б) коричневатый
(в) бесцветный
(г) синий цвет.
14. Когда железный гвоздь выдерживают в синем растворе медного купороса, через некоторое время в пробирке с раствором появляется цвет
(а) синий
(б) коричневый
(в) зеленый
(г) красный.
15. При добавлении гранул цинка в свежеприготовленный раствор железного купороса студент наблюдает, что:
(а) образуется матово-коричневый налет
(б) образуется черный налет
(в) образуется сероватый налет
(d) покрытие не образуется.
16. Студент сильно нагревает гидратированную соль железного купороса в сухой пробирке. Он увидит a:
(a) желтый остаток
(b) коричневый остаток
(c) светло-зеленый остаток
(d) белый остаток
17. Студент при нагревании твердого нитрата свинца, взятого в пробирке, увидит:
(a) белый остаток PbO 2 901 31
(б) зеленый остаток NO 2
(в) желтый остаток PbO
(г) коричневый остаток NO.
18. Студент взял твердую негашеную известь в фарфоровой посуде и добавил немного воды. Он услышал:
(а) хлопающий звук
(б) треск
(в) шипящий звук
(г) никакого звука.
19. Цвет газа, выделяющегося при нагревании твердого азотнокислого свинца:
(а) желтый
(б) коричневый
(в) зеленовато-желтый
(г) зеленый.
20. Когда очищенный железный гвоздь помещают в раствор медного купороса, цвет раствора меняется на:
(а) синий
(б) красный
(в) бледно-фиолетовый
(г) бледно-зеленый.
21. При погружении гранул цинка в окрашенный в синий цвет раствор медного купороса цвет полученного раствора:
(a) голубой
(b) желтый
(c) бесцветный
(d) коричневый.
22. При реакции сульфата натрия и хлорида бария цвет образующегося осадка
(а) желтый
(б) зеленый
(в) белый
(г) черный.
23. Железный гвоздь погрузили в раствор соли. Через некоторое время было замечено красновато-коричневое отложение ногтя. Солевой раствор может быть
(a) Нитрат серебра
(b) Сульфат натрия
(c) Хлорид алюминия
(d) Сульфат меди
24. Цвет остатка, оставшегося в пробирке после нагревания сульфата железа, подвергающегося разложению:
(a) желтовато-коричневый
(б) черный
(в) белый
(г) серый.
25. При нагревании сульфата железа сильно назовите выделяющийся газ?
26. При нагревании железного купороса можно получить
(a) сладкий запах
(b) запах тухлых яиц
(c) раздражающий запах удушья
(d) ничего из вышеперечисленного
Руководство по научной лаборатории 10 класса Вопросы, основанные на навыках отчетности и интерпретации
27. При добавлении воды к извести получаем:
При добавлении воды к извести получаем:
900 03
28. При пропускании газа СО 2 через гашеную известь получаем
29. При сильном нагревании кристаллов железного купороса образуются продукты:
90 030 30. Металлический магний горит на воздухе ослепительно белым пламенем. Тип наблюдаемой химической реакции —
(а) реакция сочетания
(б) реакция разложения
(в) реакция замещения
(г) двойное разложение.
31. Реакция сульфата натрия и хлорида бария дает осадок, образующийся продукт, который дает ppt.
(a) хлорид натрия
(b) сульфат бария
(c) сульфид бария
(d) ничего из перечисленного.
Руководство по подсчету очков для научной лаборатории CBSE класса 10 с объяснением
1. (c) Известь представляет собой оксид кальция, который выделяет тепло при взаимодействии с водой.
2. (b) Кристаллы сульфата меди синего цвета.
(b) Кристаллы сульфата меди синего цвета.
3. (c) Известь представляет собой оксид кальция.
4. (a) Гашеная известь представляет собой гидроксид кальция.
5. (d) Валентность свинца равна 2, а нитрат-иона равна 1.
6. (c) Оксид кальция соединяется с водой с образованием гидроксида кальция, при этом выделяется тепло.
7. (a) Кристаллизационная вода постоянна для каждой соли.
8. (c) Кристаллизационная вода постоянна для каждой соли.
9. (a) Тепло используется для протекания реакции.
10. (b) Соли двухвалентного железа зеленого цвета.
11. (a) Соли меди синего цвета.
12. (c) Магниевая лента должна сжигаться непосредственно на горелке с помощью щипцов.
13. (d) Синий цвет остается тем же, что и медь, и раствор соли меди показывает равновесие.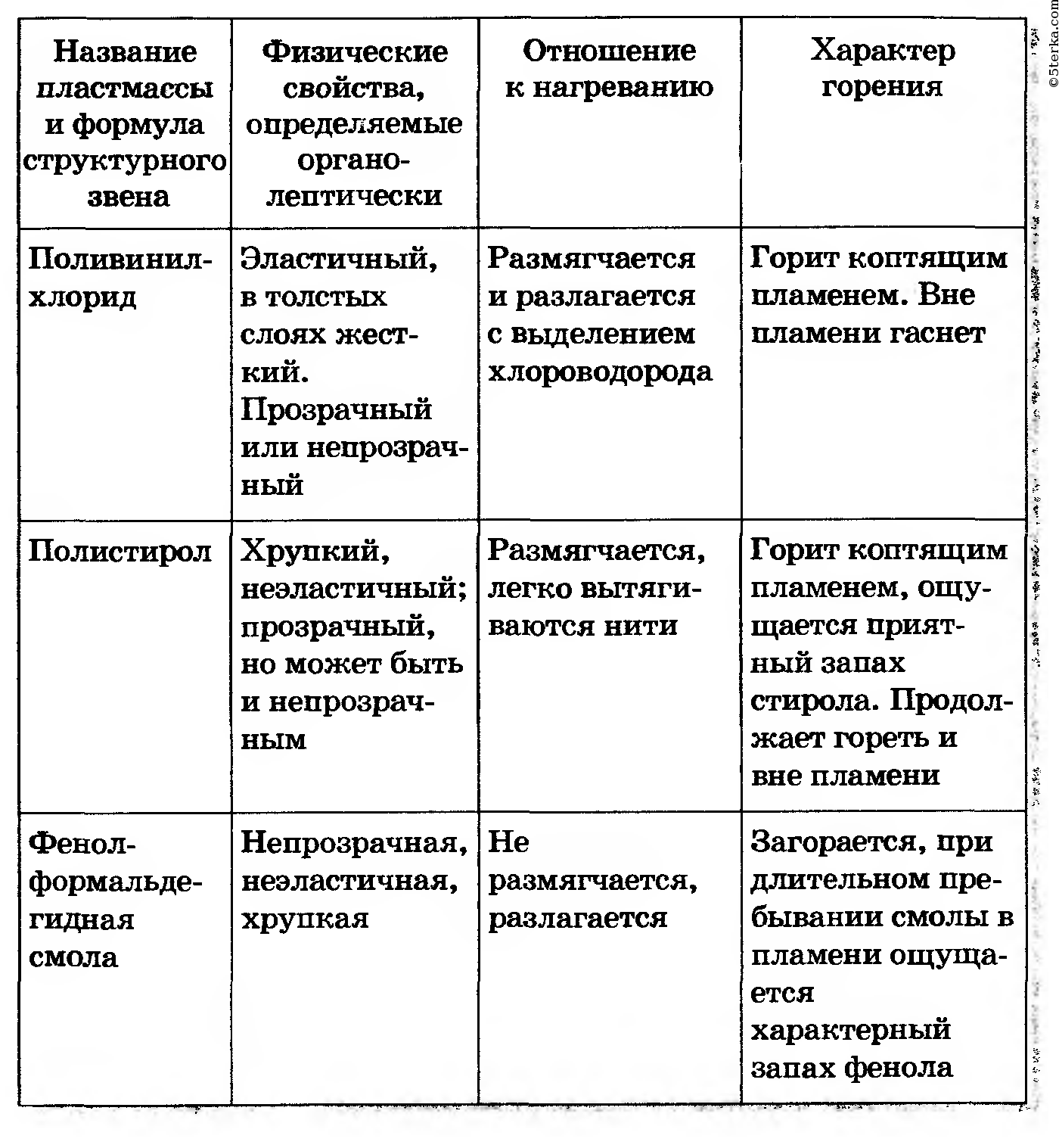
14. (c) Fe более реакционноспособно, чем Cu, и может вытеснять его.
15. (c) Цинк вытеснит Fe из своего раствора. Цвет Fe серовато-черный.
16. (b) Образуется FeO коричневого цвета.
17. (c) Нитрат свинца разлагается с образованием оксида свинца желтого цвета.
18. (b) Произошла сильно экзотермическая реакция.
19. (b) Выделяется газообразный диоксид азота коричневого цвета.
20. (d) Железо вытеснит Cu с образованием сульфата железа зеленого цвета.
21. (c) Цинк вытеснит Cu из раствора сульфата меди, а растворы солей цинка бесцветны.
22. (c) Сульфат бария представляет собой белый осадок.
23. (d) Солевой раствор должен представлять собой сульфат меди (CuSO 4 ). Железо вытесняет медь из своего солевого раствора, в результате чего на железный гвоздь осаждается красновато-коричневый слой меди.
24. (a) Образуется оксид железа коричневатого цвета.
25.
26. (c) Это реакция разложения, при которой выделяются SO 2 и SO 3 , которые вызывают удушье.
27. (a) Оксид кальция реагирует с водой с образованием гидроксида кальция.
28. (a) Гидроксид кальция реагирует с CO 2 с образованием карбоната кальция.
29. (d) Кристаллы сульфата железа разлагаются с образованием этих продуктов.
30. (a) Mg сгорает на воздухе, соединяется с кислородом и образует MgO.
31. (б) Видна двойная реакция смещения.
Мы надеемся, что это Руководство по типам реакций для научной лаборатории CBSE Class 10 поможет вам в подготовке к экзамену CBSE Class 10 Board Exam. По любым вопросам, касающимся материалов по типам реакций CBSE Class 10 Science Practices, не стесняйтесь оставлять вопросы в разделе комментариев.
Следите за последними обновлениями книг NCERT, решений NCERT, образцов документов CBSE, решений RS Aggarwal и всех ресурсов, которыми мы регулярно делимся на CBSETuts.com для студентов K12.
Дополнительные ресурсы CBSE Class 10 Lab Manual Практические навыки:
- CBSE Class 10 Science Типы реакций Практические навыки
- Лабораторное руководство по математике CBSE класса 1o
- Математические лаборатории CBSE класса 1o с заданием
- Руководство для научной лаборатории Класс 10 Типы реакций
NCERT Класс 10 Руководство для научной лаборатории Stomata
Содержание
- 1 NCERT Класс 10 Руководство для научной лаборатории – Stomata
- 1.1 NCERT Класс 10 Руководство для научной лаборатории Эксперимент – 1
- 1.2
- 1.4 Руководство по научной лаборатории NCERT 10 класса.0006 1.6
CBSE Класс 10 Руководство по биологии для лаборатории Stomata
Практические занятия по биологии для класса 10 CBSE 9 0003
Устьица Экспериментальный класс 10 Введение
- По всему телу растения присутствует эпидермис.
 Эпидермис состоит из одного слоя клеток. Эпидермис на надземных частях растений часто выделяет на своей наружной поверхности восковой, водоотталкивающий слой. Это предотвращает потерю воды, механическое повреждение и инвазию паразитирующих бактерий или грибков. Клетки эпидермиса образуют центральный слой без межклетников. Большинство этих клеток плоские, с более толстыми наружными и боковыми стенками и тонкой внутренней стенкой. В этом эпидермальном слое листьев мы можем видеть маленькие поры, называемые устьицами.
Эпидермис состоит из одного слоя клеток. Эпидермис на надземных частях растений часто выделяет на своей наружной поверхности восковой, водоотталкивающий слой. Это предотвращает потерю воды, механическое повреждение и инвазию паразитирующих бактерий или грибков. Клетки эпидермиса образуют центральный слой без межклетников. Большинство этих клеток плоские, с более толстыми наружными и боковыми стенками и тонкой внутренней стенкой. В этом эпидермальном слое листьев мы можем видеть маленькие поры, называемые устьицами. - Устьица представляют собой небольшие отверстия или отверстия, имеющиеся на поверхности листа в эпидермисе. На нижней стороне листа больше устьиц (единственное устьица).
NCERT Class 10 Science Solutions
Защитные клетки
- Устьица имеют небольшую пору, защищенную замыкающими клетками. Замыкающие клетки контролируют открытие и закрытие устьиц.
- Замыкающие клетки имеют бобовидную форму у двудольных и гантелевидную форму у однодольных.

- Внутренняя стенка защитной камеры толстая, а внешняя тонкая.
- Растениям необходимы такие газы, как кислород для дыхания и углекислый газ для фотосинтеза. Именно через это маленькое отверстие, называемое устьицей, газы диффундируют внутрь листа и всасываются внутрь.
Открытие и закрытие устьиц
- Во время фотосинтеза устьица открываются всякий раз, когда возникает потребность в углекислом газе, и открытие этих устьиц также вызывает потерю воды листьями в результате процесса, называемого транспирацией.
- Давление, возникающее в замыкающих клетках за счет воды в них, называется тургорным давлением. .
- Механизм открывания и закрывания замыкающих клеток зависит от набухания, которое они приобретают из-за воды.
- Замыкающие клетки поглощают воду и становятся набухшими, что приводит к открытию устьиц в течение дня.
- Ночью замыкающие клетки вялые, поэтому устьица закрываются. Но у некоторых пустынных растений устьица открываются только ночью, чтобы предотвратить потерю воды.

Распределение устьиц
- Устьица распределены по листьям, так что выделяемые листьями газы могут быстро диффундировать, это останавливает накопление выделяемых продуктов, что замедляет газообмен.
- На спинной стороне листа имеется больше устьичных пор, чем на брюшной.
- У пустынных растений устьица более вдавленные, чем у тропических растений.
- Распределение устьиц у растений отличается от вида к виду, обитающему в одном и том же регионе.
- У кактусов листья редуцированы до колючек, поэтому на стебле имеются устьица.
- У водных растений либо отсутствуют устьица, либо в корнях отсутствуют нефункционирующие устьица.
- Меньшее количество устьиц на верхней поверхности предотвращает чрезмерную потерю воды из-за транспирации, так как эта поверхность подвергается прямому воздействию солнечных лучей.
NCERT Класс 10. Руководство для научной лаборатории. Эксперимент – 1
Цель
Подготовить временный препарат кожуры листьев для демонстрации устьиц.
Теория
- Растениям нужен кислород для дыхания и углекислый газ для фотосинтеза. Обмен газов у растений происходит через поверхность стеблей, корней и листьев.
- На листьях имеется множество мелких крошечных пор, называемых устьицами.
- На дорсальной стороне листа имеется больше устьичных пор, чем на вентральной стороне листа.
- Через эти поры растения также могут терять воду в процессе, называемом транспирацией.
- Чтобы избежать чрезмерной потери воды, поры устьиц закрываются, а когда требуются газы, эти поры открываются.
- Открытие и закрытие пор контролируется замыкающими клетками.
- Замыкающие клетки набухают, когда в них попадает вода, в результате чего устьица открываются. Когда замыкающие клетки сокращаются, поры устьиц закрываются.
- Замыкающие клетки содержат хлоропласт и ядро. Они имеют бобовидную форму у двудольных и гантелевидную форму у однодольных.
Необходимые материалы
Свежесорванный лист рео или традесканции, чашка Петри, предметное стекло, покровное стекло, игла, щипцы, кисточка, пипетка, часовое стекло, фильтровальная бумага, глицерин, раствор сафранина и микроскоп.
Процедура
- Возьмите свежесорванный лист (Rheo или Tradescantia).
- Растяните лист спинной (нижней) частью вверх.
- Разломайте лист, применяя соответствующее давление, чтобы эпидермис выступал из листа.
- Срежьте эпидермис и поместите его в чашку Петри.
- Возьмите часовое стекло, добавьте в него несколько капель воды и каплю морилки.
- С помощью ершика перенесите небольшой кусочек эпидермиса из чашки Петри в часовое стекло.
- Оставьте кожуру в пятне на 2-3 минуты, чтобы она смогла впитать пятно.
- С помощью кисточки перенесите окрашенную кожуру в чашку Петри с водой, чтобы удалить лишнее пятно.
- Теперь возьмите чистое предметное стекло и поместите его на фильтровальную бумагу. В центр предметного стекла нанесите каплю глицерина и перенесите окрашенную кожуру с чашки Петри на предметное стекло.
- Аккуратно удерживайте покровное стекло иглой и поместите его на кожуру.
 Избегайте образования пузырьков воздуха.
Избегайте образования пузырьков воздуха. - Используйте фильтровальную бумагу, чтобы удалить излишки красителя, воды или глицерина, выступившие со сторон покровного стекла.
- Убедитесь, что предметное стекло чистое, и поместите его под микроскоп. Сначала просмотрите его при малом увеличении (10X), а затем при высоком увеличении (45X).
- Запишите свои наблюдения.
Наблюдения
- В эпидермальной корке мы видим один слой клеток.
- В промежутках между слоями эпидермиса видны мелкие пятна.
- При фокусировке под мощным микроскопом хорошо видны поры устьиц.
- Каждая пора устьица имеет две почковидные клетки, называемые замыкающими клетками.
- Каждая замыкающая клетка имеет одно ядро и множество хлоропластов.
Заключение
Эпидермальный слой кожуры листьев имеет множество устьичных пор. У двудольных растений каждая устьичная пора имеет две замыкающие клетки почковидной формы. Каждая замыкающая клетка имеет одно ядро и множество хлоропластов.
Каждая замыкающая клетка имеет одно ядро и множество хлоропластов.
Меры предосторожности
- При удалении кожуры эпидермиса убедитесь, что вы выщипываете более тонкий кусочек листа.
- Не перекрашивать кожуру.
- Избегайте образования пузырьков воздуха при помещении покровного стекла.
- Кожура не должна быть складчатой.
- Предметное стекло должно быть чистым и сухим перед помещением его под микроскоп.
NCERT Класс 10 Руководство научной лаборатории Viva Voce
Вопрос 1:
Что контролирует открытие и закрытие устьиц?
Ответ:
Замыкающие клетки контролируют открытие и закрытие устьиц.
Вопрос 2:
Когда закрывается пора?
Ответ:
При сокращении замыкающих клеток устьичная пора закрывается.
Вопрос 3:
Что влияет на открытие устьиц?
Ответ:
Солнечный свет и набухание замыкающих клеток.
Вопрос 4:
Назовите слой ткани, в котором видны устьица.
Ответ:
Это эпидермальная ткань, в которой присутствуют устьица.
Вопрос 5:
Назовите краситель, используемый для подготовки предметного стекла для устьиц.
Ответ:
Раствор сафранина
NCERT Класс 10 Руководство по научной лаборатории Практические вопросы
Вопрос 1:
Где вы найдете больше устьиц?
Ответ:
Устьица есть на листьях и стебле, но больше устьиц на нижней стороне листа.
Вопрос 2:
Какое значение имеют устьица для листа?
Ответ:
Устьица помогают растениям в обмене газов, таких как кислород и углекислый газ. Он также удаляет лишнюю воду из листьев путем транспирации.
Вопрос 3:
Как замыкающие клетки помогают открывать устьица?
Ответ:
Замыкающие клетки — бобовидные клетки, которые при набухании открывают поры.
Вопрос 4:
Пустынные растения не могут позволить себе терять воду через устьица. Как они обмениваются газами?
Ответ:
У пустынных растений устьица вдавленные, газообмен происходит ночью. У некоторых пустынных растений листья приспособлены к шипам.
Вопрос 5:
Что вы обнаружите, если сфокусируете предметное стекло устьиц под мощным объективом микроскопа?
Ответ:
Под объективом с большим увеличением видны устьица, окруженные замыкающими клетками. Каждая замыкающая клетка имеет ядро и хлоропласт.
NCERT Класс 10 Руководство по научной лаборатории Вопросы
Вопрос 1:
Какова функция замыкающих клеток в устьицах?
Ответ:
Защитные клетки контролируют открытие и закрытие пор в устьицах.
Вопрос 2:
Почему количество устьиц больше на нижней поверхности листа?
Ответ:
Для поддержания количества воды в клетках листа и регулирования скорости транспирации нижняя поверхность листа имеет больше устьиц, чем верхняя поверхность листа.
Вопрос 3:
Почему у корней отсутствуют устьица?
Ответ:
Роль устьиц заключается в газообмене при фотосинтезе и дыхании, а также в транспирации. Корни помогают поглощать воду, поэтому устьица на корнях не требуются.
Вопрос 4:
Какова форма замыкающих клеток в устьице листа травы?
Ответ:
Лист травы с гантелевидными устьицами.
Вопрос 5:
Имеют ли замыкающие клетки жесткие или эластичные стенки? Обосновать ответ.
Ответ:
Защитные клетки имеют эластичные стенки. Именно эластичные стенки замыкающих клеток меняют свою форму, открывая или закрывая устьица. Когда замыкающие клетки набухшие, поры открываются из-за образования вогнутой формы замыкающих клеток.
Руководство по научной лаборатории NCERT 10 Вопросы с множественным выбором (MCQ)
Вопросы, основанные на процедурных и манипулятивных навыках
Вопрос 1:
Устьичные отверстия видны в однослойных тканях
(а) ткани эпидермиса
(б) ткани склеренхимы
(в) ткани паренхимы
(г) ткани колленхимы.
Вопрос 2:
Краситель, используемый для приготовления устьичных препаратов:
(a) метиленовый синий
(b) сафранин
(c) ацетокармин
(d) хлопковый синий.
Вопрос 3:
При подготовке устьичного препарата глицерин используется для
(а) предотвратить образование пузырьков воздуха
(б) избежать высыхания кожуры
(в) окрасить кожуру
(г) сделать ее видимой
Вопрос 4:
7 (б) свежесорванный лист.
(в) высушенный и законсервированный лист
(г) лист, сорванный за несколько часов до монтажа.
Вопрос 5:
Открытие и закрытие устьиц контролируется
(a) транспирацией
(б) набухание клеток
(в) интенсивность света
(г) все перечисленное.
Вопрос 6:
Чтобы удалить остатки пятен, воды или глицерина, скопившиеся на предметном стекле, используйте правильный метод
(a) промойте боковые стороны предметного стекла
(b) очистите предметное стекло носовым платком
(c) соберите его ватными тампонами
(d) используйте фильтровальную/ промокательную бумагу для очистки .
Вопрос 7:
Учащегося попросили изготовить из листа временный препарат устьиц. Он должен выбрать:
(а) кончик листа
(б) средняя жилка листа
(в) эпидермис стебля
(г) нижний эпидермис.
Вопрос 8:
Для приготовления временного препарата из кожуры листьев для наблюдения за устьицами химические вещества, используемые для окрашивания и заливки, соответственно:
(a) сафранин и йод
(b) сафранин и глицерин
(c) йод и сафранин
(d ) глицерин и йод.
Вопрос 9:
Какой из следующих методов является правильным для получения листовой кожуры для наблюдения за устьицами?
(a) Разломайте лист и сорвите кожуру.
(b) Возьмите лист и лезвием сделайте тонкие срезы.
(c) С помощью иглы и пинцета оторвите тонкий слой листа.
(d) Разломайте лист и удалите выступы эпидермального слоя.
Вопрос 10:
При изготовлении предметного стекла эпидермальной кожуры листа используются следующие этапы:
I Снимите тонкую кожуру с нижней поверхности листа.
II Нанесите на предметное стекло каплю глицерина.
III Окрасьте кожуру сафранином.
IV Поместите окрашенную кожуру на глицерин.
V Удалите излишки пятна, промыв водой. VI Поместите покровное стекло на кожуру.
Какая последовательность действий является правильной?
(а) I, II, III, IV, V, VI
(б) I, III, V, II, IV, VI
(в) I, III, IV, II, V, VI
(г) I, II, IV, III, V, VI.
Вопрос 11:
Студент сфокусировал эпидермальную кожуру листа под микроскопом с малым увеличением, но не смог разглядеть части. он должен
(a) снова используйте ручку грубой настройки, чтобы сфокусировать слайд.
(b) используйте ручку точной настройки для увеличения увеличения.
(c) фокусировка при высоком увеличении с помощью ручки грубой настройки.
(d) фокусировка при высоком увеличении с помощью ручки точной настройки.
Вопрос 12:
Ниже приведены этапы подготовки временного препарата из окрашенной кожуры листьев.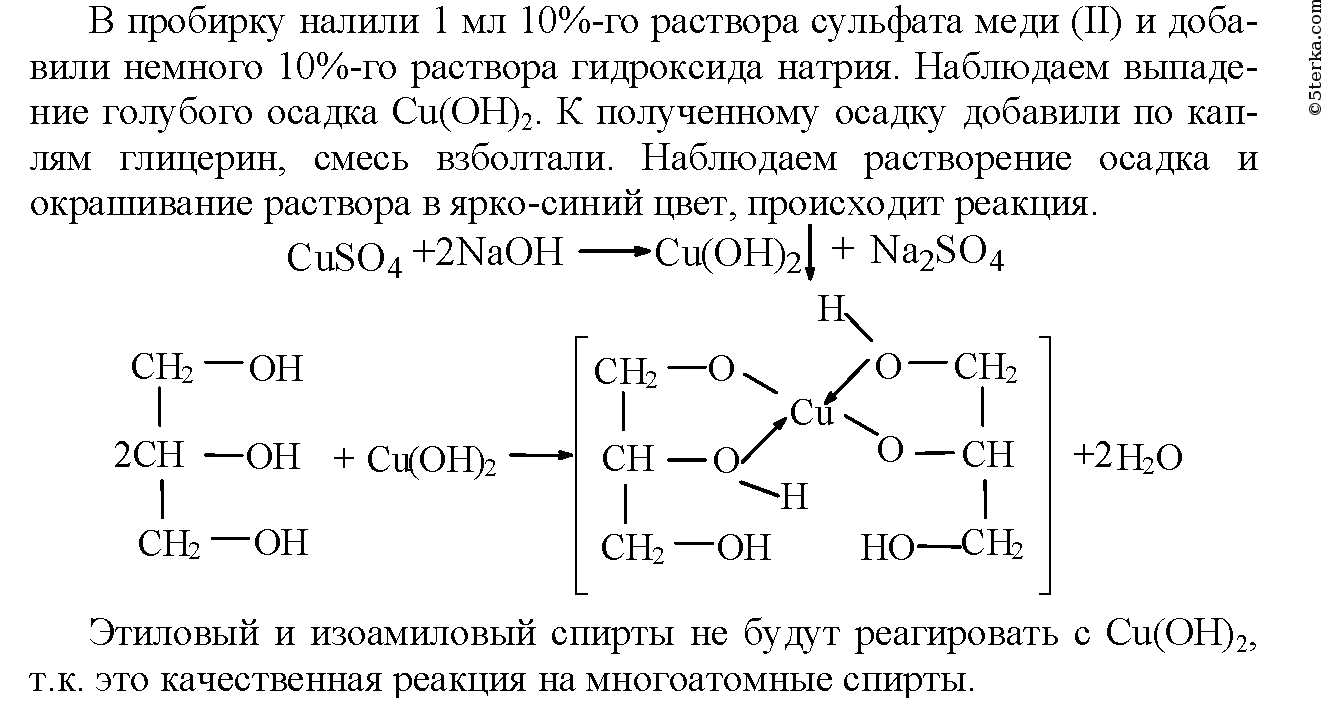
(i) Накройте материал покровным стеклом.
(ii) Перенесите окрашенную кожуру на чистое предметное стекло и добавьте каплю глицерина.
(iii) Снимите кожуру с нижней поверхности листа,
(iv) Поместите его в чашку Петри с водой и добавьте каплю красителя сафранина.
Правильная последовательность шагов:
(a) (iii), (iv), (ii), (i)
(b) (i), (if), (iii), (iv)
(c) (ii), (iii), (iv), (i)
(d) (iii), (iv), (i), (ii).
Вопросы, основанные на навыках наблюдения
Вопрос 13:
На приведенном ниже рисунке устьиц правильным обозначением для A и B является
(а) А – ядро, Б – замыкающие клетки
(б) А – замыкающие клетки, Б – ядро
(в) А – хлоропласт, Б – ядро
(г) А – хлоропласт, Б – замыкающая клетка. .
Вопрос 14:
Под микроскопом был виден временный препарат устьиц, который имел розовый цвет. Используемый краситель:
(а) йод
(б) ацетокармин
(в) фенолфталеин
(г) сафранин.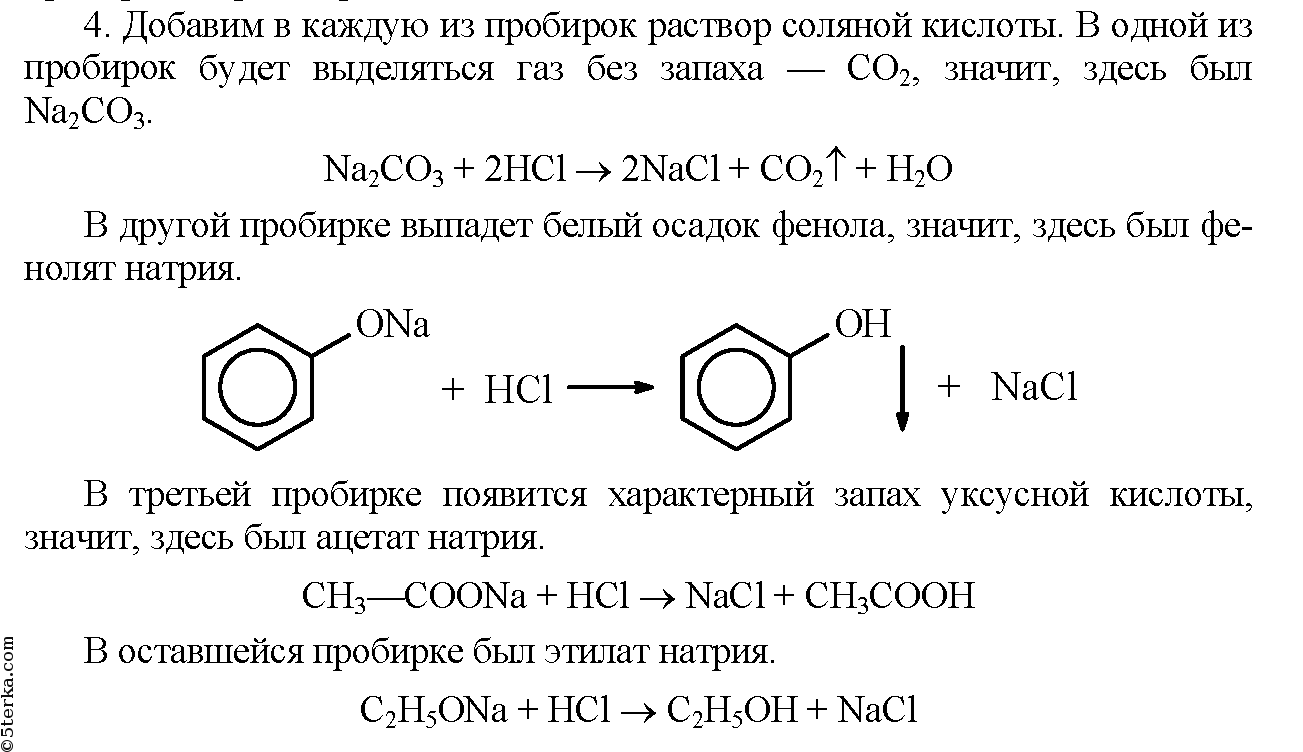
Вопрос 15:
Хорошо окрашенный препарат кожуры листьев при наблюдении под большим увеличением микроскопа показывает ядра в
(a) эпидермальные клетки
(b) замыкающие клетки
(c) обе замыкающие клетки и эпидермальные клетки
(d) ни один из них.
Вопрос 16:
Хорошо окрашенный препарат кожуры листьев, сфокусированный под большим увеличением микроскопа, покажет
(а) эпидермальные клетки, устьица, замыкающие клетки, каждая из которых имеет одно ядро и множество хлоропластов.
(б) клетки эпидермиса, устьица, замыкающие клетки со многими ядрами и одним хлоропластом.
(в) устьица и замыкающие клетки без ядер и хлоропластов.
(d) устьица, но без замыкающих или эпидермальных клеток.
Вопрос 17:
На приведенной ниже схеме устьичной поры маркировка, соответствующая хлоропласту:
(а) А
(б) В
(в) С
(г) D
9003 0 Вопрос 18:
В зарисовке устьичного аппарата чего из перечисленного не хватает:
(а) клеточной оболочки клеток
(б) клеточной стенки клеток
(в) ядер замыкающих клеток
(г) хлоропласта в замыкающих клетках.
Вопросы, основанные на навыках сообщения и интерпретации
Вопрос 19:
При использовании объектива микроскопа с большим увеличением на эпидермальном листе видны:
(a) устьица, окружающие множество замыкающих клеток
(b) устьица, окруженные парой замыкающие клетки
(в) устьица окружены несколькими эпидермальными клетками
(г) устьица окружены несколькими замыкающими клетками.
Вопрос 20:
Четыре ученика A, B, C и D, сделайте следующие записи, приведенные ниже, для частей, отмеченных X и Y на этой диаграмме.
| Студент | Х | Д |
| А | Стома | Ядро |
| Б | Ядро | Стома |
| С | Эпидермальная клетка | Стома |
| Д | Клеточная стенка | Эпидермальная клетка |
Правильная запись, это запись студента
(a) A
(b) B
(c) C
(d) D
Вопрос 21:
Четверо студентов, которые составили схему и составили таблицы, пометили предметное стекло с устьицей следующим образом:
Учащийся, который сделал правильную маркировку:
(a) Учащийся A
(b) Студент B
(c) Студент C
(d) Студент D.
Вопрос 22:
На следующем рисунке устьичного аппарата части I, II, III и IV были по-разному обозначены четырьмя студентами
Правильная маркировка из следующих: 90 087 (а) (I) замыкающая клетка, (II) устьица, (III) крахмальные гранулы, (IV) ядро
(б) (I) хлоропласт, (II) ядро, (III) устьица, (IV) замыкающая клетка
(в) (I) замыкающая клетка, (II) крахмал, (III) ядро, (IV) устьица
(г) (I) цитоплазма, (II) хлоропласт, ( III) устьица, (IV) ядро.
Вопрос 23:
Правильные обозначения для данной диаграммы соответственно
(а) устьица, замыкающая клетка, ядро
(б) устьица, хлоропласт, эпидермальная клетка
(в) устьица, ядро, замыкающая клетка
(г) устьица , замыкающая клетка, эпидермальная клетка.
Вопрос 24:
Учащийся рисует следующий рисунок устьичного аппарата:
Хлоропласт и ядро обозначены цифрами
(а) 5 и 3 соответственно
(б) 4 и 3 соответственно
(в) 3 и 5 соответственно
(г) 4 и 5 соответственно.
Вопрос 25:
Правильная последовательность из следующих вариантов для фокусировки предметного стекла эпидермальной кожуры листа под микроскопом для демонстрации устьичной поры:
I. Наблюдать при малом увеличении.
II. Отрегулируйте зеркало, чтобы получить максимальный свет.
III. Поместите слайд на сцену.
IV. Сосредоточьтесь под высокой мощностью.
(а) II, III, I, IV
(б) I, II, III, IV
(в) III, II, IV, I
(г) III, II, I, IV
Ответы:
Руководство по подсчету баллов научной лаборатории 10 класса NCERT с объяснением
- (a) Устьица присутствуют в эпидермальном слое.
- (b) Сафранин используется для изготовления предметных стекол растений.
- (b) Глицерин обладает свойством удерживать воду.
- (b) Свежий лист дает лучшее крепление.
- (d) Все факторы отвечают за открытие и закрытие устьиц.
- (d) Фильтровальная бумага помогает поглощать лишнюю жидкость рядом с покровным стеклом на предметном стекле.

- (d) На нижней эпидерме листа больше устьиц.
- (b) Красители сафранина и глицерин предотвращают высыхание препарата.
- (d) Этим методом лучше всего получается однослойный эпидермис.
- (b) Это правильная процедура для создания временной горки.
- (a) Правильная регулировка фокуса может правильно сфокусировать слайд.
- (a) Это правильная процедура для создания временной горки.
- (d) Замыкающие клетки имеют бобовидную форму и образуют поры, а в клетке присутствует хлоропласт.
- (d) Окраска сафранином розового цвета.
- (c) Обе клетки имеют ядро.
- (а) При большом увеличении клетки и их компоненты видны четко.
- (d) Хлоропласты присутствуют в клетке в большом количестве.
- (c) замыкающие клетки с выступающим ядром.
- (б) При большом увеличении отчетливо видны замыкающие клетки.
- (а) Пора устьица и ядро присутствует в клетке.
- (б) Ядро находится в клетке, пора образована замыкающими клетками, слой — эпидермис.


 Руководство для научной лаборатории. 006 2 NCERT Класс 10 Руководство по научной лаборатории Viva Voce
Руководство для научной лаборатории. 006 2 NCERT Класс 10 Руководство по научной лаборатории Viva Voce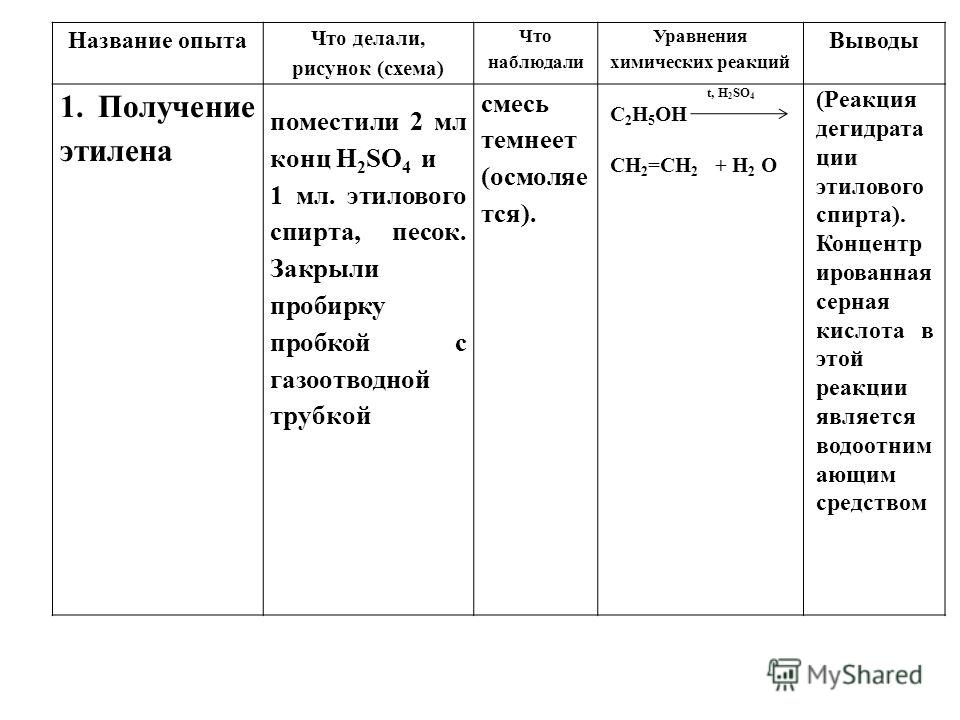
 Эпидермис состоит из одного слоя клеток. Эпидермис на надземных частях растений часто выделяет на своей наружной поверхности восковой, водоотталкивающий слой. Это предотвращает потерю воды, механическое повреждение и инвазию паразитирующих бактерий или грибков. Клетки эпидермиса образуют центральный слой без межклетников. Большинство этих клеток плоские, с более толстыми наружными и боковыми стенками и тонкой внутренней стенкой. В этом эпидермальном слое листьев мы можем видеть маленькие поры, называемые устьицами.
Эпидермис состоит из одного слоя клеток. Эпидермис на надземных частях растений часто выделяет на своей наружной поверхности восковой, водоотталкивающий слой. Это предотвращает потерю воды, механическое повреждение и инвазию паразитирующих бактерий или грибков. Клетки эпидермиса образуют центральный слой без межклетников. Большинство этих клеток плоские, с более толстыми наружными и боковыми стенками и тонкой внутренней стенкой. В этом эпидермальном слое листьев мы можем видеть маленькие поры, называемые устьицами.

 Избегайте образования пузырьков воздуха.
Избегайте образования пузырьков воздуха.
