Ответы | Лаб. 2. Изучение изобарного процесса — Физика, 10 класс
8. Вычислите средние значения <l1>, <T1>, <l2>, <Т2>. Запишите их в последней строке таблицы
- <l1> = (150 + 150)/2 = 150 мм,
- <T1> = (291 + 292)/2 = 291,5 K,
- <l2> = (80 + 85)/2 = 82.5 мм,
- <Т2> = (351 + 341)/2 = 346 K.
9.
 Вычислите отношения, результаты вычислении занесите в последнюю строку таблицы
Вычислите отношения, результаты вычислении занесите в последнюю строку таблицы
- <T1>/<T2> = 291,5/346 = 0,84,
- <l1>/<l2> = 150/142,5 = 1,05.
10. Вычислите относительную погрешность проделанного эксперимента. Результаты данных вычислений занесите в таблицу
ε = | 291,5/346 : 150/142,5 — 1 | · 100% = | 0,8 -1 | · 100% = 20%.
| № | Измерено | Вычислено | |||||
| l1 | T1 | l2 | T2 | T1/T2 | l1/l2 | ε | |
| 1 | 150 | 291 | 140 | 351 | — | — | — |
| 2 | 150 | 292 | 145 | 341 | — | — | — |
| Сред. | 150 | 291.5 | 142.5 | 346 | 0.84 | 1.05 | 20 |
11. Ответы на контрольные вопросы
1. Почему необходимо выдерживать стеклянную трубку в горячей воде в течение 3—5 минут?
Почему необходимо выдерживать стеклянную трубку в горячей воде в течение 3—5 минут?
Чтобы трубка успела остыть, потому что после остывания объём трубки уменьшается, т.к. вода давит на трубку с такой же силой, какой действует атмосферное давление на воду.
2. Почему после погружения стеклянной трубки в сосуд с водой комнатной температуры и после снятия пластилина вода по трубке поднимается вверх?
Атмосферное давление совместно с давлением воды на глубине нижнего конца трубки больше начального давления в трубке. Разница давлений заполняет трубку водой и тем самым сжимает воздух в трубке, пока не сравняются давление в трубке и атмосферное давление + давление воды на глубине уровня воды в трубке.
3. Почему при одинаковых уровнях воды в сосуде и стеклянной трубке давление воздуха в трубке равно атмосферному?
При одинаковом уровне воды их вклад в давление будет тоже одинаковым. Давления равны по причине того, что со стороны трубки давит только имеющийся там воздух, на воду же в сосуде давит атмосфера.
Изучение изобарного процесса
Лабораторная работа №Тема: Изучение изобарного процесса.
Цель работы: проверка соотношения между изменением объема и температуры определенного количества газа при его изобарном охлаждении.
Оборудование:
- прозрачная трубка с двумя кранами на концах;
- лабораторный термометр;
- измерительная лента;
- внешний стакан калориметра;
- сосуд с теплой водой;
- сосуд с холодной водой.

Теоретическая часть
В соответствии с законом Гей-Люссака соотношение имеет вид: V1/T1 = V2/T2, где V1 и V2 — объемы, занимаемые данной массой газа соответственно до и после охлаждения, а T1 и T2 — его температуры.
Исследуемым газом в данной работе является воздух, находящийся внутри прозрачной трубки. Для изоляции внутренней полости трубки от внешней среды на концах закреплены специальные краны.
Измерения объема и температуры теплого и холодного воздуха внутри трубки проводят в следующем порядке.
Трубку плотно, виток к витку, укладывают внутрь стакана калориметра. Кран, который расположится при этом вблизи дна, предварительно закрывают. Верхний кран оставляют открытым. Затем в калориметр наливают нагретую до 55 — 60 0С воду. Воду заливают так, чтобы открытый кран оказался бы погруженным в нее не более чем на 5-10 мм. По мере прогрева объем воздуха в трубке будет возрастать и из открытого крана станут выходить пузырьки. В момент, когда температура воздуха сравняется с температурой теплой воды, выделение пузырьков прекратится. Это состояние воздуха в трубке принимают за исходное. Температуру воздуха в исходном состоянии T1 можно определить, если измерить температуру воды в стакане. Его объем V1 равен объему внутренней полости трубки.
По мере прогрева объем воздуха в трубке будет возрастать и из открытого крана станут выходить пузырьки. В момент, когда температура воздуха сравняется с температурой теплой воды, выделение пузырьков прекратится. Это состояние воздуха в трубке принимают за исходное. Температуру воздуха в исходном состоянии T1 можно определить, если измерить температуру воды в стакане. Его объем V1 равен объему внутренней полости трубки.
После измерения температуры теплой воды воздух переводят в состояние с другими параметрами. Для этого закрывают кран, теплую воду сливают и заполняют стакан холодной водой, следя за тем , чтобы ее уровень над верхним краном оказался таким же, как в первой части опыта. После этого кран опять открывают. При охлаждении объем воздуха уменьшится , и через открытый кран в трубку поступит некоторое количество воды. Когда температуры воды и воздуха опять станут одинаковыми (через 1-2 минуты), приступают к определению параметров газа в новом состоянии.
Температуру воздуха вновь определяют по температуре воды. Чтобы определить его объем после охлаждения, закрывают верхний кран, трубку извлекают из калориметра и, удерживая вертикально, резко встряхивают несколько раз. При этом капли воды, попавшие внутрь, сольются и образуют неразрывный столбик. Измерив объем этого водяного столба и вычтя его из внутреннего объема трубки, узнают объем воздуха в конечном состоянии.
Измерение объемов в этой работе удобно проводить в условных единицах по длине ВОЗДУШНОГО или водяного столба: внутренняя полость трубки имеет форму цилиндра и ее объем V = Sl, но площадь поперечного сечения S в ходе опыта не меняется, и , чтобы не измерять эту величину, которая после подстановки в равенство (1) все равно сократится, объем выражают в единицах длины (см. рисунки).
Давление воздуха в трубке в первой и второй части опыта равнялось сумме атмосферного давления и давления небольшого столба воды над открытым краном. Поскольку уровень теплой и холодной воды не менялся, то эта сумма в ходе опыта не менялась, а значит и давление воздуха в трубке при его охлаждении оставалось постоянным, то есть процесс протекал изобарически.
Поскольку уровень теплой и холодной воды не менялся, то эта сумма в ходе опыта не менялась, а значит и давление воздуха в трубке при его охлаждении оставалось постоянным, то есть процесс протекал изобарически.
В завершении работы сравнивают отношения объема воздуха к его температуре до и после охлаждения.
Указания к работе
1. Подготовьте таблицу для записи результатов измерений и вычислений:
| l1, см | t1, 0С | T1, 0К | Δl, см | l2, см | t2, 0С | T2, 0К | l1/T1 | l2/T2 |
| значение |
2.
3. Закройте один кран и уложите трубку виток к витку в стакан калориметра. Кран на верхнем конце оставьте открытым.
4. Заполните стакан теплой водой и поместите в него термометр.
5. Наблюдайте за выделением пузырьков воздуха из открытого крана. Как только оно прекратится, определите и запишите показание термометра — t1, 0С.
6. Закройте кран, слейте теплую воду, заполните стакан холодной водой до прежнего уровня и снова откройте кран.
7. Выждав полторы — две минуты, определите и запишите показание термометра — t2, 0С.
8. Закройте кран, слейте воду, извлеките шланг из стакана, встряхните его и измерьте длину столба воды в нем — Δl (рисунок).
9. Вычислите длину столба охлажденного воздуха: l2 = l1 — Δl.
10. Переведите записанные показания термометра в градусы Кельвина: Т = t + 273°.
11. Вычислите отношения l1/T1 и l2/T2 и сделайте вывод о том, насколько точно изменение параметров газа в проделанном опыте соответствует закону Гей-Люссака.
12. Укажите причины, повлиявшие на точность полученных результатов.
Контрольные вопросы
- Почему процесс охлаждения воздуха в данной работе можно считать изобарным?
- Какие условия должны выполняться, чтобы, определяя параметры газа, можно было воспользоваться законом Гей-Люссака?
Если заметили ошибку, выделите фрагмент текста и нажмите Ctrl+Enter
Лабораторная работа Изопроцессы в газах.
Лабораторная работа № 5
Тема: Исследование изопроцессов в газах.
Цель работы: на опыте проверить изотермический, изохорический и изобарного процессов в газах.
Оборудование: пластиковый сосуд, Медицинский манометр, шприц, зажимы, тройник, трубка ПВХ, термометр, барометр, стакан.
Теория: Газовые законы.
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа. Всякое изменение состояния газа называется термодинамическим процессом. Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами. Изопроцессы являются идеализированной моделью реального процесса в газе.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Изобарный процесс (p =const)
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени.
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме. Изохорный процесс в идеальном газе подчиняется закону Шарля:
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Схема установки
Указание к работе:
1.Изучение изотермического процесса
Открыть зажимы 1,2 и вывести поршень шприца в положение полного объема(10 мл). В этом случае воздух в сосуде сообщается с атмосферой, его температура и давление равны атмосферному.
Зафиксировать по барометру анероиду в кабинете атмосферное давление, а по показаниям термометра температуру воздуха.
Закрыть зажим 2 и, постепенно вводя поршень, зафиксировать показания приборов, занося их в таблицу
После определения объема воздуха и его давления в каждом опыте рассчитайте их произведения.
№ опыта | Объем воздуха в системе, V,мл | Давление в сосуде Р=ратм+рманом | Произведение давления воздуха на его объем, рV |
1 | 50+10 | ||
2 | 50+7 | ||
3 | 50+5 | ||
4 | 50+3 |
Сравните результаты расчетов и сделайте вывод о выполнении закона Бойля-Мариотта
2. Изучение изобарного процесса
Изучение изобарного процесса
Открыть зажимы 1,2 установить поршень на делении 2мл, и закрыть зажим 2. Плавным перемещением поршня установить на манометре давление , например 30 мм.рт.ст.
Измерьте температуру окружающей среды и объем воздуха в замкнутой системе, заполните таблицу:
№опыта | Давление Р=ратм+рманом | Объем воздуха в системе, V,мл | Абсолютная температура, Т |
1 | |||
2 |
Поместите в стакан с горячей водой сосуд и термометр, снять показание термометра когда воздух в сосуде достаточно прогреется. Следить за показанием манометра, что бы показания оставались постоянными (регулируя штоком шприца).
По данным таблицы сделайте расчеты и убедитесь в справедливости закона Гей-Люссака.
3. Изучение изохорного процесса
Выжать воздух из шприца и пережать трубку зажимом 1. Убедится в нулевых показаниях монометра, пережать трубку зажимом 2.
Измерить температуру окружающей среды, а барометром атмосферное давление.
№опыта | Объем, мл | Давление | Температура, Т |
1 | |||
2 |
Поместить в стакан с горячей водой сосуд и термометр. Снять показания термометра и манометра после прогрева воздуха в сосуде, занести результаты в таблицу.
По данным таблицы и расчетам, проделанным по формуле, убедитесь в справедливости закона Шарля
«Опытная проверка закона Гей-Люссака»
Цель работы: Экспериментальным путем проверить верность закона Гей-Люссака Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. = сот1 при р = сот1. Следовательно, объем газа линейно зависит от температуры при постоянном давлении: V = сот1.Т. Чтобы проверить закон Гей-Люссака, необходимо измерить объем и температуру газа в двух состояниях при постоянном давлении и проверить верность равенства: . Это можно осуществить, используя воздух при атмосферном давлении. Первое состояние: стеклянная трубка открытым концом вверх помещается на 3-5 мин в цилиндрический сосуд с горячей водой (рис. а). В этом случае объем воздуха У1 равен объему стеклянной трубки, а температура — температуре горячей воды Т1. Чтобы при переходе воздуха в следующее состояние его количество не изменилось, открытый конец стеклянной трубки, находящейся в горячей воде, замазывают пластилином. После следует вынуть трубку из сосуда с горячей водой и замазанный конец быстро опускают в стакан с водой комнатной температуры (рис. б). Затем прямо под водой снимают пластилин. По мере охлаждения воздуха в трубке вода в ней будет подниматься.
= сот1 при р = сот1. Следовательно, объем газа линейно зависит от температуры при постоянном давлении: V = сот1.Т. Чтобы проверить закон Гей-Люссака, необходимо измерить объем и температуру газа в двух состояниях при постоянном давлении и проверить верность равенства: . Это можно осуществить, используя воздух при атмосферном давлении. Первое состояние: стеклянная трубка открытым концом вверх помещается на 3-5 мин в цилиндрический сосуд с горячей водой (рис. а). В этом случае объем воздуха У1 равен объему стеклянной трубки, а температура — температуре горячей воды Т1. Чтобы при переходе воздуха в следующее состояние его количество не изменилось, открытый конец стеклянной трубки, находящейся в горячей воде, замазывают пластилином. После следует вынуть трубку из сосуда с горячей водой и замазанный конец быстро опускают в стакан с водой комнатной температуры (рис. б). Затем прямо под водой снимают пластилин. По мере охлаждения воздуха в трубке вода в ней будет подниматься. После прекращения подъема воды в трубке (рис. в) объем воздуха будет У2<У1 давление р = ратм — рдП. Чтобы давление воздуха стало равным атмосферному надо погружать трубку в стакан до тех пор, пока уровень воды в трубке и стакане не выровняются (рис. г). Это второе состояние при Т2 окружающего воздуха. Отношение объемов необходимо заменить отношением высот воздушных столбов в трубке, если
После прекращения подъема воды в трубке (рис. в) объем воздуха будет У2<У1 давление р = ратм — рдП. Чтобы давление воздуха стало равным атмосферному надо погружать трубку в стакан до тех пор, пока уровень воды в трубке и стакане не выровняются (рис. г). Это второе состояние при Т2 окружающего воздуха. Отношение объемов необходимо заменить отношением высот воздушных столбов в трубке, если
сечение постоянно по всей длине В работе
следует сравнить
Необходимые инструменты для
измерения: линейка, термометр.
Используя ученическую линейку мы делаем замер длины 11 и 12 . С помощью термометра мы замеряем температуру окружающего воздуха Т2. Для дальнейшего заполнения таблицы проведем следующие вычисления: 1) А01 — абсолютная погрешность отсчета А01 = 0,5. 2) Максимальная абсолютная погрешность находится по формуле: А1 = А и I+ А 01 = 1 + 0,5 = 1,5. 3) Т, = 273 + I, = 273 + 60= 333.
Относительная погрешность
Вывод: Исходя из проведенных выше опытов становится ясно, что закон Гей-Люссака, выраженный равенством в данном случае
является верным. Что мы и доказали этой лабораторной
работой.
Лабораторна робота 2 10 клас фізика
Скачать лабораторна робота 2 10 клас фізика EPUB
10 клас, фізика. Лабораторна робота №2. Вимірювання сил. СКАЧАТИ шаблон звіту до лабораторної роботи (DOCX, DOC, PDF у ZIP-архіві). Для тих, хто роздруковуватиме шаблон, нагадуємо, що друк повинен бути двохстороннім на аркуші формату А5. 1. 2. 3. 4. 5. Категорія: 10 клас | Додав: nam-kapec (). Переглядів: | Рейтинг: /2. Всього коментарів: 0. Псевдо *. Menu ЗАКАЗАТЬ РЕШЕНИЕ 7 КЛАСС 8 КЛАСС 9 КЛАСС 10 КЛАСС 11 КЛАСС ПРАВООБЛАДАТЕЛЯМ. Лабораторная работа №1. Решение упражнений к учебнику Г.Я.Мякишева, Б.Б.Буховцева.
Изучение движения тела по окружности по действием сил упругости и тяжести. Найти: Вступайте в группу. © flowerdecor64.ru — Добавьте наш сайт в закладки нажатием клавиш Ctrl-D. Контакты: [email protected] flowerdecor64.ru СтатьиПрактическая работа №4 по географии 9 класс (ответы) — Установление связи между тектоническими структурами, формами рельефа и полезными ископаемыми по тектонической и физической картам России. Лабораторная работа №2 по физике 10 класс (ответы) — Изучение изобарного процесса.
Найти: Вступайте в группу. © flowerdecor64.ru — Добавьте наш сайт в закладки нажатием клавиш Ctrl-D. Контакты: [email protected] flowerdecor64.ru СтатьиПрактическая работа №4 по географии 9 класс (ответы) — Установление связи между тектоническими структурами, формами рельефа и полезными ископаемыми по тектонической и физической картам России. Лабораторная работа №2 по физике 10 класс (ответы) — Изучение изобарного процесса.
вкл. 27 Ноябрь Лабораторная работа №2 по физике 10 класс (ответы) — Изучение изобарного процесса. 8. Вычислите средние значения,, 2>, 2>. Вычислите относительную погрешность проделанного эксперимента. Результаты данных вычислений занесите в таблицу. ε = | ,5/ /,5 — 1 | · % = | 0,8 -1 | · % = 20%. Ход лабораторной работы 4. Определение коэффициента трения скольжения Учебник по Физике для 10 класса -> Лабораторные работы. Движение тела, брошенного горизонтально Иллюстрации по физике для 10 класса -> Кинематика.
Ход лабораторной работы 6. Измерение ускорения свободного падения с помощью маятника Учебник по Физике для 10 класса -> Лабораторные работы. Описание лабораторной работы 5. Изучение закона сохранения механической энергии Учебник по Физике для 10 класса -> Лабораторные работы. 5. Изучение закона сохранения механической энергии Учебник по Физике для 10 класса -> Лабор. Лабораторная работа № 1. Исследование зависимости дальности полёта тела от угла бросания.
Измерение ускорения свободного падения с помощью маятника Учебник по Физике для 10 класса -> Лабораторные работы. Описание лабораторной работы 5. Изучение закона сохранения механической энергии Учебник по Физике для 10 класса -> Лабораторные работы. 5. Изучение закона сохранения механической энергии Учебник по Физике для 10 класса -> Лабор. Лабораторная работа № 1. Исследование зависимости дальности полёта тела от угла бросания.
Цель работы: Исследовать зависимость дальности полёта снаряда от угла вылета. Оборудование: пистолет баллистический лабораторный; лента измерительная с сантиметровым делением; листа писчей бумаги и 1 лист копировальной бумаги; липкая лента. Порядок выполнения работы: 1. Приготовьте в тетради таблицу для записи результатов измерений и вычислений.
2. Ознакомьтесь с устройством и действием баллистического пистолета. 3. На краю стола закрепите струбцинку с баллистическим пистолетом м установите пистолет с.
ГДЗ 10 класс Физика лабораторные работы Громыко. Описание решебника. авторы: Громыко Е.В., Зенькович В.И., Луцевич А.А., Слесарь И.Э.. ГДЗ БОТ содержит верные ответы с несколькими вариантами решения по Физике за 10 класс, автор издания: Громыко Е.В., Зенькович В.И., Луцевич А.А., Слесарь И.Э.. лабораторные работы С нами учебный процесс станет лучше!.
Описание решебника. авторы: Громыко Е.В., Зенькович В.И., Луцевич А.А., Слесарь И.Э.. ГДЗ БОТ содержит верные ответы с несколькими вариантами решения по Физике за 10 класс, автор издания: Громыко Е.В., Зенькович В.И., Луцевич А.А., Слесарь И.Э.. лабораторные работы С нами учебный процесс станет лучше!.
Вашій увазі представлено ГДЗ до Лабораторні і практичні роботи Фізика 10 клас Сиротюк В.Д., який буде в нагоді учням, батькам, вчителям і навіть репетиторам. Даний універсальний посібник містить в собі все необхідне, щоб вивчити курс фізики за 10 клас і отримати по закінчанню відмінну оцінку. Для учнів дане ГДЗ грає роль засобу для перевірки правильності виконання домашнього завдання тощо. Батьки можуть використвувати ГДЗ як спосіб самостійно перевіряти рівень своїх дітей з фізики, пояснити незрозуміле для учня.
Якби це дивно не звучало, але вчителі також можуть використовувати ГДЗ для того, щ. Лабораторная работа №1. Изучение движения тела по окружности под действием сил упругости и тяжести. Цель работы: определение центростремительного ускорения шарика при его равномерном движении по окружности.
Цель работы: определение центростремительного ускорения шарика при его равномерном движении по окружности.
Оборудование: штатив с муфтой и лапкой, лента измерительная, циркуль, динамометр лабораторный, весы с разновесами, шарик на нити, кусочек пробки с отверстием, лист бумаги, линейка. 1. Приведем груз во вращение по нарисованной окружности радиуса R= 20 см. Измеряем радиус с точностью 1 см. Измерим время t, за которое тело совершит N=30 оборотов. 2. Определяем высоту конического маятника h по.
fb2, fb2, rtf, PDFПохожее:
Разработка урока по физике 10 класс «Изучение изотермического процесса. Лабораторная работа»
Открытый урок по физике 10 класс
Тема:
Изучение изотермического процесса. Лабораторная работа
Лабораторная работа
Разработал: учитель физики Носова Н.М., ГУ ЛНР «ЛОУ-СОШ №33 им. И.С. Малько»
Луганск 2018
Образовательные задачи урока:
— обеспечить в ходе урока усвоение закона Бойля – Мариотта путем опытной его проверки.
— научить работать с приборами и материалами, производить измерения и самостоятельно делать необходимые выводы.
— проверить уровень усвоения обучающимися знаний по теме «Газовые законы»
Воспитательные задачи урока:
— Содействовать в ходе урока формированию мировоззренческих идей: причинно-следственные связи явлений, познаваемость мира и его закономерностей.
— Продолжить работу по развитию познавательной самостоятельности учащихся.
— Способствовать в ходе урока нравственному воспитанию учащихся.
Развивающие задачи урока:
— Продолжить работу по развитию у обучающихся умений выделять главное, существенное, сравнивать изучаемые факты, логически излагать мысли.
— Способствовать формированию информационно — коммуникативных компетенций.
— Способствовать формированию метапредметных связей с математикой, химией, биологией.
Тип урока: урок развития практических умений и навыков.
Оборудование: комплект оборудования для проведения лабораторной работы, мультимедийный проектор, презентация, компьютеры.
План урока
Основные этапы урокаВремя
1
Организационный момент
1 мин
2
Постановка темы урока и основной проблемы урока
1 мин
3
Краткое повторение темы “Изопроцессы”
5 мин
4
Теоретическое обоснование эксперимента.
3 мин
5
Проведение инструктажа по технике безопасности и подготовка письменного отчета
5 мин
6
Самостоятельное выполнение лабораторной работы “Опытная проверка закона Бойля — Мариотта”.
Подготовка расчетов в табличном процессоре.
15 мин
7
Обработка результатов с помощью компьютеров.
5 мин
8
Оформление письменного отчета.
7 мин
9
Анализ результатов урока.
3 мин
На уроке в ходе лабораторной работы мы должны проверить справедливость газового закона, описывающего закономерность протекания изотермического процесса (слайд 1). Вспомним основные понятия, знание которых необходимы для успешного выполнения работы.
Какой процесс называют изотермическим?
Сформулируйте закон Бойля-Мариотта (слайд 2).
Какой математической зависимостью связаны давление и объем газа (слайд 3)?
Для какого газа справедливы газовые законы?
Почему для глубоководных исследований нужны особо прочные водолазные костюмы и аппараты (слайды 4-5)?
Какими особенностями обладают глубоководные организмы (слайд 6)?
Для проведения работы класс разделен на 5 рабочих групп и у каждого обучающегося своя специализация: руководитель группы, лаборант, программист.
Теоретическое обоснование эксперимента (слайд 7).
Закон Бойля-Мариотта описывает процесс, который происходит в газе данной массы при неизменной температуре. В этих условиях произведение давление газа на его объем есть величина постоянная. Иначе говоря, давление данной, массы газа при постоянной температуре изменяется обратно пропорционально его объему.
Объектом исследования в данной работе будет служить воздух, заключенный в стеклянной трубке, закрытой с одного конца. Воздух при комнатной температуре и атмосферном давлении можно считать идеальным газом. Температура и масса воздуха в ходе опыта не меняется, процесс можно считать изобарным.
В цилиндр с водой опускают открытым концом вниз трубку. Если уровень воды в трубке находится ниже уровня воды в сосуде на глубине H, то давление воздуха в трубке равно сумме атмосферного и гидростатического давления столба воды высотой H:
(р = ратм +ρgH).
Погружая трубку открытым концом в воду, мы изменяем высоту столба жидкости, следовательно, давление воздуха.
При этом изменяется объем, занимаемый воздухом. Чтобы найти объем воздуха, необходимо площадь основания трубки умножить на высоту воздушного столба в трубке. Поскольку при эксперименте диаметр трубки не меняется, то его площадь основания трубки можно условно принять за единицу и выражать объем через длину воздушного столба в условных единицах. В работе удобно измерять высоту водяного столбика в трубке h, тогда объем можно найти как разность длины трубки и высоты водяного столбика:
V = L — h
Наша задача – измерить давление и объем воздуха в нескольких состояниях и проверить равенство их произведения.
ЭТАПЫ ВЫПОЛНЕНИЯ РАБОТЫ:
Инструктаж по технике безопасности.
Подготовка письменного отчета в тетради.

Выполнение эксперимента.
Обработка экспериментальных данных.
Анализ результатов эксперимента.
Итоговый контроль знаний (тесты).
Лабораторная работа № 3
Тема: Изучение изотермического процесса (слайд 8).
Цель: проверить справедливость закона Бойля-Мариотта.
Оборудование: стеклянный цилиндр, стеклянная трубка, запаянная с одного конца, сосуд с водой, штатив с муфтой и лапкой, линейка, барометр.
Расчетные формулы: (слайд 9)
(р = ратм +ρgH) V = L — h pV = const
Ход работы:
Подготовка письменного отчета: занесите в тетрадь для лабораторных работ дату, вид работы и номер; сформулируйте цель работы; запишите в тетрадь оборудование и расчетные формулы; подготовьте в тетради таблицу для записей результатов эксперимента.

Таблица измерений и вычислений
V,усл. ед
p, Па
pV,
усл. ед
1
2
3
4
5
Инструктаж по технике безопасности (слайды 10-13).
Сборка экспериментальной установки по схеме.
Памятка по технике безопасности
Осторожно! Вода! Стекло!
Будьте осторожны при работе с водой. Не разливайте воду, не пробуйте ее на вкус.
Стекло! Будьте осторожны при работе со стеклянной посудой. Стеклянные сосуды нельзя ставить на край стола, делать резкие движения, предметы на дно сосуда необходимо опускать осторожно, не допуская ударов.
Проведение эксперимента: руководители групп и экспериментаторы проводят эксперимент.

Работа с компьютером: программисты готовят обработку данных эксперимента в табличном процессоре EXECL.
Обработка результатов эксперимента на компьютере руководителем группы и программистом.
Уборка оборудования лаборантами.
Оформление отчета о работе в тетради.
Подведение итогов работы, оформление вывода.
Итоговый контроль умений и навыков.
Подведение итогов урока (слайд 14).
Удалось ли нам подтвердить закон Бойля-Мариотта?
Из каких отраслей знаний нам сегодня понадобилась информация?
Какие явления природы вам удалось сегодня лучше понять?
Приложение 1 Презентация
Приложение 2 Использование текстового редактора
Расчет объема
Расчет давления
Расчет произведения давления на объем
Построение изотермы
2.
 Молекулярная физика — Лабораторная экспериментальная площадка для школьников
Молекулярная физика — Лабораторная экспериментальная площадка для школьниковВ данной лабораторной работе проводится исследование изотермического, изобарического и изохорного процессов для реального газа.
Теоретический минимум: атом, молекула, частица, газ, идеальный газ, молекулярно-кинетическая теория, объём, давление, атмосферное давление, среднее значение скорости молекулы (квадрата скорости), постоянная Больцмана, постоянная Авогадро, температура, мера средней кинетической энергии, тепловое равновесие, уравнение состояния идеального газа, термодинамическая система, изотермический процесс, закон Бойля-Мариотта, изотерма, изобарный процесс, закон Гей-Люссака, изобара, изохорный процесс, закон Шарля, изохора, объём Шарля.
Лабораторная работа рекомендуется для учащихся 10 классов.
Подробнее…
Настоящая работа является современной реализацией классических опытов Галилея и Герике. Стеклянный сосуд, снабженный вакуумным краном, взвешивается до и после откачки из него воздуха. Измеряя объем сосуда, мы получаем возможность оценить плотность воздуха в лаборатории.
Стеклянный сосуд, снабженный вакуумным краном, взвешивается до и после откачки из него воздуха. Измеряя объем сосуда, мы получаем возможность оценить плотность воздуха в лаборатории.
Теоретический минимум: .
Лабораторная работа рекомендуется для учащихся 8, 9 классов.
Подробнее…
В данной работе проводится определение удельной теплоемкости различных материалов, по изменению температуры воды в калориметре при погружении в нее нагретого кубика из исследуемого материала. Для этого необходимо измерить: массу тела, массу стакана калориметра, массу воды в стакане, температуру тела, начальную и конечную температуры воды в стакане. (Теплоемкость воды считается известной).
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся 8 классов.
Подробнее…
В данной работе изучаются процессы парообразования и конденсации. В работе вода нагревается с помощью сухого пара, и по измерениям массы и температуры воды до начала и после окончания эксперимента определяем теплоту парообразования. Так же в работе рассматриваются процессы, которые влияют на измеряемые величины и приводят к различию рассчитанного из эксперимента и табличного значений удельной теплоты парообразования.
В работе вода нагревается с помощью сухого пара, и по измерениям массы и температуры воды до начала и после окончания эксперимента определяем теплоту парообразования. Так же в работе рассматриваются процессы, которые влияют на измеряемые величины и приводят к различию рассчитанного из эксперимента и табличного значений удельной теплоты парообразования.
Теоретический минимум: температура, внутренняя энергия, теплопроводность, термос, количество теплоты, удельная теплоёмкость, закон сохранения и превращения энергии, агрегатное состояние вещества, твёрдое тело, жидкость, газ, плавление, кристаллизация (отвердевание), температура плавления, удельная теплота плавления, парообразование, испарение, конденсация, кипение, температура кипения, удельная теплота парообразования.
Лабораторная работа рекомендуется для учащихся 8 классов.
Подробнее…
Лабораторная установка дает возможность познакомиться с основными типами передачи теплоты: конвекцией, тепловым излучением, теплопроводностью, а также провести исследование теплопроводности различных материалов. Выполнив данную лабораторную работу с использованием теплоизолированного бокса, представляется возможным сравнить экспериментальные результаты с теоретическими и табличными данными и сделать выводы о теплоизоляционных свойствах материала или наоборот, сказать насколько хорошо материал может отводить тепло.
Выполнив данную лабораторную работу с использованием теплоизолированного бокса, представляется возможным сравнить экспериментальные результаты с теоретическими и табличными данными и сделать выводы о теплоизоляционных свойствах материала или наоборот, сказать насколько хорошо материал может отводить тепло.
Теоретический минимум: температура, внутренняя энергия, теплопроводность, конвекция, излучение (тепловое), абсолютно чёрное тело, коэффициент серости, количество теплоты, удельная теплоёмкость, закон сохранения и превращения энергии, термодинамическое равновесие.
Лабораторная работа рекомендуется для учащихся 8 классов.
Подробнее…
Лабораторная работа предполагает ознакомление с теоретическими основами работы тепловых машин и, в частности, тепловых насосов. Тепловым насосом называют машину, основной целью которой является передача тепла от более нагретого тела холодному при совершении механической работы. Экспериментальная установка представляет собой модель теплового насоса компрессорного типа, на примере которой можно разобрать принцип работы и устройство тепловых насосов и определить эффективность предложенного теплового насоса в зависимости от внешних параметров.
Экспериментальная установка представляет собой модель теплового насоса компрессорного типа, на примере которой можно разобрать принцип работы и устройство тепловых насосов и определить эффективность предложенного теплового насоса в зависимости от внешних параметров.
Теоретический минимум: температура, внутренняя энергия, теплопроводность, количество теплоты, удельная теплоёмкость, закон сохранения и превращения энергии, агрегатное состояние вещества, жидкость, газ, парообразование, испарение, конденсация, кипение, температура кипения, удельная теплота парообразования, кпд (коэффициент полезного действия) теплового двигателя (насоса).
Лабораторная работа рекомендуется для учащихся 8, 10 классов.
Подробнее…
Двигатель Стирлинга является частным случаем теплового двигателя — двигателя, превращающего тепловую энергию в механическую. Выполняя данную лабораторную работу, юные экспериментаторы имеют возможность ознакомиться с 1-м и 2-м началом термодинамики, наглядно увидеть протекание основных термодинамических процессов, а также понять принцип работы тепловых машин, который является единым для всех тепловых двигателей.
Теоретический минимум: температура, внутренняя энергия, теплопроводность, количество теплоты, удельная теплоёмкость, молекулярно-кинетическая теория, закон сохранения и превращения энергии, первый закон термодинамики, второй закон термодинамики, работа, тепловой двигатель, кпд (коэффициент полезного действия) теплового двигателя, цикл Карно, термодинамическая система, изолированная система, изотермический процесс, изобарный процесс, изохорный процесс, адиабатный процесс, уравнение теплового баланса, нагреватель, холодильник.
Лабораторная работа рекомендуется для учащихся 10 классов.
Подробнее…
В этой работе предлагается измерить коэффициент поверхностного натяжения жидкости методом отрыва кольца. Исследовать характер зависимости коэффициента поверхностного натяжения жидкости от температуры для чистой жидкости, и от концентрации для растворов вода-спирт.
Теоретический минимум: жидкость, молекула, атом, сила, сила поверхностного натяжения, силы взаимодействия молекул (атомов), температура, потенциальная энергия, внутренняяэнергия, работа, коэффициент поверхностного натяжения, смачивание, угол смачивания, капиллярный эффект, свободная поверхность жидкости.
Лабораторная работа рекомендуется для учащихся 9-11 классов с углублённым изучением физики.
Подробнее…
В этой работе предлагается познакомиться с устройством ротационного вискозиметра. И провести исследование зависимости вязкости от различных параметров для ньютоновских и неньютоновских жидкостей.
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся __ классов.
Подробнее…
В этой работе проводится исследование зависимости вязкости воды от температуры с помощью вискозиметра с падающим шариком. Знакомство с понятиями ламинарного и турбулентного течения жидкости, а также числом Рейнольдса, которое определяется соотношением между диаметром капилляра и шарика, и определяет характер течения жидкости в вискозиметре.
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся __ классов.
Подробнее…
Работа включает в себя знакомство с основными законами аэро- и гидродинамики. На основе данных законов предлагается объяснить причины наблюдения эффекта Бернулли, разобраться с принципом работы трубки Пито-Прандтля — устройства для измерения скорости воздушного потока, а также осуществить проверку применимости приближения несжимаемой среды к воздушным потокам.
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся __ классов.
Подробнее…
Работа посвящена исследованию особенностей обтекания воздушным потоком тел различной формы и размеров. Предлагается исследовать, какие тела обладают наилучшими аэродинамическими характеристиками, какие наоборот — наихудшими. Эксперимент проводится в малой аэродинамической трубе, включающей трубку Пито-Прандтля для измерения скорости воздушного потока и динамометр для измерения силы лобового сопротивления, действующей на исследуемое тело.
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся __ классов.
Подробнее…
Данная работа дает крайне наглядный и простой ответ на вопрос: как и почему самолеты могут летать? Лабораторная работа позволяет ознакомиться с методикой проведения эксперимента в аэродинамической трубе. Работа включает исследование основных аэродинамических характеристик взаимодействия воздушного потока с исследуемым телом несимметричной формы – силы лобового сопротивления и подъемной силы. В качестве исследуемого тела выступает модель крыла самолета.
Теоретический минимум:
Лабораторная работа рекомендуется для учащихся __ классов.
Подробнее…
Калориметрия постоянного объема — Химия LibreTexts
Калориметрия постоянного объема, также известная как калориметрия бомбы, используется для измерения теплоты реакции при поддержании постоянного объема и сопротивлении большим давлениям. Хотя эти два аспекта калориметрии бомбы обеспечивают точные результаты, они также вносят свой вклад в сложность калориметрии бомбы. В этом модуле будет рассмотрена основная сборка калориметра бомбы, а также то, как калориметрия бомбы связана с теплотой реакции и теплоемкостью, а также с расчетами, связанными с этими двумя вопросами.
Хотя эти два аспекта калориметрии бомбы обеспечивают точные результаты, они также вносят свой вклад в сложность калориметрии бомбы. В этом модуле будет рассмотрена основная сборка калориметра бомбы, а также то, как калориметрия бомбы связана с теплотой реакции и теплоемкостью, а также с расчетами, связанными с этими двумя вопросами.
Введение
Калориметрия используется для измерения количества тепла и может использоваться для определения теплоты реакции путем экспериментов. Обычно используется калориметр в виде чашки кофе, поскольку он проще, чем калориметр бомбы, но для измерения тепла, выделяемого в реакции сгорания, идеальным вариантом является калориметрия постоянного объема или калориметрия бомбы. Калориметр постоянного объема также более точен, чем калориметр в виде чашки кофе, но его труднее использовать, так как он требует хорошо построенного реакционного контейнера, способного выдерживать большие изменения давления, которые происходят во многих химических реакциях.
Самая серьезная калориметрия, проводимая в исследовательских лабораториях, включает определение теплоты сгорания \ (\ Delta H_ {горение} \), поскольку она необходима для определения стандартных энтальпий образования тысяч новых соединений, которые получены и охарактеризованы. каждый месяц. В калориметре постоянного объема система герметизирована или изолирована от окружающей среды, что объясняет, почему ее объем фиксирован и не выполняется работа с объемным давлением.В состав калориметра бомбы входят:
- Стальная бомба, содержащая реагенты
- Водяная баня, в которую погружена бомба
- Термометр
- Мешалка с электроприводом
- Провод зажигания
Поскольку процесс происходит при постоянном объеме, реакционный сосуд должен быть сконструирован таким образом, чтобы выдерживать высокое давление, возникающее в результате процесса горения, которое представляет собой ограниченный взрыв. Судно обычно называют «бомбой», а методика — калориметрия бомбы . Реакция инициируется разрядом конденсатора через тонкую проволоку, которая воспламеняет смесь.
Судно обычно называют «бомбой», а методика — калориметрия бомбы . Реакция инициируется разрядом конденсатора через тонкую проволоку, которая воспламеняет смесь.
Другим следствием условия постоянного объема является то, что выделяемое тепло соответствует \ (q_v \), и, следовательно, изменению внутренней энергии \ (ΔU \), а не \ (ΔH \). Изменение энтальпии рассчитывается по формуле
\ [ΔH = q_v + Δn_gRT \]
где \ (Δn_g \) — изменение количества молей газов в реакции.
Пример \ (\ PageIndex {1} \): горение дифенила
Образец бифенила (\ (\ ce {(C6H5) 2} \)) массой 0,526 г был воспламенен в калориметре бомбы первоначально при 25 ° C, что привело к повышению температуры на 1,91 К. В отдельном калибровочном эксперименте образец бензойной кислоты (\ (\ ce {C6H5COOH} \)) массой 0,825 г воспламеняется в идентичных условиях и вызывает повышение температуры на 1,94 К. Известно, что для бензойной кислоты теплота сгорания при постоянном давлении составляет 3226 кДж / моль –1 (то есть Δ U = –3226 кДж моль –1 . ) Используйте эту информацию для определения стандартной энтальпии горения дифенила.
) Используйте эту информацию для определения стандартной энтальпии горения дифенила.
Решение
Начните с определения постоянной калориметра:
\ [\ dfrac {0,825 г} {122,1 \; г / моль} = 0,00676 \; моль \ nonumber \]
- Тепло, отдаваемое калориметру:
\ [(0,00676 \; моль) \ раз (3226 \; кДж / моль) = 21,80 \; кДж \ nonumber \]
\ [\ dfrac {21.80 \; кДж} {1,94 \; K} = 11,24 \; кДж / К \ nonumber \]
Теперь определите \ (ΔU_ {сгорание} \) бифенила («BP»):
\ [\ dfrac {0.526 \; g} {154.12 \; г / моль} = 0,00341 \; моль \ nonumber \]
- Тепло, отдаваемое калориметру:
\ [(1,91 \; K) \ times (11,24 \; кДж / K) = 21,46 \; кДж \ nonumber \]
- теплоты, выделяемой на моль бифенила:
\ [\ dfrac {21.46 \; кДж} {0,00341 \; моль} = 6,293 \; кДж / моль \ nonumber \]
\ [ΔU_ {горение} (BP) = –6,293 \; кДж / моль \ nonumber \]
Это изменение тепла при постоянном объеме, \ (q_v \); отрицательный знак указывает, что реакция является экзотермической, как и все реакции горения.
Из вычисленного уравнения реакции
\ [\ ce {(C6H5) 2 (s) + 29/2 O2 (г) \ rightarrow 12 CO2 (г) + 5 h3O (л)} \ nonumber \]
мы можем рассчитать изменение количества молей газов для этой реакции
\ [Δn_g = 12 — \ frac {29} {2} = \ frac {-5} {2} \ nonumber \]
Таким образом, объем системы уменьшается на , когда реакция имеет место. Преобразуя в \ (ΔH \), мы можем записать следующее уравнение. Кроме того, напомним, что при постоянном объеме \ (ΔU = q_V \).{-1}) (298 \; K) \\ [4pt] & = (-6,293 \; кДж / моль) — (6,194 \; Дж / моль) \\ [4pt] & = (-6,293-6.2) \ ; кДж / моль \\ [4pt] & = -6299 \; кДж / моль \ end {align *} \]
Распространенной ошибкой здесь является забвение того, что вычитаемый член выражается в Дж, а не в кДж. Обратите внимание, что дополнительные 6,2 кДж в \ (ΔH \) по сравнению с \ (ΔU \) отражают работу, которую окружение совершает в системе, когда объем газов уменьшается в соответствии с уравнением реакции.
Определение теплоты реакции
Количество тепла, которое система отдает своему окружению, чтобы она могла вернуться к своей начальной температуре, является теплотой реакции.Теплота реакции — это просто отрицательная величина тепловой энергии, полученной калориметром и его содержимым (\ (q_ {calorimeter} \)) в результате реакции сгорания.
\ [q_ {rxn} = -q_ {калориметр} \ label {2A} \]
где
\ [q_ {калориметр} = q_ {бомба} + q_ {вода} \ label {3A} \]
Если калориметр постоянного объема настроен так же, как и раньше (та же стальная бомба, такое же количество воды и т. Д.), То теплоемкость калориметра может быть измерена по следующей формуле:
\ [q_ {калориметр} = \ text {(теплоемкость калориметра)} \ times \ Delta {T} \ label {4A} \]
Теплоемкость определяется как количество тепла, необходимое для повышения температуры всего калориметра на 1 ° C.Вышеприведенное уравнение также можно использовать для вычисления \ (q_ {rxn} \) из \ (q_ {calorimeter} \), рассчитанного по уравнению \ ref {2A}. Теплоемкость калориметра можно определить путем проведения эксперимента.
Теплоемкость калориметра можно определить путем проведения эксперимента.
Пример \ (\ PageIndex {4} \): Теплота сгорания
1,150 г сахарозы сжигается в калориметре бомбы. Если температура повысилась с 23,42 ° C до 27,64 ° C, а теплоемкость калориметра составляет 4,90 кДж / ° C, то определяют теплоту сгорания сахарозы \ (\ ce {C12h32O11} \) (в кДж на моль \ (\ ce {C12h32O11} \)).
Решение
Дано:
- Масса \ (C_ {12} H_ {22} O_ {11} \): 1,150 г
- \ (T_ {initial} \): 23,42 ° C
- \ (T_ {final} \): 27,64 ° C
- Теплоемкость калориметра: 4,90 кДж / ° C
Использование уравнения \ ref {4A} для вычисления \ (q_ {калориметр} \):
\ [\ begin {align *} q_ {калориметр} & = (4,90 \; кДж / ° C) \ times (27,64 — 23,42) ° C \\ [4pt] & = (4,90 \ times 4,22) \; кДж = 20,7 \; кДж \ end {align *} \]
Включите уравнение \ ref {2A}:
\ [\ begin {align *} q_ {rxn} & = -q_ {калориметр} \\ [4pt] & = -20. 7 \; кДж \; \ end {align *} \]
7 \; кДж \; \ end {align *} \]
Но вопрос касается кДж / моль \ (\ ce {C12h32O11} \), поэтому это необходимо преобразовать:
\ [\ begin {align *} q_ {rxn} & = \ dfrac {-20,7 \; кДж} {1.150 \; грамм \; C_ {12} H_ {22} O_ {11}} \\ [4pt] & = \ dfrac {-18.0 \; кДж} {г \; C_ {12} H_ {22} O_ {11}} \ end {align *} \]
Преобразовать в моль \ (\ ce {C12h32O11} \):
\ [\ begin {align *} q_ {rxn} & = \ dfrac {-18.0 \; kJ} {\ cancel {g \; \ ce {C12h32O11}}} \ times \ dfrac {342.3 \; \ cancel {g \; \ ce {C12h32O11}}} {1 \; моль \; \ ce {C12h32O11}} \\ [4pt] & = \ dfrac {-6.3 \; кДж \;} {моль \; \ ce {C12h32O11}} \ end {align *} \]
«Ледяной калориметр»
Несмотря на то, что калориметрия в принципе проста, ее практическое применение представляет собой весьма сложное искусство, особенно когда она применяется к процессам, которые происходят медленно или включают очень небольшие изменения температуры, такие как прорастание семян. Калориметры могут быть такими же простыми, как кофейная чашка из пенопласта, которую часто используют в студенческих лабораториях. Калориметры исследовательского уровня, способные обнаруживать мельчайшие изменения температуры, с большей вероятностью будут занимать столешницы или даже целые комнаты:
Калориметры исследовательского уровня, способные обнаруживать мельчайшие изменения температуры, с большей вероятностью будут занимать столешницы или даже целые комнаты:
Ледяной калориметр — важный инструмент для измерения теплоемкости жидкостей и твердых тел, а также теплоты определенных реакций.Этот простой, но гениальный прибор по сути является устройством для измерения изменения объема из-за таяния льда. Для измерения теплоемкости теплый образец помещается во внутренний отсек, окруженный смесью льда и воды.
Тепло, отводимое от образца при его охлаждении, вызывает таяние части льда. Поскольку лед менее плотен, чем вода, объем воды в изолированной камере уменьшается. Это приводит к засасыванию эквивалентного объема ртути во внутренний резервуар из внешнего контейнера.Уменьшение веса этого контейнера приводит к уменьшению объема воды и, следовательно, массы таяния льда. В сочетании с теплотой плавления льда это дает количество тепла, теряемого образцом при охлаждении до 0 ° C.
5 Общие научные требования безопасности лабораторий
Общая наука или междисциплинарная наука в основном фокусируется на научных исследованиях, знаниях и исследованиях. Это целостный подход к фундаментальной научной грамотности. В школах Коннектикута учебная программа и оценивание (Коннектикутский зачетный тест или CMT в 5 и 8 классах и Тест на академическую успеваемость в Коннектикуте или CAPT в 9 и 10 классах) работают на достижение этой цели, предлагая учащимся бесчисленное множество научного опыта и обучения.Практические, процессуальные и исследовательские методы поощряются посредством лабораторных и полевых работ. Чтобы обеспечить учащимся захватывающий и безопасный научный опыт, настоятельно рекомендуются следующие спецификации безопасности и разумные методы, которые в большинстве случаев требуются регулирующими органами (OSHA, NFPA, ICC и т. Д.).
A. Условия окружающей среды и соображения
Области научных исследований — это первая линия защиты безопасности благодаря дизайну. В их состав входят лаборатория, подготовительное помещение и кладовая.
В их состав входят лаборатория, подготовительное помещение и кладовая.
Указания по безопасности на следе:
- Должны быть отдельные помещения для лабораторных работ, подготовительные и складские помещения.
- Размещение мебели в лабораториях должно быть спроектировано таким образом, чтобы облегчить перемещение, быстрый выход, непосредственное наблюдение / наблюдение и отсутствие опасности споткнуться / падения.
- Помещения должны иметь два выхода, если их площадь составляет более 1000 квадратных футов (92,9 квадратных метров).
- Допустимая нагрузка на человека в соответствии с Национальной ассоциацией противопожарной защиты (NFPA) и Международным советом по кодам (ICC) должна рассматриваться из расчета 50 квадратных футов (4,6 квадратных метра) на каждого человека в лаборатории. Квази-юридические или академические / профессиональные передовые практики гласят, что в научных классах / лабораториях должно быть не более 24 студентов, даже если предел нагрузки может вместить больше (NSTA 2004).
 Исследования показывают, что количество несчастных случаев резко возрастает по мере того, как посещаемость классов превышает этот уровень (West 2001).Это при условии, что не нарушена законная нагрузка.
Исследования показывают, что количество несчастных случаев резко возрастает по мере того, как посещаемость классов превышает этот уровень (West 2001).Это при условии, что не нарушена законная нагрузка. - Лаборатория должна быть доступна для людей с ограниченными возможностями относительно мебели, оборудования и прочего.
Определение — Вытяжной шкаф — это инженерный элемент управления, обеспечивающий местную вытяжную вентиляцию. Обычно он имеет подвижную переднюю створку или окно с безопасным стеклом. Вытяжной колпак необходим для выпуска опасных газов, твердых частиц, паров и т. Д. Он защищает учеников и учителей от вдыхания.Вытяжной шкаф обычно ограничивается подготовкой учителя, а не активным использованием учеником на уровне средней школы.
Указания по безопасности капота:
- Используйте колпак для удаления переносимых по воздуху химикатов, таких как аэрозоли, пыль, пары и пары.
- Вытяжки не предназначены для хранения.
 Не допускайте попадания в них химикатов, лабораторной посуды и т. Д.
Не допускайте попадания в них химикатов, лабораторной посуды и т. Д. - Разместите аппарат как можно дальше к задней части кожуха для эффективного воздушного потока.
- Убедитесь, что во время работы под колпаком находятся только необходимые материалы.
- Всегда держите створку между лицом и экспериментируйте с опущенной створкой.
- Проверьте поток воздуха до и во время операции [Скорость движения 80–120 футов в минуту (24,4–36,6 метра в минуту)].
- Вытяжки следует проверять и сертифицировать для работы от одного до четырех раз в год, в зависимости от частоты использования в соответствии с рекомендациями производителя.
- Ни в коем случае не перекрывайте поток воздуха внутрь или внутрь вытяжки.
- Не используйте вытяжку в качестве устройства для удаления химикатов.
Вентиляция в лаборатории имеет решающее значение для безопасной и здоровой работы. Слабая вентиляция или ее отсутствие может привести к накоплению вредных паров, респираторным симптомам и многому другому.
Слабая вентиляция или ее отсутствие может привести к накоплению вредных паров, респираторным симптомам и многому другому.
Указания по безопасности вентиляции:
- Скорость воздухообмена в оккупированной лаборатории должна составлять от шести до 10 раз в час согласно справочнику Американского общества инженеров по отоплению, охлаждению и кондиционированию воздуха (ASHRAE) или превышать восемь воздухообменов в соответствии с NFPA 45.Свяжитесь с директором школы, чтобы узнать курс воздухообмена.
- Нормы воздухообмена в незанятых лабораториях, включая химические склады, должны быть четыре раза в час в соответствии с NFPA 45.
- Воздух, подаваемый в лаборатории, складские помещения, помещения для подготовки, никогда не следует направлять в другие части здания, другие лаборатории, классы и офисы.
- Проводите только те эксперименты, с которыми может справиться система вентиляции. В противном случае используйте вытяжной шкаф или выберите другой эксперимент.
 Идея состоит в том, чтобы ограничить воздействие на людей.
Идея состоит в том, чтобы ограничить воздействие на людей. - Программы профилактического обслуживания должны применяться для замены вентиляционных фильтров примерно четыре раза в год. Фильтры необходимо менять ежеквартально.
Хорошим ресурсом для лабораторной вентиляции является NFPA 45. Он касается обязательной принудительной вентиляции в научных лабораториях, включая академические лаборатории.
Лабораторные помещения должны иметь главные запорные устройства для коммунальных служб, таких как электричество и газ.Запорные устройства для воды обычно располагаются за пределами лаборатории в коридоре.
Тепловые датчики или датчики дыма и датчики системы пожаротушения необходимы для обеспечения безопасности лаборатории, особенно в свободное время.
Промывание глаз и кислотный душ необходимы в случае химического воздействия. Эти устройства должны быть в местах, где жильцам будет обеспечен прямой доступ.OSHA обеспечивает соблюдение стандартов Американского национального института стандартов или ANSI (Z358.1-1998), которые требуют 10-секундного доступа к любой промывке глаз / кислотному душем в лаборатории. Дополнительные станции для промывания глаз необходимы, если 10-секундный доступ невозможен с одной станцией в лаборатории. Для промывания глаз необходимо воздействие прохладной воды [60–100 градусов по Фаренгейту (15,6–37,8 градусов по Цельсию)] в течение 15 минут минимум при предписанной скорости потока 0,4 галлона (1,5 литра) в минуту. Помещения для подготовки также требуют доступа к станциям для промывания глаз в той же комнате.Не следует использовать портативные бутылочки для промывания глаз. Они не обеспечивают достаточное водоснабжение и способствуют росту микроорганизмов.
Эти устройства должны быть в местах, где жильцам будет обеспечен прямой доступ.OSHA обеспечивает соблюдение стандартов Американского национального института стандартов или ANSI (Z358.1-1998), которые требуют 10-секундного доступа к любой промывке глаз / кислотному душем в лаборатории. Дополнительные станции для промывания глаз необходимы, если 10-секундный доступ невозможен с одной станцией в лаборатории. Для промывания глаз необходимо воздействие прохладной воды [60–100 градусов по Фаренгейту (15,6–37,8 градусов по Цельсию)] в течение 15 минут минимум при предписанной скорости потока 0,4 галлона (1,5 литра) в минуту. Помещения для подготовки также требуют доступа к станциям для промывания глаз в той же комнате.Не следует использовать портативные бутылочки для промывания глаз. Они не обеспечивают достаточное водоснабжение и способствуют росту микроорганизмов.
Кислотный или безопасный душ должен обеспечивать минимальный поток 30 галлонов (113,6 литров) в минуту с непрерывным потоком прохладной воды.
Кодекс не требует, чтобы для мытья глаз и душа имел слив в полу. Однако разумно и практично иметь сливы в полу для промывки, предотвращения образования плесени и предотвращения поражения электрическим током из-за стоячей воды.
Средства для промывки глаз необходимо проверять (промывать в течение примерно трех минут) один раз в неделю в соответствии с ожиданиями производителя, чтобы удалить отложения, биологические загрязнители и т. Д. Рядом с каждой промывкой для глаз должен быть вывешен письменный журнал с указанием даты промывки. и человек, выполняющий задачу. OSHA оправдывает это ожидание.
В некоторых случаях, таких как демонстрации, могут быть рекомендованы защитные экраны в дополнение к очкам для защиты от химических брызг.
Учитывая опасность опасных химикатов и вероятность возгорания и взрыва, оборудование для пожаротушения является требованием NFPA. Огнетушители должны быть типа A-B-C (A — горючие вещества, такие как дерево, бумага, B — горючие вещества, такие как спирт, C — электрические) (также тип D для горючих металлов, таких как магний, калий, натрий и т. Д.). Учителей естественных наук следует ежегодно обучать правильному использованию огнетушителей. Проконсультируйтесь с местным советом по образованию относительно использования сотрудниками огнетушителей.
Огнетушители должны быть типа A-B-C (A — горючие вещества, такие как дерево, бумага, B — горючие вещества, такие как спирт, C — электрические) (также тип D для горючих металлов, таких как магний, калий, натрий и т. Д.). Учителей естественных наук следует ежегодно обучать правильному использованию огнетушителей. Проконсультируйтесь с местным советом по образованию относительно использования сотрудниками огнетушителей.
Используйте следующий подход NFPA «PASS» при работе с первым огнетушителем:
P — Вытяните палец
В большинстве огнетушителей используется стопорный штифт для предотвращения случайного срабатывания. Вытягивание штифта разблокирует рабочий уровень, чтобы разрешить операцию разгрузки.
A — Низкая цель
Направьте сопло огнетушителя на основание огня.
S — Выжать рычаг
Для выпуска огнетушащего вещества должен быть задействован рычаг под рукояткой или какое-либо другое спусковое устройство.
S — Размах из стороны в сторону
Широкими движениями по основанию огня продолжайте выпускать огнетушащее вещество, пока не станет казаться, что огонь потух. Обязательно следите за местом пожара; если огонь снова загорится, повторите процесс.
Знаки должны быть вывешены, чтобы показать расположение огнетушителей, особенно в областях научных лабораторий, где они могут быть легко заблокированы из вида. Знаки должны быть достаточно большими, чтобы их было видно издалека.Ниже приведен пример знака огнетушителя.
А. Знак огнетушителя
Переносные огнетушители весом более 39,7 фунтов (18 кг) должны устанавливаться таким образом, чтобы их верх был не выше 1,1 метра (3,6 фута) над полом. Те, кто весит 39,6 фунтов или меньше (18 кг или меньше), не должны находиться на высоте более 5 футов (1,5 метров) над полом.
Расстояние перемещения переносных огнетушителей класса D не должно превышать 75 футов (22. 9 метров) от опасности [29 CFR 1910.157 (d) (6)].
9 метров) от опасности [29 CFR 1910.157 (d) (6)].
Расстояние перемещения переносных огнетушителей класса ABC не должно превышать 50 футов (15,2 м) от источника опасности [29 CFR 1910.157 (d) (4)].
Огнестойкая шерсть или другие материалы могут быть полезны при тушении небольших пожаров. Никогда не заворачивайте горящего человека противопожарным одеялом. Это может создать «эффект дымохода». Следует использовать настенные канистры или ящики с соответствующими обозначениями.
Доступны шкафы с ультрафиолетовым (U-V) дезинфицирующим средством для очков, и дезинфекция очков занимает около 15 минут. Очки необходимо продезинфицировать, если их используют более одного ученика. Альтернативой дезинфицирующим средствам являются дезинфицирующие средства, спирт или средство для мытья посуды.
Все научные лаборатории, складские помещения и подготовительные комнаты должны иметь электрические розетки с прерывателями цепи замыкания на землю (GFCI) для защиты людей от поражения электрическим током. Это подтверждается OSHA в отношении источника воды длиной 6 футов (1,8 метра). Однако, учитывая, что использование воды может происходить где угодно в лаборатории (например, в аквариуме, резервуарах с волнами, резервуарах с волнами и т. Д.), Разумно иметь всю лабораторию с резервуарами для GFCI. Одно замечание — прикосновение к обоим металлическим штырям при подключении к настенной розетке не защитит пользователя.
Это подтверждается OSHA в отношении источника воды длиной 6 футов (1,8 метра). Однако, учитывая, что использование воды может происходить где угодно в лаборатории (например, в аквариуме, резервуарах с волнами, резервуарах с волнами и т. Д.), Разумно иметь всю лабораторию с резервуарами для GFCI. Одно замечание — прикосновение к обоим металлическим штырям при подключении к настенной розетке не защитит пользователя.
B. Благоразумные методы работы
Кислоты очень опасны, и с ними необходимо обращаться с особой осторожностью.При разбавлении кислоты водой «ААА» — ВСЕГДА ДОБАВЛЯЙТЕ КИСЛОТУ В ВОДУ! Медленно перемешайте содержимое, следя за выделением тепла, особенно с серной кислотой. Альтернативой разбавлению кислот является покупка разбавленных кислот вместо концентрированных в коммерческих магазинах.
Поощряйте правильное обращение, гуманный уход и обращение с животными в классе и лаборатории. Ознакомьтесь с политикой совета по уходу за животными и использованием в классе.
Ознакомьтесь с политикой совета по уходу за животными и использованием в классе.
Учителя естественных наук, руководители отделов, директора и обученные хранители — единственные сотрудники, которые должны иметь ключевой доступ к лабораториям, подготовительным комнатам и складским помещениям. Не допускайте посторонних лиц в любые научные лаборатории, подготовительные комнаты или складские помещения, где существуют опасности, например, источники электроэнергии, опасные химические вещества и сложное оборудование. OSHA считает научные лаборатории, подготовительные комнаты и складские помещения охраняемыми территориями.
- Игра с лошадьми или другое ненадлежащее поведение в лаборатории запрещено.
- Проинструктируйте студентов никогда не пробовать химикаты или другие лабораторные материалы.
- Проинструктируйте студентов никогда не вдыхать пары, образующиеся во время занятия или эксперимента.
 Используйте «тест на волну» только при необходимости и под руководством учителя.
Используйте «тест на волну» только при необходимости и под руководством учителя. - Попросите учащихся проводить только эксперименты, разрешенные учителем.
- Напомните студентам никогда не делать в лаборатории ничего, что не требуется в лабораторных процедурах.
- Попросите учащихся следовать всем письменным и устным инструкциям.
- Напомните ученикам, что несанкционированные эксперименты запрещены.
- Попросите учеников немедленно сообщать учителю о любом несчастном случае или травме, каким бы простым это ни казалось.
- Проинструктируйте студентов никогда не возвращать неиспользованные химикаты в их оригинальные контейнеры.
- Напомните ученикам, что никогда не вынимайте из лаборатории какие-либо материалы без разрешения учителя.
- Напомните учащимся никогда не работать в лаборатории без учителя.
Для работы с небольшими разливами в лаборатории должна быть доступна тележка для разлива химикатов. Крупные разливы и утечки требуют эвакуации и немедленного контакта с командой местной пожарной охраны. Все номера экстренных служб должны быть размещены в каждой лаборатории с прямой связью с фронт-офисом по телефону или внутренней связи.Наборы для сбора разливов могут быть изготовлены собственными силами или обеспечены коммерческой лабораторией.
Крупные разливы и утечки требуют эвакуации и немедленного контакта с командой местной пожарной охраны. Все номера экстренных служб должны быть размещены в каждой лаборатории с прямой связью с фронт-офисом по телефону или внутренней связи.Наборы для сбора разливов могут быть изготовлены собственными силами или обеспечены коммерческой лабораторией.
Наборы для разлива должны включать:
- Подушки для предотвращения разлива.
- Нейтрализаторы кислотных разливов (гидрокарбонат натрия).
- Нейтрализаторы разливов щелочей (гидросульфат натрия).
- Поднимите оборудование, такое как щетка, метла, ведро, поддон для пыли.
- Средства индивидуальной защиты.
- Инертные абсорбенты, такие как песок или наполнитель для кошачьего туалета.
- Химические склады являются охраняемыми территориями и должны храниться под замком с ограниченным доступом для соответствующего сертифицированного научного персонала и парапрофессионалов.

- Стеллажи должны быть изготовлены из обработанного дерева или другого химически стойкого материала с передней кромкой примерно 0,75 дюйма (1,9 см) в высоту.
- Химические вещества нельзя хранить в алфавитном порядке. Например, уксусная кислота и ацетельегид (ацетальдегид) могут быть соседними соседями на полке и несовместимой парой.
- Легковоспламеняющиеся жидкости следует хранить в шкафах для хранения легковоспламеняющихся жидкостей.
- Легковоспламеняющиеся и горючие шкафы не должны вентилироваться напрямую. Вентиляция этих шкафов не рекомендуется и не требуется, за исключением борьбы с неприятным запахом материалов. Отверстия в нижней и верхней части шкафов должны быть закрыты заглушками, входящими в комплект поставки шкафа. Если необходимо вентилировать шкафы, стравите воздух через нижние отверстия, а подпиточный воздух — через верхние отверстия (NFPA 30, 4-3.2).
- Коррозионные химикаты, такие как кислоты и щелочи, следует хранить в отдельных соответствующих шкафах для хранения химикатов.
 Храните агрессивные жидкости и твердые вещества в отдельных шкафах.
Храните агрессивные жидкости и твердые вещества в отдельных шкафах. - Азотную кислоту следует хранить отдельно от уксусной кислоты в отдельном шкафу.
- Металлы лития, калия и натрия нельзя хранить или использовать в научных лабораториях средней школы.
- Все химические вещества, образующие пероксид (например, этиловый эфир), не следует хранить или использовать в научных лабораториях средней школы.
- Тяжелые предметы следует хранить на нижних полках.
- Никогда не храните емкости с химикатами на полу.
- Зоны хранения химикатов должны быть сухими и при температуре от 50 до 80 градусов по Фаренгейту.
- Хранилище химикатов должно храниться в соответствии с системой совместимости и использования, а не только за закрытыми дверями и шкафами.
- Химические вещества можно разделить на органические и неорганические семейства, а затем на совместимые и родственные группы.
 Совместимые группы можно разделить с помощью разных полок. Храните химические вещества только в алфавитном порядке в пределах связанной и совместимой группы.
Совместимые группы можно разделить с помощью разных полок. Храните химические вещества только в алфавитном порядке в пределах связанной и совместимой группы.
Примеры связанных и совместимых групп хранения (примеры не обязательно рекомендуются для использования в средней школе):
- Неорганическое семейство
- Металлы, гидриды
- Галогениды, сульфаты, сульфиты, тиосульфаты, фосфаты
- Нитраты (кроме нитрата аммония), нитриты
- Гидроксиды, оксиды, силикаты, карбонаты, углерод
- Сульфиды, селениды, фосфиды
- Хлораты, хлориты, перекись водорода
- Бораты, манганаты
- Кислоты неорганические прочие (кроме азотной)
- Сера фосфат
- Органическое семейство
- Кислоты, ангидриды, перкислоты
- Спирты, гликоли
- Углеводороды, сложные эфиры, альдегиды
- Эпоксидные компаунды
- Сульфиды, нитриты
- Фенолы
Примечание. Предлагаемые группы хранения указаны только для модели.Не поощряется использование наиболее опасных химических веществ на уровне средней школы, например солей свинца и ртути, изоцианатов, арсенатов, цианидов, цианатов и других.
Предлагаемые группы хранения указаны только для модели.Не поощряется использование наиболее опасных химических веществ на уровне средней школы, например солей свинца и ртути, изоцианатов, арсенатов, цианидов, цианатов и других.
Следующие химические вещества следует рассматривать для использования в практических научных программах средней школы. Однако, как и со всеми химическими веществами, учитель обязан знать характер каждого химического вещества или соединения, просматривая и применяя информацию из Паспорта безопасности материала. Соответствующие меры предосторожности, СИЗ, вентиляция и т. Д., являются абсолютной необходимостью для безопасного использования всех химикатов. Обратите внимание, что в этом кратком списке представлены наиболее распространенные типы. Есть и другие химические вещества, которые можно считать безопасными. Перед использованием необходимо ознакомиться с MSDS. Также обратите внимание, что все перечисленные кислоты и основания находятся в разбавленной, а не в концентрированной форме.
A. Используемые химические вещества:
- Уголь активированный (уголь)
- Алка-Зельцер таблетки
- Квасцы (несколько соединений, содержащих алюминий и сульфат)
- Фольга алюминиевая (металлический алюминий)
- Аммиачная вода (гидроксид аммония)
- Разрыхлитель (сульфат натрия и алюминия)
- Пищевая сода (бикарбонат натрия)
- Свекольный или тростниковый сахар (сахароза)
- Бура (борат натрия)
- Кислота борная (борная кислота)
- Соль хлорида кальция (хлорид кальция)
- Мел (хлорид кальция)
- Клубная газировка (углекислота)
- Медная проволока (медь металлическая)
- Кукурузный крахмал
- Масло хлопковое
- Винный камень (битартрат калия)
- Спирт денатурированный (этанол)
- Соль Эпсома (сульфат магния)
- Цветы серы (серы)
- Сахар фруктовый (фруктоза)
- Виноградный или кукурузный сахар (глюкоза)
- Глицерин (глицерин)
- Графит (углерод)
- Раствор перекиси водорода (перекись водорода)
- Железные опилки (железо металлическое)
- Оливковое масло
- Гипс Парижский (сульфат кальция)
- Медицинский спирт (пропанол 2)
- Соль (хлорид натрия)
- Соль поваренная (хлорид натрия)
- Сахар столовый (сахароза)
- Уксус (уксусная кислота)
- Витамин С (аскорбиновая кислота)
Б. Не использовать химикаты:
Не использовать химикаты:
В следующем списке представлены общие химические вещества, которые могут быть найдены в научных лабораториях или кладовых средних школ и должны быть удалены из-за их опасного характера. Помните, что любое химическое вещество может считаться опасным, если не используется надлежащим образом. Опять же, обратитесь к паспорту безопасности материалов для получения дополнительной информации.
Не носите свободную / мешковатую одежду или свисающие украшения. Они представляют угрозу безопасности в лаборатории. Убедитесь, что длинные волосы собраны за ушами.Акриловые ногти легко воспламеняются и не должны подвергаться воздействию в лаборатории.
При работе с криогенными или очень горячими материалами используйте средства тепловой защиты, такие как предохранительные щипцы, рукавицы, фартуки и резиновые перчатки.
Обесточивайте все оборудование при выходе из лаборатории. Примеры включают отключение оборудования (например, микроскопов), перекрытие газовых клапанов (используйте главный выключатель газа) и перекрытие всех водопроводных кранов.
Примеры включают отключение оборудования (например, микроскопов), перекрытие газовых клапанов (используйте главный выключатель газа) и перекрытие всех водопроводных кранов.
Установить, установить вывески и потренироваться в учениях по эвакуации из лабораторий в соответствии с правилами NFPA и OSHA в случае пожара или других инцидентов. Во время эвакуации следует отключить газ и электричество.
Не загораживайте все выходы и оборудование для обеспечения безопасности. В коридорах нельзя хранить материалы.
Установки для промывки глаз следует промывать примерно три минуты в неделю, как рекомендовано Национальным советом безопасности и ANSI (Z358.1 Оборудование для аварийной промывки глаз и душа). На устройстве требуется журнал регистрации промывок / проверок.
Аптечки первой помощи должны быть доступны в каждой лаборатории вместе с письменным номером телефона кабинета школьной медсестры для оказания медицинской помощи в случае инцидента. Ознакомьтесь с политикой совета по образованию в отношении сотрудников, оказывающих первую помощь.
Ознакомьтесь с политикой совета по образованию в отношении сотрудников, оказывающих первую помощь.
Еда, питье и использование косметических средств запрещены в зонах хранения или использования опасных химикатов или биологически опасных веществ.
Будьте осторожны, вставляя и снимая стеклянные трубки с резиновых пробок. Смажьте стеклянную посуду (трубки, термометры и т. Д.), Прежде чем пытаться вставить ее в пробку. Защищайте руки полотенцами или перчатками, вставляя стеклянную трубку в резиновую пробку или вынимая ее из резиновой пробки.
Стеклянную посуду с сколами, трещинами или царапинами нельзя использовать в лаборатории.
Разбитая посуда: Разбитая стеклянная посуда должна быть помещена в ящик или жесткий пластиковый контейнер с пластиковым вкладышем.Включите соответствующие вывески.
Всегда используйте подставки для сушки стекла, чтобы поддерживать стеклянную посуду при сушке.
Никогда не оставляйте активную горелку без присмотра. Никогда не оставляйте без присмотра все, что нагревается или реагирует. Не забывайте выключать конфорку или плиту, когда они не используются. Не забудьте дать горячим предметам время остыть, прежде чем брать их в руки. В противном случае используйте защитные перчатки и оборудование (щипцы и т. Д.).
Рабочие зоны всегда должны содержаться в чистоте.Студенты должны использовать только лабораторные инструкции, рабочие листы и необходимое оборудование в рабочей зоне. Другие материалы, такие как рюкзаки, книги, кошельки и куртки, следует хранить в классной комнате или в шкафчиках. Порядок требуется в научных лабораториях по стандарту ведения хозяйства OSHA.
Программа экологической очистки и лабораторные приложения:
С 1 июля 2011 года каждый местный и региональный совет по образованию в Коннектикуте должен внедрить программу экологической уборки для уборки (Закон о замещающем доме №6496 Государственный закон № 09-81 2 из 7) и ремонт школьных зданий и сооружений в его районе. Никто не должен использовать чистящие средства в школе, если такие чистящие средства не соответствуют руководящим принципам или экологическим стандартам, установленным национальной или международной программой экологической сертификации, утвержденной Департаментом административных служб после консультации с Уполномоченным по охране окружающей среды. Такой чистящий продукт должен в максимально возможной степени минимизировать потенциальное вредное воздействие на здоровье человека и окружающую среду.(c) 1 апреля 2010 г. или до этой даты Департамент образования по согласованию с Департаментом общественного здравоохранения внесет поправки в форму опроса в школьных учреждениях, включив в нее вопросы, касающиеся поэтапного внедрения программ экологической очистки в школах. (d) 1 октября 2010 г. или ранее, а затем ежегодно каждый местный и региональный совет по образованию должен предоставить персоналу каждой школы и, по запросу, родителям и опекунам каждого ребенка, зачисленного в каждую школу, письменное заявление о том, что программа экологической чистки школьного округа.
Никто не должен использовать чистящие средства в школе, если такие чистящие средства не соответствуют руководящим принципам или экологическим стандартам, установленным национальной или международной программой экологической сертификации, утвержденной Департаментом административных служб после консультации с Уполномоченным по охране окружающей среды. Такой чистящий продукт должен в максимально возможной степени минимизировать потенциальное вредное воздействие на здоровье человека и окружающую среду.(c) 1 апреля 2010 г. или до этой даты Департамент образования по согласованию с Департаментом общественного здравоохранения внесет поправки в форму опроса в школьных учреждениях, включив в нее вопросы, касающиеся поэтапного внедрения программ экологической очистки в школах. (d) 1 октября 2010 г. или ранее, а затем ежегодно каждый местный и региональный совет по образованию должен предоставить персоналу каждой школы и, по запросу, родителям и опекунам каждого ребенка, зачисленного в каждую школу, письменное заявление о том, что программа экологической чистки школьного округа. Такое уведомление должно включать (1) типы и названия экологически предпочтительных чистящих средств, применяемых в школах, (2) место применения таких чистящих средств в школьных зданиях и помещениях, (3) график использования таких чистящих средств. применяется в школьных зданиях и помещениях, (4) утверждение: «Ни один родитель, опекун, учитель или сотрудник не может приносить в школьное учреждение какие-либо потребительские товары, предназначенные для очистки, дезодорации, дезинфекции или дезинфекции.», и (5) имя школьного администратора или назначенного лица, с которым можно связаться для получения дополнительной информации. Такое уведомление должно быть направлено родителям или опекунам любого ребенка, который переводится в школу в течение учебного года, и персоналу нанят в течение учебного года. Каждый местный или региональный совет по вопросам образования должен сделать такое уведомление, а также отчет, представленный в Министерство образования в соответствии с подразделом (а) раздела 10-220.
Такое уведомление должно включать (1) типы и названия экологически предпочтительных чистящих средств, применяемых в школах, (2) место применения таких чистящих средств в школьных зданиях и помещениях, (3) график использования таких чистящих средств. применяется в школьных зданиях и помещениях, (4) утверждение: «Ни один родитель, опекун, учитель или сотрудник не может приносить в школьное учреждение какие-либо потребительские товары, предназначенные для очистки, дезодорации, дезинфекции или дезинфекции.», и (5) имя школьного администратора или назначенного лица, с которым можно связаться для получения дополнительной информации. Такое уведомление должно быть направлено родителям или опекунам любого ребенка, который переводится в школу в течение учебного года, и персоналу нанят в течение учебного года. Каждый местный или региональный совет по вопросам образования должен сделать такое уведомление, а также отчет, представленный в Министерство образования в соответствии с подразделом (а) раздела 10-220.
Сюда входят очистители для стекол, очистители для рук, очистители общего назначения и многое другое.Зеленые чистящие средства не содержат отдушек, содержат мало летучих органических соединений или летучих органических соединений, хорошо работают и оказывают минимальное воздействие на здоровье.
Научные лаборатории — это убежище для биологических (плесень, плесень, бактерии, шерсть животных и т. Д.) И физических (твердые частицы, химические пары и т. Д.). В духе устава учителя естественных наук в средней школе должны работать с опекунами, чтобы перейти на использование более экологичных чистящих средств. Что касается учебной программы по естествознанию, необходимо сделать более совершенный выбор в отношении более безопасных альтернатив опасным лабораторным химическим веществам, а также принять подход микрохимии.
Инициатива зеленых школ и Институт зеленых закупок рекомендуют следующий подход (Green Schools.Net — Лучшие методы дезинфекции):
Сначала очистите: дезинфицирующие и дезинфицирующие средства не проникают эффективно через барьер грязи / микробов. Перед нанесением дезинфицирующих или дезинфицирующих средств поверхности следует тщательно вымыть водой с мылом или другим чистящим средством, если возможно.
Перед нанесением дезинфицирующих или дезинфицирующих средств поверхности следует тщательно вымыть водой с мылом или другим чистящим средством, если возможно.
Определите, где и когда необходимы дезинфицирующие средства: используйте дезинфицирующие средства низкого уровня на поверхностях в лаборатории, к которым руки напрямую прикасаются — на скамьях, раковинах, кранах и т.Если происходит инцидент, приводящий к образованию крови или других потенциально инфекционных материалов (OPIM), следует использовать дезинфицирующее средство высокого уровня.
Следуйте инструкциям производителя относительно надлежащего разбавления, нанесения и промывки, а также времени выдержки: дезинфицирующие средства должны пропитать поверхность обычно на 1-10 минут «времени выдержки», чтобы быть эффективными. Проверьте этикетку производителя!
Тщательно выбирайте противомикробные препараты: школьные округа могут определить эффективность продукта, изучив информацию на этикетке продукта, а также регистрационную информацию, хранящуюся в файле в Агентстве по охране окружающей среды США. Школьные округа должны избегать продуктов, содержащих орто-фенилфенол, и минимизировать использование хлорных отбеливателей, четвертичных аммониевых соединений («четвертичных аммония») и соснового масла, поскольку известно, что эти «активные ингредиенты» вызывают астму, тяжелые респираторные эффекты и другие серьезные риски для здоровья. Вместо этого поищите безопасные для астмы дезинфицирующие и дезинфицирующие средства, которые используют перекись водорода, лимонную кислоту и масло тимьяна для уничтожения бактерий, вирусов и других организмов.
Школьные округа должны избегать продуктов, содержащих орто-фенилфенол, и минимизировать использование хлорных отбеливателей, четвертичных аммониевых соединений («четвертичных аммония») и соснового масла, поскольку известно, что эти «активные ингредиенты» вызывают астму, тяжелые респираторные эффекты и другие серьезные риски для здоровья. Вместо этого поищите безопасные для астмы дезинфицирующие и дезинфицирующие средства, которые используют перекись водорода, лимонную кислоту и масло тимьяна для уничтожения бактерий, вирусов и других организмов.
Рассмотрите возможность перехода на безопасные для астмы дезинфицирующие и дезинфицирующие средства: загрузите Справочник безопасных для астмы дезинфицирующих и дезинфицирующих средств, в котором содержится подробная информация о некоторых безопасных для астмы дезинфицирующих и дезинфицирующих средствах.
Необходимо соблюдать личную гигиену до и после лабораторных работ путем мытья рук водой с мылом.
В лабораториях, помещениях для подготовки и в зонах хранения химикатов должен быть размещен алмаз NFPA с наивысшим рейтингом опасности химикатов в помещении.
Убедитесь, что у вас есть полный и актуальный перечень химических веществ, основанный на стандарте OSHA HazCom.Предлагается следующая информация: название химического вещества, место хранения, дата покупки и количество в наличии. OSHA требует только идентификационного имени, указанного в паспорте безопасности материалов, или общего наименования / торгового наименования. Информация об опасностях не требуется в инвентаризации, потому что сотрудник может получить эту информацию из MSDS. Инвентаризация должна быть постоянной и актуальной.
Маркировка обязательна для всех контейнеров с химическими веществами. Все этикетки должны быть разборчивыми, на английском языке и содержать название химического вещества / продукта. Химическая информация, относящаяся к соответствующим опасностям, также должна быть очевидной. Все химические вещества должны иметь маркированные контейнеры с соответствующей информацией, например, идентификатор продукта
Химическая информация, относящаяся к соответствующим опасностям, также должна быть очевидной. Все химические вещества должны иметь маркированные контейнеры с соответствующей информацией, например, идентификатор продукта
Идентификатор поставщика, Идентификационные данные химического вещества, Пиктограммы опасности, Сигнальные слова, Краткая характеристика опасности и Информация о мерах предосторожности.
Кроме того, в обновленном OSHA HazCom 2012 года отмечается следующее относительно маркировки:
- 1910.1200 (f) (6) Маркировка рабочего места. За исключением случаев, предусмотренных в параграфах (f) (7) и (f) (8) этого раздела, работодатель должен гарантировать, что каждый контейнер с опасными химическими веществами на рабочем месте промаркирован, снабжен этикеткой или маркировкой:
- 1910.1200 (f) (6) (i) Информация, указанная в пунктах (f) (1) (i) — (v) этого раздела для этикеток на отправленных контейнерах;
- или, 1910.
 1200 (f) (6) (ii) Идентификатор продукта и слова, изображения, символы или их комбинации, которые предоставляют по крайней мере общую информацию об опасностях химических веществ и которые в сочетании с другой доступной немедленно сотрудникам, участвующим в программе информирования об опасности, предоставит сотрудникам конкретную информацию о физических опасностях и опасности для здоровья, связанных с опасным химическим веществом.
1200 (f) (6) (ii) Идентификатор продукта и слова, изображения, символы или их комбинации, которые предоставляют по крайней мере общую информацию об опасностях химических веществ и которые в сочетании с другой доступной немедленно сотрудникам, участвующим в программе информирования об опасности, предоставит сотрудникам конкретную информацию о физических опасностях и опасности для здоровья, связанных с опасным химическим веществом. - 1910.1200 (f) (8) Работодатель не обязан маркировать переносные контейнеры, в которые опасные химические вещества переносятся из контейнеров с этикетками и которые предназначены только для непосредственного использования сотрудником, выполняющим перенос.
Однако в лаборатории средней школы все переносные контейнеры должны иметь маркировку. В случае инцидента, связанного с безопасностью, очень важно знать, с каким опасным химическим веществом работали в лаборатории или помещении для подготовки.
для всех опасных химикатов должен храниться в легко доступном для сотрудников месте. Для облегчения доступа во время неотложной медицинской помощи или происшествий, связанных с безопасностью, в лаборатории должен быть вывешен паспорт безопасности химикатов, используемых в определенный день. В рамках подготовки к эксперименту в лаборатории по безопасности все соответствующие паспорта безопасности должны быть рассмотрены со студентами. Паспорта безопасности должны храниться работодателем не менее 30 лет. Компьютерные терминалы или факсимильные аппараты, которые позволяют сотрудникам читать и ссылаться на паспорт безопасности данных, разрешается хранить на рабочем месте вместо бумажных копий при отсутствии препятствий для доступа.
Для облегчения доступа во время неотложной медицинской помощи или происшествий, связанных с безопасностью, в лаборатории должен быть вывешен паспорт безопасности химикатов, используемых в определенный день. В рамках подготовки к эксперименту в лаборатории по безопасности все соответствующие паспорта безопасности должны быть рассмотрены со студентами. Паспорта безопасности должны храниться работодателем не менее 30 лет. Компьютерные терминалы или факсимильные аппараты, которые позволяют сотрудникам читать и ссылаться на паспорт безопасности данных, разрешается хранить на рабочем месте вместо бумажных копий при отсутствии препятствий для доступа.
Требуется список опасных химических веществ, о которых известно, что они присутствуют, используя идентификационные данные, которые указаны в соответствующем паспорте безопасности материалов (список может быть составлен для рабочего места в целом или для отдельных рабочих зон). [1910.1200 (e) (1) (i)]
Микроволновые печи используются для медико-биологической деятельности, например, для нагрева воды. Никогда не используйте емкости с крышками в микроволновой печи. Никогда не помещайте в микроволновую печь металлические предметы, алюминиевую фольгу или металлические кастрюли.Студенты должны быть проинструктированы по их правильному использованию. Лица, у которых есть кардиостимуляторы, не должны работать рядом с микроволновой печью. Над дверью лаборатории следует вывесить надлежащие вывески, предупреждающие об использовании микроволновой печи.
Никогда не используйте емкости с крышками в микроволновой печи. Никогда не помещайте в микроволновую печь металлические предметы, алюминиевую фольгу или металлические кастрюли.Студенты должны быть проинструктированы по их правильному использованию. Лица, у которых есть кардиостимуляторы, не должны работать рядом с микроволновой печью. Над дверью лаборатории следует вывесить надлежащие вывески, предупреждающие об использовании микроволновой печи.
Убедитесь, что используются соответствующие средства индивидуальной защиты, например, перчатки, фартук, очки для защиты от брызг химикатов (защитные очки от снарядов, твердых частиц), средства защиты ног с закрытым носком.
При наполнении пипеток используйте вакуумную грушу, а не ротовую.
Проведите эксперименты или демонстрации перед тем, как поручить задание учащимся. Дайте учащимся устные и письменные инструкции по технике безопасности.
Дайте учащимся устные и письменные инструкции по технике безопасности.
Расходные продукты нельзя помещать в тот же холодильник, что и химикаты или биологически опасные материалы. Холодильники, используемые для нерасходуемых материалов, должны иметь маркировку «Не предназначено для потребления человеком». Используйте соответствующие вывески на дверях холодильников обоих типов.
Учителя естественных наук должны проявлять бдительность при проведении проверок безопасности в лаборатории. Сообщайте о любых существующих и потенциально опасных нарушениях техники безопасности научному руководителю и директору в письменной форме. Не занимайтесь научной деятельностью без соответствующего и работающего оборудования для обеспечения безопасности.
Правила безопасности должны быть вывешены на видном месте.
- Никогда не оставляйте учащихся без присмотра в лаборатории или классе естественных наук.

- Студенты должны прочитать и подписать контракты о лабораторной безопасности перед выполнением любых лабораторных работ.
- Преподаватель вместе со студентами должен изучить правила техники безопасности до начала лабораторных работ.
- Примите меры для обеспечения подотчетности учащихся, например, тестирование процедур безопасности.
- Никогда не пропускайте никаких нарушений техники безопасности. Необходим непосредственный контроль вмешательства учителя / ученика.
- Задокументируйте все инициативы по планированию безопасности в книге планов.
- Обучить студентов правильному использованию всего защитного снаряжения.
Булавки, ножи, игольчатые зонды и ножницы следует использовать с особой осторожностью. Выбрасываемые острые предметы следует помещать в отдельный жесткий контейнер с надписью «ТОЛЬКО ОСТРЫЕ».
Установите / повесьте соответствующие вывески на следующих объектах: выходы, станция для промывки глаз, противопожарное одеяло, огнетушитель, дезинфицирующее средство для очков, основные запорные устройства, аварийный душ, комплекты для разливов и контейнеры для отходов.
Утилизируйте все химические отходы должным образом, как указано учителем или MSDS. Ни в коем случае нельзя смешивать химические вещества в стоках раковин. Раковины следует использовать только для воды и тех растворов, которые указаны инструктором. Твердые химикаты, фильтровальная бумага, спички и все другие нерастворимые материалы следует утилизировать в надлежащим образом промаркированных контейнерах для отходов. Треснувшее или битое стекло следует поместить в специальный контейнер для «Битого стекла.«
Удаление отходов или предметов, подлежащих переработке, должно производиться ежегодно. Необходимо соответствующее хранение и маркировка.
C. Требования к средствам индивидуальной защиты (СИЗ):
% PDF-1.4
%
463 0 объект
>
endobj
xref
463 189
0000000016 00000 н.
0000004150 00000 н. 0000004391 00000 п.
0000004546 00000 н.
0000004610 00000 н.
0000006422 00000 н.
0000006641 00000 н.
0000006725 00000 н.
0000006814 00000 н.
0000006928 00000 н.
0000007081 00000 п.
0000007142 00000 п.
0000007246 00000 н.
0000007306 00000 н.
0000007473 00000 н.
0000007694 00000 н.
0000007755 00000 н.
0000007849 00000 н.
0000007939 00000 п.
0000008117 00000 н.
0000008300 00000 н.
0000008361 00000 п.
0000008453 00000 п.
0000008542 00000 н.
0000008651 00000 п.
0000008712 00000 н.
0000008844 00000 н.
0000008905 00000 н.
0000009055 00000 н.
0000009116 00000 п.
0000009177 00000 н.
0000009238 00000 п.
0000009299 00000 н.
0000009393 00000 п.
0000009484 00000 н.
0000009589 00000 н.
0000009650 00000 н.
0000009803 00000 п.
0000009864 00000 н.
0000009925 00000 н.
0000009986 00000 н.
0000010100 00000 п.
0000010161 00000 п.
0000010280 00000 п.
0000010341 00000 п.
0000010451 00000 п.
0000010512 00000 п.
0000010573 00000 п.
0000010634 00000 п.
0000010695 00000 п.
0000004391 00000 п.
0000004546 00000 н.
0000004610 00000 н.
0000006422 00000 н.
0000006641 00000 н.
0000006725 00000 н.
0000006814 00000 н.
0000006928 00000 н.
0000007081 00000 п.
0000007142 00000 п.
0000007246 00000 н.
0000007306 00000 н.
0000007473 00000 н.
0000007694 00000 н.
0000007755 00000 н.
0000007849 00000 н.
0000007939 00000 п.
0000008117 00000 н.
0000008300 00000 н.
0000008361 00000 п.
0000008453 00000 п.
0000008542 00000 н.
0000008651 00000 п.
0000008712 00000 н.
0000008844 00000 н.
0000008905 00000 н.
0000009055 00000 н.
0000009116 00000 п.
0000009177 00000 н.
0000009238 00000 п.
0000009299 00000 н.
0000009393 00000 п.
0000009484 00000 н.
0000009589 00000 н.
0000009650 00000 н.
0000009803 00000 п.
0000009864 00000 н.
0000009925 00000 н.
0000009986 00000 н.
0000010100 00000 п.
0000010161 00000 п.
0000010280 00000 п.
0000010341 00000 п.
0000010451 00000 п.
0000010512 00000 п.
0000010573 00000 п.
0000010634 00000 п.
0000010695 00000 п. 0000010789 00000 п.
0000010878 00000 п.
0000010986 00000 п.
0000011047 00000 п.
0000011199 00000 п.
0000011260 00000 п.
0000011377 00000 п.
0000011438 00000 п.
0000011555 00000 п.
0000011616 00000 п.
0000011737 00000 п.
0000011798 00000 п.
0000011904 00000 п.
0000011965 00000 п.
0000012108 00000 п.
0000012169 00000 п.
0000012289 00000 п.
0000012350 00000 п.
0000012463 00000 п.
0000012524 00000 п.
0000012653 00000 п.
0000012714 00000 п.
0000012845 00000 п.
0000012906 00000 п.
0000013016 00000 п.
0000013077 00000 п.
0000013195 00000 п.
0000013256 00000 п.
0000013387 00000 п.
0000013448 00000 п.
0000013577 00000 п.
0000013638 00000 п.
0000013699 00000 п.
0000013760 00000 п.
0000013870 00000 п.
0000013930 00000 п.
0000014046 00000 п.
0000014106 00000 п.
0000014230 00000 п.
0000014290 00000 п.
0000014440 00000 п.
0000014500 00000 п.
0000014608 00000 п.
0000014721 00000 п.
0000014885 00000 п.
0000014945 00000 п.
0000015044 00000 п.
0000015142 00000 п.
0000010789 00000 п.
0000010878 00000 п.
0000010986 00000 п.
0000011047 00000 п.
0000011199 00000 п.
0000011260 00000 п.
0000011377 00000 п.
0000011438 00000 п.
0000011555 00000 п.
0000011616 00000 п.
0000011737 00000 п.
0000011798 00000 п.
0000011904 00000 п.
0000011965 00000 п.
0000012108 00000 п.
0000012169 00000 п.
0000012289 00000 п.
0000012350 00000 п.
0000012463 00000 п.
0000012524 00000 п.
0000012653 00000 п.
0000012714 00000 п.
0000012845 00000 п.
0000012906 00000 п.
0000013016 00000 п.
0000013077 00000 п.
0000013195 00000 п.
0000013256 00000 п.
0000013387 00000 п.
0000013448 00000 п.
0000013577 00000 п.
0000013638 00000 п.
0000013699 00000 п.
0000013760 00000 п.
0000013870 00000 п.
0000013930 00000 п.
0000014046 00000 п.
0000014106 00000 п.
0000014230 00000 п.
0000014290 00000 п.
0000014440 00000 п.
0000014500 00000 п.
0000014608 00000 п.
0000014721 00000 п.
0000014885 00000 п.
0000014945 00000 п.
0000015044 00000 п.
0000015142 00000 п. 0000015303 00000 п.
0000015363 00000 п.
0000015481 00000 п.
0000015584 00000 п.
0000015732 00000 п.
0000015792 00000 п.
0000015852 00000 п.
0000016008 00000 п.
0000016137 00000 п.
0000016245 00000 п.
0000016352 00000 п.
0000016412 00000 п.
0000016558 00000 п.
0000016618 00000 п.
0000016678 00000 п.
0000016738 00000 п.
0000016830 00000 п.
0000016920 00000 н.
0000017084 00000 п.
0000017144 00000 п.
0000017252 00000 п.
0000017361 00000 п.
0000017511 00000 п.
0000017571 00000 п.
0000017678 00000 п.
0000017803 00000 п.
0000017906 00000 п.
0000017966 00000 п.
0000018069 00000 п.
0000018129 00000 п.
0000018188 00000 п.
0000018328 00000 п.
0000018388 00000 п.
0000018516 00000 п.
0000018576 00000 п.
0000018636 00000 п.
0000018696 00000 п.
0000018819 00000 п.
0000018879 00000 п.
0000019000 00000 н.
0000019060 00000 п.
0000019181 00000 п.
0000019241 00000 п.
0000019365 00000 п.
0000019425 00000 п.
0000019541 00000 п.
0000019601 00000 п.
0000019719 00000 п.
0000015303 00000 п.
0000015363 00000 п.
0000015481 00000 п.
0000015584 00000 п.
0000015732 00000 п.
0000015792 00000 п.
0000015852 00000 п.
0000016008 00000 п.
0000016137 00000 п.
0000016245 00000 п.
0000016352 00000 п.
0000016412 00000 п.
0000016558 00000 п.
0000016618 00000 п.
0000016678 00000 п.
0000016738 00000 п.
0000016830 00000 п.
0000016920 00000 н.
0000017084 00000 п.
0000017144 00000 п.
0000017252 00000 п.
0000017361 00000 п.
0000017511 00000 п.
0000017571 00000 п.
0000017678 00000 п.
0000017803 00000 п.
0000017906 00000 п.
0000017966 00000 п.
0000018069 00000 п.
0000018129 00000 п.
0000018188 00000 п.
0000018328 00000 п.
0000018388 00000 п.
0000018516 00000 п.
0000018576 00000 п.
0000018636 00000 п.
0000018696 00000 п.
0000018819 00000 п.
0000018879 00000 п.
0000019000 00000 н.
0000019060 00000 п.
0000019181 00000 п.
0000019241 00000 п.
0000019365 00000 п.
0000019425 00000 п.
0000019541 00000 п.
0000019601 00000 п.
0000019719 00000 п. 0000019779 00000 п.
0000019839 00000 п.
0000019899 00000 п.
0000020015 00000 н.
0000020075 00000 п.
0000020135 00000 п.
0000020195 00000 п.
0000020255 00000 п.
0000020315 00000 п.
0000020375 00000 п.
0000020499 00000 н.
0000020606 00000 п.
0000020666 00000 п.
0000020726 00000 п.
0000020786 00000 п.
0000020913 00000 п.
0000020973 00000 п.
0000021033 00000 п.
0000021093 00000 п.
0000021154 00000 п.
0000025060 00000 п.
0000027972 00000 н.
0000028092 00000 п.
0000028212 00000 п.
0000028427 00000 п.
0000028468 00000 п.
0000028748 00000 п.
0000028978 00000 п.
0000029466 00000 п.
0000029680 00000 п.
0000029914 00000 н.
0000030323 00000 п.
0000030543 00000 п.
0000031118 00000 п.
0000031342 00000 п.
0000034021 00000 п.
0000043171 00000 п.
0000043296 00000 п.
0000051680 00000 п.
0000071579 00000 п.
0000083963 00000 п.
0000004762 00000 н.
0000006399 00000 н.
трейлер
]
>>
startxref
0
%% EOF
464 0 объект
>
endobj
465 0 объект
5] zT8J˳9 Втѯ)
/ U (0: ‘gp, «G \) ؿ \ nwA)
/ П -44
/ V 1
/ Длина 40
>>
endobj
466 0 объект
>
endobj
467 0 объект
> / Кодировка> >>
/ DA (=] \ n ֕ I)
>>
endobj
650 0 объект
>
транслировать
̊ |> + PygkEL (٩ (n
WZxKAf5X \% ûcn խ; nDͰcDRH: -ҘTmOR% g = Wү% V; 7jUrp¨Axw:,: \ n \ G «78: ‘u`l> P l [u2! ZT: r + 5 hU.
0000019779 00000 п.
0000019839 00000 п.
0000019899 00000 п.
0000020015 00000 н.
0000020075 00000 п.
0000020135 00000 п.
0000020195 00000 п.
0000020255 00000 п.
0000020315 00000 п.
0000020375 00000 п.
0000020499 00000 н.
0000020606 00000 п.
0000020666 00000 п.
0000020726 00000 п.
0000020786 00000 п.
0000020913 00000 п.
0000020973 00000 п.
0000021033 00000 п.
0000021093 00000 п.
0000021154 00000 п.
0000025060 00000 п.
0000027972 00000 н.
0000028092 00000 п.
0000028212 00000 п.
0000028427 00000 п.
0000028468 00000 п.
0000028748 00000 п.
0000028978 00000 п.
0000029466 00000 п.
0000029680 00000 п.
0000029914 00000 н.
0000030323 00000 п.
0000030543 00000 п.
0000031118 00000 п.
0000031342 00000 п.
0000034021 00000 п.
0000043171 00000 п.
0000043296 00000 п.
0000051680 00000 п.
0000071579 00000 п.
0000083963 00000 п.
0000004762 00000 н.
0000006399 00000 н.
трейлер
]
>>
startxref
0
%% EOF
464 0 объект
>
endobj
465 0 объект
5] zT8J˳9 Втѯ)
/ U (0: ‘gp, «G \) ؿ \ nwA)
/ П -44
/ V 1
/ Длина 40
>>
endobj
466 0 объект
>
endobj
467 0 объект
> / Кодировка> >>
/ DA (=] \ n ֕ I)
>>
endobj
650 0 объект
>
транслировать
̊ |> + PygkEL (٩ (n
WZxKAf5X \% ûcn խ; nDͰcDRH: -ҘTmOR% g = Wү% V; 7jUrp¨Axw:,: \ n \ G «78: ‘u`l> P l [u2! ZT: r + 5 hU. LwMp_¾FI
+ Ke ۽ uf9tġWr, 0 $ + 6,0Hb ؍
Икс
LwMp_¾FI
+ Ke ۽ uf9tġWr, 0 $ + 6,0Hb ؍
Икс
Закон Чарльза с утверждениями, уравнениями, графиками и примерами ~ ChemistryGod
Закон Чарльза также известен как закон объемов. Закон описывает соотношение между объемом и температурой газа. Это очень важный закон, изучаемый в химии и физике наряду с законом Бойля, законом Гей-Люссака и законом Авогадро.
Содержание
Заявление
Закон Чарльза гласит, что для фиксированного количества идеального газа его объем прямо пропорционален его температуре при постоянном давлении.
Уравнение
Уравнение закона: PV = k . Здесь k — постоянная.
История
Этот закон назван в честь французского ученого Жака Шарля. Жак Александр Сезар Шарль был ученым, изобретателем и воздухоплавателем.
Жак Шарль (1746–1823) Примерно в 1787 году Чарльз изучал поведение газов в зависимости от температуры. В своих экспериментах он заметил, что объем различных газов будет увеличиваться на равный объем при повышении температуры. Он провел свой эксперимент на пяти воздушных шарах. Когда температура воздушных шаров повысилась, объем каждого увеличился на равную величину. Но его открытие оставалось неизвестным миру, пока Жозеф Луи Гей-Люссак в 1802 году не опубликовал его. Гей-Люссак подтвердил и расширил результаты Шарля и приписал ему открытие.
Он провел свой эксперимент на пяти воздушных шарах. Когда температура воздушных шаров повысилась, объем каждого увеличился на равную величину. Но его открытие оставалось неизвестным миру, пока Жозеф Луи Гей-Люссак в 1802 году не опубликовал его. Гей-Люссак подтвердил и расширил результаты Шарля и приписал ему открытие.
Пояснение
Согласно закону, объем газа прямо пропорционален его температуре для фиксированного количества газа при постоянном давлении.Математически это выражение может быть выражено как:
Удалив пропорциональность,
Здесь k — константа пропорциональности, V — объем, а T — абсолютная температура.
Преобразование приведенного выше выражения,
Примечание. В приведенном выше выражении температура дана в абсолютной шкале (в кельвинах или градусах ранкина).
Приведенное выше выражение действительно для фиксированного количества газа и при постоянном давлении.Следовательно, при повышении температуры газ расширяется, а при понижении температуры газ сжимается. Мы также можем сделать вывод из приведенного выше уравнения, что отношение объема к абсолютной температуре не зависит от температуры или объема при постоянном давлении.
Мы также можем сделать вывод из приведенного выше уравнения, что отношение объема к абсолютной температуре не зависит от температуры или объема при постоянном давлении.
Иллюстрация: 1 Запечатанный шприц
Запечатанный шприц — классический пример закона Чарльза. Когда кончик шприца закрывается, газ внутри цилиндра изолируется. Таким образом, он действует как поршень.
Объем запечатанного шприца уменьшается, когда температура (термометр) уменьшается при постоянном давлении (манометр).Когда шприц погружается в ледяную воду, температура воздуха внутри шприца снижается. Следовательно, объем воздуха также уменьшается по закону. Давление остается постоянным, равным атмосферному давлению.
Мы можем видеть диаграмму выше, когда температура в термометре падает, поршень шприца перемещается внутрь, т.е. объем уменьшается. Это наблюдение при нанесении на график даст прямую линию, как указано выше. Запечатанный шприц следует закону Чарльза.
Иллюстрация 2: Гибкая камера
Рассмотрим закрытую камеру (рисунок ниже) с гибкими границами i. е. он может расширяться или сжиматься. На рисунке ниже изображены камера с поршнем на ней, водяная баня для нагрева камеры, источник электрического нагрева.
е. он может расширяться или сжиматься. На рисунке ниже изображены камера с поршнем на ней, водяная баня для нагрева камеры, источник электрического нагрева.
Когда воздух внутри камеры нагревается с помощью источника тепла через воду, температура воздуха увеличивается, т.е. увеличивается кинетическая энергия, связанная с молекулами воздуха. Это мгновенно увеличивает давление внутри камеры. Теперь молекулы воздуха оказывают большее усилие в направлении наружу на неподвижный поршень, и воздух внутри камеры расширяется.По той же аналогии, когда воздух охлаждается, объем воздуха сокращается. Следовательно, он подчиняется закону.
Для данного количества идеального газа V 1 , T 1 и V 2 , T 2 — это объемы и температуры условия 1 и условия 2 при постоянном давлении. . Из закона Чарльза,
Эта формула очень полезна. Мы можем рассчитать объем или температуру при любом неизвестном состоянии, если известны объем и температура при условии.
Пример 1
Заявление: Если абсолютная температура газа удваивается при постоянном давлении. Определите изменение громкости?
Решение: абсолютная температура газа увеличена вдвое. Таким образом, T 2 = 2 T 1 .
Согласно закону,
Подставляем T 2 = 2 T 1 ,
Таким образом, объем удваивается при удвоении температуры газа.
Пример 2:
Утверждение: Начальная и конечная температура неона составляет 289 К и 323 К. Найти начальный объем, если конечный объем составляет 2,3 л?
Решение: T 1 = 289 K, T 2 = 323 K, а V 2 = 2,3 л.
По закону
Таким образом, конечный объем равен 2.0 L.
Чтобы узнать больше, продолжайте читать дальше: Уравнение закона Чарльза »
Альтернативная версия закона Чарльза
Чарльз на основе своих экспериментов пришел к выводу, что при постоянном давлении объем фиксированного количества газа увеличивается или уменьшается на 1 ⁄ 273 (сейчас 1 ⁄ 273. 15 ), умноженный на объем при 0 ° C на каждый 1 ° C повышения или понижения температуры. Математически это утверждение может быть выражено следующим образом:
15 ), умноженный на объем при 0 ° C на каждый 1 ° C повышения или понижения температуры. Математически это утверждение может быть выражено следующим образом:
Здесь V — конечный объем или объем при T , V 0 — объем при 0 ° C, t — температура, выраженная в градусах Цельсия.
Преобразуя приведенное выше выражение,
Здесь T — температура в кельвинах, а T 0 — температура в кельвинах, равная 273.15 K.
Таким образом, из приведенного выше уравнения мы приходим к закону Чарльза,
закону Чарльза и абсолютному нулю
Согласно закону Чарльза, когда абсолютная температура приближается к нулю, объем газа должен приближаться к нулю. По словам Гей-Люссака, это могло произойти только в том случае, если газ был идеальным.
Продолжайте читать: Закон Карла и абсолютный ноль »
Графическое представление
Графическое представление закона Чарльза показано на графиках ниже.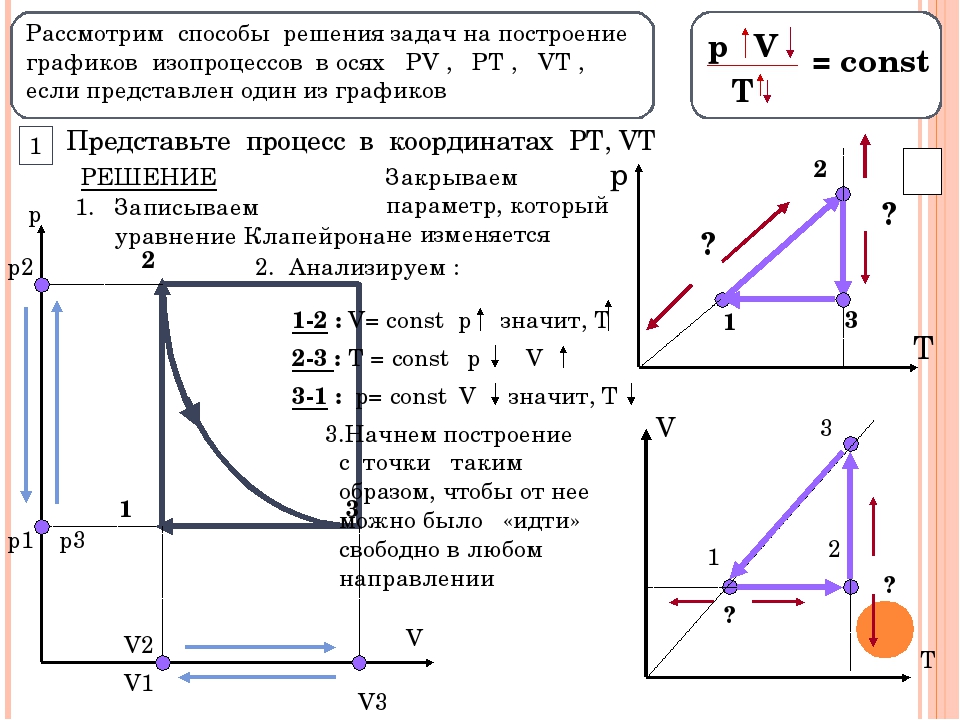
Из приведенного выше графика объем увеличивается линейно с увеличением температуры. Температура в абсолютной шкале. Также можно заметить, что когда температура приближается к нулю, объем также приближается к нулю. Все вышеуказанные четыре линии построены при постоянном давлении, то есть изобарических линий.
График зависимости объема от температуры (в ° C) представляет собой прямую линию с интервалом x -273.15 ° С.Вышеупомянутая линия построена с использованием следующего уравнения. Граница интервала x на приведенном выше рисунке составляет -273,15 ° C, а интервал y — В, 0 .
Продолжайте читать: Графики закона Чарльза »
Ограничения
Ограничения закона Чарльза следующие:
- Закон Чарльза применим только к идеальным газам.
- Закон Чарльза справедлив для реальных газов только при высоких температурах и низких давлениях.

- Связь между объемом и температурой не является линейной по природе при высоких давлениях. При высоком давлении силы отталкивания между молекулами значительно увеличиваются, что вызывает расширение объема.
Реальные приложения
Применение закона Чарльза можно наблюдать в повседневной жизни. Ниже приведены некоторые из них.
Воздушные шары
Мы все видели, как летают воздушные шары. Но кто-нибудь задумывался, как это работает? Воздушный шар состоит из сумки, корзины для перевозки пассажиров и источника тепла.Источником тепла обычно является такое топливо, как пропан, который при горении вызывает нагревание окружающего его воздуха. Когда воздух нагревается в соответствии с законом Чарльза, происходит расширение воздуха, т.е. увеличение объема. А с увеличением объема плотность воздуха уменьшается. Следовательно, подъемная сила действует на воздушный шар, направленный вверх, и он летит.
Шины
В летний сезон иногда шины автомобилей накачиваются. Это из-за закона Чарльза. Когда транспортное средство остается нетронутым в течение длительного периода.С приближением летнего сезона происходит повышение температуры, в результате чего воздух внутри шин расширяется.
Это из-за закона Чарльза. Когда транспортное средство остается нетронутым в течение длительного периода.С приближением летнего сезона происходит повышение температуры, в результате чего воздух внутри шин расширяется.
Легкие человека
Бег трусцой очень труден в холодные дни по сравнению с жаркими днями. Причина проста в том, что из-за низких температур наши легкие сжимаются, что снижает емкость легких человека.
Поплавки для бассейнов
Когда надутые поплавки вставляются в бассейны, они выглядят как недокачанные. Это связано с тем, что температура бассейна ниже температуры окружающей атмосферы.Таким образом, поплавки сжимаются по закону Чарльза.
Хлебобулочные изделия
Дрожжи используются при приготовлении многих хлебобулочных изделий. Эти дрожжи продолжают выделять углекислый газ. Когда предварительно приготовленные пирожные и хлеб нагреваются, углекислый газ расширяется, что делает наши пирожные и хлеб воздушными.
Чтобы узнать подробнее проверьте: Примеры закона Чарльза »
Лабораторный эксперимент
Мы можем проверить закон Чарльза экспериментально и определить значение абсолютного нуля. Это подтверждается множеством стандартных экспериментов.Однако мы кратко резюмируем одну из них в этой статье.
Это подтверждается множеством стандартных экспериментов.Однако мы кратко резюмируем одну из них в этой статье.
Основная установка эксперимента состоит из конической колбы и химического стакана. Пустую колбу погружают в стакан с водой, как показано на диаграмме выше. Когда тепло подается в стакан от горелки, он также нагревает воздух в колбе. Как следствие, воздух внутри колбы расширяется. Это наше условие 1. Затем колбу опускают в резервуар с водой комнатной температуры.Теперь воздух в колбе сжимается из-за снижения температуры. Это условие 2. Зная температуру и объем в обоих условиях, мы можем проверить закон.
Весь эксперимент с процедурой, наблюдением и расчетом обсуждается в статье: Проверить закон Чарльза экспериментально.
Проведите другой эксперимент: Чтобы проверить закон Чарльза с помощью шприца »
Задачи
Задача 1
Утверждение: Рассмотрим фиксированное количество пропана при температуре 30 ° C и объеме 1. 5 м 3 . Газ подвергается расширению, так что начальное и конечное давления остаются неизменными. Новая температура газа 75 ° C. Рассчитать новый объем?
5 м 3 . Газ подвергается расширению, так что начальное и конечное давления остаются неизменными. Новая температура газа 75 ° C. Рассчитать новый объем?
Решение: Сначала преобразуйте обе температуры в постановке задачи из градуса Цельсия в градус Кельвина.
Согласно закону Чарльза при постоянном давлении и заданном количестве газа
Следовательно, новый объем после расширения равен 1,7 м. 3 .
Чтобы упростить вычисления, попробуйте: Калькулятор закона Чарльза »
Задача 2
Постановление: Воздушный шар объемом 2.00 л охлаждается с температуры 65 ° C до комнатной температуры. Конечный объем 1,75 л. Оценить комнатную температуру?
Решение: Начальная температура ( T 1 ) равна
По закону Чарльза
Следовательно, комнатная температура составляет 23 ° C.
Задача 3
Постановление: Образец газообразного азота помещается в смесь льда и воды при давлении 1 атм. Образец занимает 0,80 дм 3 площади.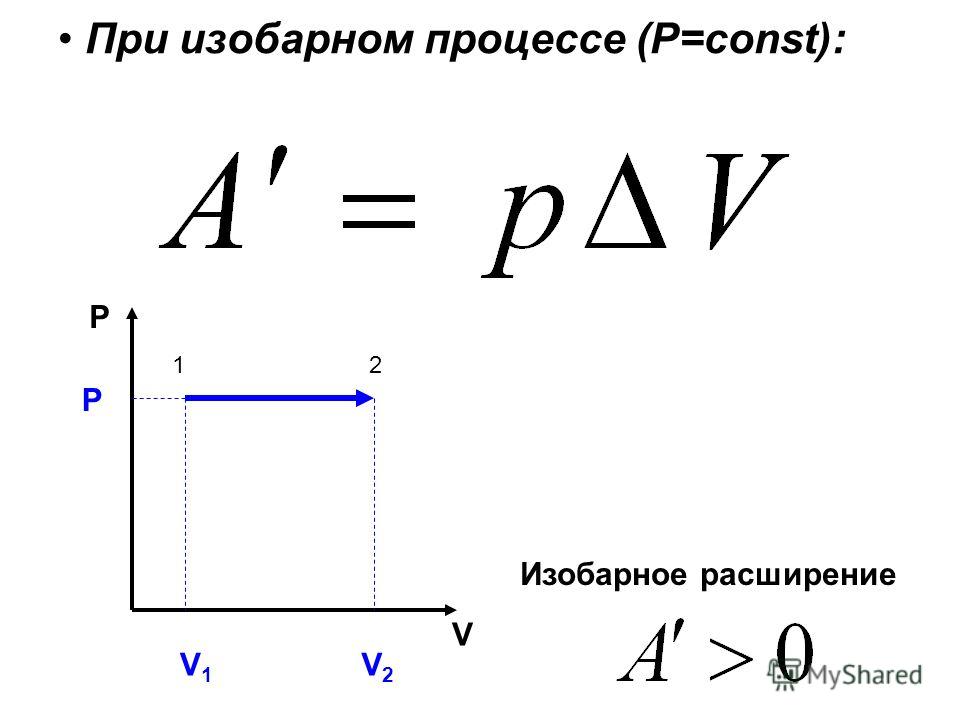 Этот же образец переводят в кипящий ацетон, где он занимает объем 0.96 дм 3 . Рассчитать температуру кипения ацетона?
Этот же образец переводят в кипящий ацетон, где он занимает объем 0.96 дм 3 . Рассчитать температуру кипения ацетона?
Решение: Давление 1 атм. При таком давлении смесь льда и воды существует только при 0 ° C, т.е. 273,15 K, что является начальной температурой.
По закону Чарльза,
Таким образом, температура кипения ацетона составляет 55 ° C.
Задача 4
Утверждение: воздушный шар, привязанный к кораблю, движущемуся из Северного Ледовитого океана в Атлантический океан, прибывает в Майами, США. Температура в Северном Ледовитом океане -2 ° C и соответствующий объем равен 1.50 л. В Майами температура 28 ° C. Определить объем, занимаемый воздушным шаром в Майами?
Корабль из Северного Ледовитого океана в МайамиРешение: T 1 = −2 ° C, V 1 = 1,50 л и T 2 = 28 ° C.
По закону Чарльза,
Следовательно, объем, занимаемый воздушным шаром в Майами, составляет 1,67 л.
Практические задачи
Задача 1
Начальная и конечная температура составляет 4 ° C и 12 ° C.Найти окончательный объем, если начальный объем равен 230 мм 3 ?
Задача 2
Газ сжимается от начального объема 9,2 дм 3 до 8,5 дм 3 . Найти конечную температуру, если начальная температура 45 ° C?
Задача 3
Гелиевый шар расширяется под постоянным давлением. Начальная и конечная температуры составляют 300 K и 430 K. Определите начальный объем, если конечный объем составляет 1,2 л.
Дополнительные проблемы см .: Рабочий лист закона Чарльза »
Показать ответы- Окончательный объем составляет 237 мм 3 .
- Конечная температура газа 21 ° C.
- Начальный объем баллона составляет 0,84 л.
Резюме
- Согласно закону Чарльза, объем и температура фиксированного количества газа прямо пропорциональны друг другу при постоянном давлении.

- Уравнение закона: В = кТ .
- — формула для двух разных условий.
- Абсолютный ноль можно определить экспериментальным путем.
- График объем-температура представляет собой прямую линию с положительным наклоном.
- Закон действует только для идеальных газов. Он не работает при высоком давлении / низкой температуре.
Сопутствующие статьи
| Измерение теплоты реакции: Калориметрия |
| Изменения температуры, вызванные реакцией, в сочетании с
значения удельной теплоемкости и массы реагирующей системы, делает его
можно определить теплоту реакции. |
Тепловую энергию можно измерить, наблюдая, как температура
известная масса воды (или другого вещества) изменяется при добавлении или удалении тепла.
По сути, так определяется наибольшая теплота реакции. Реакция
осуществляется в каком-то изолированном контейнере, где тепло поглощается или выделяется
в результате реакции вызывает изменение температуры содержимого. Эта температура
изменение измеряется, и рассчитывается количество тепла, вызвавшего изменение
умножив изменение температуры на теплоемкость системы. Эта температура
изменение измеряется, и рассчитывается количество тепла, вызвавшего изменение
умножив изменение температуры на теплоемкость системы. |
| Аппарат, используемый для измерения изменения температуры реагирующего
Система называется калориметром (то есть калориметром). Наука о
использование такого устройства и получаемых с его помощью данных называется калориметрией. В
конструкция калориметра нестандартна и используются разные калориметры
для требуемой точности. Один очень простой дизайн, используемый во многих
лаборатории общей химии — калориметр «кофейная чашка» из пенополистирола, который обычно
состоит из двух вложенных друг в друга стаканов из пенополистирола. |
Когда реакция происходит при постоянном давлении внутри кофейной чашки из пенополистирола
калориметр, изменение энтальпии связано с теплом, и небольшое количество тепла теряется на
лаборатория (или полученная из нее). Если в результате реакции выделяется тепло, например, очень
почти вся она остается внутри калориметра, количество поглощенного тепла
или выделяется в результате реакции. |
| Пример задачи |
| Реакция кислоты, такой как HCl, с основанием, таким как NaOH, в воде
включает экзотермическую реакцию |
| HCl (водн.) + NaOH (водн.) —> NaCl (водн.) + H 2 O |
| В одном эксперименте студент занял 50-е место.0 мл 1,00 М HCl в кофейной чашке
калориметром и тщательно измерил его температуру, которая составила 25,5 o C.
К этому добавляли 50,0 мл 1,00 М раствора NaOH, температура которого также была
25,5 o C. Смесь быстро перемешали, и студент заметил
что температура смеси поднялась до 32,4 o C. Что было
жар реакции? |
| Допущения |
Это растворы, а не чистая вода.Удельная теплоемкость воды равна
4,184 Дж / г o C. Предположим, что эти растворы достаточно близки к
как и вода, их удельная теплоемкость также составляет 4,1984 Дж / г o C. |
| Плотность воды составляет 1,00 г / мл, и хотя это растворы
мы можем предположить, что они достаточно близки к воде, чтобы иметь одинаковую плотность. |
| Раствор |
| Рассчитайте фактически выделяемое тепло. q = mc Δ t |
| Заполните недостающую информацию. У нас есть мл и нам нужны граммы. |
| Используйте плотность. (50 мл + 50 мл) = 100 мл раствора. |
| 100 мл X 1 г = 100 грамм раствора.(м = V X D) мл |
| Найдите изменение температуры. |
| Δ t = t конечный — t начальный = 32,4 o C — 25,5 o C
= 6,9 o С |
| q = mc Δ t = 100 грамм X 4.  184 J X 6,9 o C 184 J X 6,9 o C г o С |
| = 2,9 X 10 3 Дж |
| Это тепло, полученное водой, но на самом деле это потеря тепла
при взаимодействии HCl и NaOH, поэтому q = -2,9 x 10 3 J. |
| i.е. это экзотермическая реакция, тепло было потеряно для воды и
стало теплее. |
| Это лишь часть пути. Это тепло, выделяемое для конкретных
использованные суммы. (Обратите внимание, что мы использовали идентичные количества, чтобы эти решения были простыми).
Нам нужно найти количество тепла, выделяемого на моль. |
| Сколько HCl мы вообще использовали? |
| 50.0 мл HCl X 1,00 моль HCl = 0,0500 моль HCl 1000 мл HCl |
Использовали такое же количество основания, 0,0500 моль NaOH. |
| Чтобы рассчитать энергию на моль кислоты или основания, разделите число
джоулей на число молей. |
| т.е. молярная энтальпия = Дж / моль = -2.9 x 10 3 Дж / 0,0500 моль = -5,8 x 10 4 Дж / моль = -58000 Дж / моль = -58 кДж / моль |
| Следовательно, для нейтрализации HCl и NaOH изменение энтальпии,
часто называют энтальпией реакции Δ H = -58 кДж / моль |
| Калориметр бомбы |
Тип калориметра, используемый для очень точных измерений тепла
реакция называется калориметром бомбы.Он используется для измерения изменений энергии
для реакций, которые не произойдут, пока они не будут инициированы преднамеренно,
например, возгорание, которое необходимо зажечь. Реагенты помещаются в
«бомба», которую затем запечатывают и погружают в большую, хорошо изолированную
чан с водой. Когда реакция начинается, любое выделяющееся тепло поглощается.
поглощается бомбой, водой и любым прилипшим оборудованием
в воду, и температура всего содержимого чана повышается.Мешалка обеспечивает равномерное распределение выделяемого тепла
до считывания окончательной температуры. От изменения температуры и
теплоемкость калориметра (вода плюс все в воде),
рассчитывается выделяемое тепло. Когда реакция начинается, любое выделяющееся тепло поглощается.
поглощается бомбой, водой и любым прилипшим оборудованием
в воду, и температура всего содержимого чана повышается.Мешалка обеспечивает равномерное распределение выделяемого тепла
до считывания окончательной температуры. От изменения температуры и
теплоемкость калориметра (вода плюс все в воде),
рассчитывается выделяемое тепло. |
| |
| Пример проблемы: |
| Образец сахарозы (столового сахара) массой 1.32 г сгорает
в калориметре бомбы. Теплоемкость этого калориметра ранее была
оказалось, что 9,43 кДж / o C. Температура изменилась от 25,00 до o C.
to 27.31 o C. Рассчитайте теплоту сгорания сахарозы в килоджоулей.
на моль. Формула сахарозы: C 12 H 22 O 11 . |
| Решение |
Δ t равно 2. 31 O C. На каждый градус увеличения
в результате реакции выделилось 9,43 кДж, как мы знаем из теплоемкости. Следовательно
общее выделенное тепло составляет 31 O C. На каждый градус увеличения
в результате реакции выделилось 9,43 кДж, как мы знаем из теплоемкости. Следовательно
общее выделенное тепло составляет |
| E = 2,31 o C X 9,43 кДж = 21,8 кДж o С |
| Это тепло образовалось в результате сгорания 1.32 г сахарозы. |
| моль = г / молекулярная масса = 1,32 г / 342,3 г / моль = 3,86 х 10 -3 моль сахарозы. |
| Следовательно, количество тепла, выделяемое на моль сахарозы, равно |
| 21.8 кДж =
5,65 x 10 3 кДж / моль 3,86 x 10 -3 моль |
Поскольку горение экзотермическое, этому следует поставить знак минус
и указано как -5,65 x 10 3 кДж / моль для теплоты сгорания для
сахароза. |
Учебное пособие по физике
У всех нас есть чувство для какой температуры.У нас даже есть общий язык, который мы используем для качественного описания температуры. Вода в душе или ванне кажется горячей, холодной или теплой. На улице прохладно, или парно, . Мы, безусловно, хорошо понимаем, насколько одна температура качественно отличается от другой температуры. Мы не всегда можем прийти к единому мнению, является ли температура в комнате слишком высокой или слишком холодной или подходящей. Но мы, вероятно, все согласимся с тем, что у нас есть встроенные термометры для качественной оценки относительных температур.
Несмотря на то, что мы встроены в температуру, она остается одним из тех понятий в науке, которые трудно определить. Кажется, что страница руководства, посвященная теме температуры и термометров, должна начинаться с простого определения температуры. Но именно в этот момент я в тупике . Итак, я обращаюсь к знакомому ресурсу Dictionary.com … где нахожу определения, которые варьируются от простых, но не слишком информативных до слишком сложных, чтобы быть поучительными.Рискуя провалиться животом в бассейн просветления, я перечислю некоторые из этих определений здесь:
Но именно в этот момент я в тупике . Итак, я обращаюсь к знакомому ресурсу Dictionary.com … где нахожу определения, которые варьируются от простых, но не слишком информативных до слишком сложных, чтобы быть поучительными.Рискуя провалиться животом в бассейн просветления, я перечислю некоторые из этих определений здесь:
- Степень жары или холода тела или окружающей среды.
- Мера тепла или холода предмета или вещества по отношению к некоторому стандартному значению.
- Мера средней кинетической энергии частиц в образце вещества, выраженная в единицах или градусах, обозначенных на стандартной шкале.
- Мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.
- Любая из различных стандартизированных числовых мер этой способности, например шкала Кельвина, Фаренгейта и Цельсия.
Наверняка нас устраивают первые два определения — степень или мера того, насколько горячий или холодный объект. Но такие определения не способствуют нашему пониманию температуры. Третье и четвертое определения, относящиеся к кинетической энергии частиц и способности вещества передавать тепло, являются точными с научной точки зрения.Однако эти определения слишком сложны, чтобы служить хорошей отправной точкой для обсуждения температуры. Так что мы согласимся с определением, аналогичным пятому из перечисленных — температуру можно определить как показания термометра. По общему признанию, этому определению не хватает мощности, которая необходима для получения столь желанного Ага! Теперь я понимаю! момент. Тем не менее, он служит отличной отправной точкой для этого урока о тепле и температуре. Температура — это то, что показывает термометр.Какой бы мерой ни была эта температура, она отражается в показаниях термометра. Итак, как именно работает термометр? Каким образом измерит , какой бы мерой ни была эта температура?
Но такие определения не способствуют нашему пониманию температуры. Третье и четвертое определения, относящиеся к кинетической энергии частиц и способности вещества передавать тепло, являются точными с научной точки зрения.Однако эти определения слишком сложны, чтобы служить хорошей отправной точкой для обсуждения температуры. Так что мы согласимся с определением, аналогичным пятому из перечисленных — температуру можно определить как показания термометра. По общему признанию, этому определению не хватает мощности, которая необходима для получения столь желанного Ага! Теперь я понимаю! момент. Тем не менее, он служит отличной отправной точкой для этого урока о тепле и температуре. Температура — это то, что показывает термометр.Какой бы мерой ни была эта температура, она отражается в показаниях термометра. Итак, как именно работает термометр? Каким образом измерит , какой бы мерой ни была эта температура?
Сегодня существует множество типов термометров. Тип, с которым большинство из нас знакомо по научным занятиям, представляет собой жидкость, заключенную в узкую стеклянную колонку.В более старых термометрах этого типа использовалась жидкая ртуть. В ответ на наше понимание проблем со здоровьем, связанных с воздействием ртути, в этих типах термометров обычно используется какой-то жидкий спирт. Эти жидкостные термометры основаны на принципе теплового расширения. Когда вещество нагревается, оно расширяется до большего объема. Почти все вещества демонстрируют такое поведение при тепловом расширении. Это основа конструкции и работы термометров.
Тип, с которым большинство из нас знакомо по научным занятиям, представляет собой жидкость, заключенную в узкую стеклянную колонку.В более старых термометрах этого типа использовалась жидкая ртуть. В ответ на наше понимание проблем со здоровьем, связанных с воздействием ртути, в этих типах термометров обычно используется какой-то жидкий спирт. Эти жидкостные термометры основаны на принципе теплового расширения. Когда вещество нагревается, оно расширяется до большего объема. Почти все вещества демонстрируют такое поведение при тепловом расширении. Это основа конструкции и работы термометров.
При повышении температуры жидкости в термометре увеличивается ее объем.Жидкость заключена в высокую узкую стеклянную (или пластмассовую) колонку с постоянной площадью поперечного сечения. Таким образом, увеличение объема происходит из-за изменения высоты жидкости внутри колонны. Увеличение объема и, следовательно, высоты столба жидкости пропорционально повышению температуры. Предположим, что повышение температуры на 10 градусов приводит к увеличению высоты колонны на 1 см. Тогда повышение температуры на 20 градусов приведет к увеличению высоты колонны на 2 см. А повышение температуры на 30 градусов приведет к увеличению высоты колонны на 3 см.Связь между температурой и высотой столбца линейна в небольшом диапазоне температур, в котором используется термометр. Эта линейная зависимость делает калибровку термометра относительно простой задачей.
Тогда повышение температуры на 20 градусов приведет к увеличению высоты колонны на 2 см. А повышение температуры на 30 градусов приведет к увеличению высоты колонны на 3 см.Связь между температурой и высотой столбца линейна в небольшом диапазоне температур, в котором используется термометр. Эта линейная зависимость делает калибровку термометра относительно простой задачей.
Калибровка любого измерительного инструмента включает нанесение делений или меток на инструмент для точного измерения количества по сравнению с известными стандартами. Любой измерительный инструмент — даже измерительная линейка — необходимо откалибровать. Инструмент нуждается в делениях или маркировке; например, метрическая палка обычно имеет отметки через каждые 1 см или через каждые 1 мм.Эти отметки должны быть нанесены точно, и о точности их размещения можно судить только при сравнении их с другим объектом, имеющим определенную длину.
Термометр калибруется с использованием двух объектов с известными температурами. Типичный процесс включает использование точки замерзания и точки кипения чистой воды. Вода, как известно, замерзает при 0 ° C и кипит при 100 ° C при атмосферном давлении 1 атм. Поместив термометр в смесь ледяной воды и позволив жидкости термометра достичь стабильной высоты, отметка 0 градусов может быть помещена на термометр.Точно так же, поместив термометр в кипящую воду (при давлении 1 атм) и позволив уровню жидкости достичь стабильной высоты, отметка 100 градусов может быть помещена на термометр. С помощью этих двух отметок, размещенных на термометре, между ними можно разместить 100 делений с одинаковым интервалом, представляющих отметки в 1 градус. Поскольку существует линейная зависимость между температурой и высотой жидкости, деления между 0 и 100 градусами могут быть одинаковыми. С помощью калиброванного термометра можно проводить точные измерения температуры любого объекта в диапазоне температур, для которого он был откалиброван.
Типичный процесс включает использование точки замерзания и точки кипения чистой воды. Вода, как известно, замерзает при 0 ° C и кипит при 100 ° C при атмосферном давлении 1 атм. Поместив термометр в смесь ледяной воды и позволив жидкости термометра достичь стабильной высоты, отметка 0 градусов может быть помещена на термометр.Точно так же, поместив термометр в кипящую воду (при давлении 1 атм) и позволив уровню жидкости достичь стабильной высоты, отметка 100 градусов может быть помещена на термометр. С помощью этих двух отметок, размещенных на термометре, между ними можно разместить 100 делений с одинаковым интервалом, представляющих отметки в 1 градус. Поскольку существует линейная зависимость между температурой и высотой жидкости, деления между 0 и 100 градусами могут быть одинаковыми. С помощью калиброванного термометра можно проводить точные измерения температуры любого объекта в диапазоне температур, для которого он был откалиброван.
Температурные шкалы
В результате описанного выше процесса калибровки термометра получается так называемый термометр по Цельсию. Термометр по Цельсию имеет 100 делений или интервалов между нормальной точкой замерзания и нормальной точкой кипения воды. Сегодня шкала Цельсия известна как шкала Цельсия, названная в честь шведского астронома Андерса Цельсия, которому приписывают ее разработку.Шкала Цельсия — это наиболее широко распространенная шкала температур, используемая во всем мире. Это стандартная единица измерения температуры почти во всех странах, самым заметным исключением являются Соединенные Штаты. По этой шкале температура 28 градусов Цельсия сокращается до 28 ° C.
Термометр по Цельсию имеет 100 делений или интервалов между нормальной точкой замерзания и нормальной точкой кипения воды. Сегодня шкала Цельсия известна как шкала Цельсия, названная в честь шведского астронома Андерса Цельсия, которому приписывают ее разработку.Шкала Цельсия — это наиболее широко распространенная шкала температур, используемая во всем мире. Это стандартная единица измерения температуры почти во всех странах, самым заметным исключением являются Соединенные Штаты. По этой шкале температура 28 градусов Цельсия сокращается до 28 ° C.
Традиционно медленно применяют метрическую систему и другие принятые единицы измерения, в Соединенных Штатах чаще используется шкала температур по Фаренгейту. Термометр можно откалибровать по шкале Фаренгейта аналогично описанному выше.Разница в том, что нормальная точка замерзания воды обозначена как 32 градуса, а нормальная точка кипения воды обозначена как 212 градусов по шкале Фаренгейта. Таким образом, при использовании шкалы Фаренгейта между этими двумя температурами есть 180 делений или интервалов.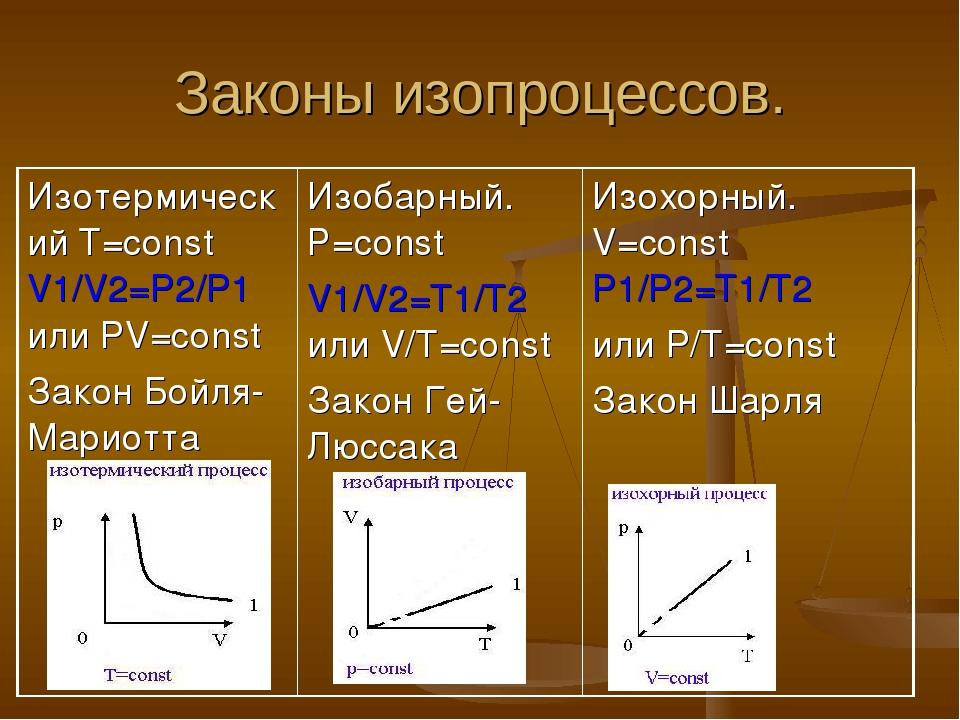 Шкала Фаренгейта названа в честь немецкого физика Даниэля Фаренгейта. Температура 76 градусов по Фаренгейту сокращенно называется 76 ° F. В большинстве стран мира шкала Фаренгейта была заменена шкалой Цельсия.
Шкала Фаренгейта названа в честь немецкого физика Даниэля Фаренгейта. Температура 76 градусов по Фаренгейту сокращенно называется 76 ° F. В большинстве стран мира шкала Фаренгейта была заменена шкалой Цельсия.
Температуры, выраженные по шкале Фаренгейта, могут быть преобразованы в эквивалент шкалы Цельсия с помощью следующего уравнения:
° C = (° F — 32 °) / 1,8
Аналогичным образом, температуры, выраженные по шкале Цельсия, могут быть преобразованы в эквивалент шкалы Фаренгейта с помощью следующего уравнения:
° F = 1,8 • ° C + 32 °
Температурная шкала Кельвина
Хотя шкалы Цельсия и Фаренгейта являются наиболее широко используемыми температурными шкалами, есть несколько других шкал, которые использовались на протяжении всей истории.Например, есть шкала Ренкина, шкала Ньютона и шкала Ромера, которые используются редко. Наконец, существует шкала температуры Кельвина, которая является стандартной метрической системой измерения температуры и, возможно, наиболее широко используемой температурной шкалой среди ученых. Температурная шкала Кельвина аналогична температурной шкале Цельсия в том смысле, что между нормальной точкой замерзания и нормальной температурой кипения воды есть 100 одинаковых приращений. Однако отметка нуля градусов по шкале Кельвина — 273.На 15 единиц холоднее, чем по шкале Цельсия. Таким образом, температура 0 Кельвина эквивалентна температуре -273,15 ° C. Обратите внимание, что в этой системе не используется символ градуса. Таким образом, температура на 300 единиц выше 0 Кельвина обозначается как 300 Кельвин, а не 300 градусов Кельвина; такая температура обозначается аббревиатурой 300 К. Преобразование между температурами Цельсия и температурой Кельвина (и наоборот) может быть выполнено с использованием одного из двух приведенных ниже уравнений.
Температурная шкала Кельвина аналогична температурной шкале Цельсия в том смысле, что между нормальной точкой замерзания и нормальной температурой кипения воды есть 100 одинаковых приращений. Однако отметка нуля градусов по шкале Кельвина — 273.На 15 единиц холоднее, чем по шкале Цельсия. Таким образом, температура 0 Кельвина эквивалентна температуре -273,15 ° C. Обратите внимание, что в этой системе не используется символ градуса. Таким образом, температура на 300 единиц выше 0 Кельвина обозначается как 300 Кельвин, а не 300 градусов Кельвина; такая температура обозначается аббревиатурой 300 К. Преобразование между температурами Цельсия и температурой Кельвина (и наоборот) может быть выполнено с использованием одного из двух приведенных ниже уравнений.
° С = К — 273.15 °
К = ° С + 273,15
Нулевая точка по шкале Кельвина называется абсолютным нулем. Это самая низкая температура, которую можно достичь. Идея абсолютного минимума температуры была продвинута шотландским физиком Уильямом Томсоном (он же лорд Кельвин) в 1848 году. Томсон предположил, основываясь на термодинамических принципах, что самая низкая температура, которая могла быть достигнута, была -273 ° C. До Томсона экспериментаторы, такие как Роберт Бойл (конец 17 века), были хорошо осведомлены о наблюдении, что объем (и даже давление) образца газа зависит от его температуры.Измерения изменений давления и объема при изменении температуры могут быть сделаны и нанесены на график. Графики зависимости объема от температуры (при постоянном давлении) и давления от температуры (при постоянном объеме) отражают тот же вывод — объем и давление газа уменьшаются до нуля при температуре -273 ° C. Поскольку это наименьшие возможные значения объема и давления, разумно сделать вывод, что -273 ° C была самой низкой возможной температурой.
Идея абсолютного минимума температуры была продвинута шотландским физиком Уильямом Томсоном (он же лорд Кельвин) в 1848 году. Томсон предположил, основываясь на термодинамических принципах, что самая низкая температура, которая могла быть достигнута, была -273 ° C. До Томсона экспериментаторы, такие как Роберт Бойл (конец 17 века), были хорошо осведомлены о наблюдении, что объем (и даже давление) образца газа зависит от его температуры.Измерения изменений давления и объема при изменении температуры могут быть сделаны и нанесены на график. Графики зависимости объема от температуры (при постоянном давлении) и давления от температуры (при постоянном объеме) отражают тот же вывод — объем и давление газа уменьшаются до нуля при температуре -273 ° C. Поскольку это наименьшие возможные значения объема и давления, разумно сделать вывод, что -273 ° C была самой низкой возможной температурой.
Томсон назвал эту минимальную самую низкую температуру абсолютным нулем и утверждал, что следует принять температурную шкалу, которая имела бы абсолютный ноль как самое низкое значение на шкале.Сегодня эта шкала температур носит его имя. Ученым и инженерам удалось охладить материю до температур, близких к -273,15 ° C, но никогда не ниже. В процессе охлаждения вещества до температур, близких к абсолютному нулю, наблюдается ряд необычных свойств. Эти свойства включают сверхпроводимость, сверхтекучесть и состояние вещества, известное как конденсат Бозе-Эйнштейна.
Температура — это то, что показывает термометр. Но что именно отражает температура? Концепция абсолютного нуля температуры весьма интересна, и наблюдение замечательных физических свойств образцов вещества, приближающегося к абсолютному нулю, заставляет задуматься над этой темой более глубоко.Что-то происходит на уровне частиц, что связано с наблюдениями, сделанными на макроскопическом уровне? Есть ли что-то более глубокое, чем просто показания термометра? Что происходит на уровне атомов и молекул по мере того, как температура образца вещества увеличивается или уменьшается? Эти вопросы будут рассмотрены на следующей странице Урока 1.
Проверьте свое понимание1.При обсуждении калибровки термометра упоминалось, что существует линейная зависимость между температурой и высотой жидкости в колонке. Что, если отношения не были линейными? Можно ли калибровать термометр, если температура и высота столба жидкости не связаны линейной зависимостью?
2. Какое приращение температуры меньше — градус Цельсия или градус Фаренгейта? Объяснять.
3.Выполните соответствующие преобразования температуры, чтобы заполнить пробелы в таблице ниже.
Цельсия (°)
по Фаренгейту (° F)
Кельвина (К)
а.
0
г.
212
г.
0
г.
78
e.
12
Испарение и круговорот воды
• Школа наук о воде ГЛАВНАЯ • Круговорот воды •
Компоненты круговорота воды »Атмосфера · Конденсация · Испарение · Испарение · Пресноводные озера и реки · Поток подземных вод · Хранение подземных вод · Лед и снег · Инфильтрация · Океаны · Осадки · Таяние снегов · Источники · Ручьи · Сублимация · Поверхностный сток
Градирни энергообъекта. Электростанции, в том числе завод Боуэн в Джорджии, вырабатывают электроэнергию, используя тепло (в данном случае от сжигания угля) для преобразования воды в пар.
Кредит: Алан Кресслер, USGS
Одним из очень важных побочных продуктов термоэлектрических установок является тепло от энергетического оборудования. Растения собирают много отходов, используют их для охлаждения оборудования, а затем им необходимо сбрасывать использованную воду обратно в окружающую среду. Сброс горячей воды обратно в реки нанесет вред экологии, поэтому многие электростанции имеют огромные градирни, где горячая вода распыляется внутри, а испарение используется для охлаждения сбрасываемой воды, прежде чем она вернется в окружающую среду.
Испарение — это процесс, при котором вода превращается из жидкости в газ или пар. Испарение — это основной путь, по которому вода переходит из жидкого состояния обратно в круговорот воды в виде водяного пара из атмосферы. Исследования показали, что океанов, , морей, озер и рек обеспечивают почти 90 процентов влаги в атмосфере за счет испарения, а остальные 10 процентов вносятся растениями транспирация .
Очень небольшое количество воды , пар попадает в атмосферу через сублимацию , процесс, при котором вода превращается из твердого (лед или снег) в газ, минуя жидкую фазу .Это часто случается в Скалистых горах, когда поздней зимой и ранней весной дуют сухие и теплые ветры чавычи с Тихого океана. Когда действует эффект чавычи, местные температуры резко повышаются за считанные часы. Когда сухой воздух попадает на снег, он превращает снег непосредственно в водяной пар, минуя жидкую фазу. Сублимация — это распространенный способ быстрого исчезновения снега в засушливом климате. (Источник: обсерватория Маунт Вашингтон)
Почему происходит испарение
Для испарения необходимо тепло (энергия).Энергия используется для разрыва связей, которые удерживают молекулы воды вместе, поэтому вода легко испаряется при температуре кипения (212 ° F, 100 ° C), но гораздо медленнее испаряется при температуре замерзания. Чистое испарение происходит, когда скорость испарения превышает скорость конденсации. Состояние насыщения существует, когда эти две скорости процесса равны, при этом относительная влажность воздуха составляет 100 процентов. Конденсация , противоположность испарению, происходит, когда насыщенный воздух охлаждается ниже точки росы (температура, до которой воздух должен быть охлажден при постоянном давлении, чтобы он стал полностью насыщенным водой), например, на внешней стороне стакана. ледяной воды.Фактически, процесс испарения удаляет тепло из окружающей среды, поэтому вода, испаряющаяся с вашей кожи, охлаждает вас.
Испарение запускает круговорот воды
Испарение из океанов является основным механизмом, поддерживающим часть круговорота воды между поверхностью и атмосферой. В конце концов, большая площадь поверхности Мирового океана (более 70 процентов поверхности Земли покрыто океанами) дает возможность для крупномасштабного испарения.В глобальном масштабе количество испаряющейся воды примерно такое же, как количество воды, доставленной на Землю в виде осадков. Хотя это действительно различается географически. Испарение более распространено над океанами, чем осадки, в то время как над сушей выпадает осадков, обычно превышает испарение. Большая часть воды, испаряющейся из океанов, выпадает обратно в океаны в виде осадков. Только около 10 процентов воды, испарившейся из океанов, переносится по суше и выпадает в виде осадков.После испарения молекула воды проводит в воздухе около 10 дней. Процесс испарения настолько велик, что без осадков , сток и подземные воды , сброс из водоносных горизонтов , океаны стали бы почти пустыми.
Люди используют испарение
Поваренная соль могла быть получена из пруда-испарителя.
Кредит: Википедия, Creative Commons
Если вы когда-нибудь окажетесь на острове и вам понадобится немного соли, просто возьмите миску, добавьте немного морской воды и подождите, пока солнце испарит воду.Фактически, один из способов производства поваренной соли — это испарение соленой воды в прудах-испарителях, метод, используемый людьми на протяжении тысяч лет.
Морская вода содержит другие ценные минералы, которые легко получить испарением. Мертвое море расположено на Ближнем Востоке в пределах закрытого водораздела и без каких-либо оттоков, что является ненормальным для большинства озер. Основным механизмом выхода воды из озера является испарение, которое в пустыне может быть довольно высоким — от 1300 до 1600 миллиметров в год.В результате воды Мертвого моря имеют самую высокую соленость и плотность (вот почему вы плывете «выше»; когда вы лежите в соленой воде) из всех морей в мире, слишком высоко, чтобы поддерживать жизнь. Эта вода идеально подходит для размещения прудов-испарителей для добычи не только поваренной соли, но также магния, поташа и брома. (Источник: Обзор водных ресурсов Ближнего Востока, Проект банков данных по водным ресурсам Ближнего Востока) .
Испарительное охлаждение: дешевый кондиционер!
Кредит: Энергетическая комиссия Калифорнии
Ранее мы говорили, что при испарении тепло удаляется из окружающей среды, что приводит к чистому охлаждению; Обратите внимание, насколько холодна ваша рука, когда врач протирает ее спиртом перед тем, как вытащить шприц с прикрепленной к ней пугающей иглой.В климате, где влажность низкая, а температуры высокие, охладитель испарителя, такой как «охладитель болота», может снизить температуру воздуха на 20 градусов по Фаренгейту, одновременно увеличивая влажность. Как показано на этой карте, испарительные охладители лучше всего работают в засушливых районах США (красные области, отмеченные A) и могут работать отчасти в областях, отмеченных синим цветом, отмеченными B. Во влажных районах восточной части США необходимо использовать обычные кондиционеры.
Вот Фидо, выглядящий одновременно остроумным и крутым, поскольку он носит новейшую модную собачью одежду, которая также сохраняет ему прохладу в жаркий день.Фидо носит «охлаждающий жилет», в котором владелец смачивает его, кладет на собаку, а свойства процесса испарения помогают собаке чувствовать себя комфортно.
Кредит: Викимедиа, Creative Commons
Fido поддерживает испарительное охлаждение
Да, охладители для болот больше не только для дома. В конце концов, процесс испарения позволяет собаке оставаться в прохладе так же хорошо, как и в доме. Испарительные охладители — действительно довольно простые устройства, по крайней мере, по сравнению с кондиционерами.Охладители болот втягивают сухой горячий наружный воздух и пропускают его через испарительную подушку, которая остается влажной за счет подачи воды. В домашнем устройстве вентилятор втягивает воздух через подушку, вода в подушке испаряется, что приводит к более холодному воздуху, который прокачивается через дом.





 Исследования показывают, что количество несчастных случаев резко возрастает по мере того, как посещаемость классов превышает этот уровень (West 2001).Это при условии, что не нарушена законная нагрузка.
Исследования показывают, что количество несчастных случаев резко возрастает по мере того, как посещаемость классов превышает этот уровень (West 2001).Это при условии, что не нарушена законная нагрузка.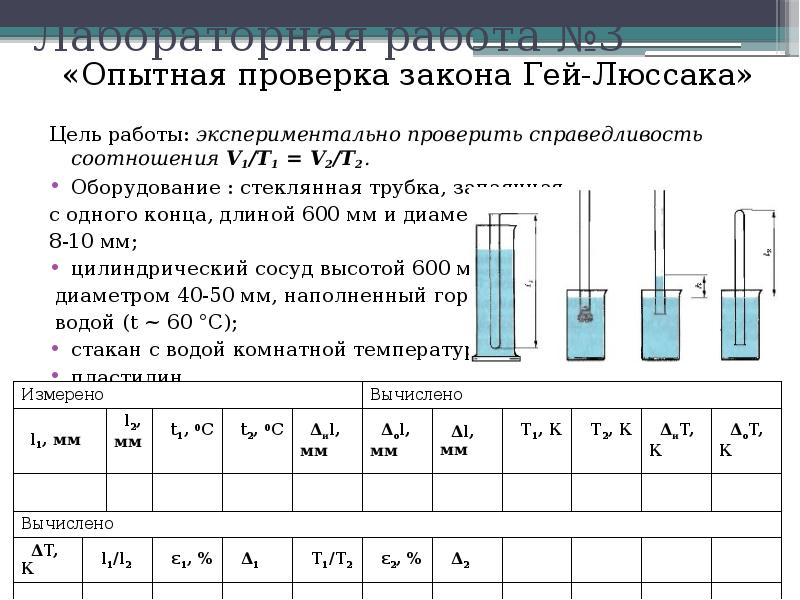 Не допускайте попадания в них химикатов, лабораторной посуды и т. Д.
Не допускайте попадания в них химикатов, лабораторной посуды и т. Д. Идея состоит в том, чтобы ограничить воздействие на людей.
Идея состоит в том, чтобы ограничить воздействие на людей. Используйте «тест на волну» только при необходимости и под руководством учителя.
Используйте «тест на волну» только при необходимости и под руководством учителя.
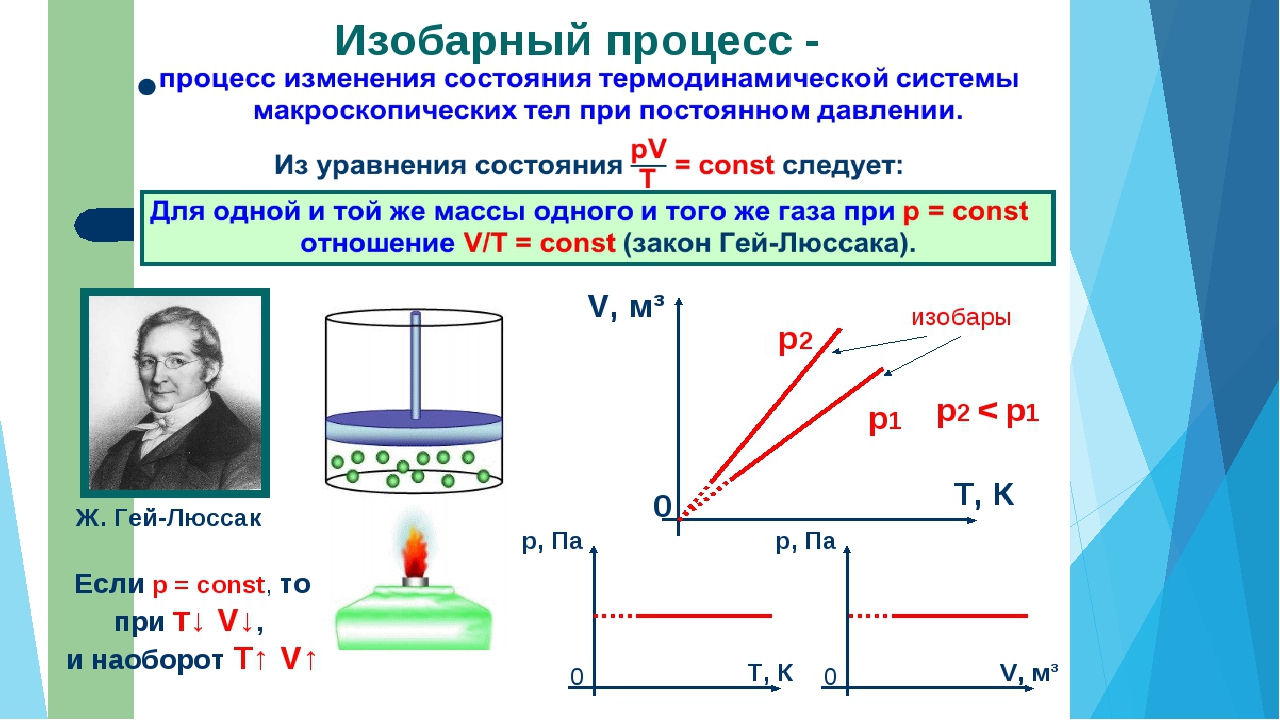 Храните агрессивные жидкости и твердые вещества в отдельных шкафах.
Храните агрессивные жидкости и твердые вещества в отдельных шкафах.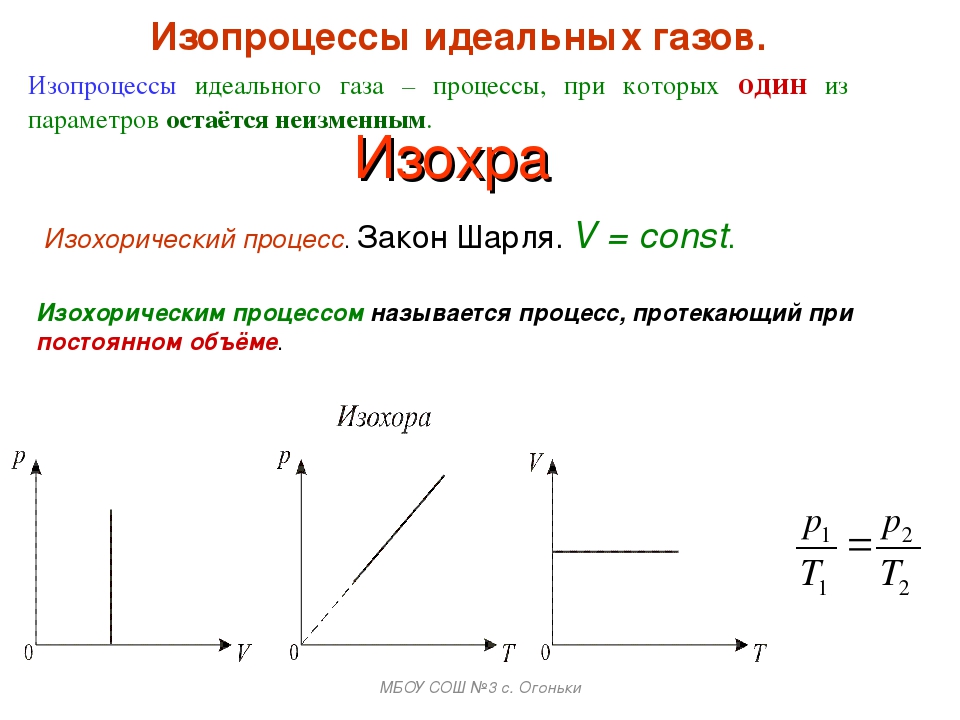 Совместимые группы можно разделить с помощью разных полок. Храните химические вещества только в алфавитном порядке в пределах связанной и совместимой группы.
Совместимые группы можно разделить с помощью разных полок. Храните химические вещества только в алфавитном порядке в пределах связанной и совместимой группы. 1200 (f) (6) (ii) Идентификатор продукта и слова, изображения, символы или их комбинации, которые предоставляют по крайней мере общую информацию об опасностях химических веществ и которые в сочетании с другой доступной немедленно сотрудникам, участвующим в программе информирования об опасности, предоставит сотрудникам конкретную информацию о физических опасностях и опасности для здоровья, связанных с опасным химическим веществом.
1200 (f) (6) (ii) Идентификатор продукта и слова, изображения, символы или их комбинации, которые предоставляют по крайней мере общую информацию об опасностях химических веществ и которые в сочетании с другой доступной немедленно сотрудникам, участвующим в программе информирования об опасности, предоставит сотрудникам конкретную информацию о физических опасностях и опасности для здоровья, связанных с опасным химическим веществом.

