Лабораторная работа » Изучение изопроцессов»
Учитель физики КГУ «Гимназии № 5 акимата г.Шахтинска» Антощук Л.Г.
Лабораторная работа «Изучение изотермического процесса в газе»
10 класс, физико- математический профиль.
ЦЕЛЬ: Обеспечить выполнение обучающимися экспериментальных исследований изопроцессов в газах.
ОБРАЗОВАТЕЛЬНЫЕ ЗАДАЧИ УРОКА:
1) Сделать экспериментальную проверку закона Бойля- Мариотта путем сравнения параметров газа в двух термических состояниях..
2) Продолжить формирование навыков и умений работать с графиками изопроцессов.
3) В результате обсуждения результатов работы доказать справедливость закона Бойля- Мариотта.
РАЗВИВАЮЩИЕ ЗАДАЧИ:
1) Развивать исследовательскую и творческую деятельность обучающихся, которая активизирует познавательные интересы учеников.
ВОСПИТАТЕЛЬНЫЕ ЗАДАЧИ:
1) Добиваться последовательности и аккуратности записи результатов при экспериментальных исследованиях. 2) Формирование навыков работы в команде.
Ход урока
1. Огр момент. Объяснение критерий и дискриптора При подготовке к уроку учащиеся выбирают карточки по форме цвету. ( квадрат –группа теоретиков , прямоугольник- группа практиков, треугольник- группа аналитиков , круг- группа экспертов )
2. Рассаживаются в зависимости от выбранной фигуры. (на столах приготовлен материал для изучения данной группы)-10 мин
3. Переход учащихся в новую группу по цвету ( выполнение работы лабораторной каждый вносит свой вклад все заносят свои данные в таблицу. Теоретик объясняет теорию , практик выполнят работу, аналитик вычисляет погрешности . Эксперт готовит защиту .) ( Экспертов можно подготовить заранее )-15мин
4. Физ минутка -2-3 мин
5. Защита-10
6. Рефлексия эксперты ставят оценку группе и каждый сам оценивает себя в группе ( итоговая оценка выводиться из трех двух эксперта и учителя)
Оценка эксперта
Оценка учителя
Средний бал
infourok.ru
Изучение изобарного процесса
Лабораторная работа №
Тема: Изучение изобарного процесса.
Цель работы: проверка соотношения между изменением объема и температуры определенного количества газа при его изобарном охлаждении.
Оборудование:
- прозрачная трубка с двумя кранами на концах;
- лабораторный термометр;
- измерительная лента;
- внешний стакан калориметра;
- сосуд с теплой водой;
- сосуд с холодной водой.
Теоретическая часть
В соответствии с законом Гей-Люссака соотношение имеет вид:
Исследуемым газом в данной работе является воздух, находящийся внутри прозрачной трубки. Для изоляции внутренней полости трубки от внешней среды на концах закреплены специальные краны.
Измерения объема и температуры теплого и холодного воздуха внутри трубки проводят в следующем порядке.
Трубку плотно, виток к витку, укладывают внутрь стакана калориметра. Кран, который расположится при этом вблизи дна, предварительно закрывают. Верхний кран оставляют открытым. Затем в калориметр наливают нагретую до 55 — 60 0С воду. Воду заливают так, чтобы открытый кран оказался бы погруженным в нее не более чем на 5-10 мм. По мере прогрева объем воздуха в трубке будет возрастать и из открытого крана станут выходить пузырьки. В момент, когда температура воздуха сравняется с температурой теплой воды, выделение пузырьков прекратится. Это состояние воздуха в трубке принимают за исходное. Температуру воздуха в исходном состоянии T1 можно определить, если измерить температуру воды в стакане. Его объем V1 равен объему внутренней полости трубки.
После измерения температуры теплой воды воздух переводят в состояние с другими параметрами. Для этого закрывают кран, теплую воду сливают и заполняют стакан холодной водой, следя за тем , чтобы ее уровень над верхним краном оказался таким же, как в первой части опыта. После этого кран опять открывают. При охлаждении объем воздуха уменьшится , и через открытый кран в трубку поступит некоторое количество воды. Когда температуры воды и воздуха опять станут одинаковыми (через 1-2 минуты), приступают к определению параметров газа в новом состоянии.
Температуру воздуха вновь определяют по температуре воды. Чтобы определить его объем после охлаждения, закрывают верхний кран, трубку извлекают из калориметра и, удерживая вертикально, резко встряхивают несколько раз. При этом капли воды, попавшие внутрь, сольются и образуют неразрывный столбик. Измерив объем этого водяного столба и вычтя его из внутреннего объема трубки, узнают объем воздуха в конечном состоянии.
Измерение объемов в этой работе удобно проводить в условных единицах по длине ВОЗДУШНОГО или водяного столба: внутренняя полость трубки имеет форму цилиндра и ее объем V = Sl, но площадь поперечного сечения S в ходе опыта не меняется, и , чтобы не измерять эту величину, которая после подстановки в равенство (1) все равно сократится, объем выражают в единицах длины (см. рисунки).
Давление воздуха в трубке в первой и второй части опыта равнялось сумме атмосферного давления и давления небольшого столба воды над открытым краном. Поскольку уровень теплой и холодной воды не менялся, то эта сумма в ходе опыта не менялась, а значит и давление воздуха в трубке при его охлаждении оставалось постоянным, то есть процесс протекал изобарически.
В завершении работы сравнивают отношения объема воздуха к его температуре до и после охлаждения.
Указания к работе
1. Подготовьте таблицу для записи результатов измерений и вычислений:
| l1, см | t1, 0С | T1, 0К | Δl, см | l2, см | t2, 0С | T2, 0К | l1/T1 | l2/T2 |
| значение |
2. Измерьте длину воздушного столба в трубке — l1 (рисунок).
3. Закройте один кран и уложите трубку виток к витку в стакан калориметра. Кран на верхнем конце оставьте открытым.
4. Заполните стакан теплой водой и поместите в него термометр.
5. Наблюдайте за выделением пузырьков воздуха из открытого крана. Как только оно прекратится, определите и запишите показание термометра — t1, 0С.
6. Закройте кран, слейте теплую воду, заполните стакан холодной водой до прежнего уровня и снова откройте кран.
7. Выждав полторы — две минуты, определите и запишите показание термометра — t2, 0С.
8. Закройте кран, слейте воду, извлеките шланг из стакана, встряхните его и измерьте длину столба воды в нем — Δl (рисунок).
9. Вычислите длину столба охлажденного воздуха: l2 = l1 — Δl.
10. Переведите записанные показания термометра в градусы Кельвина: Т = t + 273°.
11. Вычислите отношения l1/T1 и l2/T2 и сделайте вывод о том, насколько точно изменение параметров газа в проделанном опыте соответствует закону Гей-Люссака.
12. Укажите причины, повлиявшие на точность полученных результатов.
Контрольные вопросы
- Почему процесс охлаждения воздуха в данной работе можно считать изобарным?
- Какие условия должны выполняться, чтобы, определяя параметры газа, можно было воспользоваться законом Гей-Люссака?
Если заметили ошибку, выделите фрагмент текста и нажмите Ctrl+Enter
Исследование изопроцессов в газах с помощью набора по молекулярной физике и термодинамике
Разделы: Физика
На основе набора по молекулярной физике и термодинамике предлагается описание лабораторных работ по изучению изотермического, изохорного и изобарного процесов над газами. Данные работы предназначены для учащихся 10-го класса.
I. ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА В ГАЗЕ
Цель работы: экспериментально проверить закон Бойля – Мариотта путем сравнения параметров газа в двух термодинамических состояниях.
Оборудование: трубка – резервуар с двумя кранами, манометрическая трубка, измерительная лента, спиртовой термометр, барометр-анероид.
Теоретическое обоснование
Закон Бойля – Мариотта определяет взаимосвязь давления и объема газа данной массы при постоянной температуре. Запись закона Бойля – Мариотта имеет вид: P1V1 = p2V2.
Вычтем из обеих частей этого равенства произведение p2V1 , получим
V1(p2 – p1) = p2(V1 – V2) или V Δp = p ΔV.
Порядок выполнения работы
1. Соберите экспериментальную установку.
2. Кончик манометрической трубки опустите в стакан с водой на глубину 1 см.
3. На другом конце трубки – резервуара закройте кран. Медленно надавите на трубку – резервуар в конце после крана, например ученической линейкой. Подсчитайте количество выделившихся пузырьков из манометрической трубки в воде N. Объем одного пузырька равен 4.7 * 10– 9м
4. Медленно уберите линейку. Оставшийся газ расширится, а давление уменьшится. Уменьшение давления можно определить по высоте столба воды в манометрической трубке h (Δp = ρж g h). Здесь ρж = 103кг/м3, g = 10 м/с2.
5. Измерьте высоту столба воды в манометрической трубке h.
6. Расчет производится по формуле V0 Δ p = p0 ΔV. Где p0 определяется по барометру, V0 объем трубки – резервуара (L = 2 м, D = 4*10– 3м, V0 = L πD2/4).
7. Опыт проводится при температуре окружающей среды T0.
Данные занесите в таблицу 1.
Таблица 1
| Т, oС | V0, м3 |
P0, Па |
Δp, Па |
ΔV, м3 |
P0 ΔV, Дж |
V0Δp, Дж |
|
|
|
|
|
|
|
8. Определите, на сколько процентов отличается значения в последних двух столбцах.
9. Сделать вывод.
II. ИЗУЧЕНИЕ ИЗОХОРНОГО ПРОЦЕССА В ГАЗЕ
Цель работы: экспериментально проверить закон Шарля путем сравнения параметров газа в двух термодинамических состояниях.
Оборудование: трубка – резервуар с двумя кранами, манометрическая трубка, измерительная лента, спиртовой термометр, барометр-анероид.
Теоретическое обоснование
Закон Шарля p1/T1 = p2/T2 определяет взаимосвязь давления и объема газа данной массы при постоянном объеме (V = const). Чтобы убедится в справедливости закона Шарля необходимо знать термодинамические параметры в двух состояниях газа. Атмосферное давление p0 при температуре Т2 и p при температуре окружающей среды Т1.
Порядок выполнения работы
1. Укладываем трубку-резервуар виток к витку в калориметр, предварительно закрыв кран на нижнем конце трубки. Кран, который окажется сверху, должен оставаться открытым.
2. Нальем в калориметр воду, нагретую до температуры 55 – 60oС, до тех пор, пока верхний кран не окажется на глубине 5-10 мм.
3. Подождать, пока из открытого крана не перестанут выделяться пузырьки воздуха. Температура воздуха в трубке и температура воды сравняются. Измерить температуру воды Т2. Давление газа при этом будет равно атмосферному р0. С помощью барометра измерить это давление.
4. Закрыть краник и подсоединить манометрическую трубку.
5. Извлечь трубку-резервуар из калориметра. Конец трубки-манометра опустить в стакан с водой и открыть кран. По мере остывания воздуха в трубке-резервуаре в манометрическую трубку будет заходить вода.
6. Подождать, пока газ охладится до температуры окружающей среды и измерить высоту столба в манометрической трубке h. Давление газа в трубке-резервуаре определится по формуле р1 = (р0 – Δр), где Δр = ρжg h. Температуру перевести в шкалу по Кельвину T = 273 + toC.
Полученные данные занести в таблицу 2.
Таблица 2
| Т1, К | Т2, К | р0*10– 5,Па | h, м | Δр*10– 5Па | Р1*10– 5. Па | Р0/Т2 | Р1/Т1 |
7. Определите, на сколько процентов отличается значения в последних двух столбцах.
8. Сделать вывод.
III. ИЗУЧЕНИЕ ИЗОБАРНОГО ПРОЦЕССА В ГАЗЕ
Цель работы: экспериментально проверить закон Гей-Люссака путем сравнения параметров газа в двух термодинамических состояниях.
Оборудование: трубка – резервуар с двумя кранами, манометрическая трубка, измерительная лента, спиртовой термометр, барометр-анероид.
Теоретическое обоснование
Закон Гей-Люссака определяет взаимосвязь объема и температуры газа данной массы при постоянном давлении (p = const), которая имеет вид V1/T1 = V2/T2. Чтобы проверить закон Гей-Люссака достаточно измерить объем и температуру газа в двух состояниях при постоянном давлении.
Порядок выполнения работы
1. Укладываем трубку-резервуар виток к витку в калориметр, предварительно закрыв кран на нижнем конце трубки. Кран, который окажется сверху, должен оставаться открытым.Нальем в калориметр воду, нагретую до температуры 55-60oС, до тех пор, пока верхний кран не окажется на глубине 5-10 мм.
2. Подождать, пока из открытого крана не перестанут выделяться пузырьки воздуха. Температура воздуха в трубке и температура воды сравняются. Измерить температуру воды Т1. Объем газа V1 равен объему всей трубки-резервуара V1 = Ls, где s – площадь сечения трубки-резервуара, L – длина трубки-резервуара (200 см).
3. Извлечь из калориметра трубку-резервуар, оставляя открытый конец трубки в воде, создать в ней мениск длиной не более 2 см. Этот мениск будет играть роль поршня.
По мере охлаждения газа поршень-мениск будет перемещаться в сторону уменьшения объема. Как только температура газа достигнет температуры окружающей среды Т2, мениск остановится.
4. Измерить длину l, которую прошел мениск до своего окончательного положения. Новый объем газа будет равен V2 = (L – l)s.
5. Найти отношения T1/L и T2/(L – l).
Полученные данные занести в таблицу 3
Таблица 3
Т1, К |
Т2, К | L, см | L, см | T1/L | T2/(L – l) |
6. Определите, на сколько процентов отличается значения в последних двух столбцах.
7. Сделать вывод.
Литература:
1. Учебное оборудование для кабинетов физики. Под ред. Г.Г.Никифорова. 3-е издание. – М.: Дрофа, 2008.
29.01.2012
urok.1sept.ru
Бланки лабораторных работ по Мякишеву, 10 класс
Фамилия И.__________________________________________ Класс: 10
Дата: «________» __________________________ 2012год
Лабораторная работа № 1
Изучение движения тела по окружности
под действием сил упругости и тяжести
Инструктаж по ТБ пройден._____________________
Цель работы: ____________________________________________________________________________________________________________________ Оборудование:_________________________________________________________________________________________________________
Ход работы: изучив теорию Л.Р. № 1 в учебнике (стр. ______)
Измерю массу шарика с точностью до 1г.
Начерчу на листе бумаги окружность радиусом ______ см. Радиус измерю с точностью до 1 см.
Установлю маятник так, чтобы в состоянии покоя маятник находился над центром окружности.
Измерю время, за которое маятник совершает 50 полных оборотов (по окружности).
Измерю высоту маятника от точки подвеса до центра шарика.
Рассчитаю модуль центростремительного ускорения по формулам:
, , ,
F1 – узнаю, оттянув динамометром горизонтально шарик на расстояние, равное радиусу окружности.
Результаты измерений и вычислений занесу в таблицу:
R, м
N
∆t, с
h, м
m, кг
Сравню три полученных ускорения: ________ __________ _________
Вывод: _____________________________________________________________________________________________________________________________________________________________________________________________
Оценка _____________ _________ Т.А. Данильченко
Фамилия И.__________________________________________ Класс: 10
Дата: «________» __________________________ 2012год
Лабораторная работа № 2
Изучение закона сохранения механической энергии
Инструктаж по ТБ пройден._____________________
Цель работы: ____________________________________________________________________________________________________________________ Оборудование:_________________________________________________________________________________________________________
Ход работы: изучив теорию Л.Р. № 2 в учебнике (стр. ______)
Измерю вес груза F1=mg
Измерю расстояние l от крючка динамометра до центра тяжести груза.
Подниму груз до высоты крючка динамометра и отпущу его. Поднимая груз, расслаблю пружину и укреплю фиксатор около ограничительной скобы.
Сниму груз и по положению фиксатора измерю линейкой максимальное удлинение пружины, ∆l.
Растяну рукой пружину до соприкосновения фиксатора с ограничительной скобой и отсчитаю по шкале максимальное значение модуля силы упругости пружины. Средее значении силы упругости равно F/2.
Найду высоту падения груза. h = l+∆l
Вычислю потенциальную энергию системы в первом положении груза: Ep1=mgh=F1(l+∆l)
Ep2=F∆l/2
Результаты измерений и вычислений занесу в таблицу.
F1=mg
l
∆l
F
h = l+∆l
Ep1 =F1(l+∆l)
Ep2=F∆l/2
Сравню значения потенциальной энергии ________ __________
Вывод: _____________________________________________________________________________________________________________________________________________________________________________________________
Оценка _____________ _________ Т.А. Данильченко
Фамилия И.__________________________________________ Класс: 10
Дата: «_____» __________________________ 2012год
Лабораторная работа № 3
Опытная проверка закона Гей-Люссака
Инструктаж по ТБ пройден._____________________
Цель работы: опытным путем убедиться в справедливости закона, описывающего изобарный процесс. Оборудование:_________________________________________________________________________________________________________
Ход работы: изучив теорию Л.Р. № 3 в учебнике (стр. ______)
Подготовлю стакан с водой комнатной температуры и стакан с горячей водой.
Приведу воздух в трубке во втрое состояние так, как указано в учебнике. Измерю длину воздушного столба l2и температуру окружающего воздуха T2.
Вычислю l1/l2 и T1/T2 и абсолютные погрешности этих измерений по формулам: _______________________________________________________________
Занесу измерения и вычисления в таблицу:
ИЗМЕРЕНО:
Вычислено:
l1, мм
l2, мм
t1,0С
t2,0С
∆иl, мм
∆оl, мм
∆l, мм
Т1,К
Т2,К
∆иТ, К
Вычислено:
∆оТ, К
∆Т, К
l1/l2
ε1,%
∆1
T1/T2
ε2,%
∆2
Сделаю вывод о справедливости закона Гей-Люссака: ______________________________________________________________________________________________________________________________
Отвечу на контрольные вопросы (см учебник)
________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________
Фамилия И.__________________________________________ Класс: 10
Дата: «________» __________________________ 2013год
Лабораторная работа № 4
Изучение последовательного и параллельного соединения проводников
Инструктаж по ТБ пройден._____________________
Цель работы: Изучить основные характеристики электрического тока при различных соединениях
Оборудование:_____________________________________________________________________________________________________________________________________________________________
Ход работы:
Изучу теорию работы в учебнике на стр___________
Соберу последовательную цепь по схеме:
Измерю силу тока и напряжение
на различных участках цепи.
Рассчитаю сопротивления резисторов.
Проверю верность законов:
__________________________________
__________________________________
__________________________________
Соберу параллельную цепь по схеме:
Измерю силу тока и напряжение
на различных участках цепи.
Рассчитаю сопротивления резисторов.
Проверю верность законов:
__________________________________
__________________________________
__________________________________
Результаты измерений и вычислений занесу в таблицу:
соединение
U1
U2
U
I1
I2
I
R1
R2
R
последовательное
параллельное
Вывод: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________ _________________
Фамилия И.__________________________________________ Класс: 10
Дата: «________» __________________________ 2013год
Лабораторная работа № 5
Измерение ЭДС и внутреннего сопротивления источника тока
Инструктаж по ТБ пройден._____________________
Цель работы: убедиться на опыте в справедливости закона Ома для полной цепи
Оборудование:_________________________________________________________________________________________________________________________________________________________________________
Ход работы:
Изучу теорию работы в учебнике на стр _______.
Соберу цепь по схеме:
Измерю ЭДС источника тока.
Сниму показания амперметра, вольтметра,
вычислю внутреннее сопротивление
источника тока по формуле:
Вычислю абсолютную и относительную погрешности ЭДС и внутреннего сопротивления источника тока (расчеты на обратной стороне бланка).
Результаты измерений и вычислений занесу в таблицу:
ИЗМЕРЕНО:
ВЫЧИСЛЕНО:
Uпр, В
Iпр, А
ξпр,
В
∆иU
В
∆оU
В
∆U
В
εU,
%
εξ
%
rпр
Ом
∆иI
А
∆оI
А
∆I
А
εI
%
εr
%
∆r,
Ом
Вывод: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
КОНТРОЛЬНЫЙ ВОПРОС: Почему показания вольтметра при замкнутом и разомкнутом ключе различны? ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________ _________________
infourok.ru
Изучение изобарного процесса — КиберПедия
Цель лабораторной работы
Целью лабораторной работы является экспериментальное изучение изобарного процесса в газе.
Задачи лабораторной работы
Задачи лабораторной работы:
1) получение экспериментальных точек зависимости давления от температуры газа при его остывании в условиях постоянного давления;
2) проверка соответствия полученной экспериментальной зависимости закону Гей-Люссака для изобарного процесса в идеальном газе.
Экспериментальное оборудование, приборы и принадлежности
 |
Лабораторная установка
Представляет собой герметичный резервуар 1 (полупрозрачный цилиндр из пластика с гофрированной боковой поверхностью), составляющий единую конструкцию с датчиком изменения объема 2. Элементы установки размещены на кронштейне 3, который фиксируется на стойке штатива. Конструкция установки обеспечивает перемещение подвижного верхнего основания цилиндра с горловиной вдоль его продольной оси. Это основание цилиндра жестко связано с подвижной частью датчика изменения объема, и таким образом, осуществляется регистрация объема цилиндра с гофрированными стенками.
Нижнее основание цилиндра закреплено на кронштейне и остается неподвижным.
Горловина цилиндра закрыта пробкой, через которую внутрь вводится кабель чувствительного элемента датчика температуры и трубка для заполнения цилиндра воздухом. В рабочем состоянии сообщение внутреннего объема цилиндра с атмосферой перекрывается с помощью зажима, устанавливаемого на трубку.
Чувствительный элемент датчика температуры 3 расположен на оси цилиндра в его центральной части. Электронная схема датчика температуры смонтирована на плате датчика объема газа. Датчики температуры и объема выполнены на едином микроконтроллере, поэтому подключение их к компьютеру осуществляется одним кабелем.
Датчик объема газа, используемый в установке, требует предварительной настройки, которая выполняется после подключения датчиков к компьютеру.
Конструкция установки ограничивает деформацию цилиндра с гофрированными стенками. Предельные положения подвижного основания цилиндра соответствуют внутреннему объему в 300 и 720 мл соответственно.
В течение эксперимента установку следует размещать вертикально, так чтобы гофрированный цилиндр находился внизу.
Кроме того, в состав установки входит штатив, муфта и пластиковый сосуд для горячей воды.
К приборам и принадлежностям относятся компьютер с необходимым программным обеспечением для регистрации и обработки данных, а также соединительный кабель.
Теоретическая часть
Изобарным называется процесс, протекающий в системе при постоянном давлении. Примером изобарного процесса может служить расширение газа в цилиндре со свободно ходящим поршнем. В этом случае давление газа будет равно атмосферному. Если изобарный процесс происходит настолько медленно, что давление в системе можно считать постоянным и равным внешнему давлению, а температура меняется так медленно, что в каждый момент времени сохраняется термодинамическое равновесие, то изобарный процесс обратим. Для осуществления изобарного процесса к системе надо подводить или отводить теплоту, которая расходуется на работу при изменении объема и изменение внутренней энергии.
Объем идеального газа при изобарном процессе в соответствии с законом Гей-Люссака пропорционален температуре. Масса и состав газа при этом должны быть неизменными. Изобарный процесс описывается уравнением:
V = VoαT,
где V — объем газа при абсолютной температуре Т, V0— объем газа при температуре 0°С, а — температурный коэффициент объемного расширения газа, равный 1/273 К-1 (≈ 0,0037 К-1). Если температура измеряется в градусах Цельсия, то зависимость давления от температуры tпринимает вид:
V=V0(1+αt).
Таким образом, в первом случае экспериментальные точки должны «лечь» на график прямой пропорциональной зависимости у=Aх, а во втором — на график линейной зависимости, причём угловой коэффициент прямой в обоих случаях одинаков и равен aV0
cyberpedia.su
Лабораторная работа Изопроцессы в газах.
Лабораторная работа № 5
Тема: Исследование изопроцессов в газах.
Цель работы: на опыте проверить изотермический, изохорический и изобарного процессов в газах.
Оборудование: пластиковый сосуд, Медицинский манометр, шприц, зажимы, тройник, трубка ПВХ, термометр, барометр, стакан.
Теория: Газовые законы.
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа. Всякое изменение состояния газа называется термодинамическим процессом. Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами. Изопроцессы являются идеализированной моделью реального процесса в газе.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре. Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Изобарный процесс (p =const)
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении. Изобарный процесс в идеальном газе подчиняется закону Гей-Люссака:
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени.
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме. Изохорный процесс в идеальном газе подчиняется закону Шарля:
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется. Формулу закона можно записать иначе где — параметры газа в разные моменты времени
Схема установки
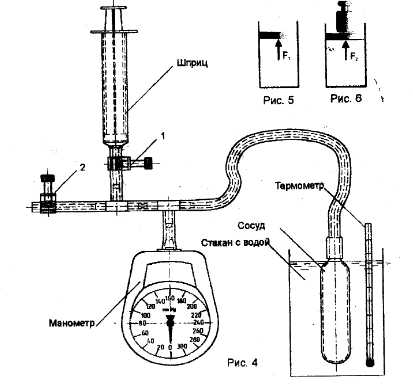
Указание к работе:
1.Изучение изотермического процесса
Открыть зажимы 1,2 и вывести поршень шприца в положение полного объема(10 мл). В этом случае воздух в сосуде сообщается с атмосферой, его температура и давление равны атмосферному.
Зафиксировать по барометру анероиду в кабинете атмосферное давление, а по показаниям термометра температуру воздуха.
Закрыть зажим 2 и, постепенно вводя поршень, зафиксировать показания приборов, занося их в таблицу
После определения объема воздуха и его давления в каждом опыте рассчитайте их произведения.
№ опыта | Объем воздуха в системе, V,мл | Давление в сосуде Р=ратм+рманом | Произведение давления воздуха на его объем, рV |
1 | 50+10 | ||
2 | 50+7 | ||
3 | 50+5 | ||
4 | 50+3 |
Сравните результаты расчетов и сделайте вывод о выполнении закона Бойля-Мариотта
2.Изучение изобарного процесса
Открыть зажимы 1,2 установить поршень на делении 2мл, и закрыть зажим 2. Плавным перемещением поршня установить на манометре давление , например 30 мм.рт.ст.
Измерьте температуру окружающей среды и объем воздуха в замкнутой системе, заполните таблицу:
№опыта | Давление Р=ратм+рманом | Объем воздуха в системе, V,мл | Абсолютная температура, Т |
1 | |||
2 |
Поместите в стакан с горячей водой сосуд и термометр, снять показание термометра когда воздух в сосуде достаточно прогреется. Следить за показанием манометра, что бы показания оставались постоянными (регулируя штоком шприца).
По данным таблицы сделайте расчеты и убедитесь в справедливости закона Гей-Люссака.
3. Изучение изохорного процесса
Выжать воздух из шприца и пережать трубку зажимом 1. Убедится в нулевых показаниях монометра, пережать трубку зажимом 2.
Измерить температуру окружающей среды, а барометром атмосферное давление.
№опыта | Объем, мл | Давление | Температура, Т |
1 | |||
2 |
Поместить в стакан с горячей водой сосуд и термометр. Снять показания термометра и манометра после прогрева воздуха в сосуде, занести результаты в таблицу.
По данным таблицы и расчетам, проделанным по формуле, убедитесь в справедливости закона Шарля
multiurok.ru
Лабораторная работа №6 «Изучение изопроцессов в газе» 10 класс, физико — математический профиль.
Лабораторная работа №6 «Изучение изопроцессов в газе»
10 класс, физико — математический профиль.
ЦЕЛЬ: Обеспечить выполнение обучающимися, экспериментальных исследований изопроцессов в газах при помощи современного оборудования LabQuest 2.
ЗАДАЧИ УРОКА:
-Провести ряд экспериментов, каждый из которых иллюстрирует газовый закон.
-Произвести вычисления , необходимые для определения газового закона в каждом опыте Из ваших результатов вывести единое математическое соотношение для давления , объема, температуры и при обсуждении работы доказать справедливость законов.
-Развивать исследовательскую и творческую деятельность обучающихся, которая активизирует познавательные интересы.
— Добиваться последовательности и аккуратности записи результатов при экспериментальных исследованиях и формирование навыков работы в команде.
Оборудование:
Компьютерный интерфейс LabQuest 2
Компьютер
Датчик давления
Датчик темтературы
20-мл газовый шприц
Пластиковые трубки с двумя соединителями с наконечниками Люера
Резиновая пробка с двухходовым клапаном
Контейнер большого объема для водяной бани ( 10см диаметр и 25 см длинной)
125-мл колба Эрленмейера
Горячая плитка
Лед
100-мл мерный цилиндр
Планируемые результаты обучения:
Обучающиеся должны уметь составлять гипотезу, проводить эксперимент и делать выводы.
Организационные формы: работа в группах, самостоятельная поисковая работа.
Ход урока
Ориентировочно-мотивационный этап.(3 мин)
Окружающий нас воздух настолько нам необходим и привычен, что о нем мы вспоминаем в ситуациях, когда его не хватает. Действительно, что воздух- это наша среда обитания и необходимый фактор нашей жизнедеятельности .Воздухом мы дышим и получаем для организма кислород, воздух нас охлаждает и нагревает , переносит влагу и удивительные ароматы цветов. Для описания многих свойств воздуха и других газов используется модель идеального газ, в которой молекулы или атомы газов рассматриваются как упругие шары, которые находятся в постоянном хаотическом движении и обмениваются энергией при упругих столкновениях. Состояние данной массы газа однозначно определяется заданием любых пар макроскопических параметров: (P,V) (P,T) (V,T).Процессы взаимного изменения этих пар параметров при неизменном третьем называются изопроцессами. Теоретически мы с вами эти процессы уже изучили, сегодня мы докажем эти зависимости через ряд экспериментов.
При подготовке к уроку учащиеся выбирают карточки по форме ( квадрат –группа1, прямоугольник- группа 2, треугольник- группа 3) Назначаются два эксперта (отлично владеющие теорией и практикой предстоящего эксперимента, которые будут выполнять роль помощников учителя во время урока)
Операционно-исполнительный этап.(25-30 мин)
На уроке рассаживаются в зависимости от выбранной фигуры. (на столах приготовлен материал для выполнение лабораторной работы ,без интерфейса. После знакомства с теорией и оборудованием , выдвижения гипотезы, составления плана действий по доказательству или опровержению гипотезы , каждый вносит свой вклад . )
Обучаемые в одной группе оформляют общее исследование на уроке, а дома каждый из них сделает индивидуальный отчет. Для каждой группы выделяется время работы с интерфейсом , в режиме не более 10 мин на снятие данных, их графический анализ и распечатку, а также сохранения информации для защиты.
Этап закрепления и применения изученного(10-15мин)
Для защиты предоставляется проект, отражающий основные моменты работы .Цель, гипотеза, результаты работы, выводы, графическое подтверждение -3-4мин на каждую группу.
Рефлексия, эксперты ставят оценку группе и каждый сам оценивает себя в группе ( итоговая оценка выводиться из трех , эксперта ,учителя и ученика)
самооценивание | Оценка эксперта | Оценка учителя | Средний бал |
Д/з: сделать индивидуальный отчет по лабораторной работе.
Цель | Гипотеза | План | Результат | Выводы |
Графики.
Приложения к уроку 1.
Компетентностно – ориентированное задание для группы 1.
Стимул-Проводя ряд опытов, каждый из которых иллюстрирует определенный газовый закон, используя оборудование и материалы для каждого опыта вы экспериментально будете исследовать три свойства газов: давление , объем, температура. Собирая оборудование , проводя тестирование и анализируя ваши данные и наблюдения , вы сможете описать газовые законы как качественно, так и математически.
Копетенция- информационная, коммуникативная
Теория
Изопроцессы
Изопроцессы — это процессы, протекающие при неизменном значении одного из макроскопических параметров (р, V, Т).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Изотермический процесс описывает закон Бойля- Мариотта, открытый в 1861 г. английским ученым Р. Бой-лем (1627-1691) и в 1876 г. французским ученым Э. Мари-оттом (1620-1684). При постоянной массе газа pV = const.
Для газа данной массы произведение давления на его объем постоянно, если температура не меняется.
Графики изотермического процесса в координатах р-V; р-Т; V-Т имеют следующий вид (рис. 27):
Задание1
Составить 3 контрольных вопроса по теме.
Задание2
Вам нужно выбрать наилучший способ проведения испытания , поэтому следует составить план , в соответствии с выдвинутой гипотезой. Вы можете проводить испытания без сбора данных , чтобы наблюдать , как протекает эксперимент .
В опыте вы будете исследовать соотношение между двумя из четырех переменных, а остальные две будут константами. В предварительном задании постройте график , который описывает вашу гипотезу относительно математического соотношения между двумя переменными .
Исследуйте зависимость между давлением и объемом. Можете использовать предложенный план проведения эксперимента или составить свой.
Наденьте защитные очки.
Разместите поршень пластикового 20-мл шприца так, чтобы в цилиндре его находился измеряемый объем воздуха. Прикрепите шприц к клапану датчика давления газа.( фото 1)Посмотрите на объем на переднем крае внутреннего черного кольца на поршне шприца.
Подключите датчик давления газа к каналу 1 интерфейса и интерфейс – к компьютеру
Запустите программу Logger Pro на вашем компьтере. На экране интерфейса отобразятся каналы датчиков.
Измерьте давление воздуха в шприце при разных объемах. Распечатайте график и данные. Лучшие результаты получаются при сборе по меньшей мере 6 точек данных.
Анализ данных
Для опыта напишите уравнение с использованием двух переменных и и константы пропорциональности.
Рассчитайте костанту , для каждого газового закона, которые вы исследовали. Это значение может быть средним для каждой пары данных опыта. Попробуйте объяснить как вы получили ваш результат
Фото1. 
Возможный вариант отчета.
Группа 2.
Компетентностно – ориентированное задание для группы 2.
Стимул-Проводя ряд опытов, каждый из которых иллюстрирует определенный газовый закон, используя оборудование и материалы для каждого опыта вы экспериментально будете исследовать три свойства газов: давление , объем, температура. Собирая оборудование , проводя тестирование и анализируя ваши данные и наблюдения , вы сможете описать газовые законы как качественно, так и математически.
Копетенция- информационная, коммуникативная
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным. Из уравнения Менделеева-Клапейрона можно записать:
Для данной массы газа отношение давления к температуре постоянно, если его объем не меняется. Графики изохорного процесса в координатах р-V; V-Т; р-Т имеют следующий вид (см. рис. 29). Этот закон был установлен экспериментально в 1787 г. Ж. Шарлем (1746-1823).
Задание 1.
Составить 3 контрольных вопроса по теме.
Задание 2. Можете использовать предложенный план проведения эксперимента или составить свой.
1.В данном опыте вы должны исследовать соотношение между абсолютной температурой газа и давлением. С помощью аппарата, показанного на фото 2.вы должны поместить колбу Эрленмейера , содержащую образец газа ,в водяную ванну и изменять температуру ванны.
2.Подключите датчик давления газа к каналу 1, а датчик температуры- к каналу 2 интерфейса.
3. Соберите установку , показанную на фото . Следите , чтобы все соединения были газонепроницаемы. Проверьте , чтобы резиновая пробка и горлышко колбы были сухими, затем плотно закройте её.
4.В новом файле соберите пары данных одновременно с датчиков давления и температуры при разных её значениях.
5.Помещайте водяную баню в большие контейнеры по мере необходимости. Распечатайте график и данные.
Анализ данных
Для опыта напишите уравнение с использованием двух переменных и иконстанты пропорциональности.
Рассчитайте костанту , для каждого газового закона, которые вы исследовали. Это значение может быть средним для каждой пары данных опыта.
Попробуйте обьяснить как вы получили ваш результат
Фото2.

Группа 3.
Компетентностно – ориентированное задание для группы 3.
Стимул-Проводя ряд опытов, каждый из которых иллюстрирует определенный газовый закон, используя оборудование и материалы для каждого опыта вы экспериментально будете исследовать три свойства газов: давление , объем, температура. Собирая оборудование , проводя тестирование и анализируя ваши данные и наблюдения , вы сможете описать газовые законы как качественно, так и математически.
Копетенция-информационная,коммуникативная
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным. Из уравнения Менделеева-Клапейрона следует, что при
постоянной массе газа
Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется.
Этот закон был установлен экспериментально в 1802 г. французским ученым Ж. Гей-Люссаком (1778-1850).
Графики изобарического процесса в координатах р-V; V-Т; р-Т имеют следующий вид (рис. 28):
Задание 1.
Составить 3 контрольных вопроса по теме.
Задание 2.
В данном опыте вы должны исследовать соотношение между объемом образца газа и абсолютной температурой газа. Можете использовать предложенный план проведения эксперимента или составить свой.
С помощью установки, показанного на фото 3. поместить колбу Эрленмейера ,в водяную ванну и изменять ее температуру .Помните:
1.Если вы начинаете с холодной воды, установите поршень шприца на отметку 0мл. Это позволит объему газа увеличиваться в более теплой ванне.
Температуру водяной ванны нельзя увеличивать более 30-40 градусов от начальной.
Даже если вы не строите график давления , важно отслеживать , чтобы оно оставалось постоянным.
Важно знать общий объем воздуха в колбе и шприце. Объем колбы, до донышка резиновой пробки, нужно точно измерить с помощью мерного цилиндра. Для определённого объема трубок( от пробки до корпуса датчика давления газа) , а также в клапане под днищем шприца используйте значение 4мл.
2.Следите чтобы датчик давления газа был подключен к каналу 1, а датчик температуры- к каналу 2 интерфейса.
3.Соберите установку как на фото 4.. Следите , чтобы резиновая пробка и горлышко колбы были сухими , плотно закрывайте её. Уровень воды должен быть по меньшей мере таким же , как у замкнутого воздуха в шприце.
4.Соберите данные об объеме при нескольких разных температурах. Устанавливайте водяную баню в большие контейнера по мере необходимости , начиная с ледяной воды и до теплой. Распечатайте график и данные.
Анализ данных
Для опыта напишите уравнение с использованием двух переменных и и константы пропорциональности.
Рассчитайте костанту , для каждого газового закона, которые вы исследовали. Это значение может быть средним для каждой пары данных опыта. Попробуйте объяснить как вы получили ваш результат
Фото 3.

Приложение2.
Критерии самооценки работы в группе
Критерий (за каждый критерий – от 0 до 5 баллов) | Моя оценка | Оценка группы | Комментарий учителя |
Я пытался внестимаксимальный вклад в работугруппы |
|
|
|
Я умеювыслушивать чужие аргументы,принимать другуюточку зрения |
|
|
|
Я умею объяснятьсвою точку зрения, приводить доводы и убеждать |
|
|
|
Я отстаиваю своемнение корректно |
|
|
|
Я готов(а) принимать новые и неожиданные идеи, отличающиеся от моегопервоначальногомнения |
|
|
|
Я пытаюсьвыяснить все взгляды напроблему, чтобы решить еекомплексно |
|
|
|
Я умеюформулировать проблему иразбивать ее на отдельные задачи |
|
|
|
Я умею работать вкоманде: иногда – брать на себяответственность, иногда -подчиняться |
|
|
|
Критерии общей оценки группы
Утверждение | Ваш комментарий |
Наша группа работала как единая команда |
|
Мы сотрудничали и решали наши проблемы вместе |
|
Мы обсуждали решения и принимали решения вместе |
|
Мы поддерживали друг друга и помогали друг другу |
|
В нашей группе уважается мнение каждого |
|
В нашей группе ценятся таланты и способности каждого |
|
kopilkaurokov.ru
