«Скорость химической реакции. Химическое равновесие» 11 класс проф уровень
Практическая работа по теме: «Скорость химической реакции. Химическое равновесие»
1. Для увеличения скорости химической реакцииFe0 +Cu2+=Fe2++Cu0
необходимо
1) увеличить концентрацию ионов железа
2) размельчить железо
3) уменьшить температуру
4) увеличить концентрацию ионов меди
5) увеличить концентрацию атомов меди
1)Поместите в одну пробирку железную проволоку длиной 10 мм или гвоздь, а в другую – железные опилки. Добавьте по 1 мл раствора хлорида меди(II).В какой пробирке быстрее произошло изменение цвета?
2)Возьмите в 2 пробирки по 1 грануле Zn и добавьте немного р-ра HCl разной конц
Что наблюдали в первом и втором эксперименте?
BI В растворе протекает реакция
2А + 3В→ С.
Kакие факторы влияют на скорость данных химических реакций?
______________
Какой закон описывает зависимость с.х.р. от температуры?
______________
2. Увеличение температуры видимо повлияет на скорость реакций:
1) CuO+H2SO4=CuSO4+H2O
2) NaOH + HCl=NaCl+H2O
3) FeCl3+3KOH=3KCl+Fe(OH)3
4) СH2-(CHOH)4-COH +2Cu(OH)2=Cu2O +
СH2-(CHOH)4COOH + 2H2O
5) BaCl2+K2SO4=BaSO4+2KCl
Докажите, выбранные вами ответы экспериментально, используя имеющиеся у вас реактивыКакая из проделанных вами реакций является качественной?
BI Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30ºдо 70º С, если температурный коэффициент скорости равен 2?
Kакой фактор влияет на скорость данной химической реакции?
______________
Какому правилу подчиняется эта зависимость?
______________
3. Какие металлы реагируют с раствором серной кислотой быстрее?
Какие металлы реагируют с раствором серной кислотой быстрее?
1) Zn 2) Fe
3) Mg 4) Ag
4. На скорость каких реакций повлияет присутствие катализатора?
1) H2SO4+2KOH=K2SO4+2H2O
2) H2O2=H2O+O2
3) 2KMnO4=K2MnO4+MnO2+O2
4) 2SO2+O2=2SO3
В присутствии катализатора образуются непрочные промежуточные соединения с участием катализатора. В этом можно убедиться, применив в качестве катализатора разложения HДокажите ваш ответ экспериментально, используя имеющиеся у вас реактивы
1) Налить в пробирку приблизительно 1-2 мл H2O2 и прибавить небольшое количество оксида марганца (IV) MnO2.
Повторить опыт, заменив катализатор MnO2 на такое же количества катализатора Fe2О3
2) в химический стаканчик насыпьте немного сухих дрожжей и добавьте раствор перекиси водорода
Какое вещество в этом опыте выполняет роль катализатора?
Запишите возможные уравнения реакций, дайте им краткую характеристику
ПРОБЛЕМНЫЙ ВОПРОС
«Возможно ли влияние меди и формалина на скорость реакции Al с HCl, если эти вещества сами по себе с соляной кислотой не реагируют?»
Al+HCl=?
Al(Cu)+HCl=?
Al(формалин)+HCl=?
Ответ подтвердите экспериментально
Kакой фактор влияет на скорость данной химической реакции?
________________
Kакой фактор влияет на скорость данных химических реакций?
5. В системе
В системе
смещению химического равновесия в сторону исходных веществ будет способствовать
1) уменьшение давления
2) уменьшение температуры
3) увеличение давления
4) уменьшение концентрации
5) уменьшение концентрации
В две пробирки налить по 2-3 мл раствора крахмала и добавить 3-4 капли 0,1 н. раствора I2. Отметить цвет растворов. Одну пробирку оставить для сравнения, другую нагреть до исчезновения окраски. Охладить пробирку после нагревания. Отметить окраску раствора
а) объяснить исчезновение окраски раствора при нагревании и появлении вновь синей окраски после охлаждения раствора;
б) объяснить, в каком направлении смещается при нагревании и при охлаждении равновесие в системе: йод + крахмал ⇄ йодокрахмал;
в) экзо- или эндотермическим процессом является реакция образова-ния йодокрахмал
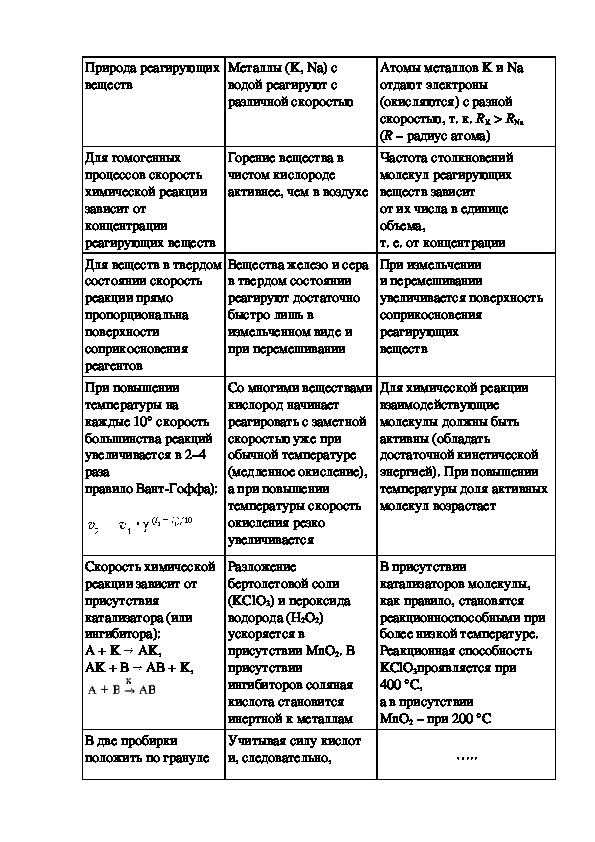
Перечислите факторы, влияющие на химическое равновесие:
Изучение влияния различных факторов на скорость химических
Опыт 1
Цинк быстрее реагирует с разбавленной соляной кислотой, чем с разбавленной уксусной кислотой.
Zn + 2HCl ⟶ ZnCl2 + H2↑
Zn + 2H+ + 2Cl— ⟶ Zn + 2Cl— + H2↑
Zn + 2H+ ⟶ Zn + H2↑
Zn + 2CH3COOH ⟶ (CH3COO)2Zn + H2↑
Вывод: скорость химической реакции зависит от природы реагирующих веществ.
Опыт 2
Разбавленная соляная кислота быстрее реагирует с порошком железа, чем с железными стружками.
Fe + 2HCl ⟶ FeCl2 + H2↑
Fe + 2H+ + 2Cl— ⟶ Fe + 2Cl— + H2↑
Fe + 2H+ ⟶ Fe + H2↑
Вывод: скорость химической реакции зависит от площади поверхности реагирующих веществ, чем она больше, тем быстрее протекает химическая реакция.
Опыт 3
Цинк быстрее реагирует с разбавленной 1:5 серной кислотой, чем с разбавленной 1:10 серной кислотой.
Zn + H2SO4 ⟶ ZnSO4 + H2↑
Zn + 2H+ + SO42- ⟶ Zn + SO42- + H2↑
Zn + 2H+ ⟶ Zn + H2↑
Вывод: скорость химической реакции зависит от концентрации реагирующих веществ, чем она больше, тем быстрее протекает химическая реакция.
Опыт 4
При нагревании цинк реагирует с разбавленной серной кислотой быстрее.
Zn + H2SO4 ⟶ ZnSO4 + H2↑
Zn + 2H+ + SO42- ⟶ Zn + SO42- + H2↑
Zn + 2H+ ⟶ Zn + H2↑
Вывод: скорость химической реакции зависит от температуры, чем она больше, тем быстрее протекает химическая реакция.
gomolog.ru1https://gomolog.ru/reshebniki/11-klass/rudzitis-i-feldman-2019/14/lab.html
Методическая разработка урока по химии в 11 классе «Скорость химической реакции»
Урок химии в 11 классе.
Тема: Скорость химической реакции. Факторы, влияющие на скорость.
Тип урока: изучение и первичное закрепление новых знаний.
Цель: обобщить и расширить сведения учащихся о скорости химической реакции, о факторах, влияющих на скорость химической реакции в процессе эксперимента и объяснить кинетические закономерности, которым подчиняется реакция.
Задачи:
Образовательные: 1. Продолжить формировать понятия о скорости, зависимость от
различных факторов
2. Проконтролировать умение проводить расчеты, используя необходимые
законы.
3. Продолжить формирование умений работать с лабораторным
оборудованием.
4. Продолжать формирование умения наблюдать
5. Продолжать формирование навыков работы с учебником, навыков
Самостоятельного добывания знаний.
6. Осуществлять межпредметные связи
Воспитательные: 1. Воспитание ответственности
2. Воспитание умения работать в коллективе
3. Продолжать формирование соблюдения правил техники безопасности
при проведении лабораторных опытов.
4. Воспитание аккуратности, соблюдая порядок на рабочем месте
при проведении лабораторных опытов
5. Воспитание самостоятельности
Развивающие: 1. Развивать наблюдательность
2. Развивать умение сравнивать, формулировать выводы, основываясь на
Развивать умение сравнивать, формулировать выводы, основываясь на
наблюдаемых явлениях.
3. Развивать речь учащихся в ходе решения образовательных и
воспитательных задач.
4. Развивать память и внимание учащихся.
Оборудование:
Компьютер, проектор, инструкции для учащихся, лабораторное оборудование.
Ход урока:
Этапы урока | Деятельность учителя | Деятельность учащихся |
Организационный (1 мин) — организация начала урока — мотивация учебной деятельности Цели для учащихся: Включиться в деловой ритм урока Определить практическое значение темы Цели для учителя: Создать благоприятную психологическую атмосферу урока, включить учащихся в деловой ритм урока Посредством ответов учащихся сформулировать цели и задачи урока Методы организации работы: Беседа с использованием проблемных вопросов Форма организации работы: Фронтальная, коллективная (эвристическая) беседа Опрос учащихся по ранее изученному материалу (актуализация опорных знаний) Цели для учащихся: -вспомнить основные понятия и термины по теме «Химические реакции» Цели и задачи для учителя: Воспроизвести необходимые для овладения новым материалом знания учащихся о химических реакциях Оценить уровень подготовленности учащихся, скорректировать их знания, проверить готовность к восприятию новой информации. Методы организации работы: фронтальный опрос Форма организации работы: фронтальная Объяснение нового учебного материала Цели для учащихся: Сформулировать понятие скорости химической реакции Доказать зависимость скорости от различных факторов Продолжить формирование навыков в решении задач Цели для учителя: Дать определение скорости Определить разницу между гомогенными и гетерогенными системами Дать понятие энергии активации Помочь учащимся в закреплении практических навыков при проведении лабораторных опытов и в решении задач Методы организации работы: Использование проблемных вопросов Рассказ учителя Практическая работа Самостоятельная работа учащихся Формы организации работы: индивидуальная групповая фронтальная 4. Цели для учащихся: Закрепить знания по теме Продолжить формирование навыков в решении задач Цели для учителя: Осуществить первичную проверку усвоения и понимания нового материала Проконтролировать навыки учащихся в решении и оформлении задач Установить соответствие между поставленными задачами на урок и его результатами Подвести итоги урока Методы организации работы: Фронтальная беседа Решение задач 5.Задание на дом Цели для учащихся: Получить задание для домашней самостоятельной работы Цели для учителя: Объяснить особеннос- ти выполнения домашнего задания Мотивировать выполнение учащимися домашнего задания хорошими оценками | Организационный момент -1 мин. Активизация знаний, целеполагание – 2 мин. Тема нашего урока: «Скорость химической реакции. Факторы, влияющие на скорость.»(слайд) Мы изучаем закономерности химических реакций, которые нас сопровождают всю жизнь -А зачем нужны знания о скорости химической реакции? — Приведите примеры, с помощью которых можно подтвердить, что химические реакции протекают с различной скоростью? — Вспомните понятие скорости из 9 класса -Сегодня на уроке мы должны: (слайд): Цели: Сформулировать понятие скорости химической реакции. Вывести формулы для вычисления скорости Рассмотреть и объяснить влияние различных факторов на скорость химической реакции Закрепить навыки в решении задач по вычислению скорости химической реакции А начать мне хочется со слов: «Кто мало знает, для того и этого много, кто много знает, тому и этого мало…»(слайд) Терминологический бой (10 мин) «На один химический вопрос может быть несколько правильных ответов, но мы выбираем один»(слайд) Примерные вопросы для устного опроса в приложении №1. «Могущество разума беспредельно» И. Ефремов (слайд) 1.Начнем с определения: Скорость химической реакции – изменение концентрации реагентов в течении времени V= моль/л×сек (слайд) В гомогенных системах: ∆СV= моль/л×сек В гетерогенных системах: V= моль / см2×сек (слайд) Решаем задачу: Химическая реакция протекает в растворе, согласно уравнению: А+В=С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 мин концентрация вещества А снизилась до 0,74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени б) концентрацию вещества В через 20 мин -Из курса химии 9 класса вам известны факторы, влияющие на скорость. Назовите их 2. Влияние всех перечисленных факторов можно объяснить, используя простую теорию – теорию столкновений. Основная её идея: реакции происходят при столкновении частиц реагентов, которые обладают определенной энергией. Чем больше частиц, тем больше шансов столкнуться и прореагировать.К химической реакции приводят лишь эффективные соударения. Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации ЕА(СЛАЙД) Если ЕА<40 кдж/моль-скорость реакции очень большая(р-ции ионного обмена) Если ЕА=40-120 кдж/моль- скорость средняя(гидролиз сахарозы, взаимодействие металлов с кислотами) Если ЕА>120 –скорость незначительная(разложение аммиака) (слайд) Многие реальные реакции самопроизвольно не протекают, т.к. реагенты имеют высокую энергию активации. А сечас на основании этой теории рассмотрим влияние различных факторов на скорость химической реакции. Практическая работа в группах по инструкциям. «Практика есть основа познания и критерий истины» (слайд) Инструкции для учащихся в Приложении №2 Отчет групп о проделанной работе (20 мин) Чтобы закрепить теоретические аспекты темы порешаем задачи(15 – 20 мин) Предлагаемые задачи в Приложении №3 -Итак, что вы сегодня усвоили? Что такое скорость химической реакции? Какие факторы влияют на скорость? Чем можно объяснить влияние факторов? Основная теория При наличии времени можно провести короткий тест. Приложение №4 Подведение итогов урока. Выставление оценок. Наш урок подошел к концу. Вы сегодня хорошо потрудились. Спасибо за внимание! | Запись в тетради -Знания помогают химикам определить эффективность химических процессов -Коррозия металлов, гниение, скисание идут медленно Горение спирта, взрыв газа – быстро — Изменение концентрации реагентов в течении времени Устный опрос. Запись в тетради Запись в тетради. Дано: С(А)1=0,80 моль/л С(В)1=1,00 моль/л С(А)2=0,74 моль/л ∆t=20 мин Найти: V ср.=? С(В)2=? Решение: V= = =0,003 моль/л мин По уравнению и по условию количества прореагировавших веществ А и В, равные∆С Следовательно, С(В)2=С(В)1-∆С=1,00-0,06=0,94 моль/л Ответ: V=0,003/моль л мин, С(В)2=0,94 моль/л — Природа реагирующих веществ -Концентрация реагирующих веществ -Температура — Площадь соприкосновения веществ -Катализатор Запись в тетради Практическая работа в группах. Оформление отчетов. Работа с учебником. Подготовка выступления от каждой группы. Каждая группа исследует влияние одного фактора на скорость. Работа у доски Запись в тетрадях Самостоятельная работа Ответы на поставленные вопросы Запись в дневниках: п. |
Приложение №1
Вопросы для терминологического боя:
Что такое химическая реакция? ( превращения веществ с разрушением старых химических связей реагентов и образованием новых химических связей продуктов реакции)
Какие типы классификаций химических реакций вы знаете? ( по химиическому составу реагентов и продуктов, по изменению степени окисления, по обратимости, по использованию катализаторов, по тепловому эффекту, по фазе)
Какого типа реакций нет в органической химии? ( обмена)
В органической химии реакции изомеризации, а в неорганической….. (аллотропизации)
Какие признаки химических реакций вы знаете? ( образование осадка, выделение газа, выделение запаха, тепла и света, изменение цвета)
В каких случаях можно судить о том, что реакция прошла до конца? (если образовался осадок, выделился газ, образовалась вода)
Гомогенные и гетерогенные реакции? (Если реагенты и продукты находятся в одинаковой фазе, то гомогенные, в разных –гетерогенные)
Что такое тепловой эффект реакции? (количество тепла, которое выделилось или поглотилось в результате реакции)
Экзотермические и эндотермические реакции? (С выделением тепла –экзотермичекие, с поглощением –эндотермические)
Энтальпия — ? (Полное энергосбережение вещества)
Энтропия? (Мера беспорядка)
Стандартные теплоты сгорания и образования? (Теплота, выделяющаяся или поглощающаяся при образовании или сгорании 1 моль вещества при стандартных условиях)
Закон Гесса? (тепловой эффект химической реакции не зависит от пути процесса, а только от вида и агрегатного состояния исходных веществ и конечных продуктов реакции. )
)
Следствие из закона Гесса (Тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ)
Что такое энергия Гиббса? (Разница между энтальпийным и энтропийным факторами)
К какому состоянию стремится любая реакционная система? (К состоянию с минимальной энергией, к увеличению беспорядка взаимодействующих частиц)
Когда реакция возможна при любых температурах? ( При отрицательных значениях энтальпии и энергии Гиббса и положительной энтропии)
В каком случае тепловой эффект положителен? (если энергия образования новых химических связей больше, чем энергия разрыва старых связей)
Когда химическая реакция невозможна? ( при положительном значении энергии Гиббса)
Как можно определить тепловой эффект и изменение энтальпии в реакции горения свечи? (экспериментально и по стандартным теплотам сгорания)
Приложение №2
Инструкции для учащихся.
Инструкция №1
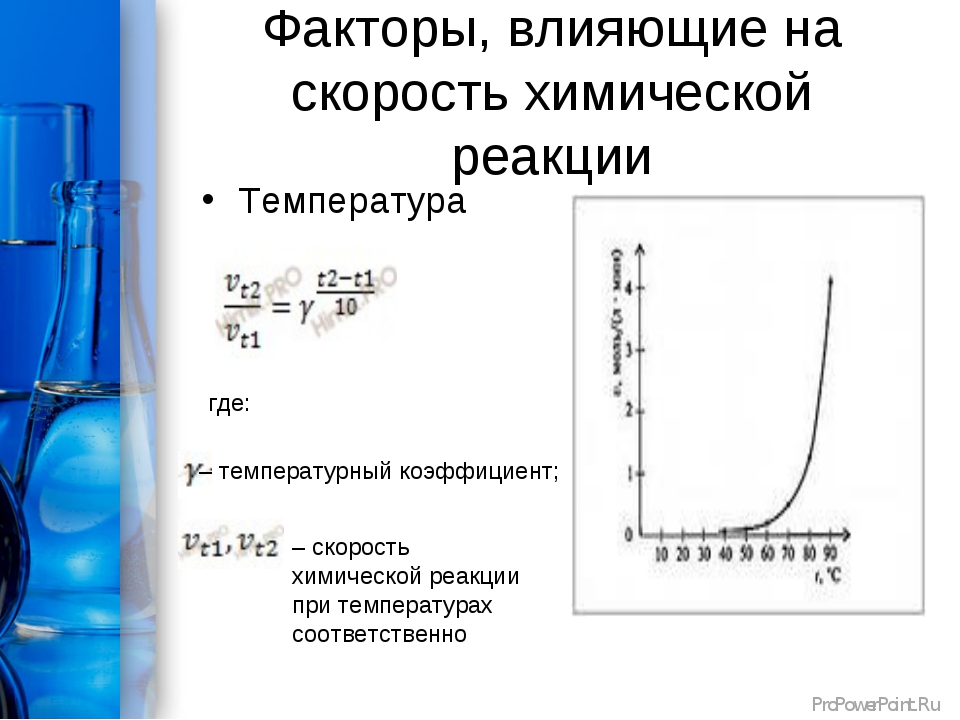
Тема: Влияние температуры на скорость химической реакции.
Цель: Установить зависимость скорости химической реакции от температуры
Оборудование: 2 пробирки, зажим для пробирок, спиртовка, спички, раствор серной кислоты.
Задание: 1. Изучить по учебнику (стр. 133) влияние температуры на скорость химической реакции
2. Провести опыт: В две пробирки насыпать порошка оксида меди, прилить одинаковый объем серной кислоты, одну пробирку закрепить в держателе и осторожно нагреть.
3. В какой пробирке скорость реакции больше?
4. Кто из ученых сформулировал зависимость скорости от температуры?
5. Почему при повышении температуры скорость реакции возрастает?
6. Всегда ли применимо для реакции повышение температуры?
7.В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
8. Подготовить выступление
Инструкция № 2
Тема: Скорость химической реакции и площадь соприкосновения реагирующих веществ.
Цель: Установить зависимость между скоростью химической реакции и поверхностью соприкосновения реагирующих веществ
Оборудование: 2 пробирки, железный гвоздь, железные опилки, раствор серной кислоты
Задание: 1. Изучить по учебнику зависимость скорости химической реакции от поверхности соприкосновения веществ (стр. 139)
2. Провести опыт: В одну пробирку поместить железный гвоздь, в другую – железные опилки. В обе пробирки прилить одинаковый объем серной кислоты.
3. В каком случае скорость реакции больше и почему?
4. Как в промышленности увеличивают площадь соприкосновения реагирующих веществ?
5. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Инструкция № 3
Тема: Скорость химической реакции и природа реагирующих веществ
Цель: Изучить зависимость скорости химической реакции от природы реагирующих веществ
Оборудование: 3 пробирки , гранулы цинка, алюминия, меди, раствор соляной кислоты
Задание: 1. Изучить по учебнику (стр.132) влияние природы реагирующих веществ на скорость реакции
2. Проделать опыт: В три пробирки поместить отдельно гранулы цинка, алюминия, меди. Прилить одинаковый объем соляной кислоты.
3. Объясните результаты опыта, используя ряд активности металлов
4. Как величина энергии активации связана с природой реагирующих веществ?
5. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Инструкция №4
Тема: Влияние концентрации реагента на скорость химической реакции.
Цель: Установить зависимость между скоростью химической реакции и концентрацией реагента
Оборудование: 2 пробирки, гранулы цинка, два раствора соляной кислоты с разной концентрацией
Задание: 1. Изучить по учебнику (стр.133-135) влияние концентрации реагентов на скорость химической реакции
2. Провести опыт: В две пробирки положить по две гранулы цинка. В одну прилить раствор соляной кислоты (1:1) ( на одну часть кислоты одна часть воды). В другую прилить раствор соляной кислоты (1:10) ( на одну часть кислоты 10 частей воды)
3. В какой пробирке скорость реакции больше и почему?
4. Назовите и сформулируйте закон, определяющий зависимость скорости химической реакции от концентрации
5. В чем причина прямой пропорциональной зависимости скорости от концентрации реагирующих веществ?
В чем причина прямой пропорциональной зависимости скорости от концентрации реагирующих веществ?
6. Концентрацию веществ в каком агрегатном состоянии учитывает закон действующих масс?
7. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
8. Подготовить выступление
Инструкция № 5 (для 1 группы)
Тема: Скорость химической реакции и катализатор
Цель: установить зависимость между скоростью химической реакции и влиянием катализатора.
Оборудование: 2 пробирки, алюминий, сульфат меди, поваренная соль
Задание: 1. Изучить материал учебника (стр.135-136)
2. Проведите опыт: В две пробирки налейте одинаковый объём сульфата меди. Затем в каждую пробирку поместите гранулы алюминия. Что наблюдаете? Затем в одну пробирку поместите несколько крупинок хлорида натрия. Что наблюдаете?
Что наблюдаете?
3. Какую роль играет хлорид натрия в реакции замещения между сульфатом меди и алюминием?
4. Что такое катализаторы?
5. Что такое катализ?
6. В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
7. Подготовить выступление
Инструкция №5 (для 2 группы)
Тема: Скорость химической реакции и катализатор
Цель: установить зависимость между скоростью химической реакции и влиянием катализатора.
Оборудование: 4 пробирки, сырой картофель, сырая морковь, сырое мясо, вареное мясо, перекись водорода.
Задание: 1. Изучить по учебнику теоретический материал (стр.138)
2. Провести опыт: В четыре пробирки поместить отдельно сырой картофель, сырую морковь, сырое мясо, вареное мясо. Прилить перекись водорода. Что наблюдаете?
Что наблюдаете?
3. Объясните результаты, какой фермент содержат эти вещества?
4. Почему в четвертой пробирке не наблюдалось действие катализатора?
5 . В тетради оформить отчет по плану: 1. Практическая работа
2. Тема
3. Цель
4. Оборудование
5. Описание опыта
6. уравнение реакции
7. Наблюдения
8. Вывод
6. Подготовить выступление
Приложение № 3
Решение задач.
Вычислите скорость химической реакции, протекающей по уравнению 2А(г)+В(г)=2АВ, если исходная концентрация вещества А -0,05 моль/л, В-0,03 моль/л, а константа скорости реакции 1 л/моль сек.
Дано: Решение:
С(А)=0,05 моль/л Выразим скорость реакции 2А+В=2АВ
С(В)=0,03 моль/л V=КС(А)2С(В)
К=1 л/моль сек V= 1×0,052×0,03=7,5×10-5 моль/лсек
Найти: V=?
Ответ: V=7,5 ×10-5 моль/л ×сек
Как изменится скорость реакции А(г)+2В(г)=С(г) при повышении концентрации А в 2 раза, давления в 2 раза?
Решение:
Согласно закону действующих масс: V=КС(А)С(В)2
А) если повысить концентрацию А в 2 раза, то скорость будет равна V3=К С(2А)×2С(В)2=8 К С(А) С(В)2
Скорость увеличится в 8 раз.
Скорость некоторой реакции при0 0 равна 1 моль/л ч, температурный коэффициент реакции -3. Какой будет скорость данной реакции при 300С ?
Дано: Решение:
V1=1 моль/л ч По правилу Вант-Гоффа
T1=00 V2=V1Ý
T2=300
Найти V2 =? V2=1×33=27 моль/л ч
Ответ: При 30 градусах скорость данной реакции станет 27 моль/л ч
Реакция протекает по уравнению А(г)+2В(г)=2С Исходная концентрация вещества А- 1 моль/л, через 1 час она стала 0,5 моль/л. Определите концентрации веществ В и С через час, если их исходные соответственно равны 1 моль/л и 0 моль/л Какова скорость данной реакции по веществу А?
Дано: Решение:
С1(А)=1 моль/л V= V= (1-0,5)/1= 0,5 моль/л час
С2(А)=0,5 моль/л По уравнению А+2В=2С видно, что на 1 моль А затрачивается
t=1 час 2 моль В и образуется 2 моль С, тогда через час израсхо-
С1(В)=1 моль/л дуется 1 моль В, его концентрация станет 0 моль/л,
С1(С)=0 моль/л образуется 1 моль С, его концентрация станет 1 моль/л
Найти: С2(В)=? Ответ: V=0,5 моль/л ч, С2(В)=0 моль/л ,С2(С)=1 моль/л
С2(С)=?
V-?
презентация скорость химических реакций 11 класс
PPTX / 336. 43 Кб
43 Кб
Механизм реакции и катализа | Скорость и степень реакции
Ранее упоминалось, что именно столкновения частиц вызывают реакции, и что только некоторые из этих столкновений успешны. Это связано с тем, что частицы реагента имеют широкий диапазон кинетической энергии, и только небольшая часть частиц будет иметь достаточно энергии (и правильную ориентацию), чтобы фактически разорвать связи, чтобы могла произойти химическая реакция. Минимальная энергия, необходимая для протекания реакции, называется энергией активации .Для получения дополнительной информации об энергии реакций обратитесь к 11 классу (глава 12).
Энергия активации (ESCN9)
- Энергия активации
Минимальная энергия, необходимая для протекания химической реакции.
Даже при фиксированной температуре энергия частиц изменяется, а это означает, что только некоторые из них будут иметь достаточно энергии, чтобы участвовать в химической реакции, в зависимости от энергии активации этой реакции (рис.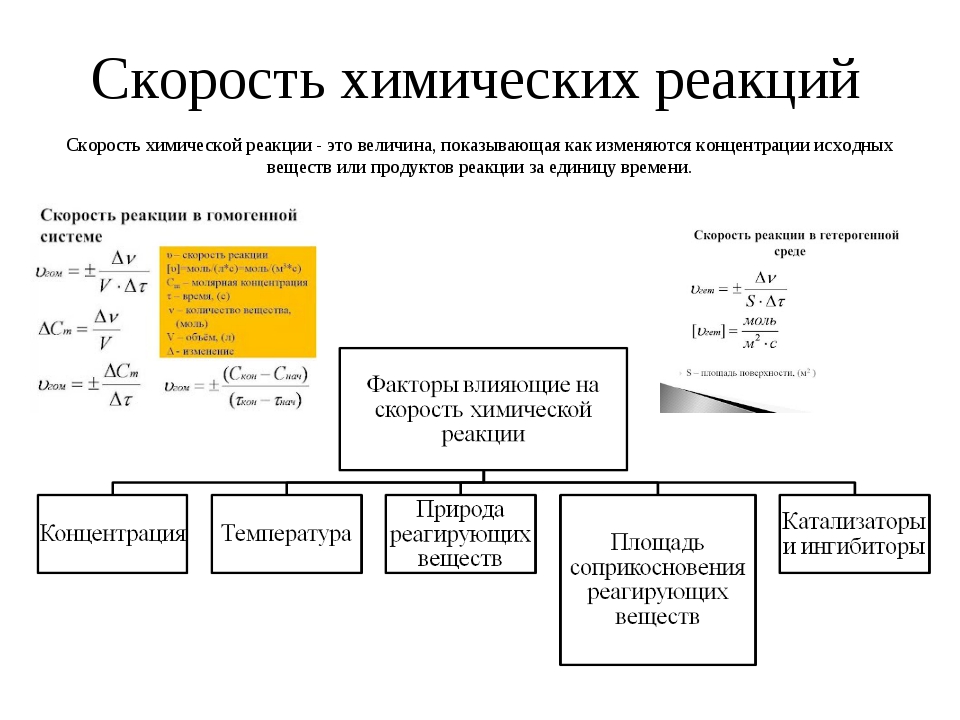
Рисунок 7.9: Распределение кинетической энергии частиц при фиксированной температуре.
Помните, что для реакции молекула должна иметь энергию больше энергии активации, а также правильную ориентацию.
Повышение температуры реакционной смеси увеличивает среднюю кинетическую энергию частиц.Как видно на графике (рис. 7.10), большая часть частиц теперь может реагировать, ускоряя реакцию. С увеличением движения молекул также увеличиваются шансы молекулы иметь правильную ориентацию.
Рисунок 7.10: Распределение кинетической энергии частиц при повышении температуры. Из-за более высокой температуры увеличивается количество частиц с достаточной энергией.
Эндотермическая реакция может быть представлена как:
\ (\ text {Reactants} + \ color {red} {\ text {Energy}} \ to \ text {Products} \) i. е. реакция, которая поглощает энергию
е. реакция, которая поглощает энергию
Это может быть показано на диаграмме энергии активации (рисунок 7.11). Эти графики также иногда называют профилем реакции или графиком потенциальной энергии.
Рисунок 7.11: Диаграмма энергии активации с энергией реагента ниже энергии продукта, т. Е. эндотермический
Экзотермическая реакция может быть представлена как:
\ (\ text {Reactants} \ to \ text {Products} + \ color {red} {\ text {Energy}} \) i.е. реакция, которая выделяет энергию
Это может быть показано на диаграмме энергии активации (рисунок 7.12):
Рисунок 7.12: Диаграмма энергии активации с энергией реагента, превышающей энергию продукта, т. Е. экзотермический
Измените этот раздел с уровня 11 (Энергия активации, Раздел 12.3).
Как работают катализаторы? (ESCNB)
Катализатор увеличивает скорость реакции несколько иначе, чем другие методы увеличения скорости реакции. Функция катализатора состоит в том, чтобы снизить энергию активации, чтобы большая часть частиц имела достаточно энергии для реакции. Катализатор может снизить энергию активации реакции на:
Функция катализатора состоит в том, чтобы снизить энергию активации, чтобы большая часть частиц имела достаточно энергии для реакции. Катализатор может снизить энергию активации реакции на:
Некоторые металлов например платина, медь и железо могут действовать как катализаторы в определенных реакциях. В нашем собственном организме содержится ферментов , которые являются катализаторами, которые помогают ускорить биологические реакции. Катализаторы обычно реагируют с одним или несколькими реагентами с образованием промежуточного химического соединения, которое затем вступает в реакцию с образованием конечного продукта.Промежуточный химический продукт иногда называют активированным комплексом
Активированный комплекс возникает в реакциях без катализаторов, а также в реакциях с катализаторами.
Ниже приводится пример того, как может протекать реакция с участием катализатора. A и B — реагенты, \ (\ color {blue} {\ text {C}} \) — катализатор, а D — продукт реакции A и B.
Шаг 1: \ ({\ text {A}} + \ color {blue} {\ text {C}} \ to \ text {A} \ color {blue} {\ text {C}} \)
Шаг 2: \ (\ text {B} + \ text {A} \ color {blue} {\ text {C}} \ to \ text {A} \ color {blue} {\ text {C}} \ text {B} \)
Шаг 3: \ (\ text {A} \ color {blue} {\ text {C}} \ text {B} \ to \ color {blue} {\ text {C}} + \ text {D} \)
\ (\ text {A} \ color {blue} {\ text {C}} \ text {B} \) представляет собой промежуточное химическое вещество.Хотя катализатор (\ (\ color {blue} {\ text {C}} \)) расходуется в реакции 1, позже он снова высвобождается в реакции 3, так что общая реакция с катализатором выглядит следующим образом:
\ (\ text {A} + \ text {B} + \ color {blue} {\ text {C}} \ to \ text {D} + \ color {blue} {\ text {C}} \)
Из этого видно, что катализатор высвобождается в конце реакции в совершенно неизменном виде. Без катализатора общая реакция будет:
\ (\ text {A} + \ text {B} \) \ (\ to \) \ (\ text {D} \)
Катализатор обеспечивает альтернативный набор стадий реакции, который мы называем альтернативным путем. Путь с участием катализатора требует меньше энергии активации и, следовательно, быстрее.
Путь с участием катализатора требует меньше энергии активации и, следовательно, быстрее.
Это можно увидеть на следующей диаграмме (рисунок 7.13).
Рис. 7.13: Доля частиц, обладающих достаточной энергией для реакции, увеличивается в присутствии катализатора.
- Катализатор
Катализатор ускоряет химическую реакцию, но не расходуется на нее. Он увеличивает скорость реакции за счет снижения энергии активации реакции.
Энергетические диаграммы полезны для иллюстрации влияния катализатора на скорость реакции. Катализаторы уменьшают энергию активации, необходимую для протекания реакции (показано меньшим значением энергии активации на энергетической диаграмме на рисунке 7.14), и, следовательно, увеличивают скорость реакции. Помните, что с катализатором средняя кинетическая энергия молекул остается прежней, но требуемая энергия уменьшается (рис. 7.13).
Рисунок 7.14: Влияние катализатора на энергию активации эндотермической реакции. Катализатор будет действовать таким же образом при экзотермической реакции.
Катализатор будет действовать таким же образом при экзотермической реакции.
Присоединяйтесь к тысячам учащихся, улучшающих свои научные оценки онлайн с помощью Siyavula Practice.
Зарегистрируйтесь здесьСкорость реакции
Упражнение 7.4Катализатор увеличивает энергию молекул реагента, так что может происходить химическая реакция.
Неверно. Катализатор снижает энергию активации реакции, поэтому может иметь место химическая реакция.
Повышение температуры реакции приводит к увеличению количества частиц реагента, энергия которых превышает энергию активации.
Катализатор не становится частью конечного продукта химической реакции.
Почему во время реакции происходит уменьшение массы?
Реакция не происходит в герметичном контейнере, поэтому газообразный водород может выйти из реакционного сосуда. {-3} $} \) соляная кислота. Как средняя скорость этой реакции соотносится с исходной скоростью реакции ?
{-3} $} \) соляная кислота. Как средняя скорость этой реакции соотносится с исходной скоростью реакции ?
Имеется больший объем соляной кислоты. Однако концентрация не увеличивается, и поэтому скорость реакции не изменяется.
Как катализатор повлияет на среднюю скорость этой реакции?
(IEB Paper 2 2003)
Средняя скорость реакции увеличится.
Напишите вычисленное химическое уравнение этой реакции.
\ (\ text {CaCO} _ {3} (\ text {s}) + 2 \ text {HCl} (\ text {l}) \) \ (\ to \) \ (\ text {CaCl} _ { 2} (\ text {s}) + \ text {CO} _ {2} (\ text {g}) + \ text {H} _ {2} \ text {O} (\ text {l}) \)
используется кусок карбоната кальция такой же массы
Площадь поверхности уменьшена, поэтому средняя скорость реакции снизится.
\ (\ text {20} \) \ (\ text {cm $ ^ {3} $} \) из \ (\ text {0,2} \) \ (\ text {mol. {-3} $} \) кислота соляная используется
{-3} $} \) кислота соляная используется
Средняя скорость реакции зависит от концентрации жидких реагентов, а не от объема. Однако концентрация увеличивается, поэтому скорость будет увеличиваться.
| Видео | Описание |
| Урок 1: Силы Xtra Gr 11 Физические науки: В этом уроке, посвященном силам, мы определяем понятие силы.Мы представляем силы с помощью векторных диаграмм. Решаем задачи, когда на объект действуют две и более сил. Наконец, мы идентифицируем различные силы, включая трение и нормальную силу. | |
| Урок 2: Законы Ньютона Xtra Gr 11 Физические науки: В этом уроке о законах Ньютона мы исследуем различные типы сил. Мы рассматриваем и применяем законы движения Ньютона. Наконец, мы используем законы тяготения Ньютона для решения проблем. | |
| Урок 3: Химическое связывание В этом уроке по химическому связыванию мы сосредоточимся на следующем: связывание, ковалентное связывание, электроотрицательность в ковалентном связывании, формы молекул, полярные ковалентные вещества, а также энергия и прочность связи.  | |
| Урок 4: Межмолекулярные силы В этом уроке о межмолекулярных силах мы сравниваем внутримолекулярные силы и межмолекулярные силы. Мы идентифицируем типы межмолекулярных сил. Наконец, мы идентифицируем взаимосвязь между состоянием веществ и присутствующими межмолекулярными силами. | |
| Урок 5: Исследование света В этом уроке «Исследование света» мы объясняем, что такое свет, откуда он исходит и почему это важно.Мы определяем, что происходит, когда свет падает на поверхность различных объектов. Наконец, мы объясняем процессы отражения, преломления, полного внутреннего отражения и дифракции. | |
| Урок 6: Расчеты света В этом уроке по расчетам света мы используем отношения между частотой, длиной волны и скоростью в расчетах света. Мы используем закон Снеллиуса для расчета скорости света в различных средах, угла преломления, критического угла и показателя преломления материалов. | |
| Урок 7: Кинетическая теория газов В этом уроке, посвященном кинетической теории газов, мы сосредоточимся на следующем: кинетическая молекулярная теория, соотношение давления, объема и температуры, свойства идеального газа, а также отклонения от поведения идеального газа.  | |
| Урок 8: Химические расчеты В этом уроке, посвященном химическим расчетам, мы сосредоточимся на следующем: химические формулы, процентный состав, относительная атомная масса, моль, закон сохранения массы и закон постоянной пропорции./ td> | |
| Урок 9: Электростатика В этом уроке по электростатике мы сосредоточимся на следующем: электростатика и типы зарядов, электрические поля, свойства и сила, сохранение заряда, закон электростатики Кулона, электрическая потенциальная энергия и разность потенциалов. | |
| Урок 10: Электромагнетизм В этом уроке по электромагнетизму мы сосредоточимся на следующем: Магнитные поля, электромагнитная индукция и заряженные частицы в магнитном поле. | |
| Урок 11: Электрические цепи В этом уроке, посвященном электрическим цепям, мы сосредоточимся на следующем: сопротивление и законы Ома, омические и неомические проводники, последовательное и параллельное соединение, а также энергия в электрической цепи. | |
| Урок 12: Энергия и химические изменения В этом уроке Энергия и химические изменения мы сосредоточимся на следующем: энергия активации и комплекс активации, энергетический профиль реакции, энтальпия, а также эндотермические и экзотермические реакции. | |
| Урок 13: Химические реакции Xtra Gr 11 Физические науки: В этом уроке, посвященном химическим реакциям, мы рассмотрим окислительно-восстановительные реакции, прямой перенос электронов, правила определения степеней окисления, теории кислот и оснований, общие кислоты и основания, общие химические уравнения кислоты с разными соединениями и, наконец, посмотрите на индикаторы. | |
| Урок 14: Химические системы В этом уроке, посвященном химическим системам, мы сосредоточимся на следующем: освоение литосферы, добыча полезных ископаемых в Южной Африке, извлечение металлов из руд, стоимость добычи, последствия добычи, добыча золота, добыча железа, фосфатов. добыча полезных ископаемых, а также источники энергии. | |
| Урок 15: Консолидация физики Xtra Gr 11 Физические науки: В этом уроке Консолидации физики мы сосредоточимся на обобщении того, что вам нужно знать о механике, свете, законах движения Ньютона, а также электричестве и магнетизме. | |
| Урок 16: Консолидация химии В этом консолидированном уроке химии мы сосредоточимся на следующем: Типы реакций, химические связи, химические расчеты и химические системы. |
Общие типы химических реакций
- Образование
- Наука
- Химия
- Общие типы химических реакций
Несколько общих типов химических реакций могут происходить в зависимости от того, что происходит при переходе от реагентов к продуктам . Наиболее распространены следующие типы химических реакций:
Комбинация
Разложение
Одинарное перемещение
Двойное смещение
Сгорание
Редокс
См. Также Теория столкновений: как происходят химические реакции.
Комбинированные химические реакции
В комбинационных реакциях два или более реагента образуют один продукт. Реакция натрия и хлора с образованием хлорида натрия,
и сжигание угля (углерода) с образованием диоксида углерода,
являются примерами комбинированных реакций.
В зависимости от условий или относительных количеств реагентов в реакции сочетания может быть образовано более одного продукта.
Химические реакции разложения
Реакции разложения на самом деле противоположны реакциям комбинации.В реакциях разложения одно соединение распадается на два или более простых вещества (элементы и / или соединения).
Разложение воды на водород и кислород,
и разложение пероксида водорода с образованием газообразного кислорода и воды,
являются примерами реакций разложения.
Химические реакции одинарного вытеснения
В реакциях однократного вытеснения более активный элемент вытесняет (выбивает) другой менее активный элемент из соединения.Например, если вы поместите кусок металлического цинка в раствор сульфата меди (II), цинк вытеснит медь, как показано в следующем уравнении:
Обозначение (водн.) указывает, что соединение растворено в воде — в водном растворе мг. Поскольку в этом случае цинк заменяет медь, он считается более активным. Если поместить кусок меди в раствор сульфата цинка, ничего не произойдет.
В следующей таблице показаны ряды активности некоторых обычных металлов.Обратите внимание, что, поскольку цинк в таблице более активен, он заменит медь, как показано в предыдущем уравнении.
| Действия | Металл |
|---|---|
| Самый активный | Щелочные и щелочноземельные металлы |
| Al | |
| Zn | |
| Cr | |
| Fe | |
| Ni | |
| Sn | |
| Pb | |
| Cu | |
| Ag | |
| Наименее активный | Au |
Химические реакции двойного вытеснения
В реакциях одиночного замещения замещается только один химический компонент.В реакциях двойного смещения или реакциях метатезиса происходит смещение двух частиц (обычно ионов). В большинстве случаев реакции этого типа протекают в растворе, при этом образуется либо нерастворимое твердое вещество (реакции осаждения), либо вода (реакции нейтрализации).
Реакции осаждения
Если смешать раствор хлорида калия и раствор нитрата серебра, в полученном растворе образуется белое нерастворимое твердое вещество. Образование нерастворимого твердого вещества в растворе называется осаждением .
Вот молекулярное уравнение этой реакции двойного вытеснения:
Белое нерастворимое твердое вещество, которое образуется, представляет собой хлорид серебра.
Реакции нейтрализации
Другой тип реакции двойного вытеснения — это реакция между кислотой и основанием. Эта реакция двойного вытеснения, называемая реакцией нейтрализации , образует воду. Взгляните на смешанные растворы серной кислоты (кислота для автомобильных аккумуляторов) и гидроксида натрия (щелочь).
Вот молекулярное уравнение этой реакции:
Химические реакции горения
Реакции горения происходят, когда соединение, обычно содержащее углерод, соединяется с кислородом воздуха. Этот процесс обычно называют прожигом . Тепло — наиболее полезный продукт большинства реакций горения.
Вот уравнение, описывающее горение пропана:
Пропан относится к классу соединений, называемых углеводородов, , соединений, состоящих только из углерода и водорода.Продукт этой реакции — тепло.
Реакции горения также относятся к типу окислительно-восстановительных реакций.
Окислительно-восстановительные химические реакции
Редокс-реакции или реакции восстановления-окисления — это реакции, в которых происходит обмен электронами:
Предыдущие реакции являются примерами других типов реакций (таких как реакции сочетания, горения и однократного замещения), но все они являются окислительно-восстановительными реакциями.


 Закрепление материала
Закрепление материала
 (10 мин)
(10 мин)
 13, стр 132-139, упр. 1-5, стр.140 (вып. 3 любые задачи)
13, стр 132-139, упр. 1-5, стр.140 (вып. 3 любые задачи)