Решебник ⏩ ГДЗ Химия 11 класс ⚡ Г. Е. Рудзитис, Ф. Г. Фельдман 1992
Авторы: Г. Е. Рудзитис, Ф. Г. Фельдман
Год: 1992
Рейтинг: 4.1
Оцените книгуСамые популярные книги
Химия — это интереснейшая из наук. Но, наверное, не все школьники оценивают ее по достоинству. Некоторые ученики запускают изучение этого предмета. Но делать это отнюдь не рекомендуется. Ведь в химии все темы связаны между собой и, пропустив одну, ученик уже не сможет понять все последующие. По крайней мере, сделать это ему будет крайне трудно.
Решебник по химии 11 класс Рудзитиса — поможет понять сложную науку
Поэтому химию в школе нужно изучать с самого первого урока и не пропускать ни одного занятия. Иначе ученик, поступающий по-другому, окажется невосполнимо отставшим по этому предмету. Для улучшения своих знаний школьникам рекомендуется использовать ГДЗ по химии.
ГДЗ по химии за 11 класс Рудзитиса — то, что нужно успешным старшеклассникам
Школьникам необходимы отменные оценки и хорошие знания по всем предметам. Не стоит отчаиваться, если в знаниях по химии появились большие пробелы. Выполнить домашку, тем не менее удастся. Ведь у старшеклассника есть надежный помощник в виде решебника по химии. Нужно учитывать, что ГДЗ по химии очень много. Их можно купить или найти на просторах интернета. Но не все они являются качественными и не все они могут помочь школьникам и тем более старшеклассникам. Нужно выбирать пособие, которое создали действительно профессиональные авторы, которые разбираются в науке химии и знают ее довольно хорошо. Можно сказать, что Рудзитис относится к авторам, сотворившим действительно полезное ГДЗ, которым школьники останутся довольны.
Не стоит отчаиваться, если в знаниях по химии появились большие пробелы. Выполнить домашку, тем не менее удастся. Ведь у старшеклассника есть надежный помощник в виде решебника по химии. Нужно учитывать, что ГДЗ по химии очень много. Их можно купить или найти на просторах интернета. Но не все они являются качественными и не все они могут помочь школьникам и тем более старшеклассникам. Нужно выбирать пособие, которое создали действительно профессиональные авторы, которые разбираются в науке химии и знают ее довольно хорошо. Можно сказать, что Рудзитис относится к авторам, сотворившим действительно полезное ГДЗ, которым школьники останутся довольны.
ГДЗ по химии за 11 класс Рудзитиса можно скачать на специализированном сайте
Специализированное ГДЗ по химии можно без труда скачать в интернете и впоследствии продуктивно им пользоваться. В чем выгода использования такого ГДЗ? Дело в том, что его наличие значительно облегчит выполнение домашки. ГДЗ содержит готовые ответы на задачи и примеры, изучаемые в 11-том классе. Помимо этого, в решебнике содержатся многие пояснения, которые старшекласснику очень понадобятся. Даже если ученик не собирается в дальнейшем связывать свою жизнь с наукой химией, все равно ему не помешают знания по этой дисциплине. Химия плотно вторглась в жизнь современных людей и оставаться несведущим в этой области бессмысленно. Химические продукты окружают людей повсюду и чтобы защитить себя, свою семью, нужно быть знакомым с химией и как можно более плотно.
Помимо этого, в решебнике содержатся многие пояснения, которые старшекласснику очень понадобятся. Даже если ученик не собирается в дальнейшем связывать свою жизнь с наукой химией, все равно ему не помешают знания по этой дисциплине. Химия плотно вторглась в жизнь современных людей и оставаться несведущим в этой области бессмысленно. Химические продукты окружают людей повсюду и чтобы защитить себя, свою семью, нужно быть знакомым с химией и как можно более плотно.
Ответы по химии за 11 класс Рудзитиса — помогут тем школьника, которые запустили изучение химии
Если школьник запустил предмет химию в школе, то выполнить домашку ему помогут готовые ответы. Все ответы, различные подсказки содержит в своем составе ГДЗ по химии. Нужно лишь полистать его страницы, чтобы найти все необходимое для себя.
Зачем старшекласснику чересчур утруждать себя? Ведь делать домашку вместе с ГДЗ намного проще, чем самостоятельно. Для чего нужно себя мучить, после того, как задание уже выполнено, если можно проверить ответы не выходя из дома. И для этого вовсе не нужна встреча с учителем. Благодаря ГДЗ можно подсмотреть те моменты, которые не являются понятными, а также проверить готовые ответы по заданиям. Решебник вовсе не предназначен для того, чтобы из него просто «перекатывать» ответы и ничего не иметь при этом в голове. Как раз наоборот! ГДЗ необходимо, чтобы облегчить труды школьника, сделать его жизнь более интересной, помочь ему освободить время для себя. Чтобы стать грамотным нужно:
И для этого вовсе не нужна встреча с учителем. Благодаря ГДЗ можно подсмотреть те моменты, которые не являются понятными, а также проверить готовые ответы по заданиям. Решебник вовсе не предназначен для того, чтобы из него просто «перекатывать» ответы и ничего не иметь при этом в голове. Как раз наоборот! ГДЗ необходимо, чтобы облегчить труды школьника, сделать его жизнь более интересной, помочь ему освободить время для себя. Чтобы стать грамотным нужно:
регулярно использовать решебник по химии за 11 класс Рудзитиса:
систематически выполнять домашнее задание;
быть прилежным и ответственным старшеклассником.
ГДЗ: Химия 11 класс Рудзитис, Фельдман
§1. Химический элемент. Нуклиды. Изотопы. Вопросы до параграфа
1 2 3§2. Законы сохранения массы и энергии в химии. Вопросы до параграфа
1§3. Периодический закон. Распределение электронов в атомах элементов малых периодов. Вопросы до параграфа
1 2 3 4§4.
 Распределение электронов в атомах элементов больших периодов. Вопросы до параграфа1 2 3
Распределение электронов в атомах элементов больших периодов. Вопросы до параграфа1 2 3§5. Положение в периодической системе водорода, лантаноидов, актиноидов и искусственно полученных элементов. Вопросы до параграфа
1 2 3 4§6. Валентность и валентные возможности атомов. Вопросы до параграфа
1 2 3§7. Основные виды химической связи. Ионная и ковалентная связь. Вопросы до параграфа
1§8. Металлическая связь. Водородная связь. Вопросы до параграфа
1§9. Пространственное строение молекул. Вопросы до параграфа
1 2§10. Строение кристаллов. Кристаллические решётки. Вопросы до параграфа
1 2 3§11. Причины многообразия веществ. Вопросы до параграфа
1 2 3§12. Классификация химических реакций. Вопросы до параграфа
1§13. Скорость химических реакций. Вопросы до параграфа
1 2§14. Катализ. Вопросы до параграфа
1 2 3§15. Химическое равновесие и условия его смешения. Вопросы до параграфа
1§16. Дисперсные системы.
 Вопросы до параграфа1 2
Вопросы до параграфа1 2§17. Способы выражения концентрации растворов. Вопросы до параграфа
1§19. Электролитическая диссоциация. Водородный показатель. Вопросы до параграфа
1 2§20. Реакции ионного обмена. Вопросы до параграфа
1§21. Гидролиз органических и неорганических соединений. Вопросы до параграфа
1§22. Химические источники тока. Вопросы до параграфа
1 2 3 4§23. Ряд стандартных электродных потенциалов. Вопросы до параграфа
1 2§24. Коррозия металлов и её предупреждение. Вопросы до параграфа
1 2§25. Электролиз. Вопросы до параграфа
1§26. Общая характеристика и способы получения металлов. Вопросы до параграфа
1 2 3 4§27. Обзор металлических элементов А-групп. Вопросы до параграфа
1 2§28. Общий обзор металлических элементов Б-групп. Вопросы до параграфа
1 2§29. Медь. Вопросы до параграфа
1§30. Цинк. Вопросы до параграфа
1§31. Титан и хром. Вопросы до параграфа
1 2§32.
 Железо, никель, платина. Вопросы до параграфа1
Железо, никель, платина. Вопросы до параграфа1§33. Сплавы металлов. Вопросы до параграфа
1 2 3 4 5§34. Оксиды и гидроксиды металлов. Вопросы до параграфа
1 2 3 4§35. Практическая работа 2. Решение экспериментальных задач по теме «Металлы». Вопросы до параграфа
1 2 3 4 5§36. Обзор неметаллов. Вопросы до параграфа
1 2 3§37. Свойства и применение важнейших неметаллов. Вопросы до параграфа
1 2 3 4§38. Общая характеристика оксидов неметаллов и кислородсодержащих кислот. Вопросы до параграфа
1 2§39. Окислительные свойства серной и азотной кислот. Вопросы до параграфа
1 2§40. Водородные соединения неметаллов. Вопросы до параграфа
1§41. Генетическая связь неорганических и органических веществ. Вопросы до параграфа
1§42. Практическая работа 3. Решение экспериментальных задач по теме «Неметаллы». Вопросы до параграфа
1 2 3 4 5§43. Химия в промышленности. Принципы химического производства. Вопросы до параграфа
1 2 3 4§44.
 Химико-технологические принципы промышленного получения металлов. Производство чугуна. Вопросы до параграфа1 2 3
Химико-технологические принципы промышленного получения металлов. Производство чугуна. Вопросы до параграфа1 2 3§45. Производство стали. Вопросы до параграфа
1 2§46. Химия в быту. Вопросы до параграфа
1 2 3§47. Химическая промышленность и окружающая среда. Вопросы до параграфа
1 2 3 4§1. Химический элемент. Нуклиды. Изотопы. Тестовые задания
0 1 2§2. Законы сохранения массы и энергии в химии. Тестовые задания
1 2§3. Периодический закон. Распределение электронов в атомах элементов малых периодов. Тестовые задания
1 2§8. Металлическая связь. Водородная связь. Тестовые задания
1 2§9. Пространственное строение молекул. Тестовые задания
1 2§12. Классификация химических реакций. Тестовые задания
1 2 3§13. Скорость химических реакций. Тестовые задания
1 2§14. Катализ. Тестовые задания
1 2§16. Дисперсные системы. Тестовые задания
1 2§17. Способы выражения концентрации растворов.
 Тестовые задания1 2 3
Тестовые задания1 2 3§19. Электролитическая диссоциация. Водородный показатель. Тестовые задания
1 2 3 4§20. Реакции ионного обмена. Тестовые задания
1 2 3§22. Химические источники тока. Тестовые задания
1 2§23. Ряд стандартных электродных потенциалов. Тестовые задания
1 2 3 4§24. Коррозия металлов и её предупреждение. Тестовые задания
1 2§25. Электролиз. Тестовые задания
1 2§26. Общая характеристика и способы получения металлов. Тестовые задания
1 2 3§27. Обзор металлических элементов А-групп. Тестовые задания
1 2 3§28. Общий обзор металлических элементов Б-групп. Тестовые задания
1 2§30. Цинк. Тестовые задания
1 2§31. Титан и хром. Тестовые задания
1 2 3§32. Железо, никель, платина. Тестовые задания
1 2 3§34. Оксиды и гидроксиды металлов. Тестовые задания
1 2§36. Обзор неметаллов. Тестовые задания
1 2§38. Общая характеристика оксидов неметаллов и кислородсодержащих кислот.
 Тестовые задания1 2
Тестовые задания1 2§39. Окислительные свойства серной и азотной кислот. Тестовые задания
1 2§41. Генетическая связь неорганических и органических веществ. Тестовые задания
1 2 3 4§43. Химия в промышленности. Принципы химического производства. Тестовые задания
1 2 3§44. Химико-технологические принципы промышленного получения металлов. Производство чугуна. Тестовые задания
1 2 3 4 5§45. Производство стали. Тестовые задания
1 2§46. Химия в быту. Тестовые задания
1 2 3§1. Химический элемент. Нуклиды. Изотопы. Подумайте, ответьте, выполните
1 2 3§2. Законы сохранения массы и энергии в химии. Подумайте, ответьте, выполните
1 2 3 4§3. Периодический закон. Распределение электронов в атомах элементов малых периодов. Подумайте, ответьте, выполните
1 2 3 4§4. Распределение электронов в атомах элементов больших периодов. Подумайте, ответьте, выполните
1 2 3 4 5§5. Положение в периодической системе водорода, лантаноидов, актиноидов и искусственно полученных элементов.
 Подумайте, ответьте, выполните1 2 3 4
Подумайте, ответьте, выполните1 2 3 4§6. Валентность и валентные возможности атомов. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§7. Основные виды химической связи. Ионная и ковалентная связь. Подумайте, ответьте, выполните
1 2 3§8. Металлическая связь. Водородная связь. Подумайте, ответьте, выполните
1 2 3§9. Пространственное строение молекул. Подумайте, ответьте, выполните
1 2 3 4 5§10. Строение кристаллов. Кристаллические решётки. Подумайте, ответьте, выполните
1 2 3 4 5§11. Причины многообразия веществ. Подумайте, ответьте, выполните
1 2 3 4 5§12. Классификация химических реакций. Подумайте, ответьте, выполните
1 2 3 4 5 6 7 8 9 10§13. Скорость химических реакций. Подумайте, ответьте, выполните
1 2 3§14. Катализ. Подумайте, ответьте, выполните
1 2 3 4§15. Химическое равновесие и условия его смешения. Подумайте, ответьте, выполните
1 2 3§16. Дисперсные системы. Подумайте, ответьте, выполните
1 2 3§17.
 Способы выражения концентрации растворов. Подумайте, ответьте, выполните1 2 3 4
Способы выражения концентрации растворов. Подумайте, ответьте, выполните1 2 3 4§19. Электролитическая диссоциация. Водородный показатель. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§20. Реакции ионного обмена. Подумайте, ответьте, выполните
1 2 3 4 5§21. Гидролиз органических и неорганических соединений. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§22. Химические источники тока. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§23. Ряд стандартных электродных потенциалов. Подумайте, ответьте, выполните
1 2 3 4 5 6 7 8 9§24. Коррозия металлов и её предупреждение. Подумайте, ответьте, выполните
1 2 3 4 5 6§25. Электролиз. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§26. Общая характеристика и способы получения металлов. Подумайте, ответьте, выполните
1 2 3 4 5 6 7§27. Обзор металлических элементов А-групп. Подумайте, ответьте, выполните
1 2 3 4 5 6 7 8 9§28. Общий обзор металлических элементов Б-групп.
 Подумайте, ответьте, выполните1 2 3 4
Подумайте, ответьте, выполните1 2 3 4§29. Медь. Подумайте, ответьте, выполните
1 2 3 4§30. Цинк. Подумайте, ответьте, выполните
1 2 3 4§31. Титан и хром. Подумайте, ответьте, выполните
1 2 3§32. Железо, никель, платина. Подумайте, ответьте, выполните
1 2 3 4§33. Сплавы металлов. Подумайте, ответьте, выполните
1 2 3 4 5 6§34. Оксиды и гидроксиды металлов. Подумайте, ответьте, выполните
1 2 3 4 5 6§36. Обзор неметаллов. Подумайте, ответьте, выполните
1 2 3§37. Свойства и применение важнейших неметаллов. Подумайте, ответьте, выполните
1 2 3 4§38. Общая характеристика оксидов неметаллов и кислородсодержащих кислот. Подумайте, ответьте, выполните
1 2 3 4 5 6§39. Окислительные свойства серной и азотной кислот. Подумайте, ответьте, выполните
1 2 3 4§40. Водородные соединения неметаллов. Подумайте, ответьте, выполните
1 2 3§41. Генетическая связь неорганических и органических веществ. Подумайте, ответьте, выполните
1§43.
 Химия в промышленности. Принципы химического производства. Подумайте, ответьте, выполните1 2 3 4 5 6 7
Химия в промышленности. Принципы химического производства. Подумайте, ответьте, выполните1 2 3 4 5 6 7§44. Химико-технологические принципы промышленного получения металлов. Производство чугуна. Подумайте, ответьте, выполните
1 2 3 4 5 6 7 8 9§45. Производство стали. Подумайте, ответьте, выполните
1 2 3 4§47. Химическая промышленность и окружающая среда. Подумайте, ответьте, выполните
1 2 3§3. Периодический закон. Распределение электронов в атомах элементов малых периодов. Задачи из задачника
1§12. Классификация химических реакций. Задачи из задачника
4§13. Скорость химических реакций. Задачи из задачника
6§14. Катализ. Задачи из задачника
6§15. Химическое равновесие и условия его смешения. Задачи из задачника
6§17. Способы выражения концентрации растворов. Задачи из задачника
3 6§23. Ряд стандартных электродных потенциалов. Задачи из задачника
6 7§26. Общая характеристика и способы получения металлов.
 Задачи из задачника6 7
Задачи из задачника6 7§28. Общий обзор металлических элементов Б-групп. Задачи из задачника
7§30. Цинк. Задачи из задачника
7§31. Титан и хром. Задачи из задачника
7§36. Обзор неметаллов. Задачи из задачника
7§40. Водородные соединения неметаллов. Задачи из задачника
6§41. Генетическая связь неорганических и органических веществ. Задачи из задачника
6§44. Химико-технологические принципы промышленного получения металлов. Производство чугуна. Задачи из задачника
6 7Практическая работа 1. Приготовление растворов с заданной молярной концентрацией
18Лабораторные опыты
§14 §18 §19 §21Дополнительные задания
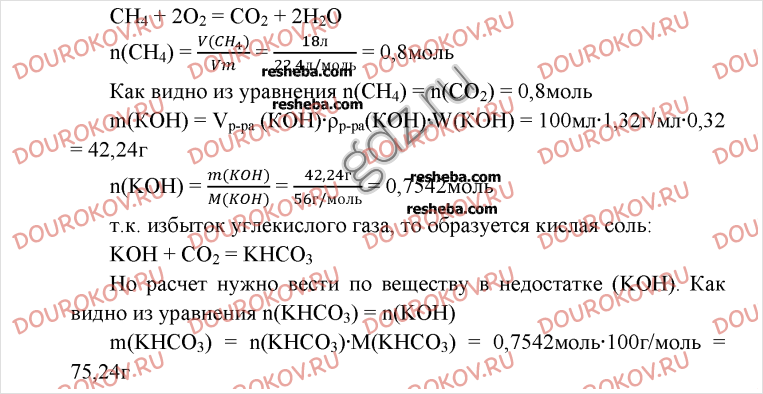
§23 §26 §28 §44§1. Химический элемент. Нуклиды. Изотопы. Вопросы до параграфа: 1
Предыдущее
Следующее
Решение
Предыдущее
Следующее
Химических Формул — Гипермаркет знаний. Химические формулы
Главная » Информатика, программирование » Химические формулы — Гипермаркет знаний. Химические формулы — Гипермаркет знаний Методы определения состава вещества
Химические формулы — Гипермаркет знаний Методы определения состава вещества
>> Химические формулы
Химические формулы
Вам поможет материал пункта:
> узнать, что такое химическая формула;
> читать формулы веществ, атомов, молекул, ионов;
> правильно использовать термин «формульная единица»;
> составлять химические формулы ионных соединений;
> охарактеризовать состав вещества, молекулы, иона химической формулой.
Химическая формула.
У каждого есть вещества есть имя. Однако по названию нельзя определить, из каких частиц состоит вещество, сколько и каких атомов содержится в его молекулах, ионах, какие заряды имеют ионы. Ответы на такие вопросы дает специальная запись – химическая формула.
Химическая формула – обозначение атома, молекулы, иона или вещества с помощью символов химических элементов и индексов.
Химическая формула атома – это символ соответствующего элемента. Например, атом алюминия обозначается символом Al, атом кремния — символом Si. Такие формулы имеют простые вещества — металлический алюминий, неметалл атомной структуры кремний.
Химическая формула
Молекула кислорода состоит из двух атомов кислорода. Его химическая формула – О 2 . Эта формула читается, произнося сначала символ элемента, затем индекс: «о-два». Формула O 2 обозначает не только молекулу, но и само вещество, кислород.
Молекула O 2 называется двухатомной. Простые вещества водорода, азота, фтора, хлора, брома и йода состоят из подобных молекул (их общая формула Е 2).
Озон содержит трехатомные молекулы, белый фосфор – четырехатомные молекулы, а сера – восьмиатомные молекулы. (Напишите химические формулы этих молекул.)
(Напишите химические формулы этих молекул.)
H 2
O 2
N 2
Cl 2
Br 2
I 2
В формуле молекулы сложного вещества символами элементов, атомы которых входят в ее состав, являются написаны, как и индексы. Молекула углекислого газа состоит из трех атомов: одного атома углерода и двух — кислорода. Его химическая формула – СО 2 (читается «це-о-два»). Помните: если в молекуле один атом какого-то элемента, то соответствующий индекс, то есть I, в химической формуле не пишется. Формула молекулы углекислого газа является и формулой самого вещества.
В формуле иона дополнительно записывается его заряд. Для этого используется верхний индекс. В нем цифра указывает количество заряда (единица измерения не пишется), а затем знак (плюс или минус). Например, ион натрия с зарядом +1 имеет формулу Na+ (читается «натрий-плюс»), ион хлора с зарядом — I — СГ- («хлор-минус»), ион гидроксида с зарядом — I -ОН- («о-золь-минус»), карбонат-ион с зарядом -2-СО 2-3 («це-о-три-два-минус»).
Na+, Cl —
простые ионы
ОН -, СО 2- 3
сложные ионы
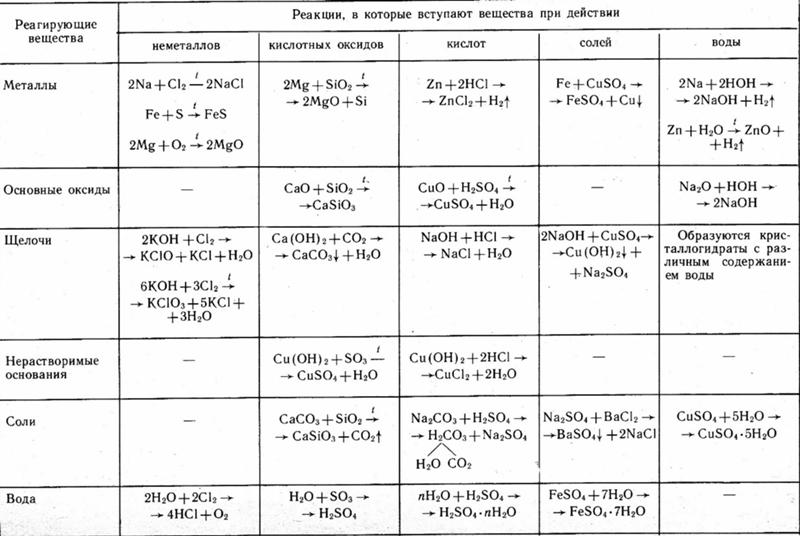
В формулы ионных соединений сначала записывают без указания зарядов положительно заряженные ионов , а затем — отрицательно заряжены (табл. 2). Если формула верна, то сумма зарядов всех ионов в ней равна нулю.
таблица 2
Формулы некоторых ионных соединений
В некоторых химических формулах в скобках записывается группа атомов или комплексный ион. В качестве примера возьмем формулу гашеной извести Ca(OH)2. Это ионное соединение. В ней на каждый ион Са 2+ приходится два иона ОН — . Составная формула гласит: « кальций -о-зола-дважды», но не «кальций-о-зола-два».
Иногда в химических формулах вместо символов элементов пишут «лишние» буквы, а также буквы-индексы. Такие формулы часто называют общими. Примеры формул этого типа: ECI n, E n O m, Fe x O y. Первая
должен быть установлен.

Если вам нужно обозначить два отдельных атома неона, две молекулы кислорода, две молекулы углекислого газа или два иона натрия, используйте обозначения 2Ne, 20 2, 2CO 2, 2Na+. Число перед химической формулой называется коэффициентом. Коэффициент I, как и индекс I, не пишется.
Единица формулы.
А что означает запись 2NaCl? Молекулы NaCl не существуют; поваренная соль представляет собой ионное соединение, состоящее из ионов Na+ и Cl-. Пара этих ионов называется формульной единицей вещества (она выделена на рис. 44, а). Таким образом, запись 2NaCl представляет собой две формульные единицы поваренной соли, т. е. две пары ионов Na + и С l-.
Термин «формульная единица» применяется для сложных веществ не только ионного, но и атомарного строения. Например, формульная единица кварца SiO 2 представляет собой сочетание одного атома кремния и двух атомов кислорода (рис. 44, б).
Рис. 44. Формульные единицы в соединениях ионного (а) атомарного строения (б)
Формульная единица – это мельчайший «кирпичик» материи, ее мельчайший повторяющийся фрагмент. Этот фрагмент может быть атомом (в простом веществе), молекул (в простом или сложном веществе),
Этот фрагмент может быть атомом (в простом веществе), молекул (в простом или сложном веществе),
совокупность атомов или ионов (в сложном веществе).
Упражнение. Составьте химическую формулу соединения, содержащего ионы Li + i SO 2-4. Назовите формульную единицу этого вещества.
Решение
В ионном соединении сумма зарядов всех ионов равна нулю. Это возможно при условии, что на каждый ион SO 2-4 приходится два иона Li+. Отсюда формула соединения: Li 2 SO 4.
Формульная единица вещества – три иона: два иона Li+ и один ион SO 2-4 .
Качественный и количественный состав вещества.
Химическая формула содержит информацию о составе частицы или вещества. Характеризуя качественный состав, называют элементы, образующие частицу или вещество, а характеризуя количественный состав, указывают:
Число атомов каждого элемента в молекуле или комплексном ионе;
соотношение атомов различных элементов или ионов в веществе.
Задание … Опишите состав метана CH 4 (молекулярное соединение) и кальцинированной соды Na 2 CO 3 (ионное соединение)
Решение
Метан образован элементами Углерод и Водород (это качественный состав). Молекула метана содержит один атом углерода и четыре атома водорода; их соотношение в молекуле и в веществе
Н(С):Н(Н)=1:4 (количественный состав).
(Буква N обозначает количество частиц — атомов, молекул, ионов.
Кальцинированная сода образована тремя элементами — Натрий, Углерод и Кислород. Она содержит положительно заряженные ионы Na+, так как Натрий является металлическим элементом и отрицательно заряженные ионы СО -2 3 (качественный состав)
Соотношение атомов элементов и ионов в веществе следующее:
выводы
Химическая формула – это запись атома, молекулы, иона, вещества с использованием символов химических элементов и индексов. Число атомов каждого элемента указано в формуле с помощью нижнего индекса, а заряд иона — с помощью верхнего индекса.
Формульная единица — частица или совокупность частиц вещества, представленная его химической формулой.
Химическая формула отражает качественный и количественный состав частицы или вещества.
?
66. Какую информацию о веществе или частице содержит химическая формула?
67. В чем разница между коэффициентом и нижним индексом в химических записях? Дополните свой ответ примерами. Для чего используется надстрочный индекс?
68. Прочитайте формулы: P 4, KHCO 3, AI 2 (SO 4) 3, Fe(OH) 2 NO 3, Ag+, NH + 4, CIO — 4.
69. Что означают ли записи: 3H 2 0, 2H, 2H 2, N 2, Li, 4Cu, Zn 2+, 50 2-, NO — 3, ЗСа(0Н) 2, 2СаС0 3?
70. Запишите химические формулы, которые читаются следующим образом: эс-о-три; бор — два-три; пепел-ан-о-два; хром-о-ясень-трижды; зола натрия-ес-о-четыре; ан-аш-четыре-дважды-эс; барий два плюс; пе-о-четыре-три-минус.
71. Составьте химическую формулу молекулы, в состав которой входят: а) один атом азота и три атома водорода; б) четыре атома водорода, два атома фосфора и семь атомов кислорода.
72. Что такое формула единицы: а) для кальцинированной соды Na 2 CO 3 ; б) для ионогенного соединения Li 3 N; в) для соединения B 2 O 3, имеющего атомную структуру?
73. Составьте формулы всех веществ, которые могут содержать только такие ионы: K+, Mg2+, F-, SO-2 4, OH-.
74. Охарактеризуйте качественный и количественный состав:
а) вещества молекулярные — хлор Cl 2 , перекись водорода (перекись водорода) H 2 O 2 , глюкоза C 6 H 12 O 6 ;
б) ионогенное вещество — сульфат натрия Na 2 SO 4 ;
в) ионы H 3 O +, HPO 2- 4.
Попель П.П., Крикля Л.С., Химия: Пидруч. за 7 кл. загалноосвит. навч. прл. — К.: ВЦ «Академия», 2008. — 136 с.: ил.
Содержание урока план урока и вспомогательная рамка презентация урока интерактивные технологии ускоренные методы обучения практика тесты, тестовые онлайн-задачи и упражнения домашние задания семинары и тренинги вопросы для обсуждения в классе иллюстрации видео- и аудиоматериалы фото, картинки, графики, таблицы, схемы, комиксы, притчи, поговорки, кроссворды, анекдоты, анекдоты, цитаты Дополнения рефераты шпаргалки чипы для любопытных статей (MAN) литература основная и дополнительная лексика терминов
Учебники и урокиисправление ошибок в учебнике; замена устаревших знаний новыми Только для учителей календарные планы образовательные программы методические рекомендации
Рассмотрим качественный и количественный состав веществ. Определим его особенности для соединений органического и неорганического происхождения.
Определим его особенности для соединений органического и неорганического происхождения.
Что показывает качественный состав вещества
Демонстрирует типы атомов, которые находятся в анализируемой молекуле. Например, вода образуется из водорода и кислорода.
В состав молекулы входят атомы натрия и кислорода. Серная кислота содержит водород, кислород, серу.
Что показывает количественный состав
Показывает количественное содержание каждого элемента в сложном веществе.
Например, вода содержит два атома водорода и один кислород. Серная кислота состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Содержит три атома водорода, один атом фосфора и четыре атома кислорода.
Органические вещества также имеют качественный и количественный состав веществ. Например, метан содержит один углерод и четыре водорода.
Методы определения состава вещества
Качественный и количественный состав веществ можно определить химическим путем. Например, при распаде молекулы сложного соединения образуется несколько молекул более простого состава. Так, при нагревании карбоната кальция, состоящего из кальция, углерода, четырех атомов кислорода, можно получить еще и два углерода.
Например, при распаде молекулы сложного соединения образуется несколько молекул более простого состава. Так, при нагревании карбоната кальция, состоящего из кальция, углерода, четырех атомов кислорода, можно получить еще и два углерода.
А соединения, образующиеся при химическом разложении, могут иметь разный качественный и количественный состав веществ.
Простые и сложные соединения могут иметь как молекулярный, так и немолекулярный состав.
Первая группа находится в разных агрегатных состояниях… Например, сахар — твердое тело, вода — жидкость, а кислород — газ.
Соединения немолекулярной структуры находятся в твердой форме при стандартных условиях. К ним относятся соли. В процессе нагревания они плавятся, переходят из твердого состояния в жидкое.
Примеры определения состава
«Опишите качественный и количественный состав следующих веществ: оксид серы (4), оксид серы (6)». Такая задача типична для школьного курса неорганической химии. Для того чтобы с ней справиться, нужно сначала составить формулы предлагаемых соединений, используя валентности или степени окисления.
Для того чтобы с ней справиться, нужно сначала составить формулы предлагаемых соединений, используя валентности или степени окисления.
Оба предлагаемых оксида содержат одни и те же химические элементы, поэтому их качественный состав одинаков. В их состав входят атомы серы и кислорода. Но в количественном отношении результаты будут отличаться.
Первое соединение содержит два атома кислорода, второе – шесть.
Выполним следующую задачу: «Охарактеризуйте качественный и количественный состав веществ ч3S».
Молекула сероводорода состоит из атома серы и двух атомов водорода. Качественный и количественный состав вещества h3S позволяет прогнозировать его химические свойства. Поскольку в составе присутствует катион водорода, сероводород способен проявлять окислительные свойства. Например, подобные характеристики проявляются при взаимодействии с активным металлом.
Информация о качественном и количественном составе вещества актуальна и для органических соединений. Например, зная количественное содержание компонентов в молекуле углеводорода, можно определить его принадлежность к определенному классу веществ.
Например, зная количественное содержание компонентов в молекуле углеводорода, можно определить его принадлежность к определенному классу веществ.
Такая информация позволяет прогнозировать химические и физические характеристики анализируемого углеводорода и выявлять его специфические свойства.
Например, зная, что в составе четыре атома углерода и десять атомов водорода, можно сделать вывод, что это вещество относится к классу предельных (насыщенных) углеводородов, имеющих общую формулу Ch3n+2. Все представители этого гомологического ряда являются характеризуется радикальным механизмом, а также окислением кислородом воздуха.
Заключение
Любое неорганическое и органическое вещество имеет определенный количественный и качественный состав. Информация необходима для установления физико-химических свойств анализируемого неорганического соединения, а для органических веществ состав позволяет установить принадлежность к классу, выявить характерные и специфические химические свойства.
В ходе занятия вы узнаете о качественном и количественном составе органических веществ, о том, что такое простейшая, молекулярная, структурная формула.
Многие молекулярные формулы могут соответствовать одной простой формуле.
Формула, показывающая порядок соединения атомов в молекуле, называется структурной формулой.
Гексен и циклогексан имеют одинаковые молекулярные формулы C 6 H 12 , но это два разных вещества с разными физическими и химическими свойствами. См. табл. 1.
Таб. 1. Разница в свойствах гексена и циклогексана
Для характеристики органического вещества необходимо знать не только состав молекулы, но и порядок расположения атомов в молекуле — строение молекулы.
Строение веществ отражает структурные (графические) формулы, в которых ковалентные связи между атомами обозначены черточками — валентными штрихами.
В органических соединениях углерод образует четыре связи, водород – одну, кислород – две и азот – три.
Валентность. Число ковалентных неполярных или полярных связей, которые может образовать элемент, называется валентностью
Связь, которая образуется одной парой электронов, называется простой или одинарной связью.
Связь, образованная двумя парами электронов, называется двойной связью, ее обозначают двумя черточками, как знаком «равно». Три электронные пары образуют тройную связь , которая обозначена тремя черточками. См. таблицу. 2.
Таб. 2. Примеры органических веществ с различными связями
На практике обычно используют сокращенные структурные формулы , в которых не указаны связи углерода, кислорода и других атомов с водородом:
Рис.: 1. Объемная модель молекулы этанола
Структурные формулы передают порядок соединения атомов друг с другом, но не передают расположение атомов в пространстве. Структурные формулы представляют собой двухмерный рисунок, а молекулы трехмерные, т.е. объемные, это показано на примере этанола на рис. 1.
Структурные формулы представляют собой двухмерный рисунок, а молекулы трехмерные, т.е. объемные, это показано на примере этанола на рис. 1.
На уроке был затронут вопрос о качественном и количественном составе органических веществ, о том, что представляет собой простейшая, молекулярная, структурная формула.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. — 14 выпуск. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учебник. для общего образования. учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учебник. для общего образования. учреждений / В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. — 4-е изд. — М.: РИА «Новая волна»: Изд-во Умеренков, 2012.
