Урок. 8-ой класс.Приготовление растворов заданной концентрации. Практическая работа № 5
Тема 4.урок № 6. Приготовление растворов заданной концентрации.
Практическая работа № 5
Теория – это хорошая вещь,
но правильный эксперимент
остается навсегда”.
(Пётр Леонидович Капица)
Цель работы: Уметь готовить растворы с определенной массовой долей растворенного вещества, используя следующие операции: взвешивание, отмеривание определенного объема жидкости, растворение; производить необходимые расчеты; знать расчетную формулу для определения массовой доли растворенного вещества, правила пользования химической посудой и реактивами
Закрепление важнейших химических понятий: объём, плотность, масса, массовая доля растворённого вещества;
Отработка химических расчётов
Задачи урока
Универсальные учебные действия
Образовательные:
выявить и закрепить основные понятия по теме, изучить практическую значимость процесса растворения и его зависимость от различных факторов,повторить и использовать правила ТБ, формированать навыков решения задач на нахождение массовой доли растворенного вещества
Познавательные:
знать определение основных понятий, уметь систематизировать и структурировать результаты,практически применить знания о растворах и массовой доле растворённого вещества,
Развивающие:
формировать и совершенствовать умения практической работы с реактивами и
оборудовании в химическом кабинете, формировать навыки работы в группе, развить
общенаучные и метапредметные умения, формировать экспериментальных умений
готовить растворы заданной концентрации.
Оборудование: Измерительный цилиндр, лабораторные весы с разновесами, стеклянная палочка, химический стакан, колба с водой.Карточки стестами и првилами.
Реактивы: соль или сахар.
Ход урока
I. Организационный момент
Зачитывает один изучащихся
«Разве вода – это только жидкость, что налита в стакан? Океан, покрывающий почти всю планету, всю нашу чудесную Землю, в которой миллионы лет назад зародилась жизнь – это вода». (академик И. В. Петряков – Соколов).
В древней Индии накаленные
серебряные стержни погружали в воду, и потом ее использовали для обмывания ран.
На долю пресной воды приходится 3 %. Большая часть пресной воды (85 %) находится на полюсах Земли в виде ледников и айсбергов.
В XVI в. Елизавета I, королева Англии объявила премию за изобретение дешевого способа опреснения морской воды. Премия пока еще никому не вручена. Воду надо беречь! Это надо понять и запомнить каждому.
Беречь воду – значит беречь жизнь, здоровье, красоту окружающей природы. В организме человека 65 % воды. Она является основной средой и растворителем. Потеря человеком воды на 12 – 15 % приводит к нарушению обмена веществ, а потеря ее до 25 % — к гибели. Без воды человек может прожить только 3 дня.
Вода – универсальный растворитель. В воде хорошо растворяются многие газы, жидкости и твердые вещества.
Процесс растворения заключает в
себе физическое явление (дробление до молекул) и химическое взаимодействие
компонентов. max p (H2O) при 4ºС = 1 г/см3.
max p (H2O) при 4ºС = 1 г/см3.
II.Практическая работа
1. Правила техники безопасности
Практическую часть начнём с проверки знаний правил ТБ, которые важно помнить при выполнении работы.
тест по правилам техники безопасности:
1. Вещества на вкус:
А) можно пробовать, Б) нельзя пробовать, В) надо спросить у учителя.
2. Твердые вещества берут:
А) рукой, Б) ложечкой, В) как придется, Г) не знаю.
3. Посуду при работе надо использовать:
А) чистую, Б) грязную, В) с трещинами
4. К работе в лаборатории можно приступать:
А) когда захочешь, Б) с разрешения учителя, В) когда будешь готов.
5. Объем воды измеряют:
А) на весах, Б) в мерном цилиндре, В) в мерном стакане.
6. Полученный раствор необходимо:
А) отдать учителю. Б) вылить в канализацию
Ответы: 1
– Б, 2 – Б, 3 – А, 4 – Б, 5 — Б, 6 – А.
Вывод: делают учащиеся
1) Нельзя пробовать вещества на вкус.2) Нельзя брать вещества руками.
3) Если взяли реактива больше, чем требуется, нельзя высыпать (выливать) обратно в банку (склянку).4) Нюхать вещества с осторожностью.
5) Работать аккуратно и внимательно, соблюдая порядок и дисциплину.
6) По окончанию работы привести в порядок рабочее место и вымыть руки с мылом.
Осторожно обращайтесь с химическим оборудованием!
2. Правила работы с лабораторными весами
1.Если весы не уравновешены, добейтесь
их равновесия.
2.Поместите на левую чашу весов взвешиваемый предмет.
3.Откройте футляр с гирями и, достав ту, что на ваш взгляд, тяжелее предмета,
положите её на правую чашу. Убедившись, что она перетягивает, поставьте её
обратно в футляр, а на чашу положите другую
гирю (меньшей массы).
Перебирая, таким образом, гирю за гирей, добейтесь равновесия весов.
4.Мелкие гирьки (от 500 до 10 мг) доставайте из футляра с помощью пинцета.
5.Определите по гирям общую массу предмета.
6. Придерживая чаши весов, снимите с них все гири и положите их обратно в футляр.
“Химик не такой должен быть,
который дальше дыму и пеплу
ничего не видит, а такой,
который на основании
опытных делать
теоретические выводы”
М.В.Ломоносов
II. Выполнение работы
1. Записали
число, тему практической работы
Записали
число, тему практической работы
«Приготовление растворов заданной концентрации».
Практическая работа № 5
2.Шаги по которым ребята будут работать
Приготовить 120 г 15% — ного раствора сахара.
Тебе помогут следующие шаги:
1. Запишите формулу для определения массовой доли растворённого вещества.
2. Выведи из данной формулы массу растворённого вещества.
3. Подставь данные в формулу и определи количество сахара, которое тебе необходимо взвесить.
4. Взвесь необходимое количество сахара и помести сахар в стакан.
5. Будь осторожен при обращении со стеклянной посудой !!!
6. От общей массы раствора вычитай массу сахара и ты получишь массу воды.
7. Плотность воды 1г/мл, поэтому V=m
8. Отмерь с помощью измерительного цилиндра необходимый объём
воды и добавь её в стакан с сахаром.
Отмерь с помощью измерительного цилиндра необходимый объём
воды и добавь её в стакан с сахаром.
9. Размешай аккуратно при помощи стеклянной палочки раствор.
3адача
Дано: mр-ра(сахара)= 120 Г; Ѡ(сахара )=15%=0,15 ———————————— |
Найти: mсахара=?, mводы=?.
3.действия учащихся
1.* записали формулу для массовой доли
2. *формула для растворенного вещества
*формула для растворенного вещества
3.*по формуле находим массу сахара, а затем и массу воды
m сахара = 0,15 * 120Г = 18Г; mводы = mраствора – mсахара
m воды = 120г — 18г = 102г
Взвешиваем сахар, помещаем в стакан. Отмеряем воду мерным цилиндром 102мл, т,к плотность воды 1г/мл. Добавляем в стакан с сахаром и тщательно размешиваем.
Сделай письменно вывод в тетради
Вывод: для приготовления раствора сахара с массовой долей 15%
нужно взять 18г сахара и 102 г воды.
Вывод: научились обращаться с весами, приготовили раствор заданной концентрации.
Уборка рабочего места.
III. Домашнее задание – раздаю карточки с задачами
Решить задачи
1. Рассчитайте, какая масса поваренной соли и какой объем воды потребуется для приготовления:
А) 45 мл6%-ого раствора поваренной соли
Б) 0,03 л 25% -ого раствора соли
2. А)
Зарисуйте мерный цилиндр и укажите на нем отмеренное количество воды;
Б) Зарисуйте весы и укажите, как взвешивали рассчитанную
массу вещества .
Расчет
Задача № А
Дано: Vр-ра = 45мл или mр-ра= 45мл* 1г/мл = 45г ; Ѡ(соли )=6%=0,06 mсоли = 45г*0,06 = 2,7г ———————————— |
Найти: mсоли=?, mводы=?. mводы = 45г
— 2,7г =42,3г
mводы = 45г
— 2,7г =42,3г
Ответ: соли – 2,7г; воды — 42,3г
Задача № Б
Дано: Vр-ра = 0,03л или mр-ра= 30мл* 1г/мл = 30г ; Ѡ(соли )=25%=0,25 mсоли = 30г*0,25= 2,7г ———————————— |
Найти: mсоли=?, mводы=?. mводы = 30г — 7,5 г =22,8г
Ответ: соли – 7,5г; воды — 22,8г
Лабораторная работа № 1.
 Приготовление растворов с определенными концентрациями
Приготовление растворов с определенными концентрациями4
Тема «Вода, растворы. Теория электролитической диссоциации»
Лабораторная работа № 1.
Приготовление растворов с определенными концентрациями
Учебная цель: научиться определять концентрацию раствора, исходя из количеств компонентов; готовить растворы заданной концентрации.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
— способы выражения концентрации растворов.
Обучающийся должен уметь:
— проводить расчеты по нахождению определенной концентрации раствора.
Задачи практического занятия:
Закрепить теоретические знания о растворах и способах выражения концентрации.
Ответить на вопросы для закрепления теоретического материала.

Закрепить практику приготовления раствора заданной концентрации.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Оборудование:
технические весы, стакан, стеклянная палочка, мерный цилиндр, мерная колба на 100 мл.
Реактивы:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме лабораторной работы
Растворами называют гомогенные смеси, состоящие из двух или более компонентов.
Растворитель это компонент раствора, агрегатное состояние которого не изменяется при образовании раствора, или содержимое которого преобладает над содержанием других компонентов. Компонентами раствора являются: растворитель и растворенное вещество.
Компонентами раствора являются: растворитель и растворенное вещество.
Однако иногда трудно сказать, вещество является растворителем или растворенным веществом, особенно когда оба вещества взаимно растворяются друг в друге в неограниченном количестве (как спирт и вода). В таких случаях растворителем называют то вещество, которого в растворе больше.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным.
Понятно, что раствор, в котором содержится меньше растворенного вещества, чем в насыщенном, называют ненасыщенным. Некоторые вещества способны образовывать пересыщенные растворы. Однако это довольно нестабильные жидкости: если их встряхнуть или потереть стеклянной палочкой о внутреннюю стенку сосуда, избыток растворенного вещества выпадает в осадок.
Содержание вещества в насыщенном растворе может служить мерой его растворимости. Как правило, растворимость (или коэффициент растворимости) выражают в граммах вещества в 100 г растворителя (например, воды). Если растворимость превышает 1 г в 100 г воды, вещество считается растворимым, от 0,1 до 1,0 г малорастворимым. Вещества растворимостью менее 0,1 г в 100 г воды условно называют нерастворимыми.
Как правило, растворимость (или коэффициент растворимости) выражают в граммах вещества в 100 г растворителя (например, воды). Если растворимость превышает 1 г в 100 г воды, вещество считается растворимым, от 0,1 до 1,0 г малорастворимым. Вещества растворимостью менее 0,1 г в 100 г воды условно называют нерастворимыми.
По отношению к растворам часто употребляют термины «концентрированный» и «разбавленный». Понятия эти весьма относительные. Если раствор содержит большое количество растворенного вещества, его называют концентрированным. Раствор с небольшим содержанием растворенного вещества называют разбавленным. Как правило, концентрированными или разбавленными называют растворы хорошо растворимых в растворителе веществ.
Твердые вещества, которые в своем составе содержат молекулы воды, называют кристаллогидратами.
Содержание растворенного вещества в растворе называют концентрацией.
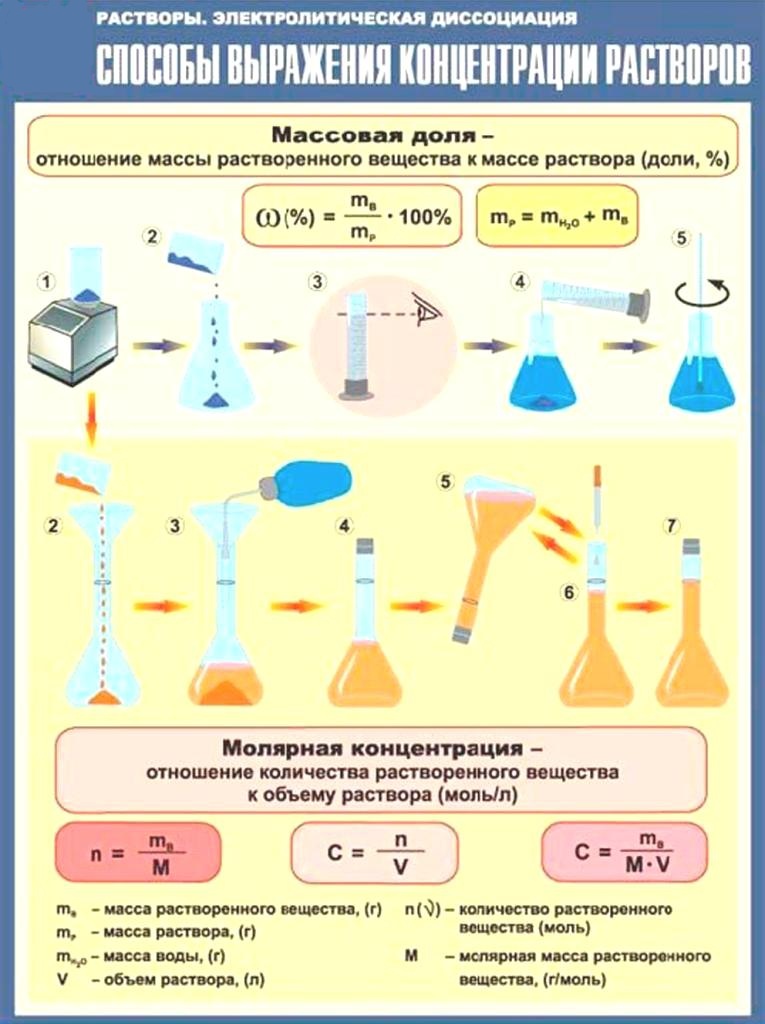
Массовой долей растворенного вещества (В) называют отношение массы растворенного вещества (В) к массе раствора (mр-ра):
(1)
Это понятие аналогично массовой доле вещества в любой смеси, как гетерогенной, так и гомогенной. Массовую долю растворенного вещества выражают в процентах (от 0 до 100%) или долях единицы (от 0 до 1).
Очевидно, что масса раствора mр-ра складывается из массы растворителя mр-ля и массы растворенного вещества mB:
mp-ра = mB + mр-ля (2)
Отмерять жидкости взвешиванием не очень удобно, гораздо проще отмерять нужный объем. Чтобы рассчитать массу известного объема V раствора, необходимо знать его плотность :
mp-ра = V (3)
Как правило, плотность раствора измеряют в граммах на миллилитр (г/мл) или граммах на кубический сантиметр (г/см3), причем численно эти значения равны, поскольку 1 мл это объем, равный 1 см3. Необходимо помнить, что плотность чистой воды равна 1 г/мл.
Необходимо помнить, что плотность чистой воды равна 1 г/мл.
Другим вариантом оценки концентрации раствора является молярная концентрация.
Молярная концентрация количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации СМ, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Расчет молярной концентрации осуществляют по формуле:
(4)
где количество растворенного вещества, моль;
V общий объём раствора, л.
Вопросы для закрепления теоретического материала к лабораторной работе
Что называется раствором?
Что называется растворителем?
Что такое концентрированный раствор?
Что такое насыщенный раствор?
Задания для лабораторного занятия:
Выполнить предложенные задания.

Результаты расчета при приготовлении растворов записать в таблицу 1.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
Вариант 1 | Вариант 2 |
Приготовить 80 г 10% раствора поваренной соли. | Приготовить 40 г 5% раствора поваренной соли. |
Порядок выполнения задания
1. Рассчитайте массу растворенного вещества и растворителя.
На весах взвесьте нужное количество растворенного вещества.
Мерным цилиндром отмерьте нужный объем воды, считая, что плотность воды равна 1 г/мл.
Пересыпьте растворяемое вещество в стакан, прилейте воду, размешайте до полного растворения вещества.

Записываем результаты расчета для приготовления раствора в таблицу 1.
Задание 2
Вариант 1 | Вариант 2 |
Приготовить раствор объемом 100 мл пищевой соды, если молярная концентрация равна 0,1 моль/л. | Приготовить раствор объемом 100 мл пищевой соды, если молярная концентрация раствора 0,2 моль/л. |
Порядок выполнения задания
1. Рассчитайте массу растворенного вещества.
На весах взвесьте нужное количество растворенного вещества.
В мерную колбу на 100 мл всыпаем расчетное количество вещества.
Доводим дистиллированной водой до 100 мл.
Перемешиваем до полного растворения вещества.

Записываем результаты расчета для приготовления раствора в таблицу 1.
Отчитаться о выполненной работе преподавателю.
Таблица 1
Расчет растворенного вещества и растворителя для приготовления раствора заданной концентрации
№ задания | Дано | Расчет по формуле | ||
Вариант | ||||
1 | (%) = р-ля = 1 г/см3 | mB = | ||
mр-ля = | mp-ля = mр-ра — mВ | |||
Vр-ля = | ||||
2 | СМ = Vр-ра = 100 мл | mB = | mB = М, где М молярная масса вещества | |
Вопросы для контроля
Что такое растворимость?
Что такое концентрация растворов?
Что такое массовая доля растворенного вещества?
Что такое молярная концентрация?
Форма контроля выполнения лабораторной работы:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.
В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 5 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12. 1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9. 0024
0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в маточном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем. умножение объема раствора на его молярность.
умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 дает раствор, содержащий 1 05 O 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. — (водн.) \)
— (водн.) \)
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO 3 − ions, so a 0.032 M In(NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 — — это, [в 3 + ] = 0,0323 М.0323 М.0323 M.0323. − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М Уравнение 12.
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств указаны инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.
 is?
is? - да
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 219779
- Дэвид Харви
- Университет ДеПау
- Ответить
Приготовление 500 мл 0,1250 М KBrO 3 требуется
\[0,5000 \text{ L} \times \frac {0,1250 \text{ моль } \ce{KBrO3}} {\text{L}} \times \frac {167,00 \text{ г } \ce{KBrO3}} {\text{моль} \ce{KBrO3}} = 10,44 \text{г} \ce{KBrO3} \номер\]
Поскольку концентрация имеет четыре значащих цифры, мы должны приготовить раствор, используя мерную посуду. Поместите 10,44 г образца KBrO 3 в мерную колбу вместимостью 500 мл и частично заполнить водой.
 Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.- Ответить
Первый раствор представляет собой маточный раствор, который мы затем разбавляем для приготовления стандартного раствора. Концентрация Zn 9{2+}}} {\text{мл}} \times 2,000 \text{мл} = C_d \times 250,0 \text{мл} \nonumber\]
, где C d — концентрация стандартного раствора. Решение дает концентрацию 16,06 мкг Zn 2 + /мл.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Дэвид Харви
- Тип страницы
- Аналитическая химия
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- № на стр.

 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
2.5: Подготовка растворов — Химия LibreTexts
Приготовление раствора известной концентрации, пожалуй, самое распространенное занятие в любой аналитической лаборатории. Метод измерения растворенного вещества и растворителя зависит от желаемой концентрации и от того, насколько точно необходимо знать концентрацию раствора. Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Метод измерения растворенного вещества и растворителя зависит от желаемой концентрации и от того, насколько точно необходимо знать концентрацию раствора. Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Приготовление исходных растворов
Исходный раствор готовят путем взвешивания соответствующей части чистого твердого вещества или путем отмеривания соответствующего объема чистой жидкости, помещения ее в подходящую колбу и разбавления до известной концентрации. объем. То, как именно измеряется реагент, зависит от желаемой единицы концентрации. Например, для приготовления раствора с известной молярностью отвешивают соответствующую массу реагента, растворяют его в порции растворителя и доводят до нужного объема. Чтобы приготовить раствор, в котором концентрация растворенного вещества является объемным процентом, вы отмеряете соответствующий объем растворенного вещества и добавляете достаточное количество растворителя, чтобы получить желаемый общий объем.
Пример 2.5.1
Опишите, как приготовить следующие три раствора: (a) 500 мл примерно 0,20 М NaOH с использованием твердого NaOH; (b) 1 л 150,0 частей на миллион Cu 2 + с использованием металлической меди; и (c) 2 л 4% по объему уксусной кислоты с использованием концентрированной ледяной уксусной кислоты (99,8% по весу уксусной кислоты).
Раствор
(a) Поскольку желаемая концентрация известна с точностью до двух значащих цифр, нам не нужно точно измерять массу NaOH или объем раствора. Желаемая масса NaOH равна
\[\frac {0,20 \text{ моль NaOH}} {\text{L}} \times \frac {40,0 \text{г NaOH}} {\text{моль NaOH}} \times 0,50 \text{L} = 4,0 \text{ г NaOH} \номер\]
Для приготовления раствора поместите 4,0 грамма NaOH, взвешенных с точностью до десятых долей грамма, в бутыль или химический стакан и добавьте примерно 500 мл воды.
(b) Поскольку желаемая концентрация Cu 2 + задается четырьмя значащими цифрами, мы должны точно измерить массу металлической Cu и объем конечного раствора. Желаемая масса металлической меди
Желаемая масса металлической меди
\[\frac {150,0 \text{мг Cu}} {\text{L}} \times 1,000 \text{ M } \times \frac {1 \text{г}} {1000 \text{мг}} = 0,1500 \text{г Cu} \номер\]
Для приготовления раствора отмерьте ровно 0,1500 г меди в небольшой химический стакан и растворите его, используя небольшую порцию концентрированной HNO 3 . Для обеспечения полного переноса Cu 2 + из стакана в мерную колбу — то, что мы называем количественным переносом — несколько раз промыть химический стакан небольшими порциями воды, добавляя при каждой промывке мерную колбу. . Наконец, добавьте еще воды до калибровочной отметки на мерной колбе.
(c) Концентрация этого раствора является приблизительной, поэтому нет необходимости точно измерять объемы, а также нет необходимости учитывать тот факт, что ледяная уксусная кислота представляет собой немного менее 100% уксусной кислоты по весу (это приблизительно 99,8% вес./вес. ). Необходимый объем ледяной уксусной кислоты
). Необходимый объем ледяной уксусной кислоты
\[\frac {4 \text{ мл } \ce{Ch4COOH}} {100 \text{ мл}} \times 2000 \text{ мл} = 80 \text{ мл } \ce{Ch4COOH} \nonumber\]
Чтобы приготовить раствор, используйте градуированный цилиндр, чтобы перенести 80 мл ледяной уксусной кислоты в контейнер, вмещающий приблизительно 2 л, и добавить достаточное количество воды, чтобы довести раствор до желаемого объема.
Упражнение 2.5.1
Предоставьте инструкции по приготовлению 500 мл 0,1250 М KBrO 3 .
Приготовление растворов путем разбавления
Растворы часто готовят путем разбавления более концентрированного маточного раствора. Известный объем маточного раствора переносят в новую емкость и доводят до нового объема. Поскольку общее количество растворенного вещества до и после разбавления одинаково, мы знаем, что
\[C_o \times V_o = C_d \times V_d \label{2.1}\]
где \(C_o\) — концентрация исходного раствора, \(V_o\) — объем разбавляемого исходного раствора, \( C_d\) — концентрация разбавленного раствора, а \(V_d\) — объем разбавленного раствора. Опять же, тип стеклянной посуды, используемой для измерения \(V_o\) и \(V_d\), зависит от того, насколько точно нам нужно знать концентрацию раствора.
Обратите внимание, что уравнение \ref{2.1} применяется только к тем единицам концентрации, которые выражены в терминах объема раствора, включая молярность, формальность, нормальность, объемные проценты и весовые проценты по объему. Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Пример 2.5.2
Лабораторная процедура требует 250 мл примерно 0,10 М раствора NH 3 . Опишите, как вы приготовили бы этот раствор, используя исходный раствор концентрированного NH 3 (14,8 М).
Раствор
Подстановка известных объемов в уравнение \ref{2.1}
\[14,8 \text{ M} \times V_o = 0,10 \text{ M} \times 250 \text{ мл} \nonumber\]
и решение для \(V_o\) дает 1,7 мл. Поскольку мы готовим раствор с концентрацией примерно 0,10 М NH 3 , мы можем использовать градуированный цилиндр для измерения 1,7 мл концентрированного NH 3 , перенести NH 3 в химический стакан и добавить достаточное количество воды, чтобы получить общий объем около 250 мл.
Хотя обычно мы выражаем молярность как моль/л, мы можем выразить объемы в мл, если сделаем это как для \(V_o\) , так и для \(V_d\).
Упражнение 2.5.2
Для приготовления стандартного раствора Zn 2 + образец цинковой проволоки массой 1,004 г растворяют в минимальном количестве HCl и доводят до нужного объема в мерной колбе вместимостью 500 мл. Если вы разбавите 2,000 мл этого исходного раствора до 250,0 мл, какова будет концентрация Zn 2 + в мкг/мл в вашем стандартном растворе?
Как показано в следующем примере, мы можем использовать уравнение \ref{2.1} для расчета исходной концентрации раствора, используя его известную концентрацию после разбавления.
Пример 2.5.3
Образец руды был проанализирован на Cu 2 + следующим образом. Навеску руды массой 1,25 г растворяли в кислоте и доводили до нужного объема в мерной колбе вместимостью 250 мл. 20 мл полученного раствора пипеткой переносили в мерную колбу вместимостью 50 мл и доводили до метки. Анализ этого раствора дает концентрацию Cu 2 + 4,62 мкг/мл. Какова массовая доля меди в исходной руде?
Решение 9{2+}} \номер\]
Эта страница под названием 2.5: Preparing Solutions распространяется под лицензией CC BY-NC-SA и была создана, изменена и/или курирована Дэвидом Харви.






 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита? is?
is? Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
