8 класс. Химия. Химические свойства кислорода — Химические свойства кислорода
Комментарии преподавателяТепловой эффект химической реакции
Кислород поддерживает процессы дыхания и горения. В кислороде горят многие неметаллы. Например, уголь горит на воздухе, взаимодействуя при этом с кислородом. В результате этой реакции образуется углекислый газ и выделяется теплота. Из курса физики вы знаете, что теплота обозначается буквой «Q». Если в результате реакции теплота выделяется, то в уравнении пишут «+Q», если поглощается – то «-Q».
Теплота, которая выделяется или поглощается в ходе химической реакции, называется тепловым эффектом химической реакции.
Реакции, протекающие с выделением теплоты, называются экзотермическими.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
Запишем уравнение реакции горения угля на воздухе:
С + О2 = СО2 + Q
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе.
Рис. 1. Горение угля в кислороде
Сера тоже горит на воздухе, при этом также выделяется теплота. Значит, реакцию взаимодействия серы с кислородом можно назвать экзотермической. В чистом кислороде сера сгорает быстрее, чем на воздухе.
Запишем уравнение реакции горения серы в кислороде, если при этом образуется оксид серы (IV):
S + O2 = SO2 + Q
Рис. 2. Горение серы в кислороде
Аналогично, можно провести реакцию горения фосфора на воздухе или в кислороде. Эта реакция также является экзотермической. Запишем ее уравнение, если в результате образуется оксид фосфора (V):
4Р + 5О2 = 2Р2О5 + Q
Рис. 3. Горение фосфора в кислороде
В атмосфере кислорода могут гореть некоторые металлы. Например, железо сгорает в кислороде с образованием железной окалины:
3Fe + 2O2 = Fe3O4 +Q
Рис. 4. Горение железа в кислородеА вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II):
При этом образуется оксид меди (II):
2Cu + O2 = 2CuO
Кислород способен реагировать не только с простыми, но и со сложными веществами.
Природный газ метан сгорает в кислороде с образованием оксида углерода (IV) и воды:
Ch5 + 2O2 = CO2 + 2h3O + Q
При неполном сгорании метана (в условиях недостаточного количества кислорода) образуется не углекислый, а угарный газ СО. Угарный газ – ядовитое вещество, чрезвычайно опасное для человека, т.к. человек не ощущает его отравляющего действия, а медленно засыпает с потерей сознания.
Реакции простых и сложных веществ с кислородом называют окислением. При взаимодействии простых и сложных веществ с кислородом, как правило, образуются сложные вещества, состоящие из двух элементов, одним из которых является кислород. Эти вещества называются оксидами.
ИСТОЧНИКИ
источник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/himicheskie-svoystva-kisloroda
источник видео — http://www. youtube.com/watch?v=YW-YKCEqIKc
youtube.com/watch?v=YW-YKCEqIKc
источник видео — http://www.youtube.com/watch?v=akuWJiPcxb8
источник прпезентации — http://ppt4web.ru/khimija/kislorod2.html
http://www.youtube.com/watch?v=3e8JIsERnCQ
http://himege.ru/kislorod-xarakteristika-elementa-svojstva/
http://www.myshared.ru/slide/379773/#
http://infourok.ru/himicheskie_svoystva_kisloroda_prezentaciya_dlya_8_klassa-534446.htm
http://900igr.net/zip/khimija/KHarakteristika-elementa-kisloroda.html
Химические свойства кислорода. Реакции соединения, оксиды, окисление, горение | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Загрузка…
Вспыхивание тлеющей лучинки при ее внесении в сосуд с кислородом характеризует его химические свойства. Ведь и с древесиной, и с кислородом произошли при этом химические изменения.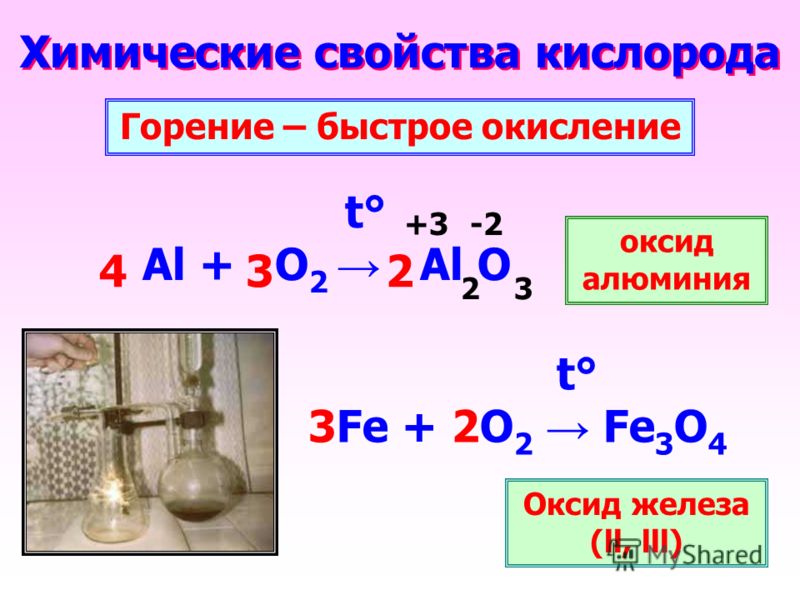
Для того чтобы деревянная лучинка загорелась, ее нужно нагреть в пламени горелки до определенной температуры. Многие вещества также реагируют с кислородом только после предварительного нагревания.
Чтобы убедиться в этом, выполним опыты.
Опыт 1. Под тягой нагреем немного серы в стальной ложечке для сжигания веществ.
Сначала сера плавится. Расплавленная сера горит в воздухе слабым синим пламенем. Возле отверстия сосуда с кислородом горение серы усиливается. В атмосфере кислорода сера сгорает ярким голубым пламенем.
Горение серы сопровождается выделением большого количества световой и тепловой энергии и появлением резкого запаха:
S + O2 = SO2.
Этот запах свидетельствует об образовании сернистого газа, который сильно раздражает слизистые оболочки.
Сернистый газ SO2 пагубно действует на бактерии и микроскопические грибы. Многие хозяева для лучшего сохранения овощей перед закладкой их на зиму сжигают в погребе немного серы.
Многие хозяева для лучшего сохранения овощей перед закладкой их на зиму сжигают в погребе немного серы.
| Рис. 19.2. Горение красного фосфора в воздухе и в кислороде (1—4) |
Опыт 2. Следующий опыт также будем проводить под тягой.
Загрузка…
Насыпем на дно толстостенной колбы кварцевого песка. Подожжем в ложечке красный фосфор. Он горит желтоватым пламенем. Быстро внесем его в колбу с кислородом и закроем ее пробкой. Пламя становится ослепительно-белым. Густой белый дым — частицы оксида фосфора (V) — продукта сгорания фосфора (рис 19.2).
Раскаленный древесный уголек при внесении в сосуд с кислородом раскаляется добела и быстро сгорает без пламени и дыма:
C + O2 = CO2.
Реакция горения угля проходит и на воздухе. Уголь широко применяют в качестве твердого топлива.
Уголь широко применяют в качестве твердого топлива.
Проанализируем уравнения реакций серы, фосфора и углерода с кислородом. В каждую из реакций вступает по два вещества, а в результате их взаимодействия образуется одно вещество. Материал с сайта http://worldofschool.ru
Реакции при участии нескольких реагентов с образованием одного продукта называют реакциями соединения.
Все продукты рассмотренных реакций соединения —
Оксиды — сложные вещества, образованные двумя элементами, один из которых — кислород.
Реакции веществ с кислородом называют реакциями окисления.
Если окисление сопровождается выделением света и тепла, то его обычно называют горением.
На этой странице материал по темам:
Вопросы по этому материалу:
Почему серу нужно сжигать в вытяжном шкафу?
Какие реакции противоположны реакциям соединения?
Приведи примеры реакций соединения, объясни их суть.

Сравни реакции соединения с реакциями разложения.
Охарактеризуй химические свойства кислорода, составь уравнения соответствующих реакций.
Сравни процессы окисления и горения.
Материал с сайта http://WorldOfSchool.ru
3.9: Химические уравнения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 209982
Цели обучения
- Определение реагентов и продуктов любой химической реакции.
- Преобразование словесных уравнений в химические уравнения.
- Используйте общие символы, \(\left( s \right)\), \(\left( l \right)\), \(\left( g \right)\), \(\left( aq \right )\) и \(\rightarrow\) при написании химической реакции.

Сжигание ископаемого топлива приводит к образованию двуокиси углерода, парникового газа и других загрязняющих веществ. Это пример химических изменений, при которых образуются новые вещества. Для того чтобы это произошло, химические связи веществ разрываются, а составляющие их атомы отделяются и перестраиваются в новые вещества с новыми химическими связями. Когда этот процесс происходит, мы называем его химической реакцией. А
Реагенты и продукты
Чтобы описать химическую реакцию, нам нужно указать, какие вещества присутствуют в начале и какие вещества присутствуют в конце. Вещества, присутствующие в начале, называются реагентами , а вещества, присутствующие в конце, называются продуктами .
Написание химических уравнений
При добавлении диоксида серы к кислороду образуется триоксид серы. Диоксид серы и кислород, \(\ce{SO_2} + \ce{O_2}\), являются реагентами, а триоксид серы, \(\ce{SO_3}\), является продуктом.
Диоксид серы и кислород, \(\ce{SO_2} + \ce{O_2}\), являются реагентами, а триоксид серы, \(\ce{SO_3}\), является продуктом.
\[ \underbrace{\ce{2SO2(g) + O2(g)}}_{\text{Реагенты}} \rightarrow \underbrace{\ce{2SO3(g)}}_{\text{Продукты }} \nonumber\]
В химических реакциях реагенты находятся перед символом «\(\стрелка вправо\)», а продукты — после символа «\(\стрелка вправо\)». Общее уравнение реакции:
\[\text{Реагенты } \rightarrow \text{Продукты} \nonumber\]
Есть несколько специальных символов, которые нам нужно знать, чтобы «говорить» в химической стенографии. В таблице ниже приведены основные символы, используемые в химических уравнениях. В таблице \(\PageIndex{1}\) приведен список символов, используемых в химических уравнениях.
| Символ | Описание | Символ | Описание |
|---|---|---|---|
| \(+\) | используется для разделения нескольких реагентов или продуктов | реагент или продукт в твердом состоянии | |
| \(\стрелка вправо\) | знак доходности; отделяет реагенты от продуктов | \(\влево(л\вправо)\) | реагент или продукт в жидком состоянии |
| \(\rightleftharpoons\) | заменяет знак выхода для обратимых реакций, которые достигают равновесия | \(\влево(г\вправо)\) | реагент или продукт в газообразном состоянии |
| \(\overset{\ce{Pt}}{\стрелка вправо}\) | Формула, написанная над стрелкой, используется в качестве катализатора в реакции | \(\влево(вода\вправо)\) | реагент или продукт в водном растворе (растворенный в воде) |
| \(\overset{\Delta}{\стрелка вправо}\) | Треугольникозначает, что реакция нагревается |
У химиков есть выбор методов описания химической реакции.
1. Вы можете нарисовать химическую реакцию с субмикроскопическими частицами.
2. Вы можете написать уравнение химической реакции в словесном формате:
«Две молекулы газообразного водорода реагируют с одной молекулой газообразного кислорода с образованием двух молекул водяного пара».
3. Вы можете написать уравнение с химическими символами
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O } \left( g \right)\]
В символьном уравнении химические формулы используются вместо химических названий реагентов и продуктов, а символы используются для обозначения фазы каждого вещества.
Чтобы превратить словесные уравнения в символьные уравнения, нам нужно выполнить следующие шаги:
- Идентифицировать реагенты и продукты. Это поможет вам узнать, какие символы идут с каждой стороны стрелки и куда идут знаки \(+\).
- Напишите правильные формулы для всех соединений.
- Иногда реагент или продукт представляет собой только элемент (например, газообразный водород или газообразный кислород).
 Есть семь элементов, которые считаются двухатомными, а это означает, что они всегда встречаются в природе парами. Они включают в себя те элементы, которые перечислены в таблице.
Есть семь элементов, которые считаются двухатомными, а это означает, что они всегда встречаются в природе парами. Они включают в себя те элементы, которые перечислены в таблице.
| Название элемента | Водород | Азот | Кислород | Фтор | Хлор | Бром | Йод |
|---|---|---|---|---|---|---|---|
| Формула | \(Н_2\) | \(N_2\) | \(О_2\) | \(Ф_2\) | \(Cl_2\) | \(Бр_2\) | \(I_2\) |
Пример \(\PageIndex{1}\)
Перенесите следующие символьные уравнения в словесные уравнения или словесные уравнения в символьные уравнения.
- \(\ce{HCl} \left( aq \right) + \ce{NaOH} \left( aq \right) \rightarrow \ce{NaCl} \left( aq \right) + \ce{H_2O} \влево( л \вправо)\)
- Газообразный пропан \(\ce{C_3H_8}\) сгорает в кислороде с образованием газообразного диоксида углерода и жидкой воды.
- Газообразный фтористый водород реагирует с водным раствором карбоната калия с образованием водного раствора фтористого калия, жидкой воды и газообразного диоксида углерода.
Раствор
а. Водный раствор соляной кислоты реагирует с водным раствором гидроксида натрия с образованием водного раствора хлорида натрия и жидкой воды.
б. Реагенты: пропан (\(\ce{C_3H_8}\)) и кислород (\(\ce{O_2}\))
Продукт: диоксид углерода (\(\ce{CO_2}\)) и вода (\(\ ce{H_2O}\))
\[\ce{C_3H_8} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + \ce{H_2O} \left( l \right) \nonumber \]
c. Реагенты: фтористый водород и карбонат калия
Продукты: фторид калия, вода и углекислый газ
\[\ce{HF} \left( g \right) + \ce{K_2CO_3} \left( aq \right) \rightarrow \ce{KF} \left( aq \right) + \ce{H_2O} \left( l \right) + \ce{CO_2} \left( g \right) \nonumber\]
Упражнение \(\PageIndex{1}\)
Перенесите следующие символьные уравнения в словесные уравнения или словесные уравнения в символьные уравнения.
- Газообразный водород реагирует с газообразным азотом с образованием газообразного аммиака.
- Ответить на
- \(H_2(г) + N_2(г) \rightarrow NH_3(г)\)
Резюме
- Химическая реакция – это процесс, при котором одно или несколько веществ превращаются в одно или несколько новых веществ.
- Химические реакции представлены химическими уравнениями.
- Химические уравнения имеют реагенты слева, стрелку, которая читается как «выход», и продукты справа.
Вклады и атрибуции
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts для соответствия стилю, представлению и качеству платформы:
Мариса Альвиар-Агню (Городской колледж Сакраменто)
Генри Эгнью (Калифорнийский университет в Дэвисе)
3. 9: Chemical Equations распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
9: Chemical Equations распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- источник[1]-хим-47500
- источник[2]-хим-47500
О соединениях серы и кислорода
Как окисляется сера
[Фликр]В качестве примера образования соединений серы с кислородом можно привести реакцию горения химически чистой серы на воздухе:
S + O₂ → SO₂
[Депозитные фотографии]Существует также реакция, демонстрирующая переход SO₂ в SO₃:
2SO₂ + O₂ → 2SO₃.
Эта реакция протекает в промышленности в присутствии оксида ванадия, который действует как катализатор. Второе условие – температура +400-500 ⁰С. Из оксида серы (VI) можно получить серную кислоту:
SO₃ + Н₂О → Н₂SO₄
Реакция горения серы является окислительно-восстановительной, т.е. элементы, участвующие в этой реакции, изменяют свою степень окисления. Мы можем поместить степени окисления в уравнение реакции:
S⁰ + О₂⁰ → S⁺⁴О₂⁻²
Сжигание серы [Викимедиа]Для удобства эту реакцию можно разделить на две: на кислород и на серу. Тогда сразу становится понятно, куда движутся электроны:
О₂⁰ + 4е ̅ → О₂⁻² — кислород получает электроны, значит, он окислитель.
S⁰ — 4е ̅ → S⁺⁴ — сера отдает свои электроны, поэтому действует как восстановитель.
Щелкните здесь, чтобы узнать, как получить диоксид серы в домашних условиях.



 Есть семь элементов, которые считаются двухатомными, а это означает, что они всегда встречаются в природе парами. Они включают в себя те элементы, которые перечислены в таблице.
Есть семь элементов, которые считаются двухатомными, а это означает, что они всегда встречаются в природе парами. Они включают в себя те элементы, которые перечислены в таблице.